食品安全是全球重要的公共卫生课题,而食源性致病菌的污染是造成食品安全问题的主要原因之一[1]。目前使用的人工合成抗菌剂会对健康造成不良影响,导致人们对其安全性产生担忧[2]。在此背景下,天然抗菌物质受到越来越多的关注,并被呼吁作为人工合成抗菌剂的有效代替品[3]。其中,植物中丰富的天然产物长久以来就是新型抗菌物质的主要来源,在食品保藏中具有巨大的应用潜力[4]。
木姜子[Litsea cubeba (Lour.) Pers.]又名山苍子,是樟科木姜子属落叶乔木,分布于我国西南地区,其果实被当地居民作为特色食品及调味品长期食用。此外,木姜子果实中存在的多种生物活性物质(如萜类、脂肪酸类、生物碱类等)使其具有优良、广谱的抗菌效果[5],是高效、安全型天然抗菌物质开发的重要资源。目前关于木姜子的抗菌活性主要围绕其果实精油开展研究及应用[6]。但精油类物质普遍存在高挥发性以及在光、热条件下易氧化分解的特点,并且浓郁的气味会对食品固有风味造成不利影响[7-8],这些因素对木姜子果实抗菌活性及其在食品保鲜的进一步应用造成限制。
相比之下,对于木姜子果实中除精油外的非挥发性抗菌成分的研究较少。王媛[9]及ZHANG等[10]使用乙醇分别从木姜子枝叶及树皮中提取得到具有抗菌活性的不同物质,但这些物质并非来源于木姜子可食用部位,其在食品中应用的安全性存在风险。李静等[11]使用不同浓度乙醇对木姜子果实进行提取,获得的粗提物对4种食源性致病菌具有显著抑制效果,但进一步的抑菌特性及应用研究未见报道。作者前期使用75%(体积分数)乙醇对木姜子果实进行浸提,获得其乙醇提取物。该物质不显示浓郁的精油气味,且对多种食源性致病菌具有良好的抗菌活性及抗菌稳定性[12-13],具备作为优良抗菌天然产物开展进一步研究及应用的价值。
因此,本研究以木姜子果实乙醇提取物(Litsea cubeba ethanol extract,LCEE)为对象,探究其抗菌作用机制,同时对其在鱼肉保鲜中的应用效果进行分析。旨在为木姜子果实非精油类抗菌物质的开发利用提供理论及应用参考。
1 材料与方法
1.1 材料与试剂
LCEE,由本实验室使用75%乙醇提取制备,具体见陈聪等[12]的方法。新鲜草鱼购于昆明本地农贸市场。
NA、TSB、PCA、VRBA培养基,广东环凯微生物科技有限公司;无水乙醇、PBS磷酸盐缓冲液(均为分析纯),天津市天力化学试剂有限公司;BCA蛋白浓度测定试剂盒、AKP检测试剂盒、ATP检测试剂盒,上海碧云天生物技术有限公司。
供试菌株:大肠杆菌(Escherichia coli,EC)、鼠伤寒沙门氏菌(Salmonella typhimurium,ST)、铜绿假单胞菌(Pseudomonas aeruginosa,PA)、福氏志贺氏菌(Shigella flexneri,SF)、坂崎肠杆菌(Enterobacter sakazakii,ES)、金黄色葡萄球菌(Staphylococcus aureus,SA)、单增李斯特菌(Listeria monocytogenes,LM)、枯草芽孢杆菌(Bacillus subtilis,BS)、耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA),大理大学公共卫生学院提供;粪肠球菌(Enterococcus faecalis,EF)、蜡样芽胞杆菌(Bacillus cereus,BC)、副溶血弧菌(Vibrio parahaemolyticus,VP),本实验室从食品中分离得到。
1.2 仪器与设备
UV-6100紫外-可见分光光度计,上海美谱达仪器有限公司;SpectraMax i D5多功能酶标仪,美国Thermo Fisher公司;DBJ-350便携式电导率仪,杭州齐威仪器有限公司;S-3000N扫描电镜(scanning electron microscope,SEM),日本Hitachi公司;JEM1011透射电镜(transmission electron microscope,TEM),日本电子株式会社;KN520凯氏定氮仪,济南阿尔瓦仪器有限公司;ST3100 pH计,奥豪斯国际贸易(上海)有限公司;CR-400色彩色差计,日本Konica Minolta公司。
1.3 实验方法
1.3.1 菌株活化
所有菌种在4 ℃下保存于NA培养基斜面上,使用前在TSB培养基中(37 ℃,160 r/min)活化培养12~14 h至对数期。采用麦氏比浊法将菌液浓度稀释至1.5×106 CFU/mL作为工作菌液。
1.3.2 最小抑菌浓度(minimum inhibitory concentration,MIC)测定
根据美国临床和实验室标准协会[14]技术标准,采用微量肉汤稀释法测定LCEE对12种食源致病菌的MIC。使用无水乙醇溶解LCEE并配制成质量浓度为100 mg/mL的母液。在96孔板中使用TSB培养基将母液稀释至初始浓度,再依次进行倍半稀释(每孔100 μL),最后加入100 μL 1.5×106 CFU/mL浓度的菌液,以无水乙醇为对照。于37 ℃培养16 h后观察结果。MIC为能够明显抑制细菌生长的最小浓度。
1.3.3 生长曲线测定
向1.3.1节中的工作菌液中加入LCEE,使其终浓度达到1 MIC和2 MIC,以无水乙醇为对照。37 ℃、160 r/min条件下培养24 h,间隔2 h用酶标仪测定600 nm下吸光度值(OD600nm),以OD600nm值为纵坐标,培养时间为横坐标绘制生长曲线。
1.3.4 电导率测定
菌液处理同1.3.3节,定时取菌液样品,4 ℃、4 000 r/min离心后将上清液用去离子水稀释20倍,使用电导率仪测定电导率。
1.3.5 细胞膜完整性测定
将对数生长期的细菌在4 000 r/min条件下离心10 min后收集菌体,使用无菌PBS缓冲液洗涤3次并稀释至1.5×106 CFU/mL浓度。加入LCEE,使其终浓度分别达到1 MIC、2 MIC,以无水乙醇为对照。在37 ℃、160 r/min条件下培养6 h。每小时取菌液样品,在4 ℃、5 000 r/min离心10 min,收集上清液并用0.22 μm醋酸纤维素膜过滤。按照BCA试剂盒说明书测定蛋白质含量,使用紫外分光光度计测定260 nm下吸光度(OD260nm值)。
1.3.6 细胞壁完整测定
细菌处理同1.3.5节,在37 ℃、160 r/min条件下培养12 h。定时取菌液样品,在4 ℃、5 000 r/min下离心10 min获得上清液,根据AKP试剂盒说明书测定胞外碱性磷酸酶(alkaline phosphatase,AKP)活性。
1.3.7 胞内ATP测定
细菌处理同1.3.5节。在37 ℃、160 r/min条件下培养1 h后,按照ATP检测试剂盒说明书处理样品,使用酶标仪测定相对发光值,以表示胞内ATP含量。
1.3.8 细胞形态及内部结构观察
细菌处理同1.3.5节,在37 ℃、160 r/min条件下培养10 h后,参照CHEN等[15]的方法使用SEM及TEM分别对大肠杆菌细胞的外部形态及内部结构进行观察。
1.3.9 LCEE在生鱼肉保鲜的应用
1.3.9.1 草鱼鱼块处理
参照WANG等[16]的方法,将鲜活草鱼杀死,除去头部、内脏并剥皮后用自来水清洗。选择鱼背两侧鱼肉,切成大小一致的鱼块(2 cm×1 cm×1 cm)。用无菌水将LCEE母液稀释至1 MIC浓度,将鱼块浸入LCEE溶液30 min,以无菌水处理作为对照。用无菌纱布擦干鱼块表面水渍,将鱼块放入无菌保鲜袋中于4 ℃下保存,定期取样进行检测。
1.3.9.2 失水率测定
将第0天鱼块质量记为m0,在第1、3、5、7、9天取出鱼块,用无菌纱布将其表面水分吸干后测定鱼块质量,记为mn,失水率按公式(1)计算:
失水率![]()
(1)
1.3.9.3 总挥发性盐基氮(total volatile base nitrogen,TVB-N)测定
将草鱼肉处理成肉糜状态,准确称取10.00 g肉糜。参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》采用半微量凯氏定氮法测定并计算TVB-N含量。
1.3.9.4 色泽测定
使用电子色差计测定鱼肉色度。测定前使用标准白板对仪器进行校准,对同一鱼块6个不同位置进行测定。L*表示亮度,a*代表红绿色度(+红、-绿),b*表示黄蓝色度(+黄、-蓝)。白度通过公式(2)计算:
白度![]()
(2)
1.3.9.5 菌落总数及大肠菌群数测定
将草鱼肉制成肉糜,准确称取1.00 g鱼肉糜。分别参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》及GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》的方法对样品菌落总数和大肠菌群数进行统计。
1.4 数据处理
实验设置3~6次重复,结果以“平均值±标准差”表示。采用SPSS 26进行方差及显著性差异分析,使用Origin 2021软件绘图。
2 结果与分析
2.1 LCEE的抗菌谱分析
以12株常见食源性致病细菌为对象(包括6株革兰氏阳性菌和6株革兰氏阴性菌),对LCEE的抗菌谱进行分析。由表1可知,LCEE对多种食源性细菌具有一定的抗菌活性,基于菌株的不同,其抗菌活性强弱也呈现出差异性。LCEE对金黄色葡萄球菌、单增李斯特菌、蜡样芽胞杆菌、粪肠球菌、大肠杆菌及铜绿假单胞菌的抗菌活性较强。而对MRSA、枯草芽孢杆菌、鼠伤寒沙门氏菌、福氏志贺氏菌、副溶血弧菌以及阪崎肠杆菌的抗菌活性相对较弱。从细菌类型来看,LCEE表现出对革兰氏阳性细菌的抑菌能力稍强于革兰氏阴性细菌的特点。可能是二者的细胞壁、膜结构的差异导致。大肠杆菌作为全球范围内最主要的食源性性病原体之一[17],选择其作为目标细菌开展进一步的LCEE抗菌机制研究。
表1 LCEE对不同食源性致病菌的抗菌活性
Table 1 Antibacterial activity of LCEE against different foodborne pathogens

指标G+G-SALMBCMRSAEFBSECSTPASFVPESLCEE的MIC/(mg/mL)0.0780.1560.03950.312101.25100.312102.510
注:“G+”表示革兰氏阳性细菌,“G-”表示革兰氏阴性细菌。
2.2 生长曲线
细菌培养液在600 nm下的吸光值与菌液浓度在一定时期内呈正相关,因此OD600nm曲线可反映细菌的生长状况。由图1-a可知,对照组细菌在2 h后进入对数生长期,在12 h后进入稳定期并在此后OD600nm值保持在1.15~1.25。1 MIC LCEE处理下的大肠杆菌生长受到显著抑制,细菌无法进入对数生长期,菌液OD600nm值在0~16 h 内缓慢增长至0.39后保持稳定。2 MIC处理的结果与1 MIC处理组相似,但细菌生长受到更为严重的抑制。菌液浓度始终低于1 MIC处理,并在14~24 h内呈现缓慢下降的趋势。处理组与对照组生长曲线的差异可直观反映LCEE对大肠杆菌生长的抑制随浓度上升而增强。
2.3 细胞膜的通透性及完整性
细胞膜是维持细胞内、外离子平衡及胞内正常生理功能的重要结构,也是许多抗菌物质的主要作用靶点[18]。细胞膜受损会导致其通透性增加,胞内电解质向胞外泄露引起胞外电导率增加,内、外离子平衡被打破。图1-b显示不同处理下大肠杆菌胞外电导率随时间的变化。在LCEE作用下,电导率在0~18 h快速上升,表明大肠杆菌细胞膜通透性受到持续损伤,胞内离子外泄严重。而在18 h后电导率趋于稳定,推测此时膜内外离子浓度已趋于平衡。对照组电导率虽然也呈现缓慢上升的趋势,但在各时间点电导率都显著低于LCEE处理组。细菌细胞内外离子梯度是其生命活动的重要体现,细胞膜受损后离子梯度逐渐丧失,直接导致细胞膜电位去极化并伴随跨膜pH的变化,这是细胞发生凋亡的体现[19]。
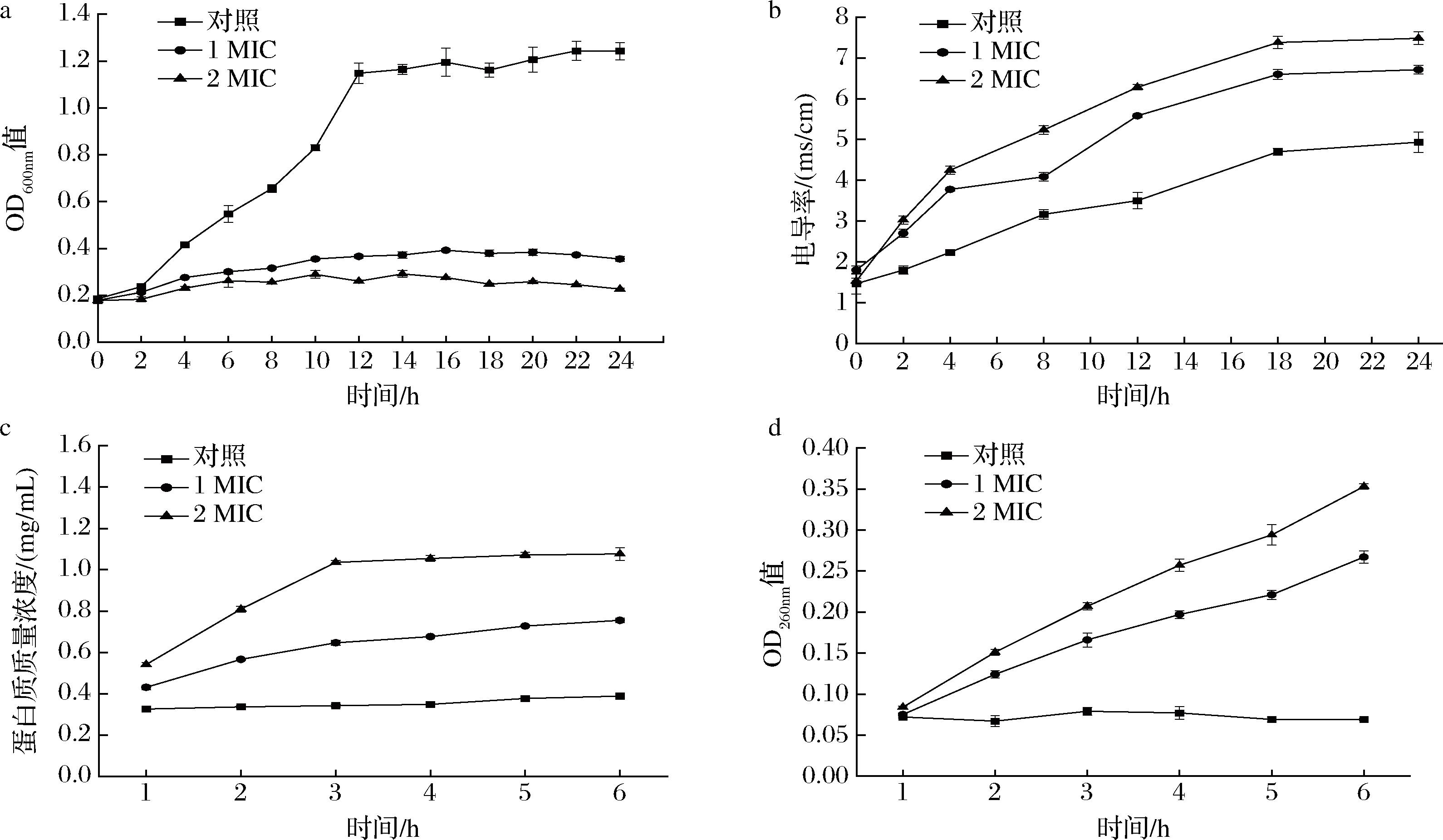
a-生长曲线;b-胞外电导率;c-蛋白质;d-核酸
图1 大肠杆菌的生长曲线、胞外电导率、蛋白质及核酸泄露程度
Fig.1 Growth curves, extracellular conductivity, protein, and nucleic acid leakage of Escherichia coli
细胞上清液中蛋白质(图1-c)及核酸分子(图1-d)的含量直接反映细胞膜完整性的受损程度。在LCEE作用下,胞外蛋白质在1~3 h持续上升并在之后保持稳定。而核酸分子在测定过程中持续增加,2 MIC较1 MIC显示更高的上升水平。胞内核酸、蛋白质的持续泄露将对细胞正常生理功能产生严重影响[20]。相比之下,未添加LCEE的对照组中胞外蛋白及核酸分子始终维持在最初的水平,表示细胞膜完整性得到了较好的保持,该结果与贾睿等[21]的研究一致。以上表明,LCEE对大肠杆菌细胞膜通透性及完整性造成破坏,并呈浓度依赖趋势。
2.4 细胞壁完整性
AKP通常存在于细胞壁与细胞膜之间而不能在胞外检出,而当细胞壁损伤时会出现外泄,胞外AKP含量即可反映细胞壁损伤的程度[22]。如图2-a所示,对照组胞外AKP活力保持在稳定水平,而LCEE处理后0~3 h胞外AKP水平迅速上升,且在3~12 h持续增长,这一结果表示细胞壁在LCEE作用下受到不可逆的持续性损伤。抗菌物质对细菌壁的损伤通常与细胞膜损伤伴随发生,但不同抗菌物质对不同细菌的抗菌机制也存在差异性。SHU等[23]及LIN等[24]分别使用甘露糖赤藓糖醇脂及ε-聚赖氨酸处理蜡样芽胞杆菌和单增李斯特菌,结果发现2种物质不会破坏细菌细胞壁的完整性,该发现与本研究结果不同。此外,AKP也参与细胞的能量代谢,可将对应底物去磷酸化,胞内AKP泄露也会对细菌能量代谢造成影响[25]。
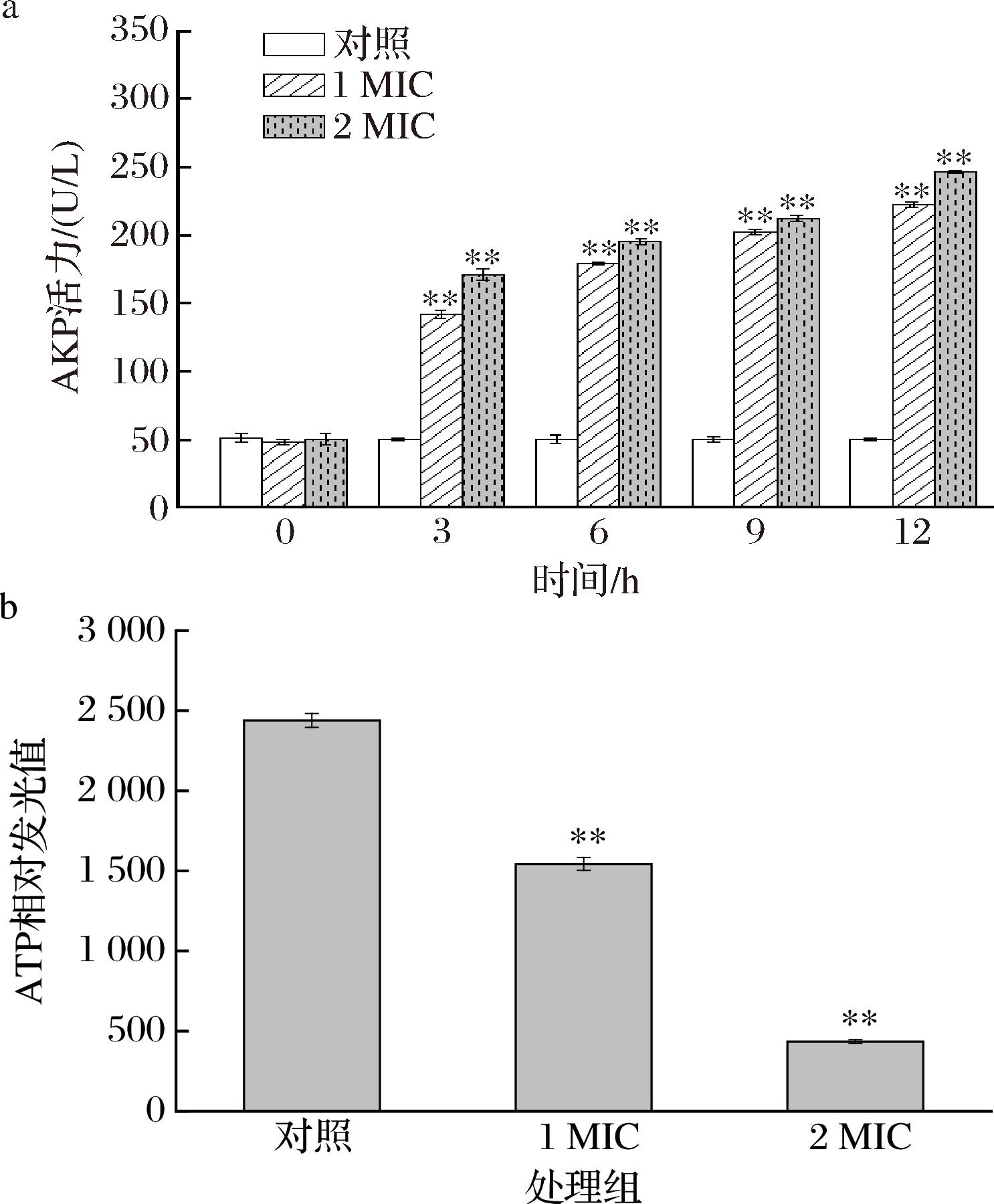
a-胞外AKP;b-胞内ATP水平
图2 大肠杆菌胞外AKP及胞内ATP水平
Fig.2 Extracellular AKP and intracellular ATP levels in Escherichia coli
注:*表示与对照组相比差异显著(P<0.05);**表示与对照组相比差异极显著(P<0.01)(下同)。
2.5 胞内ATP含量
ATP作为重要的高能分子,是细胞能量的直接来源,ATP缺失会对胞内生理代谢产生一系列的不利影响。LCEE处理1 h后胞内ATP含量较对照组出现大幅下降(图2-b)。造成这一结果的原因是多方面的,首先壁、膜损伤会造成胞内ATP分子的泄露。另外,细菌细胞ATP产生和代谢的场所是细胞质膜,而细胞膜的损伤一方面使位于细胞质膜上的ATP合成和代谢相关酶活性受到影响,同时膜内、外H+梯度出现失衡,造成细胞ATP合成能力下降[26],进一步导致胞内ATP含量降低。
2.6 细胞形态及内部结构的变化
图3-a是正常生长条件下的大肠杆菌外部形态,细菌呈现表面光滑、饱满的短棒状。经1 MIC浓度的LCEE处理10 h后(图3-b),细菌表面逐渐变的粗糙,胞间黏连,部分细菌表面出现孔洞(箭头所示)。2 MIC处理(图3-c)进一步加重了受损程度,细胞表面凹凸不平,局部塌陷,表面孔洞增多。透射电镜对细胞内部结构观察发现,正常条件下(图3-d)细胞壁、膜轮廓清晰,胞内物质均匀、饱满。1 MIC处理后(图3-e)壁、膜边缘模糊,胞内出现空腔(箭头所示),推测是因壁、膜损伤导致的内容物外泄造成。2 MIC处理下细胞受损严重,壁、膜轮廓出现明显缺口(图3-f)。由细胞内容物泄露导致的胞内空腔程度进一步加剧。SEM、TEM的观察结果印证了LCEE对细胞的损伤。这一结果与前人发现的黑果腺肋花楸提取物[27]及鼠李糖杆菌细菌素[28]对大肠杆菌的抑菌效果相同。

a-SEM对照组;b-SEM 1 MIC处理组;c-SEM 2 MIC处理组;d-TEM对照组;e-TEM 1MIC处理组;f-TEM 2 MIC处理组
图3 大肠杆菌细胞形态及内部结构观察
Fig.3 Observation of cell morphology and internal structure of Escherichia coli
2.7 LCEE对生鱼肉的保鲜效果
2.7.1 鱼肉失水率
肉品中水分含量与其色泽和质地直接相关,而肉品失水率与其肌肉蛋白持水能力呈负相关。图4-a显示,所有样品在贮藏期间失水率都呈上升趋势,对照组第9天失水率达到19.75%,处理组为15.28%,与对照差异极显著。表明LCEE处理对鱼肉蛋白持水性的保持具有促进作用。原因可能是其对于腐败微生物的抑制作用减缓了微生物对肌肉蛋白的破坏,从而提升肌肉纤维的持水能力[29]。
2.7.2 TVB-N水平
鱼肉中蛋白质含量丰富,在贮存过程中蛋白质受微生物和酶的降解产生胺及氨类等盐基氮物质,其含量与肉类腐败程度正相关[30]。对照组TVB-N含量随贮存时间上升迅速(图4-b),第9天TVB-N值已达到14.03 mg/100 g,为第0天的241.9%,鱼肉组织松散并产生臭味。而由于LCEE的抗菌活性抑制了细菌对鱼肉蛋白的降解,处理组第9天TVB-N值为11.02 mg/100 g,显著低于对照组。
2.7.3 鱼肉色度分析
肉品颜色是其品质的重要反映,经LCEE处理后鱼肉色度指标如表2所示。各指标在贮藏期内呈现亮度(L*值)及a*值逐渐下降,b*值及白度逐渐上升的趋势。由于1 MIC浓度的LCEE呈浅黄色,因此处理组在第0天时鱼肉亮度(L*值)及白度均低于对照组。但在整个贮藏期间,处理组亮度下降程度低于对照组,第9天时处理组L*值已显著高于对照组。同样,LCEE处理后样品的a*值、b*值及白度的变化程度都小于对照组。以上结果说明LCEE对鱼肉在贮藏期内的颜色退化具有保护作用。该结果与ZHAO等[31]将葡萄籽提取物应用在虾肉保鲜的效果一致。
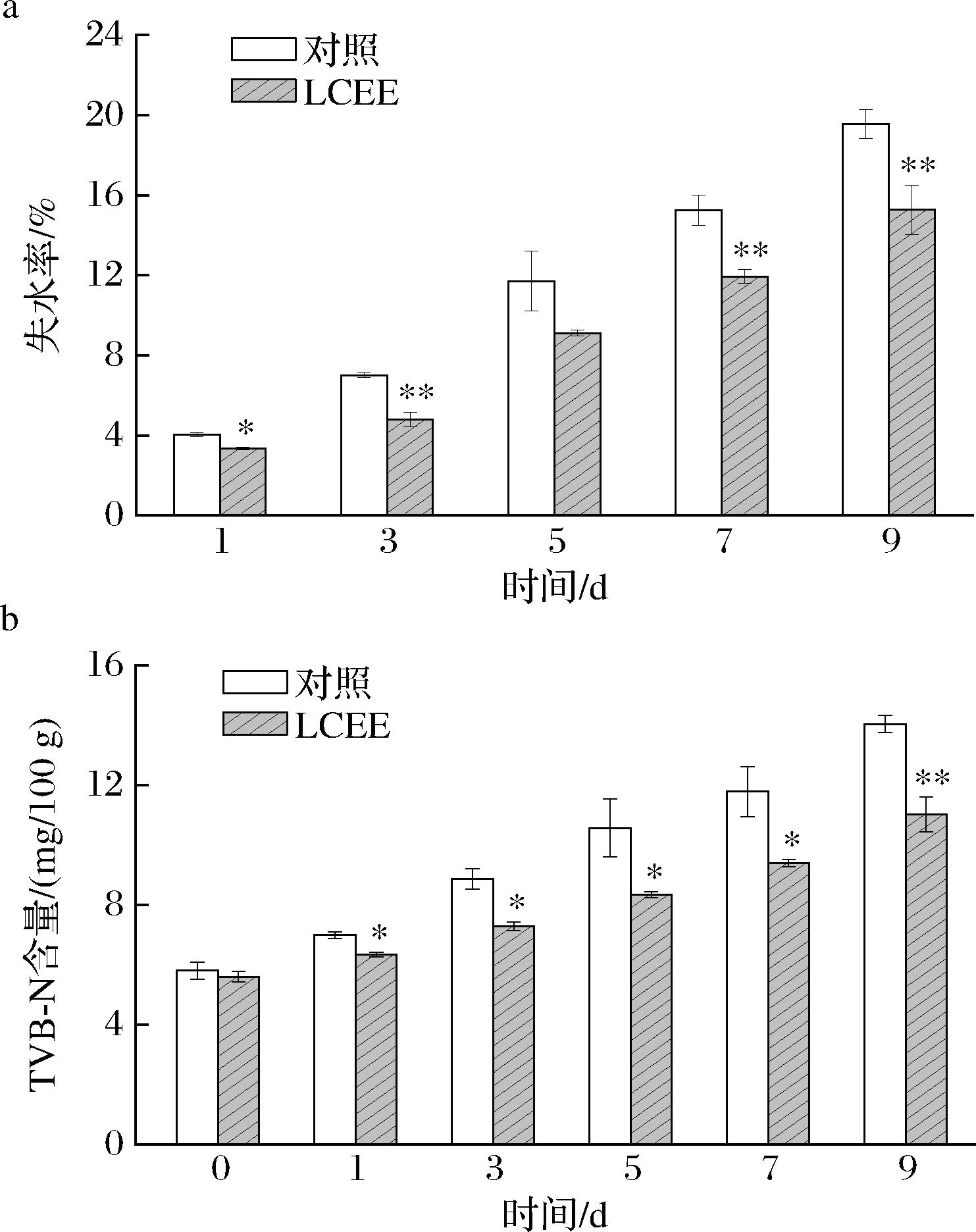
a-失水率;b-TVB-N含量
图4 鱼肉在贮存期内的失水率及TVB-N含量
Fig.4 Water loss and TVB-N content of fish during storage
表2 不同处理下鱼肉在贮藏期内的颜色变化
Table 2 Color changes of fish under different treatments during storage
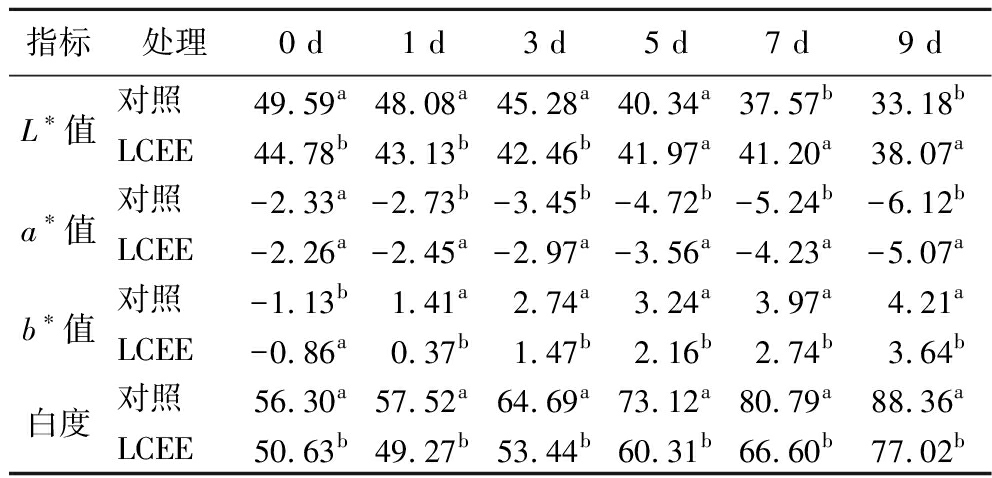
指标处理0 d1 d3 d5 d7 d9 dL∗值对照49.59a48.08a45.28a40.34a37.57b33.18bLCEE44.78b43.13b42.46b41.97a41.20a38.07aa∗值对照-2.33a-2.73b-3.45b-4.72b-5.24b-6.12bLCEE-2.26a-2.45a-2.97a-3.56a-4.23a-5.07ab∗值对照-1.13b1.41a2.74a3.24a3.97a4.21aLCEE-0.86a0.37b1.47b2.16b2.74b3.64b白度对照56.30a57.52a64.69a73.12a80.79a88.36aLCEE50.63b49.27b53.44b60.31b66.60b77.02b
注:同一时间点组内不同字母代表差异性显著(P<0.05)。
2.7.4 菌落总数及大肠菌群数
菌落总数和大肠菌群数是判断食品受微生物污染程度的重要指标。如图5所示,鱼肉中菌落总数和大肠菌群数随贮存时间而持续上升。但LCEE处理组样品中微生物生长速度显著低于对照处理。对照组在第7天鱼肉中的菌落总数和大肠菌群数分别为7.18 lg CFU/g和6.79 lg CFU/g,菌落总数已超过国家卫生标准的7 lg CFU/g。第9天时已达到8.05 lg CFU/g和7.67 lg CFU/g,均超过标准值。此时LCEE处理组中的2项指标分别为6.95 lg CFU/g和6.35 lg CFU/g,分别小于对照组1.1 lg CFU/g和1.32 lg CFU/g,符合国家卫生标准。以上结果证明LCEE处理可有效抑制鱼肉中细菌滋生,延长其保存期2 d以上。
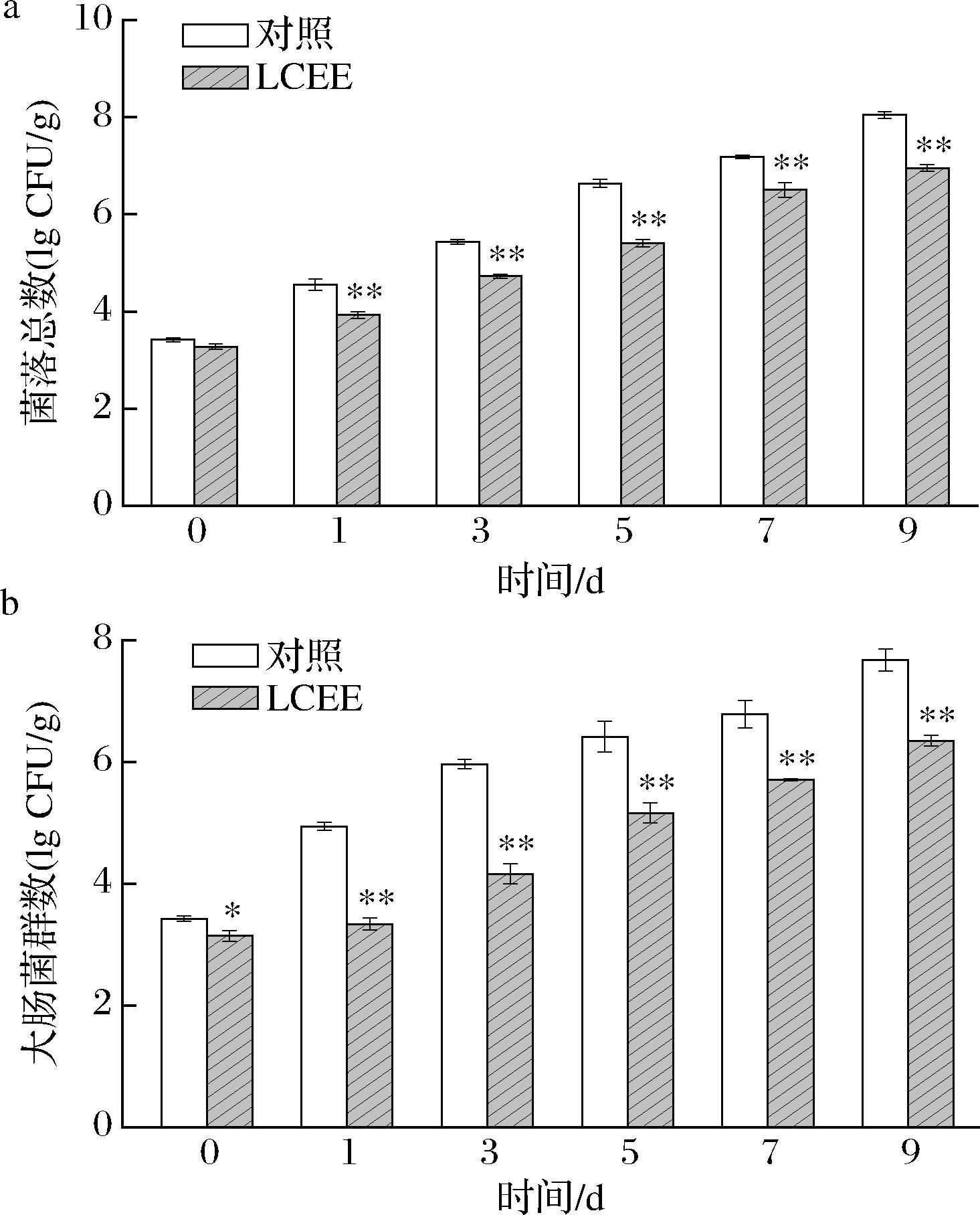
a-菌落总数;b-大肠菌群数
图5 贮存期间鱼肉中的菌落总数及大肠菌群数
Fig.5 Total bacterial count and coliform count in fish during storage
3 结论与讨论
木姜子果实乙醇提取物作为其果实中非挥发性抗菌成分,对多种食源性致病菌具有良好的抗菌活性。LCEE能够破坏大肠杆菌的细胞壁、膜,造成多种胞内物质泄露并显著降低胞内ATP水平,细胞表面及内部结构也出现严重变化,最终导致细菌死亡。在鱼肉保鲜中使用LCEE处理可提升鱼肉持水性,延缓色泽退化,降低TVB-N水平并抑制腐败微生物的生长,延长鱼肉保存期2 d以上。木姜子的抗菌特性长期被归因于精油类物质,而本研究的发现使木姜子果实的抗菌物质基础得到进一步丰富。LCEE的抗菌机制及其在食品保鲜的应用效果对天然抗菌资源的开发应用具有一定的指导作用。
[1] GRACE D.Burden of foodborne disease in low-income and middle-income countries and opportunities for scaling food safety interventions[J].Food Security, 2023, 15(6):1475-1488.
[2] NOVAIS C, MOLINA A K, ABREU R M V, et al.Natural food colorants and preservatives:A review, a demand, and a challenge[J].Journal of Agricultural and Food Chemistry, 2022, 70(9):2789-2805.
[3] EL-SABER BATIHA G, HUSSEIN D E, ALGAMMAL A M, et al.Application of natural antimicrobials in food preservation:Recent views[J].Food Control, 2021, 126:108066.
[4] 杨明晨, 胡锋, 符姜燕, 等.植物源活性物质抗菌构效关系、抗菌机理及在食品中的应用研究进展[J].食品与发酵工业, 2024,50(18):367-374.
YANG M C, HU F, FU J Y, et al.Research progress on antibacterial structure-activity relationship, antibacterial mechanism and application in food of plant-derived active substances[J].Food and Fermentation Industries, 2024,50(18):367-374.
[5] 王佳杰, 马超, 乔泽耀, 等.木姜子的化学物质构成、感官特性及其生物活性研究进展[J].食品工业科技, 2024, 45(14):378-389.
WANG J J, MA C, QIAO Z Y, et al.Research progress on the chemical constituents, sensory characteristics, and biological activities of Litsea pungens hemsl[J].Science and Technology of Food Industry, 2024, 45(14):378-389.
[6] 刘尧, 刘健华, 夏琛, 等.山苍子精油生物活性及其包埋技术的研究进展[J].中国粮油学报, 2022, 37(2):188-195.
LIU Y, LIU J H, XIA C, et al.Research progress on bioactivity and embedding technology of Litsea cubeba essential oil[J].Journal of the Chinese Cereals and Oils Association, 2022, 37(2):188-195.
[7] KHORSHIDIAN N, YOUSEFI M, KHANNIRI E, et al.Potential application of essential oils as antimicrobial preservatives in cheese[J].Innovative Food Science &Emerging Technologies, 2018, 45:62-72.
[8] JU J, CHEN X Q, XIE Y F, et al.Application of essential oil as a sustained release preparation in food packaging[J].Trends in Food Science &Technology, 2019, 92:22-32.
[9] 王媛. 木姜子枝叶化学成分及生物活性研究[D].西安:陕西科技大学,2013.
WANG Y.Chemical constituents of leaves and stem of Litsea pungens and their bioactivities[D].Xi’an:Shaanxi University of Science and Technology, 2013.
[10] ZHANG W, HU J F, LV W W, et al.Antibacterial, antifungal and cytotoxic isoquinoline alkaloids from Litsea cubeba[J].Molecules, 2012, 17(11):12950-12960.
[11] 李静, 赵洪, 马媛.山鸡椒酒精浸提液对体外细菌的抑制对比研究[J].广东农业科学, 2010, 37(3):196-198.
LI J, ZHAO H, MA Y.Comparative study for antiblastic functions of alcohol extract of the Litsea cubeba in vitro[J].Guangdong Agricultural Sciences, 2010, 37(3):196-198.
[12] 陈聪, 薛桥丽, 胡永金, 等.云南木姜子醇提物抑菌活性及其稳定性研究[J].食品工业科技, 2023, 44(16):147-154.
CHEN C, XUE Q L, HU Y J, et al.Study on the bacteriostatic activity and stability of ethanolic extract from Yunnan Litsea cubeba[J].Science and Technology of Food Industry, 2023, 44(16):147-154.
[13] 魏美娟, 陈聪, 牛刚, 等.云南木姜子提取物对蜡样芽孢杆菌抑菌作用的研究[J].食品安全质量检测学报, 2023, 14(9):43-48.
WEI M J, CHEN C, NIU G, et al.Study on the bacteriostatic effect of the extract of Yunnan Litsea cubeba on Bacillus cereus[J].Journal of Food Safety &Quality, 2023, 14(9):43-48.
[14] CLSI.Performance standards for antimicrobial susceptibility testing[S].Wayne, PA, USA:2021.
[15] CHEN Y, ZHANG Y F, WANG X H, et al.Antibacterial activity and its mechanisms of a recombinant Funme peptide against Cronobacter sakazakii in powdered infant formula[J].Food Research International, 2019, 116:258-265.
[16] WANG R F, HU X Y, AGYEKUMWAA A K, et al.Synergistic effect of kojic acid and tea polyphenols on bacterial inhibition and quality maintenance of refrigerated sea bass (Lateolabrax japonicus) fillets[J].LWT, 2021, 137:110452.
[17] RAMOS S, SILVA V, DE LURDES ENES DAPKEVICIUS M, et al.Escherichia coli as commensal and pathogenic bacteria among food-producing animals:Health implications of extended spectrum β-lactamase (ESBL) production[J].Animals, 2020, 10(12):2239.
[18] LI H, ADDO K A, YU Y G, et al.Effects of cuminaldehyde combined with mild heat against Salmonella enterica serovar Typhimurium in powdered infant formula[J].Food Control, 2023, 148:109663.
[19] NING Y W, MA M G, ZHANG Y J, et al.Antibacterial mechanism of sucrose laurate against Bacillus cereus by attacking multiple targets and its application in milk beverage[J].Food Research International, 2022, 154:111018.
[20] ZHANG B B, ZANG Y T, MO Q N, et al.Antibacterial activity and mechanism of slightly acidic electrolyzed water (SAEW) combined with ultraviolet light against Staphylococcus aureus[J].LWT, 2023, 182:114746.
[21] 贾睿, 蔡丹, 葛思彤, 等.红豆皮多酚提取物对两种致病菌的抑菌活性及作用机理[J].食品科学, 2021, 42(23):64-71.
JIA R, CAI D, GE S T, et al.Antibacterial activity and mechanism of polyphenol extracts from adzuki bean seed coat against two pathogens[J].Food Science, 2021, 42(23):64-71.
[22] NING Y W, HOU L L, MA M G, et al.Synergistic antibacterial mechanism of sucrose laurate combined with nisin against Staphylococcus aureus and its application in milk beverage[J].LWT, 2022, 158:113145.
[23] SHU Q, NIU Y W, ZHAO W J, et al.Antibacterial activity and mannosylerythritol lipids against vegetative cells and spores of Bacillus cereus[J].Food Control, 2019, 106:106711.
[24] LIN L, GU Y L, LI C Z, et al.Antibacterial mechanism of ε-Poly-lysine against Listeria monocytogenes and its application on cheese[J].Food Control, 2018, 91:76-84.
[25] ZAHER D M, EL-GAMAL M I, OMAR H A, et al.Recent advances with alkaline phosphatase isoenzymes and their inhibitors[J].Archiv der Pharmazie, 2020, 353(5):e2000011.
[26] 李文菁. 核桃青皮提取物抑菌活性及抑菌机理研究[D].乌鲁木齐:新疆农业大学, 2021.
LI W J.Study on Antibacterial activity and antibacterial mechanisms of walnut green husk extract[D].Urumqi:Xinjiang Agricultural University, 2021.
[27] DENG H T, ZHU J Y, TONG Y Q, et al.Antibacterial characteristics and mechanisms of action of Aronia melanocarpa anthocyanins against Escherichia coli[J].LWT, 2021, 150:112018.
[28] XU C, FU Y Y, LIU F, et al.Purification and antimicrobial mechanism of a novel bacteriocin produced by Lactobacillus rhamnosus 1.0320[J].LWT 2021, 137:110338.
[29] 窦川林. 鼠尾草提取物对鲢鱼肉保鲜效果的研究[D].重庆:西南大学, 2019.
DOU C L.Study on the fresh-keeping effect of sage extract on silver carp meat[D].Chongqing:Southwest University, 2019.
[30] LI H, HUANG Y Y, ADDO K A, et al.Effects of cuminaldehyde on toxins production of Staphylococcus aureus and its application in sauced beef[J].Food Control, 2022, 137:108960.
[31] ZHAO X, CHEN L, ZHAO L, et al.Antimicrobial kinetics of nisin and grape seed extract against inoculated Listeria monocytogenes on cooked shrimps:Survival and residual effects[J].Food Control, 2020, 115:107278.