口腔速溶膜(orally disintegrating film, ODF)通常是邮票大小的超薄薄膜(50~150 μm),与唾液接触后1 min内在口腔内快速崩解,从而使药物快速吸收[1-2]。在已有报道中,ODF又称口腔分散膜、口腔贴、口腔快速溶解膜、口腔薄膜等。国外研究人员从20世纪70年代末开始研究制备口腔崩解片。第一种ODF是由辉瑞制药公司开发的用于口腔清新的速溶膜,基于其溶解快速、便于携带等优点逐渐引起了世界范围内的关注。近年来,ODF作为一种新型的药物和营养因子递送系统,通过将药物和营养因子封装到脂质体、固体脂质纳米颗粒、纳米结构脂质载体、纳米乳剂和纳米悬浮液等载体中,可以改善药物的体内分布、延长作用时间,为疾病治疗和营养补充提供更有效、更精准的手段[3]。该系统具有以下优点:a)方便使用:ODF无需水和咀嚼,只需将其放在口腔内即可溶解,具有友好的使用体验,尤其适用于儿童、老年人和患有吞咽困难的患者[4];b)准确控制剂量:由于ODF每片药膜含有精确的剂量,可以避免剂量误差,提供方便和准确的药物给药[5];c)高生物利用度:图1为膜进入口腔后的吸收过程。ODF能够直接通过口腔黏膜吸收,活性成分绕过首过效应进入血液循环,从而提高药物或营养因子的生物利用度[6];d)良好的扩展性:ODF的制备可以通过改变配方和工艺来实现不同药物或营养物质的载荷,具有较好的扩展性和适应性[5];e)良好的稳定性:ODF的制备过程中,可以选择适合活性因子稳定性的材料和工艺,从而保持其稳定性,延长保存期限[3]。
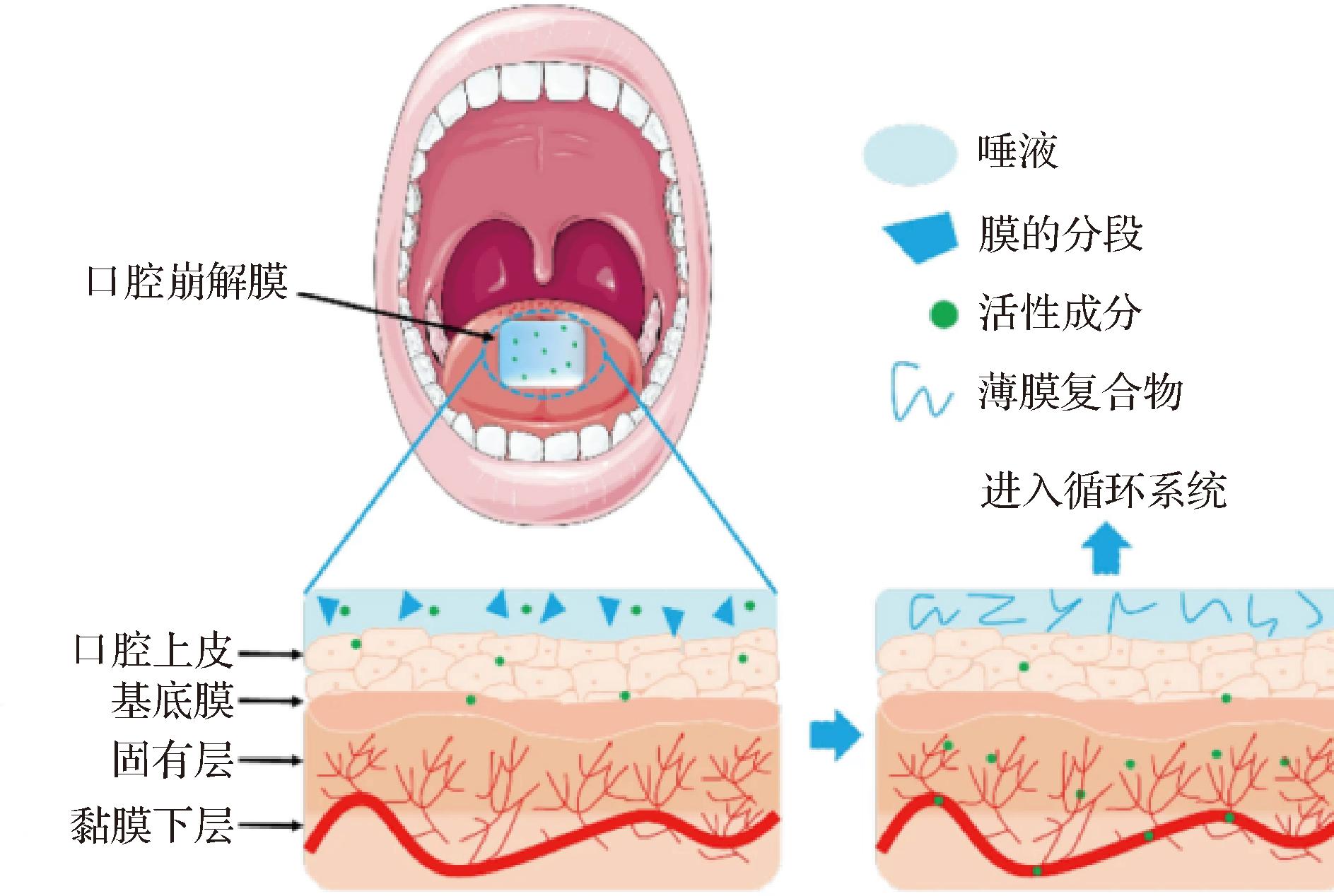
图1 有效成分在口腔内的吸收过程[7]
Fig.1 Absorption process of active ingredients in the mouth[7]
据预测,到2035年,我国将进入重度老龄化阶段,60岁及以上老年人口占比将超过30%。老年营养改善工作是维护老年人健康、实现健康老龄化的重要保障[8]。ODF对于吞咽或咀嚼困难老年人的营养帮助优势明显。近年来,ODF技术在药物领域特别是在制剂设计和临床应用方面取得了显著进展。然而,有关ODF在营养递送方面的研究还非常有限,此方面的工作亟待开展。综上,本文将从ODF的组成、制备、评价以及应用等方面进行综述,以期为食品营养因子递送系统的发展和应用提供有价值的参考。
1 ODF的组成
ODF的组成通常包括以下主要成分:成膜材料、塑形剂、崩解剂、矫味剂等。成膜材料是速溶膜的关键组成部分,用于形成薄膜结构,促进活性成分的吸收。常见的成膜材料包括羟丙基甲基纤维素、聚乙烯吡咯烷酮、聚乙烯醇等聚合物。DOMINIK等[9]指出,聚合物的组成对ODF的物理、化学和生物性能都有重要影响。添加不同的聚合物可以调节膜的孔隙结构、表面形态和化学功能;混合聚合物还可以调控ODF的机械性能、溶解度和活性成分的释放特性。此外,成膜材料浓度的变化也会影响薄膜的性能。TEDESCO等[10]以支链淀粉和羟丙基甲基纤维素为原料制备ODF时发现,当羟丙基甲基纤维素含量为40%时,薄膜难以剥离;当其含量超过50%时,薄膜的黏性将会增加。当支链淀粉含量为40%~45%时,无法形成良好性能的薄膜。
塑形剂被认为是ODF中至关重要的成分,因为它们可以提高薄膜的柔韧性并降低其脆弱性,以便在舌下迅速溶解。常用的塑形剂为聚乙二醇、甘油、邻苯二甲酸二乙酯、柠檬酸三乙酯、柠檬酸三丁酯。ODF中塑形剂类型的选择将取决于与聚合物的相容性和所用溶剂的类型。LIEW等[5]研究指出,适量的塑形剂可以改善薄膜的可塑性和崩解性能,但过量的塑形剂可能会导致薄膜变得过软或崩解过快。
崩解剂的作用是促使速溶膜剂在口腔中快速溶解。通常是刺激唾液型,呈酸性,可以刺激口腔唾液的产生,从而促进膜的分解。常见的有柠檬酸、苹果酸、抗坏血酸和酒石酸,可以单独使用或联合使用[11-12]。
矫味剂常添加到ODF中以掩盖活性成分的味道,提供良好的口感。常用的矫味剂可以是天然来源的,如葡萄糖、果糖、葡萄糖、蔗糖和异麦芽糖;也可以是合成来源的,如乙酰氨基磺酸k、三氯蔗糖和纽甜。如添加薄荷、甘草和三氯蔗糖混合物可适当地掩盖双氯芬酸钠的苦味。DAHMASH等[13]指出,在ODF的生产中添加矫味剂对儿科人群尤为重要。
2 ODF的制备方法
研究者试图通过不同的制膜方法以提高速溶膜的稳定性和活性成分释放效果[14]。目前,ODF的制备技术主要包括溶剂浇铸法、静电纺丝法和3D打印法等。
2.1 溶剂浇铸法
是一种常用的制备ODF的方法。将聚合物和其他辅助成分溶解于挥发性溶剂中,并将溶液倒入模具中,在溶剂逐渐挥发的过程中形成膜,图2为溶剂浇铸法具体制模流程。该法具有以下优点:首先,该法制备过程简单、可控性强。可通过调节溶剂的类型、浓度和挥发速度灵活控制膜的厚度和活性成分的释放速率,以满足不同的应用需求。其次,包埋能力强。该法可包埋多种活性成分,如疏水型、水溶型和温度敏感型活性成分,实现持续、稳定的释放效果[15]。第三,相比其他制备方法,溶剂浇铸法的原料成本低廉[16],具有经济优势,适用于常规实验室条件下ODF的制备。
然而,溶剂残留是溶剂浇铸法中一个需要关注的问题[17]。该法制备过程中使用的挥发性溶剂(如乙醚、丙酮等)可能残留在速溶膜中,容易对口腔黏膜造成刺激和毒性,必须进行去除处理。同时,溶液浇铸法易导致活性物质重结晶,膜会变脆。此外,该法溶剂挥发通常需要较长时间,增加了制备周期和时间成本。
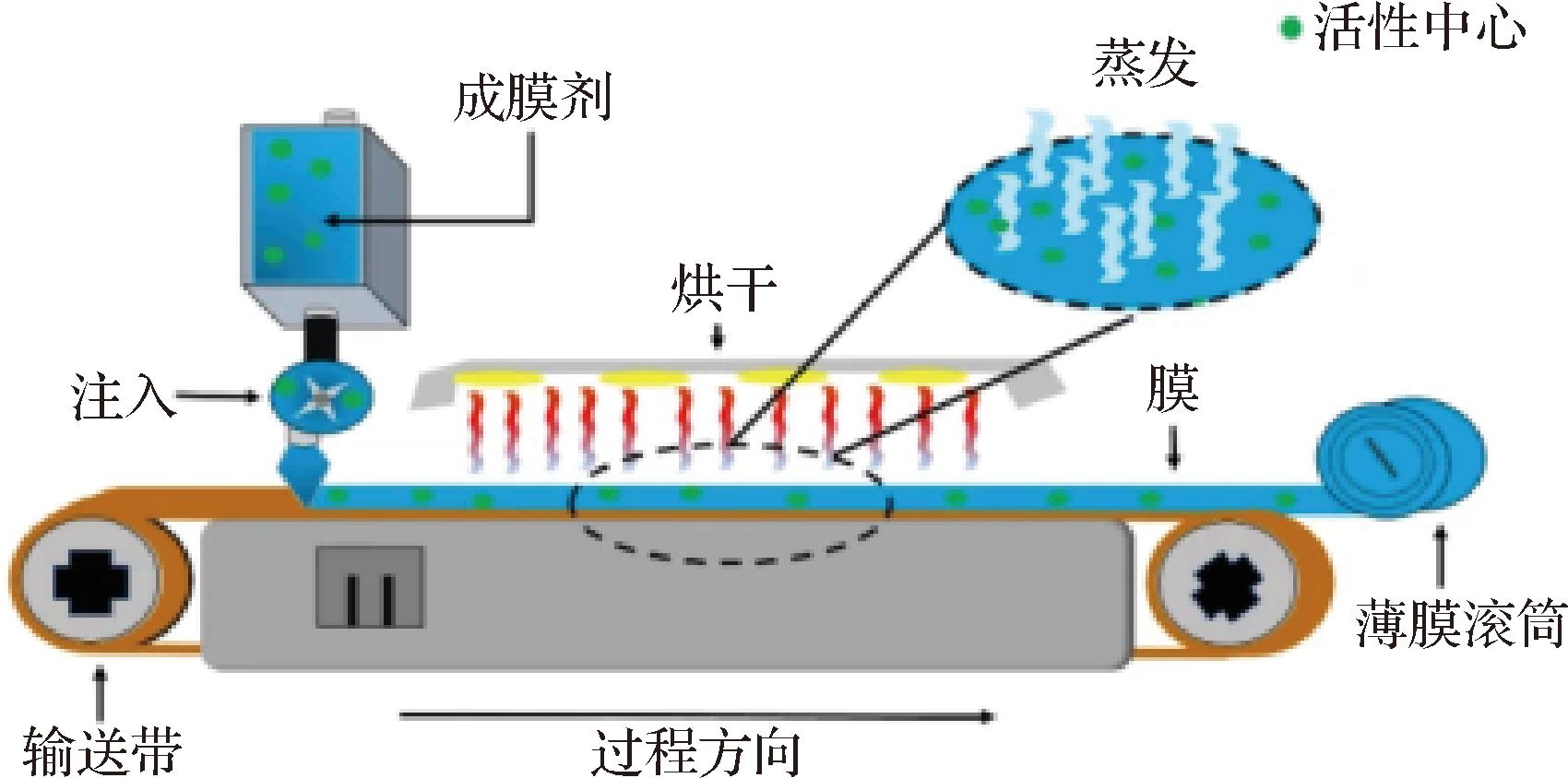
图2 溶剂浇铸法示意图[7]
Fig.2 Schematic diagram of solvent casting device[7]
2.2 静电纺丝法
静电纺丝是一种非热处理方式,黏性溶液或聚合物熔体在电场下连续喷射,喷射物在电场的作用下溶剂蒸发,在接收板上固化成纳米纤维膜,图3-A为静电纺丝成膜原理及基本流程,图3-B为3种不同类型电纺成膜示意图,按照纺丝溶液或针头的不同,静电纺丝主要分为:单轴静电纺丝、同轴静电纺丝和乳液静电纺丝[18]。静电纺丝制备ODF的原理如下:静电纺丝材料以无定形态或高分子物质溶解在溶剂中,在离液面一定距离处放置2个电极实现电场的施加,通过调整电场的强度和方向以控制纤维的形成。当电场施加到溶液上时,溶液中的分子会带有电荷。带电颗粒在电场的作用下发生移动,聚集在电极间形成固定的电荷分布。由于电荷的相互作用,溶液中的纺丝材料形成一个丝状的团簇,该团簇处于稳定的静电平衡状态。当溶液开始流动时,这个团簇会被拉伸并逐渐形成连续的纤维,形成的纤维通过空气流、电场力或离心力等辅助力从喷嘴喷出,纤维在空中会迅速固化或凝固在收集器上形成纳米纤维薄膜。
静电纺丝技术是一种很有前途的制备ODF的方法,具有替代传统成膜方法的潜力,其优势表现在以下几个方面:通过静电纺丝制备的纳米纤维膜具有孔径小、比表面积大和亲水性高等特点,有利于ODF的快速溶解和活性物质的释放[19]。例如,CELEBIOGLU等[20]利用静电纺丝技术制备的阿魏酸/环糊精包合纳米纤维膜的崩解时间小于2 s。其次,静电纺丝工艺具有高度可调控性,即可以通过调节工艺参数来精确控制纳米纤维的形态、直径和孔径,实现针对口腔疾病或治疗需求的定制化;与常规成膜方法相比,该技术制备的纳米膜不仅速溶效果更快,并且可抑制活性成分的结晶,避免摄入时不愉快的颗粒感;同时,静电纺丝通过选择无溶剂或低挥发性溶剂制备的ODF具有良好的生物相容性,对口腔组织无刺激性,不易引起不适反应;此外,静电纺丝技术方便高效、条件温和、不涉及高温条件,对于热敏性活性因子的递送极为有利[21]。杨欢[22]利用同轴纺丝技术制备鱼油纳米纤维膜,结果发现,静电纺丝能够显著提高包埋鱼油的氧化稳定性。以上这些特性使得静电纺丝制备的纳米纤维成为ODF的重要候选材料。
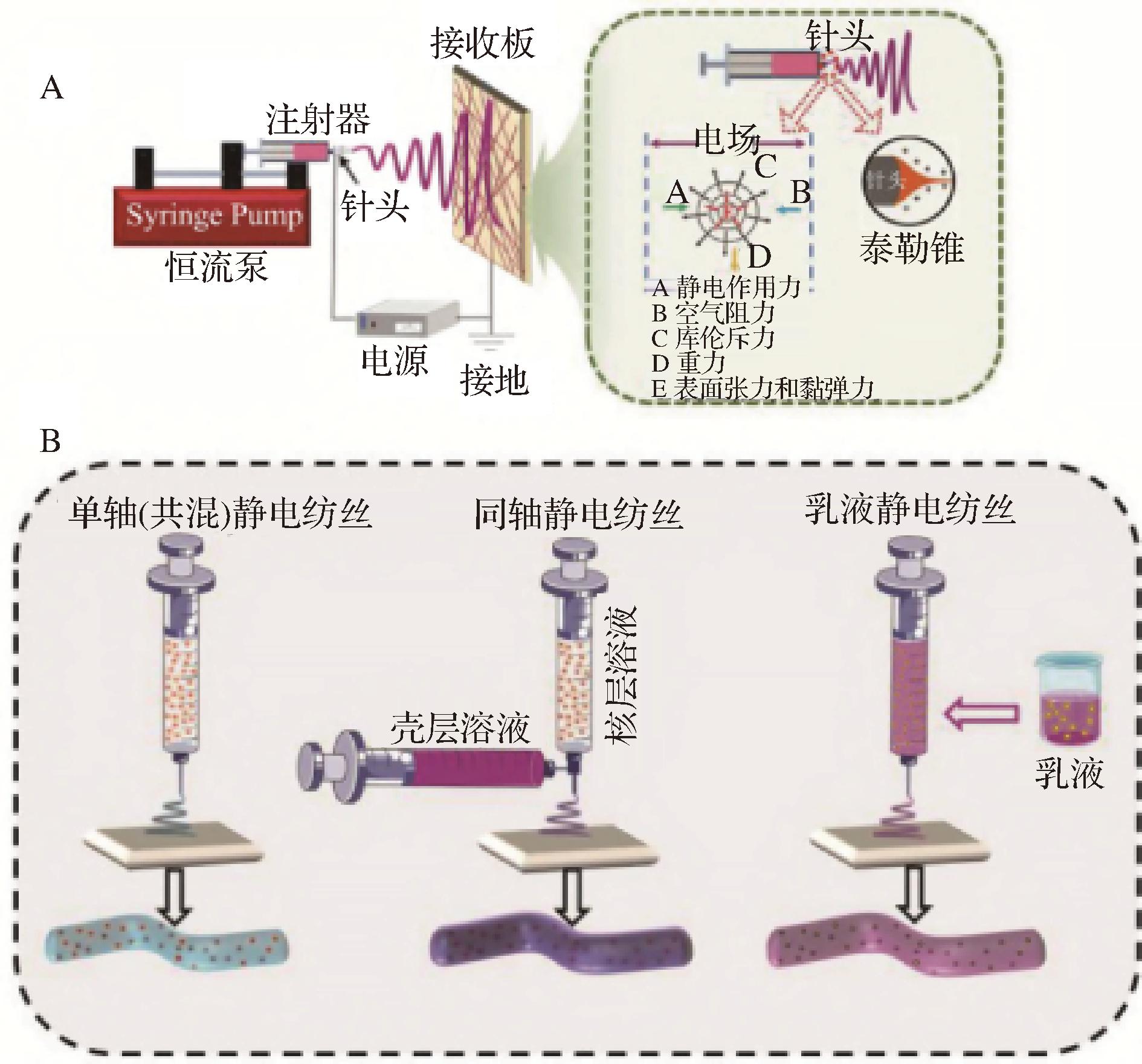
A-静电纺丝示意图;B-静电纺丝机类型
图3 典型静电纺丝装置示意图[23]
Fig.3 Schematic diagram of a typical electrostatic spinning device[23]
然而,静电纺丝技术需要对工艺参数进行合理控制,包括溶液浓度、纺丝速度、高压电场等,这增加了工艺的复杂性和操作难度[24]。同时,为保障ODF的安全性,在其制备中需要考虑所选电纺材料的安全性。POORESMAEIL等[25]利用明胶材料开发电纺纳米纤维速溶递送系统,为了得到良好的纤维形貌,静电纺丝过程中使用了有机/有毒溶剂,限制了其在ODF的进一步应用。而环糊精及其衍生物可消除静电纺丝中有机溶剂等引起的问题。据报道,羟丙基-β-环糊精可通过分子组装将水溶性差的活性分子包封在内腔,静电纺丝时不需要额外使用聚合物基质和有机溶剂,可为ODF的安全性和健康性提供保障[26]。这些信息表明:利用静电纺丝技术并选择合适的电纺材料可能成为构建ODF最有前途的方法。然而,寻找绿色、安全的电纺溶液是拓展静电纺丝在ODF领域应用的重要环节。
2.3 3D打印
3D打印是一种通过逐层堆积材料来创建三维物体的技术[27],在ODF的制备方面具有独特的优势和应用前景。图4为3D打印流程示意图。首先,使用计算机辅助设计软件创建或获取一个三维模型,这个模型定义了最终打印物体的形状和结构。将三维模型切割成一系列薄片,切片好的数据被传输到3D打印机。当3D打印机接收到切片数据后,将根据每一层的信息控制打印过程。这可能包括控制打印头的移动、温度、材料供应等。3D打印机使用特定材料(例如塑料、金属、陶瓷等)根据切片的路径逐层堆叠,从而逐渐构建出一个三维物体。根据所用的材料类型,3D打印机可能需要在堆积材料的同时进行固化或熔化以使其保持形状。一旦所有层都完全堆积并合适地固化或熔化,打印过程即完成,可以从打印床上取下打印对象。实际应用中还有诸如选择性激光烧结、喷墨打印、激光烧结等不同的3D打印方法,这将会导致工作原理和过程的略微不同。
在这种方法中,使用打印机将活性化合物沉积在基材表面,使化合物不会因薄膜生产和干燥过程中引起的机械和热应力而降解。也可以通过改变印刷溶液或增加层数来设计浓度,这样就可以根据不同个体的需求实现按需生产。在当前3D打印技术中,寻找具有优越性能的天然提取物也至关重要。BORGES等[28]通过对石榴中的天然活性化合物的提取发现,这些提取物不仅可以作为印刷溶液使用,并且,提取物的加入使膜具有良好的黏度和接触角。另外,随着印刷层的增加,酚类化合物的含量也随之增加。这些结果表明:3D打印可以有效地将这些天然化合物掺入聚合物基质中,从而用于口腔膜的制备。
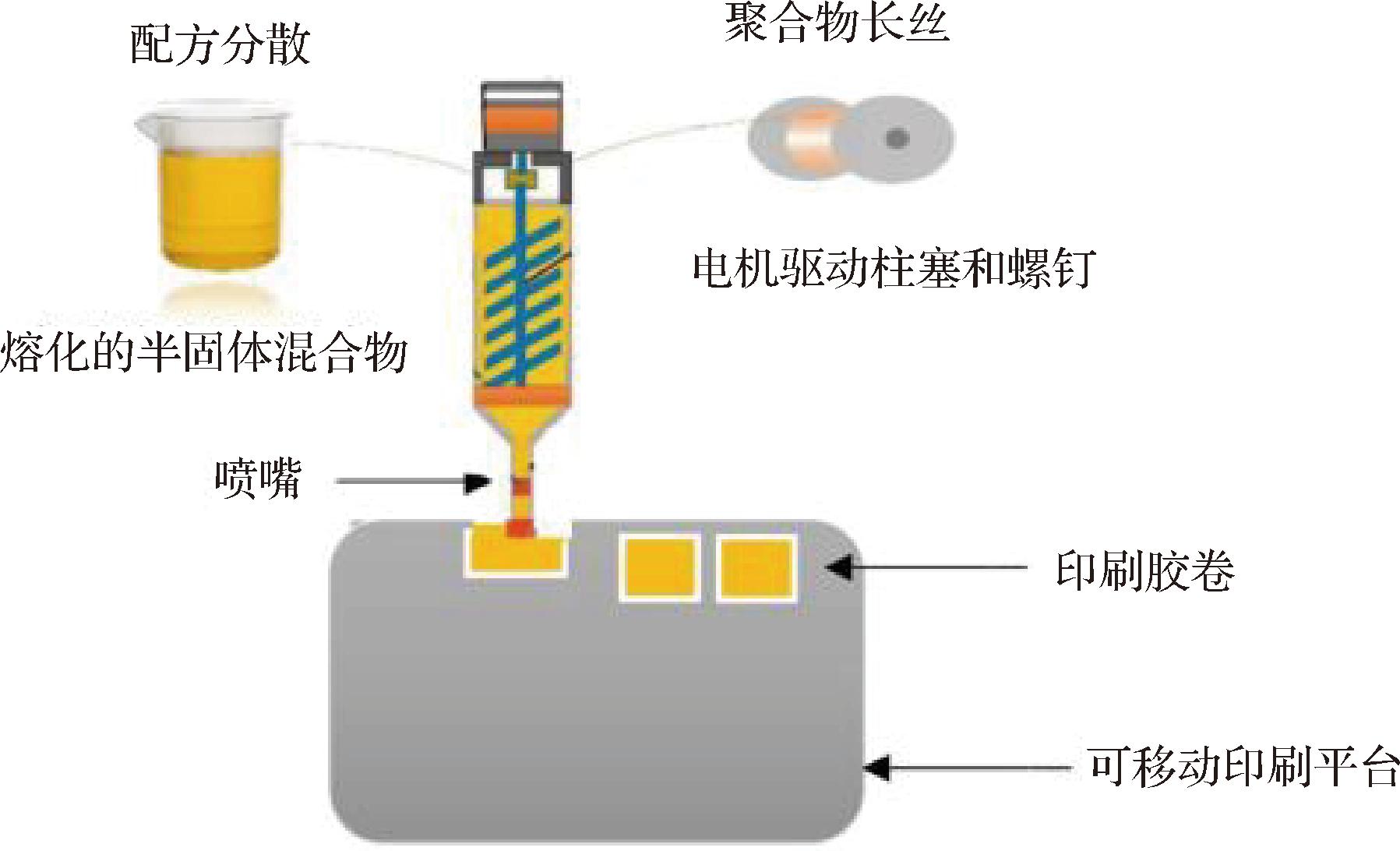
图4 3D打印示意图[29]
Fig.4 Schematic diagram of 3D printing device[29]
另外,根据患者的口腔形态借助3D打印技术可以实现ODF的客制化设计[30]。其次,该种技术还能够实现高精度的制造,即能够准确控制ODF的尺寸、形状和厚度。同时,3D打印技术通过选择特定材料和优化薄膜厚度实现药物的缓慢释放,从而提供持续的治疗效果。相对于传统的制膜方法,3D打印技术能够简化ODF的制备过程,提高制造效率和制造精确性。然而,3D打印技术的速度相对较低;目前可用于3D打印ODF的材料种类也比较有限,如聚乳酸,聚乙二醇等,这限制了其在材料选择上的灵活性。
2.4 其他方法
制备ODF的方法通常还有以下几种。熔融法:将聚合物和药物混合加热熔化,然后倒入模具中,使其凝固形成薄膜。涂布法:将聚合物溶液均匀涂布在平板上,干燥后形成薄膜。热熔挤出法:通过加热材料至熔化状态,并通过挤出机的作用将熔化的材料通过模具挤出成型的一种工艺方法。凝胶化法:将聚合物和药物溶液制备成凝胶,然后通过冷冻、冷冻干燥或化学交联等方法将凝胶转化为溶解膜。这些方法都有各自的优缺点,具体选择适合的制备方法需要根据药物的性质、所需溶解速度、薄膜的稳定性要求等因素进行综合考虑。
LYSZCZARZ等[14]比较了静电纺丝、涂布和3D打印等制备方法对ODF性质的影响。研究发现静电纺丝法制备的ODF具有较好的物理性能和药物释放性能。这是因为静电纺丝法制备的膜具有较低的纤维直径和良好的纳米纤维网络结构,有利于药物的均匀分布和快速释放。而涂布法制备的ODF厚度较大,纤维排列不均匀,药物释放相对较慢。通过3D打印技术,可以制备出具有复杂结构和个性化设计的速溶膜,并实现药物的精准释放。这些研究结果对于ODF的开发和优化具有一定的指导意义。值得注意的是:虽然传统成膜方法都能够实现活性物质的递送,但在制膜时除使用成膜材料外,还需要添加增塑剂、填充剂、崩解促进剂等辅料,难以满足人们对健康食品的追求,这些问题制约了ODF的商业化应用。
3 ODF的评价
膜剂质量评价主要涵盖两大部分:物理性质(即机械性能)评价以及制剂学评价[31]。物理性质包括拉伸强度、耐折度、延伸率、稳定性等。制剂学评价包括外观、平均厚度、平均片重、崩解时间、含量均匀度、pH值、接触角、释放速率、生物相容性等。在此,本文通过对崩解时间、稳定性、接触角、释放速率、pH 值、拉伸强度、折叠耐力、生物相容性等指标的阐述,来对 ODF 予以评价[32]。
3.1 制剂学评价
3.1.1 崩解时间
FOO等[33]认为崩解时间和力学性能是ODF的关键质量属性。崩解时间受多种因素的影响,包括膜的成分、厚度以及溶解液的性质等。首先,成分是影响崩解时间的主要因素之一。常用的溶解膜成分包括聚乙烯醇、羟丙基甲基纤维素等。羟丙基甲基纤维素制备的ODF具有柔韧性和透明性,崩解时间为24.4 s[34]。TEDESCO等[35]评估了不同比例的明胶基和羟丙基甲基纤维对膜崩解时间的影响,观察到羟丙基纤维素浓度的增加导致膜亲水性和崩解时间缩短、黏附性增加。
其次,崩解时间受薄膜厚度和薄膜基体结构双重作用的影响[36]。通常来说,膜的厚度越薄,崩解时间越短。并且,多孔结构的膜会比均质结构的膜具有更快的崩解速度。这是因为完善的网络结构使液滴难以穿透薄膜,使得崩解时间延长[37]。CELEBIOGLU等[38]利用静电纺丝技术制备的姜黄素/环糊精包合物静电纺丝纳米纤维膜具有高孔隙结构,崩解时间小于1 s。沙豪杰[39]采用溶液浇铸法制备的淀粉基ODF质地致密,当添加10%(质量分数)的β-环糊精时,薄膜的崩解时间较长(32.78 s)。TAKEUCHI等[40]研究发现,水分含量也会影响ODF的崩解性能。随着水分含量的增加,ODF的崩解时间显著缩短。这是因为当水分含量较高时,水分被迅速吸收,导致膜的结构松散,变得较易分解。此外,高水分含量还能增加膜的柔软性和可塑性,从而降低其崩解时间。目前,ODF的水分含量尚无既定的标准[41]。在现有的文献中,薄膜的水分含量通常低于10%[31-36]。PECHOV 等[42]主张ODF的水分含量应低于5%。
等[42]主张ODF的水分含量应低于5%。
溶解液的性质如pH值、温度等也会对ODF的崩解时间产生影响。一般来说,溶液的pH值越低,崩解时间越短;温度升高也会加快溶解膜的崩解速度。需要注意的是,ODF的崩解时间也与膜制备方法相关。CILURZO等[43]采用热熔挤压制备的速溶膜崩解时间为45 s,用溶剂铸造法制备的速溶膜的崩解时间为10 s。ÖBLOM等[44]指出,测定崩解时间时,动态振动的方式要比静态测定方式测得的崩解时间短。IRFAN等[45]通过静态测定方式测得的薄膜的崩解时间为90 s或更短。JAIN等[46]报道了以动态振动方式测得的口服薄膜的崩解时间仅为19秒。根据膜崩解时间的不同,可分为快速崩解膜或慢速崩解膜。然而,目前还没有关于快速溶解薄膜崩解时间的官方指导[47]。尽管如此,欧洲药典提出ODF的崩解时间应少于3 min,而美国食品和药物管理局和美国药典建议ODF的崩解时间应为30 s或者更短[48]。
3.1.2 接触角
接触角是指液体与固体之间的接触线所形成的夹角。在ODF与黏膜的接触中,接触角的大小会影响活性成分的释放、膜的附着性以及活性成分在黏膜上的吸收。当接触角较大时,液体与固体之间的接触较差,活性成分的释放和扩散速度会减慢。这可能会降低活性成分的吸收效率,并增加ODF从黏膜上脱落的风险。相反,当接触角较小时,液体与固体之间的接触较好,活性成分能够更好地释放和扩散到黏膜上,有助于增加其吸收速度和效率。据报道,抗氧化剂可能会降低ODF的表面张力,使液体更容易在膜上分散,使膜的接触角减小。BENBETTAÏEB等[49]利用壳聚糖和鱼明胶制备薄膜中加入了香豆素,接触角从110°降至90°以下。此外,较小的接触角还可以提高膜的附着性,使其在黏膜上更稳定地停留,延长药物的停留时间。同时,接触角会随着ODF的水分含量的增加而下降。
3.1.3 释放速率
释放速度是ODF实现治疗或营养补充效果的关键因素之一。释放速率受多种因素影响,包括活性成分的特性、膜的性能和口腔环境等。首先,活性成分的特性会影响其在速溶膜中的释放速度。活性成分的溶解度、溶解动力学和表面积等因素会决定活性成分在膜中的释放速度。对于高溶解度的成分,其在膜中的释放速度可能较快;而对于低溶解度的成分,可能需要更长时间才能完全释放。
其次,膜的成分、厚度、溶解性能等参数都会对活性成分的释放速度产生影响。例如,增加膜的厚度可能会降低活性成分的释放速度,而采用可溶性较高的材料制备速溶膜,可能会加快释放速度。MACIEL等[50]研究了不同成膜条件和添加浓度对药物释放速率的影响,发现羧甲基纤维素的使用可以提高膜的溶解性和释放速率。另有研究表明,若能添加天然植物提取物可进一步改善膜的释放性能。ALI OCKUN等[51]开发了一种含有花青素的枸杞提取物的快速溶解膜,结果表明,该速溶膜体外释放效果良好,10 min内花青素释放量高达98%。
最后,口腔环境对释放速度也有影响。口腔中的温度、pH值、唾液分泌等因素都可能影响药物的释放速度。总的来说,ODF中活性成分的释放速度是一个复杂的问题,受多种因素的综合影响。
3.1.4 pH值
ODF的pH值是指该膜在一定条件下的酸碱性程度[48]。可以通过酸碱指示剂或pH计测量速溶膜的pH值,评估其对口腔酸碱环境的适应性。当ODF放置在舌尖时,应能根据口腔内pH值通过唾液接触溶解或分散。SHIN等[52]学者将儿茶素添加到ODF中,随着其含量的增加,ODF的表面pH值从4.15降至3.62。结果显示,表面pH值的降低虽有助于促进ODF的快速崩解及功能性成分的快速释放,但较低的pH值带来的感官体验较差。因此,为了确保舒适的口感,ODF的表面pH值应尽可能接近生理唾液(5.8~7.4)。当ODF的pH值超出此范围时,可能会出现局部黏膜刺激和不适。
3.1.5 生物相容性
口腔速溶膜的生物相容性意味着该材料在与人体口腔组织、细胞等相互作用的过程中,不会引发有害反应。其评估方法主要为细胞毒性试验等,用于观测材料对细胞生长、增殖等方面的影响。这种评估方法有利于洞悉口腔速溶膜的生物相容性,从而保障其在临床应用中的安全性与可靠性。SAMPRASIT等[53]对由静电纺丝制成的含有美洛昔康的聚乙烯吡咯烷酮/2-羟丙基-β-环糊精口腔速溶膜展开了研究,通过细胞毒性结果表明,该膜在5 min和24 h时的细胞活力均大于80%,在口腔内安全使用长达24 h。
3.2 物理性质
3.2.1 拉伸强度
拉伸强度是指膜在受力下能承受的最大拉伸力,是显示薄膜柔韧性和强度的关键力学参数[54]。拉伸强度通常需要使用拉伸试验进行测量。将ODF样品固定在试验机上,施加拉伸力直到膜断裂,通过测量断裂前的最大拉伸力即可得到拉伸强度。ODF应拥有足够的机械性能,以确保其在加工或摄入时不会被损坏。ZHANG等[55]开发了具有自微乳化技术的快速溶解膜用于补充维生素D,该膜拉伸强度为38.453 72 MPa,弯曲强度大于200次,机械性能良好。增塑剂可能会影响ODF的机械性能。这是因为增塑剂通常与膜配方中存在的聚合物链相互作用,降低玻璃态转变温度,从而改善膜的力学性能[38]。目前,在药物递送领域,膜拉伸强度的实际可接受极限还没有明确规定。
3.2.2 折叠耐力
折叠耐力是指膜在反复折叠、弯曲过程中能保持完整性和稳定性的能力,是评价薄膜强度的重要参数。评价折叠耐力可以使用折叠试验,即将速溶膜样品在同一位置进行折叠操作,记录折叠次数达到某个预定终点时速溶膜的破损情况,可通过观察溶解膜表面的裂纹、断裂、颜色变化等来评估其耐折性能。折叠耐久性可以保证ODF在生产、搬运和运输过程中的完整性。折叠耐力越高,膜破裂的机会越小,反之亦然。据报道,增塑剂会影响薄膜的折叠耐力。MADY等[56]研究证明,随着丙二醇等增塑剂用量的增加,膜的折叠性和耐久性也会有所提高[57]。相反,TAKEUCHI等[58]研究发现,添加甘油增塑剂可以降低羟丙基甲基纤维素薄膜的折叠力。另一方面,不溶性粒子(如碳酸钙)和活性药物成分(如对乙酰氨基酚)的添加会显著降低折叠耐力,尤其是对羟丙基甲基纤维素薄膜的影响更大,但对聚乙烯醇薄膜的影响较小。总的来说,当折叠次数不低于300次时,认为该膜具有良好的机械性能[59]。
3.2.3 稳定性
ODF的稳定性包括物理稳定性、化学稳定性和保存稳定性3个方面。ODF的物理稳定性是指其保持形态完整、结构稳定的能力。这包括对口腔内的摩擦、液体接触和咀嚼等力量的抵抗能力。一个稳定的ODF应该能承受正常使用条件下的外部压力,不易破裂或变形。
ODF的化学稳定性是指其与药物或其他成分相互作用的程度。ODF的成分应该能在质量和功能上保持稳定,不受外部环境、湿度或温度的影响,也不会与药物或其他成分发生化学反应。有研究指出,ODF的稳定性和吸湿性之间存在着微妙的平衡关系。ODF适度的吸湿特性不仅有利于促进活性成分的释放,还有助于维持膜的稳定性。CAROLINA VISSER等[60]指出,ODF制剂中大量残留的水分会促进微生物生长,可能导致活性成分分解。因此,吸湿性是影响ODF稳定性的主要因素之一。同时,使用具有良好稳定性的材料制备ODF,避免材料的降解或相互反应是ODF稳定性的重要保障。DOS SANTOS GARCIA等[61]利用预凝胶化的淀粉和明胶制作ODF时加入针叶樱桃粉末。结果表明,在相对湿度为75%、贮藏温度40 ℃的条件下贮存50 d后,ODF至少保留了60%的抗氧化能力。
ODF的保存稳定性是指在贮存期间,ODF能够保持其初始的质量和性能,这包括其对温度、湿度、光照和氧气等因素的敏感程度。适当的包装和贮存条件对于保持ODF的稳定性至关重要。正确选择ODF的塑形剂,可以有效地保护ODF的稳定性,延长其使用寿命。ELMESHAD等[62]通过使用羟丙基甲基纤维素和麦芽糊精制备ODF,并评估了高湿度条件下贮存后的吸湿性能。研究结果表明,增塑剂和麦芽糊精比例为5∶5时的薄膜表现出最强的吸湿性,在5 d内达到平衡。ZHANG等[55]利用自微乳化技术开发了用于补充维生素D的快速溶解膜。纳米级油滴的包裹有助于提高维生素D的生物利用率并减少药物的波动性。此外,研究还表明,添加适当的表面活性剂也可以显著提高薄膜的物理稳定性和贮存稳定性。
4 ODF在食品领域的应用
随着技术的发展,ODF的应用领域也逐渐扩大。除了用于给药系统外,ODF还可以应用于口腔卫生产品、营养补充剂等领域[7]。在营养补充领域,ODF可用于承载各种维生素、矿物质等营养成分,为消费者提供便捷的营养补充方式。例如,将维生素C、维生素D等制成口腔速溶膜,方便人们随时随地补充营养,尤其适合儿童、老年人等特殊群体[56]。在功能食品领域,可将具有特定功能的成分如益生菌[63]、植物提取物等负载于口腔速溶膜中,有助于改善肠道菌群,提升人体健康水平。在儿童食品领域,专门为儿童设计的口腔速溶膜,包含多种儿童成长必需的营养成分,如钙、铁、锌等。同时,通过独特的口味调配和可爱的形状设计,极大地提高了儿童的食用意愿。
4.1 ODF为口腔保健提供便利
ODF可以用于添加口味、口气清新剂和口腔保健成分,使得口腔清洁和口腔健康更加便利。还可以用于改善口感、增加口味和提供方便性。例如,ODF可以用作口香糖、咀嚼片或含片的替代品,为消费者提供快速便捷的体验。
4.2 ODF递送益生菌
ODF可作为益生菌摄入的常规载体。HEINEMANN等[63]研究开发的ODF膜用于在口腔中输送益生菌。ODF配方由嗜酸乳杆菌或动物双歧杆菌亚种组成。通过活细胞计数和共聚焦显微镜对膜生产和贮存过程中微生物的活力进行评估,结果显示,益生菌在生产过程中损失小于15%;在90 d的贮存期内,益生菌显示出较高的活力。以美卡熊推出的益生菌口腔速溶膜为例,该产品采用先进的口腔速溶膜技术,将高浓度的益生菌封装其中。消费者只需将其放入口中,薄膜迅速溶解,益生菌得以快速吸收。产品具有方便携带、口感良好等优点,深受消费者喜爱。
4.3 ODF递送营养成分
在食品营养递送方面,ODF可被用作补充维生素、矿物质和膳食纤维等营养素的重要途径,用于预防或治疗某些营养缺乏症。例如,ODF是一种很有前途的维生素C递送载体。据报道,基于明胶和淀粉制备的ODF可以将维生素C的抗氧化能力保持在60%以上,并持续30 d[64]。SHIN等[52]制备了含有维生素C和儿茶素的ODF,在模拟体液实验中,该膜中维生素C在20 min内的释放量超过70%。与其他递送系统相比,这些ODF表现出更强的维生素C保留能力。IBSA开发了一种基于麦芽糊精的ODF,含有25 000 IU的维生素D,可用于骨软化症、骨质疏松症等营养缺乏症的预防。另外,AHN等[65]采用透明质酸作为基质,结合维生素D和不同比例的柠檬酸钙,成功研发了ODF。经傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FT-IR)分析证实,薄膜中的维生素D和钙之间形成了新的化学键,实现了维生素D和钙的共同释放和吸收。常道潇等[66]将叶黄素白蛋白纳米粒通过溶剂浇铸法制备的ODF,结果表明,载叶黄素白蛋白纳米粒ODF综合了白蛋白纳米粒和ODF的双重优点,吸收速度显著提高,应用前景良好。因此,ODF可作为递送食品活性因子、快速补充人体营养成分的新型载体。
其次,ODF可以增加营养成分的稳定性和延长保质期。丁海琴等[67]制备含有姜黄素-β-环糊精包合物的淀粉基纳米纤维ODF,结果表明:该膜热稳定性增强、水溶性提高,在贮存60 d后仍具有良好的稳定性。CUPONE等[68]开发了一种麦芽糖糊精的分散膜用于每日补充维生素D3。稳定性评价表明,40 ℃贮存3个月后,维生素D3含量大于90%。该膜在1 min 内崩解,15 min后维生素D3释放量≥75%。类似地,MEHMOOD等[69]以微晶纤维素与羧甲基纤维素钠和羟丙基甲基纤维素为材料,制作了含维生素D3的口服崩解膜。溶解测试表明,维生素D3能够在2 min内快速溶解。并且,当温度40 ℃、湿度75%时,该膜在至少3个月内表现出良好的稳定性。这些结果表明,ODF可作为维生素D3补充剂的一种创新形式。此外,ODF是花生皮中酚类化合物的良好载体,在加速稳定性试验中,该薄膜可保留60%的总酚类化合物[35]。DOS SANTOS GARCIA等[61]证实了预糊化淀粉和含有针叶花粉的明胶基ODF在75%相对湿度和40 ℃的条件下保存50 d内,维生素C抗氧化能力可以保持至少60%。
综上,ODF在递送营养成分和增加其稳定性方面具有不可估量的潜力。尽管如此,目前有关ODF递送食品营养因子的研究还非常有限,这方面的工作亟待开展。
5 结语
综上,ODF的快速溶解性和便携性使其成为营养补充的理想选择,特别是对于那些需要快速、便捷方式补充营养的人群,比如老年人、运动员、孕妇等。此外,高生物利用度等优点使ODF在营养递送方面展示了巨大的潜力。未来,ODF可以通过技术创新实现更多营养素的有效输送,如利用静电纺丝技术制备纳米纤维膜实现活性成分更高的释放性能。纳米颗粒的掺入,这为提高活性成分传递效率和扩大适用范围提供了新的可能性。同时,ODF还可以根据个体的营养需求和生理状态定制,如利用3D打印技术为用户提供更加精准的营养补充方案。
此外,ODF还存在一些不足。如制备过程中常使用的溶剂和添加剂可能对口腔组织产生刺激或不良反应;膜的稳定性和均匀性较低可能会导致活性成分释放不均匀;溶解膜的附着性和降解速度也需要进一步研究和优化。同时,与味道掩盖和复杂活性成分的掺入相关的挑战仍需要进一步的研究和开发来解决。随着ODF的进一步发展,对配方科学、监管指导和临床评估的持续努力同样至关重要,这将有助于充分实现ODF在营养保健服务方面的潜力。随着材料科学和药剂学的发展,新型材料和营养品的开发和运用也将推动ODF具有更为广泛的应用前景。相信ODF有望成为新型的营养递送系统,为相关需求人群提供更加便捷和个性化的营养补给。
[1] MANASA D R, PUJA C, KHAREL R, et al.A review on oral fast dissolving films a novel drug delivery system[J].Asian Journal of Research in Chemistry and Pharmaceutical Sciences, 2016, 4(4):165-175.
[2] SIDDIQUI M D N, GARG G, SHARMA P K.A short review on “A novel approach in oral fast dissolving drug delivery system and their patents”[J].Pharma Science Monitor, 2011, 5(6):291-303.
[3] QAMAR Z, QIZILBASH F F, IQUBAL M K, et al.Nano-based drug delivery system:Recent strategies for the treatment of ocular disease and future perspective[J].Recent Patents on Drug Delivery &Formulation, 2019, 13(4):246-254.
[4] KATHPALIA H, GUPTE A.An introduction to fast dissolving oral thin film drug delivery systems:A review[J].Current Drug Delivery, 2013, 10(6):667-684.
[5] LIEW K B, TAN Y T F, PEH K K.Effect of polymer, plasticizer and filler on orally disintegrating film[J].Drug Development and Industrial Pharmacy, 2014, 40(1):110-119.
[6] XIAO L, YI T, LIU Y.A new self-microemulsifying mouth dissolving film to improve the oral bioavailability of poorly water soluble drugs[J].Drug Development and Industrial Pharmacy, 2013, 39(9):1284-1290.
[7] YUAN C, SHA H J, CUI B.Orally disintegrating film:A new approach to nutritional supplementation[J].Food and Bioprocess Technology, 2022, 15(12):2629-2645.
[8] 刘丹. 中国人口老龄化发展现状、成因与对策[J].中国老年学杂志, 2022, 42(16):4123-4126.
LIU D. Present situation, causes and countermeasures of population aging in China[J]. Chinese Journal of Gerontology, 2022, 42(16):4123-4126.
[9] DOMINIK  , FILIPOV
, FILIPOV B, JEL
B, JEL NEK P, et al.The impact of polymer mixture composition on the properties of electrospun membranes for drug delivery applications[J].International Journal of Pharmaceutics, 2023, 647:123548.
NEK P, et al.The impact of polymer mixture composition on the properties of electrospun membranes for drug delivery applications[J].International Journal of Pharmaceutics, 2023, 647:123548.
[10] TEDESCO M P, DOS SANTOS GARCIA V A, BORGES J G, et al.Production of oral films based on pre-gelatinized starch, CMC and HPMC for delivery of bioactive compounds extract from acerola industrial waste[J].Industrial Crops and Products, 2021, 170:113684.
[11] BALA R, SHARMA S.Formulation optimization and evaluation of fast dissolving film of aprepitant by using design of experiment[J].Bulletin of Faculty of Pharmacy, Cairo University, 2018, 56(2):159-168.
[12] ALHAYALI A, VUDDANDA P R, VELAGA S.Silodosin oral films:Development, physico-mechanical properties and in vitro dissolution studies in simulated saliva[J].Journal of Drug Delivery Science and Technology, 2019, 53:101122.
[13] DAHMASH E Z, IYIRE A, ALYAMI H S.Development of orally dissolving films for pediatric-centric administration of anti-epileptic drug topiramate—A design of experiments (DoE) study[J].Saudi Pharmaceutical Journal, 2021, 29(7):635-647.
[14]  YSZCZARZ E, BRNIAK W, SZAFRANIEC-SZCZ
YSZCZARZ E, BRNIAK W, SZAFRANIEC-SZCZ![]() SNY J, et al.The impact of the preparation method on the properties of orodispersible films with aripiprazole:Electrospinning vs.casting and 3D printing methods[J].Pharmaceutics, 2021, 13(8):1122.
SNY J, et al.The impact of the preparation method on the properties of orodispersible films with aripiprazole:Electrospinning vs.casting and 3D printing methods[J].Pharmaceutics, 2021, 13(8):1122.
[15] 许俊. 5-氟尿嘧啶的纯化及其用聚乳酸微球包埋和缓释过程的研究[D].咸宁:湖北科技学院, 2023.
XU J. Study on purification of 5- fluorouracil and its embedding and sustained release process with polylactic acid microspheres[D]. Xianning: Hubei University of Science and Technology, 2023.
[16] 陈鑫, 费良, 殷允杰, 等.溶剂挥发法制备聚苯乙烯壁材光致变色微胶囊[J].精细化工, 2023, 40(1):63-68.
CHEN X, FEI L, YIN Y J, et al.Preparation of polystyrene wall photochromic microcapsules by solvent evaporation[J].Fine Chemicals, 2023, 40(1):63-68.
[17] RUSLAN M F H, JANAKIRAMAN A K, MING L C, et al.Comparison of solvent casting and spray casting method on compounding of an orally disintegrating film containing amlodipine besylate[J].International Journal of Pharmaceutical Compounding, 2022, 26(2):155-162.
[18] STOJANOV S, BERLEC A.Electrospun nanofibers as carriers of microorganisms, stem cells, proteins, and nucleic acids in therapeutic and other applications[J].Frontiers in Bioengineering and Biotechnology, 2020, 8:130.
[19] BIRER M, ACARTÜRK F.Electrospun orally disintegrating film formulation of telmisartan[J].Pharmaceutical Development and Technology, 2021, 26(6):661-672.
[20] CELEBIOGLU A, UYAR T.Development of ferulic acid/cyclodextrin inclusion complex nanofibers for fast-dissolving drug delivery system[J].International Journal of Pharmaceutics, 2020, 584:119395.
[21] JACOBSEN C, GARC A-MORENO P J, MENDES A C, et al.Use of electrohydrodynamic processing for encapsulation of sensitive bioactive compounds and applications in food[J].Annual Review of Food Science and Technology, 2018, 9:525-549.
A-MORENO P J, MENDES A C, et al.Use of electrohydrodynamic processing for encapsulation of sensitive bioactive compounds and applications in food[J].Annual Review of Food Science and Technology, 2018, 9:525-549.
[22] 杨欢. 静电纺功能性鱼油纳米纤维膜的制备及性能研究[D].广州:华南理工大学, 2017.
YANG H.Study on preparation of electrospun functional fish oil nanofilm and its proper[D].Guangzhou:South China University of Technology, 2017.
[23] 冯坤, 皇甫露露, 相启森, 等.静电纺丝技术在食品抗菌保鲜中的应用研究进展[J].食品安全质量检测学报, 2022, 13(20):6554-6562.
FENG K, HUANGFU L L, XIANG Q S, et al.Research progress on the application of electrospinning technology in food antibacterial preservation[J].Journal of Food Safety &Quality, 2022, 13(20):6554-6562.
[24] YU D G, ZHOU J.How can electrospinning further service well for pharmaceutical researches?[J].Journal of Pharmaceutical Sciences, 2023, 112(11):2719-2723.
[25] POORESMAEIL M, NAMAZI H, SALEHI R.Synthesis of photoluminescent glycodendrimer with terminal β-cyclodextrin molecules as a biocompatible pH-sensitive carrier for doxorubicin delivery[J].Carbohydrate Polymers, 2020, 246:116658.
[26] 宋玉东. 负载活性因子的电纺纤维膜的制备及应用研究[D].长春:吉林大学, 2022.
SONG Y D.Fabrication and application of electrospun fibrous films loadedwith active factors[D].Changchun:Jilin University, 2022.
[27] MONIA KABANDANA G K, ZHANG T, CHEN C P.Emerging 3D printing technologies and methodologies for microfluidic development[J].Analytical Methods, 2022, 14(30):2885-2906.
[28] BORGES J G, DOS SANTOS GARCIA V A, DE CARVALHO R A.Extraction of active compounds from different parts of pomegranate and incorporation into a potential delivery model system using a printing technique[J].Food Bioscience, 2019, 32:100480.
[29] JACOB S, BODDU S H S, BHANDARE R, et al.Orodispersible films:Current innovations and emerging trends[J].Pharmaceutics, 2023, 15(12):2753.
[30] MUSAZZI U M, SELMIN F, ORTENZI M A, et al.Personalized orodispersible films by hot melt ram extrusion 3D printing[J].International Journal of Pharmaceutics, 2018, 551(1-2):52-59.
[31] 魏婷, 王丹丹, 赵雅.口腔速溶膜剂改良药物剂型的研究方法[J].甘肃科技, 2020, 36(24):129-133.
WEI T, WANG D D, ZHAO Y. Research method of improving pharmaceutical dosage form of oral instant film agent[J]. Gansu Science and Technology, 2020, 36(24):129-133.
[32] 高松, 邱慧敏, 孙婷, 等.口腔速溶膜剂的研究进展[J].中国药剂学杂志(网络版), 2023, 21(5):263-269.
GAO S, QIU H M, SUN T, et al.Advance in oral fast dissolving films[J].Chinese Journal of Pharmaceutics (Online Edition), 2023, 21(5):263-269.
[33] FOO W C, KHONG Y M, GOKHALE R, et al.A novel unit-dose approach for the pharmaceutical compounding of an orodispersible film[J].International Journal of Pharmaceutics, 2018, 539(1-2):165-174.
[34] OUDA G I, DAHMASH E Z, ALYAMI H, et al.A novel technique to improve drug loading capacity of fast/extended release orally dissolving films with potential for paediatric and geriatric drug delivery[J].Aaps Pharmscitech, 2020, 21(4):126.
[35] TEDESCO M P, MONACO-LOURENÇO C A, CARVALHO R A.Gelatin/hydroxypropyl methylcellulose matrices-polymer interactions approach for oral disintegrating films[J].Materials Science &Engineering C, 2016, 69:668-674.
[36] SHA H J, YUAN C, CUI B, et al.Pre-gelatinized cassava starch orally disintegrating films:Influence of β-cyclodextrin[J].Food Hydrocolloids, 2022, 123:107196.
[37] YUAN C, XU D Y, CUI B, et al.Gelation of κ-carrageenan/Konjac glucommanan compound gel:Effect of cyclodextrins[J].Food Hydrocolloids, 2019, 87:158-164.
[38] CELEBIOGLU A, UYAR T.Fast-dissolving antioxidant curcumin/cyclodextrin inclusion complex electrospun nanofibrous webs[J].Food Chemistry, 2020, 317:126397.
[39] 沙豪杰. 功能性淀粉基口腔速溶膜的制备与性能研究[D].济南:齐鲁工业大学, 2022.
SHA H J. Preparation and properties of functional starch-based oral instant film[D]. Jinan: Qilu University of Technology, 2022.
[40] TAKEUCHI Y, HAYAKAWA F, TAHARA K, et al.Orally disintegrating films:The effects of water content on disintegration and mechanical properties[J].Journal of Drug Delivery Science and Technology, 2021, 66:102893.
[41] CARULINA VISSER J, WOERDENBAG H J, CREDIET S, et al.Orodispersible films in individualized pharmacotherapy:The development of a formulation for pharmacy preparations[J].International Journal of Pharmaceutics, 2015, 478(1):155-163.
[42] PECHOV V, GAJDZIOK J, MUSEL
V, GAJDZIOK J, MUSEL K J, et al.Development of orodispersible films containing benzydamine hydrochloride using a modified solvent casting method[J].Aaps Pharmscitech, 2018, 19(6):2509-2518.
K J, et al.Development of orodispersible films containing benzydamine hydrochloride using a modified solvent casting method[J].Aaps Pharmscitech, 2018, 19(6):2509-2518.
[43] CILURZO F, CUPONE I E, MINGHETTI P, et al.Fast dissolving films made of maltodextrins[J].European Journal of Pharmaceutics and Biopharmaceutics, 2008, 70(3):895-900.
[44] ÖBLOM H, SJÖHOLM E, RAUTAMO M, et al.Towards printed pediatric medicines in hospital pharmacies:Comparison of 2D and 3D-printed orodispersible warfarin films with conventional oral powders in unit dose sachets[J].Pharmaceutics, 2019, 11(7):334.
[45] IRFAN M,RABEL S,BUKHTAR Q, et al.Orally disintegrating films:A modern expansion in drug delivery system[J].Saudi Pharmaceutical Journal, 2016, 24(5):537-546.
[46] JAIN R A, MUNDADA A S.Formulation, development and optimization of fast dissolving oral film of montelukast sodium[J].International Journal of Drug Development and Research, 2015,7(4):40-46.
[47] JADHAV Y G, GALGATTE U C, CHAUDHARI P D.Overcoming poor solubility of dimenhydrinate:Development, optimization and evaluation of fast dissolving oral film[J].Advanced Pharmaceutical Bulletin, 2018, 8(4):721-725.
[48] ÖZAKAR E, SEVINÇ-ÖZAKAR R, YILMAZ B.Preparation, characterization, and evaluation of cytotoxicity of fast dissolving hydrogel based oral thin films containing pregabalin and methylcobalamin[J].Gels, 2023, 9(2):147.
[49] BENBETTAÏEB N, CHAMBIN O, ASSIFAOUI A, et al.Release of coumarin incorporated into chitosan-gelatin irradiated films[J].Food Hydrocolloids, 2016, 56:266-276.
[50] MACIEL V B V, REMEDIO L N, YOSHIDA C M P, et al.Carboxymethyl cellulose-based orally disintegrating films enriched with natural plant extract for oral iron delivery[J].Journal of Drug Delivery Science and Technology, 2021, 66:102852.
[51] ALI OCKUN M, BARANAUSKAITE J, UNER B, et al.Preparation, characterization and evaluation of liposomal-freeze dried anthocyanin-enriched Vaccinium arctostaphylo L.fruit extract incorporated into fast dissolving oral films[J].Journal of Drug Delivery Science and Technology, 2022, 72:103428.
[52] SHIN H J, CHANG J H, HAN J A.Physicochemical and in-vitro release characteristics of vitamin C-loaded antioxidant orally disintegrating films with different catechin levels[J].Food Bioscience, 2023, 53:102733.
[53] SAMPRASIT W, AKKARAMONGKOLPORN P, KAOMONGKOLGIT R, et al.Cyclodextrin-based oral dissolving films formulation of taste-masked meloxicam[J].Pharmaceutical Development and Technology, 2018, 23(5):530-539.
[54] SIRIPRUEKPONG W, ISSARACHOT O, KAEWKROEK K, et al.Development of gastroretentive carriers for curcumin-loaded solid dispersion based on expandable starch/chitosan films[J].Molecules, 2023, 28(1):361.
[55] ZHANG M, ZHANG T R, ZOU Y, et al.Self-microemulsifying oral fast dissolving films of vitamin D3 for infants:Preparation and characterization[J].Food Science and Nutrition, 2019, 7(8):2577-2583.
[56] MADY O Y, DONIA A M, AL-MADBOLY L A.Miconazole-urea in a buccal film as a new trend for treatment of resistant mouth fungal white patches[J].Frontiers in Microbiology, 2018, 9:837.
[57] ASHRAF I, HANNA P A, GAD S, et al.Enhancing pharmacokinetics and pharmacodynamics of rosuvastatin calcium through the development and optimization of fast-dissolving films[J].Pharmaceutics, 2023, 15(11):2640.
[58] TAKEUCHI Y, IKEDA N, TAHARA K, et al.Mechanical characteristics of orally disintegrating films:Comparison of folding endurance and tensile properties[J].International Journal of Pharmaceutics, 2020, 589:119876.
[59] YIR-ERONG B, BAYOR M T, AYENSU I, et al.Oral thin films as a remedy for noncompliance in pediatric and geriatric patients[J].Therapeutic Delivery, 2019, 10(7):443-464.
[60] CARULINA VISSER J, WIBIER L, KIEFER O, et al.A pediatrics utilization study in the netherlands to identify active pharmaceutical ingredients suitable for inkjet printing on orodispersible films[J].Pharmaceutics, 2020, 12:164.
[61] DOS SANTOS GARCIA V A, BORGES J G, OSIRO D, et al.Orally disintegrating films based on gelatin and pregelatinized starch:New carriers of active compounds from acerola[J].Food Hydrocolloids, 2020, 101:105518.
[62] ELMESHAD A N, EL HAGRASY A S.Characterization and optimization of orodispersible mosapride film formulations[J].Aaps Pharmscitech, 2011, 12(4):1384-1392.
[63] HEINEMANN R J B, CARVALHO R A, FAVARO-TRINDADE C S.Orally disintegrating film (ODF) for delivery of probiotics in the oral cavity: Development of a novel product for oral health[J].Innovative Food Science &Emerging Technologies, 2013, 19:227-232.
[64] DOS SANTOS GARCIA V A, BORGES J G, VIEIRA MACIEL V B, et al.Gelatin/starch orally disintegrating films as a promising system for vitamin C delivery[J].Food Hydrocolloids, 2018, 79:127-135.
[65] AHN D Y,KANG S Y, HAN J A.Impact of calcium addition on the characteristics of hyaluronic acid-based oral films for vitamin D supplementation[J].Food Hydrocolloids, 2024, 148:109461.
[66] 常道潇, 冯军, 朱溶月, 等.载叶黄素白蛋白纳米粒口腔速溶膜的制备及评价[J].食品科技, 2018, 43(1):93-98.
CHANG D X, FENG J, ZHU R Y, et al.Preparation and evaluation of oral fast dissolving films containing lutein nanoparticles incorporated with bovine serum albumin[J].Food Science and Technology, 2018, 43(1):93-98.
[67] 丁海琴, 穆娟.淀粉基纳米纤维口腔速溶膜的制备及其性能研究[J].粮食与油脂, 2023, 36(11):84-89.
DING H Q, MU J.Study on the preparation and properties of starch-based nanofiber oral instant film[J].Cereals &Oils, 2023, 36(11):84-89.
[68] CUPONE I E, DELLERA E, MARRA F, et al.Development and characterization of an orodispersible film for vitamin D3 supplementation[J].Molecules, 2020, 25(24):5851.
[69] MEHMOOD Y, SHAHID H, SOHAIL M, et al.Biopolymer based film loaded with cholecalciferol:A novel technique to enhance nutritional supplement absorbance[J].Pakistan Journal of Pharmaceutical Sciences, 2023, 36(5):1649-1656.