肠道是营养物质消化与吸收的重要场所,也是抵御外来抗原,维持体内稳态的关键部位[1]。肠腔中存在的数万亿共生微生物,即肠道菌群,彼此作用,逐渐形成一个相互依存、相互制约的稳态环境[2]。肠道菌群对肠道健康和黏膜屏障的发育至关重要,菌群失调会影响肠道代谢和稳态[3]。作为肠道菌群的组成部分,乳酸菌(lactic acid bacteria, LAB)具有增强机体免疫、拮抗病原菌及调节微环境稳态等益生作用[4]。其中,母乳来源的乳酸菌作为人源乳酸菌的一类,因良好的安全性及人体适应性[5],在功能挖掘与运用方面具有巨大潜力,已成为珍贵的微生物资源。
现有研究证明,母乳源乳酸菌是婴幼儿肠道微生物的重要来源,参与早期肠道菌群的建立并刺激免疫系统的发育与成熟[5]。对于成人,其能促进肠道营养代谢和吸收、构建肠道屏障、调节肠道菌群[6-7]。尽管母乳源乳酸菌在功能开发和产品创新领域中具有广阔前景,但我国拥有自主知识产权的母乳源乳酸菌在科研成果转化与实际应用方面仍十分有限[5],主要问题可能是:a)益生菌市场菌株同质化严重[5],受样品自身和传统培养方法的限制,分离、培养的乳酸菌种类较少,可选择范围较窄。b)母乳源中乳酸菌的功能研究相对较少,缺乏权威数据支撑,无法证明母乳来源的菌株在功效方面具有显著优势。因此本文对母乳中乳酸菌的种类及来源、母乳源乳酸菌对婴幼儿和成人肠道稳态的影响及其中益生菌株专利与产业化应用情况进行综述,旨在为挖掘功能性母乳源乳酸菌的研究和应用提供新的方向。
1 母乳源乳酸菌
1.1 母乳中乳酸菌种类
长期以来,母乳一直被认为是无菌的[8]。随着研究者对婴儿肠道菌群进行追溯,在不同地区、不同年龄、不同个体的母乳样本中均证明微生物的存在[9]。目前已从母乳中鉴别出200多种细菌,其中葡萄球菌(Staphylococcus)、链球菌(Streptococcus)、假单胞菌(Pseudomonas)、乳杆菌(Lactobacillus)和双歧杆菌(Bifidobacterium)最为常见[10-11]。多项研究证明母乳中主要以链球菌、金黄色葡萄球菌为优势菌群,其余的菌群含量低于10%[10-11]。母乳菌群在女性泌乳期间会发生动态变化[12]。初乳(0~5 d)菌群与过渡乳(6~15 d)菌群结构相似,和成熟乳(>15 d)菌群差异较大(表1)。乳酸菌在母乳中相对丰度不高,检出频率小,但分离出的菌株在功能挖掘方面具有较大潜能[13]。植物乳植杆菌(Lactiplantibacillus plantarum)、格氏乳杆菌(Lactobacillus gasseri)、发酵粘液乳杆菌(Limosilactobacillus fermentum)、罗伊氏粘液乳杆菌(Limosilactobacillus reuteri)、长双歧杆菌(Bifidobacterium longum)和短双歧杆菌(Bifidobacterium breve)常在母乳样本中被检出(表2)。因母乳菌群受泌乳时期、分娩方式、抗生素使用、饮食与地域等多方面影响,并因筛选及培养方法的不同,鉴定出的乳酸菌种类也存在差异。
表1 泌乳期间母乳中优势菌属的变化
Table 1 Changes in dominant bacterial genera in breast milk during lactation

泌乳期 优势菌属 初乳(0~5 d)Streptococcus、Staphylococcus过渡乳(6~15 d)Streptococcus、Staphylococcus、Lactobacillus、Bifidobacterium成熟乳(>15 d)Escherichia-Shigelle、Bifidobacterium、Streptococcus、Staphylococcus、Lactobacillus
表2 母乳中常见乳酸菌种类
Table 2 Overview of lactic acid bacteria (LAB) in breast milk
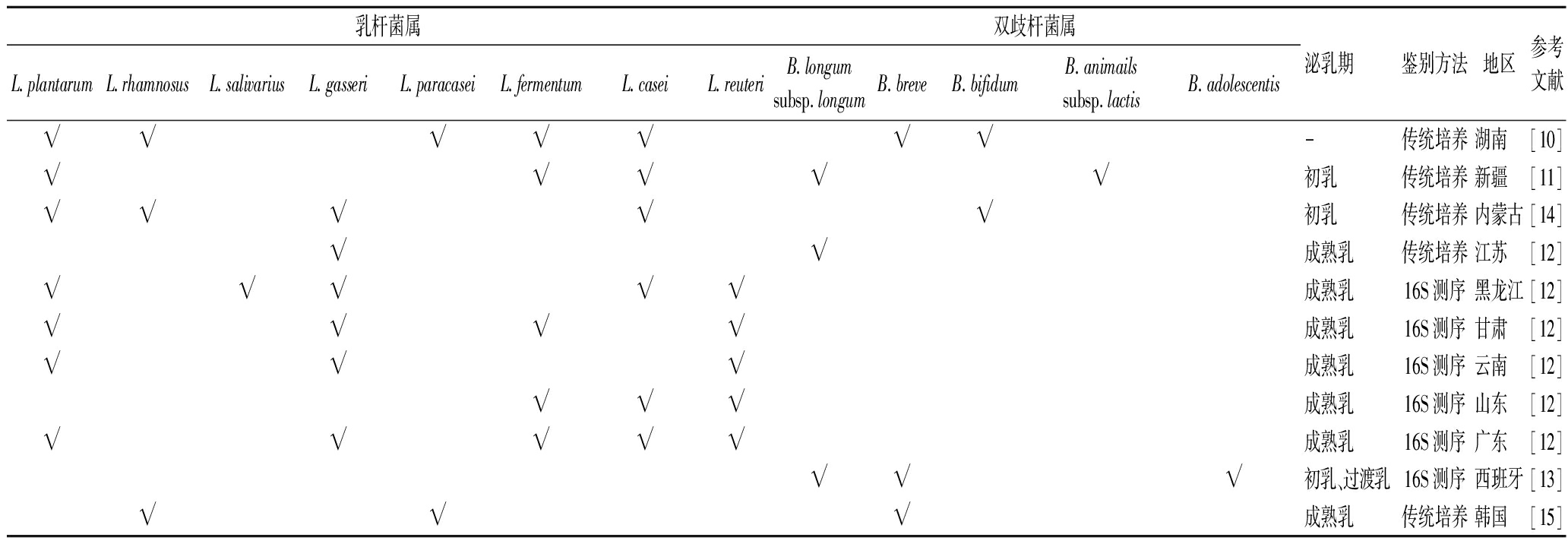
乳杆菌属双歧杆菌属L.plantarumL.rhamnosusL.salivariusL.gasseriL.paracaseiL.fermentumL.caseiL.reuteriB.longumsubsp.longumB.breveB.bifidumB.animailssubsp.lactisB.adolescentis泌乳期鉴别方法地区参考文献√√√√√√√-传统培养湖南[10]√√√√√初乳传统培养新疆[11]√√√√√初乳传统培养内蒙古[14]√√成熟乳传统培养江苏[12]√√√√√成熟乳16S测序黑龙江[12]√√√√成熟乳16S测序甘肃[12]√√√成熟乳16S测序云南[12]√√√成熟乳16S测序山东[12]√√√√√成熟乳16S测序广东[12]√√√初乳、过渡乳16S测序西班牙[13]√√√成熟乳传统培养韩国[15]
1.2 母乳中乳酸菌的来源
1.2.1 “逆行转移”假说
母乳中微生物的来源一直是学术界争论的热点之一[7]。因链球菌和葡萄球菌是成年人皮肤上常见的微生物,且母乳中这2种细菌相对丰度大,出现频率高[16]。两处在微生物组成与结构上存在一定相似性。有研究者认为这主要与外界环境交叉感染有关[17]。婴幼儿哺乳期间,母亲乳腺中存在大量逆行流,口腔及皮肤上的微生物可随婴儿吮吸过程进入乳腺并在其中定殖[16,18]。这在一定程度上可以解释母乳中链球菌和葡萄球菌的来源。
针对母乳中的乳酸菌,有观点认为其可能是通过阴道-皮肤-乳腺通路进行转移[17]。乳酸菌是绝大多数育龄期女性阴道内定殖的主要细菌[19]。健康女性阴道中乳酸菌的相对丰度通常在70%以上,其中以卷曲乳杆菌、格氏乳杆菌和惰性乳杆菌为主[20]。顺产的婴儿在出生时口腔和皮肤上会附着阴道分泌物[21],这为乳酸菌的转移提供了条件。有研究者进一步发现分娩方式会影响母乳菌群的构成[22]。在围产期额外补充益生菌,相较于剖腹产,顺产的母亲乳腺中乳酸菌的含量会增多[22]。这为逆行转移假说提供了一定程度上的数据支持。
1.2.2 “肠-乳腺轴”假说
随着对母乳中乳酸菌来源的不断深入探索,有研究发现不同地区的母乳样品具有相似且稳定的菌群结构,即存在“核心”菌群[9]。这进一步暗示母乳菌群不仅仅是外界环境造成的结果,而可能是通过身体其他内源性通路转移至乳腺。用标记的金黄色葡萄球菌喂养妊娠期小鼠,在分泌的乳汁中可以检测出标记菌株[23],同时有研究进一步证明妊娠晚期的女性肠道中的部分细菌可以实现一定距离的易位[24]。大量的研究结果显示,母乳中的部分细菌与肠道内的细菌亲缘关系近,暗示着母乳中某些菌株极有可能来自于肠道[16, 18]。目前还无法完全解释肠道细菌迁移至乳腺的明确机理。但在这一转移过程中,免疫系统尤其是肠道内的免疫细胞,如树突状细胞和巨噬细胞,发挥着关键作用[25]。树突状细胞能在肠腔中少量捕捉某些特殊的细菌(如乳酸菌),携带其穿过上皮细胞层,随淋巴循环迁移至身体各处[25]。
PEREZ等[26]通过收集哺乳期妇女的乳汁、外周血和对应的婴儿粪便,研究了所分离出的细菌在小鼠器官组织中的转移情况。结果表明,肠道细菌可通过单核细胞运输到乳腺[26]。此外,肠道菌群结构的改变、肠屏障通透性的增加均会导致细菌的迁移[24]。以上研究极大地增加了母乳中乳酸菌来自于肠道的可信度,但也存在许多亟待解决的问题,如肠道内免疫细胞对细菌的选择性,被迁移菌株自身的特性,机体如何维持肠道细菌的迁移量等[16]。
2 母乳源乳酸菌与肠道稳态
2.1 母乳源乳酸菌对婴幼儿肠道稳态的影响
母乳被公认为婴幼儿完美的天然食物,是早期肠道微生物的重要来源,参与肠道菌群的建立,也是免疫发育的关键,对宿主健康具有长期影响[27-29]。研究显示纯母乳喂养和配方奶粉喂养构建了不同的婴幼儿肠道菌群组成。纯母乳喂养的婴儿肠道中双歧杆菌、葡萄球菌和链球菌的相对丰度较高,且双歧杆菌种内构成复杂,而配方奶粉喂养的婴儿肠道中拟杆菌、梭状芽孢杆菌、肠杆菌和肠球菌含量偏高,乳杆菌与双歧杆菌丰度较低[30]。研究也发现长期配方奶粉喂养会增加婴幼儿患肠道相关疾病的风险[30],这可能与喂养后婴幼儿肠道的乳杆菌和双歧杆菌丰度较低相关。因此在生命早期采用母乳喂养或补充具有特定益生菌的配方奶粉是促进婴幼儿肠道健康发育的重要举措。
母乳源乳酸菌因其来源安全、具有良好的人体适应性,已被多项研究证明在早期肠道黏膜免疫和菌群建立方面具有促进作用[31]。母乳源罗伊氏粘液乳杆菌FN041在前期研究中发现,其能提高刚断乳的BALB/c小鼠肠道中sIgA的含量和抗菌肽相关基因的表达量,增强肠道屏障的防御能力,降低感染风险[32]。后进一步对处于妊娠晚期、哺乳期及断奶期的BALB/c母鼠及仔鼠进行FN041干预,发现该菌可在母婴间垂直传播,并刺激子代肠道内调节性T细胞的分化、抑制肥大细胞和嗜酸性粒细胞浸润[33-34]。
同样能在母婴间垂直传播的母乳源发酵粘液乳杆菌CECT5716,可改变哺乳期母亲肠道菌群结构和短链脂肪酸(short chain fatty acids,SCFAs)含量,并通过“肠-乳腺轴”促进母乳低聚糖的合成,进一步提高婴儿肠道中双歧杆菌对母乳低聚糖的利用,增加有益菌丰度[35]。在之后的多项临床试验中,发酵粘液乳杆菌CECT5716被证明可使非母乳喂养的剖腹产婴儿胃肠道感染风险降低73%[35-37]。并在一项针对236例1月龄婴儿为期1年的临床实验中,与婴儿配方奶粉相比,摄入添加发酵粘液乳杆菌CECT5716或短双歧杆菌CECT7263奶粉的婴儿腹泻发生率和夜间啼哭时间均有明显降低[38]。虽然具体机制尚不明确,但这可能与婴儿肠道内独特的微生物群落环境有关[38]。乳酸菌的摄入与定殖刺激肠道早期免疫系统的发育与成熟,同时促进肠道菌群的建立与稳定,进而维护肠道微生态的平衡。健康儿童摄入母乳来源的棒状乳杆菌CECT5711和格式乳杆菌CECT5714后,可观察到肠道菌群结构发生调整[39]。乳酸菌的引入导致肠道内部分病原体丰度相对减少,胃肠道抵抗外来致病菌侵袭和感染的能力也有相应提高[39]。这一结果不仅表现出母乳源乳酸菌对儿童肠道健康的益生作用,也进一步突出肠道菌群平衡在提升机体免疫防御中的重要地位。表3及图1总结了部分代表性母乳源乳酸菌对婴幼儿肠道稳态的影响。
尽管目前对母乳源乳酸菌预防疾病的实质性证据不足,但其在协助早期肠道菌群的建立,促进肠道免疫系统的发育与成熟上具有积极作用[18,28,40]。虽机制尚不明确,但现有结果进一步证明母乳源乳酸菌的安全性与功能性。
2.2 母乳源乳酸菌对成人肠道稳态的影响
肠道菌群在整个生命周期内是动态变化的[41]。与婴儿相比,成人肠道菌群结构相对稳定,拟杆菌属和真/优杆菌属是成年人肠道中常见的细菌[41]。成年人肠道菌群主要受宿主基因型、年龄、地理环境、膳食结构等因素影响[42]。在稳定状态下成人肠道内已存在各类活化的免疫细胞以快速应对各类抗原,这种状态被称为“生理性炎症”[43]。成人在不同生理状态下摄入母乳源乳酸菌,其发挥的益生功效也有所差别[44]。
在疾病状态时,母乳源乳酸菌往往表现出较明显的益生功效。一项为期3个月的临床实验显示,哮喘患者在连续摄入动物双歧杆菌乳亚种Probio-M8后,肠道菌群结构与代谢发生改变。其中双歧杆菌与普雷沃菌的相对丰度增加,肠道中菌群代谢产物如脂肪酸乙醇酰胺、三羟基丁酸与血清中5-十二烯酸、色氨酸、鞘磷脂的含量均有所提高[45]。这可能与疾病状态下肠道稳态失衡,致病菌丰度增加有关,摄入的乳酸菌有利于恢复肠道菌群稳态[4]。但当宿主的生理状态处于相对稳定时,母乳源乳酸菌的摄入将不会表现出在疾病宿主身上所看到的显著效果。相反,它们只表现出对极少数生理指标的小规模微调。在以30名健康成人为研究对象的实验中,格式乳杆菌CECT5714和棒状乳杆菌CECT5711两种母乳源乳酸菌可定殖于成人肠道,但仅改变粪便中乳酸菌等少数菌的相对丰度,对其他生理生化指标无显著影响[46]。
母乳源乳酸菌所发挥的功效受宿主肠道环境的影响较大[44]。鼠李糖乳杆菌Probio-M9可以显著改善处于压力状态下成人的肠道菌群多样性,粪便中巴氏杆菌(Barnesiella)和阿克曼氏菌(Akkermansia)的相对丰度与吡多胺、多巴胺和5-羟色胺等代谢物含量均得到提高[47]。但在另一项研究中,通过对100名健康大学生进行为期6周的Probio-M9 干预,发现其对人体免疫、肠道菌群和代谢的影响是有限的,但可以很大程度上影响多组学数据(益生菌干预引起的差异代谢物、细菌类群等)与免疫指标间的相关性,并可以抑制肠道菌群中单核苷酸变异,稳定肠道微生物的遗传[48]。这进一步为母乳源乳酸菌的安全性提供证据。肠道环境处于正常稳态时,母乳源乳酸菌并不会对宿主产生显著影响。但在宿主肠道受不利因素影响时,其前期所建立的新的肠道稳态往往可以在一定程度上削弱这种干扰。表3及图1总结了部分代表性母乳源乳酸菌对成人肠道稳态的影响。
表3 具有调节肠道稳态的代表性母乳源乳酸菌
Table 3 Typical breast milk-derived LAB in regulating intestinal homeostasis
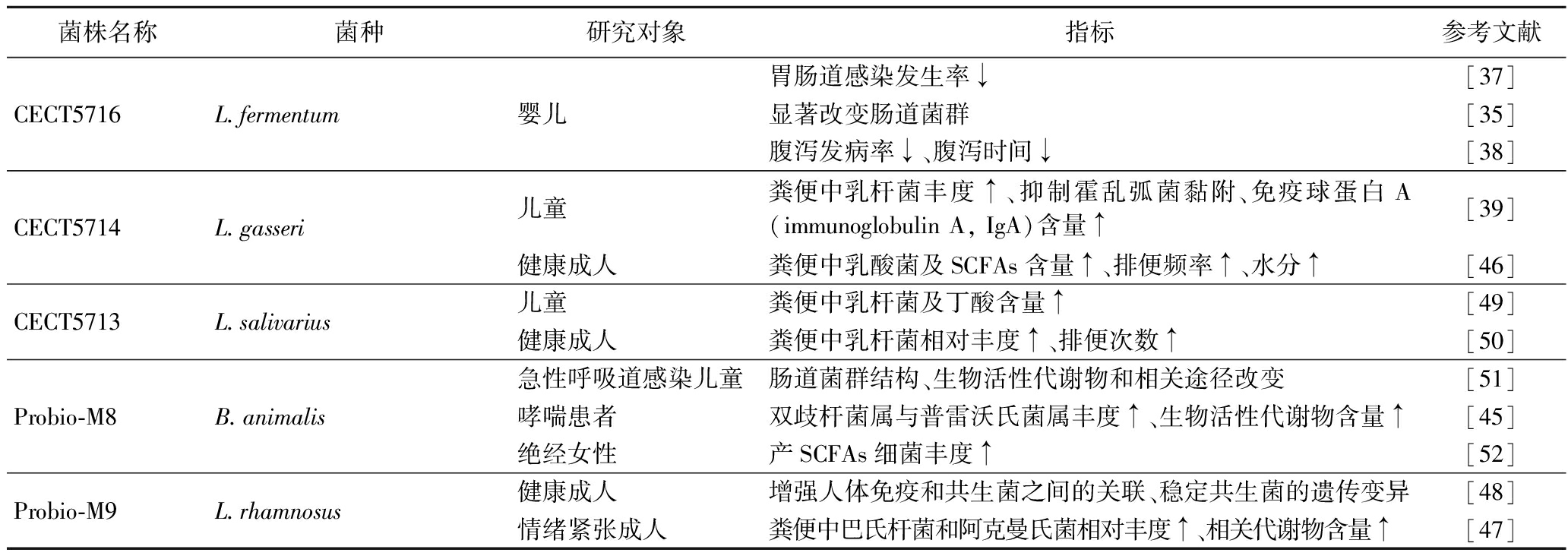
菌株名称菌种研究对象指标参考文献CECT5716L.fermentum婴儿胃肠道感染发生率↓[37]显著改变肠道菌群[35]腹泻发病率↓、腹泻时间↓[38]CECT5714L.gasseri儿童粪便中乳杆菌丰度↑、抑制霍乱弧菌黏附、免疫球蛋白A(immunoglobulin A, IgA)含量↑[39]健康成人粪便中乳酸菌及SCFAs含量↑、排便频率↑、水分↑[46]CECT5713L.salivarius儿童粪便中乳杆菌及丁酸含量↑[49]健康成人粪便中乳杆菌相对丰度↑、排便次数↑[50]Probio-M8B.animalis急性呼吸道感染儿童肠道菌群结构、生物活性代谢物和相关途径改变[51]哮喘患者双歧杆菌属与普雷沃氏菌属丰度↑、生物活性代谢物含量↑[45]绝经女性产SCFAs细菌丰度↑[52]Probio-M9L.rhamnosus健康成人增强人体免疫和共生菌之间的关联、稳定共生菌的遗传变异[48]情绪紧张成人粪便中巴氏杆菌和阿克曼氏菌相对丰度↑、相关代谢物含量↑[47]
注:“↓”表示下降;“↑”表示上升。
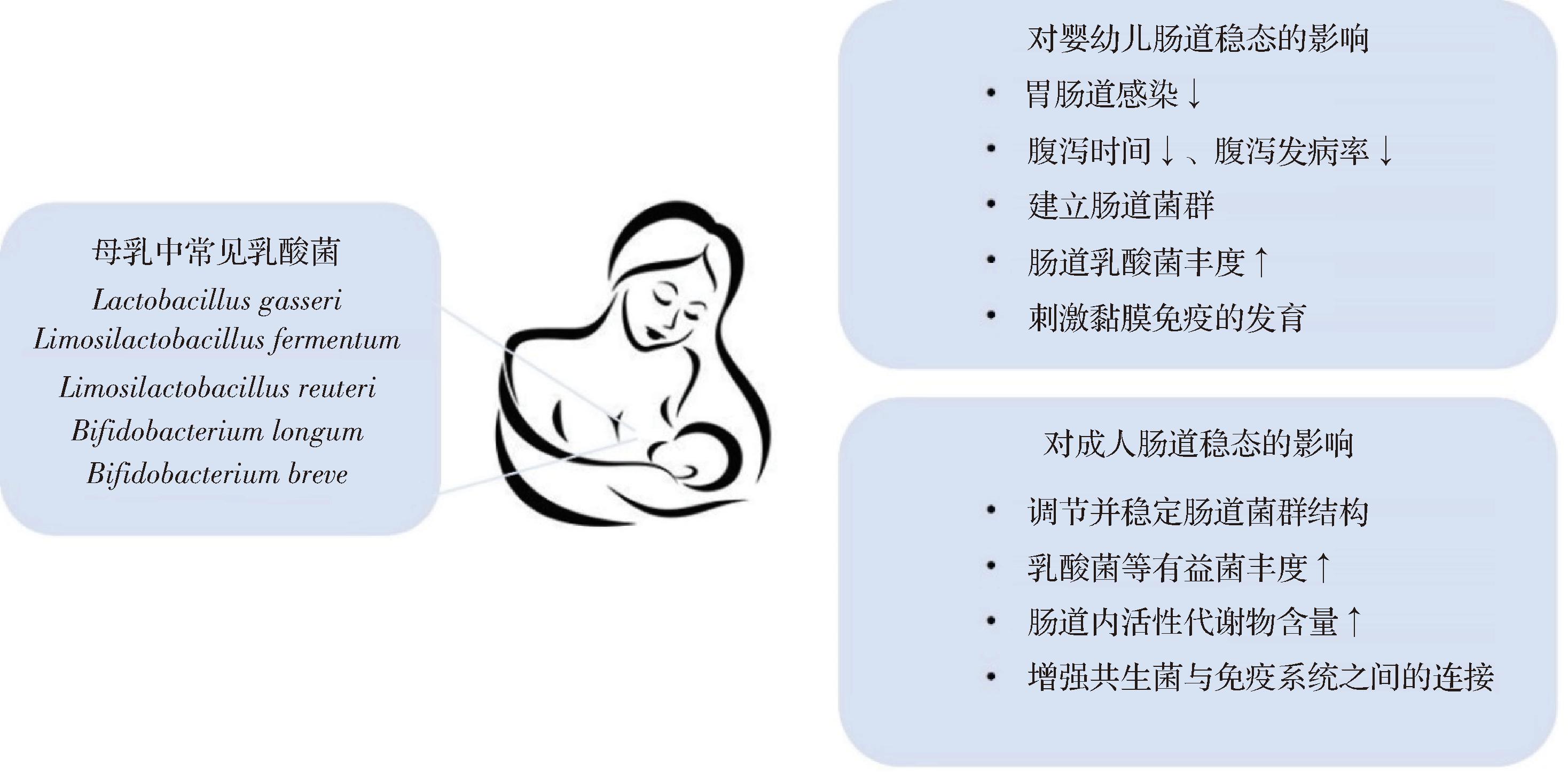
图1 母乳中常见乳酸菌种类及对肠道稳态的影响概述
Fig.1 An overview of common LAB species in breast milk and their effects on intestinal homeostasis
注:“↓”表示下降;“↑”表示上升。
3 母乳源乳酸菌的产业化应用现状
3.1 我国具有知识产权的母乳源乳酸菌
母乳作为一种新发现的筛选具有功能性乳酸菌的优质来源。自2000年西班牙科学家成功从母乳中分离并培养出具有益生功能的菌株开始,各科研机构对母乳源乳酸菌的研究从未中断[18,47]。经过长期的动物及临床实验研究,已分离得到众多具有益生功效的母乳源乳酸菌[34-35,51]。其中以发酵粘液乳杆菌CECT5716为代表,已投入商业化生产并成功转化成包括配方奶粉在内的多款产品,并于2016年经中国卫计委批准,母乳来源的CECT5716被列入《可用于婴幼儿食品菌种名单》。
我国拥有丰富的乳酸菌资源和悠久的使用历史,但菌种筛选起步较晚,缺乏对乳酸菌资源的系统性收集与开发,在乳品、发酵等产业上仍未打破依赖国外菌种的局面[53]。科汉森、杜邦和雀巢仍在益生菌市场上占据重要地位[53]。近年来,我国科研机构与企业已陆续开展母乳中益生乳酸菌的挖掘工作[54]。其中北京三元食品股份有限公司、澳优乳业(中国)有限公司、微康益生菌(苏州)股份有限公司、北京科拓恒通生物技术股份有限公司在国内具有较多的母乳源益生菌专利(表4)。在高校及科研院所中,目前公开以母乳为来源的乳酸菌种类较少,其中部分实现校企合作与成果转让(表4)。已申请专利的益生菌株中仍以植物乳植杆菌、罗伊氏粘液乳杆菌和格氏乳杆菌为主,但功能不局限于调节肠道菌群、缓解便秘及腹泻等胃肠道疾病,已逐渐延伸至抑制口腔致病菌、辅助治疗慢性疾病等方向。这为母乳源益生菌的开发与利用提供了新的思路。
表4 已申请专利的母乳源乳酸菌
Table 4 Patented breast milk-derived LAB

菌株功效申请单位植物乳植杆菌HMP2耐胆盐、对致病性大肠杆菌和/或金黄色葡萄球菌具有抑菌作用,具有安全性[55]罗伊氏粘液乳杆菌HMR28稳定高产叶酸[56]植物乳植杆菌P6黏附能力极强、对8种常见致病菌都具有抑制作用,抑菌性能好;并对8种抗生素表现敏感、有较强的耐酸和耐胆盐能力[57]格氏乳杆菌B1-26预防、缓解和/或治疗便秘的功能[58]北京三元食品股份有限公司植物乳植杆菌B5抑菌性能好、耐酸耐胆盐、良好的抗氧化活性与降血糖能力,且对多囊卵巢综合症患者与抑郁症患者具有一定的临床辅助治疗[59]桂林理工大学北京三元食品股份有限公司桂林医学院鼠李糖乳杆菌AUH2101具有良好的抑菌潜力、较低的潜在风险和良好的排镉功能[60]澳优乳业(中国)有限公司、中南大学短双歧杆菌grx05对大多数抗生素敏感,且还具有较好的耐胃酸和耐胆盐能力[61]澳优乳业(中国)有限公司动物双歧杆菌乳亚种BA79耐胃肠液能力和肠黏附能力、能够抑制食源性致病菌大肠杆菌、金黄色葡萄球菌、单增李斯特菌和屎肠球菌、既能够缓解慢传输型便秘也能够缓解出口梗阻型便秘[62]鼠李糖乳酪杆菌LRa66良好的耐胃酸能力、耐肠液能力和耐胆盐能力、显著改善高血糖和高血脂、降低甘油三酯、总胆固醇、低密度脂蛋白胆固醇,改善血清白细胞介素(in-terleukin, IL)10水平,并抑制了肿瘤坏死因子(tumor necrosis factor,TNF)α和IL-1β的生成[63]动物双歧杆菌乳亚种BLa80对大肠杆菌、沙门氏菌和金黄色葡萄球菌有很强的抑菌能力和共聚能力,对肠道上皮细胞具有较强的黏附能力,能够改善腹泻发生率和提升实验小鼠的肠道免疫力[64]动物双歧杆菌乳亚种BLa36有良好的耐胃酸能力,可以改善慢传输型便秘[62]微康益生菌(苏州)股份有限公司动物双歧杆菌乳亚种M8调节肠道菌群并能维持较高的活菌数[65]北京科拓恒通生物技术股份有限公司鼠李糖乳酪杆菌M9优异的胃肠液耐受性和良好的胆盐耐受性、有增强免疫抵抗作用、提高肠道菌群多样性、增加肠道菌群稳定性[66]内蒙古蒙牛乳业(集团)股份有限公司罗伊氏粘液乳杆菌FN041增强妊娠期或哺乳期女性,以及婴幼儿的免疫力,即增强黏膜屏障、促进肠道抗菌肽产生和IgA产生[67]湖南菲勒生物技术有限公司加氏乳杆菌BNR17抑制体重增加、耐酸性、胆汁酸抗性、肠吸收活性、对致病微生物的抗菌活性[68]株式会社百奥尼发酵粘液乳杆菌MSJK0025其具有较好的抗生素敏感性,且性状可稳定遗传;对酸、胆盐、人工胃/肠液耐受性较好、有较强的肠道定植能力,能有效抑制如大肠杆菌、金黄色葡萄球菌、鼠伤寒沙门氏菌和白色念珠菌等肠道内致病菌[69]浙江民生健康科技有限公司嗜热链球菌FUA329产尿石素A[70]江苏海洋大学戊糖片球菌HM75-1抑菌能力强,对肠道常见致病菌具有较强的抑制活性,对产肠毒素大肠埃希氏菌具有显著的抑制作用[71]石河子大学格式乳杆菌SHMB0001缓解急性结肠炎症状,减轻小鼠体重衰减及结肠缩短程度,保护肠黏膜屏障、上调肠道紧密连接蛋白表达等,具有一定的保护肠黏膜屏障功能[72]上海市儿童医院链球菌IMAU99161对伴放线放线杆菌和牙龈卟啉单胞杆菌都有明显的抑菌作用,在对伴放线放线杆菌和牙龈卟啉单胞杆菌引起的疾病(口腔疾病)的防治[73]内蒙古农业大学
3.2 市售产品
近年来为逐步摆脱国内益生菌市场对进口菌株的依赖,政府、科研机构与企业加速“产学研用一体化”进程,推进专利落地和成果转化[74]。在已实现产业化的母乳源乳酸菌中,因在母婴肠道健康与调节免疫方面具有良好优势,CECT5716为使用频率与商业化最多的菌株。近年来,蒙牛集团率先获得中国首株具有自主知识产权的母乳源活性益生菌M8并成功上市相关产品。国内多家企业相继开展相关菌株的产品转化工作,目前M8、BLa36、B1-26、BLa80已完成成果转化(表5)。但因相关法规限制,国内母乳源乳酸菌多被运用在普通食品中,如益生菌冻干粉、益生菌固体饮料及酸奶,针对特定人群产品较少,个性化微生态补充剂市场空白较大。
表5 已商品化的母乳源乳酸菌
Table 5 Commercialized LAB from breast milk
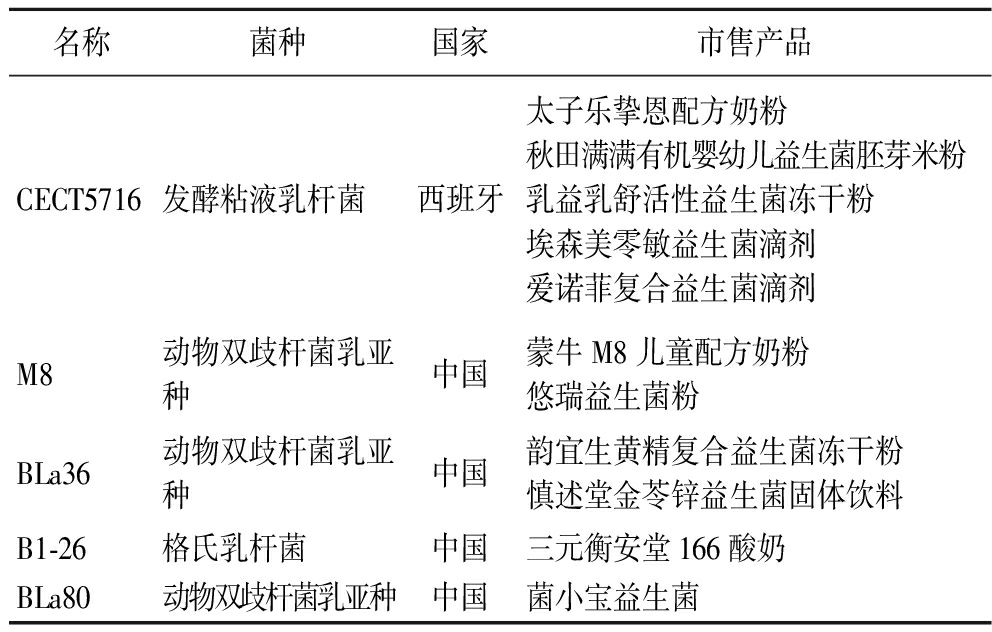
名称菌种国家市售产品CECT5716发酵粘液乳杆菌西班牙太子乐挚恩配方奶粉秋田满满有机婴幼儿益生菌胚芽米粉乳益乳舒活性益生菌冻干粉埃森美零敏益生菌滴剂爱诺菲复合益生菌滴剂M8动物双歧杆菌乳亚种中国蒙牛M8儿童配方奶粉悠瑞益生菌粉BLa36动物双歧杆菌乳亚种中国韵宜生黄精复合益生菌冻干粉慎述堂金苓锌益生菌固体饮料B1-26格氏乳杆菌中国三元衡安堂166酸奶BLa80动物双歧杆菌乳亚种中国菌小宝益生菌
4 结论与展望
随益生菌市场的发展和多组学技术的逐渐成熟,目前对母乳中乳酸菌种类、来源及功能的研究越发深入。但因取样方式和传统培养方法的限制,从母乳中分离得到的乳酸菌菌种和功效菌株十分有限。母乳源乳酸菌作为功能性益生菌的重要组成部分,在调节肠道健康和稳态方面具有天然优势。对于早期肠道环境,母乳源乳酸菌主要通过协助肠道菌群建立、激活各类免疫细胞等途径引导肠道免疫系统良性发育并形成稳态。对于成人,健康状态下摄入母乳源乳酸菌对肠道稳态影响不大。但当宿主肠道受不利因素影响时,乳酸菌可以通过稳定肠道菌群组成与结构、增强免疫应答等方式一定程度上削弱干扰。近年来各科研院校和企业已陆续开展母乳源乳酸菌的菌株筛选及功能开发。我国拥有自主知识产权的母乳源乳酸菌数目逐年增加,但专利转化效率低且无代表性菌株产生。因此亟需通过高通量分离筛选技术与系统分类学研究,逐步建立我国母乳微生态菌株资源库。同时高效利用体外益生性能评价、动物及临床循证研究,精准筛选符合国人肠道健康、维持肠道稳态的母乳源功能性菌株并针对不同人群开发其健康所需的微生态制剂。这将是未来乳酸菌产业高质量发展的首要条件和重点发展方向。
[1] CAI R, ZHOU C H, TANG R S, et al.Current insights on gut microbiome and chronic urticaria:Progress in the pathogenesis and opportunities for novel therapeutic approaches[J].Gut Microbes, 2024, 16(1):2382774.
[2] AZIZ Q, DORÉ J, EMMANUEL A, et al.Gut microbiota and gastrointestinal health:Current concepts and future directions[J].Neurogastroenterology &Motility, 2013, 25(1):4-15.
[3] GOU H Z, ZHANG Y L, REN L F, et al.How do intestinal probiotics restore the intestinal barrier?[J].Frontiers in Microbiology, 2022, 13:929346.
[4] LATIF A, SHEHZAD A, NIAZI S, et al.Probiotics:Mechanism of action, health benefits and their application in food industries[J].Frontiers in Microbiology, 2023, 14:1216674.
[5] 赵丽霞, 刘文俊.母乳中乳酸菌多样性及益生菌开发利用研究进展[J].食品与生物技术学报,2024, 43(4):25-34.
ZHAO L X, LIU W J.Research progress on diversity of lactic acid bacteria and probiotics exploitation in breast milk[J].Journal of Food Science and Biotechnology,2024, 43(4):25-34.
[6] 尹春媚. 母乳源乳酸菌的筛选、鉴定及其益生特性研究 [D].长春:吉林农业大学, 2020.
YIN C M.Screening, identification, and probiotic properties of lactic acid bacteria derived from breast milk [D].Changchun:Jilin Agricultural University, 2020.
[7] 董学艳, 姜铁民, 刘继超, 等.母乳中乳酸菌的研究进展[J].食品工业科技,2016, 37(19):391-395.
DONG X Y, JIANG T M, LIU J C, et al.Research progress in lactic acid bacteria in breast milk[J].Science and Technology of Food Industry, 2016, 37(19):391-395.
[8] 高盛, 乔宇, 张宇微, 等.人母乳源乳酸菌的筛选、鉴定及益生活性的初步研究[J].食品工业科技, 2017, 38(10):205-210.
GAO S, QIAO Y, ZHANG Y W, et al.Isolation, identification and probiotic characterization of lactic acid bacteria in human breast milk[J].Science and Technology of Food Industry, 2017, 38(10):205-210.
[9] 李双祁. 母乳来源益生菌的筛选和益生作用研究 [D].广州:广东工业大学, 2022.
LI S Q.Study on the screening and probiotic effect of human milk derived probiotics [D].Guangzhou:Guangdong University of Technology, 2022.
[10] 胡鹏钰, 于俊娟, 王鹏, 等.母乳来源益生菌的筛选及潜在益生特性研究[J].食品与发酵工业, 2021, 47(14):190-195.
HU P Y, YU J J, WANG P, et al.Screening of probiotics from breast milk and its potential probiotic characteristics[J].Food and Fermentation Industries, 2021, 47(14):190-195.
[11] 国笑情, 武岳, 李瑜, 等.新疆地区母乳中乳酸菌的分离鉴定及潜在益生菌的筛选[J].食品与发酵工业, 2023, 49(18):275-281.
GUO X Q, WU Y, LI Y, et al.Isolation and identification of lactic acid bacteria from breast milk in Xinjiang and screening of potential probiotics[J].Food and Fermentation Industries, 2023, 49(18):275-281.
[12] 丁梦帆. 母乳菌群构成及优势乳酸菌影响幼鼠肠黏膜免疫研究 [D].无锡:江南大学, 2019.
DING M F.Composition of human milk microbiota and influence of dominant lactic acid bacteria on intestinal mucosal immunity in young rats [D].Wuxi:Jiangnan University, 2019.
[13] MART N R, JIMÉNEZ E, HEILIG H, et al.Isolation of bifidobacteria from breast milk and assessment of the bifidobacterial population by PCR-denaturing gradient gel electrophoresis and quantitative real-time PCR[J].Applied and Environmental Microbiology, 2009, 75(4):965-969.
N R, JIMÉNEZ E, HEILIG H, et al.Isolation of bifidobacteria from breast milk and assessment of the bifidobacterial population by PCR-denaturing gradient gel electrophoresis and quantitative real-time PCR[J].Applied and Environmental Microbiology, 2009, 75(4):965-969.
[14] 韩菲. 母乳中乳酸菌的分离鉴定及链球菌属新种的多相分类学研究 [D].呼和浩特:内蒙古农业大学, 2022.
HAN F.Isolation and identification of lactic acid bacteria from human milk and polyphase taxonomic study of new species of Streptococcus [D].Hohhot:Inner Mongolia Agricultural University, 2022.
[15] KIM K J, KYUNG S, JIN H, et al.Lactic acid bacteria isolated from human breast milk improve colitis induced by 2,4,6-trinitrobenzene sulfonic acid by inhibiting NF-κB signaling in mice[J].Journal of Microbiology and Biotechnology, 2023, 33(8):1057-1065.
[16] LATUGA M S, STUEBE A, SEED P C.A review of the source and function of microbiota in breast milk[J].Seminars in Reproductive Medicine, 2014, 32(1):68-73.
[17] YANG L, SAKANDAR H A, SUN Z H, et al.Recent advances of intestinal microbiota transmission from mother to infant[J].Journal of Functional Foods, 2021, 87:104719.
[18] LYONS K E, RYAN C A, DEMPSEY E M, et al.Breast milk, a source of beneficial microbes and associated benefits for infant health[J].Nutrients, 2020, 12(4):1039.
[19] FRAGA M, PERELMUTER K, DELUCCHI L, et al.Vaginal lactic acid bacteria in the mare:Evaluation of the probiotic potential of native Lactobacillus spp.and Enterococcus spp.strains[J].Antonie Van Leeuwenhoek, 2008, 93(1):71-78.
[20] SHAZADI K, ARSHAD N.Evaluation of inhibitory and probiotic properties of lactic acid bacteria isolated from vaginal microflora[J].Folia Microbiologica, 2022, 67(3):427-445.
[21] 林永创, 李依米, 吴璐璐, 等.正常顺产婴儿出生6月内肠道菌群的发育特征[J].暨南大学学报(自然科学与医学版), 2022, 43(1):43-52.
LIN Y C, LI Y M, WU L L, et al.The development characteristics of intestinal flora of healthy infant within 6 months after vaginal delivery[J].Journal of Jinan University (Natural Science &Medicine Edition), 2022, 43(1):43-52.
[22] MASTROMARINO P, CAPOBIANCO D, MICCHELI A, et al.Administration of a multistrain probiotic product (VSL#3) to women in the perinatal period differentially affects breast milk beneficial microbiota in relation to mode of delivery[J].Pharmacological Research, 2015, 95-96:63-70.
[23] BI C L, ZHANG S J, SHEN Y Z, et al.Selenium plays an anti-inflammatory role by regulation NLRP3 inflammasome in Staphylococcus aureus-infected mouse mammary gland[J].Biological Trace Element Research, 2021, 199(2):604-610.
[24] CHEN X, LI P, LIU M, et al.Gut dysbiosis induces the development of pre-eclampsia through bacterial translocation[J].Gut, 2020, 69(3):513-522.
[25] STINSON L F, SINDI A S M, CHEEMA A S, et al.The human milk microbiome:Who, what, when, where, why, and how?[J].Nutrition Reviews, 2021, 79(5):529-543.
[26] PEREZ P F, DORÉ J, LECLERC M, et al.Bacterial imprinting of the neonatal immune system:Lessons from maternal cells?[J].Pediatrics, 2007, 119(3):E724-E732.
[27] PANNARAJ P S, LI F, CERINI C, et al.Association between breast milk bacterial communities and establishment and development of the infant gut microbiome[J].JAMA Pediatrics, 2017, 171(7):647-654.
[28] NYANGAHU D D, JASPAN H B.Influence of maternal microbiota during pregnancy on infant immunity[J].Clinical and Experimental Immunology, 2019, 198(1):47-56.
[29] SARKAR A, YOO J Y, VALERIA OZORIO DUTRA S, et al.The association between early-life gut microbiota and long-term health and diseases[J].Journal of Clinical Medicine, 2021, 10(3):459.
[30] LI Y P, REN L, WANG Y Y, et al.The effect of breast milk microbiota on the composition of infant gut microbiota:A cohort study[J].Nutrients, 2022, 14(24):5397.
[31] ARRIETA M C, STIEMSMA L T, AMENYOGBE N, et al.The intestinal microbiome in early life:Health and disease[J].Frontiers in Immunology, 2014, 5:427.
[32] QI C, DING M F, LI S Q, et al.Sex-dependent modulation of immune development in mice by secretory IgA-coated Lactobacillus reuteri isolated from breast milk[J].Journal of Dairy Science, 2021, 104(4):3863-3875.
[33] YU R Q, MA Y Z, LUO Z C, et al.Maternal supplementation with Limosilactobacillus reuteri FN041 for preventing infants with atopic dermatitis:Study protocol for a randomized controlled trial[J].Frontiers in Microbiology, 2023, 14:1267448.
[34] ZHOU J B, XU G S, LI X Y, et al.Limosilactobacillus reuteri FN041 prevents atopic dermatitis in pup mice by remodeling the ileal microbiota and regulating gene expression in Peyer’s patches after vertical transmission[J].Frontiers in Nutrition, 2022, 9:987400.
[35] PASTOR-VILLAESCUSA B, HURTADO J A, GIL-CAMPOS M, et al.Effects of Lactobacillus fermentum CECT5716 Lc40 on infant growth and health:A randomised clinical trial in nursing women[J].Beneficial Microbes, 2020, 11(3):235-244.
[36] MALDONADO-LOB N J A, GIL-CAMPOS M, MALDONADO J, et al.Long-term safety of early consumption of Lactobacillus fermentum CECT5716:A 3-year follow-up of a randomized controlled trial[J].Pharmacological Research, 2015, 95-96:12-19.
N J A, GIL-CAMPOS M, MALDONADO J, et al.Long-term safety of early consumption of Lactobacillus fermentum CECT5716:A 3-year follow-up of a randomized controlled trial[J].Pharmacological Research, 2015, 95-96:12-19.
[37] MALDONADO J, CA ABATE F, SEMPERE L, et al.Human milk probiotic Lactobacillus fermentum CECT5716 reduces the incidence of gastrointestinal and upper respiratory tract infections in infants[J].Journal of Pediatric Gastroenterology and Nutrition, 2012, 54(1):55-61.
ABATE F, SEMPERE L, et al.Human milk probiotic Lactobacillus fermentum CECT5716 reduces the incidence of gastrointestinal and upper respiratory tract infections in infants[J].Journal of Pediatric Gastroenterology and Nutrition, 2012, 54(1):55-61.
[38] MALDONADO J, GIL-CAMPOS M, MALDONADO-LOB N J A, et al.Evaluation of the safety, tolerance and efficacy of 1-year consumption of infant formula supplemented with Lactobacillus fermentum CECT5716 Lc40 or Bifidobacterium breve CECT7263:A randomized controlled trial[J].BMC Pediatrics, 2019, 19(1):361.
N J A, et al.Evaluation of the safety, tolerance and efficacy of 1-year consumption of infant formula supplemented with Lactobacillus fermentum CECT5716 Lc40 or Bifidobacterium breve CECT7263:A randomized controlled trial[J].BMC Pediatrics, 2019, 19(1):361.
[39] LARA-VILLOSLADA F, SIERRA S, BOZA J, et al.Beneficial effects of consumption of a dairy product containing two probiotic strains, Lactobacillus coryniformis CECT5711 and Lactobacillus gasseri CECT5714 in healthy children[J].Nutricion Hospitalaria, 2007, 22(4):496-502.
[40] MART NEZ-CA
NEZ-CA AVATE A, SIERRA S, LARA-VILLOSLADA F, et al.A probiotic dairy product containing L.gasseri CECT5714 and L.coryniformis CECT5711 induces immunological changes in children suffering from allergy[J].Pediatric Allergy and Immunology, 2009, 20(6):592-600.
AVATE A, SIERRA S, LARA-VILLOSLADA F, et al.A probiotic dairy product containing L.gasseri CECT5714 and L.coryniformis CECT5711 induces immunological changes in children suffering from allergy[J].Pediatric Allergy and Immunology, 2009, 20(6):592-600.
[41] JANDHYALA S M, TALUKDAR R, SUBRAMANYAM C, et al.Role of the normal gut microbiota[J].World Journal of Gastroenterology, 2015, 21(29):8787-8803.
[42] LUBIN J B, GREEN J, MADDUX S, et al.Arresting microbiome development limits immune system maturation and resistance to infection in mice[J].Cell Host &Microbe, 2023, 31(4):554-570.e7.
[43] LIU Y, WANG J Q, WU C X.Modulation of gut microbiota and immune system by probiotics, pre-biotics, and post-biotics[J].Frontiers in Nutrition, 2022, 8:634897.
[44] BADAL V D, VACCARIELLO E D, MURRAY E R, et al.The gut microbiome, aging, and longevity:A systematic review[J].Nutrients, 2020, 12(12):3759.
[45] LIU A L, MA T, XU N, et al.Adjunctive probiotics alleviates asthmatic symptoms via modulating the gut microbiome and serum metabolome[J].Microbiology Spectrum, 2021, 9(2):e0085921.
[46] OLIVARES M, D AZ-ROPERO M P, G
AZ-ROPERO M P, G MEZ N, et al.Oral administration of two probiotic strains, Lactobacillus gasseri CECT5714 and Lactobacillus coryniformis CECT5711, enhances the intestinal function of healthy adults[J].International Journal of Food Microbiology, 2006, 107(2):104-111.
MEZ N, et al.Oral administration of two probiotic strains, Lactobacillus gasseri CECT5714 and Lactobacillus coryniformis CECT5711, enhances the intestinal function of healthy adults[J].International Journal of Food Microbiology, 2006, 107(2):104-111.
[47] ZHENG Y, YU Z J, ZHANG W Y, et al.Lactobacillus rhamnosus probio-M9 improves the quality of life in stressed adults by gut microbiota[J].Foods, 2021, 10(10):2384.
[48] ZHANG M, ZHENG Y, SUN Z, et al.Change in the gut microbiome and immunity by Lacticaseibacillus rhamnosus probio-M9[J].Microbiology Spectrum, 2023, 11(2):e0360922.
[49] MALDONADO J, LARA-VILLOSLADA F, SIERRA S, et al.Safety and tolerance of the human milk probiotic strain Lactobacillus salivarius CECT5713 in 6-month-old children[J].Nutrition, 2010, 26(11-12):1082-1087.
[50] SIERRA S, LARA-VILLOSLADA F, SEMPERE L, et al.Intestinal and immunological effects of daily oral administration of Lactobacillus salivarius CECT5713 to healthy adults[J].Anaerobe, 2010, 16(3):195-200.
[51] LI Y L, SHI X, MA T, et al.Bifidobacterium lactis Probio-M8 relieved acute respiratory tract infections in children possibly by modulating the gut microbes and metabolites[J].Journal of Functional Foods, 2024, 115:106111.
[52] ZHAO F Y, GUO Z G, KWOK L Y, et al.Bifidobacterium lactis Probio-M8 improves bone metabolism in patients with postmenopausal osteoporosis, possibly by modulating the gut microbiota[J].European Journal of Nutrition, 2023, 62(2):965-976.
[53] 陈卫. iLABdb数据库:乳酸菌研究和产业开发的里程碑[J].科学通报,2024, 69(3):327-329.
CHEN W.iLABdb:A milestone database for lactic acid bacteria research and industrial development[J].Chinese Science Bulletin, 2024, 69(3):327-329.
[54] 张和平, 高广琦.基于人工智能的益生乳酸菌精准筛选及产业化关键技术[J].中国食品学报,2023, 23(6):1-7.
ZHANG H P, GAO G Q.The key technologies of precise isolation and industrialization of probiotic lactic acid bacteria based on artificial intelligence[J].Journal of Chinese Institute Food Science and Technology, 2023, 23(6):1-7.
[55] 陈历俊, 刘璐, 赵军英, 等.一种母乳源植物乳杆菌HM-P2及其应用:CN115491329A[P].北京, 2023-06-16.
CHEN L J, LIU L, ZHAO J Y, et al.Breast milk-derived Lactiplantibacillus plantarum HM-P2 and its application:CN115491329A[P].Beijing, 2023-06-16.
[56] 陈历俊, 季亚栋, 李先平, 等.一株罗伊氏乳杆菌及其应用:CN202211014259.2[P].北京, 2024-04-09.
CHEN L J, JI Y D, LI X P, et al.A strain of Lactobacillus reuteri and its application:CN202211014259.2[P].Beijing, 2024-04-09.
[57] 陈历俊, 刘璐, 尹春媚, 等.一种母乳源植物乳杆菌及其应用:CN202010535484.5[P].北京, 2021-12-14.
CHEN L J, LIU L, YIN C M, et al.A breast milk-derived Lactiplantibacillus plantarum and its application:CN202010535484.5[P].Beijing, 2021-12-14.
[58] 陈历俊, 刘璐, 李先平, 等.格氏乳杆菌B1-26及其应用:CN202311695608.6[P].北京, 2024-01-12.
CHEN L J, LIU L, LI X P, et al.Lactobacillus gasseri B1-26 and its application:CN202311695608.6[P].Beijing, 2024-01-12.
[59] 姜铁民, 陈历俊, 宋家乐, 等.一株具有改善多囊卵巢综合征激素和神经递质水平的植物乳植杆菌B5及其应用:CN202311386417.1[P].广西壮族自治区, 2024-03-08.
JIANG T M, CHEN L J, SONG J L, et al.Lactiplantibacillus plantarum B5 capable of improving hormone and neurotransmitter levels in polycystic ovary syndrome and its application:CN202311386417.1[P].Guangxi Zhuang Autonomous Region, 2024-03-08.
[60] 康文丽, 汪家琦, 周洪波,等.一种母乳源鼠李糖乳杆菌及其应用:CN202110486399.9[P].湖南,2022-03-18.
KANG W L, WANG J Q, ZHOU H B, et al.A breast milk-derived Lactobacillus rhamnosus and its application:CN202110486399.9 [P].Hunan, 2022-03-18.
[61] 汪家琦, 顾瑞霞, 潘丽娜, 等.一株短双歧杆菌及其培养方法和用途:CN202110171608.0[P].湖南,2022-07-12.
WANG J Q, GU R X, PAN L N, et al.A strain of Bifidobacterium breve and its culture method and use:CN202110171608.0[P].Hunan, 2022-07-12.
[62] 方曙光, 董瑶, 盖忠辉, 等.一种改善便秘的动物双歧杆菌乳亚种BLa36及其培养方法与应用:CN202210261807.5[P].江苏,2022-05-27.
FANG S G, DONG Y, GAI Z H, et al.Bifidobacterium animalis lactis subspecies lactis BLa36 for improving constipation and its culture method and application:CN202210261807.5[P].Jiangsu, 2022-05-27.
[63] 方曙光, 顾佳悦, 陈婷, 等.一种具有降血糖和降血脂功能的鼠李糖乳酪杆菌LRa66及其应用:CN202310481728.X[P].江苏,2024-06-07.
FANG S G, GU J Y, CHEN T, et al. Lactobacillus rhamnosus LRa66 with hypoglycemic and hypolipidemic functions and its application:CN202310481728.X[P].Jiangsu, 2024-06-07.
[64] 方曙光, 朱明明, 刘欢, 等.乳双歧杆菌BLa80在缓解腹泻和提升肠道免疫能力中的应用:CN202110978637.8[P].江苏,2022-11-22.
FANG S G, ZHU M M, LIU H, et al.Bifidobacterium lactis BLa80 for relieving diarrhea and enhancing intestinal immunity:CN202110978637.8 [P].Jiangsu, 2022-11-22.
[65] 马杰, 张凌宇, 杨慧娟, 等.一株分离自母乳的乳双歧杆菌M8及其应用:CN201910495537.2[P].北京,2021-05-28.
MA J, ZHANG L Y, YANG H J, et al.Bifidobacterium lactis M8 isolated from breast milk and its application:CN201910495537.2 [P].Beijing, 2021-05-28.
[66] 张凌宇, 马晨, 马杰, 等.一株分离自母乳的鼠李糖乳杆菌M9及其应用:CN201910453691.3[P].北京,2021-07-06.
ZHANG L Y, MA C, MA J, et al.Lactobacillus rhamnosus M9 isolated from breast milk and its application:CN201910453691.3[P].Beijing, 2021-07-06.
[67] 孙进, 李双祁, 齐策.一株母乳来源罗伊氏乳杆菌调节母婴免疫功能的应用:CN202010076261.7[P].湖南,2021-06-22.
SUN J, LI S Q, QI C.Application of a Lactobacillus reuteri strain derived from breast milk in regulating maternal-infant immune function:CN202010076261.7[P].Hunan, 2021-06-22.
[68] 姜智姬, 庾炳一, 尹成一, 等.分离自母乳的具有益生菌活性和抑制体重增加活性的乳酸菌:CN200780029113.2[P].韩国,2013-03-13.
JIANG Z J, YU B Y, YIN C Y, et al.Lactic acid bacteria isolated from breast milk with probiotic activity and activity to inhibit weight gain:CN200780029113.2[P].South Korea, 2013-03-13.
[69] 杨善岩, 冯锋将, 李雪龙, 等.可调节肠道菌群的母乳源发酵粘液乳杆菌MSJK0025及其应用:CN202311070808.2[P].浙江,2024-06-11.
YANG S Y, FENG F J, LI X L, et al.Breast milk-derived mucous lactobacillus fermentum MSJK0025 capable of regulating intestinal flora and its application:CN202311070808.2[P].Zhejiang, 2024-06-11.
[70] 房耀维, 刘姝, 杨光, 等.嗜热链球菌FUA329及其发酵生产尿石素A的方法:CN202211224627.6[P].江苏,2024-04-02.
FANG Y W, LIU S, YANG G, et al.Thermophilic Streptococcus FUA329 and its method for fermenting and producing urolithin A:CN202211224627.6[P].Jiangsu, 2024-04-02.
[71] 张艳, 倪永清, 王艺璇, 等.一种母乳源戊糖片球菌及其应用:CN202010812849.4[P].新疆维吾尔自治区,2022-05-20.
ZHANG Y, NI Y Q, WANG Y X, et al.A breast milk-derived Pediococcus pentosaceus and its application:CN202010812849.4 [P].Xinjiang Uygur Autonomous Region, 2022-05-20.
[72] 张婷, 王怡仲, 王续霏, 等.格氏乳杆菌SHMB 0001及其在预防和缓解急性结肠炎中的应用:CN202311109675.5[P].上海,2024-07-30.
ZHANG T, WANG Y Z, WANG X F, et al.Lactobacillus gasseri SHMB 0001 and its application in preventing and alleviating acute colitis:CN202311109675.5 [P].Shanghai, 2024-07-30.
[73] 钟智, 刘文俊, 郭丽如, 等.一株新的链球菌及其制剂在抑制口腔致病菌中的应用:CN202010500826.X[P].内蒙古自治区,2022-02-15.
ZHONG Z, LIU W J, GUO L R, et al.A new strain of Streptococcus and its preparation for inhibiting oral pathogenic bacteria:CN202010500826.X [P].Inner Mongolia Autonomous Region, 2022-02-15.
[74] 国务院办公厅关于印发《专利转化运用专项行动方案(2023—2025年)》的通知[J].中华人民共和国国务院公报, 2023 (31):16-19.
Circular of The General Office of the State Council on issuing and issuing the Special Action Plan for Patent Transformation and Utilization (2023—2025) [J].Bulletin of The State Council of the People’s Republic of China, 2023(31):16-19.