蚝油是广东和港、澳地区一种常见的水产调味品,它是以素有“海底牛奶”之称的牡蛎为原料,煮熟取汁再加入水、食用盐、白砂糖、淀粉等原料,同时辅以其他风味调料或食品添加剂调制而成的调味品[1]。蚝油因其独特的风味和丰富的营养深受消费者的喜爱[2],但在人们的使用过程中,时常会因为保存不当而出现发霉长毛情况,因此有必要明确蚝油变质过程,通过清晰变质蚝油的指标对其进行品质监控,以此促进蚝油产业的发展。
新鲜的蚝油形态颜色应极具食欲,同时带有蚝特有的香味,但是往往变质蚝油颜色会发生改变同时表面变得湿淋淋,并伴有一股难以描述的味道,尤其是放置过久后蚝油表面会出现“绿毛”的现象。目前国内外对于蚝油的研究大多数集中在其挥发性成分上[3],主要用于质量评定[4]、评价[5-7]以及分类[8],关于蚝油品质变化的研究目前多停留在蚝油体系的稳定性上[9-10],而蚝油品质劣变方面还尚未被报道。因此,为进一步探讨这种品质变化的规律,本实验将对5款不同的蚝油产品进行定向污染,记录孢子在蚝油表面的生长情况,同时测定变质前后蚝油的相关指标,对比其变化的规律,得出蚝油变质的界定依据,为成品蚝油的变质提供理论依据与参考。
1 材料与方法
1.1 材料与试剂
蚝油均购于华润万家市场,详细信息如表1所示。
表1 蚝油样品基本信息
Table 1 Oyster sample basic information

蚝油样品原辅料盐度(质量分数)/%水分(质量分数)/%贮藏条件产地A蚝汁(蚝、水、食用盐)、水、酿造酱油、白砂糖、食用盐、淀粉、小麦粉、酵母抽提物12.6652.54常温存放,开启后4 ℃冷藏广东佛山B蚝汁(蚝、水、食用盐)、水、白砂糖、食用盐、羟丙基二淀粉磷酸酯、谷氨酸钠、小麦粉、焦糖色13.4952.56常温存放,开启后4 ℃冷藏广东佛山C蚝汁(蚝、水、食用盐)、酿造酱油、水、白砂糖、淀粉、食用盐12.9553.98常温存放,开启后4 ℃冷藏四川眉山D蚝汁(蚝、水、食用盐)、水、白砂糖、食用盐、羟丙基二淀粉磷酸酯、谷氨酸钠、小麦粉、焦糖色13.8852.93常温存放,开启后4 ℃冷藏广东江门E蚝汁(蚝、水、食用盐)、白砂糖、酿造酱油、食用盐、淀粉、干贝粉、小麦粉、松茸14.1851.51常温存放,开启后4 ℃冷藏山东烟台
PDA,北京奥博星生物技术有限责任公司;硫酸铜,天津市百世化工有限公司;硼酸,阿拉丁试剂有限公司;盐酸、硫酸、氢氧化钠,广东广试试剂科技有限公司;甲基红、溴甲酚绿,天津市科密欧化学试剂有限公司;硫酸钾、氧化镁、乙酸锌、亚甲基蓝三水合物、酒石酸钾钠四水合物、亚铁氰化钾水合物、甲基橙,上海麦克林生化科技股份有限公司;酚酞,上海源叶生物科技有限公司;三氯乙酸、95%乙醇、无水乙醇,天津市汇航化工;75%酒精消毒液,山东利尔康医疗科技股份有限公司;氢氧化钠滴定溶液标准物质、盐酸滴定溶液标准物质,上海安谱实验科技股份有限公司;总蛋白酶试剂盒,苏州格锐思生物科技有限公司;α-淀粉酶活性检测试剂盒,北京索莱宝科技有限公司。
1.2 仪器与设备
生化培养箱、鼓风干燥箱,上海一恒科学仪器有限公司;新华牌SLS-M型立式灭菌器,山东新华医疗器械股份有限公司;H1750R高速台式冷冻离心机,湖南湘仪实验室仪器开发有限公司;光学显微镜、PTX-FA11OS分析天平,华志(福建)电子科技有限公司;FE28 pH计,梅特勒-托利多仪器(上海)有限公司;K1100全自动凯氏定氮仪,山东海能科学仪器有限公司;KDN-19A定氮仪,上海纤检仪器有限公司;DZF型真空干燥箱、HSP-460BE恒温恒湿培养箱,上海力辰邦西仪器科技有限公司;JJ500型电子天平,常熟市双杰测试仪器厂;TWS-26型电热恒温水浴锅,上海喆图科学仪器有限公司;SB25-12DT超声波清洗机,宁波新芝生物科技股份有限公司;Vortex 2涡旋混合器,艾卡(广州)仪器设备有限公司;SH220F石墨消解仪,山东海能科学仪器有限公司;916 Ti-Touch电位滴定仪,瑞士万通中国涌现公司;SUNRISE吸光酶标仪,德国TECAN公司。
1.3 实验方法
1.3.1 变质蚝油中微生物的分离纯化、致腐性验证及鉴定
变质蚝油样品是新鲜蚝油开盖后置于常温(26~30 ℃)条件下保存3个月,期间每2 d开1次瓶盖,每次开盖时间10 s。
微生物的分离纯化参考李锦绍[11]的方法。在无菌条件下,用一次性接种环挑取变质蚝油瓶口的菌丝放入事先准备好的PDA培养基上,置于28 ℃、湿度为90%的培养箱中培养,每天观察,长出菌落后将其转移至新制备的PDA培养基中进行培养,多次分离培养后得到纯化菌株,命名为LM。
污染实验和致腐性实验参考唐鑫等[12]的方法。取LM单菌落PDA培养基,在无菌条件下,用PBS溶液将培养基上的黄色孢子冲至灭菌好并装有玻璃珠的容器中,置于摇床中振荡1 min,得到粗悬液。然后用灭菌后的纱布过滤,得到孢子悬液,调整孢子液浓度为1×106 CFU/mL,4 ℃冷藏备用。将调好浓度的孢子菌悬液(接种量为1%)接种到盛有20 g新鲜蚝油的培养皿中,该组为处理组,对照组接入相同量的无菌PBS溶液,2组同时置于28 ℃、湿度为90%的培养箱中进行培养,期间观察并记录培养皿表面情况。待培养皿中长出霉菌后通过划线法从处理组蚝油中分离出霉菌,然后纯化和培养,根据形态学和培养特征进行鉴定,确定是否与接种菌株LM一致,根据实验结果确定该腐败菌。
微生物的形态结构观察和基因测序参考周祎炜等[13]的方法。将纯化后菌株以三点法接种于PDA培养基中,于28 ℃恒温恒湿培养箱中培养数日,期间每隔2 d观察、记录菌落的生长状况,并通过光学显微镜对菌丝及分生孢子进行形态学观察。系统发育进化树的构建采用邻接法,选择全部位点构建系统树,自展值(Bootstrap)1 000次检验。
1.3.2 蚝油样品的制备及观察
在无菌环境下,每款蚝油各称取20 g倒入无菌培养皿中,使用配制好的孢子菌悬液(接种量为1%)接种5款蚝油,然后在温度为28 ℃、湿度为90%的培养箱中进行培养,期间每天用肉眼和显微镜观察蚝油表面微生物的生长情况并记录,明确该菌在蚝油中的生长阶段。由于霉菌在适宜条件下生长较为迅速且很难确定其具体变质时段,所以将开启后4 ℃冷藏的蚝油视为未变质蚝油,经历霉菌一个生长周期的蚝油视为变质蚝油。
1.3.3 理化指标及酶活力的测定
水分测定参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》;蛋白质含量测定参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》;挥发性盐基氮含量测定参考GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》;总酸含量测定(以乳酸计)遵循GB 12456—2021《食品安全国家标准 食品中总酸的测定》中酸碱指示剂滴定法;氨基酸态氮含量测定遵循GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》;蔗糖和还原糖含量测定遵循GB/T 5009.8—2016《食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定的测定》中酸水解-莱因-埃农氏法;淀粉酶活力和总蛋白酶活力用试剂盒检测。
1.4 数据处理与分析
采用IBM SPSS Statistics 27软件进行数据分析,选择单因素方差分析中的邓肯模型,P<0.05表示数据间有显著性差异,采用Excel 2016和Origin 2021进行数据统计和图表制作。
2 结果与分析
2.1 微生物的鉴定结果
2.1.1 微生物分离及致腐性测定结果
对从变质蚝油中分离得到的纯化菌株LM进行致腐性测试,利用柯赫氏法则验证。结果如图1所示,接种孢子悬液6 d后,处理组的蚝油表面已呈现明显的深青绿色,细看有明显的孢子,而对照组未出现。处理组蚝油表面菌落颜色、形态等与常温放置3个月的蚝油瓶口菌落形态特征一致,见图1-a和图1-c。从处理组蚝油中重新分理出霉菌,并根据形态学和分子生物学进行验证,表明与原接种菌株LM一致。
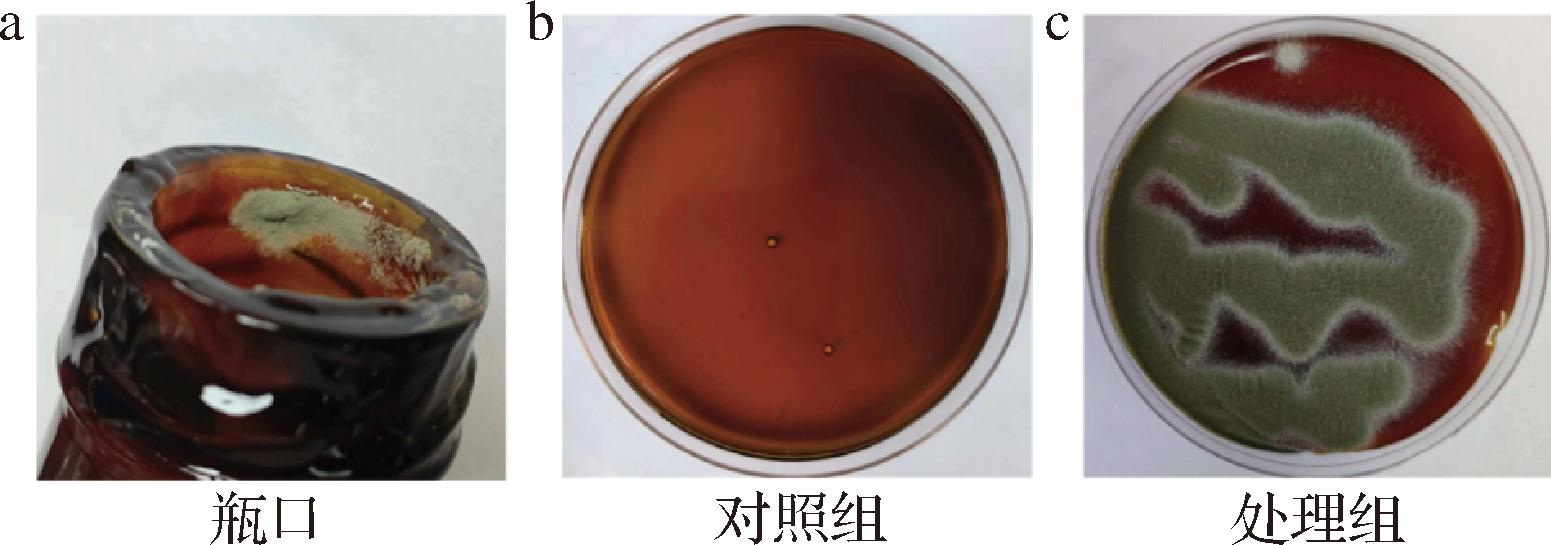
a-变质蚝油瓶口菌落图示;b-对照组蚝油接种孢子菌悬液6 d后表面菌落形态;c-处理组蚝油接种孢子菌悬液6 d后表面菌落形态
图1 LM菌株分离过程及致腐性验证
Fig.1 Isolation process of LM strain and verification of putrefactive properties
2.1.2 菌落形态结构特征
将纯化菌株LM接种到PDA培养基在28 ℃下培养数日,每隔2 d拍照记录1次,一共10 d,结果如图2所示。10 d中,前4 d菌落表面较为光滑,形态为同心圆,正面颜色整体为青绿色,中央为淡黄色,边缘为白色,反面边缘为浅白色,中央为棕黄色;第4~10天,菌落表面有明显的颗粒感,且随着培养时间的延长,中央黄色范围逐渐增大,形状开始变得不规则,正面整体颜色为黄色,从里到外颜色依次为黄色、深青绿色和白偏淡黄色,反面整体为棕黄色,中央到边缘逐渐变浅。通过菌落形态特征将LM初步鉴定为曲霉属真菌。
2.1.3 显微镜形态结构特征
菌株在光学显微镜下的形态特征如图3所示。LM菌株具有丰富的透明有隔菌丝,分生孢子梗由足细胞上垂直生出,顶端出现形态呈球形或椭圆形子囊孢子,状如“菊花”。子囊果相互缠绕,并伴生在菌丝间。随着菌株的生长发育,子囊孢子上的孢子脱落,分散在孢子头周围。结合菌落形态与光学显微镜结果可知LM菌株为曲霉属真菌。
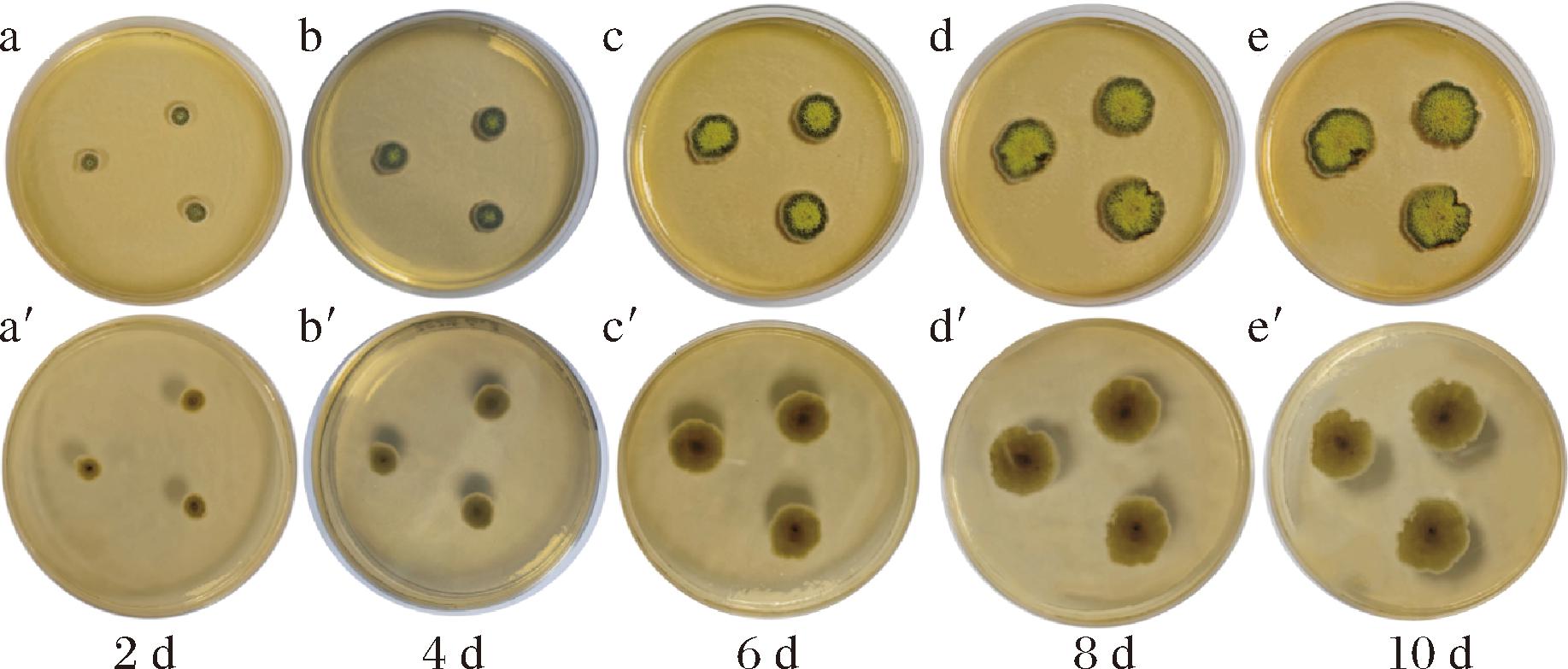
a~e-依次为LM菌培养第2、4、6、8和10天的正面;a′~e′-依次为LM菌培养第2、4、6、8和10天的反面
图2 LM菌株的菌落形态
Fig.2 Colony morphology of the LM strain

a-10 d、200×;b-10 d、400×
图3 LM在显微镜下的形态特征
Fig.3 Morphological features of LM under the microscope
2.1.4 内转录间隔序列比对结果与系统发育树
LM菌株ITS PCR扩增电泳分析及系统发育树如图4、图5所示。
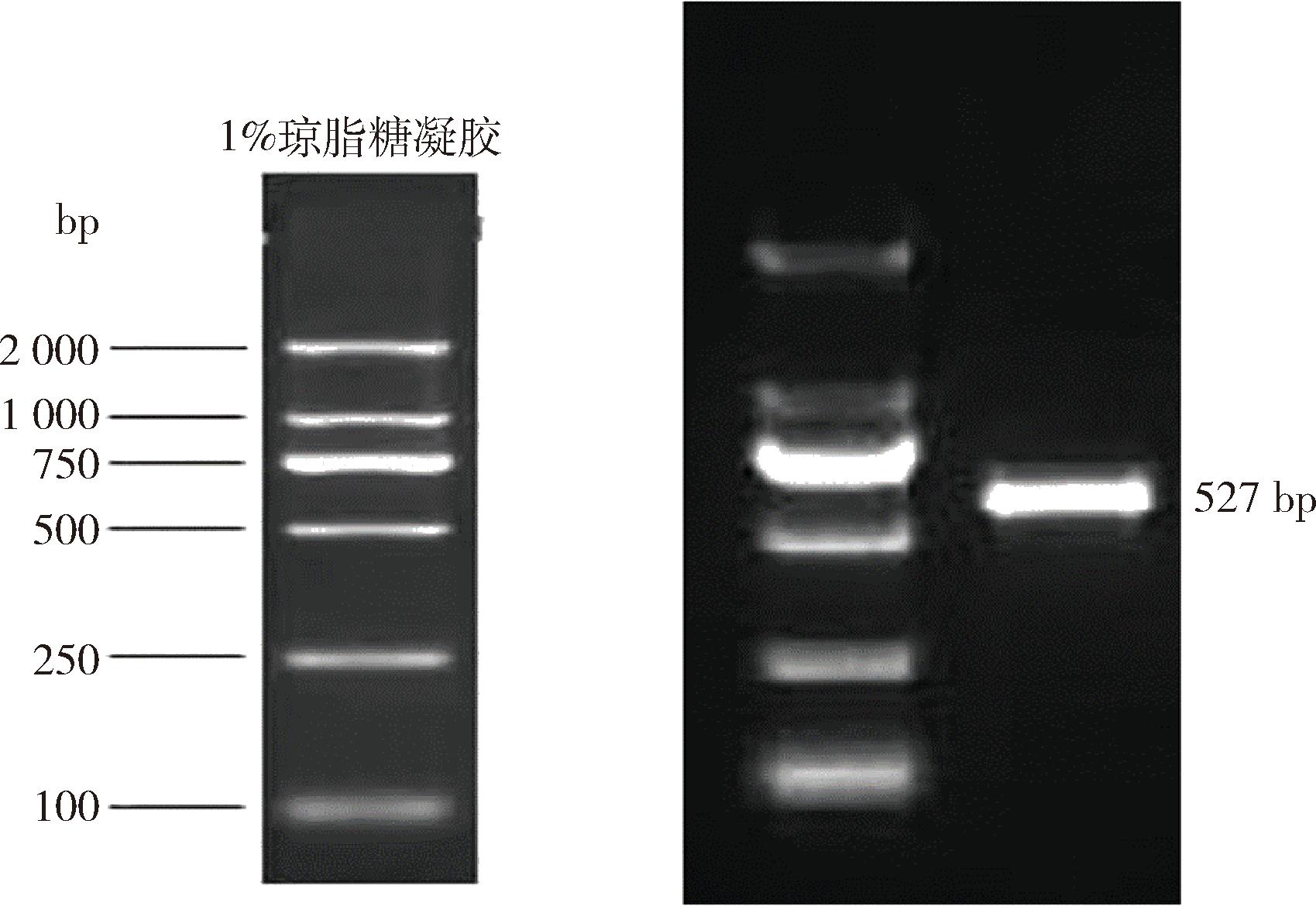
图4 ITS PCR扩增产物电泳分析
Fig.4 Electrophoretic analysis of ITS PCR amplification products
由图4可知,由通用引物IST1和ITS4进行PCR扩增获得菌株内转录间隔区,测序表明,菌株PCR长度为527 bp,且有条清晰明亮的条带,说明分离得到的菌株DNA未受到污染,纯度较高。由图5可知,通过NCBI比对,该菌株LM序列与数据库中谢瓦曲霉同源性较高。LM菌株与谢瓦曲霉(Aspergillus chevalieri)模式菌株NR135340.1聚为一支,且自展支持率为100%。因此,综合上述形态结构特征、ITS区序列比对以及多基因系统发育进化树分析,综合鉴定该菌株为谢瓦曲霉。
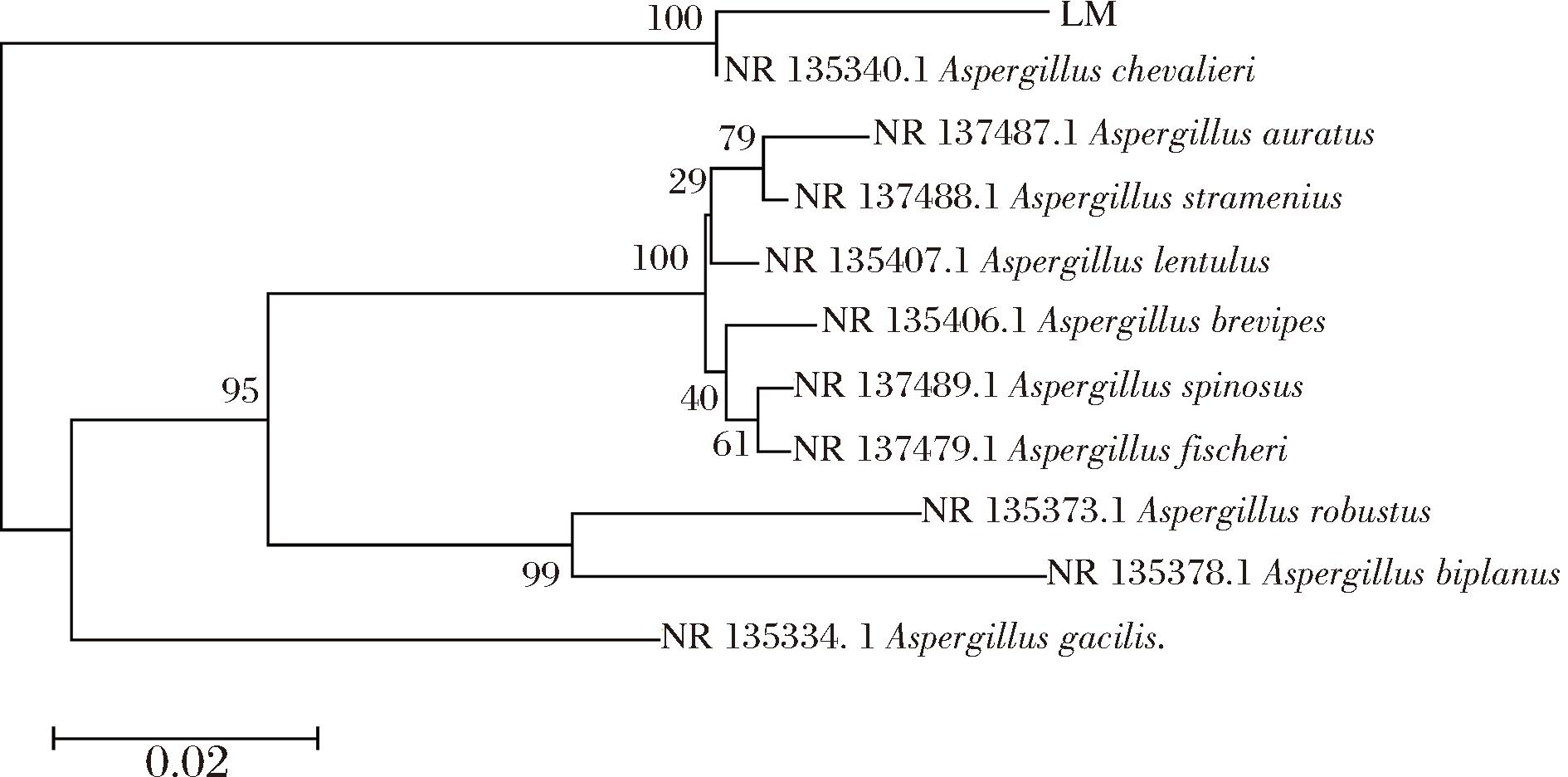
图5 邻接法构建的系统发育树
Fig.5 Phylogenetic tree constructed by the neighbour-joining method
2.2 蚝油表面菌落培养过程中结构形态特征
2.2.1 菌落形态观察
5款蚝油表面菌落形态结构如图6所示。在恒温恒湿培养箱培养过程中,5款蚝油表面的变化情况不完全相同,其中B和D组变化较为迅速,在第3天时表面已出现肉眼可见的白色菌膜,蚝油A、C和E组中的在第4天甚至第5天才出现,这可能与蚝油自身含有的营养物质含量有关。同时B和D组在第5天时,表面会出现明显的霉菌孢子,而其余3组在第7天时才会到达这个阶段,继续培养,蚝油表面逐渐呈现深绿色,直至覆盖整个平板表面。
2.2.2 显微镜形态结构特征
蚝油表面菌株在光学显微镜下的形态特征如图7所示。B1~B6为B组蚝油表面菌落在光学显微镜下的结构特征。其明显可以看出接种后第1天,视野中几乎看不到任何物质,但随着培养时间的延长,在第4天时,视野中逐渐出现菌丝,接着培养会出现子囊果,待成熟时子囊孢子上的孢子会脱落,这代表霉菌在B组蚝油表面完成了一个生长周期。将能够在光学显微镜下观察到孢子囊及其周围散落孢子阶段的蚝油视为变质阶段蚝油。图7为5款蚝油接种后第7天表面菌落在光学显微镜下的情形,此时5款蚝油基本都已到达本实验拟定的变质阶段。
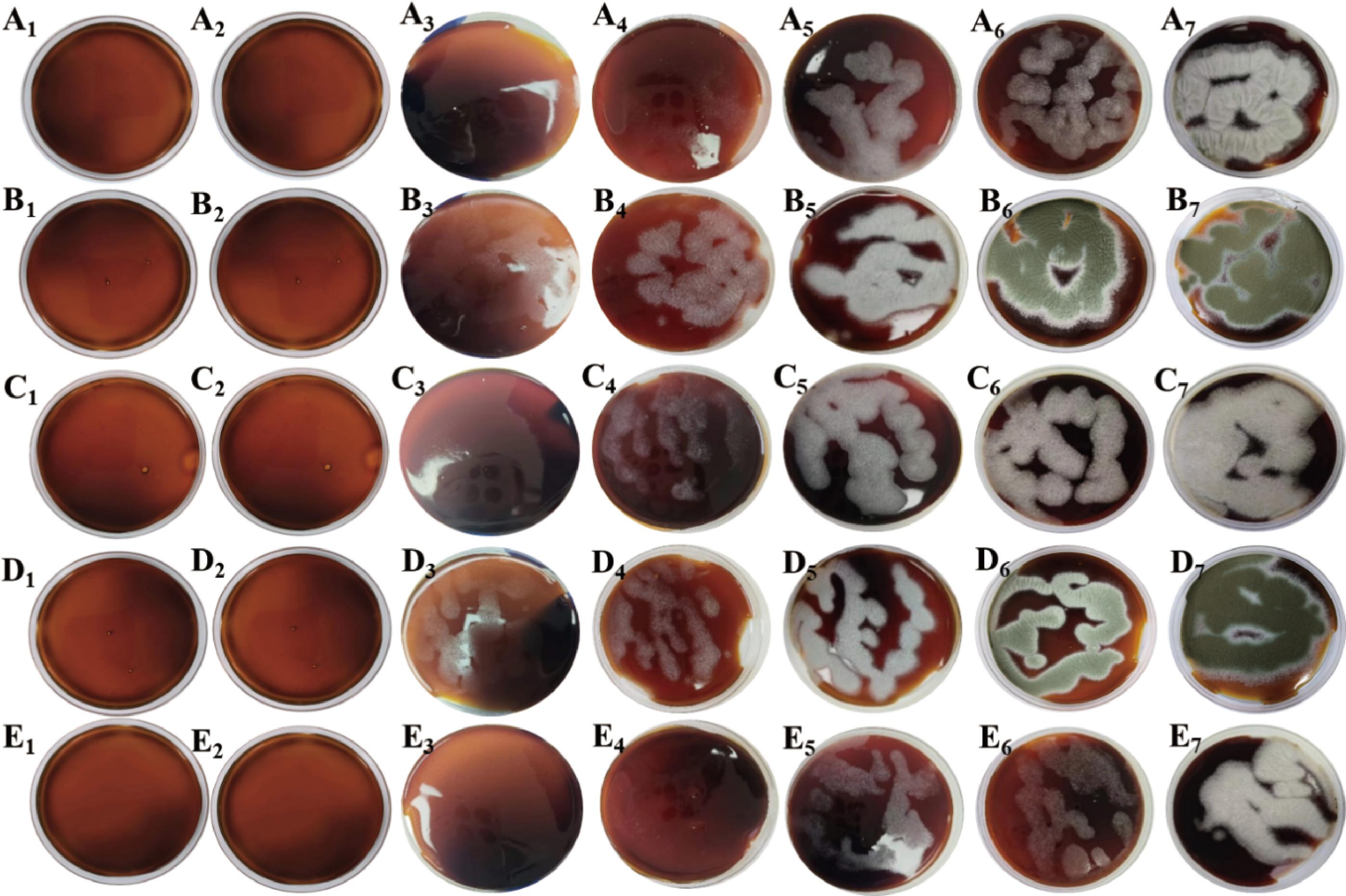
A~E-5款不同的蚝油;1~7-各蚝油培养1、2、3、4、5、6、7 d蚝油表面菌落形态
图6 蚝油接种霉菌后表面的菌落形态
Fig.6 Colony morphology on the surface of oyster sauce inoculated with mold
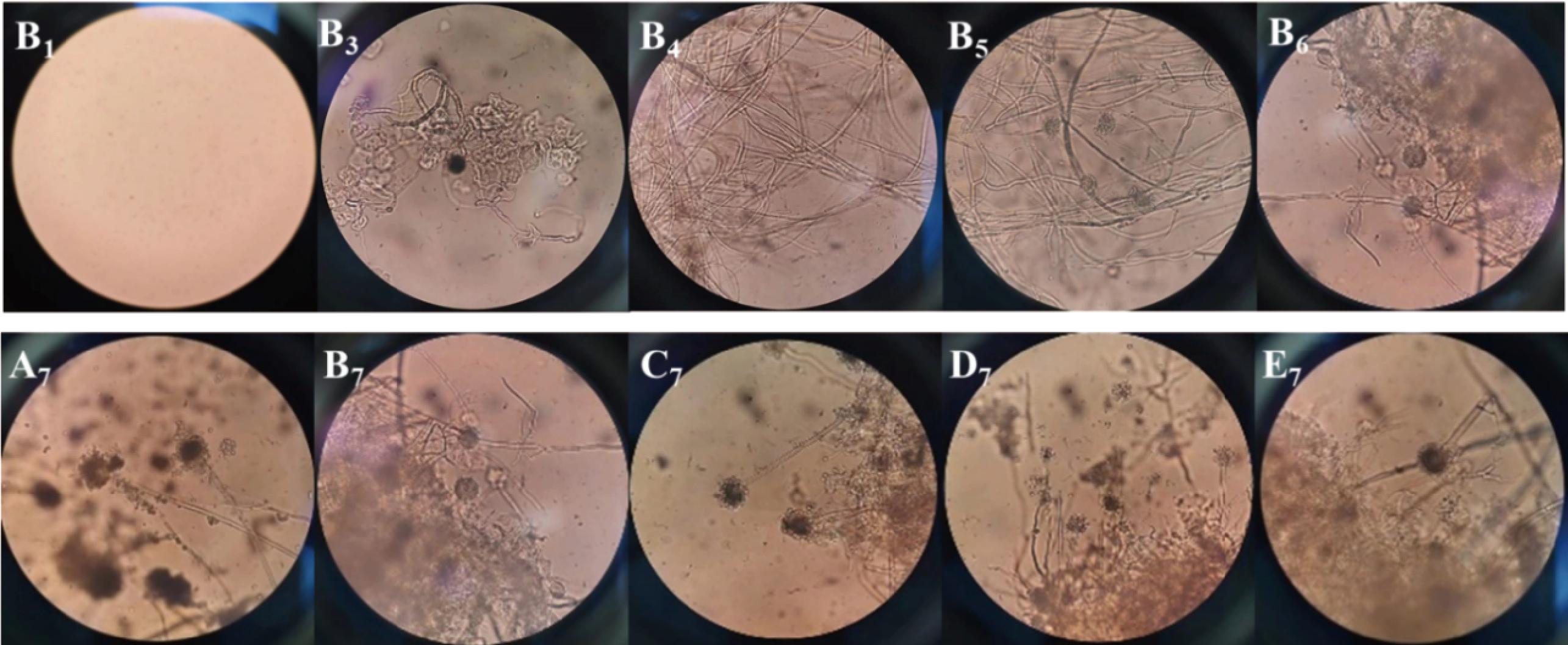
B1~B6-B组蚝油完成一个霉菌周期在200×倍镜下的镜检情况;A7~E7-A~E 5款蚝油最后一个阶段在200×倍镜下的镜检情况
图7 蚝油接种霉菌后表面菌株在光学显微镜下的形态结构特征
Fig.7 Morphological and structural characteristics of surface strains inoculated with mold in oyster sauce under optical microscope
2.3 五款蚝油变质前后相关酶活力及理化指标结果分析
2.3.1 总蛋白酶活力和α-淀粉酶活力的测定
酶活力是指酶分子在一定条件下催化酶促反应的能力,它能够加速生物体内化学反应的速率。多数曲霉在适宜的条件下都能够产酶,常用于工业上酿酒、发酵等,比如黑曲霉[14]和米曲霉[15]。因此有必要对变质前后的蚝油进行总蛋白酶活力和α-淀粉酶活力的测定来完善谢瓦曲霉的酶学特性,进一步探讨蚝油中营养物质的变化的原因。2种酶活力测定结果如图8所示。

a-总蛋白酶活力;b-α-淀粉酶活力
图8 五款蚝油变质前后酶活力的变化
Fig.8 Changes in enzyme activity before and after deterioration of 5 oyster sauces
注:不同大写字母表示相同品质状态不同蚝油品牌的数据有显著差异,不同小写字母表示相同蚝油品牌不同品质状态的数据有显著差异(P<0.05)(下同)。
由图8可知,5款蚝油变质后总蛋白酶活力和α-淀粉酶活力都有明显提升(P<0.05)。蚝油A组变质前总蛋白酶活力为1.25 U/g,α-淀粉酶活力为2.52 U/g,变质后总蛋白酶活力上升到1.66 U/g,增幅为33.33%,α-淀粉酶活力上升到3.24 U/g,增幅为28.55%。图中明显可见,蚝油B组和D组的总蛋白酶活力和α-淀粉酶活力升高最为明显,B组总蛋白酶活力由1.66 U/g上升至4.40 U/g,增幅为165%,淀粉酶活力从2.01 U/g上升至3.71 U/g,增幅为83.98%;D组总蛋白酶活力增幅为38.46%,淀粉酶活力增幅为121%,这可能是因为B组和D组蚝油中的环境更适合谢瓦曲霉生长,与先前培养过程的结果一致。新鲜蚝油被谢瓦曲霉污染后,总蛋白酶活力和α-淀粉酶活力都有所提高,其结果可证明谢瓦曲霉具有产酶能力。
2.3.2 水分含量的变化
水分是指每100 g样品中所含水分的质量(g),它是食品中一项简单但重要的指标。蚝油放置时间过久,表面会出现黏稠度降低且水淋淋的现象,此时水分含量就发生了变化[16]。水分含量的变化,与微生物的生长及生化反应都有密切的联系。5款蚝油变质前后平均水分含量变化如图9所示。
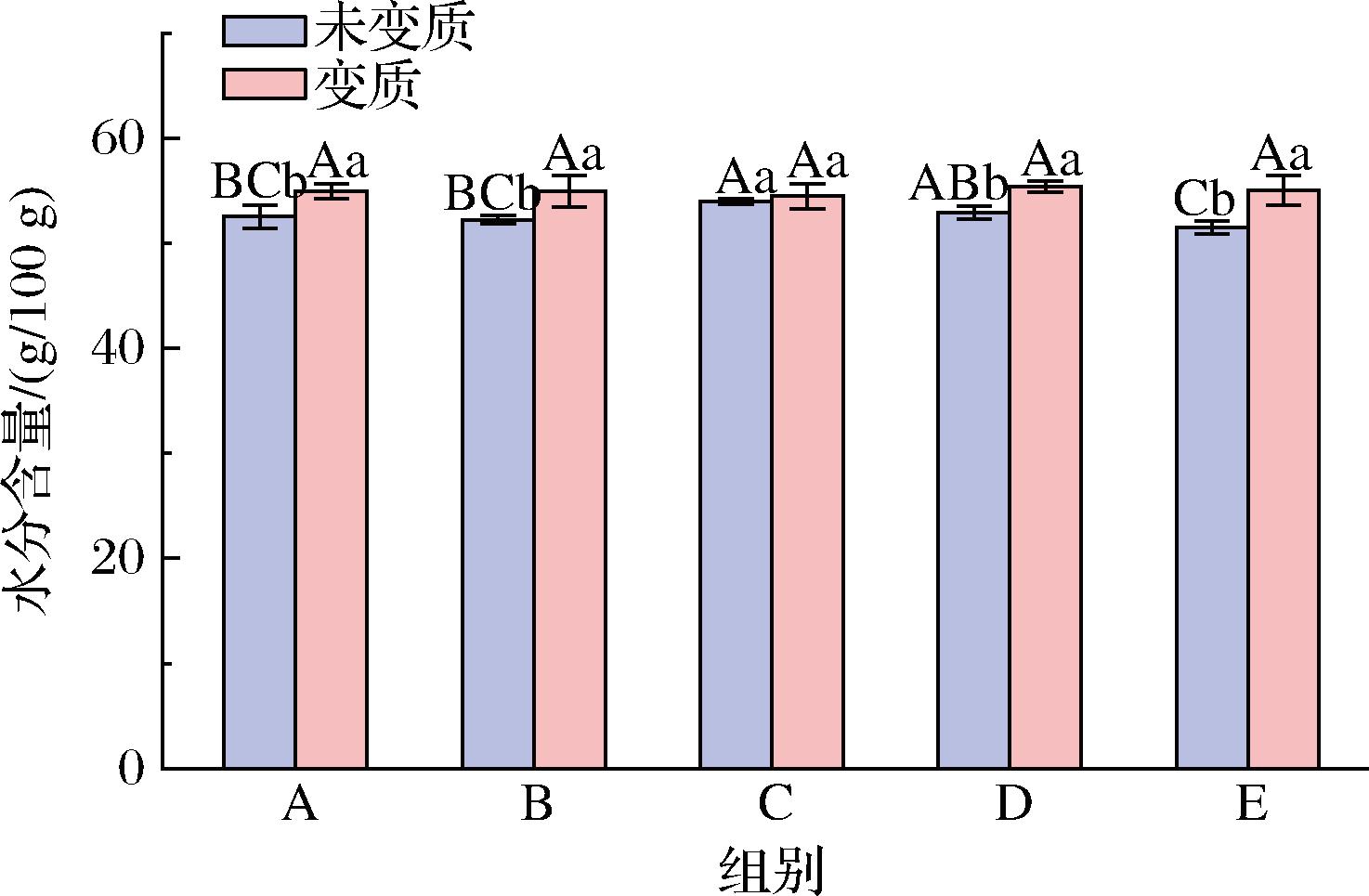
图9 五款蚝油变质前后水分含量的变化
Fig.9 Changes in moisture content of 5 oyster sauces before and after deterioration
由图9可知,5款蚝油最初始即未变质蚝油平均水分含量依次为52.54%、52.26%、53.98%、52.93%和51.51%,变质之后均有所上升,分别上升至54.99%、54.96%、54.50%、55.38%和55.01%。其中蚝油E组水分含量增加最为明显,增幅达6.79%。这主要是因为谢瓦曲霉在生长代谢过程中能够产生淀粉酶,这些淀粉酶可以分解蚝油中的淀粉或变性淀粉,从而破坏其与水分的胶着状态,释放出水分,使得变质后的蚝油水分含量上升。因此,当开盖后的蚝油表面出现水化现象且容易倾倒时,需要及时注意其风味,观察其是否变质。但水分含量并不能直接作为蚝油变质的检测指标,其原本的水分含量的高低与蚝油品牌、批次等也有关系。
2.3.3 蛋白质含量的变化
蚝油是以牡蛎或者煮熟的牡蛎汁为原料加以辅料制成,而牡蛎作为水产品的一种,体内也含有丰富的蛋白质,其组成完善,营养价值高[17]。蛋白质作为蚝油中的重要营养物质之一,其含量的变化也反映出蚝油的劣变程度。5款蚝油变质前后蛋白质含量变化如图10所示。
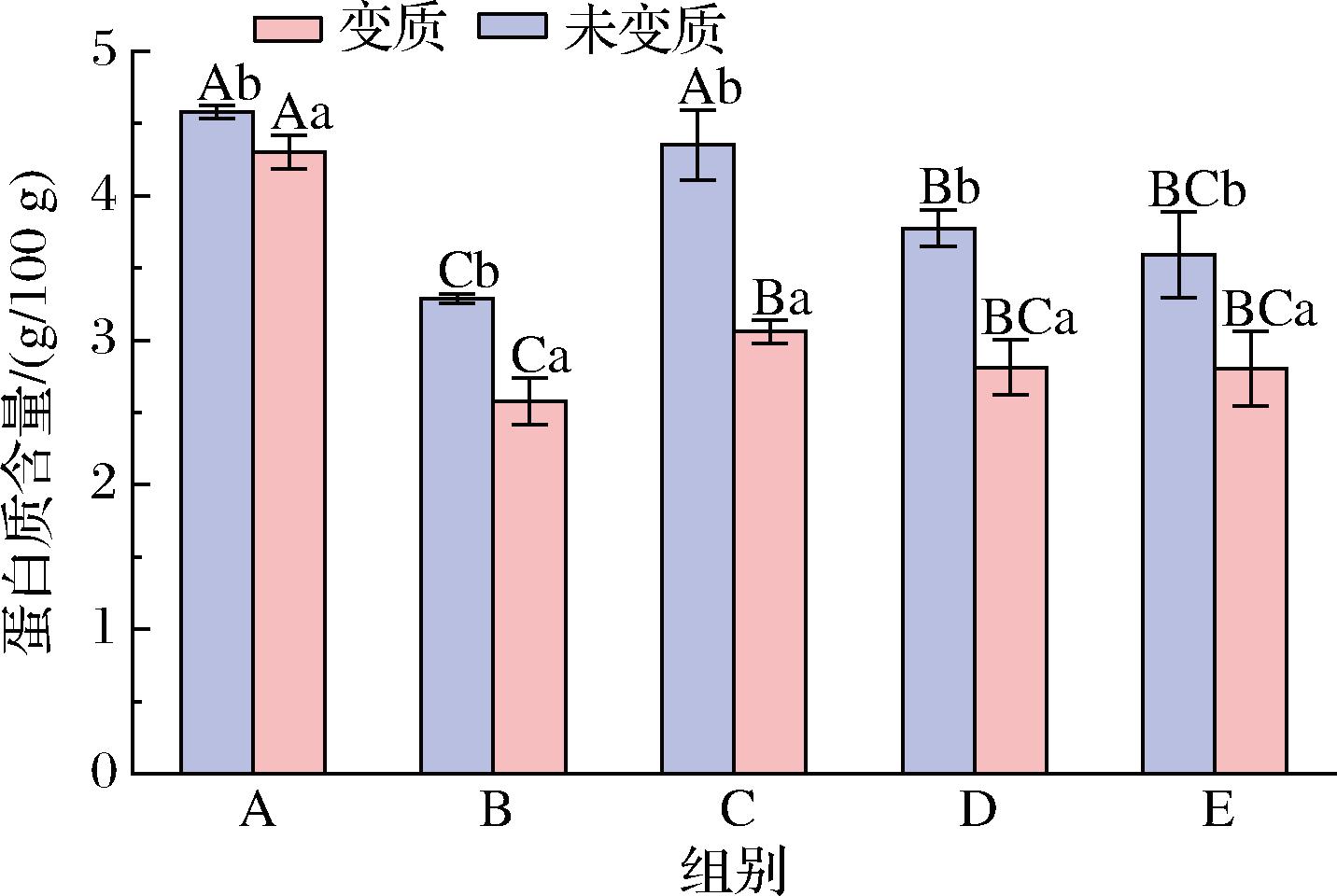
图10 五款蚝油变质前后蛋白质含量的变化
Fig.10 Changes in protein content of 5 oyster sauce before and after deterioration
由图10可知,5款蚝油变质后蛋白质含量较变质前均有明显下降(P<0.05),未变质时蛋白质含量均高于3.00 g/100 g,符合正常市售蚝油蛋白质含量范围[18]。5款蚝油样品中,蛋白质含量下降最为明显的是C组,最不明显的为A组,其降幅分别为29.64%和6.03%,这可能是因为谢瓦曲霉在生长代谢过程中消耗蛋白质为自身供能,导致变质后的蚝油蛋白质含量下降;除此之外,谢瓦曲霉能够产生蛋白酶,随着谢瓦曲霉的生长代谢,使蛋白质降解为小分子肽或游离氨基酸,也会造成蛋白质含量的减少。
2.3.4 挥发性盐基氮和氨基酸态氮含量的变化
挥发性盐基氮是蚝油调味品中的一个重要的指标,可以用来衡量食品新鲜的程度和蛋白质水解的程度。它是指动物性食品由于酶和细菌的作用,分解其中蛋白质产生氨以及胺类等碱性含氮物质[19],此反应常常发生在腐败过程中。对5款蚝油变质前后的挥发性盐基氮含量进行测定,结果如图11-a所示。5款蚝油变质前后挥发性盐基氮含量整体呈上升趋势,蚝油B组上升最为明显,A组最不明显,增幅分别为39.27%和10.30%。这是因为谢瓦曲霉自身生长会消耗蛋白质,同时产蛋白酶分解蛋白质产生氨类物质,从而使蛋白质含量下降,挥发性盐基氮含量上升。GB/T 21999—2008《蚝油》规定挥发性盐基氮含量应不高于50.00 mg/100 g,在5款蚝油中,A、B、C、D四组蚝油变质前挥发性盐基氮含量均低于国家限定标准,变质后也仍有A、B、D三组含量未超过限定标准。因此,仅仅依靠测定挥发性盐基氮含量无法确定蚝油是否变质,要判断蚝油是否变质还需综合评估。
氨基酸态氮,指的是以氨基酸形式存在的氮元素的含量,一般用来判定发酵产品的发酵程度[20]。它作为蚝油中一个必不可少的指标,通常用来评价食品营养价值、判断食品新鲜程度和调控指导食品加工生产过程。5款蚝油变质前后的氨基酸态氮含量结果如图11-b所示。5款蚝油变质前后氨基酸态氮含量呈明显上升趋势(P<0.05),未变质时的氨基酸态氮含量均高于0.30 g/100 g,符合蚝油国标限量标准。变质后,蚝油B组和D组上升较为明显,A组最不明显,增幅分别为45.00%、71.43%和13.89%。其原因与挥发性盐基氮含量变化原因相同,由于谢瓦曲霉生长代谢以蛋白质为营养物质,同时产蛋白酶将其分解成小分子肽或氨基酸,致使氨基酸态氮含量上升。
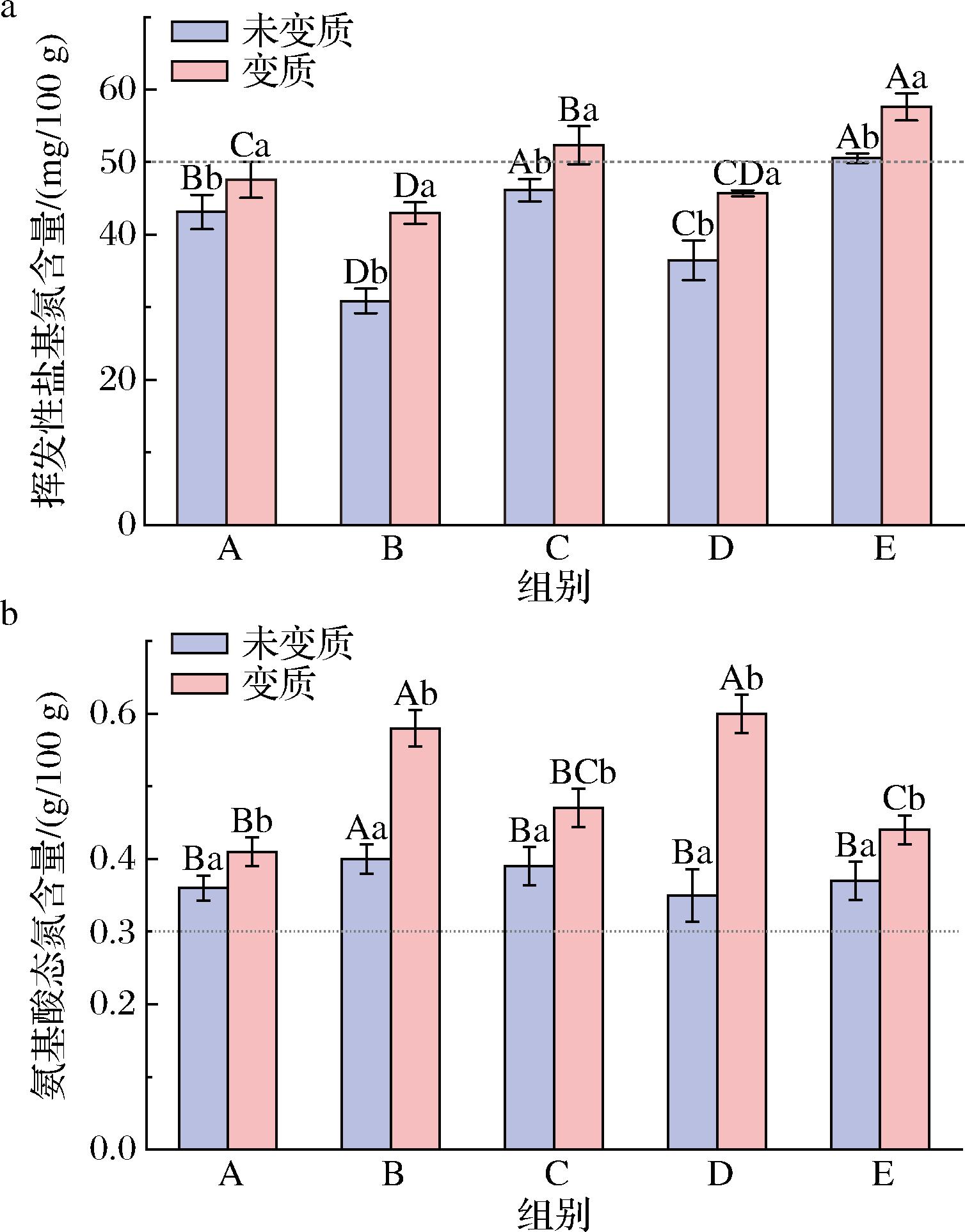
a-挥发性盐基氮含量;b-氨基酸态氮含量
图11 五款蚝油变质前后挥发性盐基氮含量和氨基酸态氮含量的变化
Fig.11 Changes in volatile saline nitrogen content and amino acid nitrogen content of 5 oyster sauces before and after deterioration
2.3.5 总酸含量的变化
蚝油的总酸通常是指蚝油中所含有的醋酸、乳酸和山梨酸等各种有机酸[21],其主要是由制作过程中乳酸菌或酵母菌分解蚝油中的糖类物质而生成的。醋酸、乳酸等有机酸也是蚝油重要的风味物质,在一定程度上能增进蚝油风味,但当总酸含量过高时,蚝油便会散发出不适宜的酸味。5款蚝油变质前后总酸含量如图12所示。
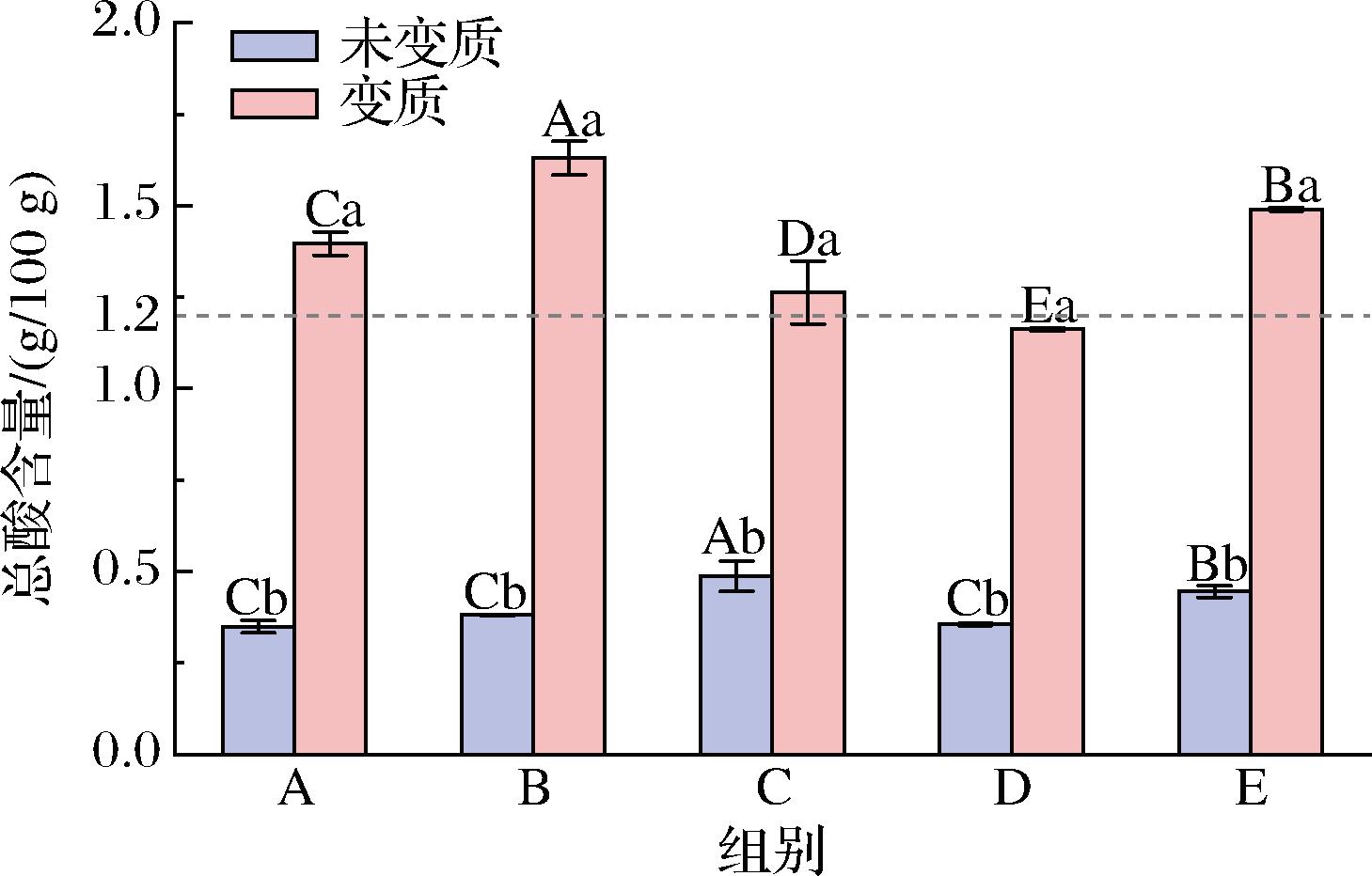
图12 五款蚝油变质前后总酸含量的变化
Fig.12 Changes in total acid content of 5 oyster sauces before and after deterioration
由图12可知,变质前后5款蚝油总酸含量均呈现明显上升趋势(P<0.05),这与酱油变质前后总酸含量变化趋势一致[22]。其中蚝油B组总酸含量从0.38 g/100 g上升至1.63 g/100 g,增幅最大,为328%,其他组A~E(除B)增幅分别为300%、159%、227%和234%,变质后总酸含量最高可达到1.63 g/100 g。这是因为霉菌能够利用蚝油中的营养物质(糖类和蛋白质等)代谢产酸,致使蚝油总酸含量升高。5款蚝油中,A、B、C和E组蚝油变质后总酸含量超过国家限定标准。D组蚝油变质后虽然总酸含量未超过国家限定标准,但总酸含量明显升高,蚝油会散发出刺鼻的酸味,蚝油风味和感官已经发生明显的变化。
2.3.6 糖类的变化
蚝油中的糖类主要指外源添加的白砂糖、淀粉和还原糖等物质。糖类作为一种重要的营养物质,在大部分微生物的生长代谢中都扮演着重要角色,其中还原糖含量便是能够直观反映出蚝油中微生物生长情况的指标。分别对变质前后的蚝油进行蔗糖和还原糖含量指标的测定,结果如图13所示。
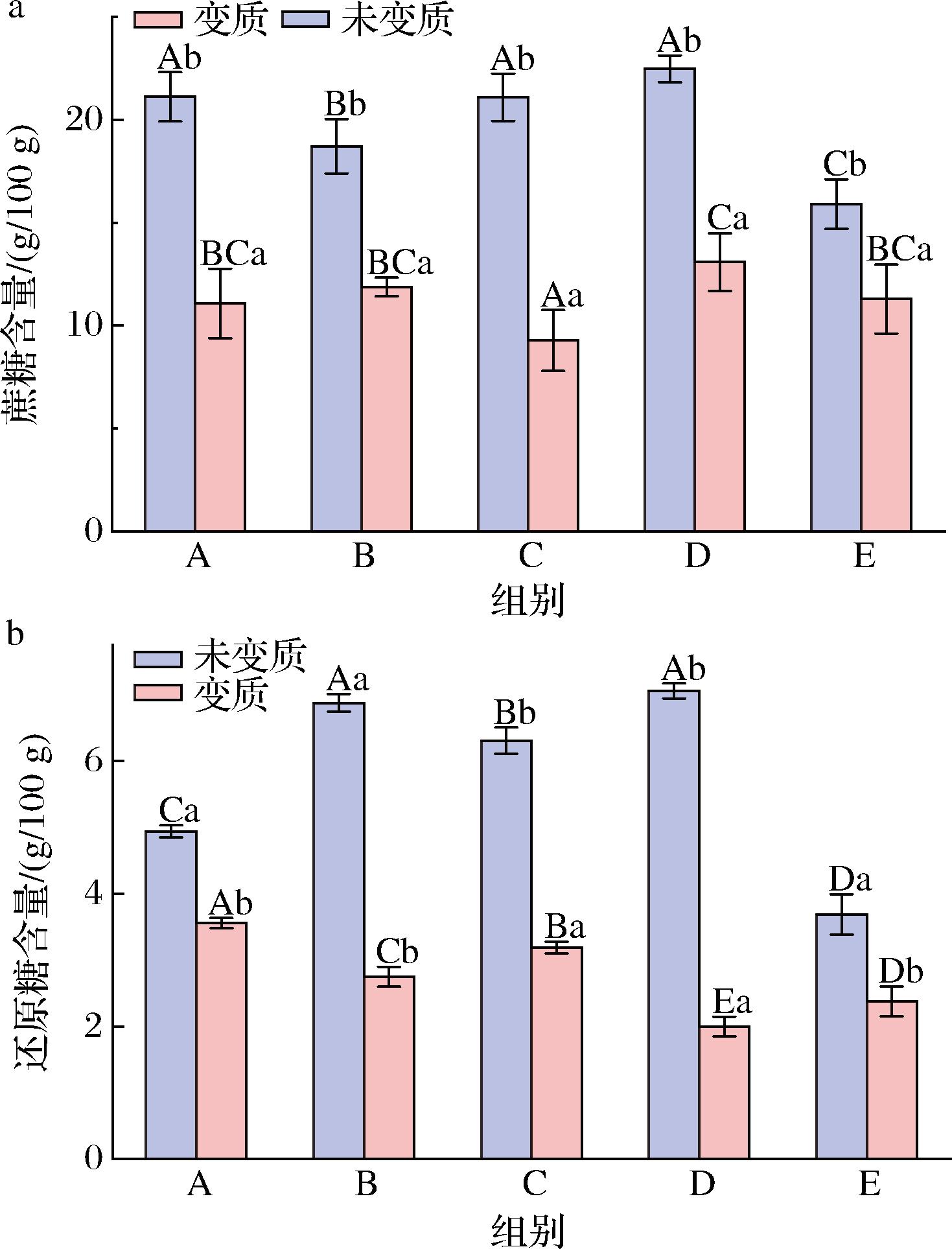
a-蔗糖含量;b-还原糖含量
图13 五款蚝油变质前后糖类含量的变化
Fig.13 Changes in sugar content of 5 oyster sauces before and after spoilage
由图13可知,5款蚝油中变质前后蔗糖含量和还原糖含量均呈明显下降趋势(P<0.05),蚝油A~E组蔗糖含量降幅分别为47.67%、36.51%、55.95%、41.83%和29.04%。还原糖含量降幅分别为27.93%、60.36%、49.44%、71.69%和35.50%。这种变化的原因主要是霉菌可以以多种碳源为营养来源[23],包括淀粉、蔗糖等,这些碳源不仅用于构成霉菌细胞的组成部分,还可为其代谢产物的形成提供碳素来源,比如总酸等。因此霉菌在蚝油中生长繁殖大量消耗了蚝油中的糖类,导致还原糖、蔗糖含量大幅下降。
3 结论与讨论
结合形态学观察与分子生物学鉴定结果发现,从成品变质蚝油中分离出的微生物属谢瓦曲霉。本实验通过测定变质前后5款不同的蚝油的酶活力和相关理化指标,可以初步得出蚝油变质的基本规律:蚝油总蛋白酶活力和α-淀粉酶活力呈上升趋势,该结果可证明谢瓦曲霉具有产酶能力;蚝油水分含量呈现上升趋势,这使得变质后的蚝油表面出现水化现象;总酸、挥发性盐基氮和氨基酸态氮含量上升,使蚝油散发出馊味臭味;糖类(蔗糖和还原糖)和蛋白质含量下降,使蚝油整体营养价值下降。因此,当开盖蚝油瓶口出现霉点,同时伴随着黏稠度降低,容易倾倒且有刺鼻馊味时,可视为蚝油已发生变质。蚝油作为一种常见的家庭调味品,微生物污染现象屡见不鲜,本试验对比研究了成品变质蚝油与未变质蚝油的相关理化指标,分析得出了蚝油变质后相关营养指标变化,为成品蚝油微生物污染引起的变质提供了相对客观的判断依据。
[1] ONG K C.In the footsteps of the Chinese diaspora:Lee Kum Kee and its worldwide oyster sauce trading network[J].Asian and Pacific Migration Journal, 2020, 29(2):186-206.
[2] 陈金秋. 蚝油加工技术[J].食品工业科技, 1999, 20(3):58-59.
CHEN J Q.Processing technology of oyster sauce[J].Science and Technology of Food Industry, 1999, 20(3):58-59.
[3] YU M G, LI T, SONG H L.Characterization of key aroma-active compounds in four commercial oyster sauce by SGC/GC×GC-O-MS, AEDA, and OAV[J].Journal of Food Composition and Analysis, 2022, 107:104368.
[4] LEE C Y, KIM Y Y, SOHN S K, et al.Process optimization for processing of oyster crassostrea gigas gratin with cream sauce[J].Korean Journal of Fisheries and Aquatic Sciences.2022, 55(2):102-110.
[5] 王洪江, 赵品贞, 姬庆, 等.影响蚝油气味品质的关键风味化合物的研究[J].食品与发酵工业, 2025, 51(7):310-316.
WANG H J, ZHAO P Z, JI Q, et al.Study on key flavor compounds influencing odor quality of oyster sauce products[J].Food and Fermentation Industries, 2025, 51(7):310-316.
[6] 段鑫锐, 康波, 张小龙, 等.蚝油挥发性风味成分比较分析[J].中国调味品, 2022, 47(11):144-150.
DUAN X R, KANG B, ZHANG X L, et al.Comparative analysis of volatile flavor components in oyster sauce[J].China Condiment, 2022, 47(11):144-150.
[7] 杨洋. 蚝油稳定体系的研究[J].食品工业, 2022, 43(6):169-172.
YANG Y.Study on the stability system of oyster sauc [J].Food Industry, 2022, 43(6):169-172.
[8] 陆大鹏.气相色谱质谱嗅闻联用分析牡蛎及制品中挥发性成分的研究[D]. 湛江:广东海洋大学,2021.
Lu D P. Analysis of volatile components in oysters and their products by gas chromatography-mass spectrometry[D]. Zhanjiang:Guangdong Ocean University, 2021.
[9] 李兆周, 陈秀金, 王耀, 等.蚝油的增香与体态稳定性控制研究进展[J].食品与发酵工业, 2023, 49(11):337-346.
LI Z Z, CHEN X J, WANG Y, et al.Research progress on flavor enhancement and appearance stability control of oyster sauce[J].Food and Fermentation Industries, 2023, 49(11):337-346.
[10] 王屋梁, 徐敏.基于原料对蚝油体态稳定性影响的研究进展[J].食品工业, 2023, 44(11):265-268.
WANG W L, XU M.Research progress based on the effect of raw materials on the stability of oyster sauce[J].The Food Industry, 2023, 44(11):265-268.
[11] 李锦绍. 天麻褐腐病病原菌分离鉴定、生物学特性研究及全基因组测序分析[D].贵阳:贵州大学, 2024.
LI J S.Isolation, identification, biological characteristics and genome sequencing of the pathogen of Gastrodia elata brown rot [D].Guiyang:Guizhou University, 2024.
[12] 唐鑫, 张进强, 江维克, 等.天麻褐腐病病原菌的分离鉴定及致病性研究[J].中国中药杂志, 2022, 47(9):2288-2295.
TANG X, ZHANG J Q, JIANG W K, et al.Isolation, identification and pathogenicity research of brown rot pathogen from Gastrodia elata[J].China Journal of Traditional Chinese Medicine, 2022, 47(9):2288-2295.
[13] 周祎炜, 燕飞, 曲东, 等.“金花” 菌的分离鉴定及其对紫娟红茶发酵品质的影响[J].食品研究与开发, 2024, 45(5):44-52.
ZHOU Y W, YAN F, QU D, et al.Isolation and identification of ‘Golden-Flower’ Fungus and its influence on fermentation quality of zijuan black tea[J].Food Research and Development, 2024, 45(5):44-52.
[14] 赵一帆, 罗磊, 马潇, 等.基于黑曲霉固态发酵的绿豆皮降解及理化特性提升机理[J].中国粮油学报, 2024, 39(3):64-70.
ZHAO Y F, LUO L, MA X, et al.Mechanism of mung bean husk degradation and physicochemical characteristics improvement based on Aspergillus niger solid-state fermentation[J].Journal of the Chinese Cereals and Oils Association, 2024, 39(3):64-70.
[15] 王泽亮, 邓维琴, 刘书亮, 等.半干态豆豉高效发酵菌株筛选及其发酵性能评价[J].食品科学, 2024, 45(5):31-39.
WANG Z L, DENG W Q, LIU S L, et al.Screening and fermentation performance of highly efficient starter cultures for semi-dry Douchi[J].Food Science, 2024, 45(5):31-39.
[16] 李圣花, 张敏, 干小燕, 等.变性淀粉增稠的调味酱化水变稀的原因分析[J].现代食品, 2022, 28(6):203-206.
LI S H, ZHANG M, GAN X Y, et al.Study on the causes of liquifying and thinning of the paste sauce thickened with modified starch[J].Modern Food, 2022, 28(6):203-206.
[17] 林海生, 秦小明, 章超桦, 等.中国沿海主要牡蛎养殖品种的营养品质和风味特征比较分析[J].南方水产科学, 2019, 15(2):110-120.
LIN H S, QIN X M, ZHANG C H, et al.Comparative analysis of nutritional components and flavor characteristics of cultivated oyster from different coastal areas of China[J].South China Fisheries Science, 2019, 15(2):110-120.
[18] 潘婷, 杨雷, 朱科帆, 等.市售蚝油产品品质的评价[J].食品工业科技, 2016, 37(20):96-100.
PAN T, YANG L, ZHU K F, et al.Quality evaluation of commercial oyster sauce samples[J].Science and Technology of Food Industry, 2016, 37(20):96-100.
[19] LU Y N, LUO Q J, CHU Y C, et al.Application of gelatin in food packaging:A review[J].Polymers, 2022, 14(3):436.[PubMed]
[20] 丁奇, 马立利, 郎爽, 等.不同调味品中氨基酸态氮、总酸含量的分析及比较研究[J].分析仪器, 2021(3):70-74.
DING Q, MA L L, LANG S, et al.Analysis and comparison of amino acid nitrogen and total acid in different condiments[J].Analytical Instruments, 2021(3):70-74.
[21] HWANG Y S, KIM S H, KIM B G, et al.Processings and quality characteristics of the oyster sauce from IQF oyster Crassostrea gigas[J].Korean Journal of Fisheries and Aquatic Sciences, 2015, 48(6):833-838.
[22] 蒋雪薇, 叶菁, 周尚庭, 等.成品酱油微生物污染变质的风险预警[J].食品与机械, 2016, 32(4):67-70.
JIANG X W, YE J, ZHOU S T, et al.Risk pre-warning of deterioration in finished sauce with microbial contamination[J].Food and Machinery, 2016, 32(4):67-70.
[23] WANG B T, HU S, YU X Y, et al.Studies of cellulose and starch utilization and the regulatory mechanisms of related enzymes in fungi[J].Polymers, 2020, 12(3):530.