黄花菜,萱草属草本植物,又被称为金针菜或萱草,原产于东亚,是从热带到原生高纬度地区被广泛栽培的多年生单子叶植物[1]。在我国已有2 000多年的栽培历史,黄花菜热量低,富含糖类、蛋白质、维生素、无机盐及多种人体必需的氨基酸[2],具有健脑、抗衰老、抗抑郁和利尿消肿等功能,被认为是一种兼具蔬菜特性和保健食品功效的药食同源食品[3-4]。在现代生活中,黄花菜与香菇、木耳、冬笋一起被称为蔬菜类中的四大珍品,深受广大消费者喜爱[5]。传统上,黄花菜除了作为食物材料外,还被用作止痛剂、发酵剂、促睡剂和镇静剂,并刺激分娩妇女的乳液分泌[6]。一些研究表明,黄花菜或其提取物对小鼠和人均具有显著的促睡眠和镇静作用[7],黄花菜水提物和乙醇提取物均能降低高糖刺激的人脐静脉内皮细胞中活性氧(reactive oxygen species,ROS)和促炎介质的表达水平,并增加抗氧化酶的表达水平[8],从黄花菜乙醇提取液中分离的咖啡酰奎宁酸可减少肿瘤坏死因子α诱导的人肝癌HepG2细胞ROS的产生[9]。目前对于黄花菜的研究主要集中在活性成分的提取及其抗氧化能力上[10-11],而对于其风味研究主要集中在干燥方式对黄花菜风味的影响,如杨双喜等[12]、马尧等[13]采用GC-MS结合化学计量法和电子鼻等方法分析了不同干燥方式对黄花菜挥发性风味物质的影响,并筛选出不同干燥方式的黄花菜特征风味物质,而对黄花菜浸膏的风味研究鲜有报道。
中国的植物提取物总体上是属于中间体的产品。在新的医学模式影响下,具备功能性或活性的植物提取产品备受青睐。由于浸膏具有非常“逼真”的天然香味,添加了食用天然香料,其香气的天然感非常强,在我国,已有24种植物浸膏被批准用于食品添加剂,其中包括杭白菊浸膏、紫罗兰叶浸膏、白丁香浸膏、水仙浸膏、菊花浸膏、甘草流浸膏、菊花黄浸膏等[14-15]。气相色谱-离子迁移质谱(gas chromatography-ion migration mass spectrometry,GC-IMS)和电子鼻(electronic nose,E-nose)具有检测范围低、选择性高、操作稳定性强,分析能力快、成本效益高等优点,对高电负性和高质子亲和力的化合物高度敏感,可以检测许多化学多样的化合物,如醇类、醛类、芳香烃、酯类和酮类,通常用于食品香气研究中检测挥发性化合物(挥发性有机物)[16-17]。XU等[18]研究了桑叶提取物对炖麝鸭杂环胺形成和风味变化的抑制作用。研究发现,酚类化合物能显著抑制杂环胺的形成。利用GC-IMS技术,鉴定出45种挥发性风味化合物,包括7种酮类、9种醇类、7种醛类、9种酯类、4种烯烃和9种其他化合物。
本研究以鲜干和蒸干黄花菜为原料,采用热水提取法和乙醇提取法制备了4种黄花菜浸膏,对比分析4种黄花菜浸膏的理化特性、化学组成,并采用电子鼻、电子舌和GC-IMS结合多元统计方法及感官评价法对黄花菜浸膏的风味进行评价,具有一定的新意和使用价值,可为黄花菜浸膏的深加工提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
供试黄花菜采购于甘肃省庆阳市庆城县韩台农村专业合作社。挑选未开花、无病虫害、无机械损伤的花蕾,一批采摘后未经预处理直接进行热风干燥,另一批蒸制后进行热风干燥,粉碎,过60目筛备用。
1.1.2 试剂
乙腈 ACS(≥99.5%),上海瀚思化工有限公司;葡萄糖、蔗糖标准品(纯度≥99%),Dr.Ehrenstorfer公司;果糖、麦芽糖标准品(纯度≥99%)、2-氯苯丙氨酸(分析纯),上海源叶生物科技有限公司;乳糖标准品(纯度≥99%),上海安谱实验科技股份有限公司;氨基酸混标,和光纯药工业株式会社;甲醇(色谱级),Merck;盐酸(分析纯),莱阳市康德化工有限公司;甲酸(分析纯),西亚试剂;异丙醇(分析纯),Merck KgaA;石油醚、偏亚硫酸氢钠、无水乙醇、福林酚试剂、丙酮、乙酸钾、三氯化铝、芦丁、硫酸锌、盐酸等试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
RE-600旋转蒸发仪、SHZ-Ⅲ型循环水真空泵,上海亚荣生化仪器厂;HWS-24型电热恒温水浴锅,上海一恒科学仪器有限公司;752 N型紫外-可见分光光度计,上海又一仪器有限公司;101型电热恒温鼓风干燥箱,北京科伟永兴仪器有限公司;TGL-16M离心机,湘仪;LA8080氨基酸自动分析仪,日本株式会社日立高新技术科学;Q-Exactive HF高分辨质谱,Thermo Fisher Scientific;1200液相色谱仪、Zorbax Eclipse C18 (1.8 μm×2.1 mm×100 mm)色谱柱,Agilent Technologies。
1.3 实验方法
1.3.1 黄花菜浸膏的制备
1.3.1.1 蒸干黄花菜浸膏的制备
准确称取蒸干黄花菜粉100 g,按1∶10的料液比(g∶mL)分别用80%(体积分数)的乙醇和纯净水在80 ℃的恒温水浴中进行提取,提取2次,每次2 h,过滤合并滤液,滤液采用真空旋转蒸发仪(55 ℃,100 hPa,50 r/min)真空浓缩后得浸膏,分别为蒸干醇提浸膏和蒸干水提浸膏。
1.3.1.2 鲜干黄花菜浸膏的制备
准确称取鲜干黄花菜粉100 g,按1∶10的料液比(g∶mL)比例分别用80%(体积分数)乙醇和纯净水在80 ℃的恒温水浴中进行提取,提取2次,每次2 h,过滤合并滤液,滤液采用真空旋转蒸发仪(55 ℃,100 hPa,50 r/min)真空浓缩后得浸膏,分别为鲜干醇提浸膏和鲜干水提浸膏。
1.3.2 营养指标的测定
1.3.2.1 水分含量的测定
物料的初始水分含量按照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》直接干燥法执行,在105 ℃干燥样品至恒重,重复测定3次,以g/100 g表示。
1.3.2.2 总糖含量的测定
总糖含量的测定参照GB 5009.8—2023《食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》蒽酮比色法测定。
1.3.2.3 还原糖含量的测定
还原糖含量的测定参照GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》直接滴定法测定。
1.3.2.4 总酚含量的测定
参照SELESHE等[19]方法,并略作修改。称取不同的黄花菜浸膏样品0.2 g,加入4 mL的提取液,用超声波萃取30 min,用4 000 r/min离心10 min,然后将其上清液分离出来,以待测定。取100 μL的待测液,加入500 μL Folin-Ciocalteu试剂混合,在室温下静置2 min后加入500 μL 10%(质量分数)碳酸钠溶液,加水定容至2 mL,混匀,室温放置10 min,以没食子酸为标准品,在769 nm处测定吸光度值,得标准曲线Y=46.839X-0.878 4,R2=0.990 7,计算黄花菜浸膏中的总酚含量。
1.3.2.5 总黄酮含量的测定
参照LIU等[20]方法并稍作修改。称取不同的黄花菜浸膏样品0.2 g,加入4 mL的提取液,用超声波萃取30 min,用4 000 r/min离心10 min,然后将其上清液分离出来,以待测定。吸取1 mL待测液,加入60 μL亚硝酸钠,混合,5 min后加入60 μL硝酸铝溶液混匀,静置5 min,最后加入800 μL氢氧化钠溶液和80 μL蒸馏水,混匀,静置15 min,在510 nm处测定吸光度值。以芦丁标准液为对照,绘制标准曲线为Y=10.835X+0.005 7(相关系数R2=0.999 6)。
1.3.2.6 类胡萝卜素的测定
根据赵红霞等[15]的方法,并稍作修改。总类胡萝卜素含量的测定采用分光光度法,称取样品适量(1.0 g),加石油醚-丙酮溶液,超声提取3次,每次20 min,过滤,合并滤液,定容至50 mL棕色试剂瓶中,于450 nm测定吸光度。标准曲线的制备:分别移取β-胡萝卜素储备液配制不同浓度的工作液,于450 nm测定吸光度。
1.3.2.7 维生素C含量的测定
采用2,6-二氯靛酚滴定法测定,同时进行空白实验。
1.3.2.8 可滴定酸的测定
准确称取黄花菜浸膏2 g,加入48 mL的水,并在其中加入酚酞指示剂3~4滴,然后用0.1 mol/L的氢氧化钠溶液进行滴定,30 s未褪色,此时记录氢氧化钠标准溶液所消耗的体积,并进行空白试验。
1.3.3 游离糖的测定方法
称取混合均匀的适量试样,加水定容至25 mL,超声30 min,用0.45 μm微孔滤膜过至样品瓶,供液相色谱分析。色谱柱:Aglient氨基柱(250 mm×4.6 mm,5 μm);检测器:示差检测器;柱温:35 ℃;进样量:10 μL;流动相:V(乙腈)∶V(水)=70∶30;流速:1.0 mL/min。果糖、葡萄糖、蔗糖、麦芽糖和乳糖的回归方程分别为Y=223.020 8X、Y=215.675 2X、Y=226.566 0X、Y=171.387 0X、Y=175.377 9X。
1.3.4 游离氨基酸含量的测定方法
称取适量混匀样品于10 mL离心管中,加入0.02 mol/L盐酸溶解并定容。分别加入5 mL甲醇、5 mL水,对C18前处理小柱进行活化,加入2.5 mL样品,再加1.5 mL 0.02 mol/L盐酸,过柱后的样品用0.02 mol/L盐酸定容到25 mL,过0.45 μm滤膜后上机。色谱柱:磺酸型阳离子树脂分离柱;波长:570 nm和440 nm;进样量:20 μL;流速:1.0 mL/min;反应温度:(135±5) ℃。
1.3.5 电子鼻
样品前处理:待样品温度自然回升至室温后,分别称取2 g样品至100 mL烧杯中,双层保鲜膜封口,室温下静置30 min后上机测试。
直接顶空吸气法:直接将进样针头插入含样品的顶空瓶中,电子鼻进行测定。测定条件:采样时间为1 s/组;传感器自清洗时间为80 s;传感器归零时间为5 s;样品准备时间为5 s;进样流量为400 mL/min;分析采样时间为80 s。电子鼻传感器性能如表1所示。
表1 电子鼻传感器性能说明
Table 1 Performance description of electronic nose sensors
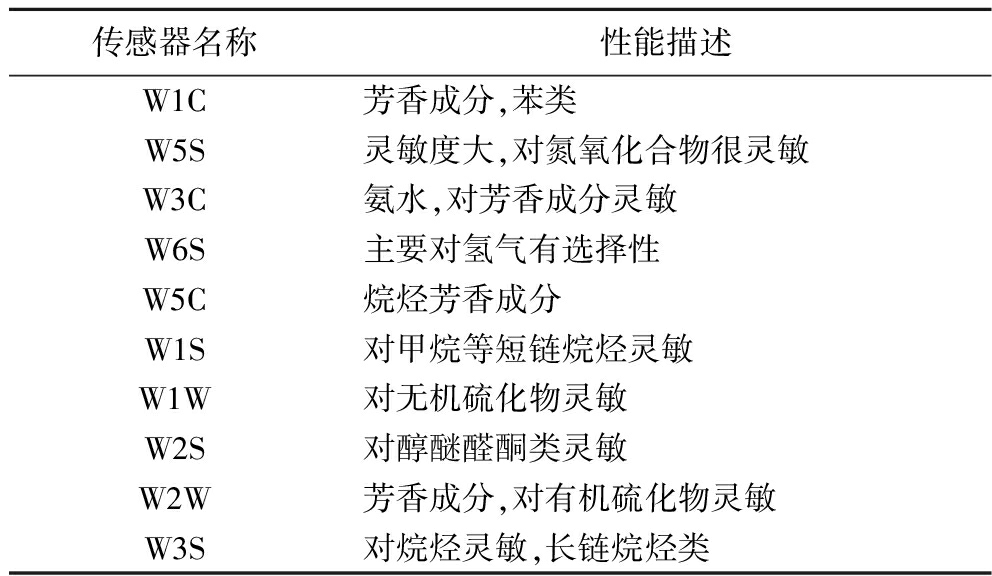
传感器名称性能描述W1C芳香成分,苯类W5S灵敏度大,对氮氧化合物很灵敏W3C氨水,对芳香成分灵敏W6S主要对氢气有选择性W5C烷烃芳香成分W1S对甲烷等短链烷烃灵敏W1W对无机硫化物灵敏W2S对醇醚醛酮类灵敏W2W芳香成分,对有机硫化物灵敏W3S对烷烃灵敏,长链烷烃类
1.3.6 电子舌
样品前处理:由于不确定电子舌测试该水提黄花菜浸膏或醇提黄花菜浸膏适合的浓度,故而对样品设置从低到高3个浓度。分别称取0.5、1.0、2.0 g样品溶于100 mL水中,搅拌使其充分溶解后上机测试。传感器介绍如表2所示。
1.3.7 GC-IMS
取0.5 mL黄花菜水醇浸提膏,置于20 mL顶空瓶中,使用FlavourSpec®风味分析仪进行分析。气相-离子迁移谱单元:分析时间:40 min;色谱柱类型:MXT-WAX 30 m-0.53 mm-1 μm;柱温:60 ℃;载气/漂移气:载气为高纯N2(纯度为99.999%);IMS温度:45 ℃。自动顶空进样单元:进样体积:500 μL;孵育时间:30 min;孵育温度:40 ℃;进样针温度:85 ℃;孵化转速:500 r/min。柱流速初始为 2 mL/min,保持2 min,2~10 min柱流速线性增加至10 mL/min,10~25 min柱流速线性增加至10 mL/min,保持15 min;飘逸气体流速150 mL/min。
表2 传感器介绍
Table 2 Introduction to sensors

传感器名称可评价的味道基本味(相对值)回味(CPA值)鲜味传感器(AAE)鲜味(氨基酸,核酸引起的鲜味)鲜味丰富度(可持续感知的鲜味)咸味传感器(CT0)咸味(食盐等无机盐引起的咸味)无酸味传感器(CA0)酸味(醋酸,柠檬酸,酒石酸等引起的酸味)无苦味传感器(C00)苦味(苦味物质引起的味道,在低浓度下被感知为丰富性)苦味回味(啤酒,咖啡等一般食品的苦味)涩味传感器(AE1)涩味(涩味物质引起的味道,低浓度下感知为刺激性回味)涩味回味(茶,红酒等呈现的涩味)
使用正酮 C4~C9 作为外标计算挥发性化合物的保留指数(retention index,RI),采用GC-IMS Library Search 软件内置的2014 NIST 数据库和IMS 数据库对挥发性成分定性分析。
1.3.8 感官评价
通过定量描述性分析,采用4个等级0~2、2.1~4、4.1~7、7.1~9强度对不同浓度的黄花菜浸膏的色泽、气味、酸味、鲜味、甜味、丰富性、涩味、咸味、苦味回味、涩味回味、刺激性和异味进行评价,综合得出总强度。接受性评价采用4个等级0~2、2.1~4、4.1~7、7.1~9强度进行评价,分别为不可接受、可接受、接受、欣然接受。
1.4 数据统计分析
采用峰面积归一化法定量挥发性风味物质,并使用Tbtools软件对挥发性风味物质的百分比数据进行热图分析;采用Origin 2021软件对电子鼻数据进行主成分分析(principal component analysis,PCA)和雷达图分析。
2 结果与分析
2.1 不同预处理黄花菜水提与醇提浸膏的得率与理化特性
不同预处理黄花菜水提与醇提浸膏样品如图1所示,4种黄花菜浸膏的形态、色泽、黏稠度等方面具有明显的不同。黄花菜浸膏的得率与理化性质如表3所示,鲜黄花菜的水分含量大约为82.34%,而不同预处理黄花菜浸膏的水分含量为40.87%~45.17%,较鲜黄花菜的水分含量具有明显的降低。不同黄花菜水醇提浸膏中可滴定酸的含量为1.57%~1.9%,密度为1.24~1.29 mg/mL,其中鲜干醇提浸膏的密度最大,为1.29 mg/mL。而不同黄花菜水醇提浸膏的得率也有一定的差异,其中,得率最高的为鲜干醇提浸膏,为67.84%,这可能与鲜干黄花菜中含有较多醇溶性物质有关。糖度是评价提取过程中浓缩程度的一个重要指标,4种黄花菜浸膏的糖度为65.3~66.7 Brix。
表3 不同预处理黄花菜水提与醇提浸膏的得率与理化性质
Table 3 The yield and physicochemical properties of water and alcohol extracts from different pretreatments of daylily

种类水分含量/%可滴定酸/%密度/(mg/mL)糖度/Brix得率/%蒸干水提浸膏45.17±0.43a1.65±0.11b1.26±0.01a66.67±1.53a65.76±2.95ab蒸干醇提浸膏40.87±0.49c1.73±0.02ab1.28±0.01a65.67±2.31a58.27±4.37b鲜干水提浸膏43.40±0.65b1.57±0.03b1.24±0.04b65.33±3.06a65.34±4.54ab鲜干醇提浸膏41.00±0.73c1.90±0.16a1.29±0.06c66.33±3.05a67.84±3.78a
注:同列右肩不同的小写字母表示具有显著差异(P <0.05)(下同)。

图1 不同预处理黄花菜水提与醇提浸膏样品
Fig.1 Samples of water and alcohol extracts of daylily with different pre-treatments
注:从左到右依次为蒸干水提浸膏、蒸干醇提浸膏、鲜干水提浸膏和鲜干醇提浸膏,每个样品2个。
2.2 不同预处理黄花菜水提与醇提浸膏的营养成分
不同预处理黄花菜水提与醇提浸膏的营养成分分析如表4所示,4种黄花菜浸膏在总糖、还原糖、多酚、黄酮等营养成分上具有显著的差异(P<0.05)。在4种黄花菜浸膏中其总糖的含量较高,为47.90~64.40 g/100 g,其中,鲜干水提浸膏的总糖含量最高,达到了64.40 g/100 g。
糖类是生命体的基本组成部分和重要营养物质,也是黄花菜中的重要风味成分和营养成分[21]。酚类化合物作为植物的次生代谢物,广泛存在于水果和蔬菜中。它们具有抗氧化、抗炎和其他各种生物作用,可以预防多种疾病,包括心血管疾病和癌症。酚类化合物一般主要含有两类成分:类黄酮类和非类黄酮类[22]。黄花菜中的多酚和黄酮含量较低,4种黄花菜浸膏中多酚含量为0.15~0.50 g/100 g,黄酮含量为0.06~0.20 g/100 g。蒸干黄花菜浸膏中的维生素C含量显著高于鲜干黄花菜浸膏,黄花菜浸膏中类胡萝卜素的含量较低,为0.01~0.08 g/100 g,其中蒸干醇提浸膏的类胡萝卜素的含量最高,为0.08 g/100 g。
表4 不同预处理黄花菜水提与醇提浸膏的营养组成
Table 4 Nutrient composition of water and alcohol extracts of daylily with different pre-treatments

种类总糖/(g/100 g)还原糖/(g/100 g)多酚/(g/100 g)黄酮/(g/100 g)维生素C/(mg/kg)类胡萝卜素/(g/100 g)蒸干水提浸膏58.20±1.10b31.10±0.90c0.42±0.02b0.06±0.01c0.37±0.70b0.01b蒸干醇提浸膏47.90±0.40c39.40±0.60a0.50±0.03a0.16±0.02b0.84±0.73a0.08±0.01a鲜干水提浸膏64.40±0.70a31.70±0.50c0.15±0.01d0.16±0.02b0.05±0.01c0.01b鲜干醇提浸膏48.30±0.80c37.60±0.40b0.21±0.01c0.20±0.02a0.05±0.02c0.02±0.01b
2.3 不同预处理黄花菜水提与醇提浸膏中单糖含量及组成
表5所示的是不同预处理黄花菜水提与醇提浸膏的各单糖含量,黄花菜浸膏中糖类成分在不断发生变化,多糖可以部分转化为低聚糖,进一步水解为二糖和单糖,其中,蔗糖是二糖,可进一步水解为葡糖糖和果糖[23]。
由表5可以看出,蒸干黄花菜水醇提浸膏中果糖含量较高,分别为9.05、10.76 g/100 g;鲜干黄花菜水醇提浸膏中蔗糖含量较高,分别为16.14、19.68 g/100 g,且鲜干黄花菜浸膏中的果糖和蔗糖含量均大于蒸干黄花菜浸膏。乳糖在4种黄花菜浸膏中均未检出。麦芽糖在醇提黄花菜浸膏中的含量要高于水提浸膏,其中鲜干醇提浸膏的麦芽糖含量最高,为0.94 g/100 g。果糖、葡萄糖、蔗糖和麦芽糖这4种糖的总量在鲜干醇提黄花菜浸膏中的含量最高,为40.98 g/100 g,占总糖含量的84.3%,这说明黄花菜中的糖主要以单糖的形式存在。
表5 不同预处理黄花菜水提与醇提浸膏中单糖的含量
Table 5 The content of monosaccharide in water and alcohol extracts of daylily with different pre-treatments
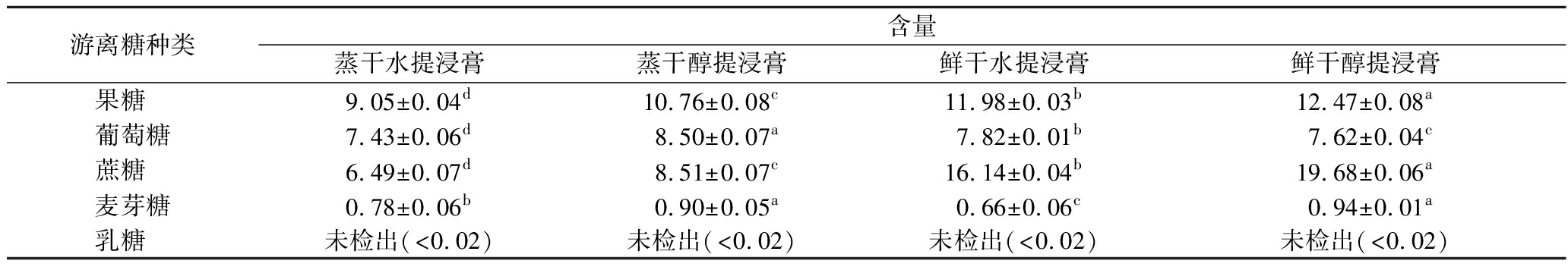
游离糖种类含量蒸干水提浸膏蒸干醇提浸膏鲜干水提浸膏鲜干醇提浸膏果糖 9.05±0.04d10.76±0.08c11.98±0.03b12.47±0.08a葡萄糖7.43±0.06d8.50±0.07a7.82±0.01b7.62±0.04c蔗糖 6.49±0.07d8.51±0.07c16.14±0.04b19.68±0.06a麦芽糖0.78±0.06b0.90±0.05a0.66±0.06c0.94±0.01a乳糖 未检出(<0.02)未检出(<0.02)未检出(<0.02)未检出(<0.02)
2.4 不同预处理黄花菜水提与醇提浸膏中游离氨基酸的含量及组成
氨基酸不仅可以促进蛋白质合成用于多种生理活动,同样也是重要的呈味物质,根据游离氨基酸的呈味规律不同,将其分为鲜味、甜味和芳香族氨基酸等。其中天冬氨酸、谷氨酸呈现出很强的鲜味,丙氨酸、甘氨酸、丝氨酸和脯氨酸表现出醇厚的甜味,芳香族氨基酸包括苯丙氨酸与酪氨酸[24]。表6所示的是黄花菜浸膏中17种游离氨基酸的含量,由表6可知,4种黄花菜浸膏中苏氨酸、谷氨酸和丙氨酸的含量较高,且在鲜干黄花菜浸膏中的含量要明显高于蒸干黄花菜浸膏。其中苏氨酸能够维持体内氨基酸平衡,对治疗抑郁症有一定效果[25],谷氨酸具有降血压、抑制动脉粥样硬化等作用[26],丙氨酸具有促进肌肉生长,增强免疫力的作用。总体来看,这17种氨基酸的总量在鲜干黄花菜浸膏中较高,最高的为鲜干水提浸膏,为1.585 g/100 g。且在4种黄花菜浸膏中鲜干水提浸膏的呈味氨基酸含量最高,达到了0.920 g/100 g,占总氨基酸含量的58.4%,更好地保持了黄花菜的风味。
表6 不同预处理黄花菜水提与醇提浸膏中17种游离氨基酸含量 单位:g/100 g
Table 6 Content of 17 free amino acids in water and alcohol extracts of daylily with different pre-treatments

项目样品蒸干水提浸膏蒸干醇提浸膏鲜干水提浸膏鲜干醇提浸膏天冬氨酸(Asp)0.023±0.002c0.029±0.001b0.055±0.003a0.051±0.002a苏氨酸(Thr)0.090±0.001c0.143±0.005b0.250±0.010a0.153±0.003b丝氨酸(Ser)0.033±0.003b0.046±0.005b0.143±0.011a0.130±0.004a谷氨酸(Glu)0.082±0.002d0.111±0.002c0.256±0.015a0.211±0.003b甘氨酸(Gly)0.011c0.014±0.002c0.043±0.004a0.035±0.003b丙氨酸(Ala)0.063±0.001d0.113±0.015c0.190±0.003b0.220±0.020a胱氨酸(Cys)0.005c0.004c 0.020±0.001 3a0.012±0.001b缬氨酸(Val)0.021±0.002c0.032±0.002b0.091±0.002a0.092±0.002a蛋氨酸(Met)——0.017±0.001a0.013±0.003a异亮氨酸(IIe)0.013±0.004c0.016±0.001c0.051±0.002a0.043±0.001b亮氨酸(Leu)0.017±0.002c0.027±0.001c0.064±0.003a0.052±0.002b酪氨酸(Tyr)0.031±0.002d0.055±0.003c0.089±0.003a0.072±0.001b苯丙氨酸(Phe)0.009d0.008c0.014±0.002a—赖氨酸(Lys)0.019±0.001d0.013±0.001c0.052±0.003a0.019±0.003b组氨酸(His)0.003d0.004c0.024±0.001a0.017±0.001b精氨酸(Arg)0.028±0.003c0.027±0.001c0.077±0.006a0.045±0.004b脯氨酸(Pro)0.044±0.001c0.071±0.002b0.130±0.015a0.143±0.003a总量0.497±0.010d0.719±0.011c1.585±0.058a1.313±0.029b
2.5 不同预处理黄花菜水提与醇提浸膏电子鼻结果分析
不同预处理黄花菜水提与醇提浸膏的电子鼻雷达图如图2所示,4种黄花菜浸膏在W2W(芳香成分,对有机硫化物灵敏)、W5S(对氮氧化合物很灵敏)和W1W(对无机硫化物灵敏)处的响应值较高,分别为19.78~51.35、14.54~33.78和18.03~33.80。由此可知,不同预处理黄花菜水提与醇提浸膏的主要风味物质包括芳香类物质、氮氧化合物和无机硫化合物,其对黄花菜浸膏风味品质的形成具有重要作用,因此与这些风味成分对应的传感器响应值可以作为区分预处理黄花菜水提与醇提浸膏风味品质的主要指标。
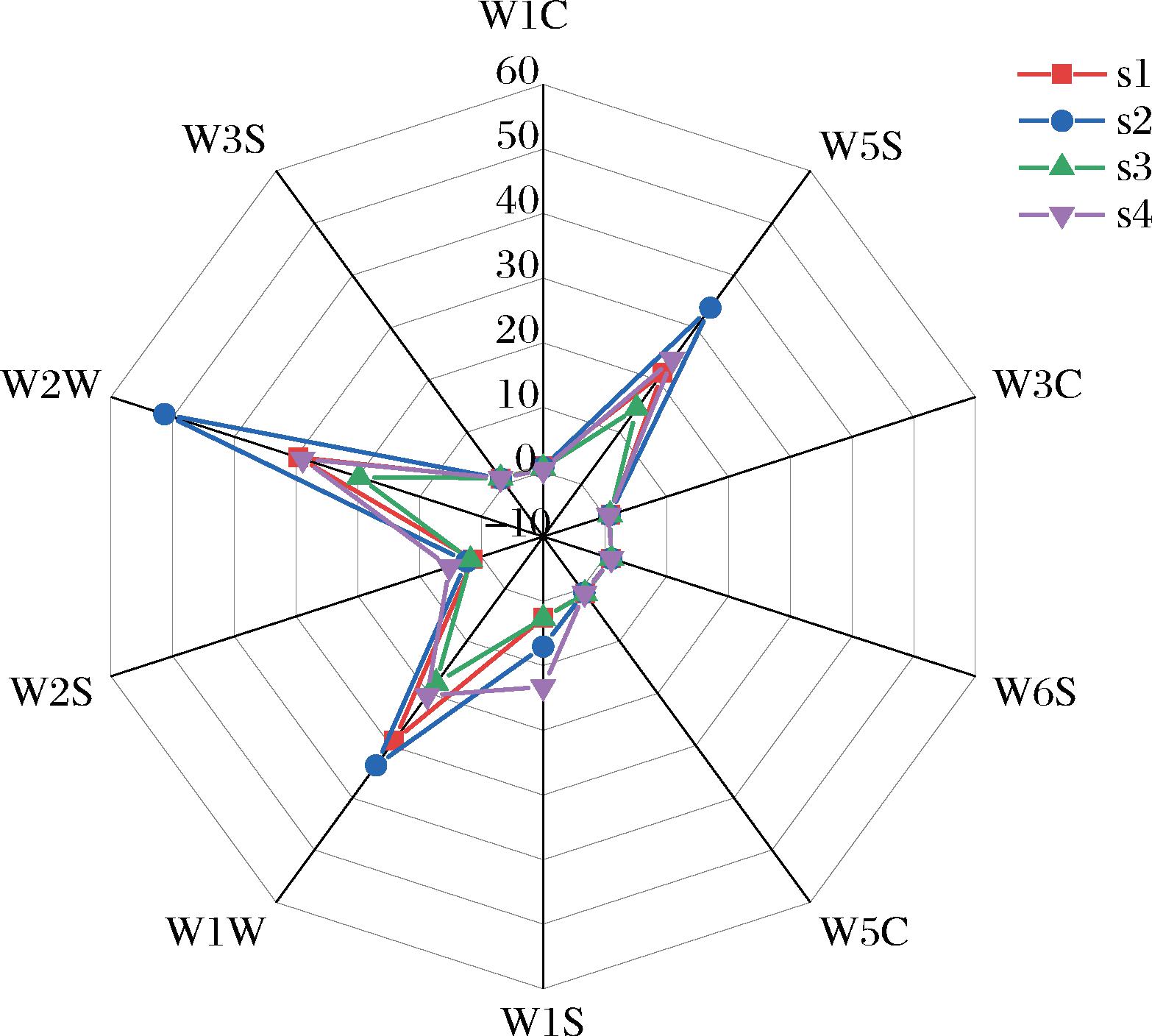
图2 不同预处理黄花菜水提与醇提浸膏的电子鼻雷达图
Fig.2 Electronic nose radar images of water and alcohol extracts of different pre-treatment methods for daylily
注:s1,蒸干水提浸膏;s2,蒸干醇提浸膏;s3,鲜干水提浸膏;s4,鲜干醇提浸膏。
2.6 不同预处理黄花菜水提与醇提浸膏风味结果分析
图3显示了不同浓度的黄花菜浸膏在酸味、甜味、咸味、丰富性、鲜味、涩味回味、苦味回味、涩味和苦味上的差异,图中的坐标轴代表滋味的强度。由图3-a、图3-c中可以看出,不同浓度的蒸干黄花菜浸膏在甜味和丰富性上差异最显著,质量浓度5 g/L的蒸干水提浸膏具有最高的甜味值,质量浓度20 g/L的蒸干醇提浸膏甜味值最低。随着质量浓度的增加,丰富性也逐渐增强,在质量浓度100 g/L下达到最大值16.98。图3-b显示的是不同浓度鲜干黄花菜浸膏的味觉值,其中,不同浓度的鲜干黄花菜浸膏在甜味上差异最显著,质量浓度5 g/L的醇提浸膏甜味值高达13.39,这可能与黄花菜中含有较多的糖类化合物有关[27]。质量浓度20 g/L浓度的水提浸膏的鲜味值也较高,达到11.09,有研究表明,可能是由于含有较高浓度的核苷酸、氨基酸等鲜味贡献物质[28]。然而,不同浓度黄花菜浸膏的酸味值较小,最小的酸味值达到-28.33,而苦味、涩味、苦味回味、涩味回味差异不显著。总体来看,与蒸干黄花菜浸膏相比,鲜干黄花菜浸膏具有更好的滋味,且在鲜干黄花菜中,醇提浸膏的滋味要比水提浸膏好,这可能是鲜干醇提黄花菜浸膏中的呈味物质含量高的原因,这与之前游离氨基酸的含量和种类及单糖含量高的研究结果一致。
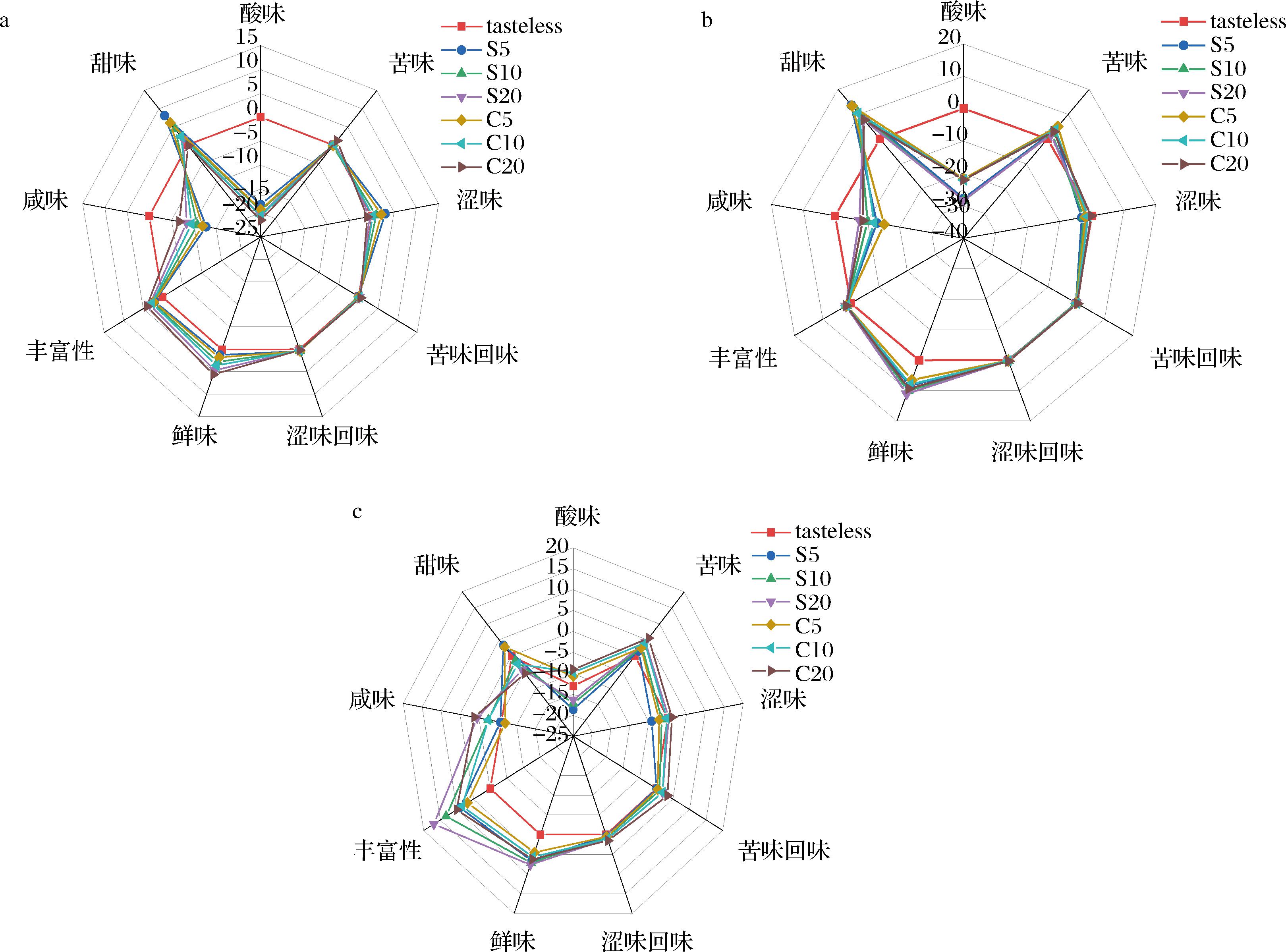
a、b-不同质量浓度的蒸干黄花菜浸膏,其中S代表水提浸膏,C代表醇提浸膏,5、10、20、50、100代表不同质量浓度的黄花菜浸膏;c-不同质量浓度的鲜干黄花菜浸膏
图3 不同预处理黄花菜水提与醇提浸膏的电子舌雷达图
Fig.3 Electronic tongue radar images of water and alcohol extracts of daylily with different pre-treatments
2.7 不同预处理黄花菜水提与醇提浸膏GC-IMS结果分析
2.7.1 不同黄花菜水提与醇提浸膏的挥发性有机物定性分析
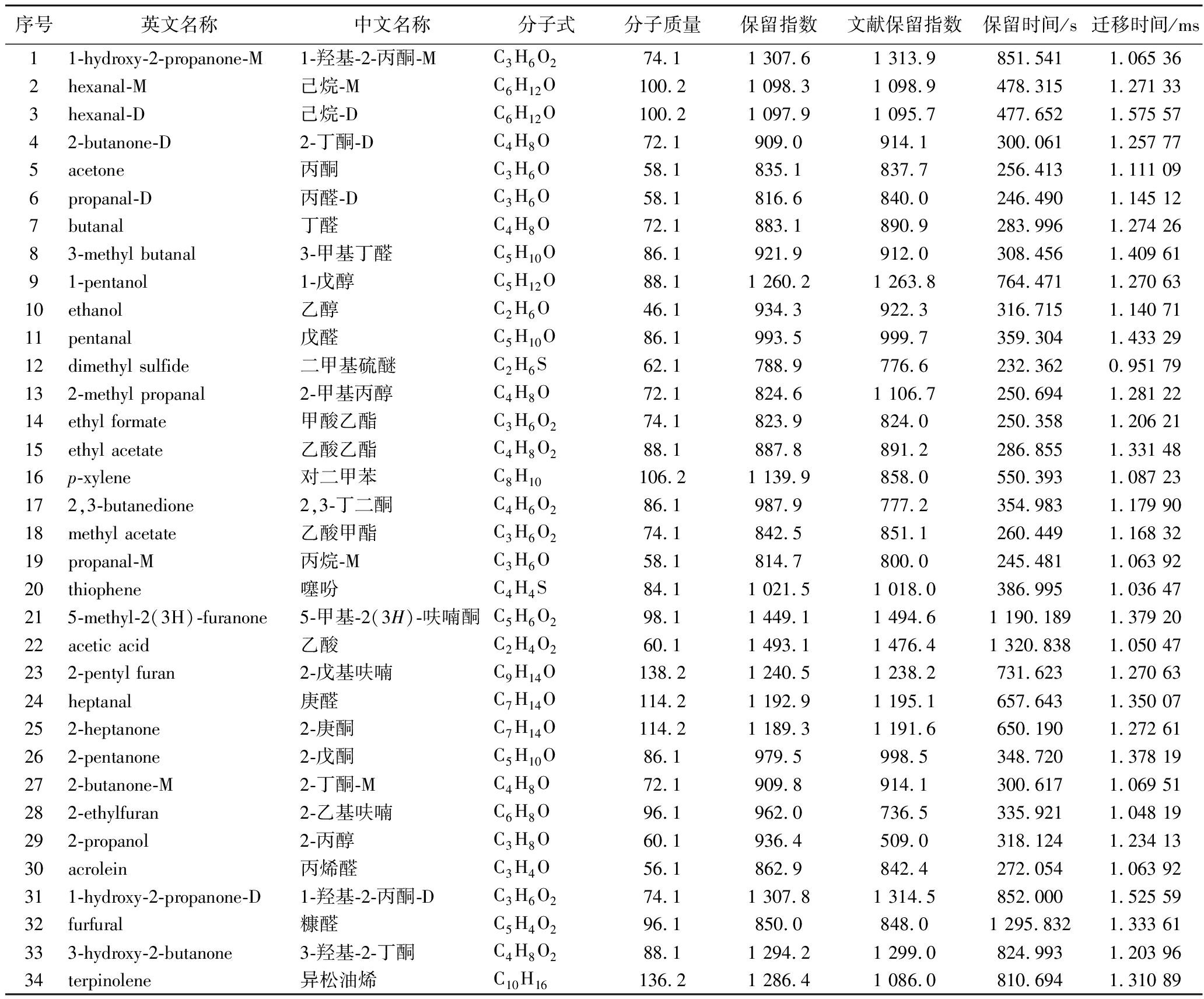
挥发性化合物对浸膏风味特征的形成以及风味品质的改善具有不可忽视的作用效果,且与消费者的喜好以及市场需求之间联系密切。因此,本研究进一步对不同预处理黄花菜水提与醇提浸膏进行了GC-IMS分析,对浸膏中的挥发性化合物进行了定性分析。根据数据库共检出42种挥发性成分,定性检出34种有机化合物,主要包括10种酮类、7种醛类、4种醇类、3种烷类、3种酯类、2种呋喃类、1种醚类、1种噻吩类、1种酸类、1种苯类、1种烯类,具体化合物种类如表7所示。短链酮类具有脂香和焦香香气,长链酮则呈现花香气息[29]。醛类物质其气味阈值较低,具有青草香味,对总体挥发性的贡献较大,主要通过脂肪的氧化和降解反应产生[30-31]。酯类物质会赋予食品甜香气味和轻微油脂气味,即使在很低的浓度条件下也对食品的香味起着非常重要的作用[32]。可见黄花菜浸膏呈现的风味并不是某一种特定化合物提供,而是由酮类、醛类、醇类、烷烃类,酯类和其他等众多挥发性化合物作用人的感觉器官产生。
2.7.2 不同预处理黄花菜水提与醇提浸膏挥发性成分的主成分分析
为进一步对黄花菜水提与醇提浸膏样品的香气特征进行分类,采用PCA对不同预处理方式制备的黄花菜浸膏样品进行分析,结果如图4所示。第一主成分PC1的贡献率为55.9%,第二主成分PC2的贡献率为26.0%,累计方差贡献率达到81.9%,表明这2个主成分能很好地反映原始数据信息,可以反映样品香气的整体信息。图4中各组分离明显,各样品间相互聚集,这说明样品间的风味成分具有一定的差异,且各样品间重复性良好。说明PCA法可以对其进行有效区分。其中s1和s3较接近,s2和s4较接近,且部分样品与主成分有一定的相关性,s3样品与PC1呈正相关,s2与PC2呈正相关。
2.7.3 不同预处理黄花菜水提与醇提浸膏挥发性风味物质偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)及模型验证
通过偏最小二乘判别分析法对4种黄花菜浸膏中的挥发性有机化合物进行分析,得到了浸膏样品的PLS-DA得分图(图5-a),与主成分分析结果一致,不同黄花菜浸膏样品得到了明显的区分。以34种化合物为x变量,4种黄花菜浸膏为y变量,进行PLS-DA相关模型的建立,经过置换检验对PLS-DA所做的模型进行验证,从图5-b中可以看出,2条回归线斜率较大,该模型具有较好的预测能力,无过拟合现象,确定本模型可用于研究4种黄花菜浸膏中的挥发性风味物质分类判别。
表7 不同预处理黄花菜水提与醇提浸膏挥发性成分定性分析
Table 7 Qualitative analysis of volatile components in water and alcohol extracts of daylily with different pre-treatments
序号英文名称中文名称分子式分子质量保留指数文献保留指数保留时间/s迁移时间/ms11-hydroxy-2-propanone-M1-羟基-2-丙酮-MC3H6O274.11 307.61 313.9851.5411.065 362hexanal-M己烷-MC6H12O100.21 098.31 098.9478.3151.271 333hexanal-D己烷-DC6H12O100.21 097.91 095.7477.6521.575 5742-butanone-D2-丁酮-DC4H8O72.1909.0914.1300.0611.257 775acetone丙酮C3H6O58.1835.1837.7256.4131.111 096propanal-D丙醛-DC3H6O58.1816.6840.0246.4901.145 127butanal丁醛C4H8O72.1883.1890.9283.9961.274 2683-methyl butanal3-甲基丁醛C5H10O86.1921.9912.0308.4561.409 6191-pentanol1-戊醇C5H12O88.11 260.21 263.8764.4711.270 6310ethanol乙醇C2H6O46.1934.3922.3316.7151.140 7111pentanal戊醛C5H10O86.1993.5999.7359.3041.433 2912dimethyl sulfide二甲基硫醚C2H6S62.1788.9776.6232.3620.951 79132-methyl propanal2-甲基丙醇C4H8O72.1824.61 106.7250.6941.281 2214ethyl formate甲酸乙酯C3H6O274.1823.9824.0250.3581.206 2115ethyl acetate乙酸乙酯C4H8O288.1887.8891.2286.8551.331 4816p-xylene对二甲苯C8H10106.21 139.9858.0550.3931.087 23172,3-butanedione2,3-丁二酮C4H6O286.1987.9777.2354.9831.179 9018methyl acetate乙酸甲酯C3H6O274.1842.5851.1260.4491.168 3219propanal-M丙烷-MC3H6O58.1814.7800.0245.4811.063 9220thiophene噻吩C4H4S84.11 021.51 018.0386.9951.036 47215-methyl-2(3H)-furanone5-甲基-2(3H)-呋喃酮C5H6O298.11 449.11 494.61 190.1891.379 2022acetic acid乙酸C2H4O260.11 493.11 476.41 320.8381.050 47232-pentyl furan2-戊基呋喃C9H14O138.21 240.51 238.2731.6231.270 6324heptanal庚醛C7H14O114.21 192.91 195.1657.6431.350 07252-heptanone2-庚酮C7H14O114.21 189.31 191.6650.1901.272 61262-pentanone2-戊酮C5H10O86.1979.5998.5348.7201.378 19272-butanone-M2-丁酮-MC4H8O72.1909.8914.1300.6171.069 51282-ethylfuran2-乙基呋喃C6H8O96.1962.0736.5335.9211.048 19292-propanol2-丙醇C3H8O60.1936.4509.0318.1241.234 1330acrolein丙烯醛C3H4O56.1862.9842.4272.0541.063 92311-hydroxy-2-propanone-D1-羟基-2-丙酮-DC3H6O274.11 307.81 314.5852.0001.525 5932furfural糠醛C5H4O296.1850.0848.01 295.8321.333 61333-hydroxy-2-butanone3-羟基-2-丁酮C4H8O288.11 294.21 299.0824.9931.203 9634terpinolene异松油烯C10H16136.21 286.41 086.0810.6941.310 89
注:表中M和D分别代表该物质的单体和二聚体。
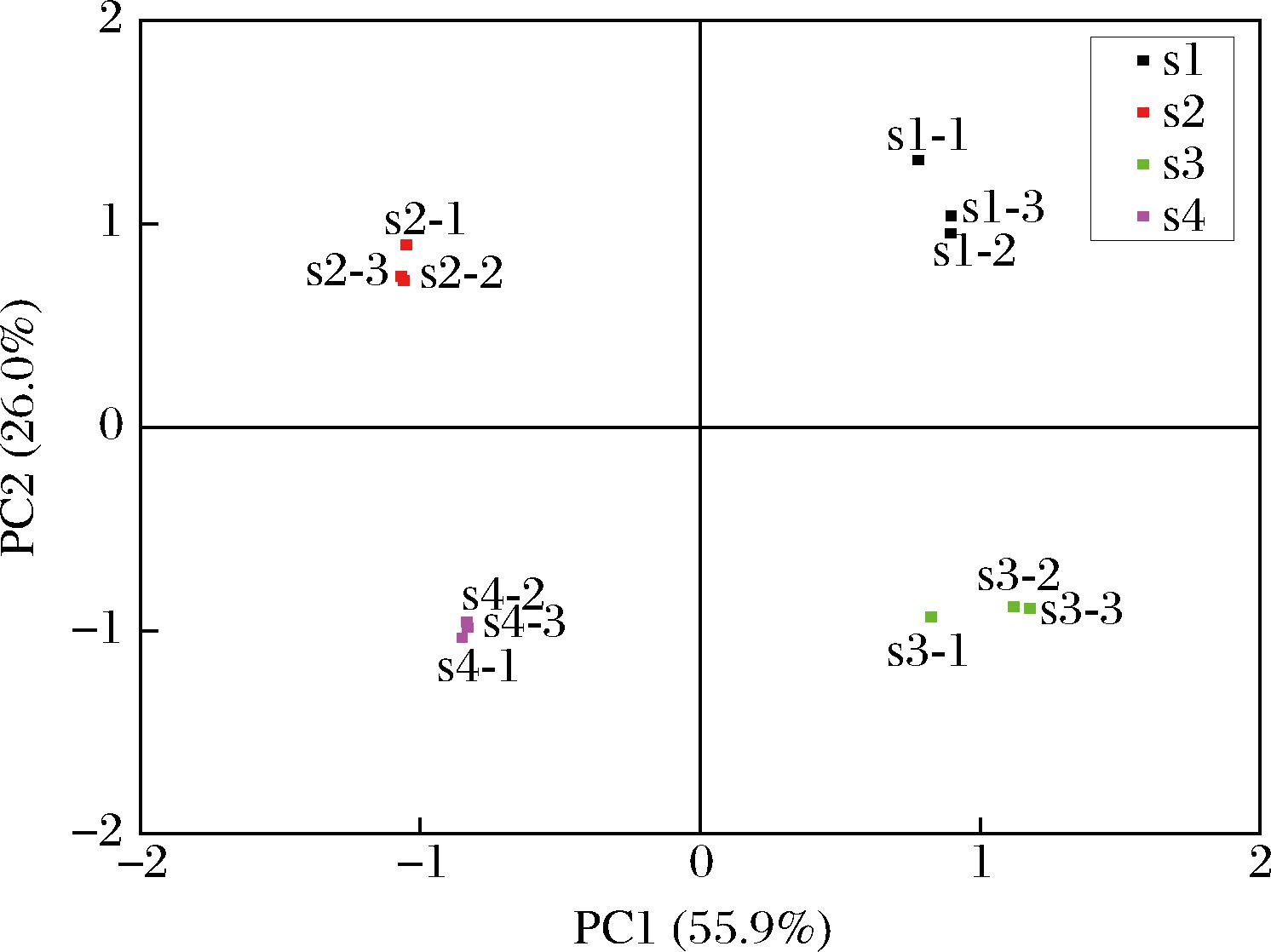
图4 不同预处理黄花菜水提与醇提浸膏的PCA图
Fig.4 PCA of water and alcohol extracts of daylily with different pre-treatments
注:s1,蒸干水提浸膏;s2,蒸干醇提浸膏;s3,鲜干水提浸膏;s4,鲜干醇提浸膏。
为了进一步表征4种黄花菜浸膏中具有显著差异的挥发性化合物,从34种挥发性化合物中筛选出17种变量投影重要性(variable importance in projection,VIP)值>1的关键差异化合物,可以有效区分4种黄花菜浸膏。如图5-c所示,分别为乙酸(VIP=1.42)、糠醛(VIP=1.29)、对二甲苯(VIP=1.23)、己烷-M(VIP=1.21)、2-庚酮(VIP=1.18)、3-羟基-2-丁酮(VIP=1.15)、戊醛(VIP=1.15)、噻吩(VIP=1.10)、二甲基硫醚(VIP=1.08)、异松油烯(VIP=1.08)、5-甲基-2(3H)-呋喃酮(VIP=1.06)、庚醛(VIP=1.04)、丙醛-D(VIP=1.04)、丁醛(VIP=1.04)、2-戊基呋喃(VIP=1.04)、己烷-D(VIP=1.03)、1-羟基-2-丙酮-M(VIP=1.02)。
为了进一步直观地区分不同预处理黄花菜水提与醇提浸膏中关键性的差异物与感官指标之间的关系,对以上17种成分相对含量结合感官评价结果进行Person相关性分析,并绘制热图,如图6所示,己烷-D、丁醛、庚醛、5-甲基-2(3H)-呋喃酮、2-庚酮、己烷-M与传感器W1C和W1W存在显著正相关(P<0.05),与传感器W6S和W3S存在显著负相关(P<0.05),且糠醛与传感器W1C、W1W和W2W存在显著正相关(P<0.05)。综上可以看出,这17种挥发性成分相互协同或拮抗共同影响了黄花菜浸膏挥发油的香气特征,大多数挥发性成分与W1C和W1W呈正相关,与W6S和W3S负相关,其中醛类和酮类化合物是影响黄花菜浸膏香气强度最主要的挥发性成分。

a-挥发性有机物的得分图;b-PLS-DA 拟合曲线;c-VIP 值分布
图5 四种黄花菜浸膏中挥发性有机物的得分图、PLS-DA拟合曲线及VIP 值分布
Fig.5 Score chart, PLS-DA fitting curve, and VIP value distribution of volatile organic compounds in four types of daylily extracts
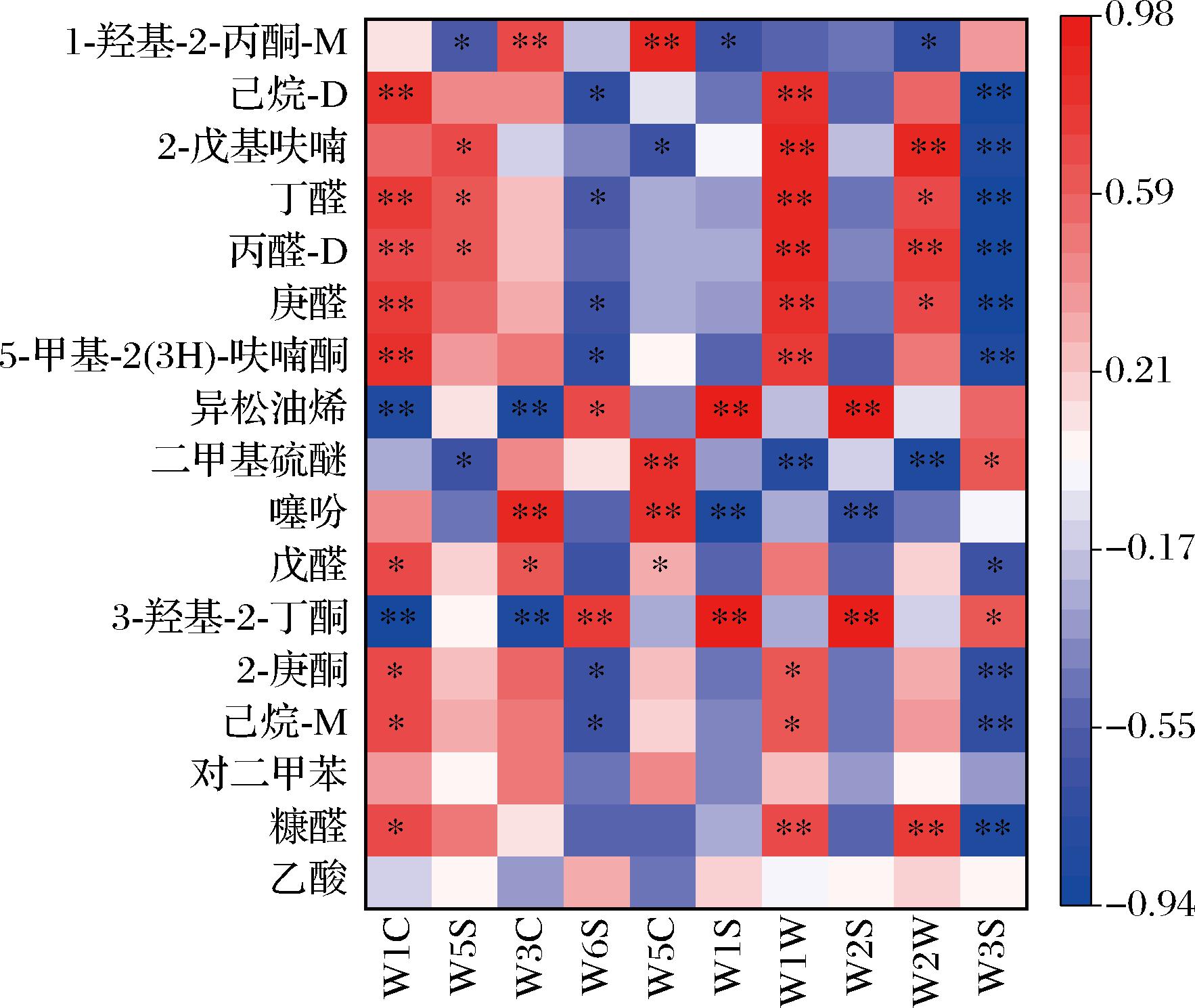
图6 不同预处理黄花菜水提与醇提浸膏中关键性差异物和电子鼻的相关性热图
Fig.6 Correlation heatmap of key foreign substances and electronic nose in water and alcohol extracts of daylily with different pre-treatment methods
注:*表示差异显著(P <0.05),**表示差异极显著(P <0.01)。
2.8 感官评价
图7显示了不同预处理黄花菜水提与醇提浸膏不同浓度样品的感官评价。其中图7-a显示了不同浓度黄花菜浸膏的强度综合评分,各浓度下的鲜干黄花菜浸膏比蒸干黄花菜浸膏的整体综合强度评分高,且随着质量浓度的增加,总强度评分也逐步提高,当质量浓度达到100 g/L时,鲜干水提和醇提黄花菜浸膏的整体综合强度评分最高,为8.7分。而在蒸干黄花菜浸膏中总强度评分与浸膏浓度的关系并不显著,无明显的量化关系。图7-b所示的是不同黄花菜水醇提浸膏的喜好性评价分值,由图7-b可以看出,4种浸膏样品中鲜干黄花菜浸膏比蒸干黄花菜浸膏更受喜爱,鲜干醇提浸膏比水提浸膏更受喜爱。鲜干醇提黄花菜浸膏(质量浓度100 g/L)色泽均匀,具有鲜黄花菜特有的青草香味,无涩味,甜味浓郁,这主要是因为该浸膏富含糖类物质和呈味氨基酸,且芳香类物质含量高,用于黄花菜新产品的开发较为理想。

a-强度综合评价得分图;b-喜好性得分图
图7 不同预处理黄花菜水提与醇提浸膏的强度综合评价得分图与喜好性得分图
Fig.7 Acceptance evaluation scores and preference scores of water and alcohol extracts of daylily with different pretreatments
3 结论
本文对不同预处理黄花菜水提与醇提浸膏的理化特性、营养成分、游离糖和氨基酸的种类和含量进行了系统分析,结果表明,4种黄花菜浸膏在总糖、还原糖、多酚、可滴定酸等营养成分上具有显著的差异(P<0.05)。在4种黄花菜浸膏中其总糖的含量较高,为47.90~64.40 g/100 g,多酚含量为0.15~0.50 g/100 g,黄酮含量为0.06~0.20 g/100 g。并进一步采用靶向代谢组学技术对果糖、葡萄糖、蔗糖、麦芽糖和乳糖进行定性定量分析,发现果糖、葡萄糖、蔗糖和麦芽糖这4种糖的总量在鲜干醇提黄花菜浸膏中的含量最高,为40.98 g/100 g,占总糖含量的84.30%。17种氨基酸的总量在鲜干水提浸膏最高,达到了1.585 g/100 g。电子鼻分析表明,黄花菜水醇提浸膏中芳香类物质、氮氧化合物、无机硫化合物含量丰富。电子舌味觉强度差异较大,在质量浓度5 g/L下4种黄花菜浸膏的甜味值最大。通过GC-IMS共定性检出34种有机化合物,通过VIP值进一步筛选出17种对有效区分4种黄花菜浸膏中发挥关键作用的特征标志物,结合感官评价发现,质量浓度100 g/L的鲜干黄花菜醇提浸膏可接受度高,感官评价最佳,可进一步用于黄花菜新产品的开发。
[1] RAMOS M, CARVALHO R, SOARES DA SILVA E, et al.Pathological and epidemiological characterization of first outbreak of daylily rust in Europe and evaluation of Puccinia hemerocallidis resistance in Hemerocallis cultivars[J].Plants, 2020, 9(4):427.
[2] 刘佩冶, 李可昕, 张超凡, 等.黄花菜生物活性成分及功能研究进展[J].食品与发酵工业, 2022, 48(12):330-336.
LIU P Y, LI K X, ZHANG C F, et al.Research progress on bioactive components and functions of daylily[J].Food and Fermentation Industries, 2022, 48(12):330-336.
[3] LIU W, ZHANG J H, ZHANG Q, et al.Effects of postharvest chilling and heating treatments on the sensory quality and antioxidant system of daylily flowers[J].Horticulture, Environment, and Biotechnology, 2018, 59(5):671-685.
[4] 楚倩倩, 任广跃, 段续, 等.不同预处理方式对热风干燥黄花菜褐变及干燥特性的影响[J].食品科学, 2023, 44(7):81-88.
CHU Q Q, REN G Y, DUAN X, et al.Effects of different pretreatment methods on browning and drying characteristics of hot air-dried daylily buds[J].Food Science, 2023, 44(7):81-88.
[5] 秦喜悦, 张雷, 温艳斌, 等.黄花菜营养活性研究进展[J].食品研究与开发, 2022, 43(5):204-209.
QIN X Y,ZHANG L,WEN Y B,et al.Advances in research on nutritional activities of important functional components of Hemerocallis citrina baroni[J].Food Research and Development, 2022, 43(5):204-209.
[6] LIM T K.Edible Medicinal and Non-Medicinal Plants:Volume 8, Flowers[M].Dordrecht:Springer Netherlands, 2014:822-829.
[7] HSU L M, CHEN H W, WU P C, et al.Daylily (Hemerocallis fulva Linn.) flowers improve sleep quality in human and reduce nitric oxide and interleukin-6 production in macrophages[J].Chinese Journal of Physiology, 2023, 66(5):313-325.
[8] WU W T, MONG M C, YANG Y C, et al.Aqueous and ethanol extracts of daylily flower (Hemerocallis fulva L.) protect HUVE cells against high glucose[J].Journal of Food Science, 2018, 83(5):1463-1469.
[9] LIN Y L, LU C K, HUANG Y J, et al.Antioxidative caffeoylquinic acids and flavonoids from Hemerocallis fulva flowers[J].Journal of Agricultural and Food Chemistry, 2011, 59(16):8789-8795.
[10] HAO Z L, LIANG L, LIU H, et al.Exploring the extraction methods of phenolic compounds in daylily (Hemerocallis citrina Baroni) and its antioxidant activity[J].Molecules, 2022, 27(9):2964.
[11] 张腊腊, 胡浩斌, 韩明虎, 等.响应面优化黄花菜多酚提取工艺及其抗氧化活性研究[J].中国食品添加剂, 2023, 34(2):102-108.
ZHANG L L, HU H B, HAN M H, et al.Optimization of polyphenol extraction from Hemerocallis fulva with response surface methodology and its antioxidant activity[J].China Food Additives, 2023, 34(2):102-108.
[12] 杨双喜, 马雪梅, 张海红, 等.GC-MS结合化学计量法分析不同干燥方式对黄花菜风味物质的影响[J].食品与发酵工业, 2023, 49(4):274-281.
YANG S X, MA X M, ZHANG H H, et al.Analysis of effects of different drying methods on flavor substances of daylily using GC-MS combined with a stoichiometric method[J].Food and Fermentation Industries, 2023, 49(4):274-281.
[13] 马尧, 郝慧慧, 张海红, 等.GC-MS结合电子鼻分析不同干燥方式对黄花菜粉挥发性物质的影响[J].食品科学, 2022,43(6):324-330.
MA Y, HAO H H, ZHANG H H, et al.Effects of different drying methods on volatile avor components of daylily powder analyzed by gas chromatography-mass spectrometry combined with electronic nose[J].Food Science, 2022, 43(6):324-330.
[14] 李娟, 张璟琳, 卢斌斌, 等.天然食用香料浸膏中氨基酸的分析[J].中国食品添加剂, 2016,27(7):174-180.
LI J, ZHANG J L, LU B B, et al.Determination of amino acids in natural flavor concretes by acid hydrolysis method and amino acid analyzer[J].China Food Additives, 2016,27(7):174-180.
[15] 赵红霞, 王应强, 刘爱青, 等.预处理对热水浸提黄花菜浸膏粉营养组成及生物活性影响研究[J].中国食品添加剂, 2023, 34(1):101-109.
ZHAO H X, WANG Y Q, LIU A Q, et al.Effect of pretreatment on nutrition composition and bioactivities of daylily extract powder by hot water extraction[J].China Food Additives, 2023, 34(1):101-109.
[16] GAO H, LIU M K, ZHENG L L, et al.Comparative analysis of key odorants and aroma characteristics in hot-pressed yellow horn (Xanthoceras sorbifolia bunge) seed oil via gas chromatography-ion mobility spectrometry and gas chromatography-olfactory-mass spectrometry[J].Foods, 2023, 12(17):3174.
[17] YANG F, LIU Y, WANG B, et al.Screening of the volatile compounds in fresh and thermally treated watermelon juice via headspace-gas chromatography-ion mobility spectrometry and comprehensive two-dimensional gas chromatography-olfactory-mass spectrometry analysis[J].LWT, 2021, 137:110478.
[18] XU Y, HUANG T R, HUANG Y Q, et al.Effect of mulberry leaf (Morus alba L.) extract on the quality and formation of heterocyclic amines in braised muscovy duck[J].Food Control, 2024, 156:110137.
[19] SELESHE S, AMEER A, KANG S N.Exploration of the antioxidant chemical constituents and cntioxidant performance of various solvent extracts of eighteen plants[J].Preventive Nutrition and Food Science, 2022, 27(2):212-222.
[20] LIU X M, LIU Y, SHAN C H, et al.Effects of five extraction methods on total content, composition, and stability of flavonoids in jujube[J].Food Chemistry:X, 2022, 14:100287.
[21] 孔滢, 王欢, 郎利新, 等.不同百合样品中13种内源性游离糖的含量分析[J].食品科学, 2021, 42(10):249-254.
KONG Y, WANG H, LANG L X, et al.Analysis of the contents of 13 intrinsic free sugars in different lily samples[J].Food Science, 2021, 42(10):249-254.
[22] BRGLEZ MOJZER E, KNEZ ![]() M,
M,  KERGET M, et al.Polyphenols:Extraction methods, antioxidative action, bioavailability and anticarcinogenic effects[J].Molecules, 2016, 21(7):901.
KERGET M, et al.Polyphenols:Extraction methods, antioxidative action, bioavailability and anticarcinogenic effects[J].Molecules, 2016, 21(7):901.
[23] 吴永剑, 张超, 周丽娟, 等.不同干燥温度对潞党参药材中游离糖及多糖的影响[J].时珍国医国药, 2022, 33(1):121-124.
WU Y J, ZHANG C, ZHOU L J, et al.Effects of different drying temperatures on the contents of free sugars and polysaccharides in Codonopsi[J].Lishizhen Medicine and Materia Medica Research, 2022, 33(1):121-124.
[24] 马尧. 不同干燥方式对黄花菜粉品质影响及喷雾干燥工艺优化[D].银川:宁夏大学, 2022.
MA Y.Influence of different drying methods on the quality of daylily power and optimization ospray drying process[D].Yinchuan:Ningxia University, 2022.
[25] NATHAN KOCHEN N, VASANDANI V, SEANEY D, et al.Threonine cavities are targetable motifs that control alpha-synuclein fibril growth[J].ACS Chemical Neuroscience, 2022, 13(17):2646-2657.
[26] 刘坤, 杨永学, 陈毛华.三种芡种仁营养成分和功能成分比较[J].湿地科学, 2023, 21(6):944-950.
LIU K, YANG Y X, CHEN M H.Comparison of nutritional and functional components of the kernel of three kinds of Euryale ferox[J].Wetland Science, 2023, 21(6):944-950.
[27] 权佳, 孙国栋, 张韵琦, 等.基于UPLC-Q-TOF-MS/MS法分析黄花菜的化学成分[J].中南药学, 2023, 21(3):637-646.
QUAN J, SUN G D, ZHANG Y Q, et al.Chemical constituents in Hemerocallis citrina Borani by UPLC-Q-TOF-MS/MS[J].Central South Pharmacy, 2023, 21(3):637-646.
[28] OR-RASHID M M, ODONGO N E, SUBEDI B, et al. Fatty acid composition of yak (Bos grunniens) cheese including conjugated linoleic acid and trans-18:1 fatty acids[J]. Journal of Agricultural and Food Chemistry, 2008, 56(5):1654-1660.
[29] 包陈力根, 关淳博, 辛明航, 等.HS-SPME-GC-MS结合电子鼻分析烘烤对大球盖菇挥发性风味物质的影响[J].食品科学, 2022, 43(14):226-233.
BAO C, GUAN C B, XIN M H, et al.Effect of roasting on volatile flavor compounds of Stropharia rugoso-annulata analyzed by headspace-solid phase microextraction-gas chromatography-mass spectrometry combined with electronic nose[J].Food Science, 2022, 43(14):226-233.
[30] 侯冉, 窦露, 任钦, 等.丁酸梭菌对小尾寒羊宰后成熟过程中挥发性风味物质的影响及机理研究[J].食品科学, 2023, 44(12):181-188.
HOU R, DOU L, REN Q, et al.Effect and mechanism of dietary supplementation of Clostridium butyricum on volatile flavor compounds in meat of small tailed-Han sheep during postmortem aging[J].Food Science, 2023, 44(12):181-188.
[31] HOU H, LIU C, LU X S, et al.Characterization of flavor frame in shiitake mushrooms (Lentinula edodes) detected by HS-GC-IMS coupled with electronic tongue and sensory analysis:Influence of drying techniques[J].Lwt, 2021, 146:111402.
[32] 贺超, 尹乐斌, 何攀, 等.基于SPME-GC-MS分析不同磨浆温度对神仙豆腐挥发性风味的影响[J].中国粮油学报, 2024, 39(3):151-158.
HE C, YIN L B, HE P, et al.Analysis of effect of different grinding temperatures on volatile flavor substances of fairy tofu based on SPME-GC-MS[J].Journal of the Chinese Cereals and Oils Association, 2024, 39(3):151-158.