肉苁蓉是一种草本植物,有“沙漠人参”的美誉,具有极高的食用价值且是药食同源的原料[1],于2019年11月被国家卫生计生委食品司列为药食同源物质[2]。药典中有记载肉苁蓉性味甘、咸,温,归肾、大肠经,具有补肾阳,益精血,润肠通便,缓解疲劳,抗衰老的功效[3-6];现代研究证明更是发现苯乙醇苷类、环烯醚萜类、木脂素类、生物碱、多糖等成分[7-9],这些成分经证实具有新陈代谢、提高记忆力等功能[10]。新鲜苁蓉水分和糖分含量较高,脱水速度慢,采用常规方法进行干制,耗时长且干制中多酚氧化酶的酶水解会造成果肉中苯乙醇苷等活性物质含量降低,果肉色泽发生褐变,降低果肉的经济价值[11-12]。因此,研究能够在不影响肉苁蓉色泽和活性成分含量的条件下,实现肉苁蓉的快速干燥,是目前亟待解决的科学问题。
肉苁蓉在不同含水量条件下,其显微组织特征,如细胞横截面、小孔截面等,均表现出与含水量有关的特征[13-16]。孔道是影响水分运移的重要因素,但目前关于肉苁蓉微观结构的相关研究没有报道。基于此,本文对肉苁蓉进行切片处理,根据实验条件分批次进行干燥,通过扫描电子显微镜(scanning electron microscope,SEM)获得肉苁蓉切片图像,探究不同干燥温度和切片厚度下的微观结构变化趋势,并确定对细胞影响较小的干燥参数。
1 材料与方法
1.1 原料
本文挑选无病虫害、无机械损伤、外表较光滑,整体粗细均匀,质地较为坚硬饱满,光泽鲜亮的肉苁蓉为实验对象,实验前置于4 ℃冰箱避光保存。
1.2 仪器与设备
FDU-2100真空冷冻干燥机,日本Tokyo Rikakikai公司;BXH-130S精密可程式烘箱,上海博迅医疗生物仪器有限公司;日立SU3500-冷冻扫描电镜,广州市仪德科学仪器有限公司;Apreo-2S扫描电镜,ThermoFisher公司;HistoCore MULTICUT 轮转式切片机,徕卡显微系统(上海)有限公司。
1.3 实验方法
根据前期大量预实验,发现肉苁蓉在长度上含水量、干燥特性和孔隙结构差别较大,本文选择肉苁蓉尖部(近细端1/2部分)为研究对象进行实验,根据其果肉形态不一,将其果肉部位分为金边和内果肉,如图1所示。
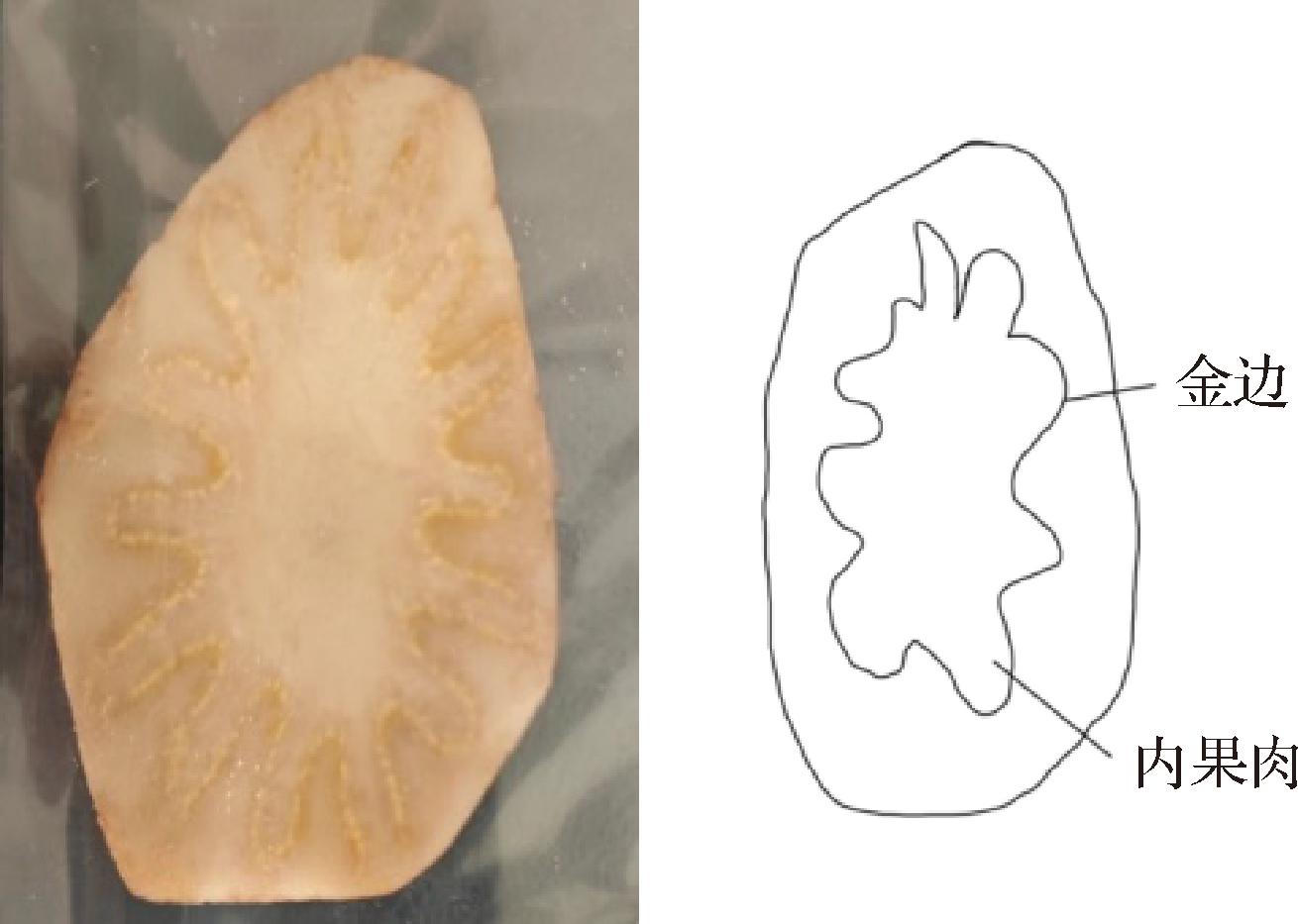
图1 肉苁蓉切片示意图
Fig.1 Schematic diagram of Cistanche slices
1.3.1 热风干燥
取新鲜肉苁蓉纵向切成不同厚度(4、5、6、7、8 mm)的薄片,均匀平铺在干燥盘上,分别设置不同的干燥温度(60、70、80、90、100 ℃)进行干燥,当水分含量<10%时,停止干燥。每组实验重复3次,取平均值作为结果。干燥后的产品冷却至室温后放入保鲜袋中真空贮存,进行下一组实验。
1.3.2 干制品制备与观察
在测干制肉苁蓉之前需要制样,对表面部分制样的方法是将电胶粘贴在样品台上,撕开导电胶,将样品粘贴在导电胶上;对截面部分制样的方法是用液氮脆断后,将断面朝上粘贴导电胶,将处理好的肉苁蓉样品块放入扫描电子显微镜观察台,调节扫描电镜的焦距,在内果肉1 000×、金边表面2 000×、金边截面4 000×放大倍数下对肉苁蓉块样品进行表面和截面形貌的观察。
1.3.3 新鲜样品准备与观察
在测新鲜肉苁蓉之前需要制样,对截面部分制样的方法:取出样品需测量部位送去液氮冷冻,传输进样品制备仓后进行冷冻断裂,选择合适温度进行升华操作,在内果肉、金边表面、金边截面均为600×放大倍数下对肉苁蓉样品进行表面和截面形貌的观察,调节好焦距和像散,进行拍摄。
1.3.4 微观结构测量方法
SEM图像获得后,采用Image-Pro Plus 6.0软件进行图像分析。测量细胞过程中选取有完整轮廓的整个细胞,沿着细胞边缘涂描以确定轮廓进行测量,最后得到整体的具有代表性的平均细胞面积、周长、主轴长、次轴长等参数,不完整的细胞、空腔不计在内。每张SEM图像中,可统计15~50个细胞。
1.3.5 湿基含水率的测定
采用GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中第一法测定物料的含水量,干燥过程中样品的湿基含水率计算方法如公式(1)所示[17]:
(1)
式中:ωt,任意干燥t时刻物料湿基含水率,%;ω0,物料初始湿基含水率,%;mt,任意干燥t时刻的质量,g;m0,物料初始质量,g
1.3.6 细胞当量直径的测定
细胞当量直径,即与所测物料面积相同的圆的直径,计算方法如公式(2)所示[18]:
(2)
式中:D,肉苁蓉块细胞横截面面积的当量直径,μm;A,肉苁蓉块细胞横截面的面积,μm2。
1.3.7 圆度的测定
圆度计算(roundness):选择圆度(R)作为形态变化指标,表示细胞形状的变化。R=1代表圆形,且R的值越小说明偏离圆的程度越大。计算方法如公式(3)所示[19]:
(3)
式中:A,细胞面积,μm2;P,周长,μm。
1.3.8 伸长率的测定
伸长率计算(elongation)计算方法如公式(4)所示[20]:
(4)
式中:Z,主轴长,μm;C,次轴长,μm。
1.3.9 紧密度的测定
紧密度计算(compactness)计算方法如公式(5)所示[21]:
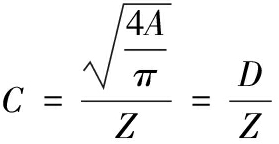
(5)
式中:Z,主轴长,μm;D,细胞等效直径,μm。
1.3.10 收缩率的测定
在干燥过程中,将肉苁蓉干燥过程每隔30 min 进行拍照记录,利用Image-Pro Plus6.0测量肉苁蓉切片,获得切片干燥前后的横截面面积,取3个样品做平行,结果取其平均值,皱缩率的计算方法如公式(6)所示:
(6)
式中:S,肉苁蓉样品的收缩率;At,任意t时刻肉苁蓉样品的横截面面积,cm2;A0,初始时刻肉苁蓉样品的横截面面积,cm2。
2 结果与分析
2.1 肉苁蓉样品电镜图片
将新鲜肉苁蓉样品横截面分为内果肉、金边和纵截面金边。放大600倍后观察结果如图2所示,从左到右依次为金边横截面、金边纵截面和内果肉横截面,可观察出新鲜肉苁蓉细胞间紧密排列,且可看出金边位置细胞壁较内果肉相比更薄一些,细胞内孔隙更紧密,这可能与肉苁蓉干制后的微观结构变化有密切联系[22]。
将新鲜肉苁蓉通过热风干燥技术制成干制品后,分为金边表面、金边截面、内果肉表面三部分。放大一定倍数后观察结果如图3所示,从上到下依次为干制品三部分细胞图。
由图3可看出干燥后的肉苁蓉细胞间排列较疏松,且细胞大小不均一。

a-金边横截面;b-金边纵截面;c-内果肉横截面
图2 新鲜肉苁蓉样品电镜图片(600×)
Fig.2 Image of fresh sample (600×)
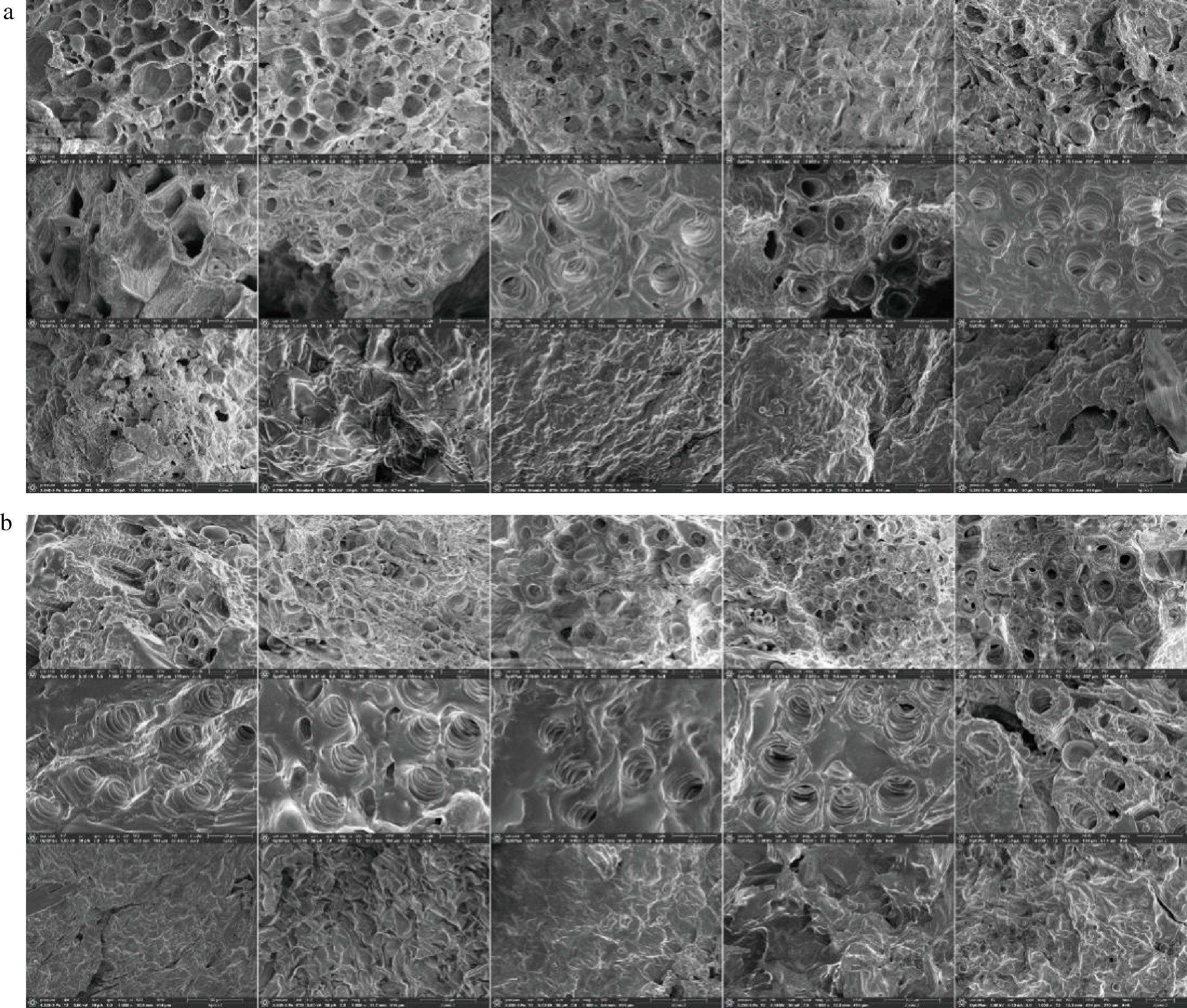
a-从左到右依次为不同温度肉苁蓉干制品细胞图像;b-从左到右依次为不同厚度肉苁蓉干制品细胞图像
图3 肉苁蓉干制品的电子镜像图(1 000×)
Fig.3 Electron mirror image of Cistanche dried products (1 000×)
2.2 温度对肉苁蓉微观结构的影响
2.2.1 干燥温度对肉苁蓉细胞面积的影响
设置风门开度为100%、切片厚度为4 mm,观察干燥后样品的SEM图像,经测量细胞后,得到干燥温度为60、70、80、90、100 ℃时的肉苁蓉各部位周长变化曲线,如图4所示。随着干燥的进行,细胞在高温作用下收缩变形,细胞横截面面积均值变小。可能是因为金边位置处的细胞与内果肉相比内孔道密度较大,对细胞支撑性较强;细胞壁较薄,保护性较弱,所以导致在干制时金边处细胞按比例收缩较高,各参数变化程度更为明显,而内果肉干燥后细胞形状较不规则。
由图4可看出,干燥温度为60、70、80、90、100 ℃条件下,金边表面处细胞面积分别集中在110、110、160、50、90 μm2,即峰值;金边截面处细胞面积分别集中在220、130、80、80、160 μm2,即峰值。而内果肉与其相差很大,内果肉细胞面积集中在1 200、1 900、700、1 200、1 700 μm2,即峰值。其中在80 ℃干燥时,细胞面积概率密度较大,说明此时细胞大小较均匀。
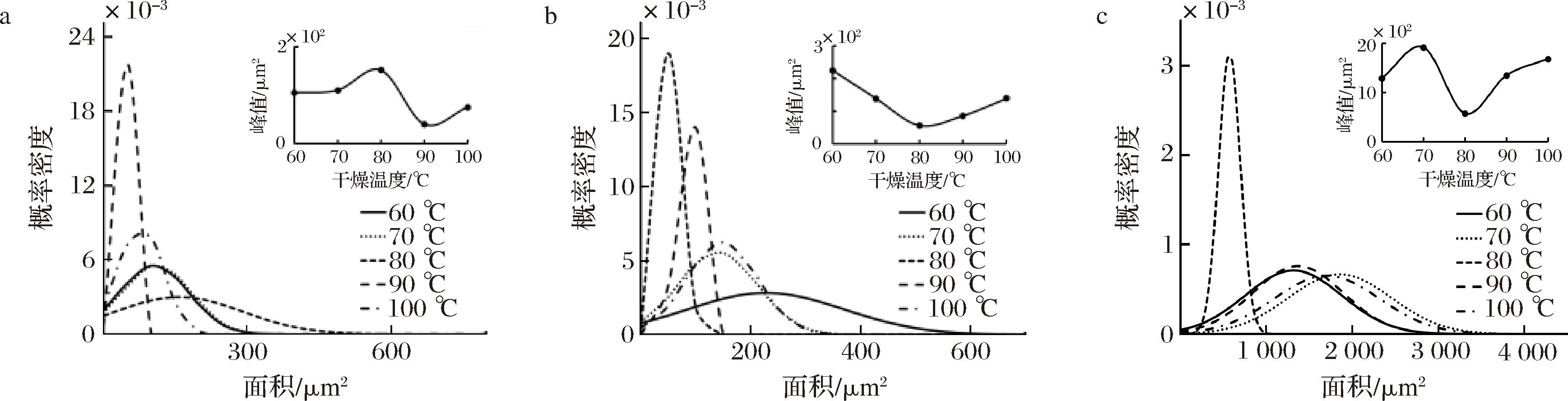
a-金边表面;b-金边截面;c-内果肉表面
图4 不同温度下热风干燥肉苁蓉各部位面积变化
Fig.4 Area change of the parts of hot wind dried Cistanche at different temperatures
2.2.2 干燥温度对肉苁蓉细胞周长的影响
设置风门开度为100%、切片厚度为4 mm,观察干燥后样品的SEM图像,经测量细胞后,得到干燥温度为60、70、80、90、100 ℃时的肉苁蓉各部位周长变化曲线,如图5所示。由图5可看出,干燥温度在90 ℃时,金边表面处细胞周长集中在20 μm2,金边截面处周长集中在35 μm2,内果肉细胞周长集中在175 μm2,外果肉细胞周长集中在105 μm2,都是峰值,细胞周长概率密度较大,说明此时细胞大小较均匀。
由图可得肉苁蓉干制过程周长总是缩小的,干制过程中细胞的形变会引起组织结构的坍塌,导致表面周长的缩小。但也可看出内果肉干制细胞周长比新鲜样品增大的情况。这可能是因为在植物细胞内具有较高渗透压的液泡使细胞质、细胞膜贴近细胞壁,细胞形态相对稳定[23],在热的作用下细胞膜结构遭到破坏,细胞失去膨压,细胞内液会向细胞外转移[24],纤维素酶、多聚半乳糖醛酸酶(polygalacturonase,PG)和相应的底物接触发生催化水解,导致可溶性物质的增加;另外,热处理会引起果胶的 β-消除反应和酸水解,导致果胶物质的降解[25],这些因素导致细胞软化,使得细胞在各种应力的作用下呈现多态化,这可能是细胞横截面周长分布曲线在干制过程中变化的一种因素,而另一种因素可能是干制过程中细胞破裂导致多个细胞结合[26],从而影响到细胞横截面周长的分布情况。
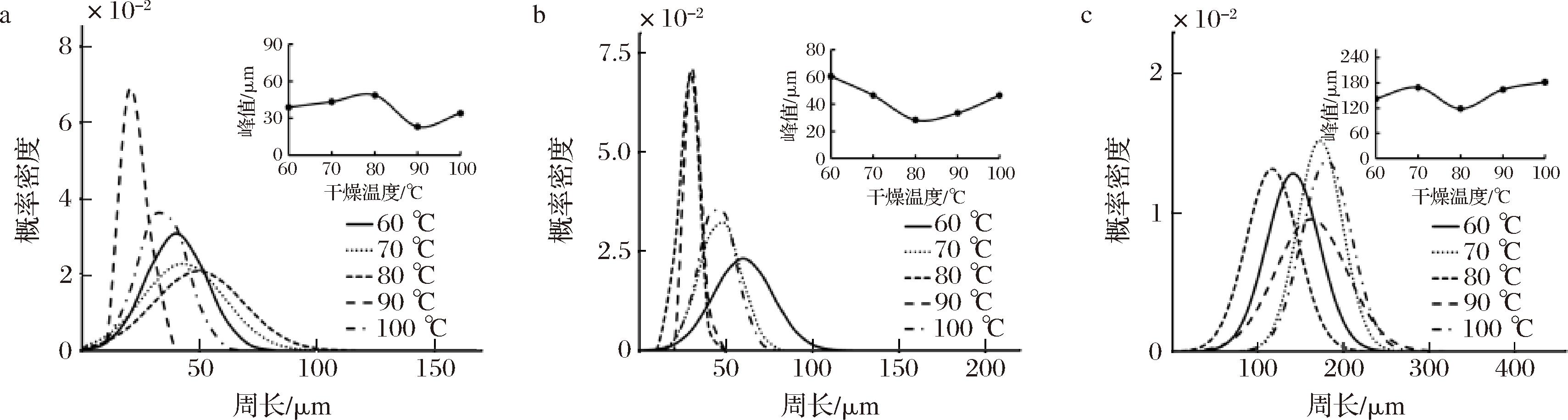
a-金边表面;b-金边截面;c-内果肉表面
图5 不同温度下热风干燥肉苁蓉各部位周长变化
Fig.5 Change of circumference of hot wind dried Cistanche at different temperatures
2.2.3 干燥温度对肉苁蓉细胞当量直径的影响
设置风门开度为100%、切片厚度为4 mm,观察干燥后样品的SEM图像,经测量细胞后,得到干燥温度为60、70、80、90、100 ℃时的肉苁蓉各部位当量直径变化曲线,如图6所示。由图6可知,干燥温度在90 ℃时金边表面处细胞当量直径集中在7 μm,即峰值;金边截面处当量直径集中在10 μm,即峰值;内果肉细胞当量直径集中在38 μm,即峰值,细胞当量直径概率密度较大,说明此时细胞大小较均匀。
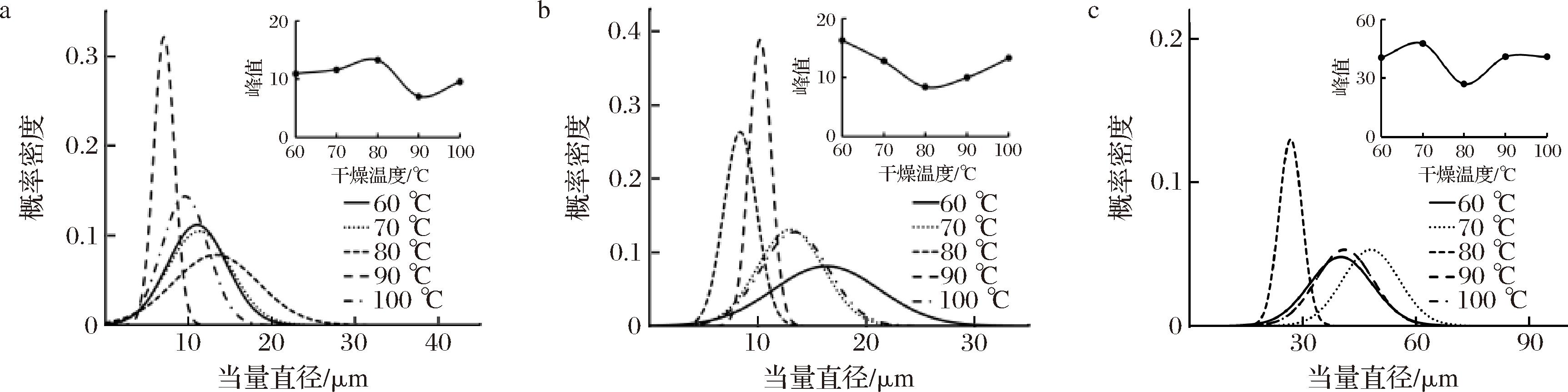
a-金边表面;b-金边截面;c-内果肉表面
图6 不同温度下热风干燥肉苁蓉各部位当量直径变化
Fig.6 Equivalent diameter change of Cistanche at different temperatures
2.2.4 干燥温度对肉苁蓉细胞微观参数的影响
设置风门开度为100%、切片厚度为4 mm,观察干燥后样品的SEM图像,经细胞测量并对数据进行整理作图,得到干燥温度为60、70、80、90、100 ℃时的肉苁蓉各部位细胞伸长率、细胞圆度和细胞紧密度变化曲线如图7~图9所示。
由图7可以看出,干燥温度在80 ℃时金边表面处细胞伸长率集中在1.7,即峰值;金边截面处伸长率集中在1.3,即峰值;内果肉细胞伸长率集中在1.7,即峰值;外果肉细胞伸长率集中在1.6,即峰值。从图中信息可知,概率密度变化趋势并不具有一致性,但是整体观察可看出其伸长率在80 ℃时伸长率最佳,概率密度最高。
由图8可看出,干燥温度在90 ℃时金边表面处细胞圆度集中在0.90,即峰值;金边截面处圆度集中在0.90,即峰值;内果肉细胞圆度集中在0.72,即峰值;外果肉细胞圆度集中在0.62,即峰值,圆度平均值在0.79左右,最接近新鲜样品圆度值,概率密度最高。

a-金边表面;b-金边截面;c-内果肉表面
图7 不同温度下热风干燥肉苁蓉各部位伸长率变化
Fig.7 Change of elongation ratio of hot air drying at different temperatures
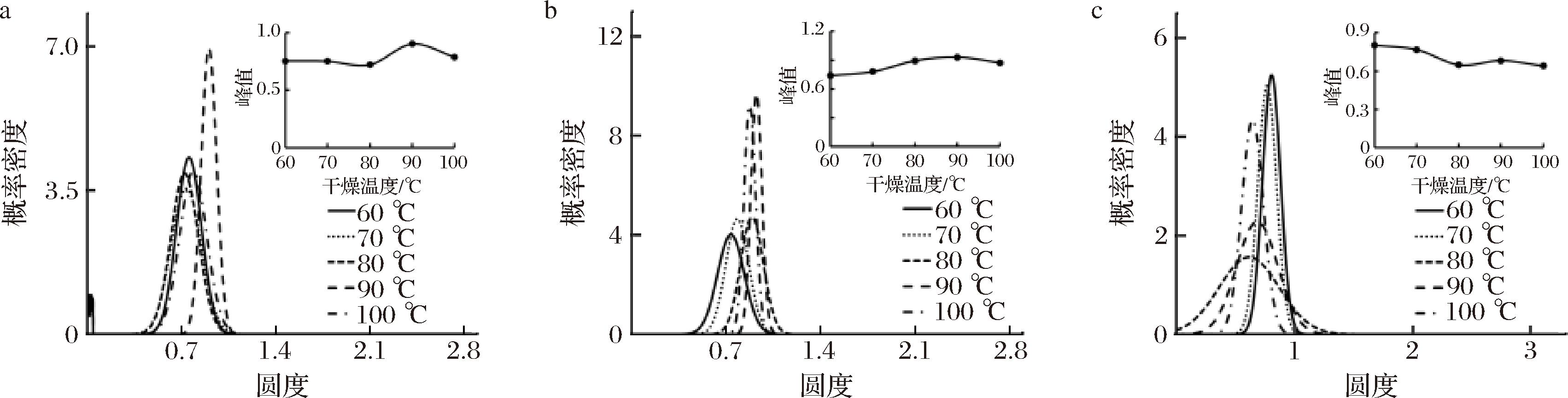
a-金边表面;b-金边截面;c-内果肉表面
图8 不同温度下热风干燥肉苁蓉各部位圆度变化
Fig.8 Cirarity change of the parts of Cistanche at different temperatures
由图9可看出,干燥温度在80 ℃时金边表面处细胞紧密度集中在0.81,即峰值;金边截面处紧密度集中在0.51,即峰值;内果肉细胞紧密度集中在0.51,即峰值,细胞紧密度由于热风干燥会使细胞内水分丢失,细胞皱缩,更加紧密,细胞更为集中。
由图可看出干燥条件为80 ℃时,紧密度平均值在0.7左右,细胞间排列最致密,概率密度也最高。
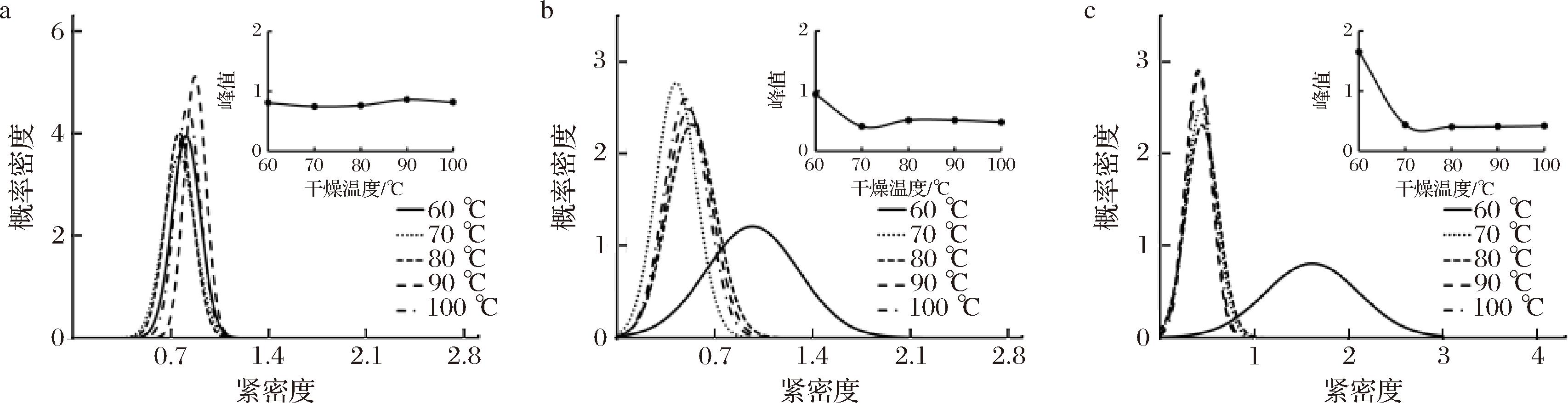
a-金边表面;b-金边截面;c-内果肉表面
图9 不同温度下热风干燥肉苁蓉各部位紧密度变化
Fig.9 Ttightness change of all parts of the Cistanche at different temperatures
2.2.5 干燥温度对肉苁蓉收缩率的影响
设置风门开度100%,将切片厚度为4 mm的肉苁蓉,在干燥温度为60、70、80、90、100 ℃的条件下干燥,得到尖部收缩率变化如图10所示。肉苁蓉在热风干燥过程中由于水分的流失会引起物料的体积收缩,由图10可以看出肉苁蓉在干燥温度增加时收缩率有明显的下降趋势。当干燥温度为60、70、80、90、100 ℃时,新鲜肉苁蓉切片在干燥到湿基含水率10%以下的收缩率分别为78.80%、63.28%、61.46%、51.63%和55.69%,100 ℃的收缩率相比60 ℃的收缩率减小了29.33%,导致收缩率减小的原因可能是随着温度的升高,物料内部水分极速流失使得物料表面形成极高的干燥速率,与物料内部形成较大的水分梯度,所以就会出现较大的内部应力而产生裂纹,这个裂纹会向内部延伸,故肉苁蓉的收缩率在干燥温度升高时出现下降趋势[27-28],在干燥过程中也会发现干燥温度为90 ℃和100 ℃的出现从中间开始的裂纹。
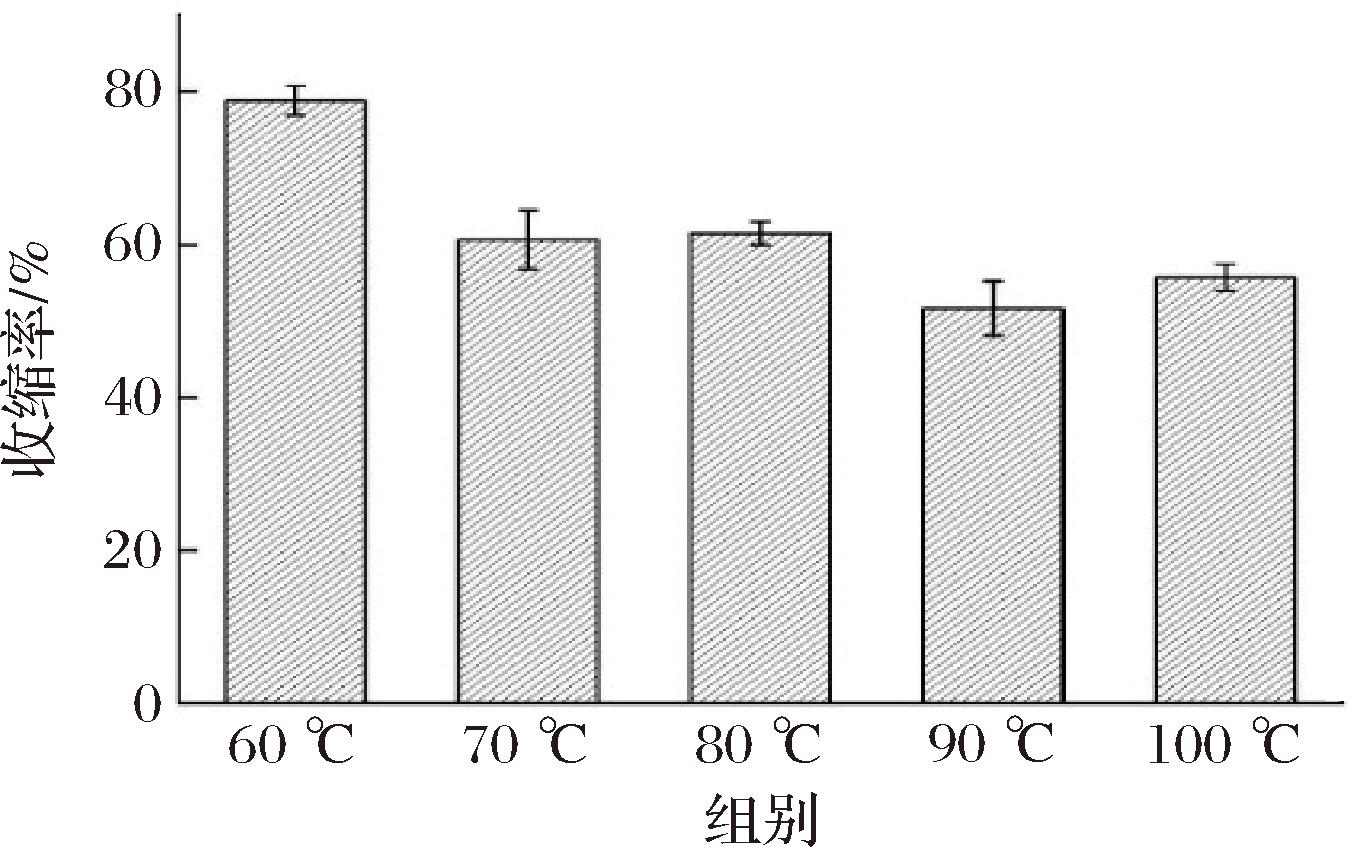
图10 干燥温度对肉苁蓉收缩率变化的影响
Fig.10 Effect of drying temperature on shrinkage rate variation of Cistanche
2.3 切片厚度对肉苁蓉微观结构的影响
2.3.1 切片厚度对肉苁蓉细胞面积的影响
设置风门开度为100%、干燥温度为80 ℃,观察干燥后样品的SEM图像,经测量细胞后,得到切片厚度为4、5、6、7、8 mm时的肉苁蓉尖部各部位面积变化曲线,如图11所示。随着干燥过程的进行,细胞孔道间的游离水被蒸发,细胞在高温作用下收缩变形,概率密度曲线向左偏移,细胞横截面面积均值变小。因为金边位置处的细胞与内外果肉相比内孔道密度较大,对细胞支撑性较强;细胞壁较薄,保护性较弱,所以导致在干制时金边处细胞按比例收缩较高,各参数变化程度更为明显,而内外果肉干燥后细胞形状较不规则。切片厚度在4 mm时金边表面处细胞面积集中在170 μm2,即峰值;金边截面处面积集中在70 μm2,即峰值;而内外果肉与其相差很大,内果肉细胞面积集中在700 μm2,即峰值。切片厚度在5 mm时金边表面处细胞面积集中在120 μm2,即峰值;金边截面处面积集中在90 μm2,即峰值;内果肉细胞面积集中在2 400 μm2。切片厚度在6 mm时金边表面处细胞面积集中在110 μm2,即峰值;金边截面处面积集中在75 μm2,即峰值;内果肉细胞面积集中在1 600 μm2,即峰值。切片厚度在7 mm时金边表面处细胞面积集中在270 μm2,即峰值;金边截面处面积集中在60 μm2,即峰值;内果肉细胞面积集中在960 μm2,即峰值。切片厚度在8 mm时金边表面处细胞面积集中在190 μm2,即峰值;金边截面处面积集中在71 μm2,即峰值;内果肉细胞面积集中在760 μm2,即峰值。其中在切片厚度在4 mm,细胞面积概率密度较大,说明此时细胞大小较均匀。
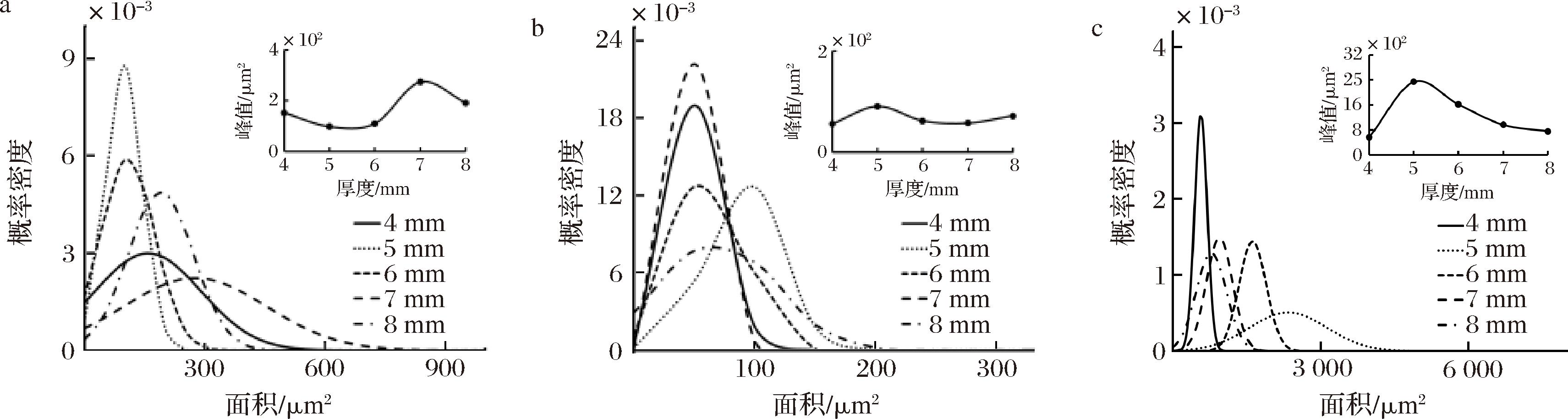
a-金边表面;b-金边截面;c-内果肉表面
图11 不同切片厚度下热风干燥肉苁蓉各部位面积变化
Fig.11 Area change of Cistanche under different section thickness
2.3.2 切片厚度对肉苁蓉细胞当量直径的影响
设置风门开度为100%、干燥温度为80 ℃,观察干燥后样品的SEM图像,经测量细胞后,得到切片厚度为4、5、6、7、8 mm时的肉苁蓉尖部各部位当量直径变化曲线,如图12所示。
由图12还可看出,切片厚度在6 mm时金边表面处细胞当量直径集中在11.1 μm,即峰值;金边截面处当量直径集中在8.9 μm,即峰值;内果肉细胞当量直径集中在45.3 μm,即峰值,细胞当量直径概率密度较大,说明此时细胞大小较均匀。
2.3.3 切片厚度对肉苁蓉细胞微观参数的影响
设置风门开度为100%、干燥温度为80 ℃,观察干燥后样品的SEM图像,经测量细胞后,得到切片厚度为4、5、6、7、8 mm时的肉苁蓉尖部各部位细胞伸长率、细胞圆度和细胞紧密度变化曲线如图13~图15 所示。
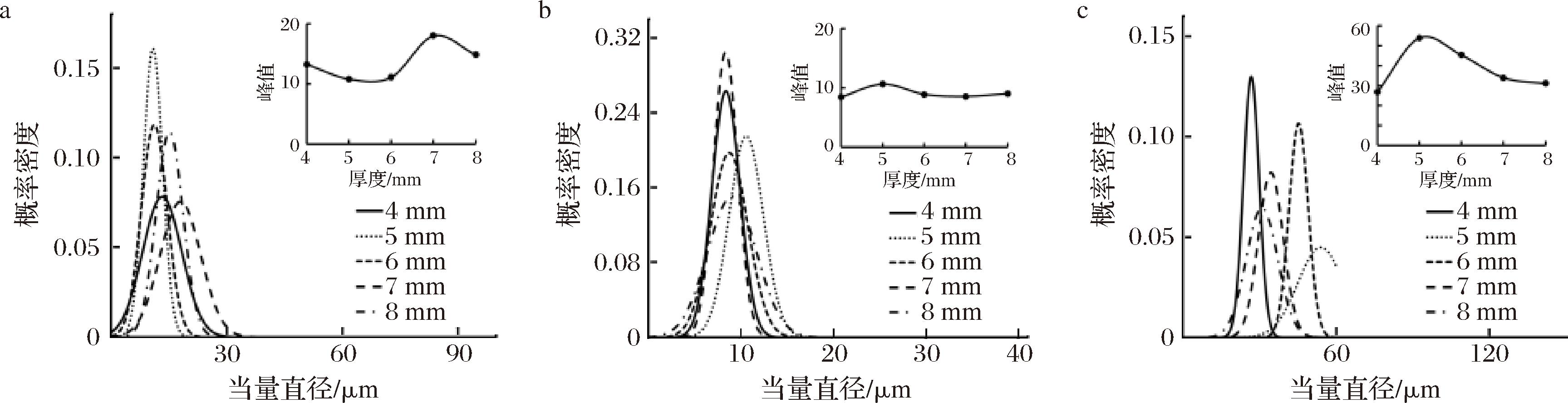
a-金边表面;b-金边截面;c-内果肉表面
图12 不同切片厚度下热风干燥肉苁蓉各部位当量直径变化
Fig.12 Equivalent diameter change of each parts of dried Cistanche under different section thickness
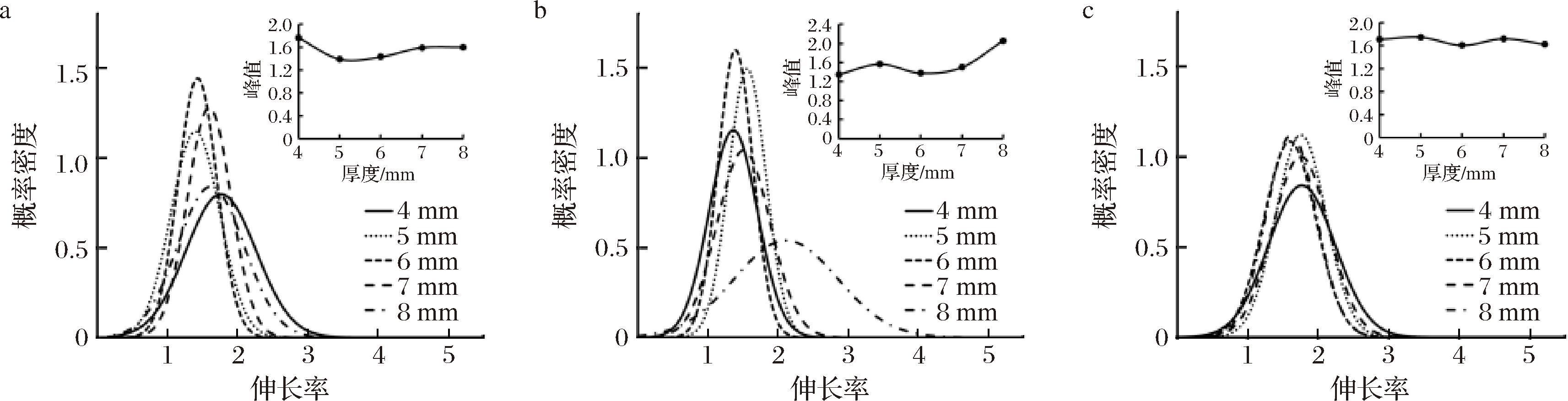
a-金边表面;b-金边截面;c-内果肉表面
图13 不同切片厚度下热风干燥肉苁蓉各部位伸长率变化
Fig.13 Elongation change of each parts of dried Cistanche under different section thicknesses
由图14可得,概率密度变化趋势并不具有一致性,但是整体观察可看出其伸长率在切片厚度6 mm时时伸长率最佳,概率密度最高。切片厚度在6 mm时金边表面处细胞伸长率集中在1.43;金边截面处伸长率集中在1.37;内果肉细胞伸长率集中在1.60;外果肉细胞伸长率集中在1.53。
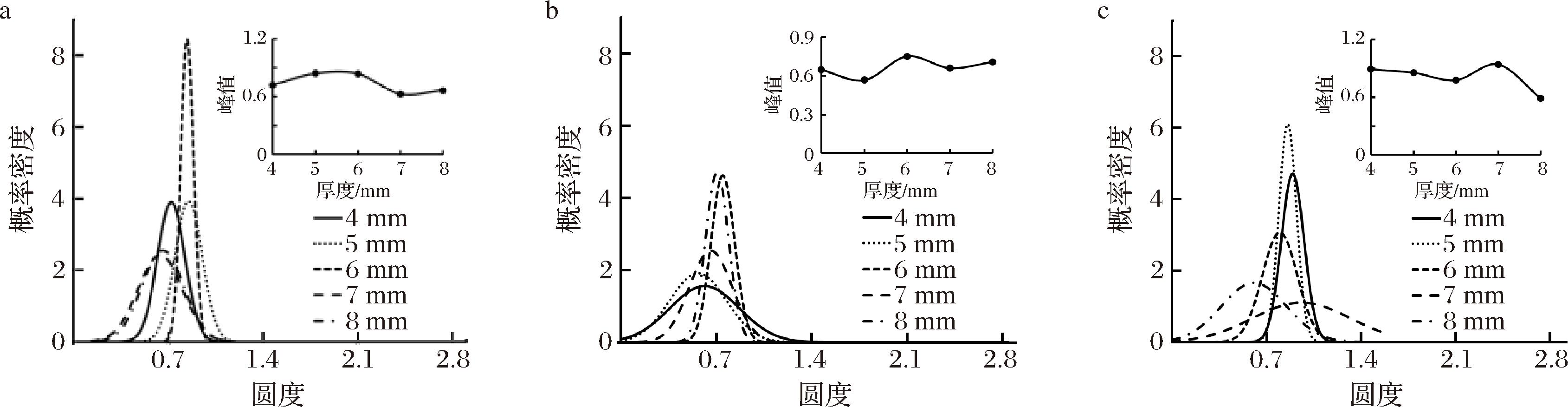
a-金边表面;b-金边截面;c-内果肉表面
图14 不同切片厚度下热风干燥肉苁蓉各部位圆度变化
Fig.14 Cirarity change of each parts of Cistanche under different section thickness
由图15可看出,切片厚度在4 mm时金边表面处细胞圆度集中在0.72,即峰值;金边截面处圆度集中在0.89,即峰值;
内果肉细胞圆度集中在0.64,即峰值。对比观察可看出其在厚度4 mm时,圆度平均值在0.73左右,概率密度最高。
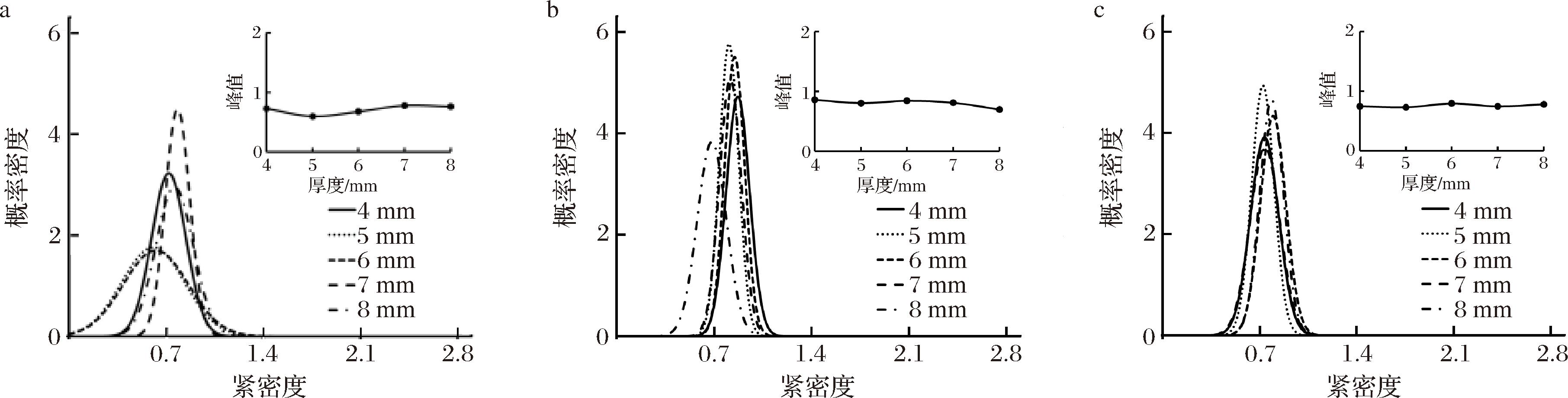
a-金边表面;b-金边截面;c-内果肉表面
图15 不同切片厚度下热风干燥肉苁蓉各部位紧密度变化
Fig.15 The tightness of the parts of dried Cistanche under different section thickness
由图15可看出,切片厚度在4 mm时金边表面处细胞紧密度集中在0.72,即峰值;金边截面处紧密度集中在0.86,即峰值;内果肉细胞紧密度集中在0.74,即峰值。切片厚度在5 mm时金边表面处细胞紧密度集中在0.60,即峰值;金边截面处紧密度集中在0.80,即峰值;内果肉细胞紧密度集中在0.72,即峰值。切片厚度在6 mm时金边表面处细胞紧密度集中在0.67,即峰值;金边截面处紧密度集中在0.84,即峰值;内果肉细胞紧密度集中在0.79,即峰值。切片厚度在7 mm时金边表面处细胞紧密度集中在0.78,即峰值;金边截面处紧密度集中在0.81,即峰值;内果肉细胞紧密度集中在0.74,即峰值。切片厚度在8 mm时金边表面处细胞紧密度集中在0.76,即峰值;金边截面处紧密度集中在0.69,即峰值;内果肉细胞紧密度集中在0.78,即峰值。细胞紧密度由于热风干燥会使细胞内水分丢失,细胞皱缩,更加紧密,细胞更为集中。对比观察可看出其紧密度在5 mm时,紧密度平均值在0.8左右,细胞间排列最致密,概率密度最高。
2.3.4 切片厚度对肉苁蓉收缩率的影响
设置风门开度100%,干燥温度为80 ℃,在切片厚度为4、5、6、7、8 mm的条件下干燥,得到肉苁蓉的收缩率变化如图16所示。由图16可以看出,不同厚度对肉苁蓉的收缩率影响并不大,且收缩率都在60%左右浮动,不同厚度下肉苁蓉的收缩率都比较大,在干燥过程中体积收缩变化较大。
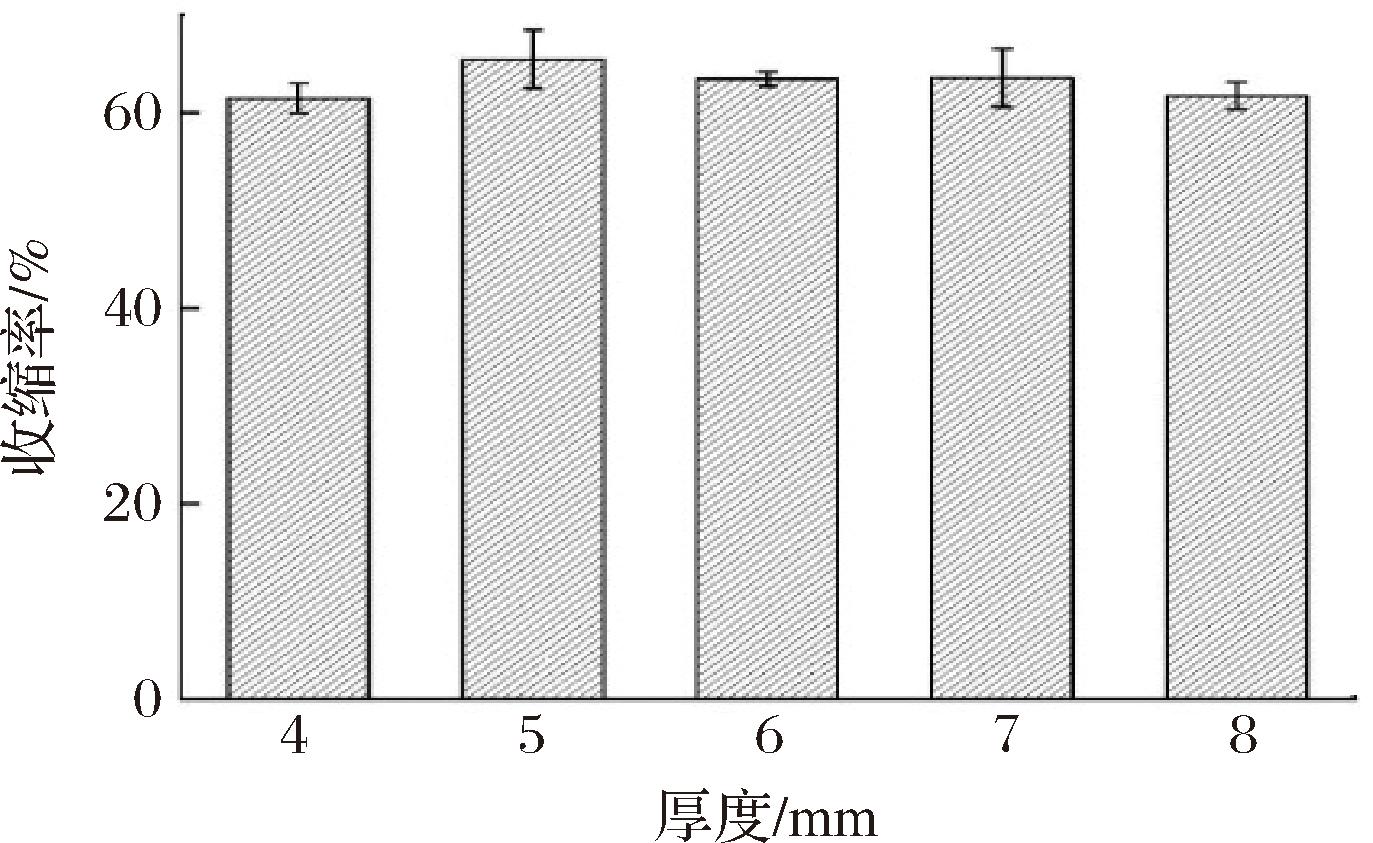
图16 切片厚度对肉苁蓉收缩率的影响
Fig.16 Effect of slice thickness on the shrinkage rate of Cistanche
3 结论
热风干燥中,干燥温度对干制品收缩率有明显的影响,肉苁蓉的收缩率随温度的升高而减少,在80 ℃和100 ℃时达到最小值,其值越小表明在干燥过程中体积收缩越小,结构被破坏程度越小。进一步考察干制品内部结构,肉苁蓉金边表面和截面处的细胞收缩程度极大,这两处在干燥后细胞面积、周长、当量直径大小较新鲜样品均缩小且大小相似,伸长率、圆度变化不一致,但变化不明显,紧密度均增:肉苁蓉内果肉表面的细胞收缩程度相对较小,但细胞微观参数趋势变化与金边处相一致。对比金边处与内果肉数据可看出,干制后的内外果肉细胞面积、周长、当量直径均比金边处大很多;紧密度比金边处大,说明干制后金边处的细胞间排列较致密。分析其原因在于金边位置处的细胞与内外果肉相比内孔道密度较大,对细胞支撑性较强;细胞壁较薄,保护性较弱,所以导致在干制时金边处细胞按比例收缩较高,各参数变化程度更为明显,而内外果肉干燥后细胞形状较不规则。根据数据对比可得出热风干燥温度80 ℃,切片厚度4 mm,风门开度100%条件下进行对细胞破坏性较小,细胞形态大小较均一。
[1] 国家药典委员会. 中华人民共和国药典(1部)[M].北京:化学工业出版社, 2020:140.
The National Pharmacopoeia Commission.Chinese Pharmacopoeia (Part 1)[M].Beijing:Chemical Industry Press, 2020:140.
[2] 毕萃萃, 刘银路, 魏芬芬, 等.肉苁蓉的主要化学成分及生物活性研究进展[J].药物评价研究, 2019, 42(9):1896-1900.
BI C C, LIU Y L, WEI F F, et al.Research progress on main chemical constituents and biological activities of Cistanche deserticola[J].Drug Evaluation Research, 2019, 42(9):1896-1900.
[3] PETROSYAN K, THIJS S, PIWOWARCZYK R, et al.Diversity and potential plant growth promoting capacity of seed endophytic bacteria of the holoparasite Cistanche phelypaea (Orobanchaceae)[J].Scientific Reports, 2023, 13(1):11835.
[4] 冯朵, 何悦, 蒋勇军, 等.肉苁蓉抗衰老功能的研究进展[J].食品安全质量检测学报, 2021, 12(11):4429-4443.
FENG D, HE Y, JIANG Y J, et al.Research progress on anti-aging function of Cistanches[J].Journal of Food Safety and Quality, 2021, 12(11):4429-4443.
[5] 王美霞. 弱势差下含湿多孔介质的水分迁移分形研究[D].天津:天津商业大学, 2018.
WANG M X.Fractal study of water migration in wet porous media under weak difference[D].Tianjin:Tianjin University of Commerce, 2018.
[6] 尼加提·图尔迪麦麦提, 米合热古丽·库尔班, 马挺军.肉苁蓉的资源概括和营养保健特性研究进展[J].食品工业, 2023, 44(10):280-283.
NIJIATI T E D M M T, MIHEREGULI K R B, MA T J.Research progress on resource summary and nutritional and health characteristics of Cistanche deserticola[J].The Food Industry, 2023, 44(10):280-283.
[7] CHENG N, WANG H, HAO H F, et al.Research progress on polysaccharide components of Cistanche deserticola as potential pharmaceutical agents[J].European Journal of Medicinal Chemistry, 2023, 245:114892
[8] 张赛, 陈君若, 刘显茜.水果在热风干燥中的水分扩散分形模型[J].农业工程学报, 2014, 30(4):286-292.
ZHANG S, CHEN J R, LIU X X.Diffusion fractal model of fruit moisture in hot air drying[J].Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(4):286-292.
[9] SANSIRIBHAN S, DEVAHASTIN S, SOPONRONNARIT S.Generalized microstructural change and structure-quality indicators of a food product undergoing different drying methods and conditions[J].Journal of Food Engineering, 2012, 109(1):148-154.
[10] KERDPIBOON S, DEVAHASTIN S, KERR W L.Comparative fractal characterization of physical changes of different food products during drying[J].Journal of Food Engineering, 2007, 83(4):570-580.
[11] 李彪. 肉苁蓉有效成分含量的研究[D].呼和浩特:内蒙古农业大学, 2012.
LI B.Study on the active ingredient content of Cistanche[D].Hohhot:Inner Mongolia Agricultural University, 2012.
[12] 王丽楠, 陈君, 杨美华, 等.肉苁蓉中苯乙醇苷的含量测定[J].西北药学杂志, 2008, 23(2):67-69.
WANG L N, CHEN J, YANG M H, et al.Quantitative determination of total phenylethanoid glycosides in Cistanche desertiola[J].Northwest Pharmaceutical Journal, 2008, 23(2):67-69.
[13] 杨建华, 胡君萍, 热娜·卡斯木, 等.不同加工方法对肉从蓉饮片苯乙醇苷类成分的影响[J].中药材, 2010, 33(5):691-693.
YANG J H, HU J P, RENA K S M, et al.The influence of different processing methods on the composition of meat from decoction slices[J].Journal of Chinese Medicinal Materials, 2010, 33(5):691-693.
[14] 郭志刚, 于金梅, 刘瑞芝, 等.盐生肉苁蓉愈伤组织培养与苯乙醇苷类化合物合成的研究[J].中草药, 2004, 35(2):204-207.
GUO Z G, YU J H, LIU R Z, et al.Studies on culture of Cistanche salsa callus and synthesis of phenylethanoid glycosides[J].Chinese Traditional and Herbal Drugs, 2004, 35(2):204-207.
[15] 刘志勇, 吴茂玉, 葛邦国, 等.梨干低温气流膨化干燥工艺研究[J].食品工业, 2012, 33(9):59-63.
LIU Z Y, WU M Y, GE B G, et al.Explosion puffing drying of pear at low temperature and air current[J].The Food Industry, 2012, 33(9):59-63.
[16] 王经洲, 郑晓, 宛农, 等.基于扫描电镜图像分析的菜籽仁饼孔隙结构分形研究[J].农业工程学报, 2008, 24(3):16-20.
WANG J Z, ZHENG X, WANG N, et al.Fractal character of the pore structure of dehulled rapeseed cake based on scanning electron microscopy image analysis[J].Transactions of the Chinese Society of Agricultural Engineering, 2008, 24(3):16-20.
[17] RATHORE N S, PANWAR N L.Experimental Studies on hemi cylindrical walk-in type solar tunnel dryer for grape drying[J].Applied Energy, 2010, 87(8):2764-2767.
[18] LEWICKI P P, PAWLAK G.Effect of drying on microstructure of plant tissue[J].Drying Technology, 2003, 21(4):657-683.
[19] CHIANG M Y M, YANGBEN Y Z, LIN N J.et al.Relationships among cell morphology, intrinsic cell stiffness and cell-substrate interactions[J].Biomaterials, 2013, 34(38):9754-9762.
[20] 王雪媛, 陈芹芹, 毕金峰, 等.热风-脉动压差闪蒸干燥对苹果片水分及微观结构的影响[J].农业工程学报, 2015, 31(20):287-293.
WANG X Y, CHEN Q Q, BI J F, et al.Effect of hot air-pulsed sudden decompression flashing drying on moisture and microstructure in apple slices[J].Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(20):287-293.
[21] 徐建国, 徐刚, 张绪坤, 等.利用核磁共振成像技术分析胡萝卜干燥过程中内部水分传递[J].农业工程学报, 2013, 29(12):271-276;293.
XU J G, XU G, ZHANG X K, et al.Moisture transport in carrot during hot air drying using magnetic resonance imaging[J].Transactions of the Chinese Society of Agricultural Engineering, 2013, 29(12):271-276;293.
[22] HOU S B, TIAN M H, CHANG S L, et al.Effects of different processing (Paozhi) on structural characterization and antioxidant activities of polysaccharides from Cistanche deserticola[J].International Journal of Biological Macromolecules, 2023, 245:125507.
[23] 刘玲霞, 刘相东, 常剑, 等.果蔬干燥过程的水分跨膜传输模型构建[J].农业工程学报, 2012, 28(20):256-264.
LIU L X, LIU X D, CHANG J, et al.Transmission model of moisture transmembrane during fruit and vegetable drying process[J].Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(20):256-264.
[24] 丁胜华. 生长成熟与干制对枣果品质特性及其果胶多糖的形成规律研究[D].北京:中国农业大学, 2014.
DING S H.Study on the quality and characteristics of jujube fruit and the formation law of pectin polysaccharide[D].Beijing:China Agricultural University, 2014.
[25] 李星恕, 张博, 靳莉珍, 等.加热温度对苹果组织中细胞阻抗特性及水分分布的影响[J].农业工程学报, 2015, 31(14):284-290.
LI X S, ZHANG B, JIN L Z, et al.Effect of heating temperature on cell impedance properties and water distribution in apple tissue[J].Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(14):284-290.
[26] 常剑, 杨德勇, 路倩倩, 等.热风干燥对果蔬薄壁组织细胞结构的影响[J].农业工程学报, 2012, 28(14):262-268.
CHANG J, YANG D Y, LU Q Q, et al.Effect of hot-air drying on cell structure of fruit and vegetable parenchyma[J].Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(14):262-268.
[27] THIBAULT B, ZEYNODDIN M, BONAKDARI H, et al.Assessment of artificial intelligence for predicting porosity of dehydrated food products[J].Computers and Electronics in Agriculture, 2024, 221:108934.
[28] 孙卿. 基于低场核磁共振与近红外组合的典型果蔬干燥品质智能检测研究[D].无锡:江南大学, 2022.
SUN Q.Study on intelligent detection of typical dried fruit and vegetable quality based on the combination of low-field NMR and NIR[D].Wuxi:Jiangnan University, 2022.