嗜热链球菌(Streptococcus thermophilus)作为酸奶常见的发酵剂,与德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp.bulgaricus)之间存在着共生关系,这2种微生物之间互相促进,加快了发酵速率,提高了产品质量[1]。牛乳中糖种类简单,但其乳糖含量较为丰富。来自乳源的S.thermophilus是一种同型乳酸发酵的革兰氏阳性兼性厌氧细菌,是继乳酸乳球菌之后的第二大工业乳酸菌菌种[2]。在酸奶生产过程中,β-半乳糖苷酶(β-galactosidase,β-Gal)将乳糖分解成葡萄糖和半乳糖,其中的半乳糖无法利用被分泌到周围环境中,导致半乳糖大量积累。在发酵乳制品生产过程中,发酵剂利用半乳糖生成二氧化碳,这可能会导致乳制品的结构性缺陷,进而产生裂痕[3]。
诱变育种[4]是指在一定条件下,对目标物种进行理化改造,使其基因发生变异,并通过筛选获得性状优良的物种。化学诱变[5]是指使用化学试剂与原始菌株的DNA发生作用,以改变碱基类似物的结构。亚硝基胍(N-methyl-N′-nitro-N-nitrosoguanidine,NTG)是一种高效的化学诱变剂,广泛应用于细菌的诱变选育。BENATEYA等[6]利用NTG诱变处理S.thermophilus CNRZ302,获得的突变株的半乳糖代谢率显著提高。THOMAS等[7]通过NTG诱变处理发酵乳杆菌(Lactobacillus fermentum),获得一株产生更多乳酸的突变体。
为生产低半乳糖含量的发酵乳制品,以1株发酵特性优良的S.thermophilus IMAU20153为研究对象,利用NTG对菌株进行诱变,通过对实验菌株和突变株的发酵时间,与半乳糖代谢有关酶的活力以及基因序列进行比较分析,筛选出可代谢半乳糖的突变株。此研究的完成对可代谢半乳糖发酵剂的开发和应用有重要意义。
1 材料与方法
1.1 菌株信息
本实验中所用的菌株S.thermophilus IMAU20153及商业发酵剂PYS-010来自于内蒙古农业大学乳品生物技术与工程教育部重点实验室乳酸菌菌种资源库(Lactic Acid Bacteria Collection Center,LABCC)。
1.2 实验试剂
M17培养基(质量分数):0.5%大豆蛋白胨,0.25%细菌学蛋白胨,0.25%酪蛋白胨,0.25%酵母浸粉,0.5%牛肉膏,0.5%乳糖,0.025%硫酸镁,0.05% L-抗坏血酸钠,1.9%β-甘油磷酸二钠五水物。121 ℃条件下灭菌15 min。
1%半乳糖M17液体培养基(质量分数):保持M17液体培养基其他成分不变,将0.5%乳糖替换成1%半乳糖。在121 ℃条件下灭菌15 min。
PBS缓冲液(质量分数):分别为0.02% KH2PO4、0.115% Na2HPO4、0.8% NaCl、蒸馏水1 000 mL。在121 ℃条件下灭菌15 min。
无菌NaCl溶液:质量分数0.85%NaCl,1 L蒸馏水。于121 ℃条件灭菌15 min。
β-Gal、PK活力检测试剂盒,北京Solarbio科技有限公司;GalK、GK活力检测试剂盒,江苏酶免实业有限公司;细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司。
全脂乳:将蒸馏水加热至65 ℃,添加质量分数11.5%全脂乳粉和0.01%的蔗糖,充分搅拌使其溶解后,水合30 min。于65 ℃低压15 MPa、高压35 MPa条件下进行2次均质。95 ℃下灭菌5 min,快速冷却至4 ℃备用。
1.3 仪器与设备
JY2002电子天平,上海奥豪斯仪器有限公司;DHP-9272B电热恒温培养箱,上海一恒科技有限公司;SX-700高压蒸汽灭菌锅,日本TOMY公司;ThermalCycler2720 PCR仪,ThermoFisherScientific公司;Agilent1260高效液相色谱仪,美国AgilentTechnologies公司;SRH60-70高压均质机,上海申鹿均质机有限公司;5810R高速离心机,德国Eppendorf公司。
1.4 实验方法
1.4.1 菌株活化
按照接种量2%接种S.thermophilus IMAU20153至M17试管培养基,42 ℃下培养24 h。在连续3代培养的条件下,其活力最高。
1.4.2 NTG诱变
NTG母液的配制:称取NTG 50 mg,按照NTG∶丙酮=10∶1(mg∶mL)加入丙酮进行溶解,得到10 mg/mL的NTG丙酮溶液。取上述NTG丙酮溶液1 mL,以V(NTG丙酮溶液)∶V(磷酸缓冲液)=1∶9加入0.1 mol/mL pH 6.0的无菌磷酸缓冲液,制得1 mg/mL的NTG母液。
将菌液用PBS缓冲液以5 000 r/min离心5 min反复清洗2次,并称取菌泥的质量。以1 g菌泥加入10 mL PBS缓冲液为标准,制备菌悬液,混匀后分装到NTG质量浓度为0、100、300、500、700、900 μg/mL的离心管中。NTG母液的加入量按公式(1)计算:
C1×V1=C2×V2
(1)
式中:C1为NTG母液的质量浓度,1 mg/mL;V1为NTG母液的加入量,mL;C2为NTG终质量浓度,μg/mL;V2为菌液终体积,mL。
将上述添加菌悬液的NTG溶液于42 ℃避光振荡培养1 h,离心(6 000 r/min,20 min)后,用PBS缓冲液洗菌2次,分别吸取200 μL处理液打入M17液体培养基中,42 ℃培养2 h。采用生理盐水梯度稀释法计算菌悬液中的活菌数。在培养皿中打入1 mL的稀释液,加入M17琼脂培养基。摇晃均匀后42 ℃下倒置培养48 h。每一梯度设置3个平行。记录培养基的菌落数量,在3个平行实验中取平均值,菌株存活率计算如公式(2)所示:
致死率![]()
(2)
筛选出致死率为80%~90%的菌悬液,将其划线于1%半乳糖M17培养基上,42 ℃培养48 h。挑选50个大小不一、形态不同的菌落,于M17液体培养基培养3代,以便进行后续实验。
1.4.3 发酵培养
将S.thermophilus IMAU20153与挑选出的50株突变株接种于M17液体培养基,连续活化3代。以5×106 CFU/mL为接种量,将实验菌株与突变株分别接入灭菌脱脂乳中,42 ℃下静置发酵。记录发酵乳pH值到达4.5时所需的时间。
1.4.4 酶活力的检测
将实验菌株与突变株连续活化3代。检测S.thermophilus IMAU20153及其突变株的β-Gal、半乳糖激酶(galactokinase,GalK)、葡萄糖激酶(glucokinase,GK)和丙酮酸激酶(pyruvate kinase,PK)的活力。具体检测方法根据试剂盒内附说明。
1.4.5 基因序列对比
将实验菌株和筛选的突变株在M17培养基中连续培养3代,4 000 r/min离心10 min收集菌泥,采用Bacteria Genomic DNA Preparation Kit试剂盒提取DNA。根据NCBI(http://www.ncbi.nlm.nih.gov/genome/)中已公布的带注释基因组S.thermophilus CNRZ1066全基因组序列设计galK、pyk、glcK和lacZ的引物,详细信息见表1,其中引物委托上海桑尼生物科技有限公司合成。采用PCR技术,以实验菌株及突变株中提取的DNA作为模板扩增目的基因。表2 为PCR扩增体系。
利用PCR技术扩增DNA。PCR反应条件:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,30个循环;72 ℃终延伸10 min。1%的琼脂糖凝胶电泳对PCR产物进行检测。检测完成后测序分析结果。
表1 本试验所用引物
Table 1 Primers used in this experiment
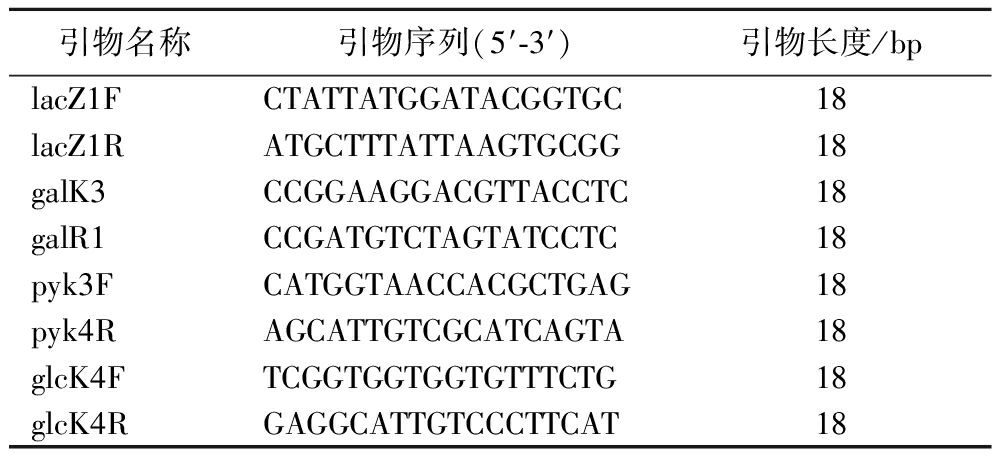
引物名称引物序列(5′-3′)引物长度/bplacZ1FCTATTATGGATACGGTGC18lacZ1RATGCTTTATTAAGTGCGG18galK3CCGGAAGGACGTTACCTC18galR1CCGATGTCTAGTATCCTC18pyk3FCATGGTAACCACGCTGAG18pyk4RAGCATTGTCGCATCAGTA18glcK4FTCGGTGGTGGTGTTTCTG18glcK4RGAGGCATTGTCCCTTCAT18
表2 PCR扩增体系(50 μL)
Table 2 PCR amplification system(50 μL)

体系成分剂量/μL10×PCR Buffer5.0dNTP4.0Primer F1.5Primer R1.5TaKaRa ExTaq酶(5 U/μL)0.5基因组DNA模板(100 ng/μL)2.0ddH2O35.5
1.4.6 乳糖、半乳糖、葡萄糖以及乳酸的含量
将S.thermophilus IMAU20153及其突变株以接种量为5×106 CFU/mL接入全脂乳,42 ℃静置发酵。采用HPLC法对实验菌株及突变株在发酵及贮藏期间乳糖、半乳糖、葡萄糖及乳酸的含量进行检测。分别在发酵0、3、6 h和贮藏0(pH 4.5)、1、3、7、14 d时取发酵乳样品,取3组平行。
发酵乳中乳糖、半乳糖和葡萄糖含量的测定:将发酵乳样品混合均匀,称取1 g于25 mL容量瓶,并加入20 mL超纯水定容,振荡均匀。超声30 min,8 000×g离心10 min后取上清液,使用0.45 μm的微孔滤膜在液相色谱样品瓶过滤。色谱柱为Aglient氨基柱(5 μm,250 mm×4.6 mm),柱温35 ℃;检测器为示差检测器温度35 ℃;流动相为体积比70∶30的乙腈与超纯水的混合液,流速1 mL/min;进样量为10 μL[8]。
发酵乳中乳酸含量的测定:取发酵乳样品0.5 g于10 mL容量瓶,加入浓度为0.1 mol/L的H2SO4定容,振荡均匀。8 000×g离心10 min后取上清液,使用0.45 μm微孔滤膜在液相色谱样品瓶过滤。色谱柱为Zorbax SB-Aq色谱柱(5 μm,4.6 mm×150 mm)柱温35 ℃;检测器为紫外检测器,检测波长为210 nm;流动相为体积比3∶97的甲醇与0.01 mol/L磷酸盐缓冲液(pH 2.0),流速0.5 mL/min;进样量为10 μL。
1.4.7 突变株遗传稳定性的测试
以2%体积分数的接种率,将突变株在M17培养基中于42 ℃培养24 h,连续培养10代,测定GK、β-Gal、PK和GalK的活性。
1.4.8 感官评价
分别将商业发酵剂(PYS-010)、实验菌株及突变株以接种量为5×106 CFU/mL接入全脂乳,于42 ℃发酵培养,在pH 4.5时进行感官评价。组织10位有经验的品评员从颜色、气味、组织状态和口感滋味等方面对发酵乳进行评价,评定标准参考中国乳制品工业行业规范RHB 104—2020《发酵乳感官评鉴细则》,感官评价标准见表3。综合评价分数越高,发酵乳品质越好。
表3 感官评定标准表
Table 3 Sensory rating scale

项目特征分值/分色泽(20分)呈均匀乳白色12~20淡黄色或灰色5~11有斑点或杂质,或其他异常颜色0~4 滋味和气味(40分)具有自然的发酵风味和气味,酸甜比适中31~40自然发酵风味不够,略酸21~30奶味不够,自然发酵风味差,有苦味5~20异常滋味或气味0~4 组织状态(40分)组织细腻、均匀、表面光滑、无裂纹、无气泡、无乳清析出31~40表面平整、无明显裂纹、有少量气泡、有少量乳清析出21~30组织粗糙、有明显裂纹、有明显气泡、有明显乳清析出11~20组织粗糙、有大量裂纹、有大量气泡、乳清析出严重0~10总分100
2 结果与分析
2.1 突变株筛选结果
S.thermophilus IMAU20153在不同NTG浓度下的存活率如表4所示。据已有研究,使用NTG诱变菌株,诱变后的细胞致死率为80%~90%时具有较好的突变效果[9]。由表4可知,在NTG质量浓度为700 μg/mL的菌悬液中,细胞的致死率为88.26%。因此,选择NTG终质量浓度为700 μg/mL的菌悬液,划线于1%半乳糖的M17培养基平皿,培养48 h后挑选50个大小不同形态不一的菌株,编号后用于后续实验。
NTG在诱变过程中容易结合基质的酶的活力位点,具有较高的诱变效率[10]。彭钰媛等[11]使用不同浓度NTG处理蜡样芽孢杆菌(Bacillus cereus)L18时,确定该菌株的NTG最佳诱变致死率为81.3%。韩龙等[12]以脱氮假单胞菌(Pseudomonas denitrificans)为出发菌株,当NTG致死率为80.7%时,正突变率最高。以上研究表明NTG的浓度越高,菌株的致死率也相应提高[13],正突变率先上升后下降。因此本实验选择致死率为88.26%,NTG终质量浓度为700 μg/mL时的菌悬液进行后续实验。
表4 不同NTG浓度下S.thermophilus IMAU20153的致死率
Table 4 Survival rate of S.thermophilus IMAU20153 at different NTG concentrations
NTG终质量浓度/(μg/mL)100300500700900致死率/%45.3155.6862.1188.2696.05
2.2 发酵时间的确定
乳酸菌在发酵时能快速分解乳糖后产生乳酸,降低产品的pH值[14-15],产酸速率是衡量发酵剂能否应用于发酵乳制品生产的前提[16]。S.thermophilus IMAU20153及50株突变株在发酵过程中pH值降至4.5时所用的时间如表5所示,选取发酵时间小于实验菌株的22株突变株进行后续实验。
表5 S.thermophilus IMAU20153及其突变株发酵时间
Table 5 Duration of fermentation for S.thermophilus IMAU20153 and its mutant strain

菌株名发酵时间/h菌株名发酵时间/hIMAU201537.5IMAU20153-266.5IMAU20153-17IMAU20153-276.5IMAU20153-26.5IMAU20153-288IMAU20153-37.5IMAU20153-297.5IMAU20153-47IMAU20153-307.5IMAU20153-57.5IMAU20153-318IMAU20153-67.5IMAU20153-327.5IMAU20153-76.5IMAU20153-337.5IMAU20153-87.5IMAU20153-347.5IMAU20153-96IMAU20153-356.5IMAU20153-108IMAU20153-366.5IMAU20153-116.5IMAU20153-378IMAU20153-126IMAU20153-386.5IMAU20153-136IMAU20153-397IMAU20153-148IMAU20153-407IMAU20153-158IMAU20153-418IMAU20153-166IMAU20153-428IMAU20153-178IMAU20153-436.5IMAU20153-186IMAU20153-447.5IMAU20153-197.5IMAU20153-457.5IMAU20153-207IMAU20153-468IMAU20153-218IMAU20153-476.5IMAU20153-227IMAU20153-488IMAU20153-237.5IMAU20153-497.5IMAU20153-246.5IMAU20153-508IMAU20153-258
2.3 酶活力测定结果
检测实验菌株和突变株GalK、β-Gal、PK和GK的活力如图1所示。GK在EMP途径中将葡萄糖磷酸化为葡萄糖-6-磷酸[17-18],GK活力降低会使糖酵解速率降低,进而减少葡萄糖的代谢。通过检测GK的活力,发现所挑选突变株中有16株GK的活力低于实验菌株。在乳糖渗透酶的催化下,乳糖被转运至细胞内,并通过β-Gal水解作用转化为葡萄糖和半乳糖,分别通过糖酵解和Leloirt通路继续代谢[19-20]。β-Gal属于糖苷水解酶,也具有半乳糖苷的转移作用[21]。β-Gal活力越大,乳糖代谢速率越快。上述16株GK活力低于实验菌株的突变株中有12株β-Gal的活力高于实验菌株。PK能够对EMP途径的代谢速率进行控制,在代谢过程中催化磷酸烯醇式丙酮酸分子中的高能磷酸基团转移给ADP,生成ATP[22],其活力降低时可以提高代谢速率。在上述12株β-Gal活力高于实验菌株的突变株中有10株的PK活力低于实验菌株。GalK在半乳糖代谢中可催化D-半乳糖生成半乳糖1-磷酸[23],活性提高时半乳糖的排出量明显减少。根据GalK的活力检测结果筛选出6株活力高于实验菌株的突变株进行后续实验。
在该研究中,β-Gal和GalK活力在实验菌株中较弱,但在突变株中较高,表明突变株在水解乳糖方面优于实验菌株。李嘉雯[24]采用2-脱氧葡萄糖(2-deoxy-D-glucose,2-DG)诱变S.thermophilus,β-Gal的活力较原始株升高6.81%,突变株代谢乳糖和半乳糖能力提高。王建宇等[25]从芽孢杆菌(Bacillales sp.)中克隆了β-Gal基因,在大肠杆菌(Escherichia coli)中催化表达时低聚半乳糖的产率高达34%。张夙夙[26]驱动S.thermophilus GalK基因高表达,提高了菌株利用半乳糖能力。GK和PK是糖酵解过程中的限速酶,降低酶活力会抑制糖酵解的代谢,并使葡萄糖在发酵乳中积累。在S.thermophilus IMAU20153Y中检测到较低的GK和PK活力,表明糖酵解速率低于实验菌株。考虑到4种酶的作用,选择比实验菌株具有更高的β-Gal和GalK活力,但GK和PK活力弱的突变株作为后续实验的菌株。
2.4 基因序列对比结果
根据GK、β-Gal、PK和GalK活力测定的结果,推测编码这些酶的基因序列可能发生了基因突变。因此,为验证NTG对S.thermophilus IMAU20153DNA的作用,提取实验菌株和6株突变株的DNA,使用特异引物扩增galK、pyk、glcK和lacZ基因序列后进行测序,将测序结果进行比对,发现仅有1株突变株IMAU20153-43的氨基酸序列得到了理想的突变,将其命名为IMAU20153Y(图2)。lacZ基因序列在201和202位点由“CA”突变为“TG”。galK基因序列在165位点由“C”突变为“T”。pyk基因序列在14和15位点由“GG”突变为“TT”。glcK基因序列在48位点由“T”突变为“C”。
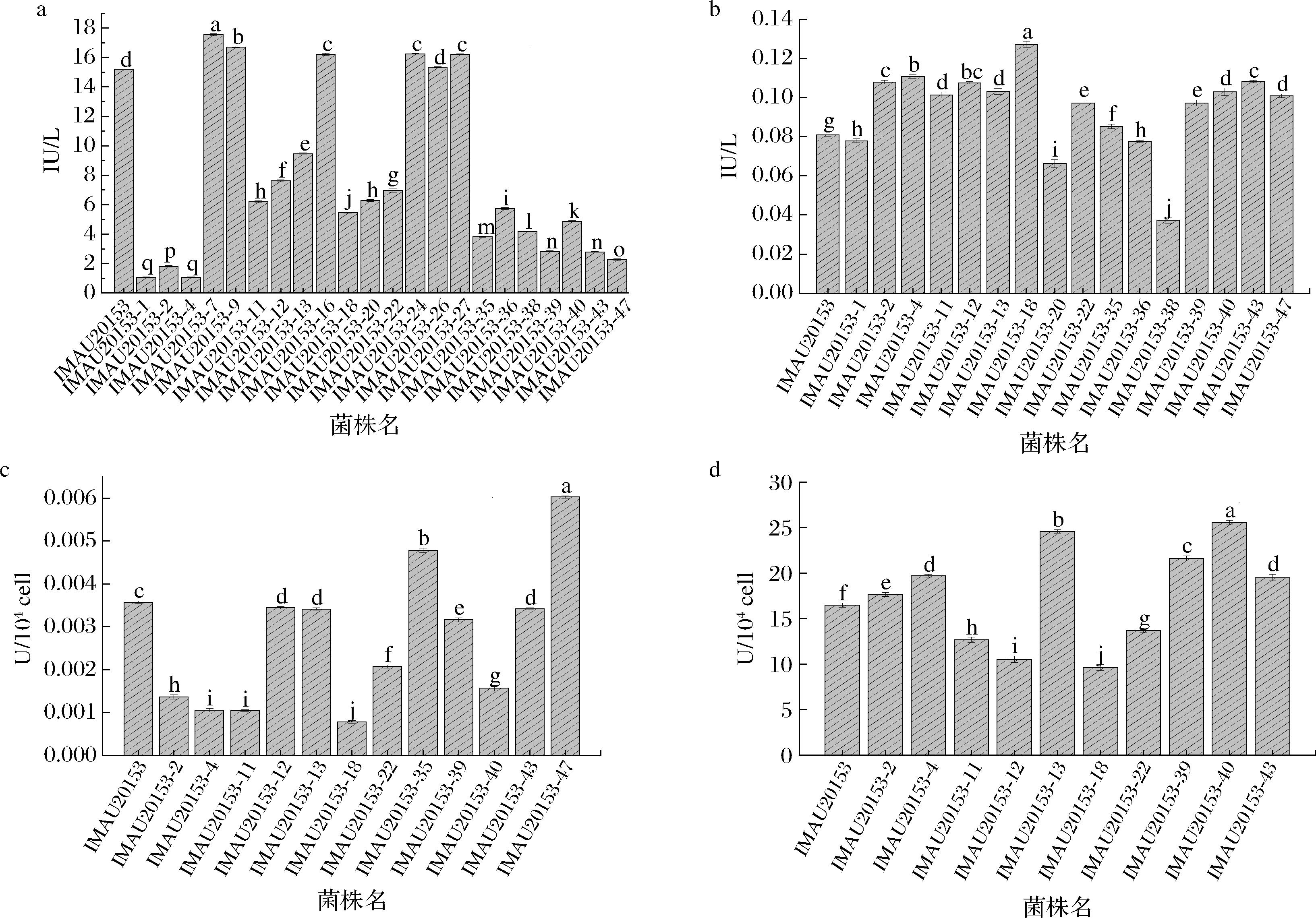
a-GK;b-β-GAL;c-PK;d-GALK
图1 S.thermophilus IMAU20153及其突变株GK、β-Gal、PK和GalK的活力
Fig.1 GK, β-Gal, PK, and GalK activity of S.thermophilus IMAU20153 and its mutant strain
注:不同小写字母表示差异显著(P<0.05)。
NTG是一种双功能烷化剂,可以与DNA分子中核酸碱基烷化,使DNA增加了烷基侧链[27]。同时还可在DNA双链间形成共价键,阻碍DNA复制时双链解开。和实验菌株相比,S.thermophilus IMAU20153Y中lacZ、galK、pyk、glcK基因序列均发生了碱基替换,认为NTG和DNA的结合引起了编码这些酶的基因序列的突变,菌株的原始代谢途径发生了变化,这导致突变株在乳糖和半乳糖代谢方面比实验菌株具有更高的能力。使用NTG对菌株的代谢途径进行遗传控制,适用于工业生产高效菌株。

图2 S.thermophilus IMAU20153及S.thermophilus IMAU20153Y lacZ、galK、pyk和glcK的序列比对结果
Fig.2 Comparion results of S.thermophilus IMAU20153 and S.thermophilus IMAU20153Y lacZ, galK, pyk, and glcK gene sequence
2.5 HPLC的分析结果
标准品的保留时间及回归方程见表6,各样品的质量浓度与峰面积之间有良好的线性相关性,相关系数都达到0.999。实验菌株及突变株在发酵乳中的乳糖、半乳糖、葡萄糖和乳酸含量见表7。
实验菌株及突变株在发酵乳中乳糖含量随着发酵和贮藏时间的延长呈减少趋势。发酵开始时实验菌株及突变株发酵乳中检测的乳糖含量为4.353和4.421 g/100 g,随着发酵过程乳糖逐步代谢,于贮藏14 d时分别降至2.763和2.577 g/100 g。这主要是因为突变株中β-Gal活力高于实验菌株(图1-b),和实验菌株相比,更多的乳糖被分解成葡萄糖和半乳糖,导致突变株发酵乳中乳糖残量始终低于实验菌株。
表6 样品的回归方程及相关系数
Table 6 Regression equations and correlation coefficients for the sample

类别保留时间回归方程相关系数乳糖 10.565y=74 201x+325.210.999半乳糖6.733y=81 355x+1 995.40.999葡萄糖6.400y=86 311x+1 0890.999乳酸 4.405 y=1 166.2x+113.44 0.999
表7 发酵和贮藏过程中乳糖、半乳糖、葡萄糖和乳酸的含量 单位:g/100 g
Table 7 Content of lactose, galactose, glucose, and lactic acid in fermentation and storage

时间乳糖半乳糖葡萄糖乳酸实验菌株突变株实验菌株突变株实验菌株突变株实验菌株突变株0 h4.353±0.002a4.421±0.017b------3 h3.807±0.008a3.533±0.001b0.102±0.001b0.155±0.001a--0.274±0.003b0.347±0.035a6 h3.651±0.030a3.015±0.002b0.323±0.001a0.294±0.004a0.123±0.003b0.404±0.002a0.433±0.001b0.545±0.039a0 d3.085±0.009a2.845±0.001b0.463±0.001b0.473±0.003a0.083±0.002b0.474±0.003a0.566±0.001b0.755±0.002a1 d2.917±0.001a2.765±0.002b0.507±0.001b0.533±0.002a-0.443±0.002a0.624±0.001b0.863±0.002a3 d2.835±0.012a2.675±0.001b0.525±0.001a0.436±0.001b-0.435±0.003a0.771±0.001b0.976±0.000a7 d2.797±0.002a2.615±0.001b0.553±0.002a0.414±0.003b-0.427±0.001a0.974±0.001b1.064±0.000a14 d2.763±0.002a2.577±0.001b0.587±0.001a0.395±0.002b-0.421±0.000a1.067±0.000b1.167±0.001a
注:-表示未检出(<0.02);不同小写字母表示同种物质同一时间差异的显著性(P<0.05)。
实验菌株在乳中的半乳糖含量从0.102增加至0.587 g/100 g,呈增加趋势。突变株发酵乳中半乳糖含量变化趋势先增加后减少,由0.155增加至最高值0.533 g/100 g(1 d),随后开始减少至0.395 g/100 g。突变株GalK活力高于实验菌株(图1-d),其代谢半乳糖的能力显著高于实验菌株,导致更多的半乳糖被催化生成半乳糖1-磷酸,所以突变株发酵乳中半乳糖残量上升至0.533 g/100 g后开始下降。
在贮藏与发酵期间,实验菌株与突变株发酵乳中葡萄糖含量有明显差别。在发酵6 h时,实验菌株和突变株发酵乳中葡萄糖含量分别为0.123和0.404 g/100 g。在贮藏1 d时实验菌株发酵乳中未检出,这可能是由于在牛奶发酵过程中葡萄糖通过EMP途径快速代谢,因此所达到的低水平未能达到检测极限。而突变株发酵乳中葡萄糖在贮藏0 d时累积到最大值0.474 g/100 g,随后开始下降,在贮藏14 d时减小至0.421 g/100 g。葡萄糖被GK磷酸化后进入糖酵解过程,而突变株中GK活力降低,使被磷酸化的葡萄糖含量减少,从而有更多无法被代谢的葡萄糖被排出胞外,导致发酵乳中葡萄糖含量增加。
实验菌株与突变株发酵乳在发酵3 h时均有乳酸产出,在到达发酵时间(0 d)时,实验菌株乳酸含量为0.566 g/100 g,突变株乳酸含量更高,为0.755 g/100 g。在贮藏14 d时实验菌株乳酸含量增加至1.067 g/100 g,而突变株乳酸含量更高,达到1.167 g/100 g,乳酸含量增加了3.4%。S.thermophilus是一种同型发酵乳酸菌,生成的代谢产物为2分子丙酮酸和2个ATP[28],丙酮酸再由乳酸脱氢酶还原为乳酸,通常超过90%的底物会转变成乳酸。本研究中在发酵3 h时实验菌株和突变株发酵乳中均有乳酸产出,说明这2个株菌株均有良好的产酸能力。此外,在发酵过程中突变株的产酸量始终高于实验菌株,说明和实验菌株相比,发酵时间更短,与表5结果一致。类似的结果在赵兴文等[29],李源等[30]的报道中也有发现。郭清泉等[31]的研究表明,L.delbrueckii subsp.bulgaricus在酸奶贮存过程中的后酸化起了决定性作用,因此,本文将突变株与弱后酸化的L.delbrueckii subsp.bulgaricus进行复配发酵,在到达发酵终点时时,突变株复配组的酸度为80 oT(数据未发表)。因此,该实验菌株在发酵乳制品生产中应用时不会导致后酸化现象发生。
2.6 遗传稳定性分析
菌株的连续传代是导致菌种出现衰退现象的直接因素。乳酸菌容易受生长环境压力的影响而发生基因突变,进而出现表型特征的变化[32-33]。S.thermophilus IMAU20153Y在连续培养10代过程中β-Gal、GK、GalK、PK的活力检测如表8所示。在连续传代过程中,β-Gal的活力始终维持在0.098~0.102 IU/L,GK的活力为2.584~2.653 IU/L,GalK和PK的活力为19.497~19.648和0.003 1~0.003 8 U/104cell,结果没有显著性差异(P>0.05)。表明S.thermophilus IMAU20153Y经过多次传代后β-Gal、GK、GalK及PK活力稳定,遗传稳定性较好。
表8 S.thermophilus IMAU20153Y连续传代过程中β-Gal、GK、GalK、PK的活力
Table 8 Viability of β-Gal, GK, GalK, and PK during successive passages in S.thermophilus IMAU20153Y
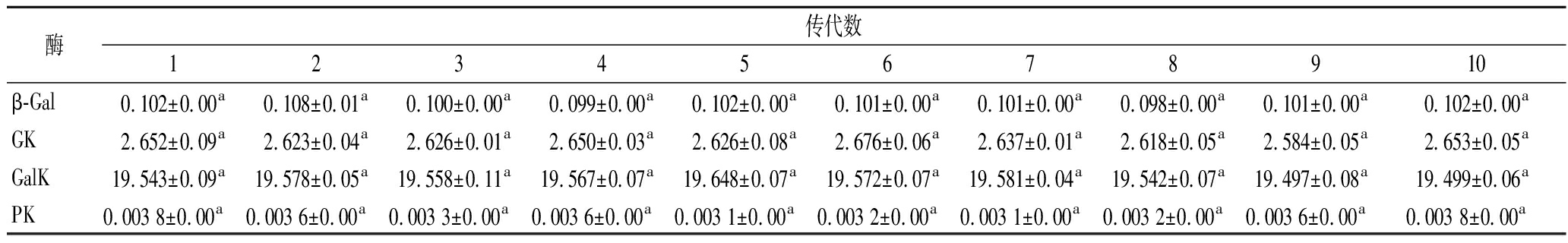
酶传代数12345678910β-Gal0.102±0.00a0.108±0.01a0.100±0.00a0.099±0.00a0.102±0.00a0.101±0.00a0.101±0.00a0.098±0.00a0.101±0.00a0.102±0.00aGK2.652±0.09a2.623±0.04a2.626±0.01a2.650±0.03a2.626±0.08a2.676±0.06a2.637±0.01a2.618±0.05a2.584±0.05a2.653±0.05aGalK19.543±0.09a19.578±0.05a19.558±0.11a19.567±0.07a19.648±0.07a19.572±0.07a19.581±0.04a19.542±0.07a19.497±0.08a19.499±0.06aPK0.003 8±0.00a 0.003 6±0.00a 0.003 3±0.00a 0.003 6±0.00a 0.003 1±0.00a 0.003 2±0.00a 0.003 1±0.00a 0.003 2±0.00a 0.003 6±0.00a 0.003 8±0.00a
注:小写字母表示同种物质同一时间差异的显著性(P>0.05)。
2.7 感官评价分析结果
10位品评员对商业发酵剂、实验菌株及突变株制备的发酵乳感官评价的结果见表9。感官评价可以很好地反映出不同菌株发酵乳之间的品质及口感差异,还可以从消费者的角度比较产品的被接受程度。实验菌株组及突变株组整体得分均低于商业发酵剂组,且突变株组色泽和组织状态评分较高,产品组织均匀,质地细腻丝滑,品尝时无颗粒感,具有醇香的酸奶味。
表9 发酵乳感官评分表 单位:分
Table 9 Fermented milk sensory scale
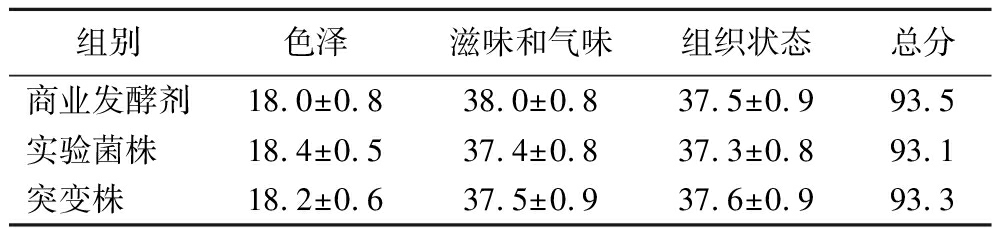
组别色泽滋味和气味组织状态总分商业发酵剂18.0±0.838.0±0.837.5±0.993.5实验菌株 18.4±0.537.4±0.837.3±0.893.1突变株 18.2±0.637.5±0.937.6±0.993.3
3 结论
利用NTG诱变可筛选出一株可代谢半乳糖的S.thermophilus IMAU20153Y,和实验菌株相比,突变株中和半乳糖代谢相关酶β-Gal、GalK、GK和PK的活力发生明显变化;基因序列比对的结果表明,S.thermophilus IMAU20153Y中β-Gal、GalK、PK、GK编码的基因序列均发生了碱基的替换;HPLC的分析结果也证明了NTG对S.thermophilus IMAU20153Y的表型产生了影响,和实验菌株相比,突变株能代谢更多的乳糖和半乳糖,产生更多的乳酸,生产的产品组织均匀,具有醇香的酸奶味。本研究的顺利进行,为更多低半乳糖发酵乳制品的研发与应用奠定了基础。
[1] 崔欣, 孙亚琳, 王开云, 等.嗜热链球菌和德氏乳杆菌保加利亚亚种共生关系的研究进展[J].食品研究与开发, 2021, 42(6):184-189.
CUI X, SUN Y L, WANG K Y, et al.Research progress on symbiotic relationship between Streptococcus thermophilus and Lactobacillus delbrueckii subsp.bulgaricus[J].Food Research and Development, 2021, 42(6):184-189.
[2] DE VIN F, RÅDSTRÖM P, HERMAN L, et al.Molecular and biochemical analysis of the galactose phenotype of dairy Streptococcus thermophilus strains reveals four different fermentation profiles[J].Applied and Environmental Microbiology, 2005, 71(7):3659-3667.
[3] BLEY M E, JOHNSON M E, OLSON N F.Factors affecting nonenzymatic browning of process cheese[J].Journal of Dairy Science, 1985, 68(3):555-561.
[4] 王利, 吴洁, 李凯锋, 等.乳糖不耐受及其相关性的研究[J].科技创新导报, 2010(28):4-5.
WANG L, WU J, LI K F, et al.Study on lactose intolerance and its correlation[J].Science and Technology Innovation Herald, 2010(28):4-5.
[5] 成晓艳, 张丁洁, 田艾迪, 等.优化乳杆菌高产共轭亚油酸的研究进展[J].中国食品学报, 2022, 22(10):391-405.
CHENG X Y, ZHANG D J, TIAN A D, et al.Research progress on optimization of lactobacillus for high yield of conjugated linoleic acid[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(10):391-405.
[6] BENATEYA A, BRACQUART P, LINDEN G.Galactose-fermenting mutants of Streptococcus thermophilus[J].Canadian Journal of Microbiology, 1991, 37(2):136-140.
[7] THOMAS B T, AGU G C, MAKANJUOLA S, et al.Genome shuffling of Lactobacillus fermentum for improved production of lactic acid[J].American Journal of Research, 2014, 2: 245-250.
[8] ZEPPA G, CONTERNO L, GERBI V.Determination of organic acids, sugars, diacetyl, and acetoin in cheese by high-performance liquid chromatography[J].Journal of Agricultural and Food Chemistry, 2001, 49(6):2722-2726.
[9] 马文瑞, 孙志伟, 石俊, 等.非酿酒酵母Nakazawaea ishiwadae GDMCC 60786产乙酸乙酯的诱变菌株筛选及其安全性评价[J].食品科学, 2023, 44(10):165-172.
MA W R, SUN Z W, SHI J, et al.Screening and safety evaluation of ethyl acetate-producing mutant of non-Saccharomyces yeast Nakazawaea ishiwadae GDMCC 60786[J].Food Science, 2023, 44(10):165-172.
[10] 张俊桃, 刘文俊, 孟和毕力格.酸奶弱后酸化发酵剂乳酸菌育种技术研究进展[J].中国微生态学杂志, 2017, 29(4):481-486.
ZHANG J T, LIU W J, MENG H.Breeding of lactic acid bacteria with low post-acidification in yoghurt:Progress in research[J].Chinese Journal of Microecology, 2017, 29(4):481-486.
[11] 彭钰媛, 易浪波, 彭清忠, 等.亚硝基胍与紫外诱变选育高效解钾菌株[J].吉首大学学报(自然科学版), 2016, 37(6):62-67.
PENG Y Y, YI L B, PENG Q Z, et al.Screening of high efficiency potash feldspar-solubilizing bacteria by NTG/UV[J].Journal of Jishou University (Natural Sciences Edition), 2016, 37(6):62-67.
[12] 韩龙, 阮国祥, 马杰希, 等.维生素B12生产菌的化学诱变和抗生素抗性筛选[J].精细与专用化学品, 2019, 27(1):36-39.
HAN L, RUAN G X, MA J X, et al.Screening for chemical mutagenesis and antibiotic resistance of vitamin B12-producing strain[J].Fine and Specialty Chemicals, 2019, 27(1):36-39.
[13] 杨晨军, 汪林兰, 余健, 等.淡紫灰链霉菌X33水溶性抗真菌产物高产菌株的诱变选育[J].中国抗生素杂志, 2021, 46(2):121-127.
YANG C J, WANG L L, YU J, et al.Mutation screening for high-yield strains of a water-soluble fungicide from Streptomyces lavendulae X33[J].Chinese Journal of Antibiotics, 2021, 46(2):121-127.
[14] FUGL A, BERHE T, KIRAN A, et al.Characterisation of lactic acid bacteria in spontaneously fermented camel milk and selection of strains for fermentation of camel milk[J].International Dairy Journal, 2017, 73:19-24.
[15] 陆嘉诚, 关成冉, 张臣臣, 等.嗜热链球菌发酵特性比较与分析[J].中国乳品工业, 2019, 47(5):13-17.
LU J C, GUAN C R, ZHANG C C, et al.Comparison and analysis of fermentation characteristics of Streptococcus thermophiles[J].China Dairy Industry, 2019, 47(5):13-17.
[16] VAN DEN BOGAARD P T C, HOLS P, KUIPERS O P, et al.Sugar utilisation and conservation of the gal-lac gene cluster in Streptococcus thermophilus[J].Systematic and Applied Microbiology, 2004, 27(1):10-17.
[17] XU J Z, RUAN H Z, YU H B, et al.Metabolic engineering of carbohydrate metabolism systems in Corynebacterium glutamicum for improving the efficiency of L-lysine production from mixed sugar[J].Microbial Cell Factories, 2020, 19(1):39.
[18] LINDNER S N, SEIBOLD G M, HENRICH A, et al.Phosphotransferase system-independent glucose utilization in Corynebacterium glutamicum by inositol permeases and glucokinases[J].Applied and Environmental Microbiology, 2011, 77(11):3571-3581.
[19] FOUCAUD C, POOLMAN B.Lactose transport system of Streptococcus thermophilus.Functional reconstitution of the protein and characterization of the kinetic mechanism of transport[J].The Journal of Biological Chemistry, 1992, 267(31):22087-22094.
[20] LAZAR Z, GAMBOA-MELÉNDEZ H, LE COQ A M, et al.Awakening the endogenous Leloir pathway for efficient galactose utilization by Yarrowia lipolytica[J].Biotechnology for Biofuels, 2015, 8(1):185.
[21] LIU P, XIE J X, LIU J H, et al.A novel thermostable β-galactosidase from Bacillus coagulans with excellent hydrolysis ability for lactose in whey[J].Journal of Dairy Science, 2019, 102(11):9740-9748.
[22] ZHANG X, YAO C X, WANG T, et al.Production of high-purity galacto-oligosaccharides (GOS) by Lactobacillus-derived β-galactosidase[J].European Food Research and Technology, 2021, 247(6), 1501-1510.
[23] VAILLANCOURT K, BÉDARD N, BART C, et al.Role of galK and galMin galactose metabolism by Streptococcus thermophilus[J].Applied and Environmental Microbiology, 2008, 74(4):1264-1267.
[24] 李嘉雯.嗜热链球菌半乳糖诱变株的选育及其发酵特性的研究[D].呼和浩特:内蒙古农业大学, 2021.
LI J W.Breeding of galactose mutant of Streptococcus thermophilus and its fermentation characteristics[D].Hohhot:Inner Mongolia Agricultural University, 2021.
[25] 王建宇, 李婷, 李敬, 等.芽孢杆菌35家族β-半乳糖苷酶的性质及其在合成低聚半乳糖中的应用[J].食品科学技术学报, 2023, 41(6):29-38.
WANG J Y, LI T, LI J, et al.Characterization of GH family 35 β-galactosidase from Bacillales sp.and its application in synthesis of galactooligosaccharides[J].Journal of Food Science and Technology, 2023, 41(6):29-38.
[26] 张夙夙. 乳酸菌的乳糖/半乳糖代谢及其应用[D].济南:山东大学, 2020.
ZHANG S S.Lactose/galactose metabolism of lactic acid bacteria and its application[D].Jinan:Shandong University, 2020.
[27] 蒋金龙, 贾建波.亚硝基胍诱变处理氧化亚铁硫杆菌的育种研究[J].矿产综合利用, 2005(1):21-24.
JIANG J L, JIA J B.Study on breeding of Thiobacillus ferrooxidans mutagenized with NTG[J].Multipurpose Utilization of Mineral Resources, 2005(1):21-24.
[28] 陆文伟.全局转录调控因子CodY在嗜热链球菌中的调控机制研究[D].济南:山东大学, 2014.
LU W W.Study on the regulatory mechanism of global transcription regulator CodY in Streptococcus thermophilus[D].Jinan:Shandong University, 2014.
[29] 赵兴文, 王然, 杨建珺, 等.嗜热链球菌发酵剂的筛选及其发酵特性研究[J].中国奶牛, 2024(3):34-41.
ZHAO X W, WANG R, YANG J J, et al.Screening and fermentation properties of Streptococcus thermophilus[J].China Dairy Cattle, 2024(3):34-41.
[30] 李源, 王佳瑶, 刘娇, 等.乳酸菌发酵对麦芽糯米水解液抗氧化活性及乳酸含量的影响[J].食品科技, 2022, 47(8):69-74.
LI Y, WANG J Y, LIU J, et al.Effect of lactic acid bacteria fermentation on antioxidant activity and lactic acid content of malt glutinous rice hydrolysate[J].Food Science and Technology, 2022, 47(8):69-74.
[31] 郭清泉, 张兰威, 夏秀芳.酸奶制品发生后酸化主要发酵剂菌确定及性质研究[J].食品与发酵工业, 2002, 28(4):24-27.
GUO Q Q, ZHANG L W, XIA X F.Determination and property research on main starter bacteria of yogurt to induce postacidification[J].Food and Fermentation Industries, 2002, 28(4):24-27.
[32] FILANNINO P, DI CAGNO R, CRECCHIO C, et al.Transcriptional reprogramming and phenotypic switching associated with the adaptation of Lactobacillus plantarum C2 to plant niches[J].Scientific Reports, 2016, 6:27392.
[33] 逄晓阳, 朱青, 芦晶, 等.乳酸菌群体感应系统研究进展[J].生物加工过程, 2020, 18(2):141-149.
PANG X Y, ZHU Q, LU J, et al.Progress in quorum sensing system of lactic acid bacteria[J].Chinese Journal of Bioprocess Engineering, 2020, 18(2):141-149.