炎症是一种特异性、自控的免疫反应,是机体针对有害刺激的防卫机制[1]。但是炎症失调会引发慢性系统损伤,即炎症性疾病。褐藻多酚(phlorotannin, PTN)是褐藻的次生代谢产物,具有良好的抗炎活性[2]。其抗炎机制主要包括抑制TNF-α、IL-1β、IL-6等促炎细胞因子和NO、前列腺素E2(prostaglandin E2, PGE2)、一氧化氮合酶、环氧合酶2等炎症介质的产生,降低激活蛋白-1和转录因子核因子-κB p50/p65的水平,并激活蛋白激酶B和丝裂素活化蛋白激酶p38信号通路[3-4]。PTN还能抑制炎症基因的活性,减少3T3-L1脂肪细胞中急、慢性炎症标志物及Toll样受体的mRNA表达。
利用环境酸碱差异是包埋和递送多酚的有效方法[5]。由于炎症组织(pH 5.7~6.8)和细胞外液(pH 7.4)之间存在pH梯度,并且内体(pH 5.5~6.0)和溶酶体(pH 4.5~5.0)具有酸性环境,pH敏感性载体在刺激响应递送系统中备受关注。pH响应递送系统可以选择性地通过低pH区域,同时在生理条件下保持稳定以减少副作用,是基于炎症组织微环境pH值与正常组织不同的智能响应系统常见设计思路[6]。单宁酸(tannic acid, TA)是一种天然弱酸性多酚,其化学结构中丰富的羟基可作为氢供体,与含有氢受体的分子形成的氢键[7]。TA能够与多种金属离子相互作用形成稳定的金属酚醛网络(metal phenolic network, MPN),金属配体可为聚合物之间提供稳定、可逆的交联点,从而实现聚合物的自组装[8-9]。配位金属可以控制MPN胶囊的薄膜厚度、荧光行为和拆解特性,是决定其性质的关键因素[10]。这种网络结构可以提高负载量并具有pH响应特性,对活性物质的释放至关重要。
玉米醇溶蛋白(zein)因其高包封能力和良好的生物降解性,被用于制备各种纳米递送系统[11]。碳量子点(carbon quantum dots, CQDs)具有尺寸小、光稳定性和生物相容性高等优势,在基因/药物递送、生物成像的荧光纳米探针以及抗菌等领域具有广阔的应用前景[12]。本文在zein和CQDs纳米颗粒的基础上,通过TA与Fe3+之间的螯合作用形成了在中性条件下稳定但在酸性条件下崩解的金属-多酚网络结构,用于PTN的包埋和缓释。研究了pH响应型多酚金属离子包覆纳米颗粒在不同pH条件下的持续释放行为、细胞毒性和抗炎活性。以期增强PTN的生物活性,扩大多酚-金属材料在功能食品与生物医药领域中的应用。
1 材料与方法
1.1 材料与试剂
D-无水葡萄糖(≥99.8%)、L-赖氨酸(≥99%),北京索莱宝生物科技有限公司;玉米醇溶蛋白(≥92%),上海源叶生物科技有限公司;褐藻多酚(≥95%),天门恒昌化工有限公司;单宁酸(≥99.7%)、FeCl3(≥99%)、脂多糖(lipopolysaccharide,LPS),上海麦克林生化科技有限公司;噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT),广州赛国生物科技有限公司;IL-10、TNF-α和IL-6酶联免疫吸附测定试剂盒,成都远诺天成科技有限公司;IL-1β酶联免疫吸附测定试剂盒,深圳益百顺科技有限公司;PGE2酶联免疫吸附测定试剂盒,上海酶联生物科技有限公司;总NO、活性氧(reactive oxygen species, ROS)测定试剂盒,上海碧云天生物技术有限公司;其他分析纯试剂均购自生工生物工程(上海)股份有限公司。
1.2 仪器与设备
Nano ZS90激光粒度仪,日本马尔文有限公司;cytoFLEX流式细胞仪,美国贝克曼库尔特有限公司;ECLIPSE Ts2倒置显微镜,尼康仪器有限公司。
1.3 实验方法
1.3.1 zein-PTN-CQDs纳米颗粒的制备与优化
通过美拉德反应制备CQDs[13]。将0.6 g葡萄糖和0.6 g L-赖氨酸充分溶解于40 mL去离子水中并放入微波炉中加热10 min。将所得淡黄色固体CQDs溶解在少量去离子水中,10 000 r/min离心10 min以去除固体沉淀物。上清液用0.22 μm滤膜过滤,经去离子水中透析24 h后,冷冻干燥得到纯净的CQDs。
将0.1 g zein和0.01 g PTN溶解于50 mL 70%(体积分数)乙醇溶液中,然后加入不同质量CQDs(zein与CQDs质量比分别为100∶0、100∶1、50∶1、20∶1、10∶1、5∶1、3∶1),并在1 000 r/min的转速下搅拌1 h。在50 ℃旋转蒸发以除去纳米颗粒中的乙醇,冷冻干燥后得到zein-PTN-CQDs纳米颗粒。按照此方法,制备不含CQDs的zein-PTN纳米颗粒作为对照。
1.3.2 zein-PTN-CQDs-FeⅢ纳米颗粒的制备
将0.1 g zein和0.01 g PTN溶解于50 mL 70%乙醇溶液中,然后加入0.004 g CQDs并在1 000 r/min的转速下搅拌1 h。磁力搅拌下依次滴加500 μL 24 mmol/mL的单宁酸溶液和500 μL 24 mmol/mL FeCl3溶液。继续搅拌2 h后用去离子水透析24 h,冷冻干燥后得到zein-PTN-CQDs-FeⅢ纳米颗粒[14]。
1.3.3 纳米颗粒的表征
1.3.3.1 粒径、电位测定
使用纳米粒度分析仪测量新制备样品的粒径和电位值。将样品用去离子水稀释至0.1 mg/mL测量3次。获得的颗粒尺寸为累积平均直径。测量温度为25 ℃。
1.3.3.2 包埋率和载药量测定
采用福林酚法[14]测定PTN的包埋率。梯度稀释0.2 mg/mL没食子酸标准溶液,将1 mL没食子酸溶液与1 mL 0.25 mol/L福林酚试剂振荡混匀,静置3 min后加入2 mL 150 g/L Na2CO3溶液,振荡混匀后静置30 min。用紫外可见分光光度计在760 nm下测定溶液的吸光度,绘制多酚标准曲线。配制0.1 mg/mL样品,按上述方法在760 nm下测定其吸光度,根据没食子酸标准曲线计算样品包埋的多酚含量。
1.3.4 多酚体外释放
将20 mL新鲜制备的PTN、zein-PTN、zein-PTN-CQDs和zein-PTN-CQDs-FeⅢ纳米颗粒悬浮液置于分子质量为8~14 kDa的透析袋中,然后将透析袋浸入不同pH值(7、6.2、5.0和4.0)的PBS。将装有透析袋的锥形瓶放入37 ℃恒温摇床以100 r/min的速度振荡,在特定时间点从透析袋中取出1 mL样品,并加入相同体积的空白缓冲液。用紫外分光光度计检测PTN的释放量[15]。
1.3.5 细胞复苏与培养
将HT-29细胞(人结肠癌细胞)和RAW 264.7细胞(小鼠巨噬细胞)从液氮中取出,迅速在37 ℃水浴中解冻,待冻存液融化后将细胞转入5 mL含10%胎牛血清的完全培养基的离心管中,在室温下1 000 r/min离心5 min,弃去上清液收集细胞。将细胞悬浮于完全培养基中并接种至培养皿,在37 ℃、5%(体积分数)CO2饱和湿度条件下培养。当细胞密度达到80%时进行传代:弃去培养基并用PBS清洗,加入1~2 mL 0.25%胰蛋白酶消化细胞1~2 min后,迅速弃去胰蛋白酶,加入完全培养基通过吹打细胞制备单细胞悬浮液,按1∶3扩增并在37 ℃、5% CO2饱和湿度条件下培养。
1.3.6 纳米颗粒的细胞毒性
1.3.6.1 HT-29细胞MTT检测
将处于对数生长期且状态良好的HT-29细胞以5×103个细胞/孔的密度接种于96孔板中,在37 ℃、5% CO2饱和湿度条件下过夜培养。用不同质量浓度zein-PTN-CQDs-FeⅢ纳米颗粒(0.02、0.1、0.5、2.5、12.5 mg/mL)处理细胞24 h。每孔添加10 μL MTT溶液,随后在37 ℃条件下孵育4 h。孵育结束后,移除培养基,并向每孔中加入150 μL 二甲基亚砜,振荡处理10 min。使用酶标仪检测各孔在568 nm波长下的吸光度。
1.3.6.2 细胞凋亡检测
将爬好细胞的玻片浸入40 g/L多聚甲醛(pH 7.4)溶液中,室温固定15 min,随后用PBS洗涤3次。向每片玻片滴加100 μL 20 μg/mL的蛋白酶K溶液,完全覆盖并在室温下孵育20 min。用去离子水润洗玻片,滴加100 μL 1×平衡缓冲液,确保覆盖样品区域,室温孵育15 min后加入末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase,TdT)孵育缓冲液。用塑料盖玻片覆盖组织,确保试剂均匀分布后放入湿盒,37 ℃孵育60 min。用PBS洗涤3次,滴加4′,6二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)并避光孵育5 min从而对细胞核染色。用含有抗荧光淬灭剂的封片液封片,24 h后通过荧光显微镜观察并收集图像。
1.3.7 纳米颗粒的体外抗炎活性
1.3.7.1 RAW 264.7细胞的处理
将处于对数生长期且状态良好的RAW 264.7细胞以5×105个细胞/孔的密度接种于6孔板中,在37 ℃、5% CO2饱和湿度条件下过夜培养。用1 μg/mL LPS诱导细胞,并分别加入不同质量浓度的zein-CQDS-FeⅢ溶液(25、50、100、200 μg/mL)、PTN溶液(25、50、100、200 μg/mL)和zein-PTN-CQDS-FeⅢ溶液(25、50、100、200 μg/mL),在37 ℃、5% CO2培养箱中培养24 h。
1.3.7.2 细胞ROS检测
将小鼠细胞1 500 r/min离心5 min,弃去上清液,用PBS洗涤细胞2次,每次在1 500/min下离心5 min。在PBS中加入1 mL稀释的二氢乙啶,在37 ℃培养20 min,每3 min混合一次。用无血清培养基清洗细胞3次,加入500 μL PBS重悬,用ROS阳性对照刺激20 min,采用流式细胞仪进行检测。
1.3.7.3 IL-1β、IL-10、IL-6、TNF-α和PGE2的分泌检测
小鼠细胞3 000 r/min离心10 min,取上清液进行检测。设置空白孔、标准孔和待测样品孔,分别加入100 μL标准品或样待测样品,37 ℃孵育90 min。弃除液体,每孔加入100 μL生物素化抗体工作液,37 ℃避光孵育1 h。再次弃除液体并用PBS洗板,每孔加入100 μL酶偶联物工作液,37 ℃避光孵育30 min。弃去液体并洗板,每孔加入90 μL显色剂,37 ℃避光孵育15 min。每孔加入50 μL终止液停止反应,立即用酶标仪测定各孔在450 nm下的吸光度值。
1.3.7.4 检测细胞上清液中的NO分泌
小鼠细胞3 000 r/min离心10 min,取上清液进行检测。向100 μL上清液中加入300 μL检测试剂,涡旋混匀后静置10 min,然后3 500 r/min离心15 min,取上清液。分别向空白孔、标准孔、测定孔中加入160 μL双蒸水、20 μmol/L亚硝酸钠标准液、上清液,然后加入80 μL显色剂,振荡混匀后静置15 min,用酶标仪测量各孔在550 nm下的吸光度值。
1.4 数据处理
所有实验至少重复测定3次,采用Origin 2018绘图,采用SPSS 27软件进行数据统计和邓肯检验,P<0.05表示差异显著。
2 结果与分析
2.1 纳米颗粒的表征
不同zein和CQDs比例对纳米颗粒粒径、电位的影响如图1-a所示。带有负电荷的CQDs能够中和zein-PTN的部分正电荷,形成紧凑结构,使得纳米颗粒粒径随CQDs的增大而逐渐减小。在zein与CQDs质量比为20∶1时,CQDs的负电荷可有效稳定纳米粒子,使其粒径最小并降低电位值,最终使系统稳定性达到最优状态。继续增加CQDs的添加量,zein颗粒被多层CQDs包裹,粒径增大至1 487 nm,这是由于zein-PTN纳米颗粒的正电荷不足以约束CQDs的负电荷,导致正负电荷失衡。在质量比达到3∶1时的粒径与电位受CQDs的主导。纳米颗粒的包埋率(encapsulation efficiency,EE)随CQDs增加而增加,并在5∶1时达到最高91%,表明zein与CQDs对PTN的包埋具有协同效应(图1-a)。这是因为zein、PTN和CQDs之间通过静电吸引力、氢键和疏水效应等相互作用提高PTN的EE[16]。当质量比达到3∶1时,由于PTN无法被体系中存在的过量CQDs包埋,导致EE显著降低。此外,壁材质量的增加导致载药量(loading capacity,LC)在质量比超过20∶1时开始下降。因此,选择zein与CQDs质量比为20∶1进行后续实验。
根据优化后条件制备所得zein-PTN-FeⅢ纳米颗粒的粒径为559.93 nm,电位为9.93 mV。PTN能够通过与富含脯氨酸的zein紧密结合,减小纳米颗粒的粒径。加入CQDs后,由于强烈的非共价作用力和电位的升高,导致静电斥力增大(15.63 mV),粒径进一步减小至428.40 nm。zein-PTN-FeⅢ纳米颗粒EE和LC分别为76.16%和8.69%。CQDs通过提供更多相互作用位点使zein、PTN、CQDs三者紧密结合,从而显著提高zein-PTN-CQDS-FeⅢ纳米颗粒的EE(87.72%,P<0.05),变化趋势与粒径一致。zein-PTN-CQDs-FeⅢ纳米颗粒的EE优于由zein和CQDs制备的紫杉醇纳米颗粒(80%),以及β-环糊精和CQDs制备的柚皮素纳米颗粒(56.9%)[17-18]。但CQSs的加入会导致纳米颗粒干燥后的质量增大,降低LC。结果表明,通过添加TA和Fe3+能够在纳米颗粒表面形成多酚-金属包封网络结构,减小纳米颗粒的粒径,提高电位和EE。
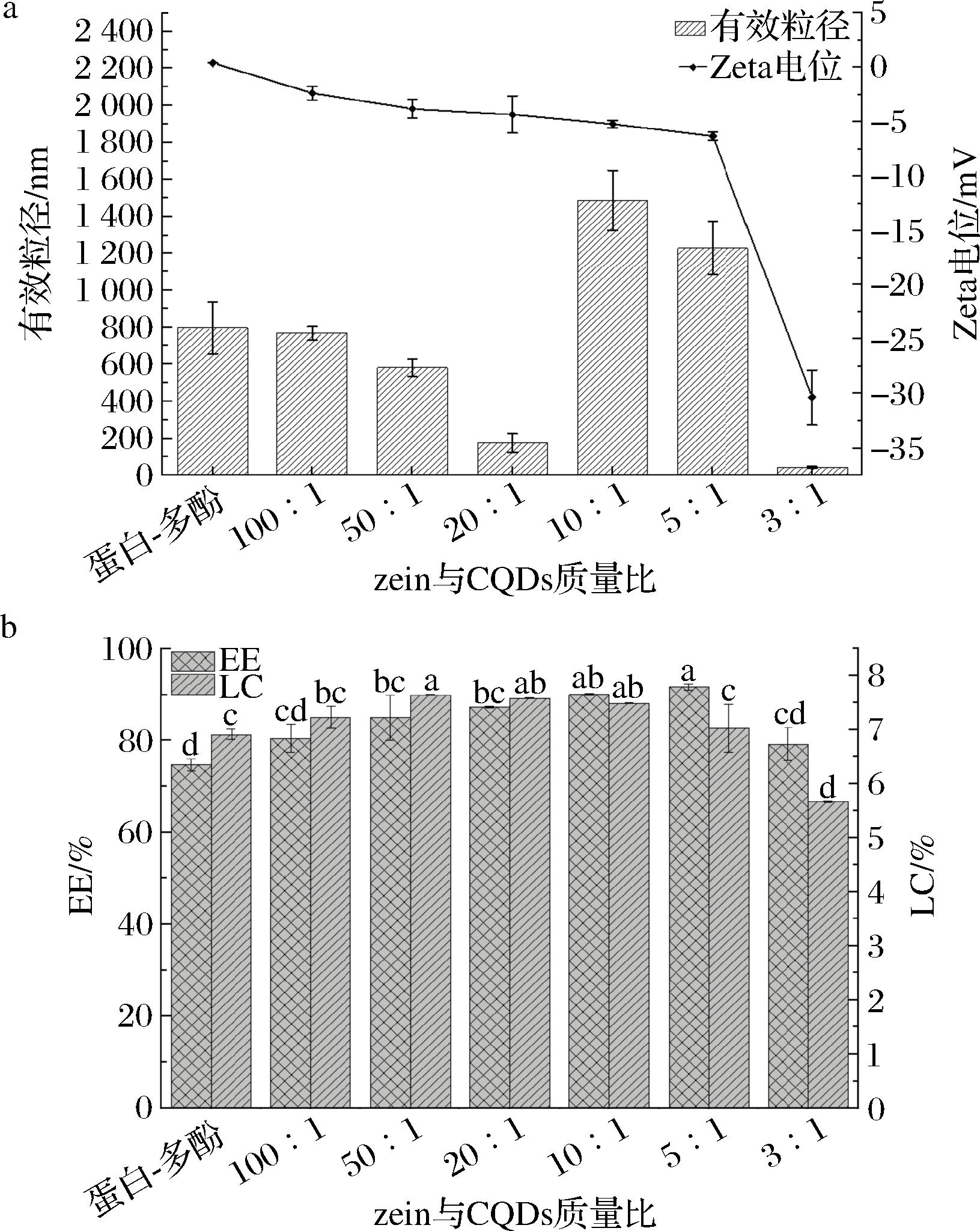
a-zein和CQDs质量比对纳米颗粒粒径、电位的影响;b-zein和CQDs质量比对纳米颗粒包埋率、载药量的影响
图1 不同zein和CQDs比例对纳米颗粒的影响
Fig.1 Effects of different rations of zein and CQDs on the nanoparticles
2.2 多酚体外释放分析
不同pH值(7、6.2、5.0、4.0)条件下PTN、zein-PTN、zein-PTN-CQDs和zein-PTN-CQDS-FeⅢ纳米颗粒悬浮液体外释放曲线如图2所示。在4种pH条件下,PTN、zein-PTN和zein-PTN-CQDs的释放速率基本相同,表明pH的变化对释放速率没有影响。此外,PTN在体外的释放率非常低,约为25%。用zein包埋后,释放率提高到约76%。添加CQDs后,释放率进一步增加到约85%。说明由zein和CQDs包埋的PTN纳米颗粒具有一定的保护作用,不仅能提高PTN的释放率,还能实现持续释放。加入TA和Fe3+后,PTN的累积释放率呈现出pH响应和持续释放的特性。在pH 7条件下,累积释放率为28%;在pH值为6.2、5和4条件下,累积释放率分别提高到78%、89%和96%,表明zein-PTN-CQD-FeⅢ纳米颗粒在酸性条件下的释放率高于中性条件下的释放率。这是因为TA和金属离子会在纳米颗粒表面形成一层金属-多酚包膜,其在中性条件下非常稳定。在酸性条件下,TA上的酚羟基会发生质子化并与金属离子竞争螯合,使纳米颗粒的结构不稳定甚至解离,导致纳米颗粒中被包埋的多酚释放,从而提高了释放率。此外,PTN的累积释放率在9 h左右保持不变,PTN释放完全,表明zein-PTN-CQDs-FeⅢ纳米颗粒可以改善PTN的释放率和释放时间。这些结果表明,zein-PTN-CQDs-FeⅢ纳米颗粒可以在不同的酸碱环境中实现PTN的控制释放和持续释放。
2.3 细胞毒性分析
2.3.1 细胞MTT分析
通过MTT试验评估了zein-PTN-CQDs-FeⅢ纳米颗粒对人结肠癌细胞(HT-29细胞)的体外细胞毒性。图3显示了不同质量浓度(0、0.02、0.1、0.5、2.5、12.5 mg/mL)的zein-PTN-CQDs-FeⅢ纳米颗粒对HT-29细胞的活力。结果表明,纳米颗粒对HT-29细胞具有显著的细胞毒性,且呈剂量依赖性。在未添加纳米颗粒的情况下,细胞活力为100%;当纳米颗粒质量浓度为0.02、0.1 mg/mL时,细胞活力分别为95.26%和94.83%,且无明显的凋亡现象。这可能是因为此时纳米颗粒浓度较低,PTN的释放量较少,对细胞的毒性较低。随着zein-PTN-CQDs-FeⅢ纳米颗粒浓度的增加,细胞活力明显下降(P<0.05)。在12.5 mg/mL时,zein-PTN-CQDs-FeⅢ纳米颗粒的活力降至26.65%,说明高浓度的zein-PTN-CQDs-FeⅢ纳米颗粒可以诱导细胞死亡。此时纳米颗粒的浓度较高,PTN的释放量较大,并且纳米级尺寸更有利于多酚类物质渗透进入癌细胞,从而导致更多的细胞死亡[19]。以上结果表明,制备的纳米颗粒对癌细胞生长的具有良好的抑制能力。
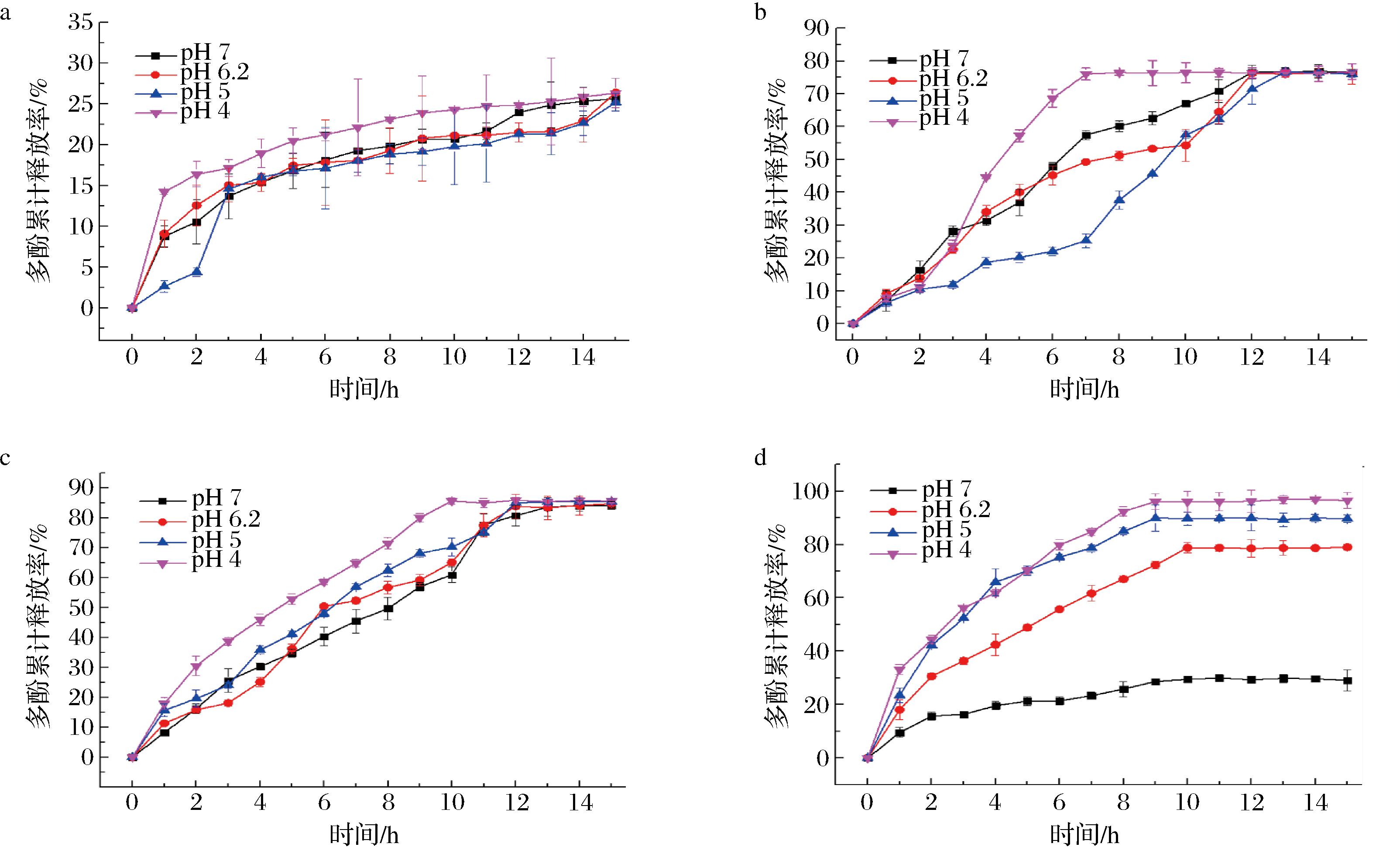
a-PTN;b-zein-PTN;c-zein-PTN-CQDs;d-zein-PTN-CQDs-FeⅢ
图2 PTN在pH值为7、6.2、5、4下的体外释放速率
Fig.2 In vitro release rates of PTN at pH value of 7, 6.2, 5, and 4
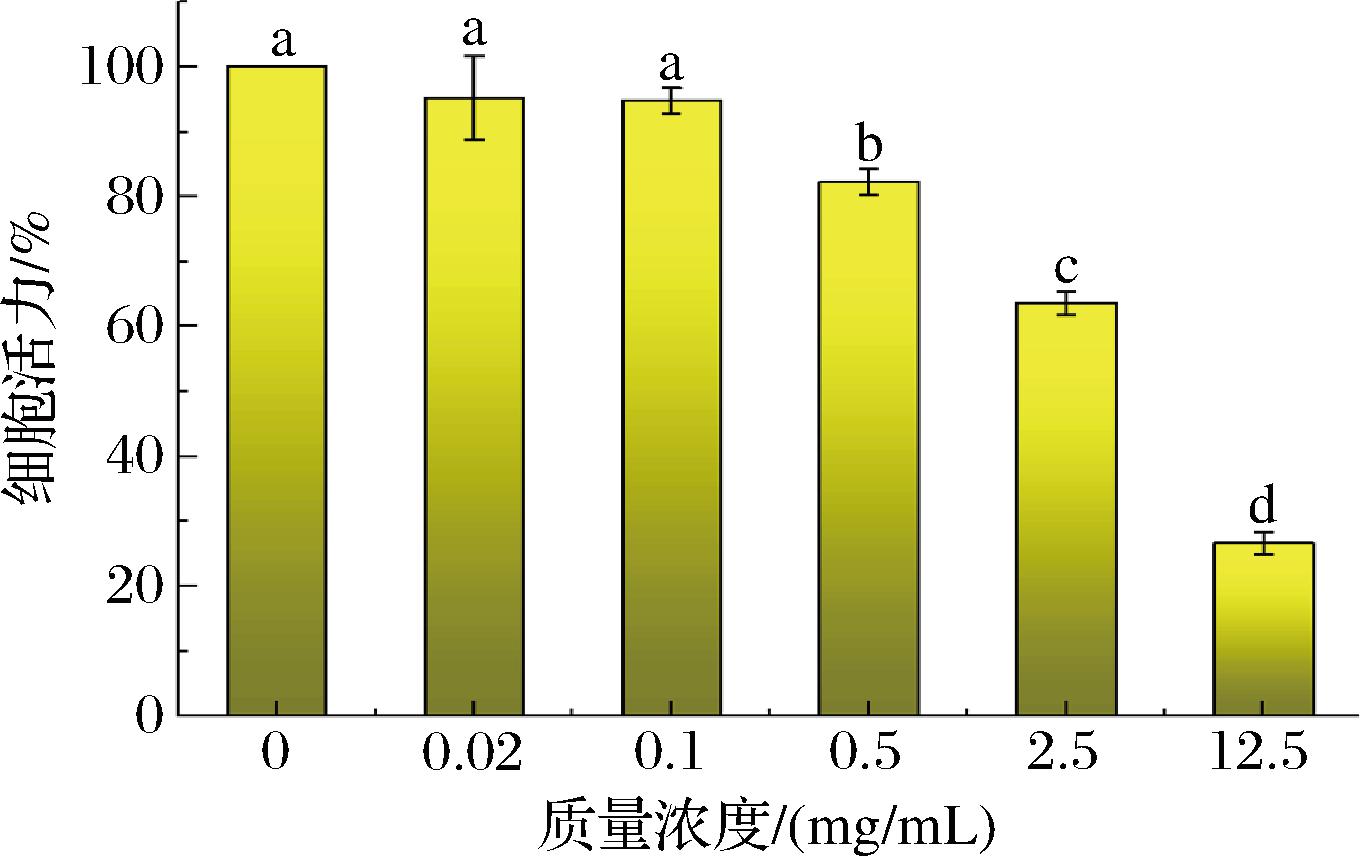
图3 zein-PTN-CQDs-FeⅢ在不同质量浓度下的细胞活力
Fig.3 Cell viability of zein-PTN-CQDs-FeⅢ at different concentrations
2.3.2 细胞凋亡检测与分析
为进一步探究zein-PTN-CQDs-FeⅢ纳米颗粒对HT-29细胞的毒性,使用DAPI对细胞进行染色,并用荧光显微镜观察不同质量浓度(0、0.02、0.1、0.5、2.5、12.5 mg/mL)的zein-PTN-CQDs-FeⅢ纳米颗粒对细胞凋亡的影响,结果如图4所示。凋亡细胞在荧光显微镜下显示为红色荧光,正常细胞则呈蓝色荧光。没有加入纳米颗粒的阴性对照组HT-29细胞呈现蓝色荧光,分散性好、形态完整、分布广、活力强,没有发生细胞凋亡。当纳米颗粒质量浓度增加到0.02、0.1 mg/mL时,红色荧光细胞的数量略有增加,表明细胞开始凋亡。随纳米颗粒浓度上升,图像中的红色荧光继续增加,当质量浓度达到0.5 mg/mL时,出现大面积细胞凋亡。结果表明,纳米颗粒会以剂量依赖的方式导致癌细胞凋亡,这与细胞毒性实验的结果一致[20]。
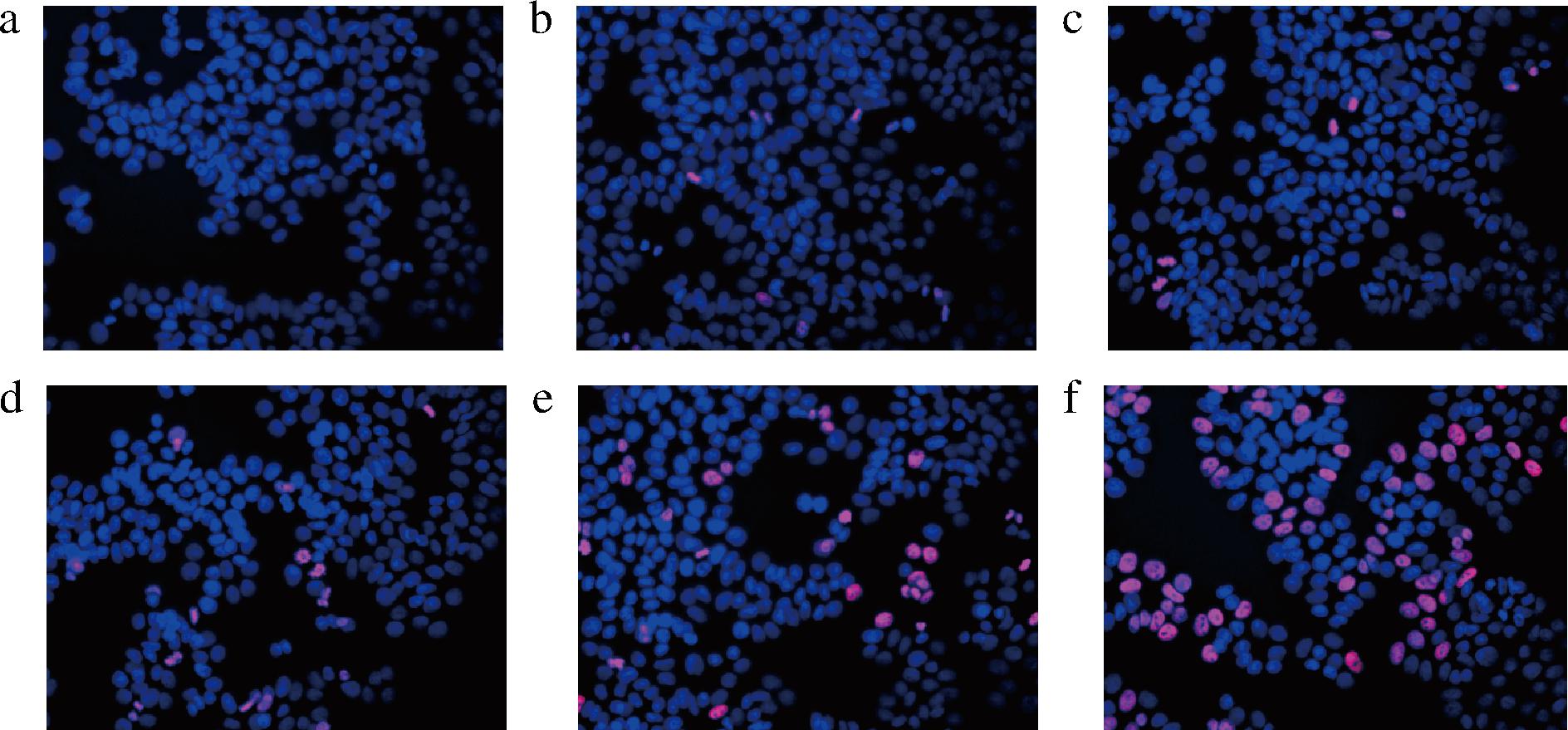
a-0 mg/mL;b-0.02 mg/mL;c-0.1 mg/mL;d-0.5 mg/mL;e-2.5 mg/mL;f-12.5 mg/mL
图4 不同浓度zein-PTN-CQDs-FeⅢ的细胞凋亡图像(×400)
Fig.4 Apoptosis images of zein-PTN-CQDs-FeⅢ at different concentrations (×400)
2.4 纳米颗粒体外抗炎活性分析
2.4.1 ROS的分泌情况分析
氧是细胞功能所必需的代谢底物,但过量的ROS会引发氧化应激,从而导致氧化损伤。同时,ROS会不可逆地破坏细胞器和生物大分子,进一步导致炎症反应,是许多炎症性疾病发生的关键因素[21]。zein-CQDs-FeⅢ纳米颗粒、zein-PTN-CQDs-FeⅢ纳米颗粒和PTN对LPS诱导的RAW 264.7细胞产生ROS的影响如图5所示。LPS处理会诱导RAW 264.7细胞产生大量ROS,从而引发炎症因子分泌量的增加。zein-CQDs-FeⅢ组的细胞ROS产生与LPS组的相似,表明不含PTN的纳米颗粒抗氧化能力不佳。PTN可以显著降低细胞ROS的产生,抗氧化效果表现出剂量依赖性,在质量浓度达200 μg/mL时使ROS含量恢复正常水平。zein-PTN-CQDs-FeⅢ表现出比PTN单独作用更强的ROS抑制能力,表明纳米颗粒主要依靠PTN发挥抗氧化作用,包埋能够通过增强PTN的细胞渗透能力提高PTN的抗氧化活性。
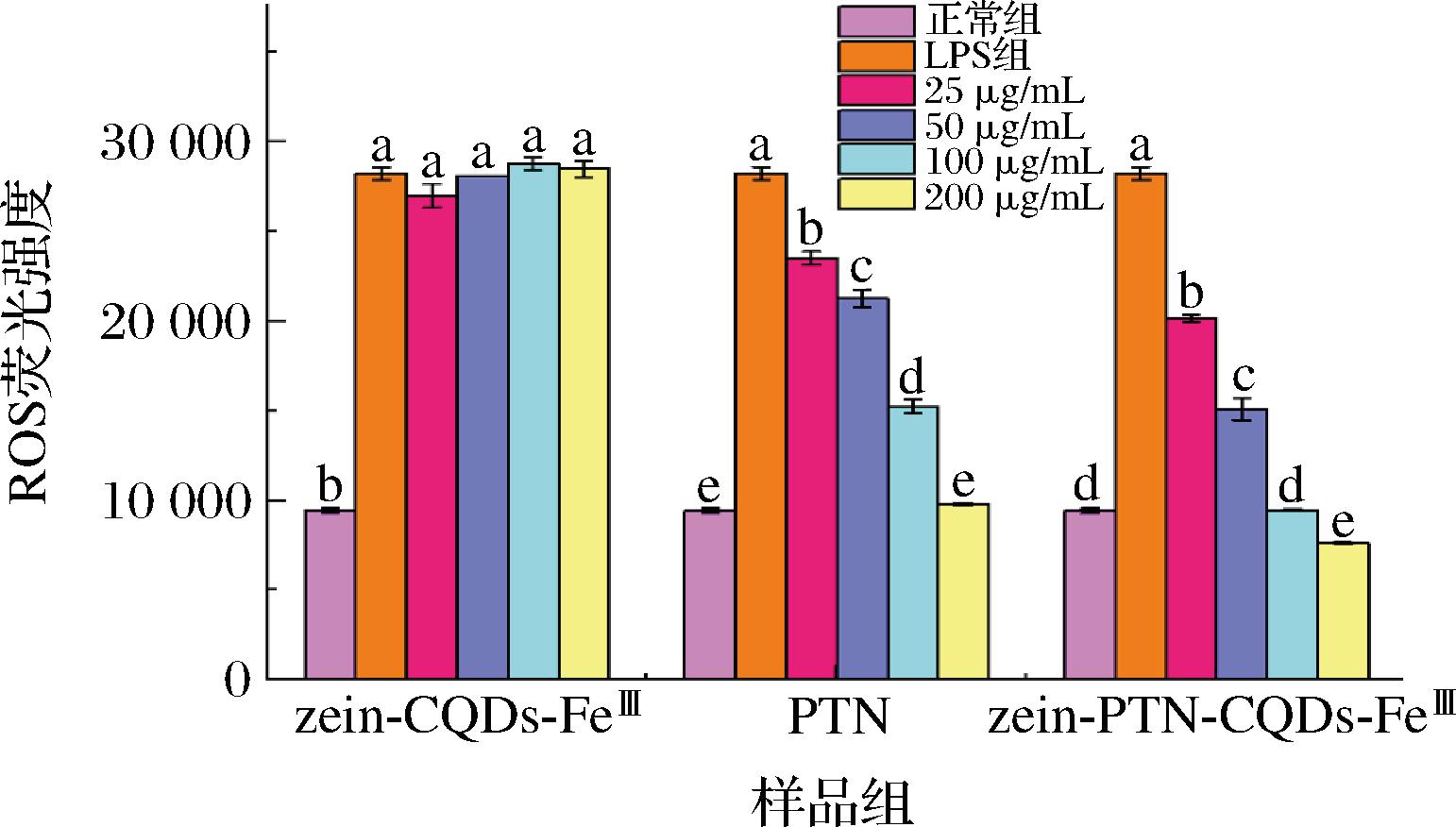
图5 RAW 264.7细胞中ROS的含量分析
Fig.5 Analysis of ROS contents in RAW 264.7 cell
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.4.2 IL-1β、IL-10、IL-6、TNF-α和PGE2的分泌情况分析
LPS会刺激巨噬细胞分泌IL-1β、IL-10、IL-6、TNF-α和PGE2等细胞因子,这些细胞因子的过量产生会导致免疫功能失调、组织损伤和器官功能障碍,最终损害机体[22]。zein-CQDs-FeⅢ纳米颗粒和zein-PTN-CQDs-FeⅢ纳米颗粒和PTN在调节LPS诱导的RAW 264.7细胞炎症反应模型中各种物质分泌的情况如图6所示。与空白组相比,LPS处理导致细胞中促炎因子(IL-1β、IL-6和TNF-α)的含量显著上升,分别为空白组的3.65、2.96和3.45倍。LPS组的抗炎因子IL-10和PGE2的含量分别下降了32.48%和44.69%(P<0.05)。不同浓度的zein-CQDs-FeⅢ纳米颗粒处理后,促炎因子和抗炎因子的含量与LPS造模组相比无明显变化。而不同浓度zein-PTN-CQDs-FeⅢ纳米颗粒处理后,细胞中的促炎因子含量明显降低,抗炎因子含量则显著上升(P<0.05),表明纳米颗粒抗炎效果呈剂量依赖性。与PTN组相比,接受不同浓度zein-PTN-CQDs-FeⅢ处理后,促炎因子含量更低,而抗炎因子含量更高,表明纳米颗粒能够提高PTN的抗炎活性,这与ROS含量的变化一致。结果表明,zein-PTN-CQDs-FeⅢ具有良好的促炎因子的抑制能力和抗炎因子的促进能力。
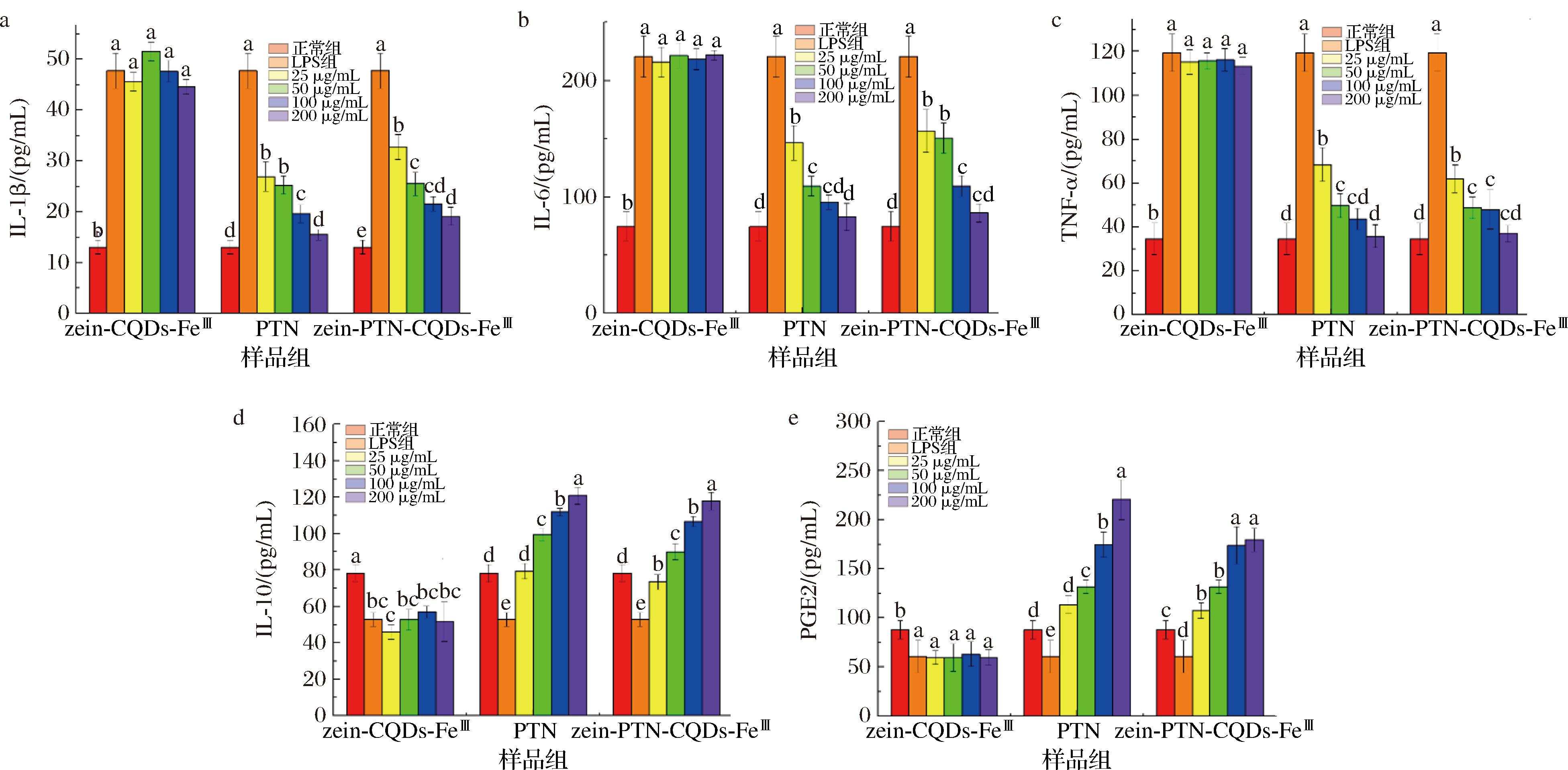
a-IL-1β;b-IL-6;c-TNF-α;d-IL-10;e-PGE2
图6 RAW 264.7细胞中炎症因子的含量分析
Fig.6 Analysis of inflammatory cytokines in RAW 264.7 cell
2.4.3 NO的分泌情况分析
zein-CQDs-FeⅢ纳米颗粒、zein-PTN-CQDs-FeⅢ纳米颗粒和PTN在LPS诱导的RAW 264.7细胞炎症反应模型中调节NO分泌的情况如图7所示。LPS能够直接作用于巨噬细胞,加速NO的过量生成并引发细胞的炎症反应。与正常组相比,添加LPS后3组的NO含量均显著增加(P<0.05)。适量的NO可作为信使分子,在血管扩张、神经传递和炎症反应调节中发挥重要作用,但过量的NO可诱导炎症反应的过度表达,甚至诱导细胞凋亡和坏死。不同浓度zein-CQDs-FeⅢ纳米颗粒对细胞NO含量的变化无明显影响,表明zein-CQDs-FeⅢ纳米颗粒本身不具有抗炎作用。然而,随着PTN和zein-PTN-CQDs-FeⅢ纳米颗粒浓度的增加,NO含量均呈明显的剂量依赖效应下降,且zein-PTN-CQDs-FeⅢ组的下降幅度大于PTN组。结果表明,zein-PTN-CQDs-FeⅢ纳米颗粒比zein-CQDs-FeⅢ纳米颗粒和PTN具有更强的抗炎作用,纳米颗粒的包埋使得PTN的抗炎效果最大化。
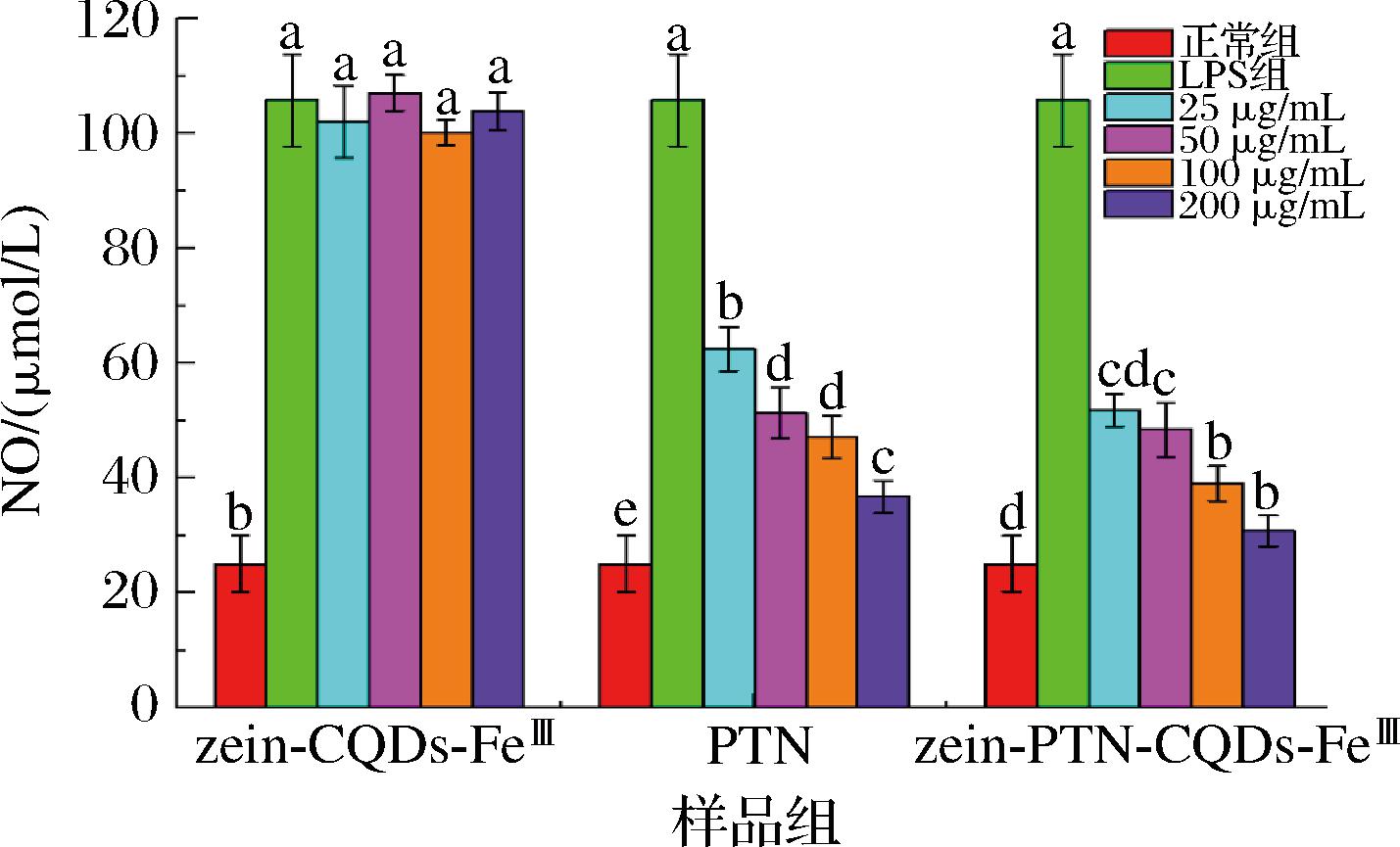
图7 RAW 264.7细胞中NO的含量分析
Fig.7 Analysis of NO contents in RAW 264.7 cell
3 结论与讨论
本文制备并表征了zein-PTN-CQDs-FeⅢ纳米颗粒,研究了其体外多酚释放率、对HT-29细胞的毒性和对RAW 264.7细胞的抗炎活性。加入CQDs可以有效降低纳米粒子的粒径、提高包埋率。加入TA和Fe3+后,TA的酚羟基可与Fe3+发生络合作用和静电相互作用,在纳米粒子表面形成网络结构实现pH响应。PTN体外释放分析表明,zein-PTN-CQDs-FeⅢ纳米颗粒在不同pH条件(pH 7、6.2、5.0和4.0)下具有pH响应特性。细胞MTT毒性测试和DAPI染色表明,纳米颗粒对HT-29细胞具有显著的剂量依赖性细胞毒性。浓度越高,细胞活力显著降低。RAW 264.7细胞抗炎实验表明,zein-CQDs-FeⅢ本身无明显抗炎活性,但能通过增强细胞渗透提高PTN的抗氧化和抗炎活性。zein-PTN-CQDs-FeⅢ纳米颗粒的抗炎效果呈剂量依赖性,对促炎因子的抑制和抗炎因子的促进作用优于PTN单独作用。本研究利用pH响应性实现PTN在不同酸碱条件下的释放,为活性物质的靶向控制释放提供了理论依据。
[1] 郑雅君, 李美秀, 姜泽东, 等.琼胶寡糖对脂多糖诱导的巨噬细胞RAW 264.7炎症反应的抑制作用[J].中国食品学报, 2022, 22(6):72-82.
ZHENG Y J, LI M X, JIANG Z D, et al.Inhibition of agar-oligosaccharides on the lipopolysaccharide-induced inflammatory reaction in macrophages RAW 264.7[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(6):72-82.
[2] 梁馨元, 孙露川阳, 刘玥婷, 等.海藻多酚的生物活性研究进展[J].食品安全质量检测学报, 2021, 12(4):1412-1420.
LIANG X Y, SUN L, LIU Y T, et al.Research progress in bioactivity studies of seaweed polyphenols[J].Journal of Food Safety &Quality, 2021, 12(4):1412-1420.
[3] UMMAT V, TIWARI B K, JAISWAL A K, et al.Optimisation of ultrasound frequency, extraction time and solvent for the recovery of polyphenols, phlorotannins and associated antioxidant activity from brown seaweeds[J].Marine Drugs, 2020, 18(5):250.
[4] GONG X B, YANG Y, HUANG L G, et al.Antioxidation, anti-inflammation and anti-apoptosis by paeonol in LPS/d-GalN-induced acute liver failure in mice[J].International Immunopharmacology, 2017, 46:124-132.
[5] GUO J L, SUMA T, RICHARDSON J J, et al.Modular assembly of biomaterials using polyphenols as building blocks[J].ACS Biomaterials Science &Engineering, 2019, 5(11):5578-5596.
[6] BAI Y, SUN Y H, GU Y, et al.Preparation, characterization and antioxidant activities of kelp phlorotannin nanoparticles[J].Molecules, 2020, 25(19):4550.
[7] 何南, 王振全, 董蕙, 等.单宁酸-铁离子纳米薄膜的合成及应用现状[J].环境化学, 2021, 40(11):3553-3560.
HE N, WANG Z Q, DONG H, et al.Synthesis and application of tannic acid-iron ion nano films[J].Environmental Chemistry, 2021, 40(11):3553-3560.
[8] GUO Z H, XIE W S, LU J S, et al.Tannic acid-based metal phenolic networks for bio-applications:A review[J].Journal of Materials Chemistry B, 2021, 9(20):4098-4110.
[9] MAERTEN C, LOPEZ L, LUPATTELLI P, et al.Electrotriggered confined self-assembly of metal-polyphenol nanocoatings using a morphogenic approach[J].Chemistry of Materials, 2017, 29(22):9668-9679.
[10] HUANG H, LI P, LIU C L, et al.pH-Responsive nanodrug encapsulated by tannic acid complex for controlled drug delivery[J].RSC Advances, 2017, 7(5):2829-2835.
[11] 杨婷婷, 任李顺, 陈光未, 等.玉米醇溶蛋白负载植物甾醇纳米颗粒的制备及性能[J].食品科学, 2023, 44(18):40-48.
YANG T T, REN L S, CHEN G W, et al.Preparation and properties of zein loaded phytosterol nanoparticles[J].Food Science, 2023, 44(18):40-48.
[12] MOLAEI M J.Principles, mechanisms, and application of carbon quantum dots in sensors:A review[J].Analytical Methods, 2020, 12(10):1266-1287.
[13] GAO W W, CHAN J M, FAROKHZAD O C.pH-Responsive nanoparticles for drug delivery[J].Molecular Pharmaceutics, 2010, 7(6):1913-1920.
[14] 史航. 卵清蛋白基复合载体的构建及其负载山奈酚/单宁酸的研究[D].锦州:渤海大学, 2020.
SHI H.Construction of ovalbumin-based composite carrier and study on kaempferol/tannic acid loading on it[D].Jinzhou:Bohai University, 2020.
[15] 马园. 基于荧光碳量子点的药物递送系统构建及性能研究[D].太原:太原理工大学, 2019.
MA Y.Construction and performance research of drug delivery system based on fluorescent carbon dots[D].Taiyuan:Taiyuan University of Technology, 2019.
[16] DAI L, LI R R, WEI Y, et al.Fabrication of zein and rhamnolipid complex nanoparticles to enhance the stability and in vitro release of curcumin[J].Food Hydrocolloids, 2018, 77:617-628.
[17] PATEL P, PATHAK A, JAIN K.Novel ligand decorated theranostic zein nanoparticles coloaded with paclitaxel and carbon quantum dots:Formulation and optimization[J].Nanomedicine, 2024, 19(5):367-382.
[18] LIANG Y, HOU D Y, NI Z, et al.Preparation, characterization of naringenin, β-cyclodextrin and carbon quantum dot antioxidant nanocomposites[J].Food Chemistry, 2022, 375:131646.
[19] RASHIDZADEH H, REZAEI S J T, ZAMANI S, et al.pH-sensitive curcumin conjugated micelles for tumor triggered drug delivery[J].Journal of Biomaterials Science,Polymer Edition, 2021, 32(3):320-336.
[20] ZHANG Q, WANG J, LIU D, et al.Targeted delivery of honokiol by zein/hyaluronic acid core-shell nanoparticles to suppress breast cancer growth and metastasis[J].Carbohydrate Polymers, 2020, 240:116325.
[21] BIST G, PUN N T, MAGAR T B T, et al.Inhibition of LPS-stimulated ROS production by fluorinated and hydroxylated chalcones in RAW 264.7 macrophages with structure-activity relationship study[J].Bioorganic &Medicinal Chemistry Letters, 2017, 27(5):1205-1209.
[22] PARK C M, PARK J Y, NOH K H, et al.Taraxacum officinale Weber extracts inhibit LPS-induced oxidative stress and nitric oxide production via the NF-κB modulation in RAW 264.7 cells[J].Journal of Ethnopharmacology, 2011, 133(2):834-842.