传统发酵牦牛酸奶是西藏人民家庭生计的支柱,同时它对生活在高海拔恶劣环境下的藏族人饮食做出了重要贡献[1]。独特的高原环境也赋予了牦牛酸奶特殊的生理活性,其成分及制品为人体提供了丰富的能量和营养[2]。但由于西藏居民身处海拔恶劣的地理环境,可能会导致人体免疫力低下并患有慢性疾病,如拉萨部分地区人民脂肪肝发病率较高等[3]。牦牛酸奶除了含有丰富的营养价值外,其中含有的益生菌不仅在调节人体内菌群平衡、抗炎、抗氧化、抗肿瘤作用等方面起直接作用或间接作用,而且还含有免疫球蛋白、胰岛素生长因子、表皮生长因子等多种免疫活性物质,这对维护藏族牧民健康起着至关重要的作用,具有很大的开发应用潜力[4]。
乳酸菌是传统酸奶微生物群中最普遍的菌群,乳酸菌、乳球菌和链球菌是最常见的属,通常占细菌总数的90%以上[5]。许多学者在西藏传统发酵食品中发现了不同类型的功能乳酸菌,ZHANG等[6]从传统藏曲拉筛选的乳酸菌经过性能测试,选择的7种乳酸菌菌株作为促进宿主的健康、保持肠道菌群平衡的益生菌候选物。SHEHATA等[7]从乳制品和非乳制品中筛选出的9株乳酸菌,它们对高胆固醇去除率和表达的BSH活性表现出良好的抵抗力。DING等[8]从西藏牦牛乳中筛选的植物乳植杆菌Lp3通过动物实验表明可以用于治疗高脂血症,并可用于功能性食品。也有学者筛选出了具有免疫调节能力的功能乳酸菌,蒙月月[9]研究的植物乳植杆菌KLDS1.0318具有较好生长特性和耐受性,且该菌株在小鼠体内具有免疫调节作用;TARIQUE等[10]从传统酸奶中分离的菌株如链球菌属、鼠李糖乳酪杆菌等都产生胞外多糖(exopolysaccharides,EPS),分离株MBL3和MBL10的2种潜在益生菌对脾细胞C57BL/6和BALB/c有良好的的免疫调节作用;陈丽娥等[11]从青海西宁酸奶样品中分离得到1株具有提高免疫力功能的发酵乳杆菌691,能促进环磷酰胺引起的小鼠免疫功能抑制的恢复。因此,由于其良好的益生菌特性,乳酸菌是否有作为益生菌的潜力,它必须满足特定标准,包括抵抗胃肠道酸性条件的能力、黏附在肠黏膜上的能力、不存在毒力因子、对抗生素的耐药性等,以便到达宿主的肠道以发挥其益生性[12]。
由于资源和地理限制,西藏牦牛酸奶中丰富的乳酸菌资源目前没有得到合理开发和利用,关于牦牛酸奶中具有益生功能乳酸菌分离筛选的信息很少。因此,本研究以西藏传统发酵牦牛酸奶为样本,分离筛选出具有潜在免疫调节功能的的乳酸菌菌株,以鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus)LGG为阳性对照,从耐酸、耐胆盐、人工胃肠液耐受性、抗生素敏感性等来评估分离乳酸菌的体外益生性能,并测定菌株的黏附性和产胞外多糖能力来间接评价优势菌株的免疫调节功能潜力,以期通过后期动物体内实验来进一步验证其免疫活性。本研究对西藏地区牦牛酸奶中的功能性乳酸菌资源进行深度挖掘,为后续研究开发免疫功能性乳酸菌产品提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
本试验所用的酸奶样本均采自西藏日喀则和阿里地区不同县、村的传统自然发酵牦牛酸奶,在采样过程中,样本收集在50 mL无菌离心管中,用-20 ℃车载冰箱运回实验室后,保存于-4 ℃冰箱备用。
鼠李糖乳酪杆菌LGG ATCC 53103,上海保藏微生物中心;MRS肉汤培养基,北京奥博星生物技术有限公司;细菌基因组DNA提取试剂盒,天根生化科技有限公司;牛胆酸钠、胃蛋白酶、胰蛋白酶、透析袋,北京博奥拓达科技有限公司;抗生素药敏片,常德比克曼生物科技有限公司;其余试剂均为分析纯或进口试剂。
LDZX-50L-I型立式高压蒸汽灭菌器,上海申安医疗器械厂;LRH-250生化培养箱,上海一恒科技有限公司;2-16N型高速微量离心机,湖南恒诺仪器设备有限公司;T20型PCR仪,杭州朗基科学仪器有限公司;Tanon 1600型凝胶成像系统,上海天能科技公司;1300 SERIES A2型超净工作台,美国Thermo公司;UV-1780紫外-可见分光光度计,日本岛津公司。
1.2 实验方法
1.2.1 乳酸菌的分离纯化及鉴定
取牦牛酸奶样本1 g于9 mL无菌生理盐水中,涡旋振荡混匀后进行梯度稀释,取10-5~10-7 CFU的稀释液均匀涂布于MRS固体平板,倒置平板于37 ℃厌氧箱培养48~72 h,根据菌落形态特征挑取具有乳酸菌形态的单菌落,连续转接于MRS固体平板直至镜检为纯菌落[13]。纯化后的菌株接种于MRS培养基37 ℃培养24 h,挑取单菌落进行革兰氏染色及过氧化氢酶测定,纯化的菌株和30%灭菌甘油1∶1保存至冻存管中,-80 ℃保藏备用。
收集活化后的菌体,根据细菌DNA提取试剂盒方法提取DNA,提取成功后用1%(质量浓度)的琼脂糖凝胶电泳检测DNA的提取质量并测定其浓度和纯度。PCR扩增体系:10×PCR buffer(Mg2+plus)2.5 μL,dNTP Mixture 2.0 μL,上游引物1.0 μL,下游引物1.0 μL,DNA模板1.0 μL,rTaq DNA聚合酶(5 U/μL)0.3 μL,ddH2O补足至25 μL。细菌16S rRNA基因V3~V4可变区:上游引物27F:5′-AGAGTTTGATCMTGGCTCAG-3′,下游引物1492R:5′-GGTTACCTTGTTACGACTT-3′。PCR扩增条件:95 ℃预变性3 min,35个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,72 ℃稳定延伸10 min),最后4 ℃保存。将测序序列与NCBI数据库中的已知序列进行比对,并用MEGA 11软件构建系统发育树。
1.2.2 耐酸能力测定
耐酸性测定参照MULAW等[14]的方法略有修改,用0.1 mol/L的乳酸分别调整MRS液体培养基的pH值为1.5、2.5、3.5、4.5、5.5,灭菌冷却后待测菌液按2%的接种量(菌体浓度为108 CFU/mL)接种至液体培养基,37 ℃恒温培养24 h,测定OD600nm吸光值,3次平行。
1.2.3 耐胆盐能力测定
胆盐耐受性测定参照胡伟中等[15]的方法略有修改,用牛胆酸钠调整MRS液体培养基中牛胆盐质量浓度分别为1、2、3、4、5 g/L,灭菌冷却后待测菌液按2%的接种量(菌体浓度为108 CFU/mL)接种至液体培养基,37 ℃恒温培养24 h,测定OD600nm吸光值,3次平行。
1.2.4 人工胃肠液耐受性
参照李建军等[16]的方法,配制3.5 g/L胃蛋白酶溶液(用灭菌磷酸盐缓冲液溶解,调整pH值至3.0),用0.22 μm滤膜过滤备用即为模拟人工胃液。配制1 g/L胰蛋白酶溶液(用含3 g/L胆盐的灭菌的磷酸盐缓冲液溶解,调整pH值至8.0),过滤备用即为模拟人工肠液。调整待测菌液浓度为108 CFU/mL,将菌液接种于模拟人工胃液中,37 ℃摇床培养,在第3 h取样进行菌落计数。乳酸菌接种人工胃液培养3 h后,取1 mL加入9 mL模拟人工肠液中,37 ℃摇床培养,于第3 h取样进行菌落计数。
1.2.5 自聚集性和疏水性测定
菌株自聚集性的测定参考MEGUR等[17]的方法并稍作修改,将活化后的菌液(108 CFU/mL)6 000 r/min离心10 min,沉淀用无菌PBS(pH 7.2)洗涤后重悬于PBS中,调整菌液吸光度在0.8±0.05范围内,室温静置分别于第1、3、6 h取样测定OD600nm值,自聚集率按公式(1)计算:
自聚集率![]()
(1)
式中:A0,0 h的吸光值,At,不同时间点的吸光值。
菌株疏水性测定参考HE等[18]的方法并稍作修改,将活化后的菌液(108 CFU/mL)6 000 r/min离心10 min,沉淀用无菌PBS(pH 7.2)洗涤后重悬于PBS中,调整菌液吸光度在0.8±0.05范围内。吸取3 mL菌液与1 mL二甲苯、乙酸乙酯分别涡旋混合,室温静置30 min,取下层水相测定OD600nm的吸光度值,以无菌PBS为空白对照,疏水率按公式(2)计算:
疏水率![]()
(2)
式中:A0,0 h的吸光值;At,静止30 min后的吸光值。
1.2.6 抗生素药敏性试验
采用药敏纸片扩散法测定分离菌株对抗生素的耐药性[19],吸取待测菌液100 μL均匀涂布MRS固体培养基表面,待菌液吸收后将药敏纸片贴至表面,37 ℃恒温培养24 h,测量抑菌圈直径。评判标准参照美国临床与实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)进行,17种抗生素种类及判断标准见表1。
表1 药敏纸片标准
Table 1 Criteria of drug sensitive paper
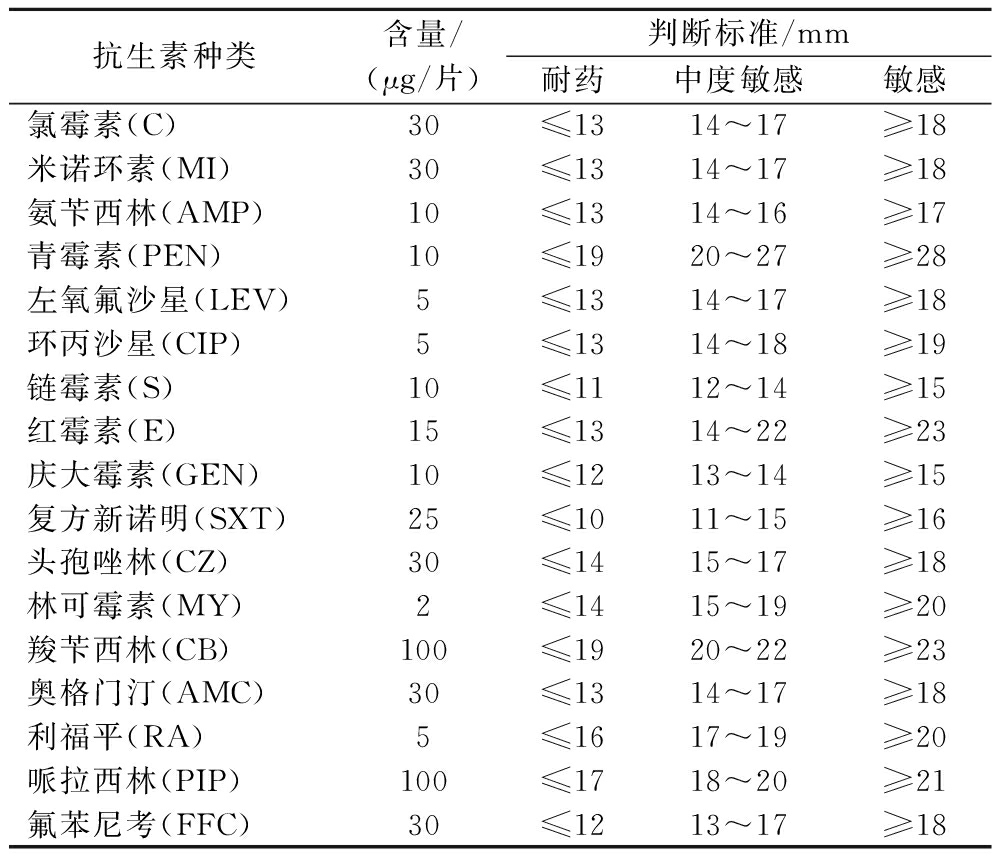
抗生素种类含量/(μg/片)判断标准/mm耐药中度敏感敏感氯霉素(C)30≤1314~17≥18米诺环素(MI)30≤1314~17≥18氨苄西林(AMP)10≤1314~16≥17青霉素(PEN)10≤1920~27≥28左氧氟沙星(LEV)5≤1314~17≥18环丙沙星(CIP)5≤1314~18≥19链霉素(S)10≤1112~14≥15红霉素(E)15≤1314~22≥23庆大霉素(GEN)10≤1213~14≥15复方新诺明(SXT)25≤1011~15≥16头孢唑林(CZ)30≤1415~17≥18林可霉素(MY)2≤1415~19≥20羧苄西林(CB)100≤1920~22≥23奥格门汀(AMC)30≤1314~17≥18利福平(RA)5≤1617~19≥20哌拉西林(PIP)100≤1718~20≥21氟苯尼考(FFC)30≤1213~17≥18
1.2.7 生长曲线测定
将耐受性能较好的5株乳酸菌进行生长性能测定,菌液按1%的接种量接种至MRS液体培养基,37 ℃培养24 h,每隔2 h取样测定OD600值,MRS液体培养基为空白对照,以培养时间为横坐标,吸光度为纵坐标绘制生长曲线[20]。
1.2.8 产胞外多糖能力测定
参考CHEN等[21]的方法略有修改,将各菌株接种至50 mL液体培养基中,37 ℃培养24 h,菌液8 000 r/min、4 ℃离心10 min除去菌体,发酵上清液沸水浴10 min,冷却至室温加入80%(质量分数)的三氯乙酸溶液至终质量分数为6%,4 ℃中静置12 h,8 000 r/min、4 ℃离心10 min除去蛋白沉淀,上清液加入3倍体积的无水乙醇,于4 ℃中静置12 h,10 000 r/min、4 ℃离心20 min收集粗多糖沉淀,沉淀加入适量蒸馏水溶解,使用截留分子质量为8 000~14 000 Da 的透析袋于4 ℃透析48 h,每8 h换水,透析结束后多糖溶液加蒸馏水定容至50 mL待测备用。使用苯酚-硫酸法测定多糖含量,测定OD490nm下吸光度值,绘制葡萄糖标准曲线。葡萄糖标准曲线见图1,葡萄糖标准曲线方程为y=0.228 9x+0.034 2,R2=0.995 8,具有良好的相关性,可以用于乳酸菌胞外多糖含量的测定与计算。
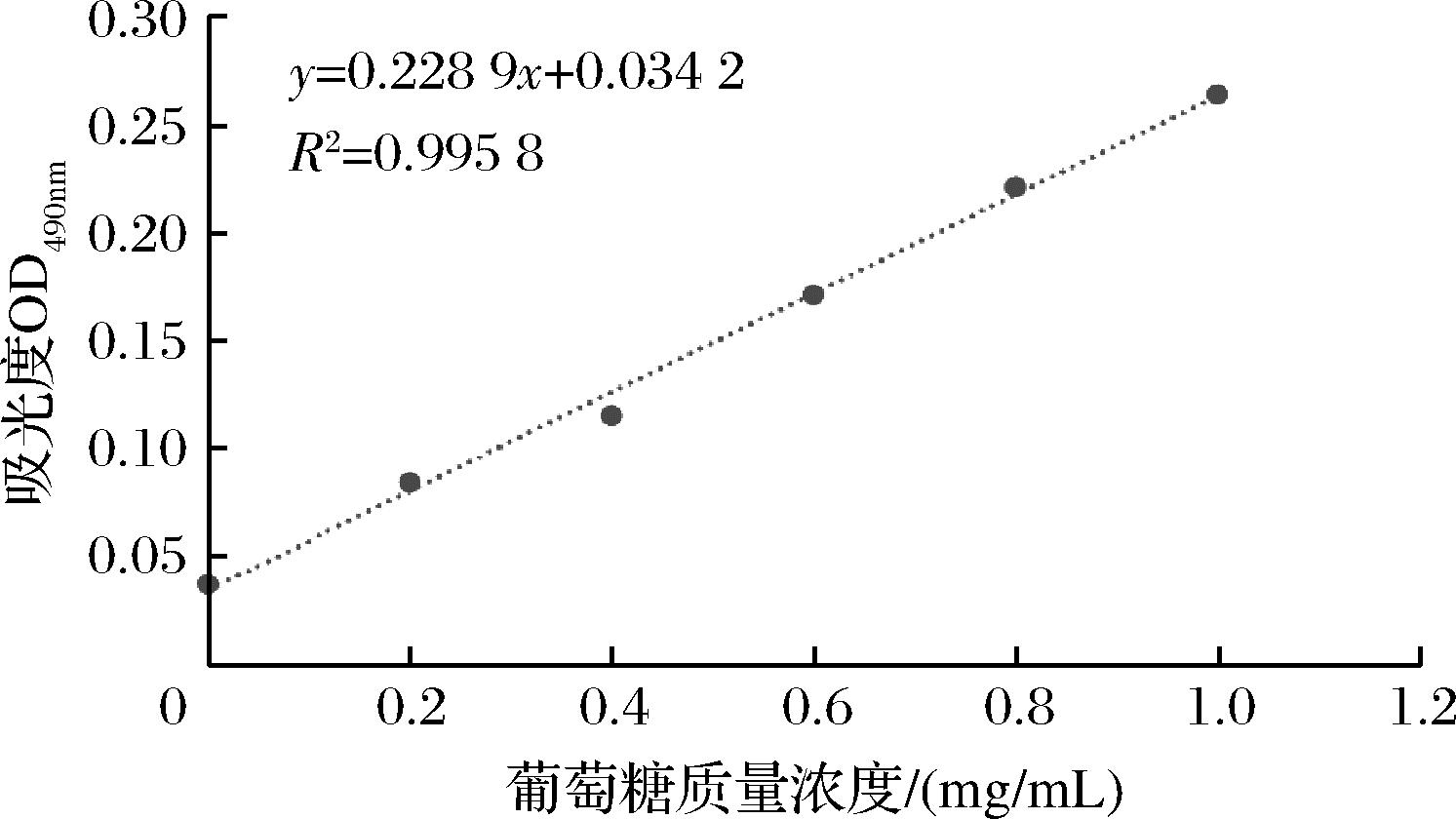
图1 葡萄糖标准曲线
Fig.1 Glucose standard curve
1.3 数据处理
所有实验3次平行,数据分析使用SPSS 23软件,使用Duncan多重比较法进行数据间显著性分析,显著水平设为0.05;使用Origin 2021作图并分析;在NCBI数据库中使用BLAST分析基因序列的序列同源性,使用MEGA 11绘制系统发育树。
2 结果与分析
2.1 乳酸菌的分离纯化及鉴定
本研究从西藏牦牛酸奶中分离筛选乳杆菌,部分菌株的形态特征及革兰氏染色镜检图见图2,菌株经纯化后在MRS平板上菌落形态呈白色或者乳白色,大部分菌落形态较小,表面光滑无褶皱,少部分菌株菌落较大,边缘不规则,经革兰氏染色后,得到12株过氧化氢酶触反应为阴性且革兰氏染色阳性菌。将疑似乳酸菌按试剂盒说明书进行DNA提取,经过PCR扩增,部分菌株扩增产物凝胶电泳见图3,在1 000 bp处有明显条带。

图2 部分乳杆菌形态特征及革兰氏染色镜检图
Fig.2 Morphological characterization and Gram-stained microscopic examination of some Lactobacillus

图3 部分疑似乳杆菌扩增凝胶电泳图
Fig.3 Amplified gel electrophoresis of some suspected Lactobacillus
将菌株的16S rDNA序列提交至NCBI进行BLAST比对,下载基因登录号,使用MEGA11软件对分离菌株和模式菌株进行多序列比对,构建系统发育树见图4。结果表明,菌株S107-6、S141-9为植物乳植杆菌(Lactiplantibacillus plantarum);菌株S114-8、S115-6、S115-8、S115-10、S139-3、S141-6为戊糖乳杆菌(Lactiplantibacillus pentosus);S111-2、S129-5、S134-9为发酵粘液乳杆菌(Limosilactobacillus fermentum);菌株S101-6为类干酪乳酪杆菌(Lacticaseibacillus casei)。
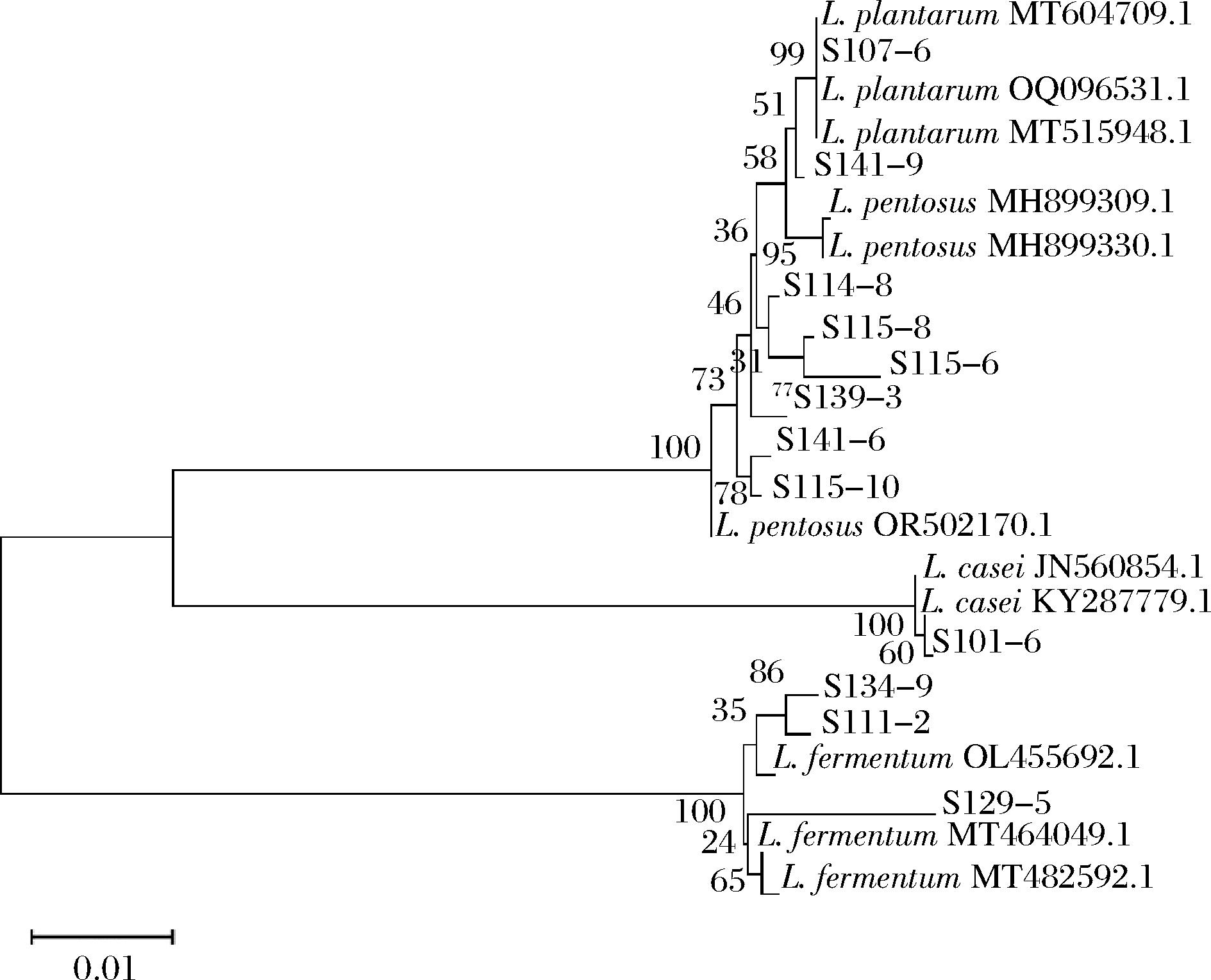
图4 分离菌株16S rDNA序列构建的系统发育树
Fig.4 Phylogenetic tree constructed from 16S rDNA sequences of isolated strains
2.2 耐酸能力测定
人体中胃液的pH值一般为(3.0±0.5),只有优良耐酸性能的乳酸菌才能顺利进入肠道内并发挥益生作用[22]。如表2所示,随着pH降低,OD600值也随之下降,这说明酸性环境对乳杆菌的生长有很大的影响,当初始培养基pH值为5.5时,菌株生长未受环境和其他不良因素抑制,均能正常生长;当初始培养基pH值为4.5时,菌株活性开始降低但仍能较好生长,OD600值均在1.0以上;当pH值为3.5时,菌株OD600值明显下降,生长活性受到了抑制,其中S101-6活性最弱;当pH值为2.5时,除S114-8、S115-6、S139-3这3株菌外,其他菌株几乎无法生长。综合分析所有菌株在pH 2.5或者更低的条件下均无法生长,在pH 5.5和pH 4.5的条件下部分菌株的生长活性与对照菌株LGG无明显差异,在pH 2.5的条件下生长活性最优的菌株S139-3与对照菌株LGG相比差异显著,这与仝静雯[23]研究的乳酸菌JK-L1、JK-L3等6株菌在pH值为3.0的酸性条件下有较高的存活率结果相似。
表2 菌株耐酸性
Table 2 Acid tolerance of strains
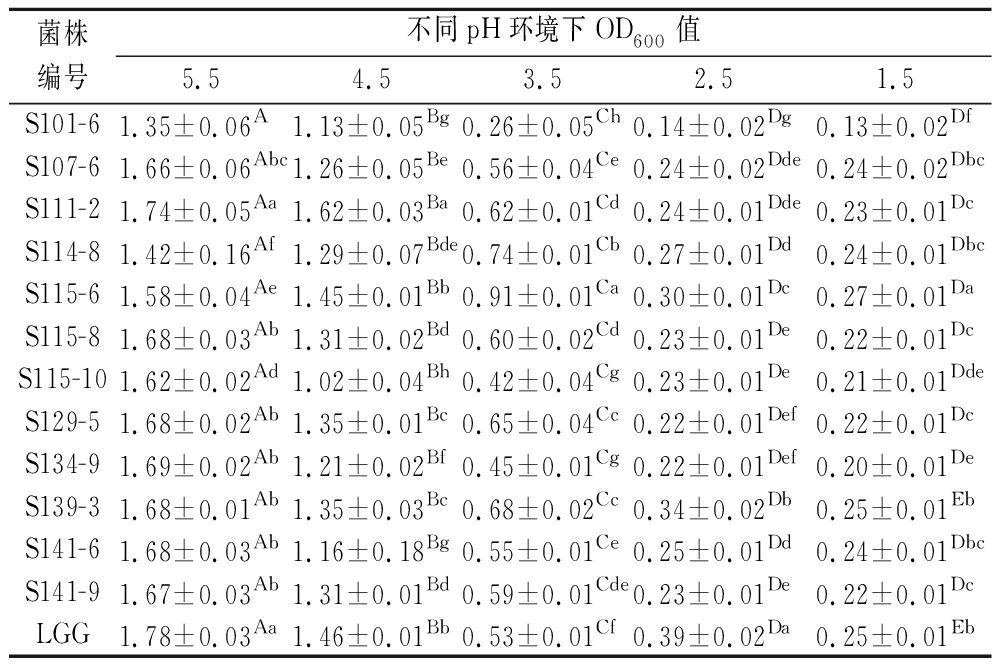
菌株编号不同pH环境下OD600值5.54.53.52.51.5S101-61.35±0.06A 1.13±0.05Bg0.26±0.05Ch0.14±0.02Dg0.13±0.02DfS107-61.66±0.06Abc1.26±0.05Be0.56±0.04Ce0.24±0.02Dde0.24±0.02DbcS111-21.74±0.05Aa1.62±0.03Ba0.62±0.01Cd0.24±0.01Dde0.23±0.01DcS114-81.42±0.16Af1.29±0.07Bde0.74±0.01Cb0.27±0.01Dd0.24±0.01DbcS115-61.58±0.04Ae1.45±0.01Bb0.91±0.01Ca0.30±0.01Dc0.27±0.01DaS115-81.68±0.03Ab1.31±0.02Bd0.60±0.02Cd0.23±0.01De0.22±0.01DcS115-101.62±0.02Ad1.02±0.04Bh0.42±0.04Cg0.23±0.01De0.21±0.01DdeS129-51.68±0.02Ab1.35±0.01Bc0.65±0.04Cc0.22±0.01Def0.22±0.01DcS134-91.69±0.02Ab1.21±0.02Bf0.45±0.01Cg0.22±0.01Def0.20±0.01DeS139-31.68±0.01Ab1.35±0.03Bc0.68±0.02Cc0.34±0.02Db0.25±0.01EbS141-61.68±0.03Ab1.16±0.18Bg0.55±0.01Ce0.25±0.01Dd0.24±0.01DbcS141-91.67±0.03Ab1.31±0.01Bd0.59±0.01Cde0.23±0.01De0.22±0.01DcLGG1.78±0.03Aa1.46±0.01Bb0.53±0.01Cf0.39±0.02Da0.25±0.01Eb
注:同行A~E表示相同菌株不同pH环境下差异显著(P<0.05);同列a~h表示相同pH环境下不同菌株差异显著(P<0.05)。
2.3 耐胆盐能力测定
人体肠道内胆盐产生的渗透压会改变乳酸菌细胞膜通透性,使其生长繁殖受到抑制,因此耐胆盐能力是评价益生菌能否在宿主肠道定殖并发挥生理功能的重要指标[24]。由表3可知,各菌株生长活性随胆盐浓度的增加而下降。胆盐含量为0.1%时,大部分菌株活性较高,其中S107-6、S114-8、S115-6、S129-5、S139-3、S141-9的生长活性较高于S101-6、S111-2等菌株,与对照菌LGG相比差异显著;胆盐含量为0.3%时,所有菌株OD600值明显下降,但S111-2、S115-10、S115-8、S139-3、S141-9仍然保持一定的生长活性,且明显优于对照菌株LGG;胆盐含量为0.5%时,菌株S139-3在高浓度胆盐条件下仍保持较好的生长活性,OD值最高为0.51,由此结果分析胆盐浓度对乳酸菌的生长产生很大影响,在高浓度胆盐条件下乳酸菌生长活性受到很大的抑制,通常人体肠道内含有0.3%以下的胆盐,因此所有菌株均有一定的胆盐耐受性。HULIGERE等[25]研究的酸性胆汁为0.3%和1%时,LAB菌株的存活率最高为98%和93%,7种分离株在胆汁浓度为0.3%时表现出高存活率。
表3 菌株胆盐耐受性
Table 3 Bile salt tolerance of strains
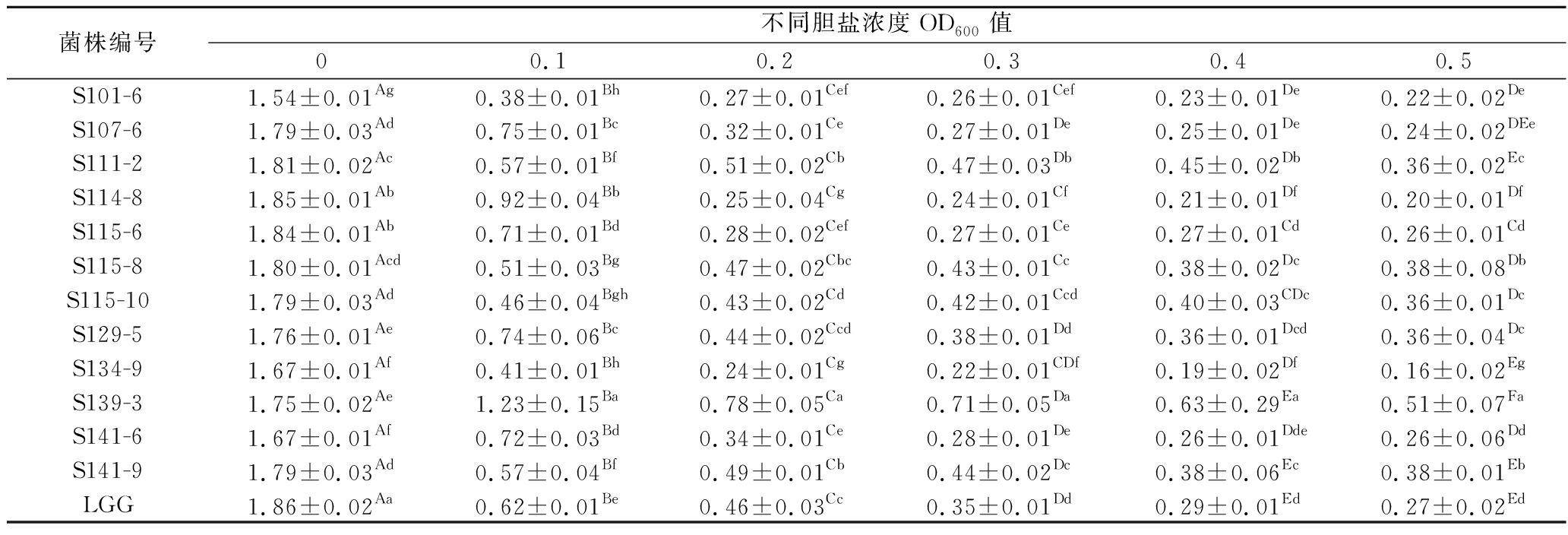
菌株编号不同胆盐浓度OD600值00.10.20.30.40.5S101-61.54±0.01Ag0.38±0.01Bh0.27±0.01Cef0.26±0.01Cef0.23±0.01De0.22±0.02DeS107-61.79±0.03Ad0.75±0.01Bc0.32±0.01Ce0.27±0.01De0.25±0.01De0.24±0.02DEeS111-21.81±0.02Ac0.57±0.01Bf0.51±0.02Cb0.47±0.03Db0.45±0.02Db0.36±0.02EcS114-81.85±0.01Ab0.92±0.04Bb0.25±0.04Cg0.24±0.01Cf0.21±0.01Df0.20±0.01DfS115-61.84±0.01Ab0.71±0.01Bd0.28±0.02Cef0.27±0.01Ce0.27±0.01Cd0.26±0.01CdS115-81.80±0.01Acd0.51±0.03Bg0.47±0.02Cbc0.43±0.01Cc0.38±0.02Dc0.38±0.08DbS115-101.79±0.03Ad0.46±0.04Bgh0.43±0.02Cd0.42±0.01Ccd0.40±0.03CDc0.36±0.01DcS129-51.76±0.01Ae0.74±0.06Bc0.44±0.02Ccd0.38±0.01Dd0.36±0.01Dcd0.36±0.04DcS134-91.67±0.01Af0.41±0.01Bh0.24±0.01Cg0.22±0.01CDf0.19±0.02Df0.16±0.02EgS139-31.75±0.02Ae1.23±0.15Ba0.78±0.05Ca0.71±0.05Da0.63±0.29Ea0.51±0.07FaS141-61.67±0.01Af0.72±0.03Bd0.34±0.01Ce0.28±0.01De0.26±0.01Dde0.26±0.06DdS141-91.79±0.03Ad0.57±0.04Bf0.49±0.01Cb0.44±0.02Dc0.38±0.06Ec0.38±0.01EbLGG1.86±0.02Aa0.62±0.01Be0.46±0.03Cc0.35±0.01Dd0.29±0.01Ed0.27±0.02Ed
注:同行A~F表示相同菌株不同胆盐环境下差异显著(P<0.05);同列a~h表示相同胆盐环境下不同菌株差异显著(P<0.05)。
2.4 人工胃肠液耐受性
菌株是否能抵御宿主胃肠道的恶劣环境,在肠道中定植生长并发挥益生功能是判定菌株是否为益生菌的关键条件之一[26]。结果见图5,所有菌株通过pH 3.0的模拟人工胃液处理3 h后,各菌株的存活率差异显著,其中菌株S115-8表现出较好的耐受性,存活率最高为86.93%,S115-6、S139-3次之。其余菌株生存能力较弱,耐胃液能力较差的存活率在20%~51%,可能由于受胃液低酸性的影响。离开胃后,益生菌进入十二指肠遇到胆汁盐和胰酶,胰酶是消化酶的组合,对于消化脂肪、蛋白质和糖是必不可少的,而胆汁是一种消化液,可溶解脂质和脂溶性维生素以进行消化。益生菌选择的标准是耐受肠道中胰酶存在的能力,经过模拟人工肠液处理6 h后,S141-9的存活率最低,表明无法适应模拟肠液环境,可能是肠液中的碱性环境和蛋白酶造成菌体细胞壁裂解导致菌体死亡。S115-6、S115-8的存活率最高,分别为70.35%、67.92%,均高于对照菌鼠李糖乳酪杆菌LGG(63.46%),说明这2株菌具备在肠道定植的基本条件,综合分析菌株S115-6和S115-8的胃肠液耐受性较好,可能会在肠道发挥益生功能。雷雪艳等[27]研究的马乳酒样乳杆菌IMAU12330和IMAU12335在人工肠液中的耐受性较好,但是在人工胃液中的耐受性较差,胃液3 h的存活率均小于50%,可能是由于高浓度胆盐和胰蛋白酶的影响,导致菌株生长活性受到抑制。
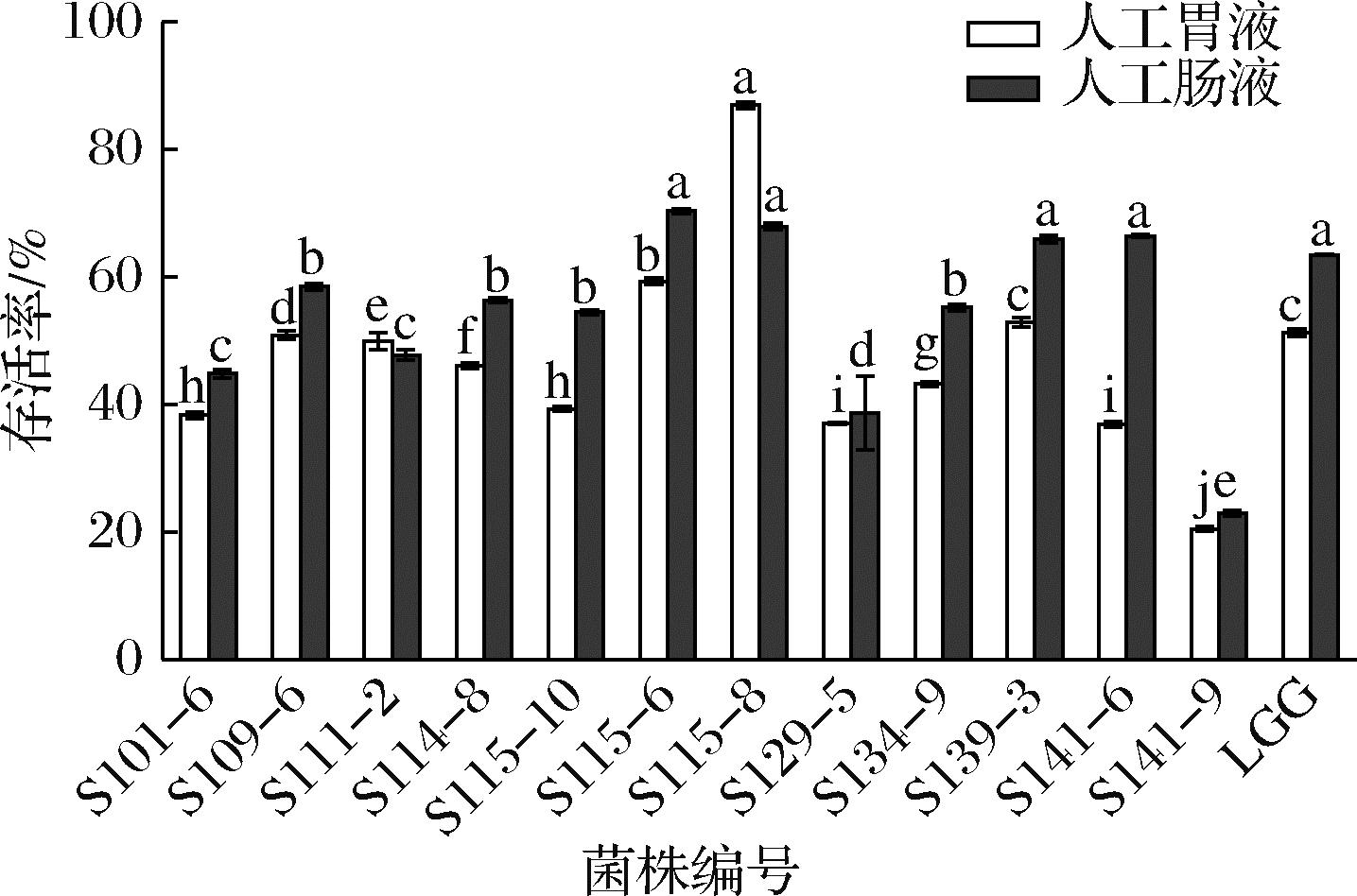
图5 菌株模拟人工胃肠液处理后的存活率
Fig.5 Survival of strains simulating treatment with artificial gastrointestinal fluids
2.5 自聚集性和疏水性测定
乳酸菌对上皮细胞组织的黏附定植能力作为益生菌筛选的必要条件,有研究表明自聚集性与细胞表面疏水能力越高越有助于细菌在肠黏膜表面的定植,并能促进细菌在肠道上皮细胞的黏附[28]。因此本实验研究了菌株的自聚集性与疏水性的大小,来间接评价对细胞的黏附定植能力,结果如图6所示,菌株自聚集率随着时间的延长而增加,在第6 h所有菌株自聚集能力在7%~35%,其中S139-3、S134-9和S141-6的自聚集能力最高,分别为34.46%、32.15%和31.38%,与对照菌株相比自聚集性有较明显的差异,不同菌株间自聚集性差异不同,可能是由于与细胞表面蛋白质相互作用导致[29]。细菌的疏水性是决定细菌在宿主细胞表面非特异性黏附的主要因素,本实验通过与有机溶剂(二甲苯和乙酸乙酯)相互作用测定菌株的疏水性,如图6所示所有菌株疏水性在2%~42%,菌株S139-3、S134-9和S115-6的疏水性最高,分别为41.59%、36.68%和30.99%,均优于对照菌株LGG(13.02%),综合自聚集性结果推断菌株S115-6、S139-3和S134-9可能具有较高的黏附性,说明这3株菌黏附于肠上皮细胞的能力也较强,易发挥自身的益生作用,可进一步测定其胞外多糖含量来间接评价其免疫性能。
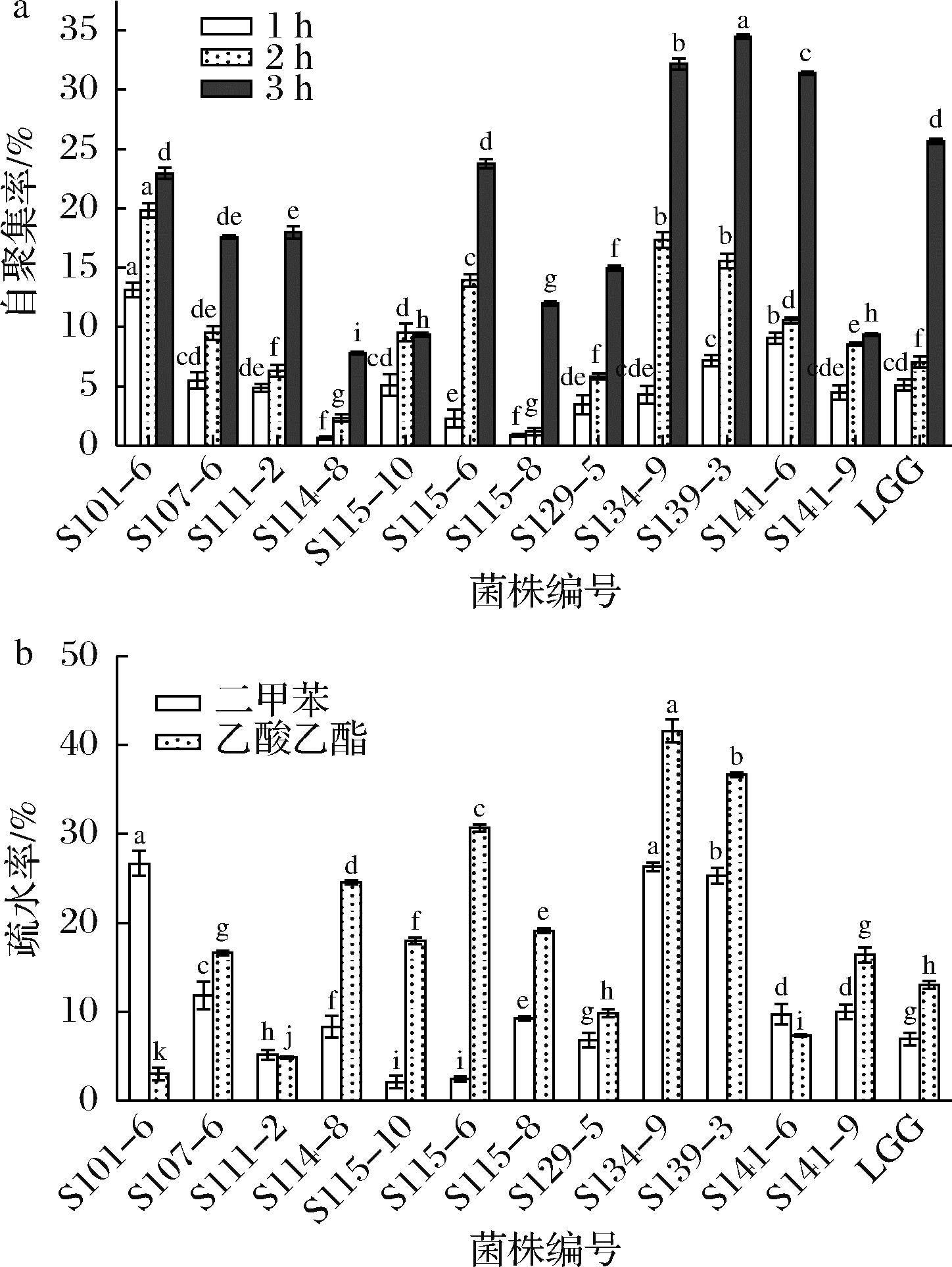
a-自聚集率;b-疏水率
图6 菌株的自聚集率和疏水率
Fig.6 Self-aggregation rate and hydrophobicity of the strain
2.6 抗生素药敏性试验
尽管大多数菌株没有致病性,但它们可能会形成一个对抗生素产生耐药性的基因库,这些基因有可能会转移到致病菌株上[30]。因此,本试验采用纸片扩散法对12株乳酸菌的抗生素耐药性进行评估,由表4可知,所有菌株对左氧氟沙星、环丙沙星、链霉素、庆大霉素具有高度耐药性,对氨卡西林、红霉素、头孢唑林、羧卡西林、奥格门汀、利福平、哌拉西林、氟苯尼考表现出高度敏感性,对氯霉素、米诺环素、青霉素具有中度敏感或敏感性,其中S114-8、S115-10、S115-6、S115-8、S129-5对氯霉素、米诺环素等6种抗生素表现敏感。本研究菌株对大多对氨基糖苷类药物(庆大霉素、链霉素)具有耐药性,主要是由细菌细胞表面对氨基糖苷类的低渗透性以及乳酸杆菌中不存在细胞色素介导的电子传递元这2个关键因素引起,而且大部分菌株对链霉素的耐药性高于庆大霉素,抑菌圈直径更小,可能是由于这种抗生素比其他氨基糖苷类药物有更强的膜穿透力[31]。所有菌株对青霉素和氨苄西林这类低浓度β-内酰胺类药物敏感,可能是由于菌株中的结合蛋白序列保留了抗生素结合位点中的氨基酸残基,对照菌鼠李糖乳酪杆菌LGG与所有菌株的抗生素敏感性无明显的差异。不同菌株抗生素敏感性不同,有研究表明乳酸菌表现出对环丙沙星、链霉素等抗生素的耐药抗性属于固有抗性,一般这类抗性是安全的,不会发生基因的转移[32],因此本研究所筛选出的乳杆菌株具有一定的安全性。
表4 菌株对不同抗生素的敏感性
Table 4 Susceptibility of strains to different antibiotics
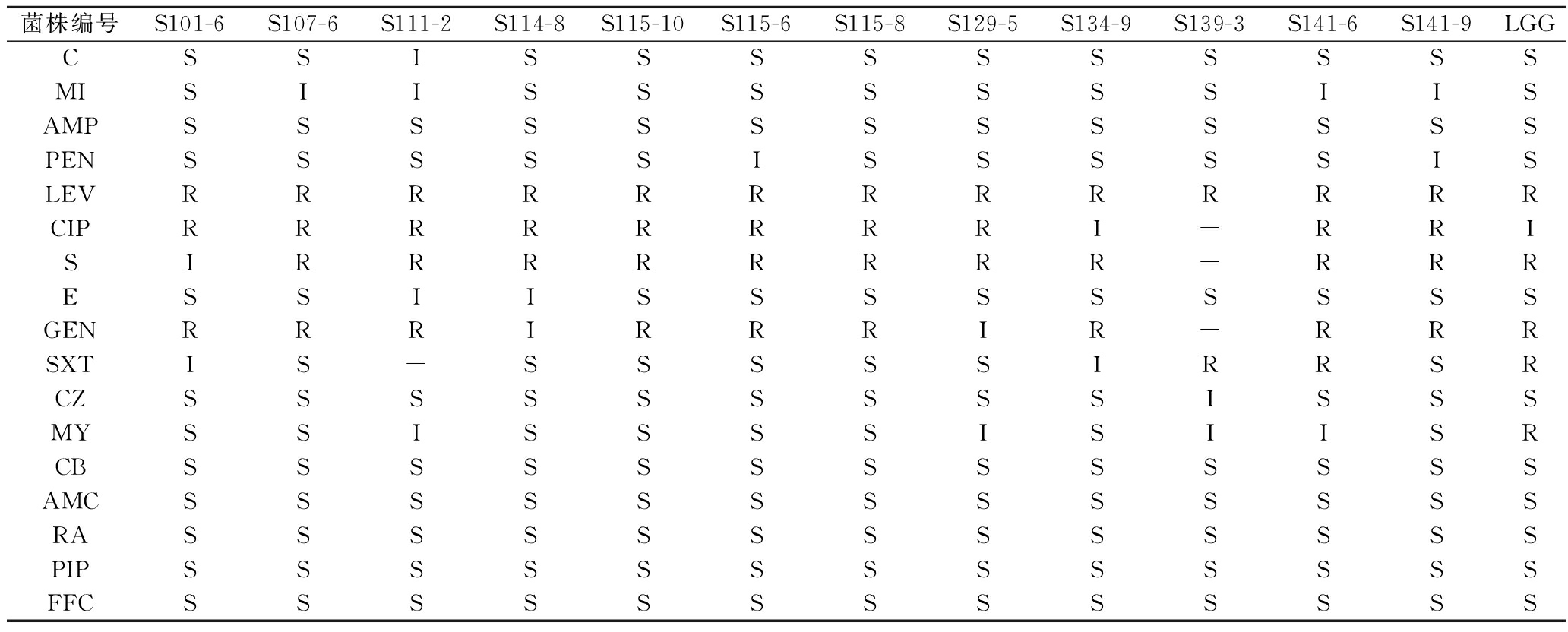
菌株编号S101-6S107-6S111-2S114-8S115-10S115-6S115-8S129-5S134-9S139-3S141-6S141-9LGGCSSISSSSSSSSSSMISIISSSSSSSIISAMPSSSSSSSSSSSSSPENSSSSSISSSSSISLEVRRRRRRRRRRRRRCIPRRRRRRRRI-RRISIRRRRRRRR-RRRESSIISSSSSSSSSGENRRRIRRRIR-RRRSXTIS-SSSSSIRRSRCZSSSSSSSSSISSSMYSSISSSSISIISRCBSSSSSSSSSSSSSAMCSSSSSSSSSSSSSRASSSSSSSSSSSSSPIPSSSSSSSSSSSSSFFCSSSSSSSSSSSSS
注:C-氯霉素;MI-米诺环素;AMP-氨卡西林;PEN-青霉素;LEV-左氧氟沙星;CIP-环丙沙星;S-链霉素;E-红霉素;GEN-庆大霉素;SXT-复方新诺明;CZ-头孢唑林;MY-林可霉素;CB-羧苄西林;AMC-奥格门汀;RA-利福平;PIP-哌拉西林;FFC-氟苯尼考;S-敏感;I-中介;R-耐药。
2.7 生长曲线测定
生长曲线能够较好地反映菌株的生长速率,对益生潜力较好的S115-6、S115-8、S134-9、S139-3、S141-6这5株乳酸菌的生长曲线进行测定,由图7可知,菌株生长曲线呈S型,5株乳酸菌生长情况相似。0~4 h为菌株的延滞期,生长缓慢,OD600值均在0.1左右,说明菌株正在适应不同培养环境;4~12 h进入对数生长期,菌株生长迅速,表明菌株在此阶段代谢最旺盛,活力最强,OD600值均达到1.3以上;12 h进入生长稳定期,大部分菌株OD600值达到1.7以上。植物乳杆菌S134-9的OD600值较低,活力较弱,可能是菌株本身适应其他环境的能力较弱[33]。
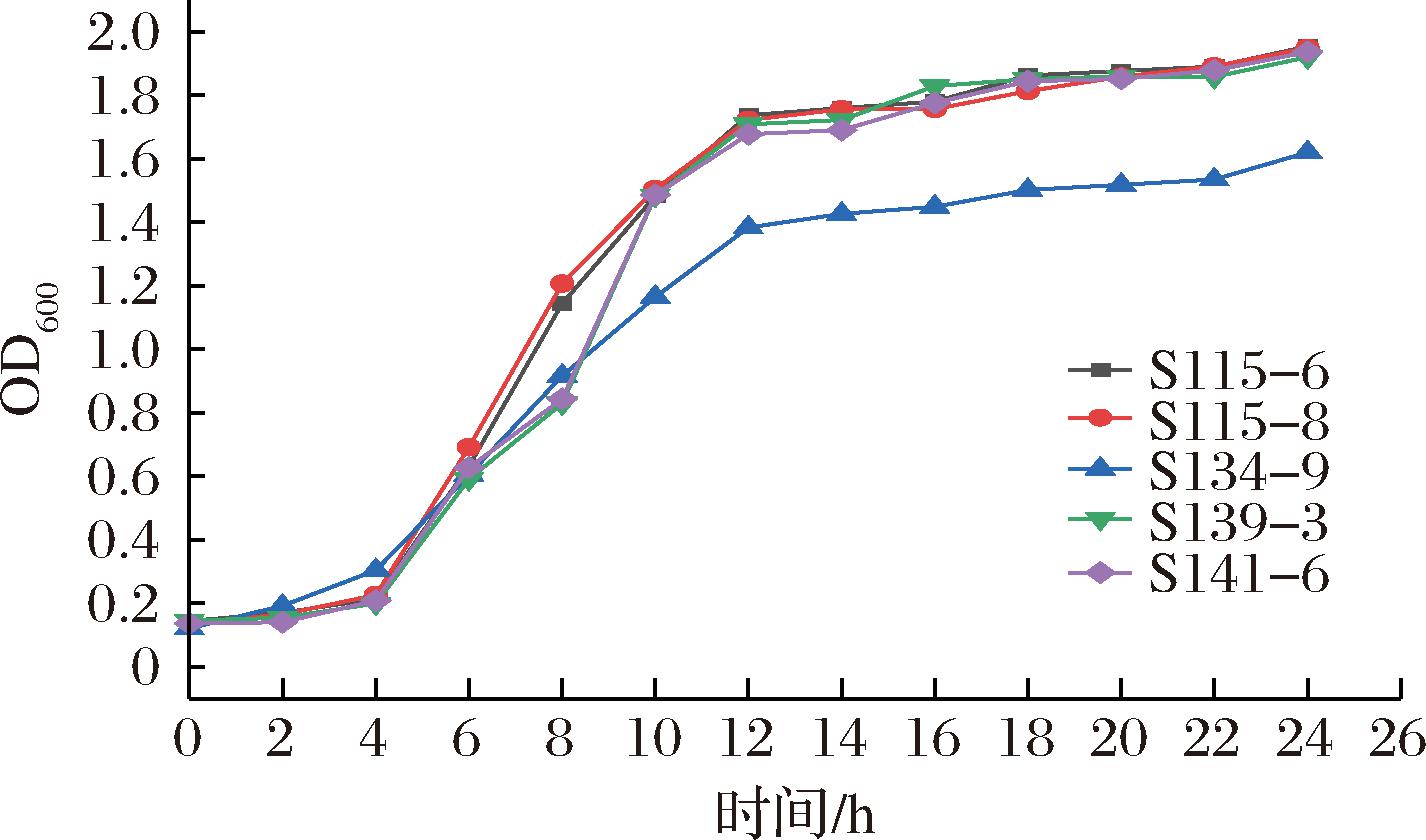
图7 菌株的生长曲线
Fig.7 Growth curve of the strains
2.8 产胞外多糖能力测定
EPS是乳酸菌重要的代谢产物,不同菌株由于其特定的结构,具有不同的免疫调节能力,产EPS含量也有明显差异[34]。如图8所示,戊糖乳杆菌S115-6产胞外多糖性能最优,且显著高于其他菌株,含量达到1.12 g/L(P<0.05),说明在相同的培养条件下该菌株具有较好的产黏能力;S139-3产胞外多糖性能次之,含量为1.08 g/L;对照菌株LGG胞外多糖产量为0.93 g/L,高于S134-9、S141-6两株菌的多糖含量,S115-8含量最低,仅0.51 g/L,与其他菌株相比该菌株的产胞外多糖能力较差。不同种属戊糖乳杆菌S115-6和发酵粘液乳杆菌S134-9的胞外多糖含量差异较大,表现出了不同的产胞外多糖能力,可能是因为菌株生长时间、产酸量、产酶量等不同引起的差异,因此结合上述耐受性和黏附性综合分析S115-6和S139-3这2株菌具有较高的益生性能,可能具有潜在免疫能力。ALAMERI等[35]研究表明,F8、F28 2株菌表现出较好的益生性和产EPS的能力,并且经动物试验发现有良好的免疫调节活性。
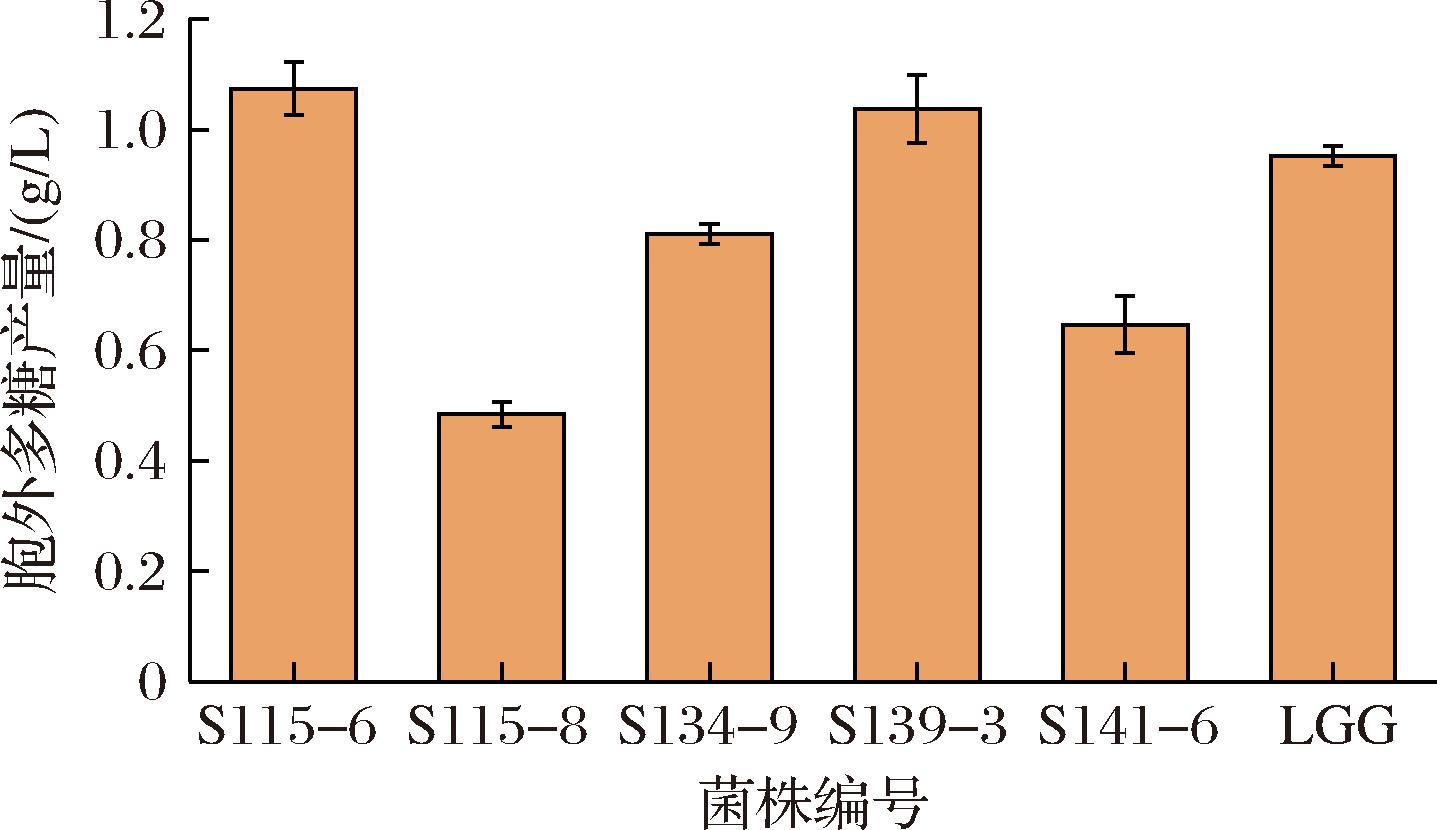
图8 菌株的胞外多糖含量
Fig.8 Extracellular polysaccharide content of the strain
3 结论
本研究对西藏牦牛酸奶样本中的乳杆菌资源进行分离鉴定,以鼠李糖乳杆菌LGG作为对照,通过耐受性、黏附性、抗生素药敏性等益生特性及产胞外多糖能力的测定,筛选出了戊糖乳杆菌S115-6和S139-3这2株具有潜在免疫功能的乳杆菌,戊糖乳杆菌S115-6在胃肠液中存活率最高,产胞外多糖含量最高;戊糖乳杆菌S139-3在pH 2.5和0.5%胆盐环境条件下生长活性最高、自聚集性和疏水性最高,通过抗生素药敏性判断其安全性,因此,综合分析戊糖乳杆菌S115-6和S139-3这2株菌乳酸菌具有较好的益生特性,可作为后续开发具有免疫功能乳酸菌及益生菌制剂的优良潜在菌株,还需要对其进行动物实验来进一步验证免疫功能特性,以判断其应用潜力,本研究为西藏传统奶制品中功能乳酸菌资源的开发与利用提供了优良菌株。
[1] LI A L, LIU C, HAN X T, et al.Tibetan Plateau yak milk:A comprehensive review of nutritional values, health benefits, and processing technology[J].Food Chemistry, 2023, 20:100919.
[2] SINGH T P, ARORA S, SARKAR M.Yak milk and milk products:Functional, bioactive constituents and therapeutic potential[J].International Dairy Journal, 2023, 142:105637.
[3] 文华英, 张玉红.西藏益生菌的研究进展及其应用[J].湖北农业科学, 2019, 58(4):9-13.WEN H Y, ZHANG Y H.Research progress and application of probiotics in Tibet[J].Hubei Agricultural Sciences, 2019, 58(4):9-13.
[4] 刘文俊, 张和平.益生菌基因组学在乳酸菌筛选和功能评价中的应用[J].中国食品学报, 2024, 24(1):1-11.LIU W J, ZHANG H P.Application of probiogenomics in screening and functional evaluation of probiotics lactic acid bacteria[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(1):1-11.
[5] 尤利军, 靳昊, 郭丽如, 等.探索自然发酵乳中乳酸菌种内微观多样性及其生态驱动因素[J].科学通报, 2024, 69(25):3681-3683.YOU L J, JIN H, GUO L R, et al.Intraspecific microdiversity and ecological drivers of lactic acid bacteria in naturally fermented milk ecosystem[J].Chinese Science Bulletin, 2024, 69(25):3681-3683.
[6] ZHANG B, WANG Y P, TAN Z F, et al.Screening of probiotic activities of lactobacilli strains isolated from traditional Tibetan qula, a raw yak milk cheese[J].Asian-Australasian Journal of Animal Sciences, 2016, 29(10):1490-1499.
[7] SHEHATA M G, EL SOHAIMY S A, EL-SAHN M A, et al.Screening of isolated potential probiotic lactic acid bacteria for cholesterol lowering property and bile salt hydrolase activity[J].Annals of Agricultural Sciences, 2016, 61(1):65-75.
[8] DING W R, SHI C, CHEN M, et al.Screening for lactic acid bacteria in traditional fermented Tibetan yak milk and evaluating their probiotic and cholesterol-lowering potentials in rats fed a high-cholesterol diet[J].Journal of Functional Foods, 2017, 32:324-332.
[9] 蒙月月. 免疫活性乳酸菌的筛选及其对小鼠免疫调节作用的研究[D].哈尔滨:东北农业大学,2018.MENG Y Y.Screening of immunologically active lactic acid bacteria and their immunomodulatory effects on mice[D].Harbin:Northeast Agricultural University, 2018.
[10] TARIQUE M, ABDALLA A, MASAD R, et al.Potential probiotics and postbiotic characteristics including immunomodulatory effects of lactic acid bacteria isolated from traditional yogurt-like products[J].LWT, 2022, 159:113207.
[11] 陈丽娥, 孙盛, 俞赟霞, 等.西北传统食品中乳酸菌的分离及提高免疫力菌株的筛选[J].中国乳品工业, 2019, 47(10):15-19;33.CHEN L E, SUN S, YU Y X, et al.Immune-enhancing strains identified from traditional food in Northwest China[J].China Dairy Industry, 2019, 47 (10):15-19;33.
[12] GRUJOVI M Ž, MLADENOVI
M Ž, MLADENOVI K G, SEMEDO-LEMSADDEK T, et al.Advantages and disadvantages of non-starter lactic acid bacteria from traditional fermented foods:Potential use as starters or probiotics[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(2):1537-1567.
K G, SEMEDO-LEMSADDEK T, et al.Advantages and disadvantages of non-starter lactic acid bacteria from traditional fermented foods:Potential use as starters or probiotics[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(2):1537-1567.
[13] 汤凯, 武运, 王雪, 等.伊犁地区奶疙瘩中乳酸菌的筛选及其特性研究[J].食品工业科技, 2025, 46(3):188-195.TANG K, WU Y, WANG X, et al.Screening and characteristics of lactic acid bacteria from cheese in Yili area[J].Science and Technology of Food Industry, 2025, 46(3):188-195.
[14] MULAW G, TESSEMA T S, MULETA D, et al.In vitro evaluation of probiotic properties of lactic acid bacteria isolated from some traditionally fermented Ethiopian food products[J].International Journal of Microbiology, 2019, 2019(1):7179514.
[15] 胡伟中, 李慧颖, 史早, 等.抑制单增李斯特菌的益生乳酸菌筛选及原位抑制效果研究[J].食品与发酵工业, 2025,51(10):23-32.HU W Z, LI H Y, SHI Z, et al.Screening and in situ inhibitory effects of probiotic lactic acid bacteria against Listeria monocytogenes[J].Food and Fermentation Industries, 2025,51(10):23-32.
[16] 李建军, 古丽拜克热木·艾比卜拉, 倪永清, 等.新疆和田地区人源肠道乳酸菌的筛选及其体外益生特性分析[J].食品工业科技, 2024, 45 (5):134-143.LI J J, GU L B K R M·A B B L, NI Y Q, et al.Probiotic characteristics of lactic acid bacteria isolated from the intestinal tract of mothers and infants in Hotan, Xinjiang[J].Science and Technology of Food Industry, 2024, 45(5):134-143.
[17] MEGUR A, DALIRI E B, ![]() T, et al.In vitro screening and characterization of lactic acid bacteria from Lithuanian fermented food with potential probiotic properties[J].Frontiers in Microbiology, 2023, 14:1213370.
T, et al.In vitro screening and characterization of lactic acid bacteria from Lithuanian fermented food with potential probiotic properties[J].Frontiers in Microbiology, 2023, 14:1213370.
[18] HE Y Y, LI F R, XU M G, et al.Probiotic potential of lactic acid bacteria isolated from yaks[J].Animal Diseases, 2024, 4(1):17.
[19] DUCHE R T, SINGH A, WANDHARE A G, et al.Antibiotic resistance in potential probiotic lactic acid bacteria of fermented foods and human origin from Nigeria[J].BMC Microbiology, 2023, 23(1):142.
[20] 郭云浩, 李钰嘉, 王宇轩, 等.奶嚼口中乳酸菌的筛选及生物学特性研究[J].农产品加工, 2024(12):62-66.GUO Y H, LI Y J, WANG Y X, et al.Screening and biological characteristics of lactic acid bacteria from milk chew[J].Farm Products Processing, 2024(12):62-66.
[21] CHEN J, ZHOU J H, MAO Q Q, et al.Screening and identification of extracellular polysaccharide-producing lactic acid bacteria[J].Food &Machinery, 2023, 39(4):26-31;169.
[22] 聂紫玉, 吴艳阳, 王增光, 等.植物源益生乳酸菌的筛选及其特性[J].食品科学, 2022, 43(18):143-151.NIE Z Y, WU Y Y, WANG Z G, et al.Screening and characterization of plant-derived probiotic lactic acid bacteria[J].Food Science, 2022, 43(18):143-151.
[23] 仝静雯. 传统发酵食品中优良可食用乳酸菌的筛选及其在发酵乳中的应用研究[D].杭州:浙江工商大学, 2023.TONG J W.Screening of good edible lactic acid bacteria in traditional fermented foods and their application in fermented milk [D].Hangzhou:Zhejiang Gongshang University, 2023.
[24] 国笑情, 武岳, 李瑜, 等.新疆地区母乳中乳酸菌的分离鉴定及潜在益生菌的筛选[J].食品与发酵工业, 2023, 49(18):275-281.GUO X Q, WU Y, LI Y, et al.Isolation and identification of lactic acid bacteria from breast milk in Xinjiang and screening of potential probiotics[J].Food and Fermentation Industries, 2023, 49(18):275-281.
[25] HULIGERE S S, CHANDANA KUMARI V B, ALQADI T, et al.Isolation and characterization of lactic acid bacteria with potential probiotic activity and further investigation of their activity by α-amylase and α-glucosidase inhibitions of fermented batters[J].Frontiers in Microbiology, 2023, 13:1042263.
[26] 马新淼, 魏敏敏, 张左利, 等.新疆哈萨克酸马奶中功能性乳酸菌株的筛选、鉴定及功能评价[J].食品安全质量检测学报, 2024, 15(7):151-159.MA X M, WEI M M, ZHANG Z L, et al.Screening, identification and functional evaluation of functional lactic acid bacteria strains in Xinjiang Kazakh koumiss[J].Journal of Food Safety &Quality, 2024, 15(7):151-159.
[27] 雷雪艳, 赵丽霞, 李瑜, 等.内蒙古地区自然发酵乳中乳酸菌的分离鉴定及优良菌株筛选[J].食品与发酵工业, 2025, 51(1):11-17.LEI X Y, ZHAO L X, LI Y, et al.Isolation and identification as well as screening of excellent lactic acid bacteria from natural fermented milk in Inner Mongolia[J].Food and Fermentation Industries, 2025, 51(1):11-17.
[28] YANG Z Z, NI L, TIAN W, et al.Screening and identification of goat-milk-derived lactic acid bacteria with bacteriocin-like activity and probiotic potentials[J].Microorganisms, 2023, 11(4):849.
[29] KUMAR S, VARADA V V, BANAKAR P S, et al.Screening and characterization of Sahiwal cattle calves-origin lactic acid bacteria based on desired probiotic attributes for potential application[J].Animal Biotechnology, 2023, 34(4):1612-1625.
[30] PURNAMA DEWI N, PODDAR S, PRASATH RAI R, et al.The potential lactic acid bacteria from Dadiah Sianok Bukittinggi city, west Sumatera as probiotic[J].Research Journal of Pharmacy and Technology, 2023:627-634.
[31] ZHANG Q L, WANG M, MA X, et al.In vitro investigation on lactic acid bacteria isolatedfrom yak faeces for potential probiotics[J].Frontiers in Cellular and Infection Microbiology, 2022, 12:984537.
[32] 訾静, 王琰, 李亮亮, 等.林麝肠道中乳酸菌的分离筛选及益生特性[J].食品科学, 2024, 45(8):79-86.ZI J, WANG Y, LI L L, et al.Isolation and screening of lactic acid bacteria from the gut of forest musk deer for probiotic properties[J].Food Science, 2024, 45(8):79-86.
[33] ZHANG J, XIAO Y, WANG H C, et al.Lactic acid bacteria-derived exopolysaccharide:Formation, immunomodulatory ability, health effects, and structure-function relationship[J].Microbiological Research, 2023, 274:127432.
[34] 孙盛, 陈作国, 俞赟霞, 等.产胞外多糖植物乳杆菌WHH589的免疫活性及其在发酵乳中的应用[J].食品与发酵工业, 2021, 47(13):43-50.SUN S, CHEN Z G, YU Y X, et al.The immunomodulatory activity of Lactobacillus plantarum WHH589 with extracellular polysaccharide-producing property and its application in fermented milk[J].Food and Fermentation Industries, 2021, 47(13):43-50.
[35] ALAMERI F, TARIQUE M, OSAILI T, et al.Lactic acid bacteria isolated from fresh vegetable products:Potential probiotic and postbiotic characteristics including immunomodulatory effects[J].Microorganisms, 2022, 10(2):389.