木薯是全球第六大粮食作物,年产量约5.5亿t,为非洲、亚洲和美洲等地区近8 亿人提供稳定食物来源,为促进粮食安全和消除贫困做出了巨大贡献[1]。不过,木薯存在营养组成、加工利用方式单一等问题。木薯块根中淀粉含量为10%~30%,蛋白质含量约为1%~2%,脂肪含量约为0.3%~4.3%[2]。因此,提高木薯营养品质和改善加工特性,对加快木薯食品的开发和应用具有重要意义。
在非洲等热带地区,当地居民利用传统自然发酵方法制成的木薯产品有gari、attiéké、fufu等[3],微生物发酵后赋予产品独特的香气,不仅解决了木薯高度易腐烂的问题,而且显著降低了抗营养因子含量[4]。固态发酵(solid-state fermentation,SSF)广泛用于加工各种发酵食品,如豆豉、味噌和酱油等[5]。此外,固态发酵越来越多地用于木薯等农作物加工,具有提高产品质量的潜力。固态发酵可以通过提高木薯中生物活性化合物含量来提高产品的营养价值[5]。研究发现,与对照样品相比,采用少孢根霉(Rhizopus oligosporus)固态发酵木薯可提高其可溶性和总蛋白浓度,降低氰化物含量[6]。少孢红球菌固态发酵木薯茎提高了总酚、类黄酮等化合物含量和抗氧化活性[7]。固态发酵还可以改善木薯产品质地和感官属性。OJIMELUKWE等[8]用黑曲霉对木薯进行固态发酵,发酵产品具有更好的感官属性[8]。固态发酵还可以降低木薯产业的加工成本和环境污染。使用木薯废料(如木薯皮或木薯渣)作为固态发酵基质,可以最大限度地减少木薯加工过程中产生的废物,从而降低环境污染[9]。目前,需要开发新的固态发酵策略,如共培养或混合培养技术,以提高木薯SSF的效率和质量。
本研究拟以广西木薯为原料,利用白酒酿造大曲为发酵剂,通过厌氧固态发酵方式,探究发酵木薯营养成分和微生物群落结构及功能组成,分析发酵木薯挥发性代谢产物含量变化,旨在提高产品营养价值和风味品质,为发酵木薯食品的开发和应用拓展新思路。
1 材料与方法
1.1 材料与仪器
1.1.1 试剂
中温大曲:河南漯河贾湖酒业集团有限责任公司提供,用无菌袋包装后置于-20 ℃保藏备用。新鲜木薯:购自广西,70 ℃烘干粉碎(过100目筛)后备用。
3,5-二硝基水杨酸,国药集团化学试剂有限公司;水合茚三酮、2,6-二氯甲苯,上海麦克林生化科技股份有限公司;1,2-丙二醇,天津富宇精细化工有限公司;二氯甲烷,成都市科隆化学品有限公司(色谱纯);H2SO4,洛阳市化学试剂厂;SDS-PAGE变性丙烯酰胺凝胶快速制备试剂盒,生工生物工程(上海)股份有限公司;Na2HPO4、KH2PO4、NaOH,天津科密欧化学试剂有限公司。以上试剂均为分析纯。E.Z.N.ATM Mag-Bind Soil DNA试剂盒(Omega, M5635-02, USA),上海远慕生物科技有限公司。
1.1.2 仪器与设备
HH-S数显恒温水浴锅,上海博讯实业有限公司医疗设备厂;XPR204S/AC电子精密天平,梅特勒-托多利仪器(上海)有限公司;UV-2012PC紫外可见分光光度计,上海美谱达仪器有限公司;DHG-9140A鼓风干燥机,上海一恒科学仪器有限公司;Genlee4K低速离心机,湖南湘立科学仪器有限公司;同时蒸馏萃取装置(玻璃),康玻实验设备有限公司;SHZ-D低温冷却循环泵,巩义市予华仪器有限责任公司;7890B-5977B型气相色谱-质谱联用仪,美国安捷伦公司。
1.2 实验方法
1.2.1 强化大曲厌氧固态发酵木薯
将粉碎木薯、无菌水和中温大曲按比例混合均匀。其中,m(木薯)∶m(无菌水)=4∶6,大曲添加量为80 g/kg木薯。将混合物置于玻璃坛(图1-a),室温固态发酵48 h,坛子顶部加水密封,确保发酵过程无空气进入。发酵结束后样品于-20 ℃冰箱保存备用。

a-固态发酵容器;b-同时蒸馏萃取装置
图1 木薯固态发酵和同时蒸馏萃取装置
Fig.1 Cassava solid-state fermentation vessel and simultaneous distillation extraction unit
1.2.2 发酵木薯挥发性代谢产物提取
将50.0 g发酵木薯加入175 mL丙二醇,调节pH值至7.0,在90 ℃水浴锅中反应8 h,离心得到提取液。将提取液加入同时蒸馏萃取装置(图1-b)一端的圆底烧瓶中,并加入100 mL 去离子水。装置的另一端蒸馏瓶中注入50 mL二氯甲烷,于60 ℃水浴中加热。当水与二氯甲烷分层开始计时,2.5 h后萃取结束,在萃取液中加入10.0 g无水硫酸钠,静置过夜。为了定量分析挥发性代谢产物,萃取液中添加2,6-二氯甲苯作为内标。然后将萃取液浓缩至1 mL转移至样品瓶中,低温密封保存,用于GC-MS分析。
1.2.3 GC-MS测定挥发性代谢产物
色谱柱为HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm),升温程序为:初始温度50 ℃,以4 ℃/min升温至280 ℃。进样口温度280 ℃,分流比10∶1;载气高纯He;载气流量3.0 mL/min;进样量1 μL。质谱条件EI源,接口温度270 ℃,四极杆温度150 ℃,电子能量70 eV,质量扫描范围为35~550 m/z。
1.2.4 发酵木薯营养成分分析
水分、粗蛋白质、粗脂肪、粗纤维、粗灰分和总磷含量分别按照GB/T 6435—2014《饲料中水分的测定》、GB/T 6432—2018《饲料中粗蛋白的测定 凯氏定氮法》、GB/T 6433—2025 《饲料中粗脂肪的测定》、GB/T 6434—2022《饲料中粗纤维的含量测定》、GB/T 6438—2007《饲料中粗灰分的测定》和GB/T 6437—2018《饲料中总磷的测定 分光光度法》方法测定。还原糖:采用3,5-二硝基水杨酸法测定。
1.2.5 宏基因组测序分析
发酵木薯、大曲和木薯原料样品(分别记为A、B、C,每个样品3个平行),送样到上海生工生物科技(中国上海)有限公司进行宏基因组测序分析。
1.2.6 数据分析
本研究所有处理均重复3次,结果用“平均值±标准差”表示。使用 Origin Pro 9.1 软件(Origin Lab,USA)进行统计分析并绘制图表。
2 结果与分析
2.1 基因组测序与组装质量分析
本次宏基因测序样本的基因片段长度集中在0~1 900 nt范围内,短片段长度基因占大多数(图2)。
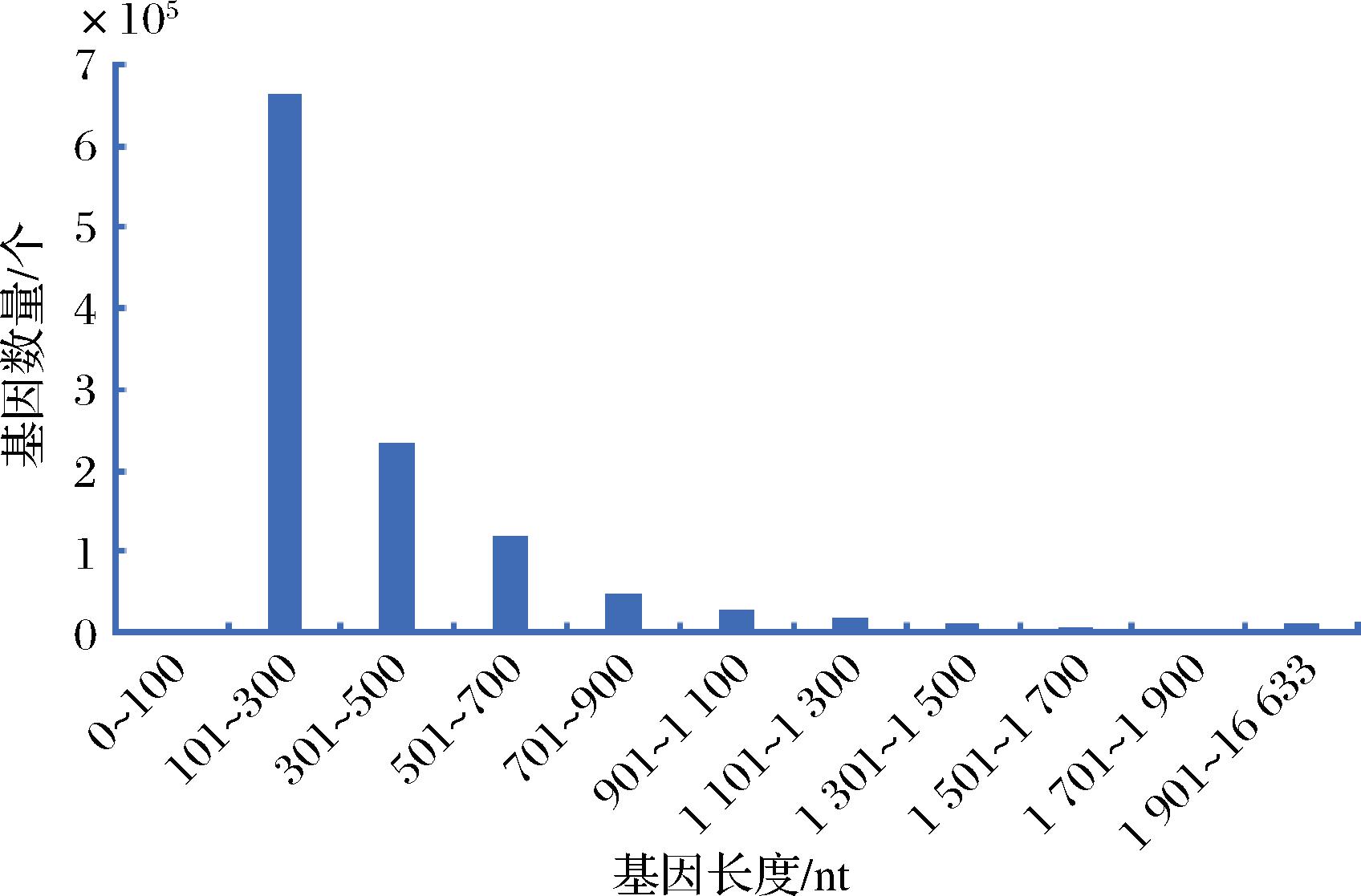
图2 样品基因数量分析
Fig.2 Analysis of gene quantity in samples
由表1可知,基因覆盖度指数(Coverage)均超过0.997,说明测序结果能代表样本的真实情况,能够反映该区域微生物群落物种组成[10]。在基因多样性方面(Shannon和Simpson指数),发酵木薯、大曲和木薯原料之间差异不显著(P>0.05)。在观测到的基因数目(Observed指数)和基因丰富度方面(Chao1 和ACE指数),发酵木薯指数最低,与大曲、木薯原料之间差异显著(P<0.05),说明在强化接种大曲木薯发酵产品中具有稳定的优势菌群,且微生物群落多样性降低[11]。
表1 样品基因多样性统计
Table 1 Statistics of sample gene diversity
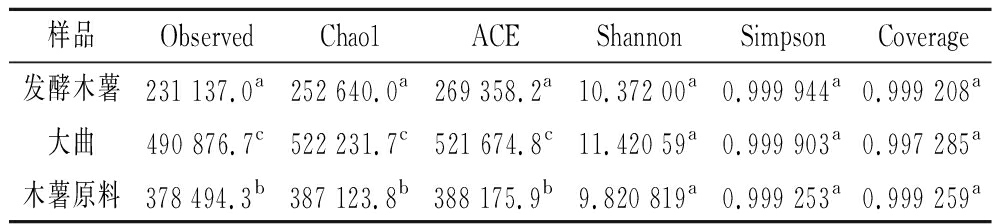
样品ObservedChao1ACEShannonSimpsonCoverage发酵木薯231 137.0a252 640.0a269 358.2a10.372 00a0.999 944a0.999 208a大曲490 876.7c522 231.7c521 674.8c11.420 59a0.999 903a0.997 285a木薯原料378 494.3b387 123.8b388 175.9b9.820 819a0.999 253a0.999 259a
注:同列数据小写字母不同表示差异显著(P<0.05)。
2.2 微生物群落多样性分析
图3为样品(A-发酵木薯;B-大曲;C-木薯原料)微生物群落在门和属水平上的丰度前10的堆积图(图3-a、图3-b)和韦恩图(图3-c、图3-d)。韦恩图结果显示,3种样品微生物群落组成及相互影响有所区别。在门水平上(图3-a),发酵木薯中主要以芽孢杆菌门(Bacillota)和变形菌门(Pseudomonadota)为主,相对丰度均值分别为75.35%、24.28%;木薯原料中放线菌门(Actinomycetota,相对丰度均值9.39%)及大曲中子囊菌门(Ascomycota,相对丰度均值16.49%)和毛霉菌门(Mucoromycota,相对丰度均值48.26%)在发酵木薯中含量较少。在属水平上(图3-b),3种样品微生物群落组成差异较大(P<0.05),发酵木薯中优势菌群主要由肠球菌属(Enterococcus,相对丰度均值最高为52.15%)、肠杆菌属(Enterobacter,相对丰度均值为18.28%)和乳球菌属(Lactococcus,相对丰度均值为14.40%)组成,但在大曲和木薯原料中含量极少。发酵剂大曲中的菌群结构较为复杂,没有特别明显优势的菌属(相对丰度>25%),而在特定木薯培养基和厌氧环境中,形成了特定的优势菌群并发挥作用。由于采用厌氧固态发酵方式,大曲中相对丰度均值最高22.45%的横梗霉属(Lichtheimia)受到较大抑制。木薯原料中相对丰度较高的假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)和链霉菌属(Streptomyces)在发酵过程中也受到抑制。
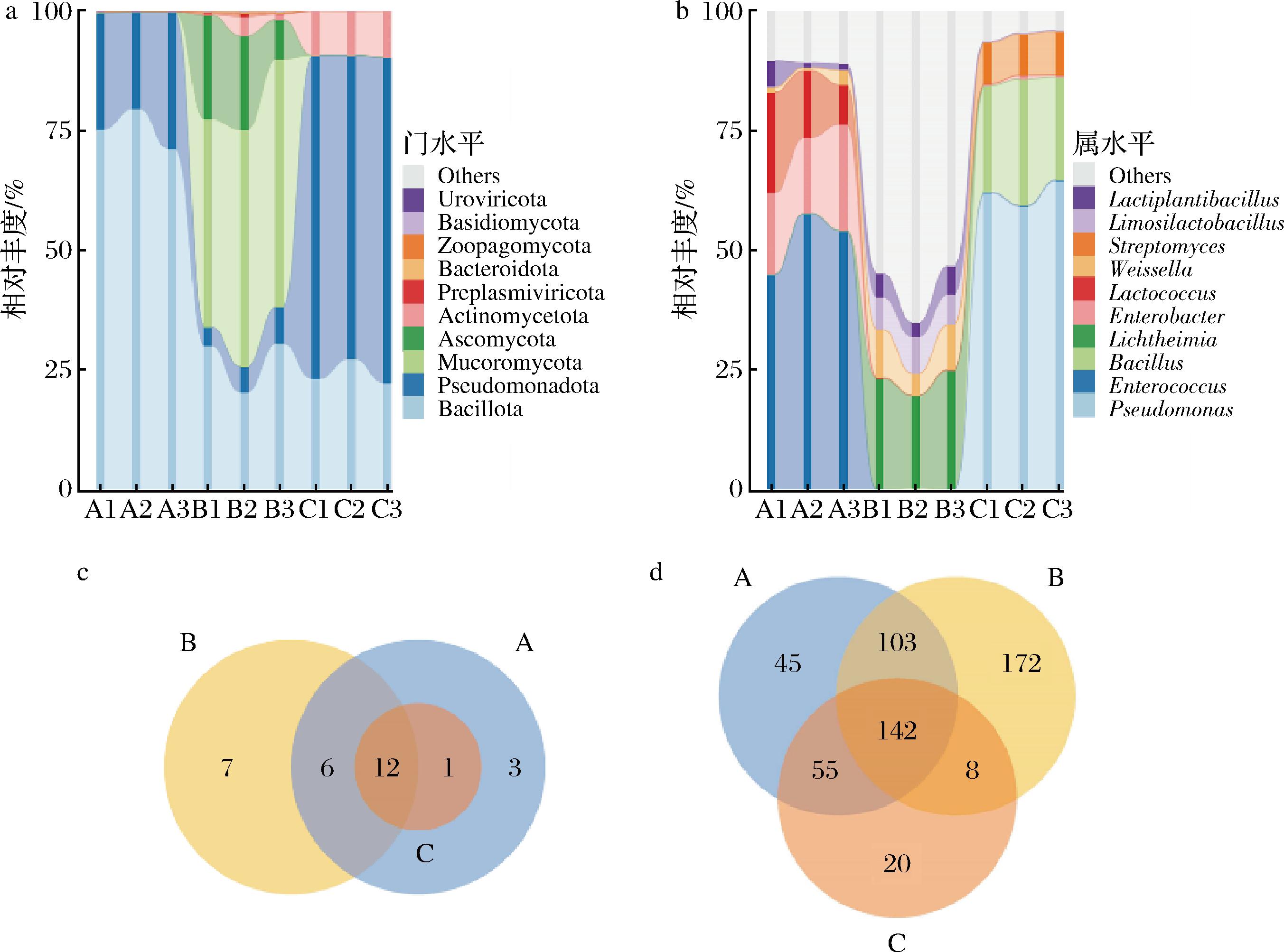
a-微生物群落在门水平上堆积图;b-微生物群落在属水平上堆积图;c-微生物群落在门水平上韦恩图;d-微生物群落在属水平上韦恩图
图3 样本微生物群落在门和属水平上的组成
Fig.3 Microbial composition at the phylum and genus levels in samples
2.3 宏基因功能注释与分析
2.3.1 基因集KEGG注释结果
将发酵木薯基因集注释到KEGG数据中,主要归属为6大类代谢通路:细胞过程、环境信息处理、遗传信息处理、人类疾病、新陈代谢和生物体系统[12]。主要功能基因二级代谢途径有46类。由图4可知,全局和概述图谱(Global and overview maps)被注释到的基因数最多,其次是碳水化合物代谢(Carbohydrate metabolism)、氨基酸代谢(Amino acid metabolism)、辅因子和维生素代谢(Metabolism of cofactors and vitamins)。全局和概述图谱的KEGG三级功能分类包括主要代谢通路,其次是碳代谢、翻译、单向转导、折叠、分选和降解以及其他次生代谢的生物合成途径,包含生物生存所必须的主要代谢功能或过程[13]。木薯原料含有较为丰富的碳水化合物与蛋白质,因此碳水化合物代谢与氨基酸代谢相关基因会比较丰富,是风味物质及其前体形成的重要途径[14-15]。
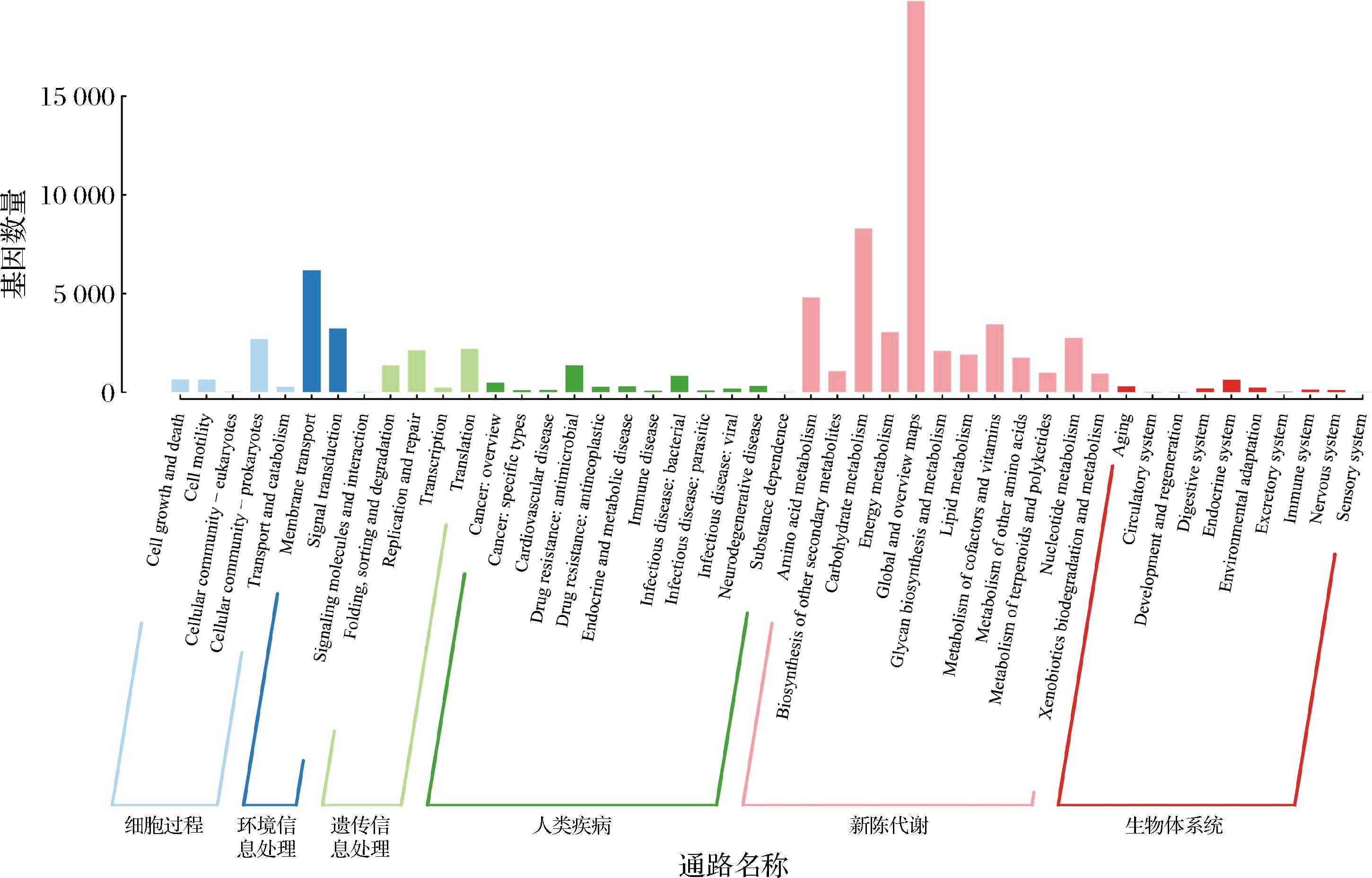
图4 KEGG代谢通路分类统计柱状图
Fig.4 KEGG secondary classification annotation
2.3.2 基因集碳水化合物活性酶(Carbohydrate active enzyme, CAZy)注释结果
通过CAZy数据库比对,可以获得CAZy基因的功能注释信息。CAZy数据库主要涵盖5个功能类别:糖苷水解酶(glycoside hydrolases,GHs)、糖基转移酶(glycosyltransferases,GTs)、碳水化合物酯酶(carbohydrate esterases,CEs)、辅助氧化还原酶(auxiliary oxidoreductases,AAs)和碳水化合物结合模块(Carbohydrate-binding modules, CBMs)。在发酵过程中,糖复合物、低聚糖和多糖在生命中起着至关重要的作用,不仅是结构和能量储备成分,也是细胞内和细胞间的重要识别事件[16]。如图5所示,在CAZy功能分类统计中,发酵木薯(图5-a)和大曲(图5-b)中GHs注释结果最多,表明GHs是执行碳水化合物代谢功能时促进多糖水解的主要酶系统。相对于大曲中注释较少的非催化性CBMs(图5-b),在发酵木薯中得到有效注释(图5-a)。CBMs大多数通过肽链与模块化CAZy的催化区域紧密相连并帮助酶识别、黏附底物以便更好地发挥酶解作用[17]。CBMs主要参与木薯原料中纤维素与半纤维素酶解过程,释放出大量还原糖[18]。
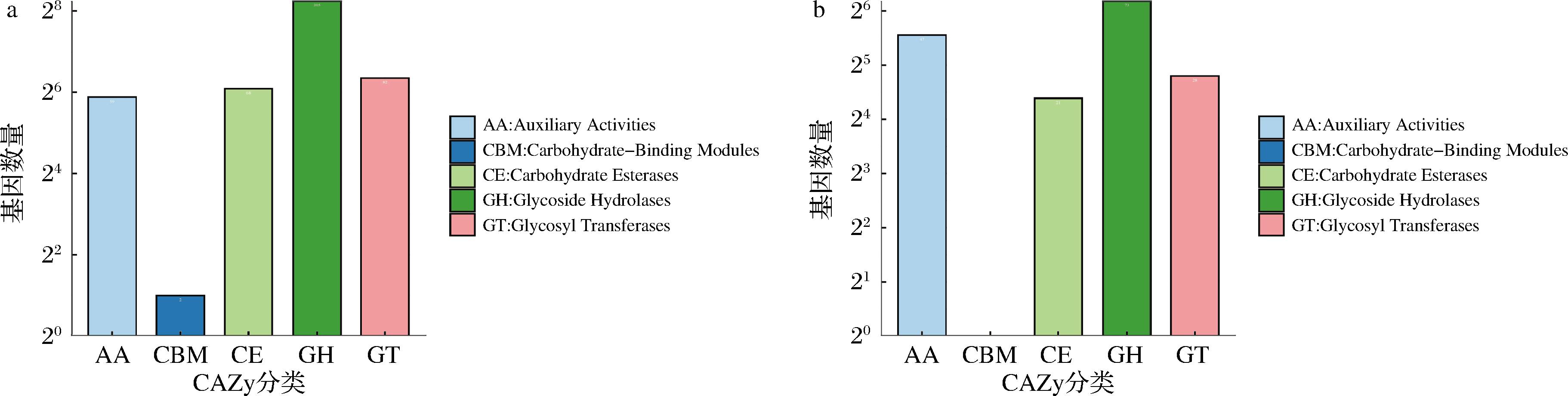
a-发酵木薯;b-大曲
图5 CAZy功能分类统计柱状图
Fig.5 CAZy annotation classification statistics for samples
2.4 发酵木薯营养成分分析
表2结果表明,发酵木薯中还原糖含量为18.54 mg/g,较木薯原料提高了57.39%,这可能是由于大曲微生物产生的α-淀粉酶降解原料淀粉的作用[19]。发酵木薯中粗蛋白含量达到3.07%,较木薯原料提高了65.95%。其中,氨基酸总量达到23.92 g/kg,较发酵前提高了65.88%,特别是亮氨酸、缬氨酸和苯丙氨酸含量分别提高了300%、231.03%和120.21%。这可能是归因于发酵过程中的优势微生物乳球菌属(Lactococcus),即乳球菌水解蛋白产生多肽和游离氨基酸,这与RAZZAQ等[20]的研究结果一致。还原糖和氨基酸作为美拉德反应的前体物质,在湿发酵木薯烘干过程中可产生更丰富的风味产物。此外,发酵过程导致粗脂肪含量显著减少,这可能是大曲微生物代谢产生脂肪酶介导脂质水解的结果[21]。
表2 发酵木薯营养成分分析
Table 2 Nutritional component analysis of fermented cassava
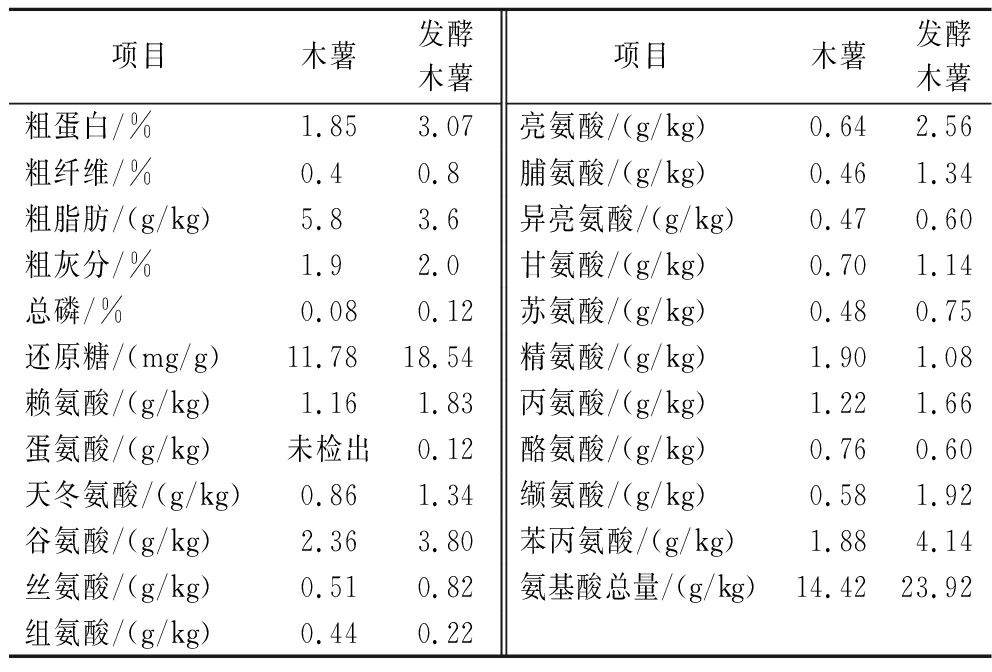
项目木薯发酵木薯项目木薯发酵木薯粗蛋白/%1.853.07亮氨酸/(g/kg)0.642.56粗纤维/%0.40.8脯氨酸/(g/kg)0.461.34粗脂肪/(g/kg)5.83.6异亮氨酸/(g/kg)0.470.60粗灰分/%1.92.0甘氨酸/(g/kg)0.701.14总磷/%0.080.12苏氨酸/(g/kg)0.480.75还原糖/(mg/g)11.7818.54精氨酸/(g/kg)1.901.08赖氨酸/(g/kg)1.161.83丙氨酸/(g/kg)1.221.66蛋氨酸/(g/kg)未检出0.12酪氨酸/(g/kg)0.760.60天冬氨酸/(g/kg)0.861.34缬氨酸/(g/kg)0.581.92谷氨酸/(g/kg)2.363.80苯丙氨酸/(g/kg)1.884.14丝氨酸/(g/kg)0.510.82氨基酸总量/(g/kg)14.4223.92组氨酸/(g/kg)0.440.22
2.5 挥发性代谢产物分析
采用GC-MS对同时蒸馏萃取馏分样品的挥发性香味成分进行检测,结果如表3所示。在发酵木薯挥发性代谢产物中,棕榈酸含量最高,反油酸和亚油酸次之,分别达到51.91、48.35、29.72 μg/g,说明接种大曲发酵强化了木薯中脂肪酸的生物合成。挥发性代谢产物中酯类主要有油酸乙酯(9.33 μg/g)、亚油酸乙酯(8.73 μg/g)、单油酸甘油酯(2.70 μg/g)和棕榈酸单甘酯(1.58 μg/g)等,由糖酵解或酯解微生物将醇与酸酯化形成,一般具有果香和花香味[22]。醇类作为酯类物质的前体,一般具有生香作用[23],含量最高的是1-(1,3-二甲基丁氧基)-2-丙醇,达到1.84 μg/g。醛类物质一般由氨基酸分解代谢或丙酮酸脱羧产生[24],发酵木薯中以异戊醛丙二醇缩醛(4.70 μg/g)、3-糠醛(3.38 μg/g)、辛醛丙二醇缩醛(1.65 μg/g)和苯乙醛(1.60 μg/g)等为主。挥发性代谢产物赋予了发酵样品独有风味特征。
表3 发酵木薯挥发性代谢产物分析
Table 3 Volatile component test results of fermented cassava
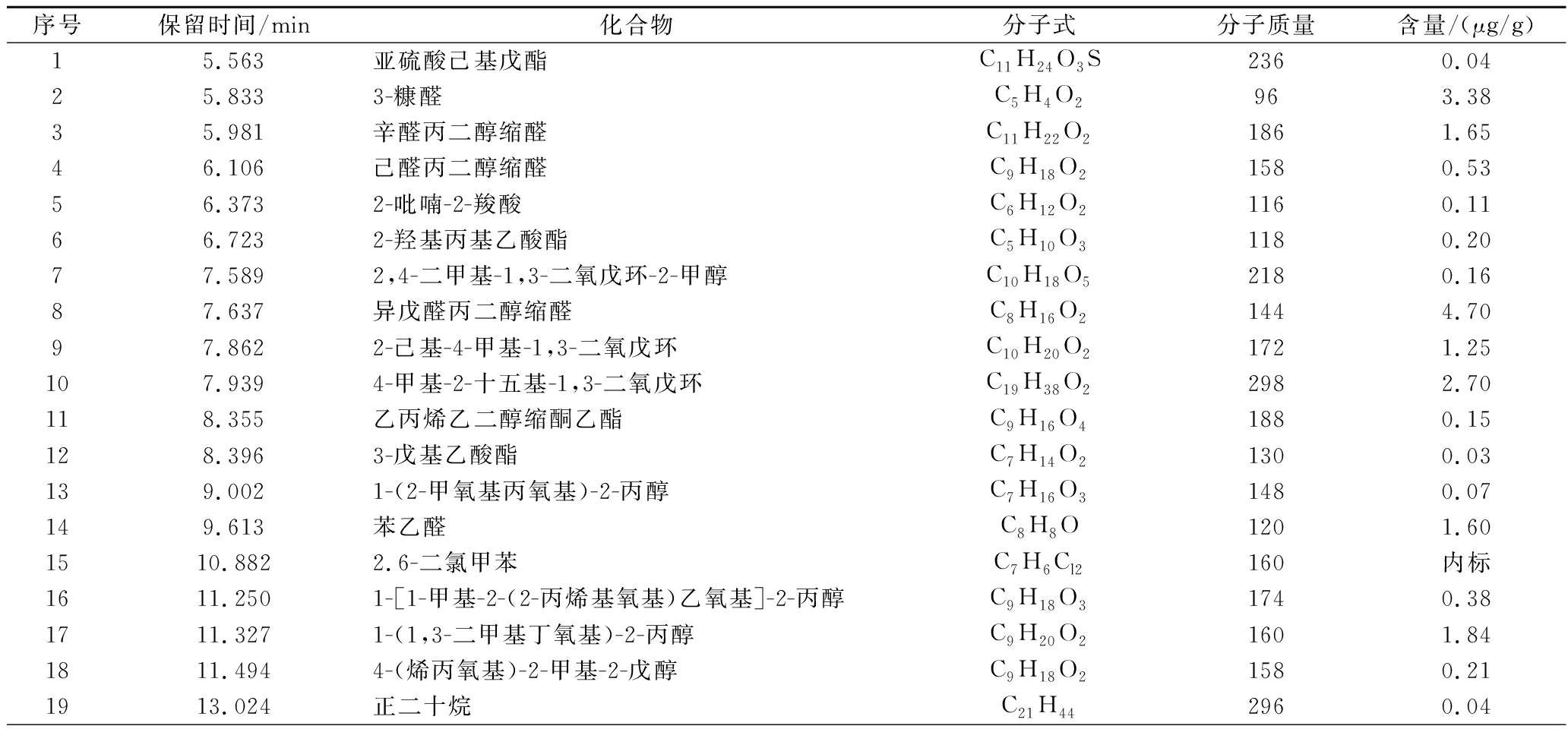
序号保留时间/min化合物分子式分子质量含量/(μg/g)15.563亚硫酸己基戊酯C11H24O3S2360.0425.8333-糠醛C5H4O2963.3835.981辛醛丙二醇缩醛C11H22O21861.6546.106己醛丙二醇缩醛C9H18O21580.5356.3732-吡喃-2-羧酸C6H12O21160.1166.7232-羟基丙基乙酸酯C5H10O31180.2077.5892,4-二甲基-1,3-二氧戊环-2-甲醇C10H18O52180.1687.637异戊醛丙二醇缩醛C8H16O21444.7097.8622-己基-4-甲基-1,3-二氧戊环C10H20O21721.25107.9394-甲基-2-十五基-1,3-二氧戊环C19H38O22982.70118.355乙丙烯乙二醇缩酮乙酯C9H16O41880.15128.3963-戊基乙酸酯C7H14O21300.03139.0021-(2-甲氧基丙氧基)-2-丙醇C7H16O31480.07149.613苯乙醛C8H8O1201.601510.8822.6-二氯甲苯C7H6Cl2160内标1611.2501-[1-甲基-2-(2-丙烯基氧基)乙氧基]-2-丙醇C9H18O31740.381711.3271-(1,3-二甲基丁氧基)-2-丙醇C9H20O21601.841811.4944-(烯丙氧基)-2-甲基-2-戊醇C9H18O21580.211913.024正二十烷C21H442960.04
续表3

序号保留时间/min化合物分子式分子质量含量/(μg/g)2013.8851-苯基-2-丙酮乙缩醛C11H14O21782.362116.1872,4-二叔丁基苯酚C14H22O2060.062219.064肉豆蔻酸C14H28O22280.072320.127十五烷酸C15H30O22420.242420.821棕榈酸甲酯C17H34O22700.102521.034十五碳烯酸C16H30O22540.552621.325棕榈酸C16H32O225651.912721.598棕榈酸乙酯C18H36O22840.202822.328十七烷酸C17H34O22700.272922.630亚油酸甲酯C19H34O22940.953022.690油酸甲酯C20H38O23100.693123.046亚油酸C18H32O228029.723223.105反油酸C18H34O228248.353323.236亚油酸乙酯C20H36O23088.733423.289油酸乙酯C20H38O23109.333523.473油酸癸酯C28H54O24220.013624.072棕榈酸单甘酯C19H38O43301.583725.146十八碳二烯酸C23H42O23500.273825.342单油酸甘油酯C21H40O43562.703926.006邻苯二甲酸C26H42O44180.044028.303芥酸酰胺C22H43NO3370.084128.635角鲨烯C30H504100.074229.092菜油甾醇C28H48O4000.40
3 结论与讨论
本研究采用白酒中温大曲作为发酵剂对木薯进行固态发酵,以评估其对发酵木薯食品营养成分和风味品质的影响。大曲中丰富微生物群落协同作用下,木薯中各种成分发生了生物化学上的转变。发酵木薯中优势菌群主要由肠球菌属(Enterococcus,相对丰度均值最高为52.15%)、肠杆菌属(Enterobacter,相对丰度均值为18.28%)和乳球菌属(Lactococcus,相对丰度均值为14.40%)组成。固态发酵提高了木薯中还原糖、氨基酸和粗蛋白含量,同时降低了粗纤维含量。发酵木薯中挥发性代谢产物组成和含量也得到了相应改善,其中脂肪酸(如棕榈酸、反油酸和亚油酸等)的生物合成得到一定加强。因此,固态发酵提供了一种可行的方法来提高农产品的营养成分和风味品质。后续可通过生物信息学方法构建人工合成核心功能微生物群落对木薯进行强化固态发酵,将更具操作潜力。
[1] TAPPIBAN P, SMITH D R, TRIWITAYAKORN K, et al.Recent understanding of starch biosynthesis in cassava for quality improvement:A review[J].Trends in Food Science &Technology, 2019, 83:167-180.
[2] RAMALHO R P, FERREIRA M D, VERAS A S C, et al.Replacement of corn with cassava scrapings in diets for primiparous lactating Holstein cows [J].Revista Brasileira De Zootecnia-Brazilian Journal of Animal Science, 2006, 35(3):1221-1227.
[3] TEEKEN B, AGBONA A, BELLO A, et al.Understanding cassava varietal preferences through pairwise ranking of gari-eba and fufu prepared by local farmer-processors[J].International Journal of Food Science &Technology, 2021, 56(3):1258-1277.
[4] WILLIAMS-NGEGBA M S E, ONABANJO O O, ANTHONY N M, et al.Variations in micronutrient concentrations and retentions in fufu made from yellow-fleshed cassava as a function of genotype and processing methods[J].Frontiers in Nutrition, 2024, 11:1295609.
[5] EGBUNE E O, EZEDOM T, ORORORO O C, et al.Solid-state fermentation of cassava (Manihot esculenta Crantz):A review[J].World Journal of Microbiology &Biotechnology, 2023, 39(10):259.
[6] EGBUNE E O, AGANBI E, ANIGBORO A A, et al.Biochemical characterization of solid-state fermented cassava roots (Manihot esculenta Crantz) and its application in broiler feed formulation[J].World Journal of Microbiology &Biotechnology, 2022, 39(2):62.
[7] OJO I, APIAMU A, EGBUNE E O, et al.Biochemical characterization of solid-state fermented cassava stem (Manihot esculenta crantz-MEC) and its application in poultry feed formulation[J].Applied Biochemistry and Biotechnology, 2022, 194(6):2620-2631.
[8] OJIMELUKWE P C, NWAKANMA A C.Solid state fermentation improves the quality of soy-cassava diet[J].Acta Alimentaria, 51(3):341-347.
[9] CHILAKAMARRY C R, MIMI SAKINAH A M, ZULARISAM A W, et al.Advances in solid-state fermentation for bioconversion of agricultural wastes to value-added products:Opportunities and challenges[J].Bioresource Technology, 2022, 343:126065.
[10] PANG Z M, LI W W, HAO J, et al.Correlational analysis of the physicochemical indexes, volatile flavor components, and microbial communities of high-temperature Daqu in the northern region of China[J].Foods, 2023, 12(2):326.
[11] WANG W H, XU Y Q, HUANG H Q, et al.Correlation between microbial communities and flavor compounds during the fifth and sixth rounds of sauce-flavor Baijiu fermentation[J].Food Research International, 2021, 150:110741.
[12] IBRAHIM R M, SEDEEK M S, ABDEL WARETH A, et al.Impact of cultivar types and thermal processing methods on sweet potato metabolome, a comparative analysis via a multiplex approach of NIR and GC-MS based metabolomics coupled with chemometrics[J].Food Chemistry, 2025, 463:141125.
[13] YIN Y M, QIAO S C, KANG Z H, et al.Transcriptome and metabolome analyses reflect the molecular mechanism of drought tolerance in sweet potato[J].Plants, 2024, 13(3):351.
[14] JI C Y, CHUNG W H, KIM H S, et al.Transcriptome profiling of sweetpotato tuberous roots during low temperature storage[J].Plant Physiology and Biochemistry, 2017, 112:97-108.
[15] 张清玫, 赵鑫锐, 李江华, 等.不同香型白酒大曲微生物群落及其与风味的相关性[J].食品与发酵工业, 2022, 48(10):1-8.ZHANG Q M, ZHAO X R, LI J H, et al.The relationship between microbial community and flavors of three types of Daqu[J].Food and Fermentation Industries, 2022, 48(10):1-8.
[16] LOMBARD V, GOLACONDA RAMULU H, DRULA E, et al.The carbohydrate-active enzymes database (CAZy) in 2013[J].Nucleic Acids Research, 2014, 42(Database issue):D490-D495.
[17] SHI Q C, ABDEL-HAMID A M, SUN Z Y, et al.Carbohydrate-binding modules facilitate the enzymatic hydrolysis of lignocellulosic biomass:Releasing reducing sugars and dissociative lignin available for producing biofuels and chemicals[J].Biotechnology Advances, 2023, 65:108126.
[18] GILBERT H J, KNOX J P, BORASTON A B.Advances in understanding the molecular basis of plant cell wall polysaccharide recognition by carbohydrate-binding modules[J].Current Opinion in Structural Biology, 2013, 23(5):669-677.
[19] ZHAO T, LI X P, ZHU R Z, et al.Effect of natural fermentation on the structure and physicochemical properties of wheat starch[J].Carbohydrate Polymers, 2019, 218:163-169.
[20] RAZZAQ A, SHAMSI S, ALI A, et al.Microbial proteases applications[J].Frontiers in Bioengineering and Biotechnology, 2019, 7:110.
[21] AL-ANSI W, ALI MAHDI A, ALI AL-MAQTARI Q, et al.The potential improvements of naked barley pretreatments on GABA, β-glucan, and antioxidant properties[J].LWT, 2020, 130:109698.
[22] SHEN Y Y, WU Y Y, WANG Y Q, et al.Contribution of autochthonous microbiota succession to flavor formation during Chinese fermented mandarin fish (Siniperca chuatsi)[J].Food Chemistry, 2021, 348:129107.
[23] SU Z B, LIU B X, MA C.Analyses of the volatile compounds in cherry wine during fermentation and aging in bottle using HS-GC-IMS[J].Food Science and Technology Research, 2021, 27(4):599-607.
[24] ZHANG H J, WANG Y, FENG X J, et al.The analysis of changes in nutritional components and flavor characteristics of wazu rice wine during fermentation process[J].Food Analytical Methods, 2022, 15(4):1132-1142.