中国水果产量近年来一直居世界首位,而且种类繁多。据国家统计局公布的最新统计数据显示,2022年我国水果产量稳步增长,果园面积与产量分别达1 300.95万hm2 和31 296.24万t,较2021年分别增加了1.57%和4.42%,较2012年分别增加了18.38%和41.67%[1]。李子果实营养丰富,含糖分、维生素C、蛋白质及多种矿物质和微量元素,有益健康[2-5]。2021年中国李子产量占全球55.2%,2021年中国收获面积1 946.5千hm2[1]。近年来随着化肥和人工成本的持续增长,以及国内果品种类的不断增加,传统李子种植产业面临着巨大的压力。这使得李子种植的需求和利润空间受到持续挤压,产业发展遭遇瓶颈。为了应对这一挑战,提升产业利润和附加值,发展李子加工品成为了一个重要的方向。对于李子种植产业来说,发展加工品是一个迫在眉睫的任务。通过技术升级、提高产品质量和拓展市场渠道等措施,可以推动李子产业的持续发展,为消费者提供更多优质的李子产品。
国内外对酵母菌的研究主要集中在菌群多样性、生理作用、抗性研究、筛选应用等方面,其中针对筛选的研究主要专注于以提高果酒风味、营养物质和品质的专用酵母菌筛选应用方面。NIYOMVONG等[6]研究发现,泰国有孢汉逊酵母Zal1酿造的李子酒总酚含量和抗氧化活性相比于普通葡萄酒酵母酿造的李子酒较低,但酿造的李子酒具有明显的香气。WU等[7]从柠檬环境中筛选得到一株酸耐受性较强的酿酒酵母(NM-8)酿造的柠檬酒品质优良,口感评分较高,并且酿造的柠檬酒具有较强的抗氧化活性。陈雪雪[8]从猕猴桃自然发酵液中筛选的酿酒酵母用于发酵,丰富了酒的风味并提高了其典型性。与单一菌株发酵果酒相比,混合发酵会促使更高水平的萜烯类、高级醇和酯类物质产生,制得的发酵果酒口感更为丰富[9]。程思琦[10]利用克鲁维毕赤酵母与酿酒酵母进行混菌发酵,为咖啡果皮酒增添了丰富的花香、甜香与草木香。GUO等[11]通过酿酒酵母与土著非酿酒酵母共接种去除桑葚酒中的乙酸,与酿酒酵母RV002纯种发酵相比,葡萄酒中乙酸浓度下降了65%~73%。筛选专用酵母菌是果酒品质的决定性因素。目前,国内李子果酒发酵主要采用酿酒酵母、SY安琪酵母,酵母单一,果酒特征风味不足[12]。本土果酒专用酵母的筛选,促进该地区酵母菌资源库的建立,利用和选育我国优良的酵母品系,有效解决国产果酒风味同质化问题,增强其国际竞争力[13-14]。
四川青脆李,因其独特的口感和丰富的营养,广受欢迎。其种植面积广泛,产量丰富,果实硕大,果肉内含多种维生素和矿物质,深得消费者喜爱。随着乡村振兴战略的推进,四川青脆李的栽培与生产日益兴旺,然而市场供需的波动也会对果农的收入产生影响。筛选四川本土的专用于李子酿造的酵母菌,不仅有助于促进李子果酒产业链的延伸,提高李子的经济价值,还能为当地酵母资源库的建立提供基础数据。
1 材料与方法
1.1 材料与试剂
青脆李,产地为四川达州;YPD液体培养基、YPD固体培养基,杭州百思生物技术有限公司;2×Taq PCR mix(蓝色),北京酷来搏科技有限公司;DNA Marker,北京索莱宝科技有限公司。以上试剂均为分析纯。
1.2 仪器与设备
DW-86L726G PCR基因扩增仪,上海宝予德科学仪器有限公司;JS-2012凝胶成像系统,上海培清科技有限公司;HE-120水平电泳系统,上海民仪电子有限公司;EPS 600数显式稳压稳流电泳仪,上海沪粤明科学仪器有限公司;ZHWY-1102C恒温振荡培养箱,上海智城分析仪器制造有限公司;UV-1800PC紫外可见分光光度计,上海美析仪器有限公司。
1.3 试验方法
1.3.1 样品处理
新鲜青脆李洗净、晾干后去核称重,加入其质量分数30%~50%的白砂糖,密封,并置于28 ℃培养箱中放置2~3 d进行富集。
1.3.2 酵母菌分离纯化
将1 mL糖渍李子液以10倍梯度稀释至10-3~10-7,取0.1 mL稀释液涂布在YPD固体培养基上,在28 ℃下培养2 d。挑选具有酵母菌菌落特征的单个菌落进行平板划线,纯化培养2次后,在光学显微镜下观察其菌体形态和繁殖方式。
1.3.3 优良酵母菌菌株的筛选
1.3.3.1 产气性能测定
参照文献[15]的方法,将分离出的菌株接种在含杜氏小管的YPD液体培养基中,于28 ℃下培养2 d,每隔24 h观察1次杜氏小管中的产气情况。
1.3.3.2 产酒精、产酯性能测定
将1.3.3.1节筛选得到的菌株按照2%的接种量(菌液浓度约为1.0×107 CFU/mL)接种于葡萄糖质量浓度为260 g/L的YPD液体培养基中,在28 ℃下振荡发酵8 d。参照GB 5009.225—2023《食品安全国家标准 酒和食用酒精中乙醇浓度的测定》中酒精计法测定其酒精度,参照GB/T 10345—2022《白酒分析方法》中的电位滴定法测定其总酯含量。
1.3.3.3 发酵力性能测定
参考杜沁岭等[16]的方法,稍作修改,将1.3.3.2节筛选得到的菌株在葡萄糖质量浓度为200 g/L 的YPD液体培养基发酵8 d,每隔12 h测定1次质量,并绘制发酵力性能曲线。
1.3.4 酵母菌分子生物学鉴定
将通过1.3.3节步骤筛选得到的高产气、高产酒精、高产香及发酵力强的综合特性优良的酵母菌菌株进行生物分子学鉴定。采用26S rDNA序列扩增,使用通用引物NL1(5′-GCATATCAATAAGCGGAGGAA-AAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′),由百克赛斯生物科技有限公司合成。PCR扩增后送至成都有康健兴生物科技有限公司测序。将测序得到的序列与NCBI数据库进行同源比对分析,并使用MEGA 7.0构建系统发育树。
1.3.5 酵母菌耐受性研究
1.3.5.1 耐酒精性能测定
按照2%接种量将鉴定后的菌株接种于分别添加4%、6%、8%、10%、12%(体积分数)乙醇的YPD液体培养基中,在28 ℃下振荡发酵2 d,测定发酵液的OD600 nm值。以不添加乙醇的YPD培养基为空白对照,评估菌株的耐酒精性能。
1.3.5.2 耐糖性能测定
分别配制含质量浓度为300、350、400、450、500 g/L葡萄糖的YPD液体培养基,接种菌株,其余步骤同1.3.5.1节。以不添加葡萄糖的YPD培养基为空白对照,评估菌株的耐糖性能。
1.3.5.3 耐低pH性能测定
用乳酸将YPD培养基的pH值分别调整为2.5、2.7、2.9、3.1、3.3、3.5,接种菌株,其余步骤同1.3.5.1节,以不添加乳酸的YPD培养基为空白对照,评估菌株的耐低pH性能。当OD600 nm值处于1.5~2.5时,酵母菌活性较高,作为判断耐受性好坏的依据[17]。
1.4 数据处理与分析
采用单因素方差分析(analysis of variance,ANOVA)和Duncan检验,当P<0.05表示显著差异。实验结果以“平均值±标准差”表示。
2 结果分析
2.1 酵母菌分离与纯化
对四川达州青脆李糖渍后,进行分离纯化酵母菌,得到40株菌株,编号为J1~J40,其菌落形态见表1。40株菌的菌落形态相似,但菌落颜色、菌落大小以及繁殖方式有一定的差别。其中,J9、J10、J17菌落颜色为红色,其余37株菌均为乳白色;J2、J5、J13、J31、J32、J33、J34、J36、J39、J40的菌落均相对较大;J6、J10、J14的繁殖方式为单/双端出芽,其余的37株菌均为单端出芽。
表1 四十株菌株的菌落特征及细胞形态特征分析
Table 1 Colony and morphology characteristics of isolated 40 strains

菌株编号菌落颜色菌落大小边缘情况表面情况是否易挑起细胞形态繁殖方式J1乳白色中等整齐光滑、较湿润是椭圆形单端出芽J2乳白色偏大整齐光滑、较湿润是椭圆形单端出芽J3乳白色偏小整齐光滑、较湿润是椭圆形单端出芽J4乳白色中等整齐光滑、较湿润是椭圆形单端出芽J5乳白色偏大整齐光滑、较湿润是椭圆形单端出芽J6乳白色中等整齐光滑、较湿润是椭圆形单/双端出芽J7乳白色偏小整齐光滑、较湿润否柠檬形单端出芽J8乳白色中等整齐光滑、较湿润是柠檬形单端出芽J9红色中等整齐光滑、较湿润是球形单端出芽J10红色中等整齐光滑、较湿润是柠檬形单/多端出芽J11乳白色偏小整齐光滑、较湿润是球形单端出芽J12乳白色中等整齐光滑、较湿润是球形单端出芽J13乳白色偏大整齐光滑、较湿润是柠檬形单端出芽J14乳白色中等整齐光滑、较湿润是椭圆形单/双端出芽J15乳白色中等整齐光滑、较湿润是球形单端出芽J16乳白色中等整齐光滑、较湿润是柠檬形单端出芽J17红色中等整齐光滑、较湿润否椭圆形单端出芽J18乳白色中等整齐光滑、较湿润是柠檬形单端出芽J19乳白色中等整齐光滑、较湿润是圆形单端出芽J20乳白色中等整齐光滑、较湿润是椭圆形单端出芽J21乳白色中等整齐光滑、较湿润是球形单端出芽J22乳白色中等整齐光滑、较湿润是球形单端出芽J23乳白色中等整齐光滑、较湿润是球形单端出芽J24乳白色中等整齐光滑、较湿润是柠檬形单端出芽J25乳白色中等整齐光滑、较湿润是椭圆形单端出芽J26乳白色中等整齐光滑、较湿润是椭圆形单端出芽J27乳白色中等整齐光滑、较湿润否椭圆形单端出芽J28乳白色偏小整齐光滑、较湿润是椭圆形单端出芽J29乳白色偏小整齐光滑、较湿润是柠檬形单端出芽J30乳白色偏小整齐光滑、较湿润是柠檬形单端出芽J31乳白色偏大整齐光滑、较湿润是椭圆形单端出芽J32乳白色中等整齐光滑、较湿润是圆形单端出芽J33乳白色偏大整齐光滑、较湿润是圆形单端出芽J34乳白色偏大整齐光滑、较湿润是柠檬形单端出芽J35乳白色偏小整齐光滑、较湿润是圆形单端出芽J36乳白色偏大整齐光滑、较湿润是椭圆形单端出芽J37乳白色中等整齐光滑、较湿润是圆形单端出芽J38乳白色中等整齐光滑、较湿润是圆形单端出芽J39乳白色偏大整齐光滑、较湿润是椭圆形单端出芽J40乳白色偏大整齐光滑、较湿润是椭圆形单端出芽
2.2 酵母菌菌株筛选
2.2.1 酵母产气性能试验
通过产气试验判断酵母菌的发酵能力和起酵速度。将40株菌株进行产气性能试验,发酵24 h后,J3、J7、J8、J24、J27、J28、J29、J30均不产气,剩余32株菌株均产气;发酵48 h后,J3、J7、J24、J28、J29、J30均不产气,其余34株菌株均产气,J8、J27在24~48 h产气,与不产气菌株相比,它们拥有产气能力,但弱于发酵24 h就产气的菌株。因此,保留产气能力强的32株菌株。具体产气能力见表2。
表2 酵母菌产气能力
Table 2 Gas-producing capacity of yeast
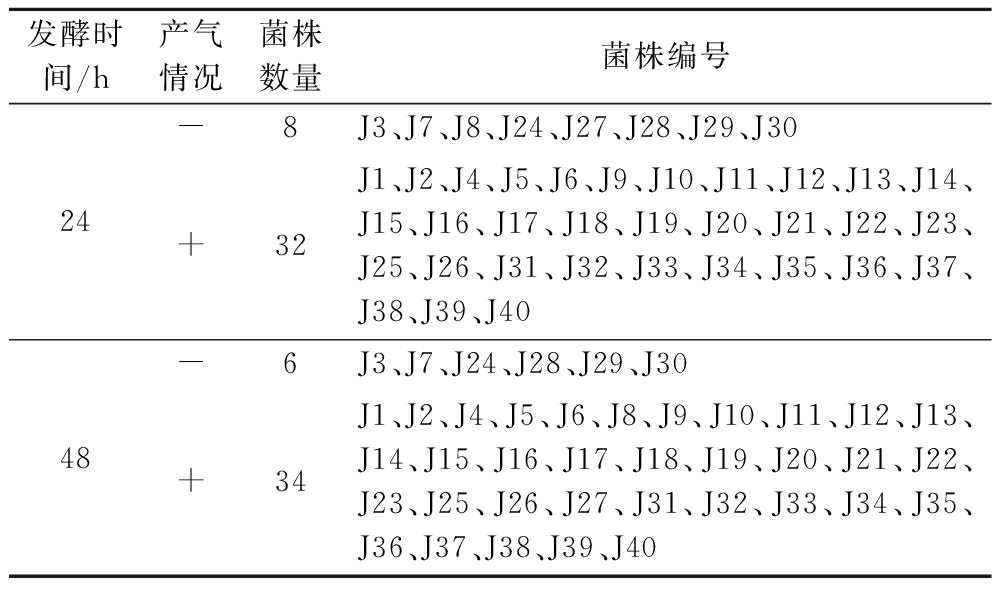
发酵时间/h产气情况菌株数量菌株编号24-8J3、J7、J8、J24、J27、J28、J29、J30+32J1、J2、J4、J5、J6、J9、J10、J11、J12、J13、J14、J15、J16、J17、J18、J19、J20、J21、J22、J23、J25、J26、J31、J32、J33、J34、J35、J36、J37、J38、J39、J4048-6J3、J7、J24、J28、J29、J30+34J1、J2、J4、J5、J6、J8、J9、J10、J11、J12、J13、J14、J15、J16、J17、J18、J19、J20、J21、J22、J23、J25、J26、J27、J31、J32、J33、J34、J35、J36、J37、J38、J39、J40
注:杜氏小管中无气体用“-” 表示;杜氏小管中充满气体用“+”表示。
2.2.2 产酒精性能试验
在发酵8 d后,经过产气试验的32株酵母菌的酒精度呈现出不同结果,结果见表3。其中,J2、J4、J9和J31这4株酵母菌的产酒精能力较强,均超过7.0%vol,显著高于其他菌株(P<0.05),在NY/T 1508—2017《绿色食品 果酒》要求的果酒酒精度的标准范围7%vol~18%vol。4株产酒精能力强的菌株中,J2、J4和J31菌株的发酵液酒精度均超过8.5%vol,显著高于J9(P<0.05)。J12、J17、J20、J22、J23、J25、J26、J32、J33、J40表现出一定的产酒精能力,其发酵液的酒精度均超过5.0%vol。剩余18株酵母菌中J35、J36和J39的发酵液酒精度均小于2.0%vol,仅为0.32%vol、1.06%vol、1.21%vol。根据QB/T 5476—2020《果酒通用技术要求》,果酒酒精度应不低于2.0%vol,鉴于此,J35、J36、J39酵母菌菌株发酵液的酒精度不符合标准。因此,在此阶段选定发酵液酒精度大于8.5%vol的菌株,即J2、J4、J31。
表3 三十二株酵母菌的产酒精能力、产酯能力及其香气特征
Table 3 Alcohol production capacity, ester generation ability and aroma characteristics of 32 yeast strains
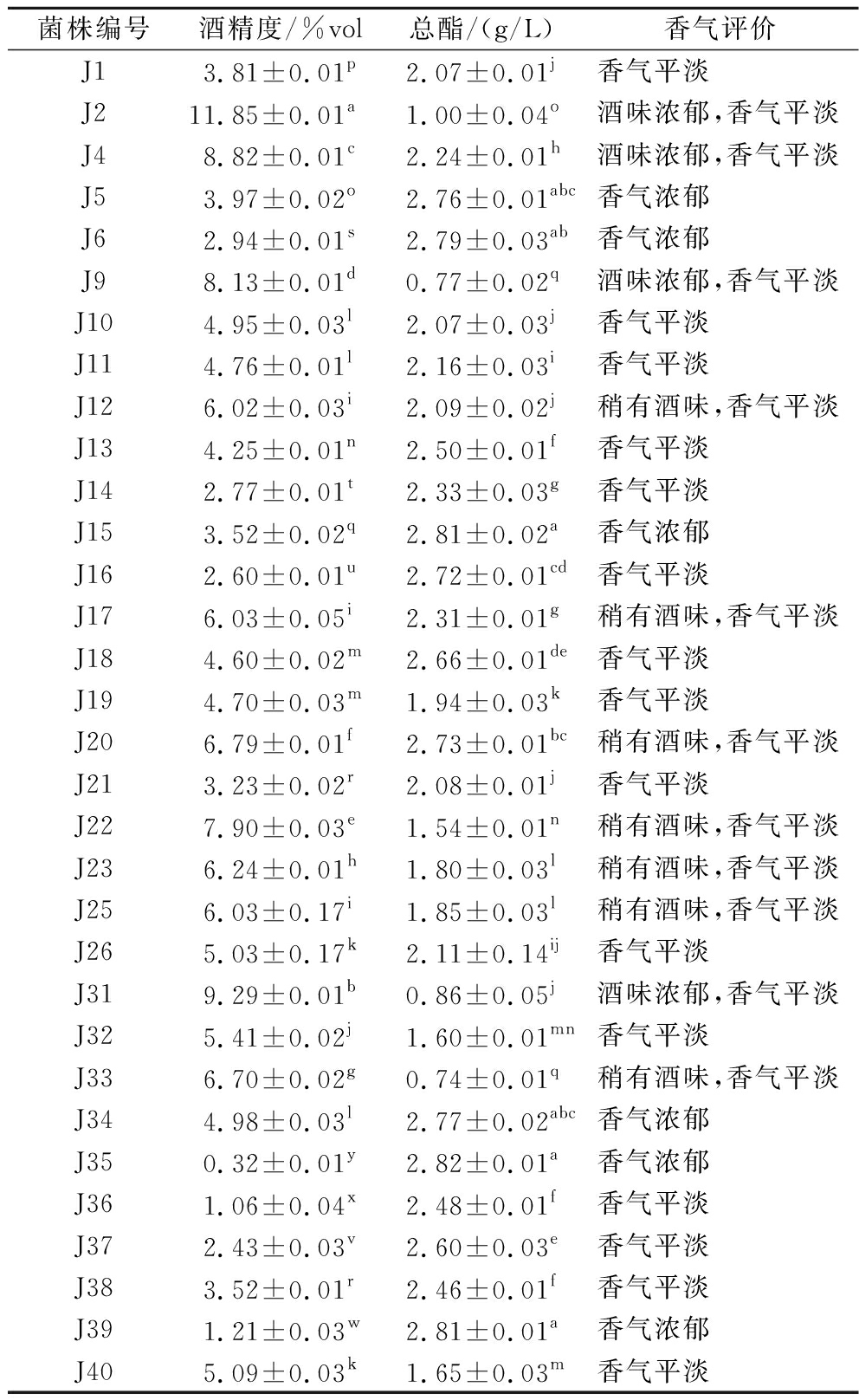
菌株编号酒精度/%vol总酯/(g/L)香气评价J13.81±0.01p2.07±0.01j香气平淡J211.85±0.01a1.00±0.04o酒味浓郁,香气平淡J48.82±0.01c2.24±0.01h酒味浓郁,香气平淡J53.97±0.02o2.76±0.01abc香气浓郁J62.94±0.01s2.79±0.03ab香气浓郁J98.13±0.01d0.77±0.02q酒味浓郁,香气平淡J104.95±0.03l2.07±0.03j香气平淡J114.76±0.01l2.16±0.03i香气平淡J126.02±0.03i2.09±0.02j稍有酒味,香气平淡J134.25±0.01n2.50±0.01f香气平淡J142.77±0.01t2.33±0.03g香气平淡J153.52±0.02q2.81±0.02a香气浓郁J162.60±0.01u2.72±0.01cd香气平淡J176.03±0.05i2.31±0.01g稍有酒味,香气平淡J184.60±0.02m2.66±0.01de香气平淡J194.70±0.03m1.94±0.03k香气平淡J206.79±0.01f2.73±0.01bc稍有酒味,香气平淡J213.23±0.02r2.08±0.01j香气平淡J227.90±0.03e1.54±0.01n稍有酒味,香气平淡J236.24±0.01h1.80±0.03l稍有酒味,香气平淡J256.03±0.17i1.85±0.03l稍有酒味,香气平淡J265.03±0.17k2.11±0.14ij香气平淡J319.29±0.01b0.86±0.05j酒味浓郁,香气平淡J325.41±0.02j1.60±0.01mn香气平淡J336.70±0.02g0.74±0.01q稍有酒味,香气平淡J344.98±0.03l2.77±0.02abc香气浓郁J350.32±0.01y2.82±0.01a香气浓郁J361.06±0.04x2.48±0.01f香气平淡J372.43±0.03v2.60±0.03e香气平淡J383.52±0.01r2.46±0.01f香气平淡J391.21±0.03w2.81±0.01a香气浓郁J405.09±0.03k1.65±0.03m香气平淡
注:同一列中不同小写字母表示差异显著(P<0.05)(下同)。
2.2.3 产酯性能试验
酯类化合物是构成酵母菌发酵液的主要风味物质,根据发酵液总酯的含量多少可以判断酵母菌产香能力[18],实验结果见表3。在这32株酵母菌株中,其中J5、J6、J15、J34、J35、J39,这6株菌株酯能力明显优于其他26株菌(P<0.05),发酵液总酯含量均大于2.75 g/L。熊荣园等[19]研究结果表明,从南充本地的柑橘和桑葚自然发酵果肉汁中分离出的克鲁维毕赤酵母的总酯产量为2.05 g/L;匡钰等[20]研究结果表明,安琪果酒酵母的总酯产量为2.37 g/L。同前人实验结果相比,本实验中上述6株酵母菌的产酯能力较强。剩余26株菌中J9、J31、J33产酯能力较弱,总酯含量均小于1.00 g/L。因此,除产酒精能力强的J2、J4、J31外,还保留发酵液总酯含量大于2.75 g/L的菌株J5、J6、J15、J34、J35、J39进行发酵能力的测定。
2.2.4 发酵力性能试验
酵母菌酿酒的过程分为2个阶段:糖化阶段,酶在有氧条件下将淀粉等多糖转化为单糖;在酒化阶段,酵母菌在无氧条件下将单糖分解为乙醇和CO2[21]。通过发酵液中CO2的质量损失量,来判断菌株发酵能力的强弱同时也能确定发酵的时间[22]。如图1所示,J2、J4、J31的发酵力在12~36 h内随着发酵时间增加,发酵液中CO2的质量损失量逐渐增加,均在36 h内达到峰值,CO2的质量损失量分别增大到3.11、2.30、3.22 g,说明在第12~36 h这3株菌株处于对数增长期。第36 h后,随着发酵时间延长,J2、J4、J31的CO2的质量损失逐渐减少均下降到0.15 g,说明在延长发酵时间后,发酵液中的底物减少,乙醇产物积累量增加,发酵反应受到抑制,导致CO2的质量损失也逐渐降低。由图1可知,在第132~180 h,CO2的质量损失趋于平缓,为0.15 g,说明菌株在第132 h时发酵基本完成,此时发酵液中葡萄糖已全部转化为CO2和乙醇。
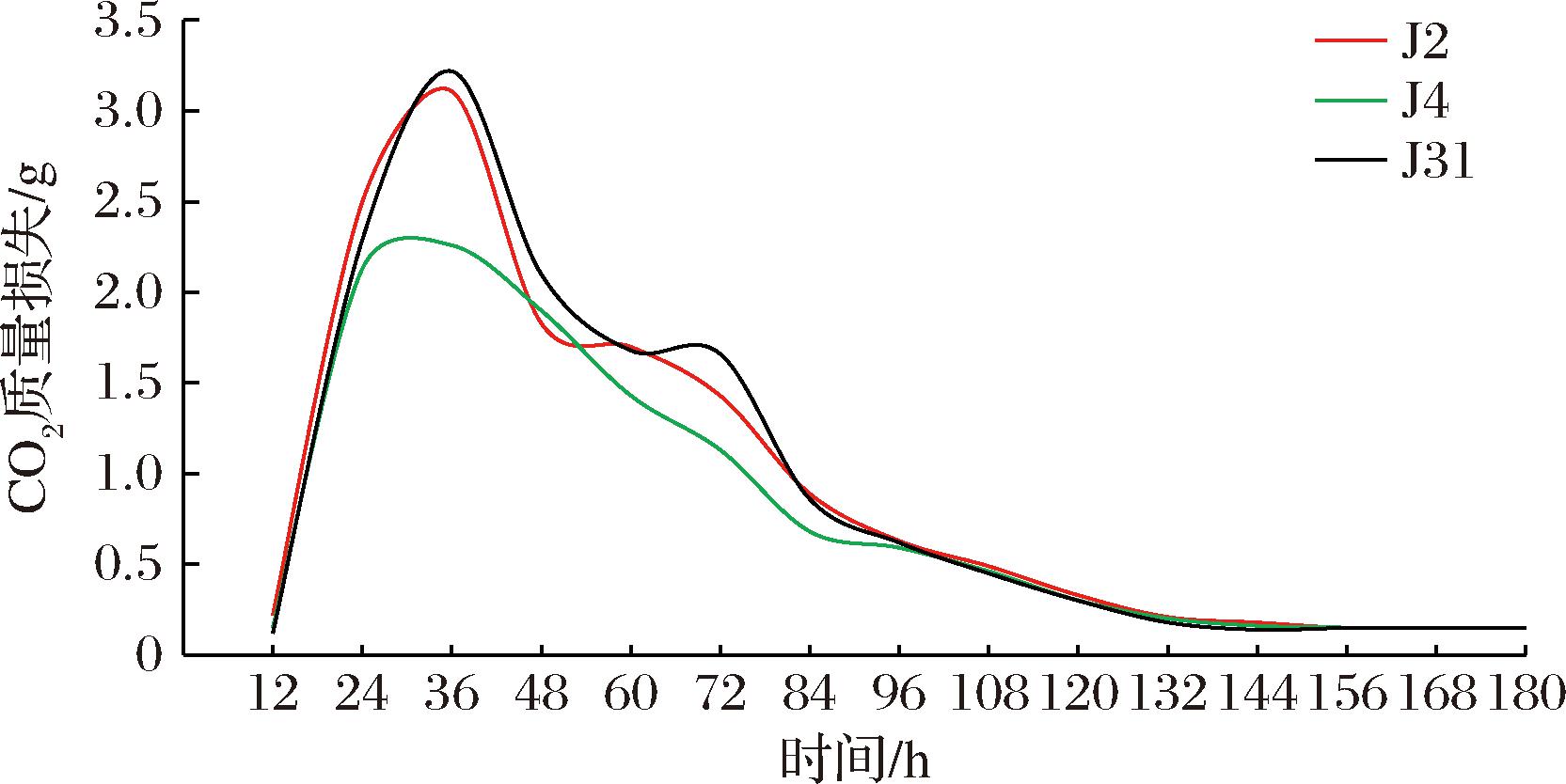
图1 产酒精能力强的酵母菌株的发酵性能
Fig.1 Fermentation performance of high alcohol-producing yeast strains
如图2所示,J5、J6、J15、J34、J35、J39发酵时间为12~24 h时,随着时间的延长,6株菌发酵液的CO2质量损失量在增加,在第24 h时达到峰值,分别为1.23、1.22、1.23、0.89、1.20、1.21 g,表明此阶段菌株处于对数增长期。在第24~48 h,CO2质量损失量逐渐减少,总体而言,较上述3株菌提前了12 h。在第180 h时,6株菌CO2的质量损失的极差均小于0.1 g,说明180 h后6株菌株均完成了发酵。该6株菌的发酵时间,且CO2质量损失量普遍较低,这可能因为它们属于不同酵母菌种[23]。综上,经比较之后,J4、J34发酵力相对较弱,因此选择剩余7株菌J2、J5、J6、J15、J31、J35、J39进行后续的分子生物学鉴定和耐受性研究。
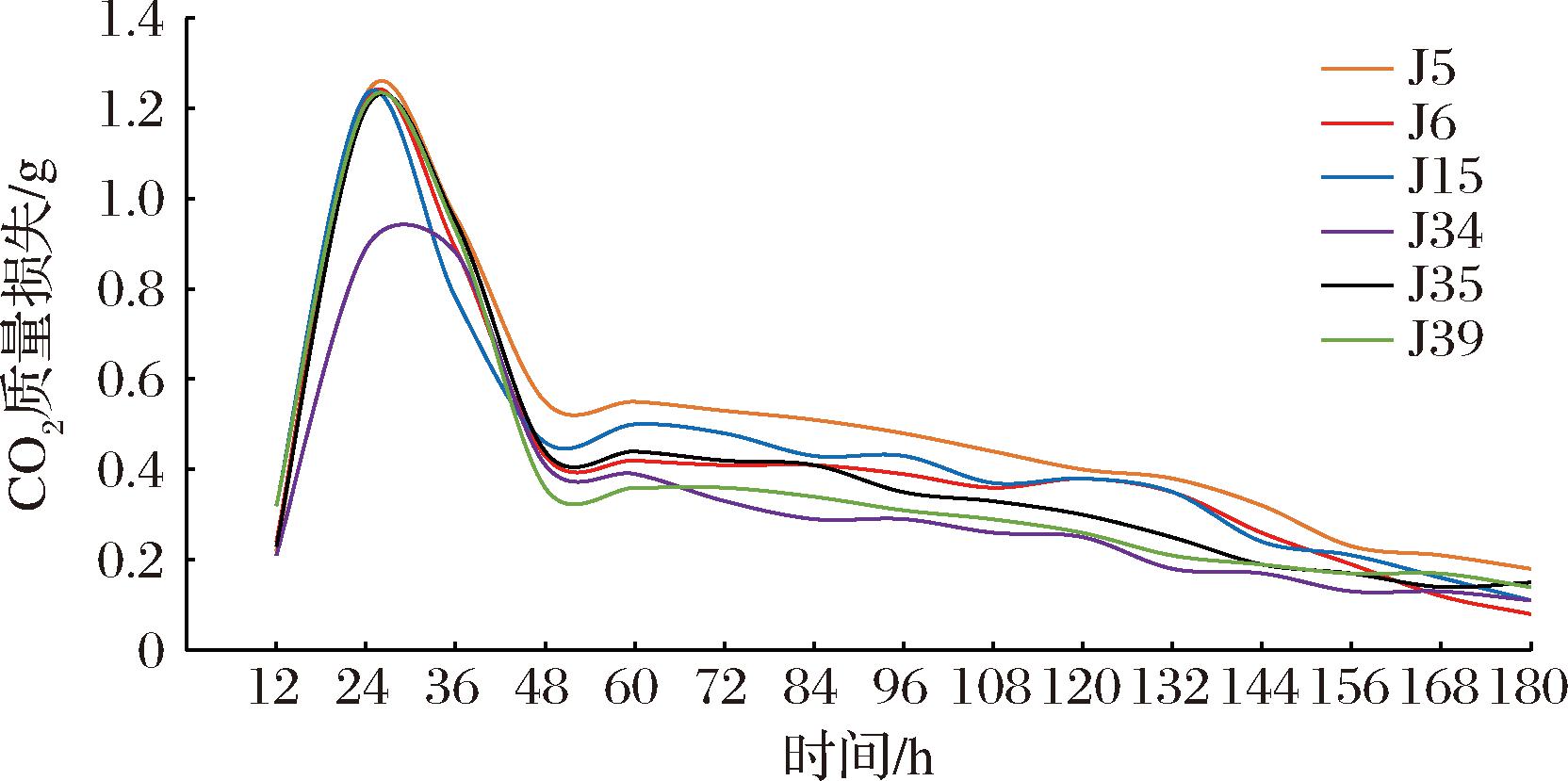
图2 产酯能力强的酵母菌株的发酵性能
Fig.2 Fermentation performance of high ester-producing yeast strains
2.3 酵母菌分子生物学鉴定
从2.2.4节筛选出的7株酵母菌株中提取DNA并进行PCR扩增。图3显示,7株菌的DNA片段长度均在500~750 bp,符合已有研究中酵母菌基因序列长度的范围[24]。用MEGA软件分析基因序列,构建了系统发育树(图4)。由图4可知,J5、J6、J15、J35、J39为库兹曼酵母,J2、J31为梅奇酵母。
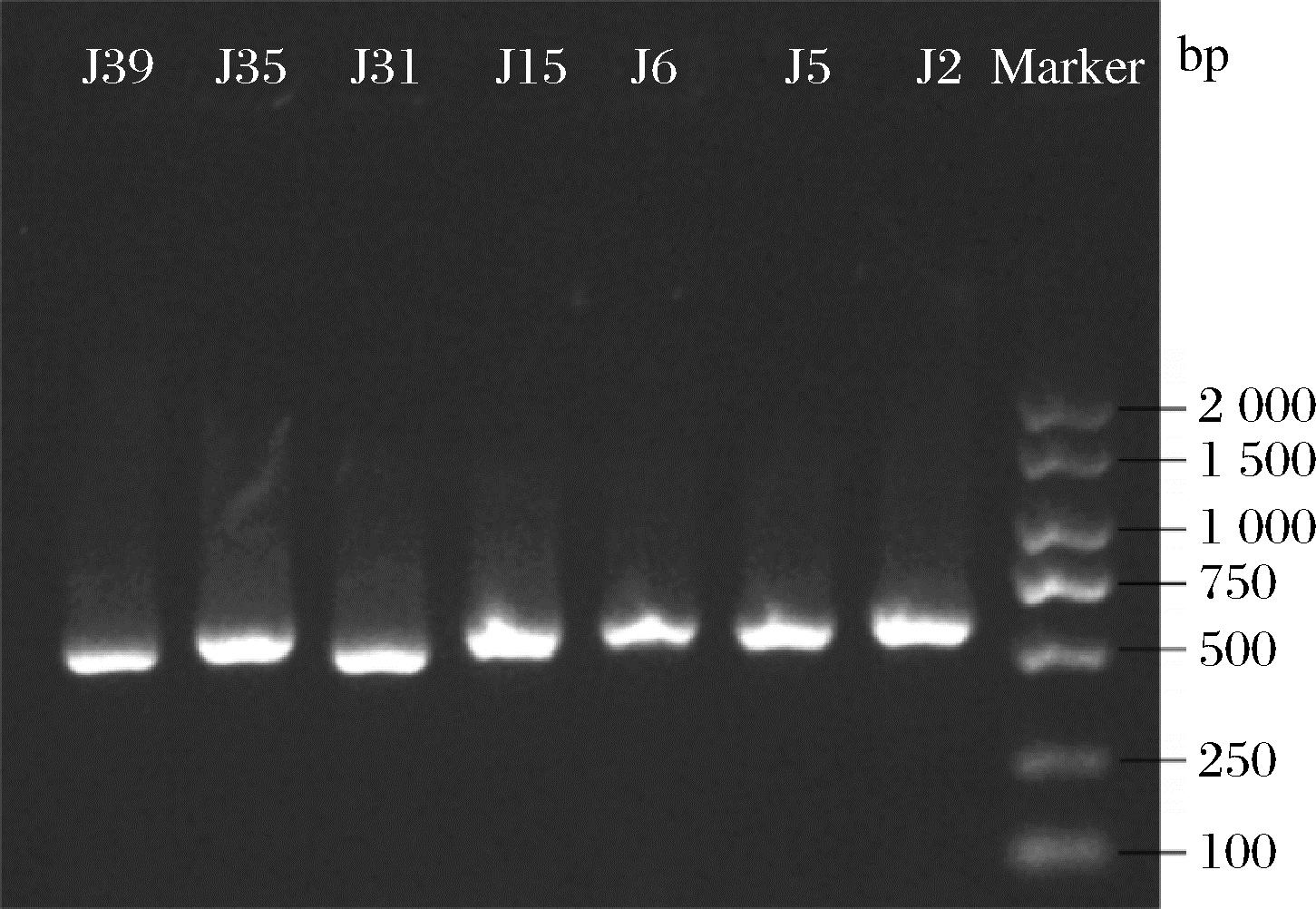
图3 酵母菌PCR扩增电泳图
Fig.3 Electrophoresis of PCR amplification of yeast strains
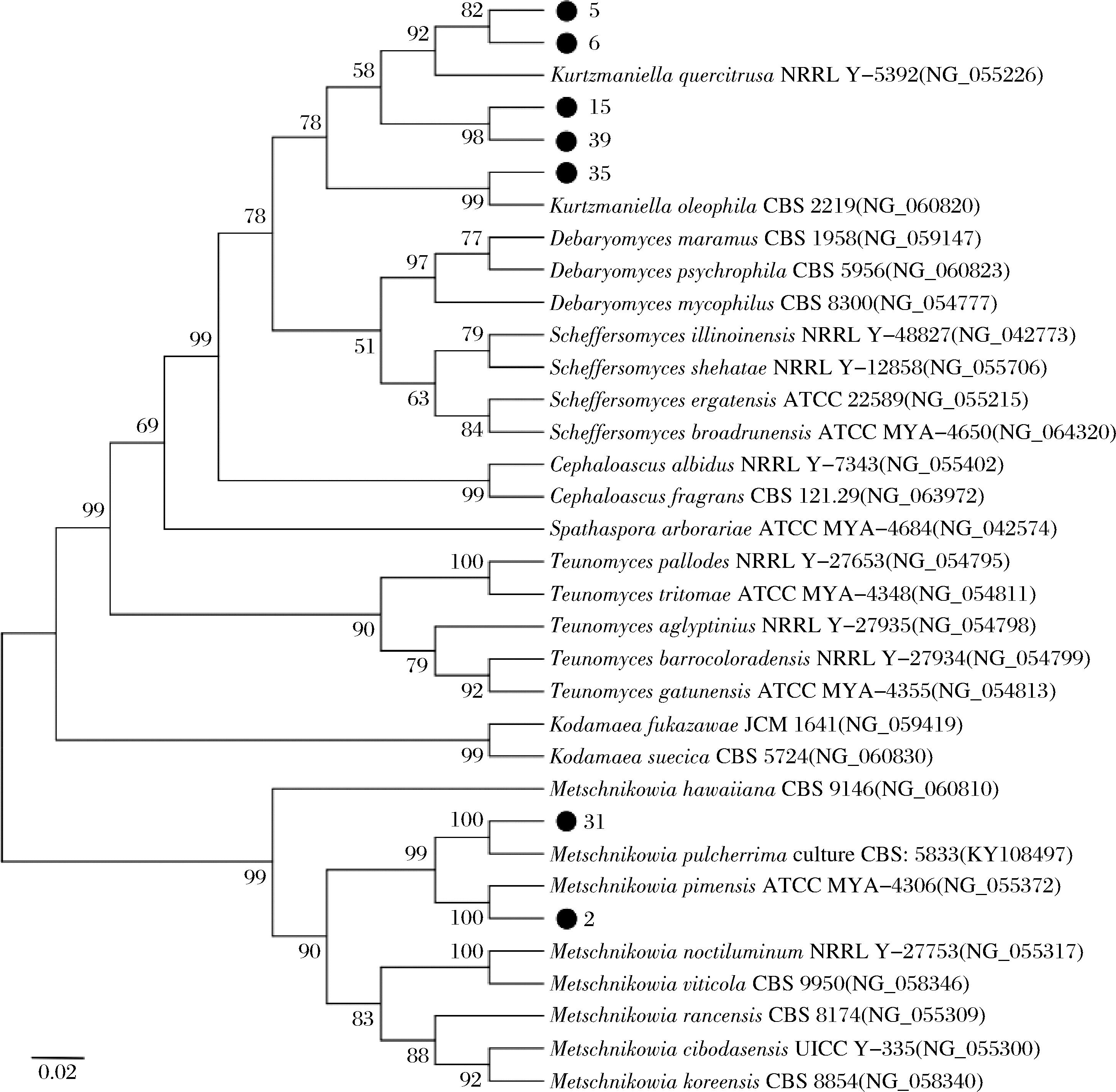
图4 七株酵母菌菌株的系统发育树
Fig.4 Phylogenetic tree of the seven yeast strains
2.4 酵母菌耐受性研究
2.4.1 酵母菌的耐酒精性能研究
高浓度酒精抑制菌的生长活力,影响酵母菌发酵效果。耐酒精能力强的菌株可使果酒发酵更完全,发酵液的酒精度更高[25-26]。分别对经分子生物学鉴定过的7株酵母菌进行耐酒精性能研究,结果如表4。在乙醇体积分数为4%的条件下,J31、J35、J39菌株发酵液在600 nm处的OD值均大于1.5,其中J39的OD值为1.97(菌落浓度4.50×107~7.50×107 CFU/mL),显著高于其他6株酵母菌(P<0.05);在体积分数4%乙醇的条件下,J6的耐酒精性能最弱,OD值仅为0.84(2.52×107~4.20×107 CFU/mL)。随着乙醇体积分数的增加,7株菌株的酒精耐受能力逐渐降低。然而,J39的OD值均显著高于其他菌株,说明对酒精耐受性最强。J31、J35能够耐受4%乙醇,J39能够耐受6%乙醇,而J2的耐受能力较弱,但发酵液的酒精度超过8.5%vol,显示出较强的酒精的适应性驯化能力。
表4 七株酵母菌的酒精耐受性
Table 4 Alcohol tolerance of the seven yeast strains
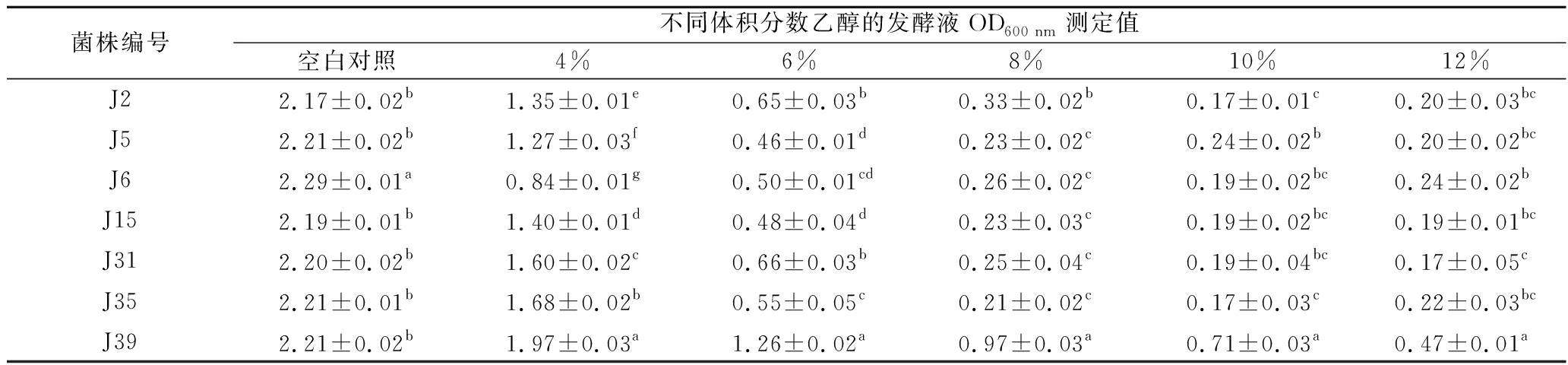
菌株编号不同体积分数乙醇的发酵液OD600 nm测定值空白对照4%6%8%10%12%J22.17±0.02b1.35±0.01e0.65±0.03b0.33±0.02b0.17±0.01c0.20±0.03bcJ52.21±0.02b1.27±0.03f0.46±0.01d0.23±0.02c0.24±0.02b0.20±0.02bcJ62.29±0.01a0.84±0.01g0.50±0.01cd0.26±0.02c0.19±0.02bc0.24±0.02bJ152.19±0.01b1.40±0.01d0.48±0.04d0.23±0.03c0.19±0.02bc0.19±0.01bcJ312.20±0.02b1.60±0.02c0.66±0.03b0.25±0.04c0.19±0.04bc0.17±0.05cJ352.21±0.01b1.68±0.02b0.55±0.05c0.21±0.02c0.17±0.03c0.22±0.03bcJ392.21±0.02b1.97±0.03a1.26±0.02a0.97±0.03a0.71±0.03a0.47±0.01a
2.4.2 酵母菌的耐糖性能研究
葡萄糖为酵母菌发酵的提供能源,但高浓度葡萄糖会抑制微生物生长[27]。分别对经分子生物学鉴定过的7株酵母菌进行耐耐糖性能研究,结果见表5。
表5 七株酵母菌的高糖耐受性
Table 5 High glucose tolerance of the seven yeast strains
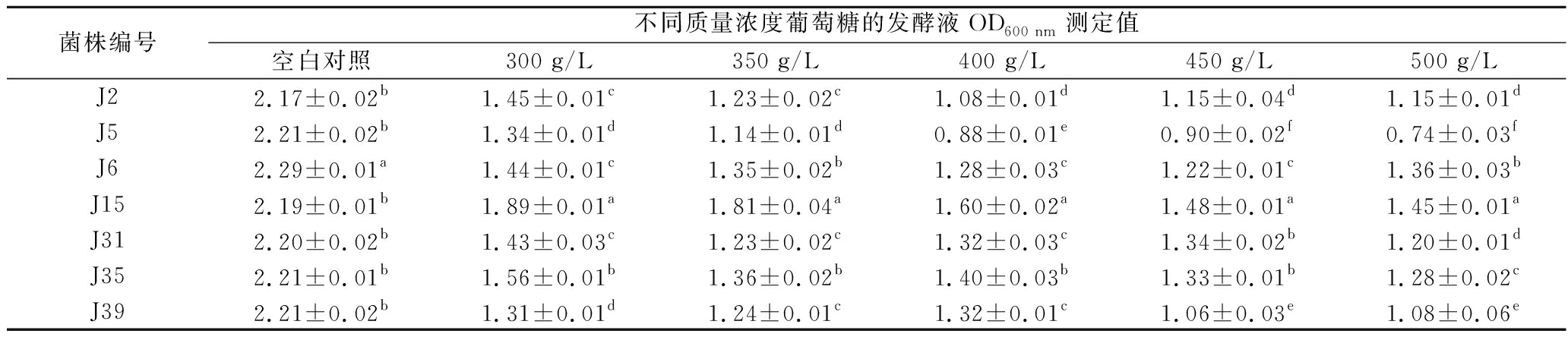
菌株编号不同质量浓度葡萄糖的发酵液OD600 nm测定值空白对照300 g/L350 g/L400 g/L450 g/L500 g/LJ22.17±0.02b1.45±0.01c1.23±0.02c1.08±0.01d1.15±0.04d1.15±0.01dJ52.21±0.02b1.34±0.01d1.14±0.01d0.88±0.01e0.90±0.02f0.74±0.03fJ62.29±0.01a1.44±0.01c1.35±0.02b1.28±0.03c1.22±0.01c1.36±0.03bJ152.19±0.01b1.89±0.01a1.81±0.04a1.60±0.02a1.48±0.01a1.45±0.01aJ312.20±0.02b1.43±0.03c1.23±0.02c1.32±0.03c1.34±0.02b1.20±0.01dJ352.21±0.01b1.56±0.01b1.36±0.02b1.40±0.03b1.33±0.01b1.28±0.02cJ392.21±0.02b1.31±0.01d1.24±0.01c1.32±0.01c1.06±0.03e1.08±0.06e
在葡萄糖质量浓度为300 g/L的条件下,J15、J35发酵液在600 nm处的OD值均大于1.50,显著高于其他5株菌株(P<0.05),其中J15的OD值为1.89(菌落浓度5.67×107~9.45×107 CFU/mL);在葡萄糖质量浓度为350~400 g/L的条件下,只有J15的OD值大于1.50,说明J35能耐受300 g/L的葡萄糖;当葡萄糖质量浓度大于400 g/L时,J15的OD值小于1.50,说明J15能耐受葡萄糖的质量浓度为400 g/L。随着葡糖糖浓度的升高,除J15的发酵液OD值逐渐下降外,其余6株菌株虽呈现下降的趋势,但下降过程中具有波动性,这种现象可能是由于外部环境的渗透压对酵母细胞代谢酶活性抑制程度不同[28]。因此,可以得出J15能耐受400 g/L的葡萄糖,J35能耐受300 g/L的葡萄糖。
2.4.3 酵母菌的耐pH性能研究
酿酒酵母最适生长pH值为3.8~6.0,但极少数用于果酒发酵的酵母菌可以耐受pH=3.2的环境条件[29-30]。分别对经分子生物学鉴定过的7株酵母菌进行耐低pH性能研究,结果见表6。在pH值为2.9~3.5环境下,7株菌发酵液的OD值均大于1.5,在pH值为2.9的条件下,J2、J6和J35的耐受性最强,OD值显著高于其他4株(P<0.05),其OD值分别为2.1(菌落浓度范围在6.30×107~1.05×108 CFU/mL)、2.09(浓度范围6.27×107~1.04×108 CFU/mL)、2.2(浓度范围6.60×107~1.10×108 CFU/mL),J31的耐受性最弱,OD值为1.57(浓度范围4.71×107~7.85×107 CFU/mL);当pH<2.9时,7株酵母的生长均受到抑制。当pH值从2.9降低到2.7时,7株菌株发酵液的OD值急剧下降,说明菌株耐pH的最低值在2.9~2.7。总体而言,7株酵母菌均能耐受pH 2.9。
表6 七株酵母菌的低pH耐受性
Table 6 Low pH tolerance of the seven yeast strains
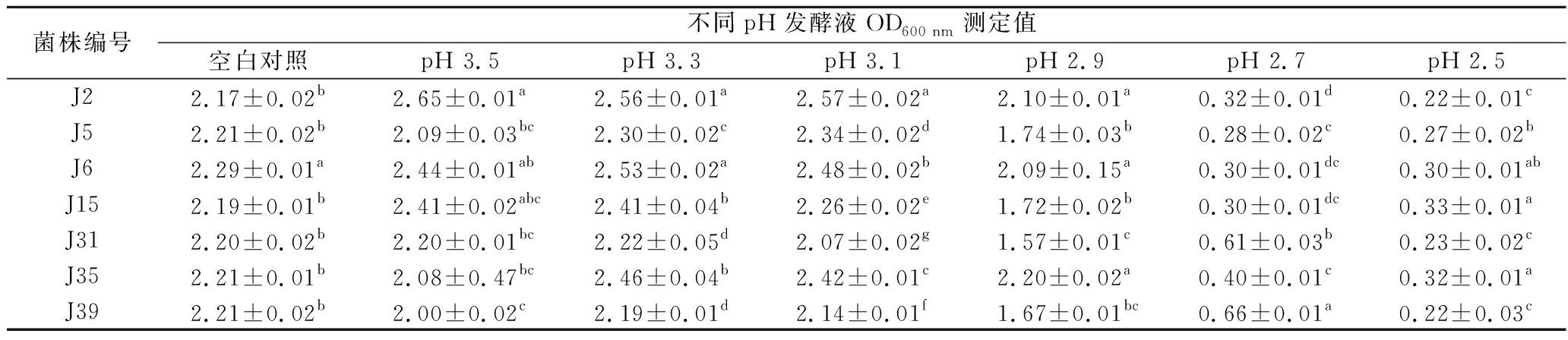
菌株编号不同pH发酵液OD600 nm测定值空白对照pH 3.5pH 3.3pH 3.1pH 2.9pH 2.7pH 2.5J22.17±0.02b2.65±0.01a2.56±0.01a2.57±0.02a2.10±0.01a0.32±0.01d0.22±0.01cJ52.21±0.02b2.09±0.03bc2.30±0.02c2.34±0.02d1.74±0.03b0.28±0.02c0.27±0.02bJ62.29±0.01a2.44±0.01ab2.53±0.02a2.48±0.02b2.09±0.15a0.30±0.01dc0.30±0.01abJ152.19±0.01b2.41±0.02abc2.41±0.04b2.26±0.02e1.72±0.02b0.30±0.01dc0.33±0.01aJ312.20±0.02b2.20±0.01bc2.22±0.05d2.07±0.02g1.57±0.01c0.61±0.03b0.23±0.02cJ352.21±0.01b2.08±0.47bc2.46±0.04b2.42±0.01c2.20±0.02a0.40±0.01c0.32±0.01aJ392.21±0.02b2.00±0.02c2.19±0.01d2.14±0.01f1.67±0.01bc0.66±0.01a0.22±0.03c
2.4.4 小结
综合考虑酵母菌对酒精、糖、pH的耐受性结果,J15、J35、J39更适宜用作后续的发酵。J15能够耐受400 g/L葡萄糖和pH 2.9,当葡萄糖400 g/L时,菌落浓度在4.80×107~8.00×107 CFU/mL;J35能够耐受300 g/L葡萄糖,pH 2.9以及体积分数4%的乙醇,当pH 2.9时,菌落浓度在6.60×107~11.00×107 CFU/mL;J39能够耐受体积分数为6%的乙醇和pH值为2.9的环境条件,当乙醇体积分数为6%时,菌落浓度在3.78×107~6.30×107 CFU/mL。综合来看,J35的综合耐受性更强,但J15、J39在耐酒精和耐葡萄糖上均有自己的特点,可以将它们进行驯化后用于发酵。
3 结论与讨论
本研究从达州青脆李中分离出野生酵母菌,通过形态学筛选出40株酵母菌(编号为J1~J40),其中9株在产气、产酒和产酯测试中表现更佳。进一步筛选得到7株起酵速度快、发酵能力强的具备优良性能的酵母菌,分别为J2、J5、J6、J15、J31、J35、J39。通过扩增测序,鉴定出J5、J6、J15、J35、J39为库兹曼酵母,J2、J31为梅奇酵母。对7株酵母菌在对酒精、高葡萄糖、低pH的耐受性方面进行了探究。J35能耐受体积分数为4%的乙醇,质量浓度为300 g/L的葡萄糖和pH 2.9,J2发酵液的酒精度最高为11.85%vol,J35的产香能力最强,总酯含量为2.82 g/L。综合考虑后,J15、J35、J39更适宜用作后续的果酒发酵,在此基础上将继续探究筛选出的菌株单一或混合菌株发酵对青脆李果酒品质的影响,此外,将筛选出的菌株进行诱导、驯化,或与商业菌株混合发酵,以其获得风味良好,品质优良的李子果酒。
[1] 张放. 2022年我国水果生产变化简析[J].中国果业信息, 2024, 41(2):35-43.ZHANG F.Analysis on the changes of fruit production in China in 2022[J].China Fruit News, 2024, 41(2):35-43.
[2] 安佰义, 曲霜, 刘晓嘉, 等.不同李品种果实品质分析与综合评价[J].北方园艺, 2019(2):25-29.AN B Y, QU S, LIU X J, et al.Quality analysis and comprehensive evaluation of different varieties in plum fruits[J].Northern Horticulture, 2019(2):25-29.
[3] 夏乐晗, 回经涛, 陈玉玲, 等.不同品种(系)李果实外观和内在品质的比较[J].经济林研究, 2019, 37(1):125-132.XIA L H, HUI J T, CHEN Y L, et al.Comparison of appearance and internal qualities of different varieties (accessions) of Prunus salicina fruits[J].Non-wood Forest Research, 2019, 37(1):125-132.
[4] 张绍阳, 吴姝, 肖海燕, 等.贵州沿河沙子空心李果实营养分析与评价[J].食品工业, 2020, 41(3):340-343.ZHANG S Y, WU S, XIAO H Y, et al.Nutritional characteristics of shazikongxinli fruits produced in Yanhe County[J].The Food Industry, 2020, 41(3):340-343.
[5] 李刚凤, 李洪艳, 张绍阳, 等.沙子空心李果实营养品质的主成分分析和综合评价[J].食品与发酵工业, 2020, 46(12):264-270.LI G F, LI H Y, ZHANG S Y, et al.Principal component analysis and comprehensive evaluation of the nutritional quality of Prunus salicina Lindl.cv ‘Shazi Kongxinli’ fruit[J].Food and Fermentation Industries, 2020, 46(12):264-270.
[6] NIYOMVONG N, TRAKUNJAE C, BOONDAENG A.Fermentation characteristics and aromatic profiles of plum wines produced with Hanseniaspora thailandica Zal1 and common wine yeasts[J].Molecules, 2023, 28(7):3009.
[7] WU D H, WU Y, GU Z X, et al.Multi-step screening of suitable Saccharomyces cerevisiae strain for lemon wine brewing[J].Food Bioscience, 2023, 56:103092.
[8] 陈雪雪.猕猴桃果酒发酵菌株筛选及酒体品质研究[D].无锡:江南大学, 2023.CHEN X X.Screening of fermentation strains of kiwi fruit wine and study on quality of the wine body[D].Wuxi: Jiangnan University, 2023.
[9] 罗文珊, 陈晓维, 黄雯倩, 等.组胺降解酵母的筛选及其对桑葚果酒品质的影响[J].食品与发酵工业, 2024, 50(12):32-40.LUO W S, CHEN X W, HUANG W Q, et al.Screening of histamine-degrading yeast and its effect on quality of mulberry fruit wine[J].Food and Fermentation Industries, 2024, 50(12):32-40.
[10] 程思琦.克鲁维毕赤酵母与酿酒酵母混菌发酵对咖啡果皮酒品质的影响[D].昆明:昆明理工大学, 2024.CHENG S Q. Effects of Pichia Crowe and Saccharomyces cerevisiae mixed fermentation on the quality of coffee wine[D].Kunming: Kunming University of Science and Technology, 2024.
[11] GUO C C, DENG H X, LI E H.Removal of acetic acid in mulberry wine by co-inoculating Saccharomyces cerevisiae with indigenous non-Saccharomyces yeast[J].Food Bioscience, 2024, 58:103658.
[12] TIAN T T, WU D H, NG C T, et al.A multiple-step strategy for screening Saccharomyces cerevisiae strains with improved acid tolerance and aroma profiles[J].Applied Microbiology and Biotechnology, 2020, 104(7):3097-3107.
[13] 汤晓宏.蓬莱葡萄酒产区酿酒酵母的选育[D]. 济南:齐鲁工业大学, 2014.TANG X H. The breeding of Saccharomycesc erevisiae in Penglai Wine region—The screening of Saccharomyces cerevisiae of Chateau Junding[D].Jinan:Qilu University of Technology, 2014.
[14] 王志恒, 刘雅琴, 冯翠娥, 等.宁夏贺兰山东麓酿酒酵母分离筛选及菌株鉴定[J].食品研究与开发, 2017, 38(11):176-180.WANG Z H, LIU Y Q, FENG C E, et al.Isolation and identification of Saccharomyces cerevisiae strain of east Helan Mountain area in Ningxia[J].Food Research and Development, 2017, 38(11):176-180.
[15] 李亚辉, 梁颖, 王英, 等.枸杞内生酵母菌的筛选及其发酵特性研究[J].中国酿造, 2019, 38(4):121-125.LI Y H, LIANG Y, WANG Y, et al.Screening and fermentation performances of endogenous yeast from wolfberry[J].China Brewing, 2019, 38(4):121-125.
[16] 杜沁岭, 屠婷瑶, 徐文, 等.青梅野生酵母菌的筛选鉴定与耐受性研究[J].食品与发酵工业, 2023, 49(4):196-201.DU Q L, TU T Y, XU W, et al.Screening, identification, and tolerance of wild yeast strains isolated from greengage[J].Food and Fermentation Industries, 2023, 49(4):196-201.
[17] 卢思言.野生浆果中降酸酵母菌株筛选、鉴定及有机酸降解特性研究[D].长春:吉林农业大学, 2022.LU S Y.Screening and identification of acid reducing yeast strains from wild berries and their characteristics of organic acid degradation[D].Changchun:Jilin Agricultural University, 2022.
[18] 于娟.红曲霉和酵母菌混合发酵普洱茶的风味品质研究[D].昆明:云南农业大学, 2023.YU J.Study on flavor quality of Pu-erh tea fermented by Monascus and yeast[D].Kunming: Yunnan Agricultural University, 2023.
[19] 熊荣园, 王黎明, 魏玲, 等.柑橘及桑葚中优质酵母菌的筛选及鉴定[J].中国酿造, 2023, 42(4):163-167.XIONG R Y, WANG L M, WEI L, et al.Screening and identification of high-quality yeasts from citrus and mulberry[J].China Brewing, 2023, 42(4):163-167.
[20] 匡钰, 梁建平, 廖留萍, 等.咖啡果酒发酵菌种筛选及香气成分分析[J].热带农业科技, 2020, 43(2):12-17;23.KUANG Y, LIANG J P, LIAO L P, et al.Screening of fermentation yeast for coffee wine and analysis of aroma components[J].Tropical Agricultural Science &Technology, 2020, 43(2):12-17;23.
[21] 李甜, 邓孟胜, 雷雨, 等.克鲁维毕赤酵母与酿酒酵母顺序接种对茵红李果酒风味的影响[J].现代食品科技, 2024, 40(8):283-293.LI T, DENG M S, LEI Y, et al.Effect of sequential fermentation of Pichia kluyveri and Saccharomyces cerevisiae on flavor quality of Yinhong plum wine[J].Modern Food Science and Technology, 2024, 40(8):283-293.
[22] 张丽, 卢红梅, 陈莉, 等.酱香型大曲贮存过程中发酵性能变化的研究[J].现代食品科技, 2017, 33(9):231-237.ZHANG L, LU H M, CHEN L, et al.Study on changes in the biochemical properties of Maotai-flavor Daqu during storage[J].Modern Food Science and Technology, 2017, 33(9):231-237.
[23] LAI Y T, HSIEH C W, LO Y C, et al.Isolation and identification of aroma-producing non-Saccharomyces yeast strains and the enological characteristic comparison in wine making[J].LWT, 2022, 154:112653.
[24] 赵雪平, 温雅娇, 李正英, 等.内蒙古乌海地区果园及发酵醪液中酿酒酵母菌的筛选[J].食品与发酵工业, 2020, 46(11):178-183.ZHAO X P, WEN Y J, LI Z Y, et al.Screening of Saccharomyces cerevisiae from orchards and fermentation mash in Wuhai Inner Mongolia[J].Food and Fermentation Industries, 2020, 46(11):178-183.
[25] 李玉花.山西葡萄产区酿酒酵母的优选与鉴定及其共发酵特性分析[D].呼和浩特:内蒙古农业大学, 2021.LI Y H. Selection and identification of Saccharomyces cerevisiae in Shanxig rape production area and analysis of its co-fermentation characteristics[D].Hohhot:Inner Mongolia Agricultural University, 2021.
[26] YANG Y J, XIA Y J, LIN X N, et al.Improvement of flavor profiles in Chinese rice wine by creating fermenting yeast with superior ethanol tolerance and fermentation activity[J].Food Research International, 2018, 108:83-92.
[27] 冯莉, 陈雪, 李丽, 等.5株克鲁维毕赤酵母的酿造学特性[J].中国食品学报, 2018, 18(12):66-73.FENG L, CHEN X, LI L, et al.The enology characteristics of five strains of Pichia kluyveri[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(12):66-73.
[28] WANG B S, TAN F L, CHU R C, et al.The effect of non-Saccharomyces yeasts on biogenic amines in wine[J].Trends in Food Science &Technology, 2021, 116:1029-1040.
[29] DZIALO M C, PARK R, STEENSELS J, et al.Physiology, ecology and industrial applications of aroma formation in yeast[J].FEMS Microbiology Reviews, 2017, 41(1):S95-S128.
[30] ZHANG M M, ZHANG K Y, MEHMOOD M A, et al.Deletion of acetate transporter gene ADY2 improved tolerance of Saccharomyces cerevisiae against multiple stresses and enhanced ethanol production in the presence of acetic acid[J].Bioresource Technology, 2017, 245:1461-1468.