枇杷(Eriobotrya japonica Lindl.),蔷薇科苹果亚科枇杷属,常绿乔木植物,其叶形似琵琶,果实呈球形或长圆形。优质枇杷果实总可溶性固形物含量在12%(质量分数)以上,酸度在0.3%~0.6%,果肉硬度较低。枇杷果实和叶子含有高浓度的维生素A、抗坏血酸、钙、铁、锰、钾,以及山柰酚、熊果酸、齐墩果酸、酒石酸和槲皮素等药理活性成分。枇杷因食用药用的特点而深受消费者欢迎[1],具有抗炎、抗肿瘤、抗氧化、抗突变、抗糖尿病等药理作用[2]。枇杷果实贮藏期短,收获后易发生各种生理紊乱和腐烂,需要适当的贮存技术和收获后处理。目前,我国用于生产加工的枇杷数量仅占枇杷总产量的14%左右[3],为了增加枇杷的市场价值,它被加工成不同的产品,如果脯、果酱、果冻、果醋、果汁、酒、水果罐头、干片、枇杷膏等。枇杷叶子可以用于豆腐、饼干、面条等食品的开发。枇杷籽可用于制备淀粉和提取油脂。
果酒是以鲜果为主要原料,经过破碎、榨汁、发酵等工艺酿造出来的果香浓郁、低度、健康、高营养的酒精饮料。相较于白酒,果酒所含的营养物质更加丰富,杂醇油、醛类等有害物质更少,更加健康;相较于啤酒,果酒种类多样,可以为消费者提供更多的选择性。同时因枇杷具有某些特殊的生物功能性而受到了消费者的青睐[4]。因此,开发枇杷果酒是一个极具研究潜力的深加工方向。而优良菌种的获得对果酒的发酵及产品品质具有至关重要的影响[5]。我国目前只有浙江和四川两个主要的枇杷产区,使用的都是自然发酵,乙醇含量和发酵程度都不高,同时生产周期长达几个月,产量也不高。需要运用现代化的仪器设备和现代生物技术来提高产品的品质和营养价值[6],赋予产品更多的健康属性,使果酒行业得到更好发展。
市售的发酵枇杷果酒较少,仅浙江、四川枇杷产地有少量采用传统自然发酵方法发酵的枇杷果酒,酒精度及发酵度较低,工艺耗时长,产量较低[7]。用于酿造的枇杷品种多样,质量参差不齐,影响果酒品质。不同酿造者采用的酿造技术和方法存在差异,果酒的标准参差不齐[8]。
本文旨在获得一款精深加工的产品枇杷酒,既能体现出枇杷的独特风味,又可在很大程度上保持或提升枇杷的营养和保健功效。研究以枇杷、果园土壤及实验室保藏共计330株菌株为研究对象,分离筛选得到1株具有优良潜力的酿酒酵母菌株,并对其进行了菌种鉴定,同时优化了枇杷果酒发酵工艺,最终获得一款具有典型枇杷清香特性的果酒产品。
1 材料与方法
1.1 材料与试剂
新鲜白玉枇杷,福建绿泉食品有限公司;酿酒酵母D254,安琪酵母股份有限公司。酵母基因组DNA提取试剂盒,天根生化科技有限公司;市售白砂糖、柠檬酸;其余试剂均为色谱纯或分析纯,国药集团化学试剂有限公司。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基(g/L):葡萄糖20.0,蛋白胨20.0,酵母浸膏10.0,固体则再加琼脂20.0。
枇杷汁液体培养基(g/L):枇杷汁使用蔗糖调整至含糖量220,灭菌冷却后加氨苄青霉素1.0。
氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)上层培养基(g/L):葡萄糖0.5,琼脂15.0,灭菌冷却后加入TTC 0.5。
TTC下层培养基(g/L):葡萄糖50.5,蛋白胨10.0,酵母浸膏7.5,酸性K3PO4 5.0,MgSO4 2.0,柠檬酸1.35,氨苄青霉素1.0,调整pH值4.0以上,琼脂30.0[9]。
CaCO3琼脂培养基(g/L):酵母浸膏3.0,葡萄糖10.0,CaCO3 3.0,琼脂15.0。
Biggy琼脂培养基(g/L):酵母浸膏1.0,甘氨酸10.0,葡萄糖10.0,Na2SO3 3.0,柠檬酸铋铵5.0,琼脂16.0,pH (6.8±0.2)。
ESA培养基(g/L):葡萄糖20.0,蛋白胨5.0,酵母浸膏5.0,琼脂15.0,焦亚硫酸钠0.15,乙醇(根据需要配制5%和12%,体积分数)。
1.2 仪器与设备
PL2002电子天平,瑞士梅特勒-托利多仪器有限公司;BSP-250生化培养箱,上海博讯实业有限公司医疗设备厂;5804R高速冷冻离心机,德国Eppendorf公司;SW-CJ-2D超净工作台,苏州空气设备净化厂;FE20精密数显pH计,北京Hanna公司;Trace1310-ISQ L气相色谱-质谱联用,美国赛默飞世尔科技有限公司;Chromaster CM5110高效液相色谱仪,日本日立公司;Alcolyzer阿贝折光仪,泰光有限公司;啤酒分析仪,安东帕(上海)商贸有限公司。Waters Sugar-pak1TM 6.5 mm(ID)×300 mm Column色谱柱、Waters X select HSS T3(4.6 mm×250 mm)色谱柱,沃特世科技(上海)有限公司。
1.3 实验方法
1.3.1 菌种分离
取少量新鲜白玉枇杷榨汁,调整糖度至22 °Brix,将果汁装入无菌锥形瓶中,28 ℃恒温静置2~3 d自然发酵。将果皮和果园土壤捣碎后分别放入加玻璃珠的无菌水中打浆,适度稀释后按5%接种比例接入适量YPD中,28 ℃、180 r/min培养24 h。
上述筛选源中各取2 mL悬浊液用0.9%生理盐水稀释10-6~10-1共计6个浓度梯度,将稀释菌液均匀涂布在含有25 mg/L氨苄青霉素和100 mg/L链霉素的YPD平板上,28 ℃静置培养2 d,每组设置3个平行,观察菌落生长情况。从培养皿中挑出具有典型的酵母菌特征的单菌落,在YPD平板中划线分离。将分离到的单菌落活化后接入甘油管并编号,在-80 ℃下保藏备用[10]。
1.3.2 酵母菌的性能测定
1.3.2.1 产酒精能力
将甘油管保藏菌株接种于YPD液体试管中活化18 h后,将菌液稀释10-6~10-1共计6个梯度,涂布在TTC下层平板上,28 ℃倒板静置2 d,之后将TTC上层培养基倒入长有菌落的下层培养基,28 ℃避光培养2 h后观察。典型的酿酒酵母菌落表面有光泽、柔软、易挑取,其中具有产酒精能力的菌株在TTC平板上呈红色[11]。据此可筛选典型酿酒酵母形态的菌株。
1.3.2.2 起始发酵能力
将上一级筛选获得的菌株活化后以5%接种量分别接种于含杜氏小管的枇杷汁液体培养基中,使得菌株在培养基中的终浓度为1×107 CFU/mL,25 ℃培养48 h,根据培养基中气泡产生情况,保留起酵速度快(即气泡产生速度快)的菌株进行下一级筛选。
1.3.2.3 H2S和乙酸生产能力
将上一级筛选出的起酵速度快的菌株活化后,在CaCO3和Biggy琼脂平板上点样5 μL活化18 h的培养物,28 ℃静置培养2 d。菌株颜色若为深黑色则菌株高产H2S,浅褐色或白色的菌株低产或不产H2S。菌株透明圈越大则产乙酸能力越强,反之则产乙酸能力越弱。根据菌落颜色和透明圈大小选择低产H2S和乙酸的菌株进行下一级筛选。
1.3.2.4 乙醇和SO2耐受能力
将二级筛选得到的菌株在YPD培养基中活化后稀释点板于乙醇体积分数12%的ESA培养基中,在28 ℃下静置培养2 d。平板白色菌落越深则菌株的乙醇和SO2耐受性越强,平板菌落浅或没有菌落则菌株耐受性差或不耐受,据此筛选出能耐受高浓度SO2和乙醇的菌株,置于斜面保藏。
1.3.3 菌株18S rDNA鉴定和系统发育分析
将初筛得到的菌株在10 mL YPD中活化24 h后取适量培养液,8 000 r/min离心1 min后弃上清液,采用试剂盒提取菌体DNA,如表1所示,ITS1和ITS4为酵母18S通用引物,用2%琼脂糖凝胶电泳检测扩增后的PCR产物,将条带长度合适的产物送样测序。采用BLAST方式将测定的18S rDNA序列与GenBank中酵母菌的序列进行比对,与待鉴定菌株构建菌株系统发育树[12]。
表1 酵母ITS引物通用序列
Table 1 Sequence of ITS primers

引物通用序列ITS1TCCGTAGGTGAACCTGCGGITS4TCCTCCGCTTATTGATATGC
1.3.4 枇杷果酒的发酵
选取新鲜,表面无伤的枇杷果,用淡盐水清洗杀菌后榨汁。调整果汁含糖量至180 g/L,可滴定酸5.5 g/L,发酵规模500 mL,装液量60%,加入0.01%食品级偏重亚硫酸钾。为保证实验顺利并排除一系列杂菌带来的不良影响,采取105 ℃高压蒸汽灭菌10 min,之后接种5%的酿酒酵母,使得酿酒酵母在发酵体系中的终浓度为1×107 CFU/mL,25 ℃发酵8 d后结束发酵,期间每日测定失重并摇起絮凝的酵母。发酵完成之后离心分离获得枇杷酒样品,并和典型市售枇杷果酒一同测定理化和风味指标。
1.3.5 优选枇杷果酒酵母的单因素优化
分别以初始含糖量140、160、180、200、220、240 g/L,主发酵温度19、22、25、28、31 ℃,初始pH值3.0、3.3、3.6、3.9、4.2、4.5,酵母接种量3×106、6×106、9×106、12×106、15×106 CFU/mL,进行枇杷果酒发酵单因素试验,当每24 h失重<0.1 g/100 mL时结束发酵,对枇杷果酒进行感官品评和酒精度检测。每个发酵设置3个平行。
1.3.6 感官分析
该分析由具有果酒感官品评方面经验的12名同学和老师组成。在室温约22 ℃下,将不同枇杷酒样品分装到相同规格但有不同标记的品评杯中。小组成员主要从色泽、香气、风味和典型性4个方面评价[13],感官品评表如表2。
表2 枇杷果酒感官品评表
Table 2 Sensory evaluation standard of loquat wine

项目评价标准分值色泽(20分)具有枇杷酒应有的色泽,颜色协调、澄清、透亮、有光泽16~20具有枇杷酒应有的色泽,澄清透明,无明显悬浮物11~15与枇杷酒应有颜色差异较大,暗淡无光、无明显悬浮物6~10不具备果酒相应的颜色,颜色暗淡酒体较浑浊,有悬浮物0~5香气(30分)酒香、果香浓郁,整体香气协调和谐,香味怡人21~30酒香、果香气味良好,但香气略淡,香味较怡人11~20酒香、果香香味不足,但无异香,或香味不悦人6~10香气不良,使人厌恶0~5风味(40分)酒体丰满,醇厚协调、舒服、爽口、回味延绵31~40酒味柔和协调,酸甜适中21~30酒体寡淡或不协调,或有其他明显缺陷11~20酸、涩、苦、有异味0~10典型性(10分)具有枇杷的独特香味,典型完美、风格独特8~10较为典型,具有独特的风格5~7典型性不明显,与其他果酒没有明显的差异3~4完全不具有枇杷酒的典型性0~2
1.3.7 枇杷果酒理化指标分析
1.3.7.1 酒精度、残糖、可滴定酸、挥发酸和总SO2
酒精度测定方法参考GB 5009.225—2023《食品安全国家标准 酒和食用酒精中乙醇浓度的测定》,其余指标检测的具体方法参考GB/T 15038—2006《葡萄酒、果酒通用分析方法(含第1号修改单)》。
1.3.7.2 糖组分和有机酸含量分析
利用HPLC法对样品中糖组分和有机酸含量进行检测分析。通过高效液相色谱仪,配有示差折光检测器,使用Waters Sugar-pak1 6.5 mm(ID)×300 mm Column色谱柱对糖组分进行分析[14],流动相为超纯水,流速0.3 mL/min,柱温85 ℃,进样体积10 μL。使用Waters X select HSS T3(4.6 mm×250 mm)色谱柱对有机酸组分进行分析,波长210 nm,流动相25 mmol/L、pH 2.7的KH2PO4溶液,流速0.5 mL/min,柱温30 ℃,进样体积10 μL。
1.3.7.3 风味化合物检测分析
使用固相微萃取-气相色谱-质谱联用分析枇杷果酒的香气组分[15]。样品处理及分析条件参考曹倩雯等[16]的方法,实验均以2-辛醇作为内标。
定性分析:未知化合物的定性通过与NIST 05质谱库(Agilent Technologies Inc)中标准谱图比对,与标准品的香气描述和标准品的保留指数(retention index,RI)比对来确定[17],RI根据改进的Kovats法计算得到的。
半定量分析[18]:各组分相对于内标2-辛醇的含量。
定量分析[19]:在pH 3.2、10%(体积分数)乙醇溶液(模拟酒样环境)中配制挥发性物质标准液,通过待测物与内标物峰面积比值绘制的标准曲线确定。
香气活力值(odor activity value,OAV)是通过定量分析得到的待测物质浓度与对应物质检测阈值浓度的比值,通常认为OAV≥1的物质对风味有贡献[20]。相关计算如公式(1)所示:
(1)
式中:Ci,香气物质的质量浓度,mg/L;OTi,香气物质的阈值,mg/L。
1.4 数据处理与分析
本研究采用Origin 2021,TBtools等软件进行主成分分析等统计学处理。所有实验数据均使用独立平行实验的“平均值±标准差”表示。
2 结果与分析
2.1 菌株的分离与初筛
通过对330个不同筛选源的菌株进行深入分析,对于产酒精能力(A)的筛选,培养后有170株菌在TTC平板上显红色,这表明它们高产酒精,对于菌株的起酵能力(B),静置后有110株菌产生的气泡填满或接近充满杜氏小管,这表明它们的起始发酵能力强,对于乙酸的生产(D),点板后有76株菌产生的透明圈直径<3 mm,可归为产乙酸能力弱或不产乙酸。对于菌株产H2S的能力(E),54株菌在点板后有浅棕色或白色菌落,说明这些菌低产或不产H2S。将上述54株菌在ESA培养基上点板培养后,有17株菌在平板上能较好生长。优良的酿酒酵母需要能够耐受一定浓度的乙醇和SO2(C)。综合筛选排除了313株菌,剩余17株菌进入果酒发酵。菌株的分类见图1。
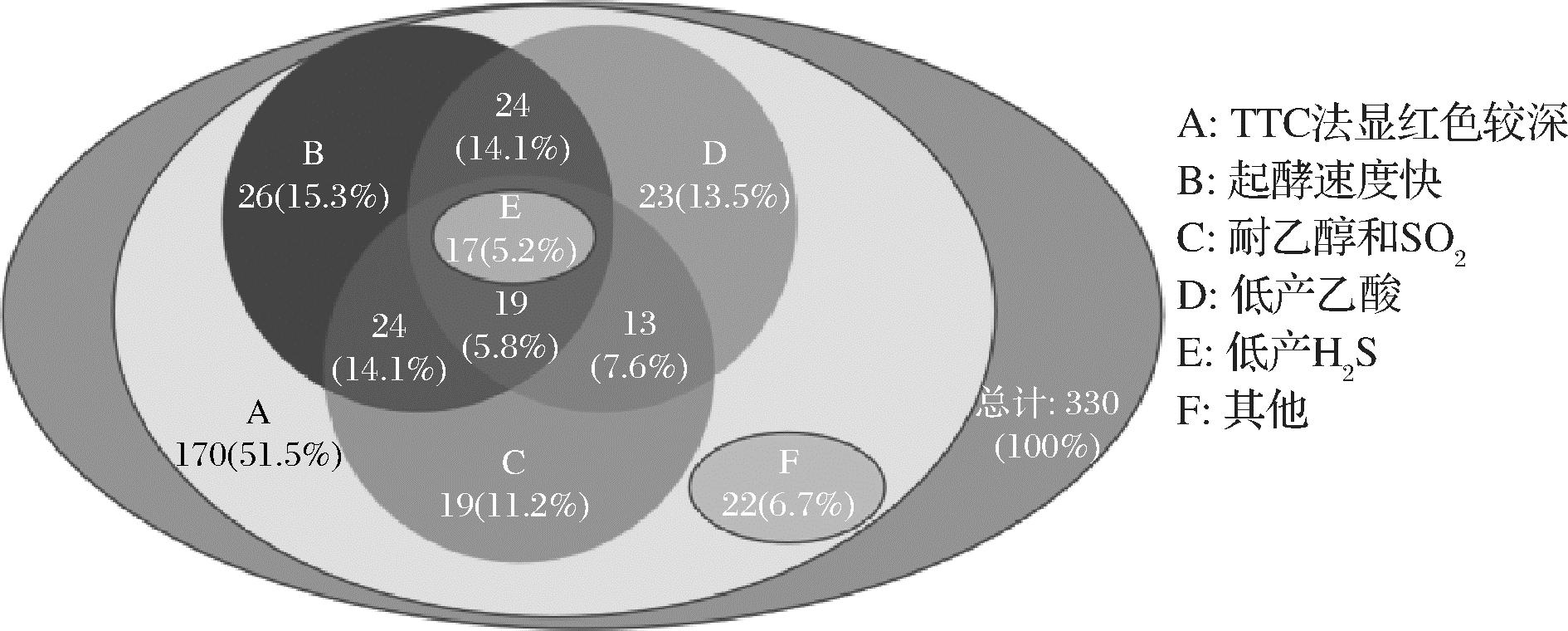
图1 菌株初筛结果图
Fig.1 Venn diagram of initial screening results of strains
2.2 枇杷果酒的发酵
初筛得到的17株菌株经过测序有12株酿酒酵母和5株非酿酒酵母(具体结果见2.4节),将上述筛选得到的12株酿酒酵母按5%接种比例接入前处理好的枇杷汁中,同时以商业酵母D254作为对照,25 ℃静置发酵8 d后,对各发酵枇杷果酒以及典型市售枇杷果酒的各类指标进行比较和分析。
2.2.1 基础理化指标
酒精度作为衡量菌株发酵能力和最终发酵度的重要指标,在相同发酵时间内酒精度低的菌株在工业生产中发酵周期长,导致单位时间产量下降,影响设备经济效益[12]。由表3可知,25 ℃静置发酵8 d后,各菌株发酵果酒的酒精度有一定差异,低约8.35%,高至13.46%。酿酒酵母SC-1、SC-14、SC-53、SC-80、SC-101和对照菌株D254的乙醇产量差异不大,酒精度均在12%vol以上,以上5株菌株的挥发性酸含量均低于0.6 g/L,残糖含量低于10 g/L,发酵相对较快。而SC-22菌株发酵果酒残糖含量高达17.10 g/L,乙醇含量也最低,发酵速度相对缓慢。所有发酵果酒挥发酸含量均低于敏感阈值(0.8 g/L)。发酵后,除对照组外,所有枇杷酒的滴定酸高于6.5 g/L,总体酸度较高。典型市售果酒的酒精度、残糖和总SO2含量高于实验室发酵果酒。保留以上5株菌进行后续的分析。
表3 枇杷果酒理化指标
Table 3 Physiochemical indexes of loquat wine

编号发酵时间/d酒精度/%vol残糖含量/(g/L)pH值挥发酸含量/(g/L)可滴定酸含量/(g/L)总SO2含量/(mg/L)SC-1813.46±0.139.05±0.653.66±0.070.54±0.047.05±0.1279.36±2.56SC-14812.87±0.158.80±0.283.45±0.090.43±0.037.38±0.0977.57±2.26SC-2288.35±0.1117.10±1.423.63±0.040.66±0.047.22±0.1873.73±2.56SC-30811.57±0.0613.56±1.213.55±0.010.63±0.026.82±0.0767.58±2.56SC-3489.28±0.0510.92±0.653.52±0.060.64±0.056.97±0.1181.92±2.56SC-36810.31±0.079.13±0.673.65±0.050.61±0.017.16±0.1455.55±2.56SC-42811.21±0.1010.72±0.823.61±0.040.66±0.077.22±0.1743.52±0.00SC-53813.18±0.195.97±0.223.60±0.090.49±0.097.55±0.2570.41±2.56SC-5889.51±0.0313.30±1.063.63±0.060.68±0.046.54±0.0442.76±0.00SC-65811.38±0.126.84±0.363.62±0.060.75±0.107.33±0.0568.61±2.56SC-80813.37±0.168.15±0.553.64±0.040.52±0.067.02±0.1065.28±2.56SC-101812.78±0.117.57±0.473.54±0.080.54±0.067.19±0.1664.00±2.56D254813.11±0.088.05±0.613.33±0.050.58±0.036.22±0.0871.42±2.56市售-20.97±0.2435.41±3.463.87±0.060.57±0.054.93±0.04103.46±5.12
2.2.2 非挥发性组分分析
通过液相色谱进一步分析测定枇杷果酒中各有机酸和糖类物质组成及含量,结果如表4所示。所有发酵果酒的葡萄糖和蔗糖转化率都>96%,果糖转化率>94%。枇杷果酒中甘油的质量浓度在3.18~5.34 g/L,山梨醇含量介于2.86~4.46 g/L。SC-1发酵枇杷酒甘油和山梨醇含量最高,SC-53和商品菌D254发酵枇杷酒甘油含量较低,甘油和山梨醇通过影响光滑度、甜度和复杂性进而影响果酒的味道[21]。
表4 枇杷果酒主要非挥发性组成含量 单位:g/L
Table 4 Main non-volatile components in loquat wine

枇杷汁SC-1SC-14SC-53SC-80SC-101D254市售多元醇蔗糖32.24±1.110.40±1.110.63±0.060.62±0.050.21±0.030.44±0.070.63±0.11—葡萄糖96.71±3.672.15±0.222.65±0.313.35±0.223.77±0.293.08±0.182.65±0.1615.28±0.21果糖164.61±5.887.31±0.448.37±0.559.07±0.429.91±0.388.69±0.266.37±0.1817.97±0.17甘油—5.34±0.213.62±0.163.18±0.124.89±0.244.65±0.113.42±0.090.89±0.04山梨醇—4.46±0.323.05±0.332.86±0.233.68±0.134.15±0.182.45±0.151.22±0.31有机酸草酸0.31±0.020.13±0.010.16±0.020.15±0.010.14±0.030.15±0.020.06±0.01—乳酸0.19±0.032.33±0.231.31±0.141.21±0.122.29±0.232.26±0.220.21±0.023.17±0.31酒石酸0.01±0.010.36±0.030.39±0.040.36±0.050.34±0.040.40±0.030.12±0.010.42±0.03柠檬酸0.49±0.043.31±0.542.17±0.212.04±0.172.67±0.142.89±0.232.06±0.310.22±0.01丙酮酸0.02±0.010.26±0.030.29±0.040.33±0.050.23±0.020.24±0.020.16±0.010.03±0.00琥珀酸0.12±0.011.06±0.121.78±0.181.72±0.221.40±0.121.38±0.171.53±0.150.28±0.02苹果酸0.71±0.082.15±0.271.85±0.162.27±0.121.19±0.162.39±0.131.36±0.07—奎宁酸0.61±0.061.35±0.151.70±0.111.69±0.141.54±0.181.37±0.152.45±0.220.78±0.06
注:—表示未检出。
有机酸是一种可以改善食物的感官(风味、颜色和香气),利于健康特性[22](抗氧化抑菌)的天然组分。枇杷果酒中主要有机酸有柠檬酸、奎宁酸、琥珀酸、乳酸和苹果酸,占有机酸总量的90%以上[23]。柠檬酸具有怡人柑桔香味,口感清新圆润[24],SC-1菌株发酵后果酒柠檬酸含量最高,达到3.31 g/L。奎宁酸可作为碳源被菌株利用[25],其含量仅次于柠檬酸,枇杷果酒中奎宁酸含量下降较高。琥珀酸带有一定酸味和特殊的咸苦味,有利于在果酒成熟的过程中酯类物质的形成[26],枇杷果酒中琥珀酸含量介于1.06~1.78 g/L,菌株SC-14发酵果酒产生了最多的琥珀酸。乳酸是一种比较温和的有机酸[27],仅在发酵过程中形成,会使果酒的口感更加平滑柔和。苹果酸酸性较强,略带刺激性,SC-101产生了最多的苹果酸,为2.39 g/L,D254发酵果酒中苹果酸最少,为1.36 g/L,枇杷果酒中苹果酸含量低于柠檬酸和乳酸[28]。
2.2.3 挥发性物质组成半定量分析
通过绘制聚类热图能更直观形象的显示不同菌株发酵枇杷酒中挥发性物质含量的差异,由如电子版增强出版附图1(https://doi.org/10.13995/j.cnki.11-1802/ts.040548)可知,6种单菌发酵果酒中共计检测出88种挥发性化合物,其中醇类23种,酯类43种,酸类物质7种,醛、酮、酚类物质10种,烃类物质5种,不同菌株发酵果酒的挥发性化合物种类有差异,它们构成了果酒的发酵香味、枇杷的典型性香味。
果酒中醇类与酯类含量占比高,酯类主要包括乙酸酯和脂肪酸乙酯,乙酸酯由高级醇的酯化反应产生。酯类大部分来源于水果,具有较为优雅的花果香味且阈值较低,对酒品质有积极影响[19]。果酒中的醇类化合物是重要的助香剂,大多数在低浓度时可以促使果酒香气更为复杂,浓度过高时则会给果酒带来不愉快的气味,使酒体变得粗糙。醛多被认为是通过与氨基酸的反应或不饱和脂肪酸的β-氧化形成的,发酵会促进这些反应,醛类化合物在微生物作用下是不稳定的,在食物基质中很容易被还原为醇或氧化为酸[29]。此外,发酵过程增加了酮的形成,这些酮类物质被认为具有草药、水果甚至是花的芳香。果酒中醛酮类、酚类物质含量较少,但也和醇类、酯类相互作用,共同维持酒体平衡[30]。果酒中的酸类主要起助香的作用,低浓度下有利于果酒的风味(果香和奶酪香),但浓度较高会有汗水味,酸苦味等不愉悦的味道[27, 31]。对比商业菌株D254,菌株SC-1发酵果酒提高异戊醇、壬酸乙酯、苯甲酸乙酯、异戊酸乙酯的含量。菌株SC-14发酵枇杷酒中乙酸乙酯、乙酸苯乙酯、月桂酸乙酯等物质含量得到提高,菌株SC-53发酵果酒中1,3-丙二醇二乙酸酯、棕榈酸乙酯等含量较高。菌株SC-80发酵果酒中十四酸乙酯、硬脂酸乙酯、2-壬酮等含量较高。菌株SC-101发酵果酒中苯乙醇、乙酸壬酯、十五酸乙酯、3-羟基辛酸乙酯等含量较高。市售果酒的苯乙醇、异戊醇等含量较高。
2.2.4 主要挥发性物质含量定量分析
通过半定量分析仅能说明不同发酵果酒挥发性物质组成的差异,但缺少分析各组分在果酒中的实际含量和阈值。在该研究中首先描述了枇杷果酒中30种主要挥发性化合物的香气,并利用外标法对这些特征性香气物质做浓度标准曲线[见电子版增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.040548)]。根据标准曲线测得的香气物质含量,并通过查得物质阈值来计算该物质的OAV,结果如电子版增强出版附表2和附表3(https://doi.org/10.13995/j.cnki.11-1802/ts.040548)所示。
挥发性风味物质的浓度高低不一定会对果汁或果酒香气有较大的贡献,还要看该物质在介质中的阈值大小。OAV>1说明含量高于阈值,对于样品整体的香气有贡献,且OAV越高,作用越显著。由附表2和附表3可知,SC-1酿造的枇杷果酒中OAV>1的物质共有11种,包括4种醇类,5种酯类和2种酸类,其中异戊醇,乙酸异戊酯和丁酸乙酯在枇杷果酒中的OAV分别为2.77、12.12和16.27,对枇杷果酒香气贡献程度最大。在枇杷果酒中含量较高的酯类有乙酸乙酯、丁酸乙酯、乙酸异戊酯、癸酸乙酯,它们赋予果酒清新的花草和果香味。乙酸乙酯是5种枇杷果酒中含量最高的乙酸酯,SC-101发酵果酒乙酸乙酯含量最高,达到23.54 mg/L,SC-80最少,仅为16.89 mg/L。其次含量较高的有乙酸异戊酯,SC-1和D254发酵果酒乙酸异戊酯产量都高于0.55 mg/L。异戊酸乙酯、己酸乙酯的含量较低,但其OAV>1,可能对枇杷果酒风味带来积极影响。
果酒中的醇类化合物主要由原料中的蛋白质,氨基酸和糖在发酵过程中产生,其主要呈现出果香和花香。异戊醇、苯乙醇、正丙醇、异丁醇是发酵枇杷果酒中含量较高的醇类化合物,在酿酒酵母SC-1发酵果酒样品中的含量分别为39.94、18.01、11.59、20.79 mg/L。
醇酯比是指高级醇和总酯的比值。高级醇和酯类物质是果酒风味物质的重要组成部分。醇酯比过高则酒味过浓,香味不足;醇酯比过低则香味过浓,酒味不足,则失去果酒本身意义。果酒中醇酯比范围目前标准尚不统一,啤酒中认为醇酯比在(3.5~5)∶1时酒体风味较柔和协调。SC-1发酵果酒的醇酯比从3.38提升到4.09,整体风味更佳,同时香气更宜人,总酯含量相比对照组D254提高了17.94%。脂肪酸类物质下降了15.21%,感官评分得分也最高。果酒中的脂肪酸主要在发酵过程中形成,主要影响酒体口感和后味。由附表2和附表3可知,枇杷果酒中的脂肪酸主要有辛酸、正癸酸和正十二烷酸,其中辛酸和正癸酸的OAV>1,总脂肪酸含量<10 mg/L。脂肪酸除了本身的淡香之外,也可一定程度上阻碍酯类物质的水解[10]。此外,枇杷果酒中检出的其他微量挥发性化合物中包含芳樟醇,β-香茅醇和γ-葵内酯。萜烯化合物与花香和柠檬香气有关,芳樟醇可为果酒提供淡淡的柑桔香,γ-葵内酯含有轻微的桃香。
市售果酒的异戊醇含量远高于实验室发酵果酒,在饮用时会有一定的上头感,同时乙酸乙酯含量偏低,果香味偏淡。可能会导致其嗜好程度降低。
2.2.5 感官品评分析
对5个品评结果较好的枇杷酒、D254发酵果酒以及市售果酒进行感官品评,结果如图2所示。果香是果酒品质的重要指标,SC-1在嗜好程度、甜、果香、花香、愉悦程度上的得分高,同时异味程度最低。SC-101在花香上得分较高。SC-14愉悦程度得分较高。对照组D254酸度最高。实验室果酒整体颜色略深(橙黄色),考虑是由于美拉德反应导致的颜色变化。市售枇杷果酒一般采用瞬时高温灭菌或紫外杀菌的方法,与实验室枇杷果酒对比,市售果酒产品的颜色略浅(浅橙色),口感偏甜,但花香和果香偏淡,嗜好程度略低。总体来看实验工艺下的发酵枇杷果酒在口感、香气和功能上更优于市售枇杷果酒样品。

图2 酿酒酵母菌株发酵枇杷果酒感官品评雷达图
Fig.2 Descriptive quantitative analysis of fermented loquat wine by different yeast
2.3 发酵条件单因素试验
以优选菌株SC-1作为发酵剂进行单因素优化试验,拟通过改变初始含糖量、发酵温度、初始pH值、酵母接种量,探究发酵条件对枇杷果酒的影响,优化枇杷果酒工艺。
初始含糖量直接影响发酵液的酒精含量和风味物质含量,从而影响枇杷果酒的质量。如图3-a所示,发酵后果酒的酒精度随初始含糖量的增加而增加,初始糖含量为200 g/L时,果酒的酒精度为11.8%vol,此时酒体较为丰满,感官评分较高。之后当初始含糖量继续升高时,酒精度升高的幅度逐渐减小,同时感官评分降低。
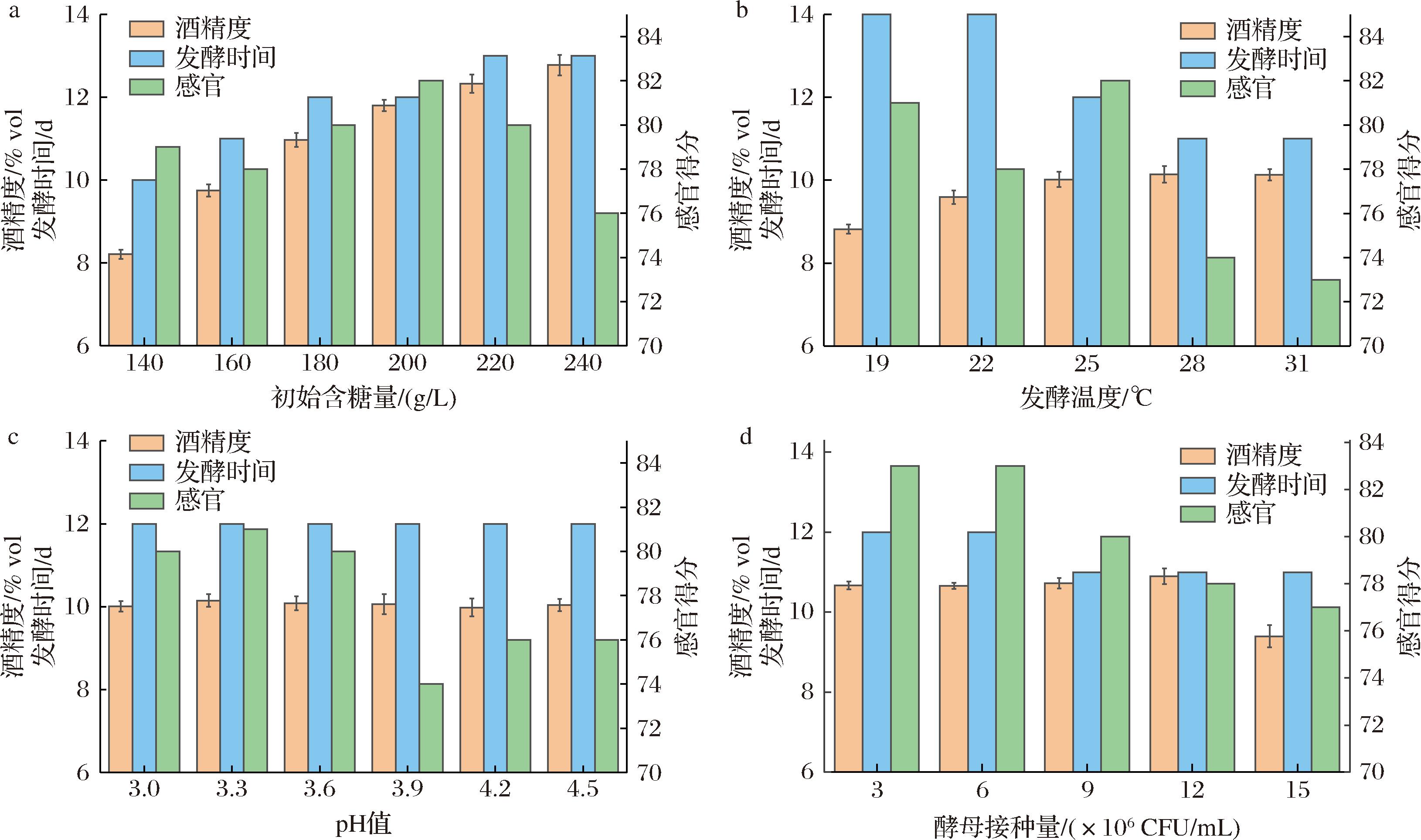
a-初始含糖量;b-发酵温度;c-pH值;d-酵母接种量
图3 发酵条件对枇杷果酒的影响
Fig.3 Effect of fermentation conditions on loquat wine
如图3-b所示,发酵温度<22 ℃时,发酵时间相对延长,发酵不彻底,而发酵温度>28 ℃时,发酵速度较快,但感官得分相对降低。低温发酵可以增加果酒的花香和果香,但会抑制酵母的生长,降低糖的消耗率;随着温度的升高,酵母的生长速度加快,发酵速度加快。不过温度过高会导致酵母自溶和活细胞减少。发酵温度为25 ℃时酒体丰满,感官得分最高。
如图3-c所示,在不同pH条件下,发酵时间无明显差异。当初始pH值较低时,发酵酒的酸味更浓,感官评分略低;当初始pH值较高时,发酵的果酒会有明显的苦味。综合考虑pH 3.3为最适初始pH值。
如图3-d所示,当酵母接种量低于6×106 CFU/mL时发酵时间相对延长,接种量达到15×106 CFU/mL时酒精度明显降低。酵母接种量较低时,代谢繁殖速度缓慢,污染杂菌的风险增加,酵母接种量过多时,菌群大量繁殖消耗营养成分,破化发酵环境致使酵母提前衰老并发生自溶,影响果酒风味。综合考虑最佳接种量为6×106 CFU/mL。
通过单因素优化试验确定的最适条件组为:初始含糖量200 g/L,发酵温度25 ℃,初始pH值3.3,酵母接种量6×106 CFU/mL。
2.4 菌株的鉴定
通过测序发现初筛得到的菌株有12株酿酒酵母和5株非酿酒酵母。图4是其18S rDNA PCR产物凝胶电泳图。对菌株的扩增产物测序,并构建系统发育树,如图5所示。筛选菌株SC-1为酿酒酵母Saccharomyces cerevisiae。
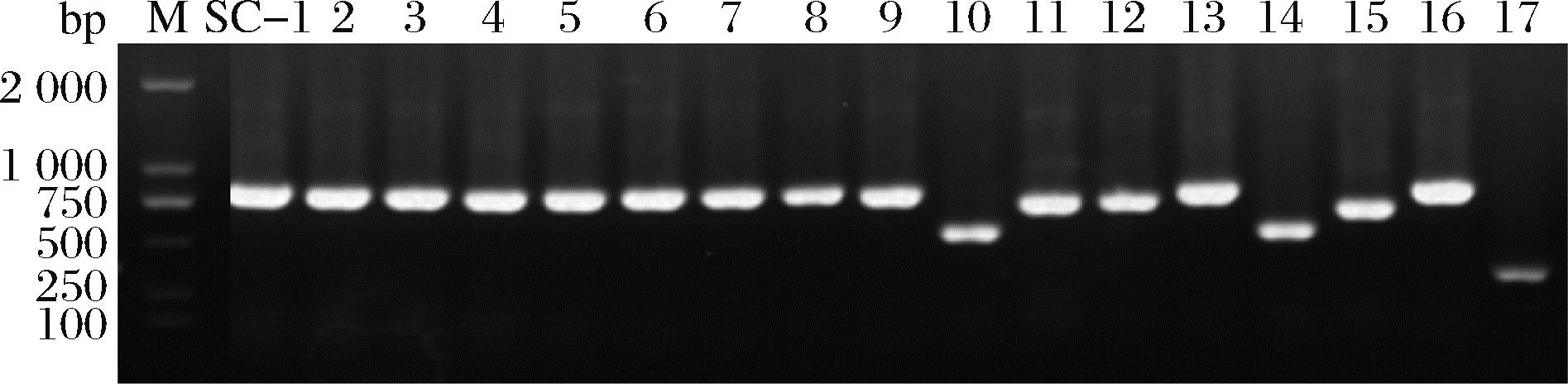
M: DNA maker DL 2000 bp; 泳道1~9、11~13为酿酒酵母;泳道10、14~17为非酿酒酵母。
图4 酵母的18S rDNA产物凝胶电泳图
Fig.4 Gel electrophoresis of yeast 18S rDNA products
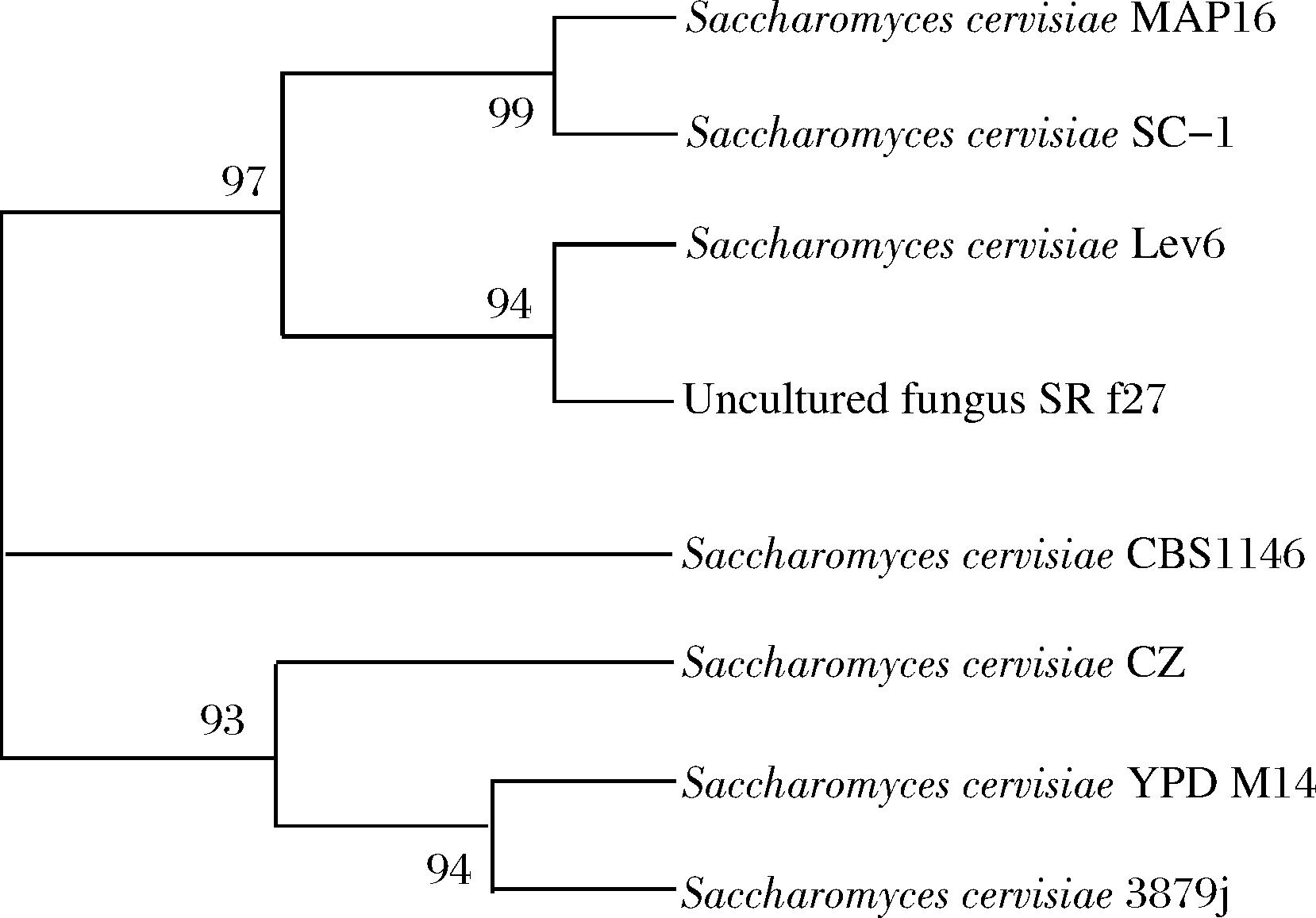
图5 基于18S rDNA测序构建的SC-1菌株系统发育树
Fig.5 Phylogenetic tree of SC-1 based on 18S rDNA sequencing
3 结论
中国是世界水果生产大国,极高的产量和多样的种类很好地解决了果酒的原料问题。水果产量的增长与质量的提高也推动了水果深加工产业的发展。果酒也逐渐在市场上活跃起来。相较于白酒,果酒所含的营养物质更加丰富,杂醇油、醛类等有害物质更少,更加健康;相较于啤酒,果酒种类多样,可以为消费者提供更多的选择性。枇杷果酒还因为具有特殊的生物功能性而受到了消费者的青睐。枇杷果酒在酿造过程中还存在一些问题,包括原料品种质量、酿造工艺、出发菌种选择、自制果酒中一些有害健康的物质等,这些问题亟待解决。
本试验主要目的是获得1株发酵能力和产酒精能力强、香气浓郁且风味好、口味佳的酿酒酵母。以腐烂枇杷果肉、果皮、果园土壤以及实验室保藏菌株等为筛选源,通过一系列生长和耐受实验,感官品评及风味分析,得到了优良酿酒酵母菌株。同时分析了枇杷果酒的各类指标。该菌株发酵枇杷果酒中多种挥发性物质含量均优于其他菌株。该酿酒酵母发酵枇杷果酒在感官品评上得分较高,发酵后产品口感清爽,感官品评结果优于其他筛选菌株、对照商业菌株以及市售枇杷果酒,同时讨论了灭菌处理可能对枇杷果酒造成的影响。后续可筛选具有一定特殊香气的非酿酒酵母进行混菌发酵,探索优化发酵条件,并对果酒进行降酸脱涩,进一步提升果酒的质量。基于本文方法筛选得到的酿酒酵母对特征性枇杷果酒产品在工业实际中的生产应用具有一定参考价值,为进一步相关产业研发奠定了良好的基础。
[1] ORTIZ M J, BARRAJ N N, BAFFI M A, et al.Spontaneous must fermentation:Identification and biotechnological properties of wine yeasts[J].LWT, 2013, 50(2):371-377.
N N, BAFFI M A, et al.Spontaneous must fermentation:Identification and biotechnological properties of wine yeasts[J].LWT, 2013, 50(2):371-377.
[2] 翟小芬, 蔡健.枇杷的营养保健和开发利用[J].广州食品工业科技, 2004, 20(3):104-106.ZHAI X F, CAI J.Nutrition healthy and development utilization of loquat Zhai[J].Guangzhou Food Science and Technology, 2004, 20(3):104-106.
[3] CAO T L, SONG K B.Effects of gum karaya addition on the characteristics of loquat seed starch films containing oregano essential oil[J].Food Hydrocolloids, 2019, 97:105198.
[4] 张倩茹, 殷龙龙, 尹蓉, 等.果酒主要成分及其功能性研究进展[J].食品与机械, 2020, 36(4):226-230;236.ZHANG Q R, YIN L L, YIN R, et al.Analysis of components and functionality of fruit wine[J].Food &Machinery, 2020, 36(4):226-230;236.
[5] HU L L, LIU R, WANG X H, et al.The sensory quality improvement of citrus wine through co-fermentations with selected non-Saccharomyces yeast strains and Saccharomyces cerevisiae[J].Microorganisms, 2020, 8(3):323.
[6] 张聪, 林叶新.发酵果酒的研究进展[J].江苏调味副食品, 2021, 38(3):13-16.ZHANG C, LIN Y X.Research advance of fermented fruit wine[J].Jiangsu Condiment and Subsidiary Food, 2021, 38(3):13-16.
[7] PLANETA D, FARINA V, BAMBINA P, et al.Analysis of aroma compounds of nine autochthonous and non-autochthonous loquat cultivars grown in Sicily[J].Italian Journal of Food Science, 2021, 33(4):33-42.
[8] LIU X F, LI N Y, ZHAO X Y, et al.Sensory and chemical characterizations of aroma during the loquat wine fermentation[J].Food Bioscience, 2024, 58:103731.
[9] 李凯, 王金晶, 李永仙, 等.红心火龙果果酒特征香气分析[J].食品与发酵工业, 2019, 45(13):217-223.LI K, WANG J J, LI Y X, et al.Characteristic aroma components of red pitaya wine[J].Food and Fermentation Industries, 2019, 45(13):217-223.
[10] 徐铭阳, 李崎, 郑飞云, 等.适于红枣汁发酵的乳酸菌的筛选及其发酵特性分析[J].食品与发酵工业, 2023, 49(21):66-73.XU M Y, LI Q, ZHENG F Y, et al.Screening and fermentation characteristics of lactic acid bacteria suitable for jujube juice fermentation[J].Food and Fermentation Industries, 2023, 49(21):66-73.
[11] 胡晓冰, 王振伟.TTC法在筛选西瓜果酒酵母中的应用[J].酿酒科技, 2011(2):69-70;73.HU X B, WANG Z W.Application of TTC in screening yeast for watermelon fruit wine production[J].Liquor-Making Science &Technology, 2011(2):69-70;73.
[12] 李明瑕. 枇杷果酒酿酒酵母的筛选及其工艺研究[D].无锡:江南大学, 2021.LI M X.Screening and process study of yeast for yellow peach wine brewing[D].Wuxi:Jiangnan University, 2021.
[13] ZHU J C, NIU Y W, FENG T, et al.Evaluation of the formation of volatiles and sensory characteristics of persimmon (Diospyros kaki L.f.) fruit wines using different commercial yeast strains of Saccharomyces cerevisiae[J].Natural Product Research, 2014, 28(21):1887-1893.
[14] 张亚萌. 高浓酿造啤酒酵母选育及其糖利用机制研究[D].无锡:江南大学, 2023.ZHANG Y M.Study on breeding of high concentration brewing beer yeast and its sugar utilization mechanism[D].Wuxi:Jiangnan University, 2023.
[15] 赵宁, 魏新元, 樊明涛, 等.SPME-GC-MS结合电子鼻技术分析不同品种猕猴桃酒香气物质[J].食品科学, 2019, 40(22):249-255.ZHAO N, WEI X Y, FAN M T, et al.Analysis of volatile components of kiwifruit wines made from different cultivars using solid phase microextraction-gas chromatography-mass spectrometry combined with electronic nose[J].Food Science, 2019, 40(22):249-255.
[16] 曹倩雯, 郑飞云, 赵佳迪, 等.桑葚果酒专用酵母的分离、筛选及鉴定[J].食品与发酵工业, 2017, 43(3):94-98.CAO Q W, ZHENG F Y, ZHAO J D, et al.The isolation, screening and identification of yeasts for mulberry wine[J].Food and Fermentation Industries, 2017, 43(3):94-98.
[17] LI J K, LIU Q Y, WANG J, et al.Effect of red pepper (Zanthoxylum bungeanum Maxim.) leaf extract on volatile flavor compounds of salted silver carp[J].Food Science &Nutrition, 2020, 8(3):1355-1364.
[18] 张志龙. 冷浸渍处理对黑比诺干红葡萄酒挥发性风味物质的影响[D].兰州:甘肃农业大学, 2014.ZHANG Z L.The effect of cold impregnation treatment on volatile flavor compounds in Pinot Noir dry red wine[D].Lanzhou:Gansu Agricultural University, 2014.
[19] HUANG L, MA Y, TIAN X, et al.Chemosensory characteristics of regional vidal icewines from China and Canada[J].Food Chemistry, 2018, 261:66-74.
[20] LORENZINI M, SIMONATO B, SLAGHENAUFI D, et al.Assessment of yeasts for apple juice fermentation and production of cider volatile compounds[J].LWT, 2019, 99:224-230.
[21] BALLESTER-TOM S L, PRIETO J A, GIL J V, et al.The Antarctic yeast Candida sake:Understanding cold metabolism impact on wine[J].International Journal of Food Microbiology, 2017, 245:59-65.
S L, PRIETO J A, GIL J V, et al.The Antarctic yeast Candida sake:Understanding cold metabolism impact on wine[J].International Journal of Food Microbiology, 2017, 245:59-65.
[22] LEE P R, YU B, CURRAN P, et al.Effect of fusel oil addition on volatile compounds in papaya wine fermented with Williopsis saturnus var.mrakii NCYC 2251[J].Food Research International, 2011, 44(5):1292-1298.
[23] GUO C T, BI J F, LI X, et al.Antioxidant profile of thinned young and ripe fruits of Chinese peach and nectarine varieties[J].International Journal of Food Properties, 2020, 23(1):1272-1286.
[24] VILELA A.Use of nonconventional yeasts for modulating wine acidity[J].Fermentation, 2019, 5(1):27.
[25] WU B H, GÉNARD M, LESCOURRET F, et al.Influence of assimilate and water supply on seasonal variation of acids in peach (cv Suncrest)[J].Journal of the Science of Food and Agriculture, 2002, 82(15):1829-1836.
[26] BARO M, FIALA J.Chasing after minerality, relationship to yeasts nutritional stress and succinic acid production[J].Czech Journal of Food Sciences, 2012, 30(2):188-193.
M, FIALA J.Chasing after minerality, relationship to yeasts nutritional stress and succinic acid production[J].Czech Journal of Food Sciences, 2012, 30(2):188-193.
[27] CHIDI B S, BAUER F F, ROSSOUW D.Organic acid metabolism and the impact of fermentation practices on wine acidity:A review[J].South African Journal of Enology and Viticulture, 2018, 39(2).DOI:10.21548/39-2-3172.
[28] MA W, GUO A Q, ZHANG Y L, et al.A review on astringency and bitterness perception of tannins in wine[J].Trends in Food Science &Technology, 2014, 40(1):6-19.
[29] LIZARDO R C M, CHO H D, WON Y S, et al.Fermentation with mono- and mixed cultures of Lactobacillus plantarum and L.casei enhances the phytochemical content and biological activities of cherry silverberry (Elaeagnus multiflora Thunb.) fruit[J].Journal of the Science of Food and Agriculture, 2020, 100(9):3687-3696.
[30] RUPPERT V, INNERHOFER G, VOIT J, et al.The impact of the fermentation strategy on the flavour formation of ilzer rose (Malus domestica borkh.) apple wine[J].Foods, 2021, 10(10):2348.
[31] SUN S Y, CHE C Y, SUN T F, et al.Evaluation of sequential inoculation of Saccharomyces cerevisiae and Oenococcus oeni strains on the chemical and aromatic profiles of cherry wines[J].Food Chemistry, 2013, 138(4):2233-2241.