酪蛋白(casein, CAS)作为牛奶中的主要成分,是酸奶、奶酪等乳制品生产加工的关键组分,作为食品添加剂应用于食品加工等多个领域。然而,酪蛋白在酸性条件下易发生凝乳沉淀,例如在酸性乳饮料中,随着体系pH值降低,酪蛋白稳定性骤降,短时间内就可能出现分层、沉淀等现象[1]。这一特性限制了酪蛋白在食品加工领域的应用,因此,选择合适的辅助剂来增强其稳定性一直是酪蛋白加工领域的研究重点。
多糖作为天然生物聚合物,具备安全无毒、增稠、胶凝、乳化等特性,被应用于食品领域[2]。研究表明,可以通过添加多糖的方式来提升酪蛋白的酸稳定性[3]。罗望子多糖(tamarind seed polysaccharide, TSP)是一种天然多糖,具有良好的耐酸性,这一特性可以有效的提高酪蛋白在酸性条件下的稳定性。蛋白与多糖交联的常见方法有直接混合法、干热和湿热糖基化法以及酶促糖基化法等。刘丽娅[4]研究发现直接混合法在较低pH值下会使蛋白-多糖形成不稳定体系。钱冠林[5]通过干、湿热法使酪蛋白发生糖基化反应,发现酪蛋白-大枣多糖乳化性高于单一酪蛋白。但是干热法反应体系复杂,反应进程缓慢,通常需要较长时间来达到理想的修饰效果;湿热法涉及高温,易破坏蛋白质结构。而酶促糖基化法反应条件温和,很大程度上保护了蛋白质的天然结构并且安全高效[6]。刘郁琪等[7]通过酶法修饰酪蛋白,发现酪蛋白-大豆多糖交联产物的溶解度较单一酪蛋白得到改善。谷氨酰胺转移酶(transglutaminase, TG)是一种天然酶制剂,具有较好的pH值适应性[8]。本研究利用谷氨酰胺转移酶使酪蛋白与罗望子多糖发生反应,制备糖基化复合物,以提升其酸稳定性,对拓展酪蛋白在食品工业中的应用具有重要意义。
1 材料与方法
1.1 材料与试剂
CAS,美国Sigma-Aldrich公司;TSP,云南夜草生物科技有限公司;TG(200 U/g)、异硫氰酸荧光素(fluorescein isothiocyanate isomer,FITC)、SDS、尼罗红,上海源叶生物科技有限公司;无水乙醇,上海泰坦科技股份有限公司;四硼酸钠、β-巯基乙醇,上海麦克林生化科技有限公司。
1.2 仪器与设备
Nano ZS纳米粒度仪,英国Malvern公司;pH计,梅特勒-托利多仪器上海有限公司;Nicolet傅里叶红外光谱仪,美国Thermo公司;752型紫外可见分光光度计,上海光谱仪器有限公司;LEICA DFC7000T荧光显微镜,德国徕卡微系统有限公司;Freezone12冷冻干燥机,美国Labconco公司;GL-3型磁力搅拌器,河南巩义市英峪予华仪器厂;HH-S恒温水浴锅,金坛市荣华仪器厂。
1.3 实验方法
1.3.1 CAS-TSP复合物的制备
参考刘郁琪[7]的方法,稍作修改。10 g/L的CAS溶液的制备:准确称取一定质量的CAS固体粉末溶于去离子水中,400 r/min搅拌过夜,使CAS完全溶解。10 g/L TSP溶液的制备:准确称取一定质量的TSP,加入去离子水,搅拌过夜使其溶解。将CAS溶液和TSP溶液等体积充分搅拌均匀,在37 ℃下反应并加入TG,使TG的添加量为5 U/g,分别反应0、1、3、5 h,待反应结束后,将溶液迅速置于100 ℃水浴锅中进行高温灭活处理,样品冷冻干燥48 h后备用。
1.3.2 接枝度的测定
参考彭秀清[9]的方法并稍作修改,准确称取80 mg邻苯二甲醛避光溶解在无水乙醇中,分别称取1.91 g四硼酸钠和0.1 g SDS,吸取200 μL的β-巯基乙醇,将以上试剂充分混合均匀,使用棕色容量瓶将混合溶液定容至100 mL。取4 mL配制好的上述试剂,加入200 μL 2 mg/mL的CAS-TSP复合物溶液。混合后的溶液置于37 ℃水浴反应2 min。在340 nm处测定吸光值,按公式(1)计算接枝度:
接枝度![]()
(1)
式中:A0,初始吸光值;At,CAS-TSP复合物与OPA试剂反应后的吸光值。
1.3.3 褐变程度及中间产物的测定
利用PBS溶解样品,使其质量浓度为2 mg/mL。分别在294 nm和420 nm下测定样品的吸光值表示反应进程[9]。
1.3.4 傅里叶变换红外光谱测定
参考张诗璇[10]的方法稍作修改。准确称量适量的样品,加入KBr进行压片。在4 000~400 cm-1的波数范围内进行扫描,设置光谱分辨率为4 cm-1,扫描64次以确保数据的可靠性。
1.3.5 接触角的测定
取粉末样品,用压片机压制成表面平滑、无杂质且厚度适宜的薄片,将其置于测量仪载物台上,利用悬滴法对接触角进行精确测量[11]。
1.3.6 溶液稳定性的观察
分别制备5 mg/mL的CAS溶液与10 mg/mL的CAS-TSP复合物溶液,使用0.1 mol/L的盐酸调节各体系的pH值,观察溶液形态并拍照记录。
1.3.7 复合物乳液制备及其性质分析
1.3.7.1 乳液的跌落实验
在5 mL玉米油和5 mL纯水中分别加入50 μL乳液,进行液滴常规跌落测试,观察液滴的形态并拍照记录。
1.3.7.2 乳液乳化能力的测定
取玉米油和样品溶液按1∶4 的体积比混合,在12 000 r/min下剪切3 min,得到的乳液在室温下静置。在0 min和30 min时分别取50 μL乳液,加入4 950 μL 1 g/L的SDS溶液将其稀释。在波长500 nm处测定吸光值[12]。乳化活性(emulsification activity index, EAI)和乳化稳定性(emulsification stability index, ESI)分别按公式(2)、公式(3)计算:
(2)
(3)
式中:V,稀释的比例;C,样品质量浓度,g/mL;φ,比色池的光径,cm;θ,乳液中油相所占的体积比例,0.2;A0,在0 min时测得的吸光值;A30,在30 min时测得的吸光值。
1.3.7.3 乳液粒径的测定
参考冯思瑞[11]的方法稍作修改。使用激光粒度分析仪对乳液粒径进行测定,将折射率设为1.470,对样品进行3次平行测量。
1.3.7.4 乳液多重荧光染色微观结构分析
参考张露露[13]的方法稍作修改。将配制好的1 g/L尼罗红和FITC染液混合均匀,得到混合荧光染料。将20 μL混合染料加入到1 mL乳液中,使其混合均匀。使用荧光模式进行观察,分别记录尼罗红和FITC染色的荧光图像。
1.4 数据处理
对每个实验参数进行3次平行测定,以确保数据的准确性和可靠性。借助Excel来计算实验数据的平均值和标准差,采用Origin 2021软件绘制相关图形,同时使用SPSS Statistics 25软件进行显著性差异分析(P<0.05)。
2 结果与分析
2.1 接枝度
如图1所示,在反应0 h时,接枝度为5.9%,原因可能是参与反应的氨基酸较少,接枝度较低[14]。随着反应持续进行,接枝度变大,反应5 h的复合物接枝度为22.3%,这可能是由于随着反应时间的增加,参与反应的糖链增多,与蛋白质分子碰撞概率增大,在TG的催化下加速了反应的进行[5]。李灵诚[15]的研究也揭示了相似的规律,即随着反应时间的延长,大米蛋白-木糖糖基化产物的接枝度越大。
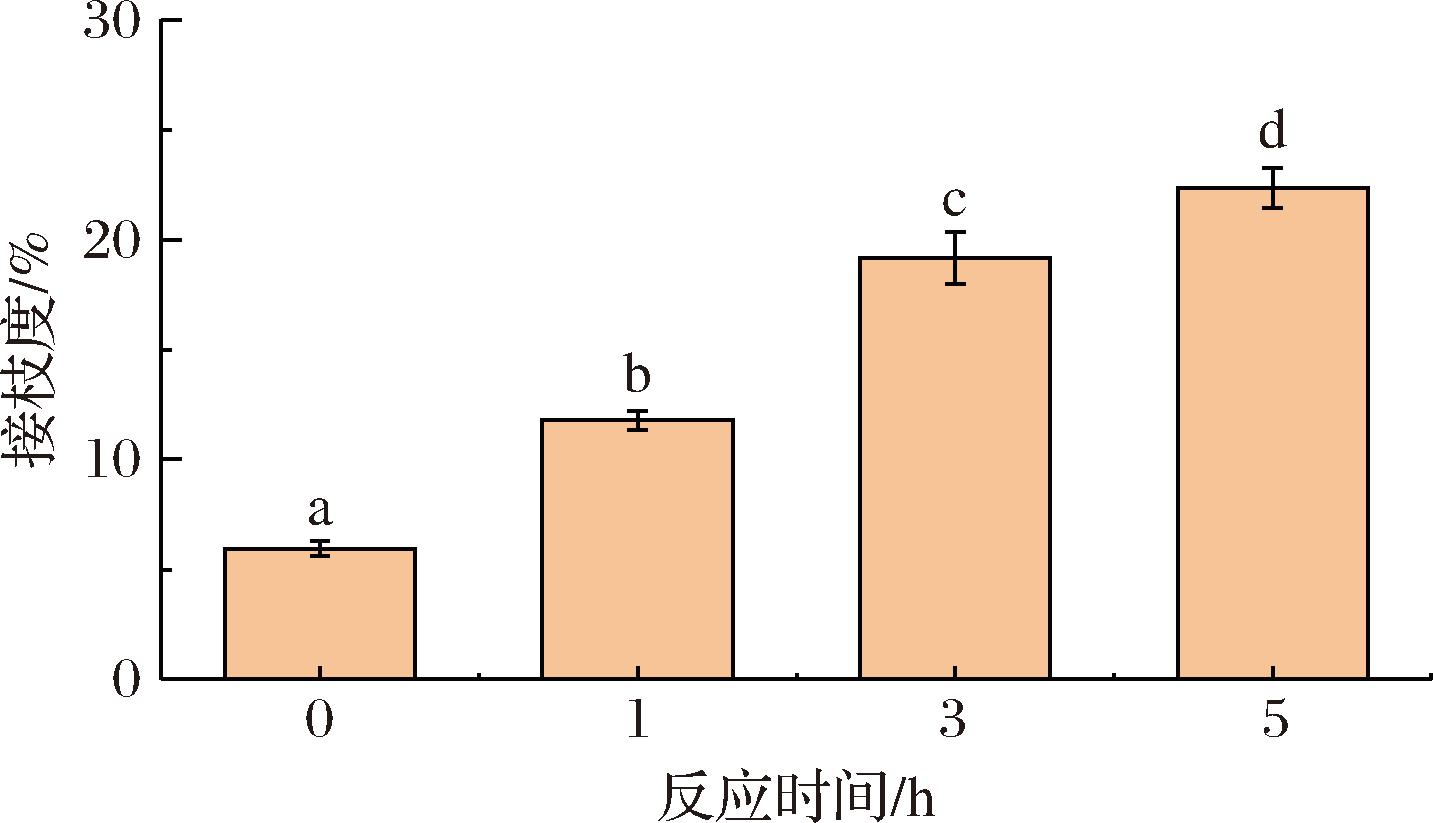
图1 反应时间对CAS-TSP复合物接枝度的影响
Fig.1 Effect of reaction time on the grafting degree of CAS-TSP complexes
注:不同大小写字母分别表示组间差异显著(P<0.05)(下同)。
2.2 褐变指数和中间产物
420 nm波长测得的吸光度主要反映了糖基化进程中棕色非结晶聚合物含量,而294 nm波长测得的吸光度主要反映中间产物含量[7]。由图2可知,随着反应的进行,溶液颜色逐步加深,反应5 h时,其褐变程度为0.19,较0 h提高了62.9%。反应5 h的复合物中间产物达到最大为0.32,较0 h提高了79.8%。中间产物含量与褐变指数的变化基本一致。王佳琪[16]在研究中发现经糖基化反应后乳清蛋白-菊粉复合物的褐变程度和中间产物均增加,与本实验结果相符。
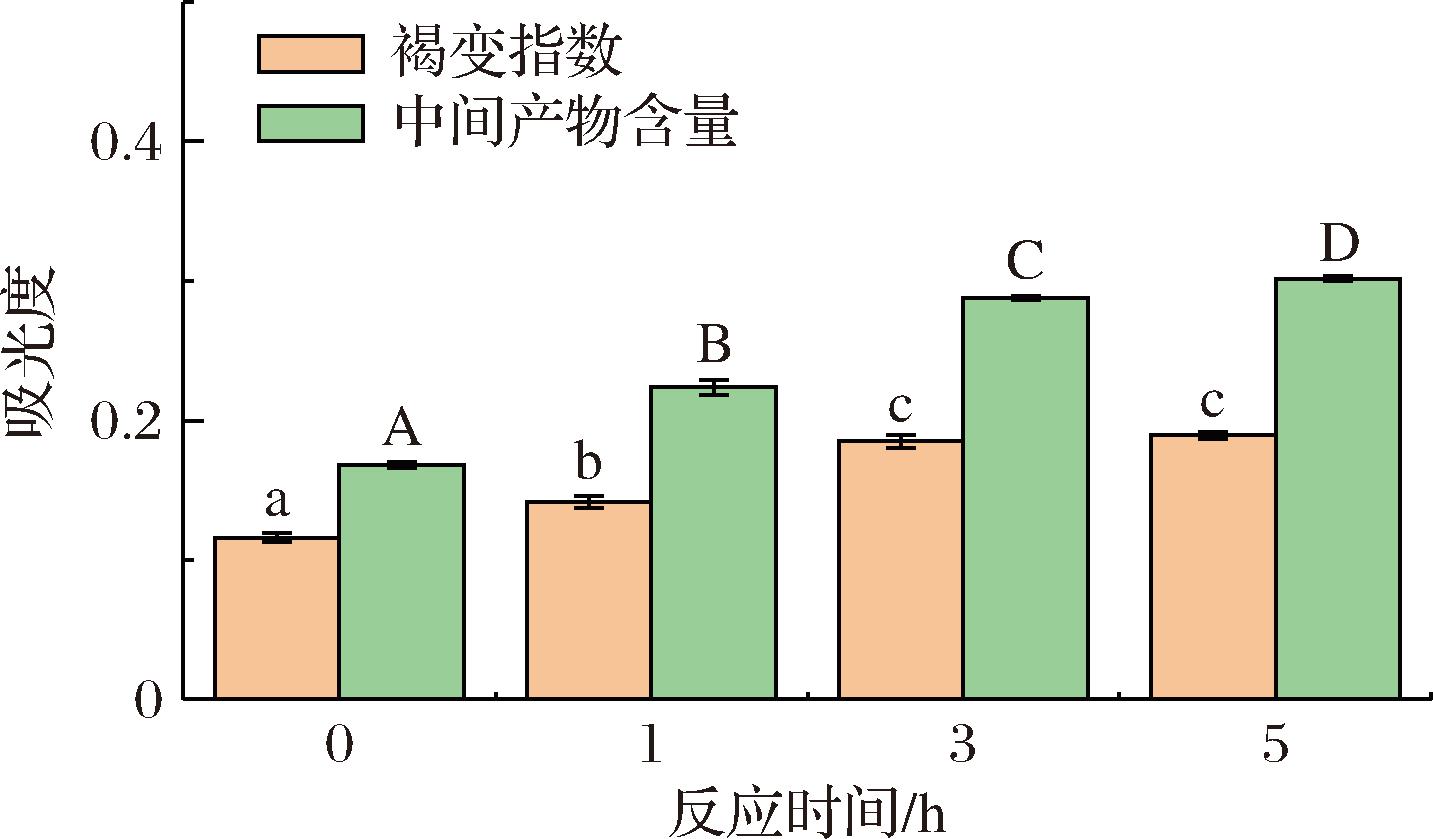
图2 反应时间对CAS-TSP复合物褐变指数和中间产物含量的影响
Fig.2 Effect of reaction time on browning index and intermediate product content of CAS-TSP complexes
2.3 傅里叶变换红外光谱
如图3所示,3 600~3 000 cm-1的吸收峰源于分子间的羟基(—OH)的伸缩振动[7]。随着反应时间的延长,CAS-TSP复合物的峰值发生红移且峰宽变大,可能是由于CAS与TSP发生反应后,融入了更多的—OH基团[17]。CAS的酰胺Ⅰ带位于1 650 cm-1附近,由C![]() O键的拉伸振动产生;酰胺Ⅱ带,位于1 540 cm-1附近,由N—H键的弯曲振动所导致;CAS-TSP复合物在酰胺Ⅰ带与酰胺Ⅱ带的红外光谱呈现出细微变化,这说明二者之间或许存在氢键、疏水作用等[18]。位于1 043 cm-1附近的吸收峰,是糖分子中C—O—C伸缩振动所呈现出的特征峰,称为糖带[19],在此处CAS-TSP复合物有明显的吸收峰,这主要是由于TSP的特定官能团引入,进而引发了CAS侧链的振动现象[20]。这些现象都说明了CAS与TSP发生了相互作用。
O键的拉伸振动产生;酰胺Ⅱ带,位于1 540 cm-1附近,由N—H键的弯曲振动所导致;CAS-TSP复合物在酰胺Ⅰ带与酰胺Ⅱ带的红外光谱呈现出细微变化,这说明二者之间或许存在氢键、疏水作用等[18]。位于1 043 cm-1附近的吸收峰,是糖分子中C—O—C伸缩振动所呈现出的特征峰,称为糖带[19],在此处CAS-TSP复合物有明显的吸收峰,这主要是由于TSP的特定官能团引入,进而引发了CAS侧链的振动现象[20]。这些现象都说明了CAS与TSP发生了相互作用。
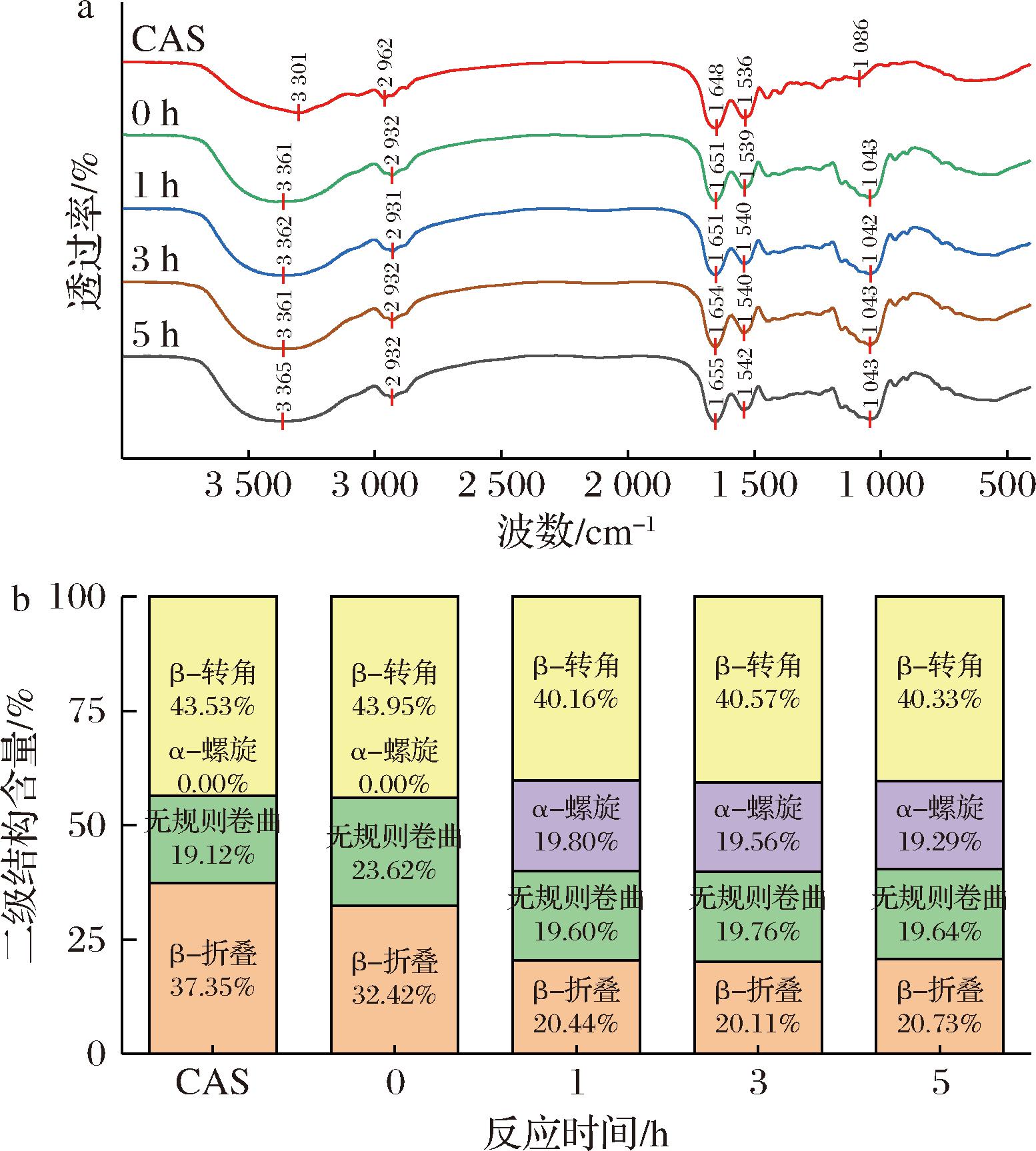
a-红外光谱;b-二级结构
图3 反应时间对蛋白质结构的影响
Fig.3 Effect of reaction time on protein structure
为了对蛋白质二级结构的变化展开进一步的研究分析,选用Peak Fit V4.12软件对CAS与CAS-TSP复合物在1 700~1 600 cm-1波数范围内的红外光谱进行高斯拟合。CAS二级结构主要由β-折叠与β-转角构成,分别占比37.35%和43.53%[5]。相比于CAS,CAS-TSP复合物的α-螺旋含量升高,β-折叠含量降低。说明反应后蛋白质的β-折叠结构部分转变为α-螺旋结构,α-螺旋比β-折叠具有更高的稳定性,这种转变可能导致蛋白质结构的柔性增加[21]。
2.4 接触角
图4结果表明随着反应时间的增大,接触角呈现增大趋势。反应使蛋白分子结构发生变化,其分子链可能会发生折叠、卷曲或伸展等构象改变,进而使接触角增大[22]。CAS与CAS-TSP复合物的接触角均小于90°,更倾向于形成O/W型乳液。反应5 h复合物的接触角为61.5°,说明其制备的乳液更稳定。郑雅丹等[23]研究发现,大豆分离蛋白与魔芋胶交联后产物的接触角大于天然大豆分离蛋白,疏水性得到显著增强,与本实验结果趋势一致。

图4 反应时间对接触角的影响
Fig.4 Effect of reaction time on contact angle
2.5 CAS与CAS-TSP复合物溶液酸稳定性
由图5可知,当pH为5时,CAS溶液呈现出明显的浑浊状态,底部出现沉淀,这是因为在等电点附近,CAS分子之间的静电斥力会有所减弱,从而使分子更容易相互靠近,发生聚集现象;反应5 h的复合物溶液较澄清透明,未产生明显沉淀。这表明CAS与TSP结合后,溶液的酸稳定性有所提高。

图5 不同pH值对CAS溶液与反应5 h溶液稳定性的影响
Fig.5 Effect of different pH values on the stability of CAS solution and reaction solution for 5 h
2.6 乳液的跌落试验
如图6所示,将50 μL的乳液分别加入到5 mL玉米油和5 mL去离子水中,可以观察到,液滴形成乳白色的球形并在玉米油中保持团聚,自由移动不会破裂,而在去离子水中液滴破裂分散,使水相变得浑浊。这表明该乳液为水包油(O/W)类型乳液,因为O/W型乳液的外相是水相,内相是油相,当把O/W乳液置于油中时,油滴之间会因表面性质及相互作用力而保持一定的距离,不会轻易地合并或聚集,使液滴保持相对稳定的状态[24-25]。

图6 乳液分散在油和水中的溶液状态
Fig.6 Solution state of the emulsion dispersed in oil and water
2.7 乳液乳化活性和乳化稳定性分析
如图7-a所示,当pH值为7时,CAS乳液的EAI和ESI为51.9 m2/g和36.7 min,CAS-TSP复合物的EAI和ESI均高于CAS乳液,反应5 h复合物制备的乳液达到最大值为75.9 m2/g和46.6 min,较CAS乳液分别提高了46.2%和27%。这可能是因为随着反应时间的增加,蛋白和多糖分子结构更加伸展,在油水界面形成的吸附层厚度增加,空间位阻效应随之增强,该效应能够有效地阻止乳液中的油滴相互靠近和聚集,进而使乳液呈现出更加稳定的状态,从而使乳化能力提高[26]。在pH值为1、3、5条件下(图7-b~图7-d),CAS-TSP复合物制备的乳液EAI和ESI均高于CAS乳液,且EAI和ESI样品表现出一致的趋势。反应5 h复合物制备的乳液表现出更高的EAI和ESI。这可能是由于CAS与TSP发生反应时,随着反应时间的增加,其内部的疏水基团逐渐显露,疏水基团能够降低油-水的液面张力,增加油滴在该体系的稳定程度,进而使乳化性能增加,防止了乳液的聚结与絮凝[27]。王丹[28]研究发现大豆蛋白-壳寡糖的产物的ESI显著高于对照组大豆蛋白,与本实验结果一致。总之,在不同pH值条件下CAS-TSP糖基化复合物制备的乳液表现出更好的EAI和ESI,说明经酶促糖基化后,CAS-TSP复合物制备的乳液酸稳定性得到提升。
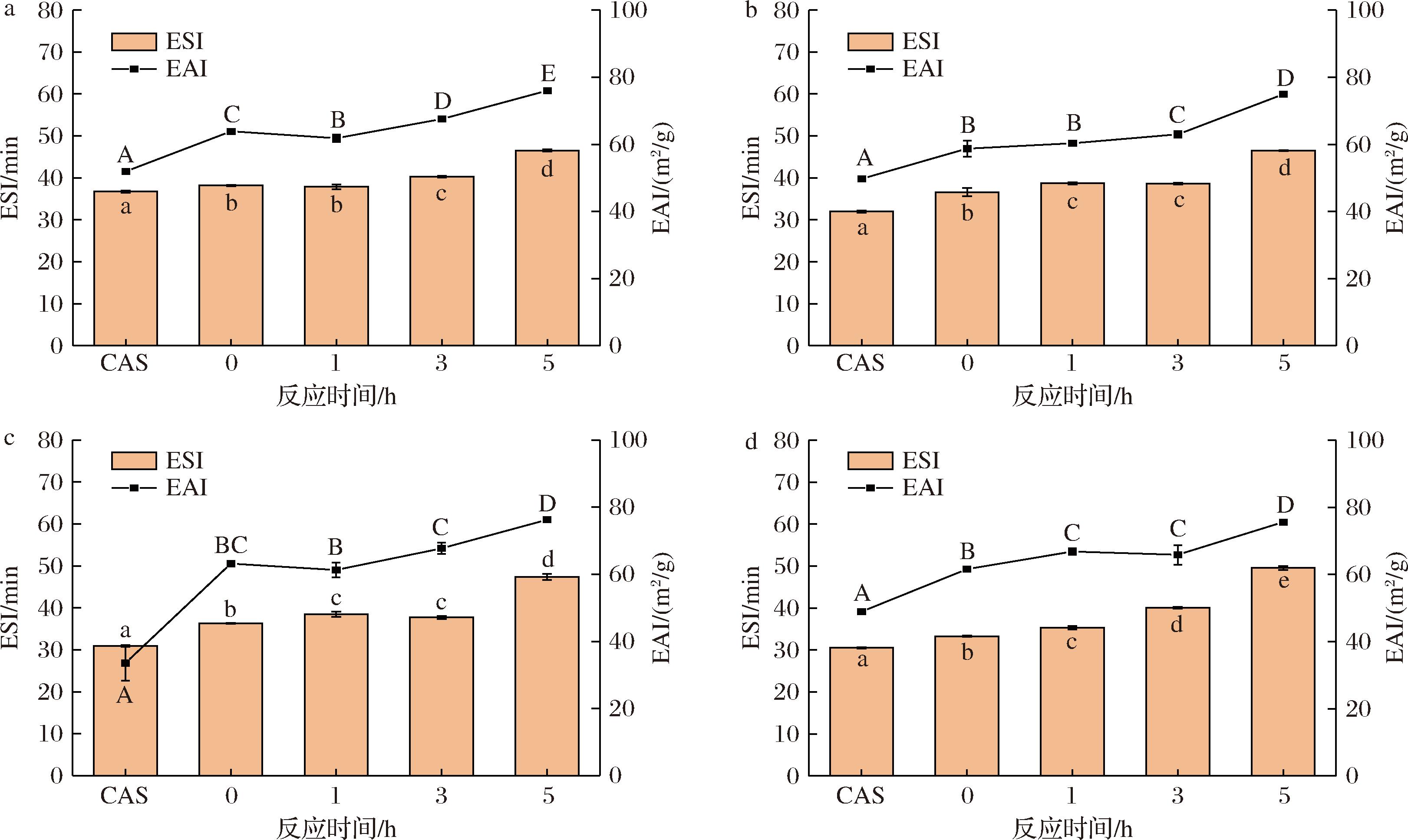
a-pH 7;b-pH 5;c-pH 3;d-pH 1
图7 不同pH值对EAI和ESI的影响
Fig.7 Effect of different pH on EAI and ESI
2.8 乳液粒径结果分析
粒径是乳液体系均匀性和稳定性的重要指标,粒径大小一定程度上能反映聚合物分子在水溶液中分散和聚集的变化情况[29]。如图8所示,pH值为5时,CAS制备的乳液粒径达到最大值,这是因为CAS的等电点为4.6~4.8,蛋白表面电荷趋近于零,液滴间静电斥力微弱,促使蛋白颗粒相互靠拢,粒径增大。在酸性环境下,CAS乳液的粒径变化幅度大,CAS-TSP复合物制备的乳液粒径变化波动小。可能是由于在CAS与TSP结合后,界面膜变得稳固[30],即便遭遇酸性条件下H+的冲击,油滴依然能保持良好的分散状态,不会因相互碰撞、融合而显著增大粒径,这说明乳液的酸稳定性得到了提升。陈星[31]研究发现乳清分离蛋白-岩藻多糖复合物制备的乳液平均粒径小于乳清分离蛋白乳液,这主要是由于复合物可吸附于油滴表面,该吸附作用能更有效地抑制液滴间的聚集现象,因此粒径更小。
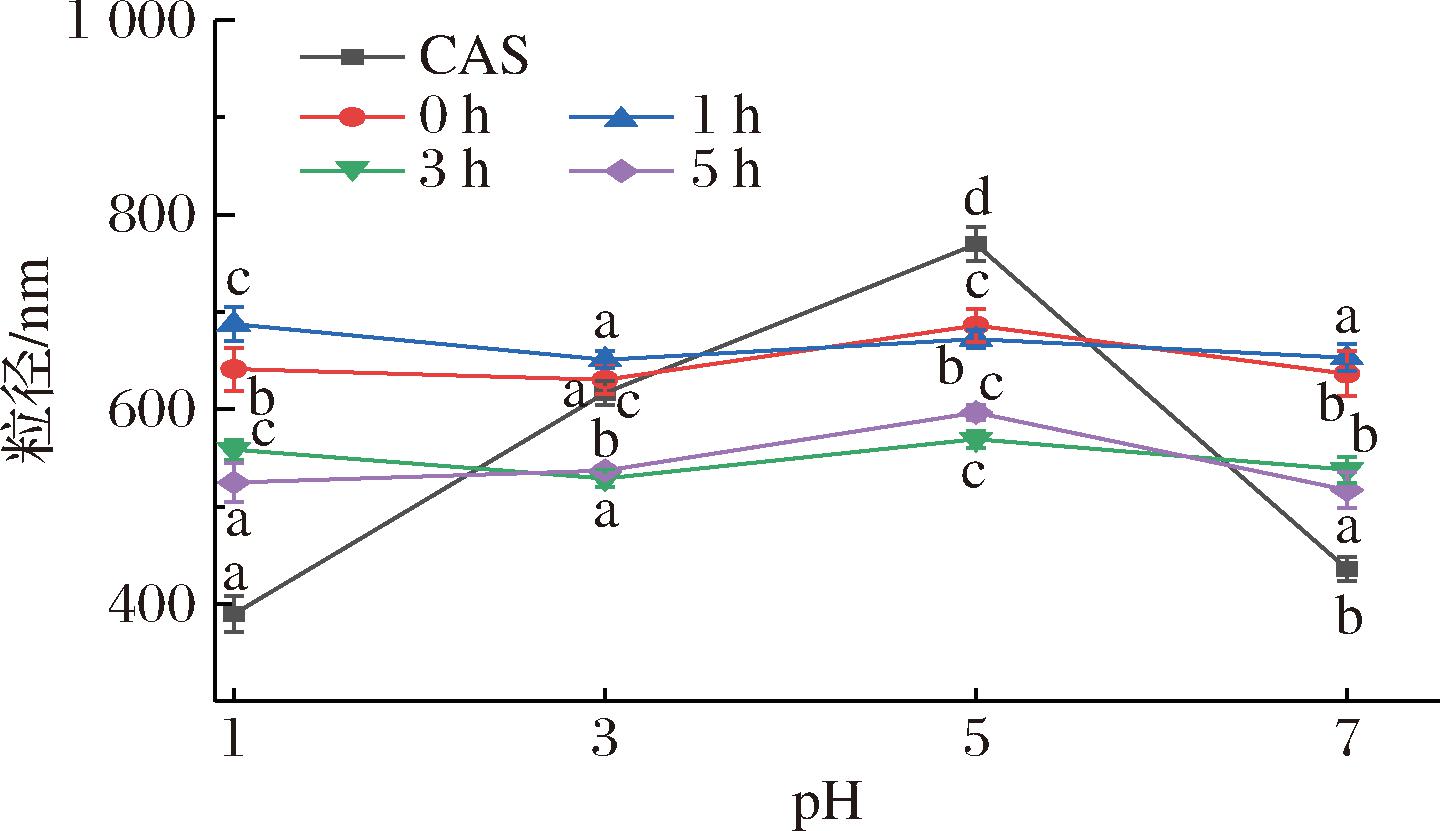
图8 不同pH值对乳液粒径的影响
Fig.8 Effect of different pH on particle size of emulsion
2.9 乳液多重荧光染色微观结构
如图9和图10所示,FITC与乳液结合后,发出黄绿色荧光。相比于CAS乳液,反应5 h复合物制备的乳液在油水界面的吸附更加均匀和稳定,油滴周围会出现荧光强度较为稳定的黄绿色光晕。尼罗红可对乳液中的油相进行染色,被尼罗红染色的油滴呈现出橙红色荧光,相比于CAS乳液,反应5 h复合物制备的乳液中油滴的分布会更加均匀,大小相对更规则,且油滴的间距维持着相对稳定的状态。随着pH值的上升,CAS乳液的粒径呈现先增大后减小的变化趋势,当pH值为3和5时,粒径逐渐变大,这与2.8节粒径分析结果一致。反应5 h复合物制备的乳液的粒径变化幅度小,乳液呈现较分散均一的体系,可能是由于TSP的黏度特性,蛋白质与多糖共同构建了一个稳固的界面层,使得形成的液滴具有较高的稳定性[27]。李宛蓉[32]研究发现了糖基化反应能够增强蛋白纤维在乳液界面层的厚度,减少液滴间的碰撞,与本实验结果相符。
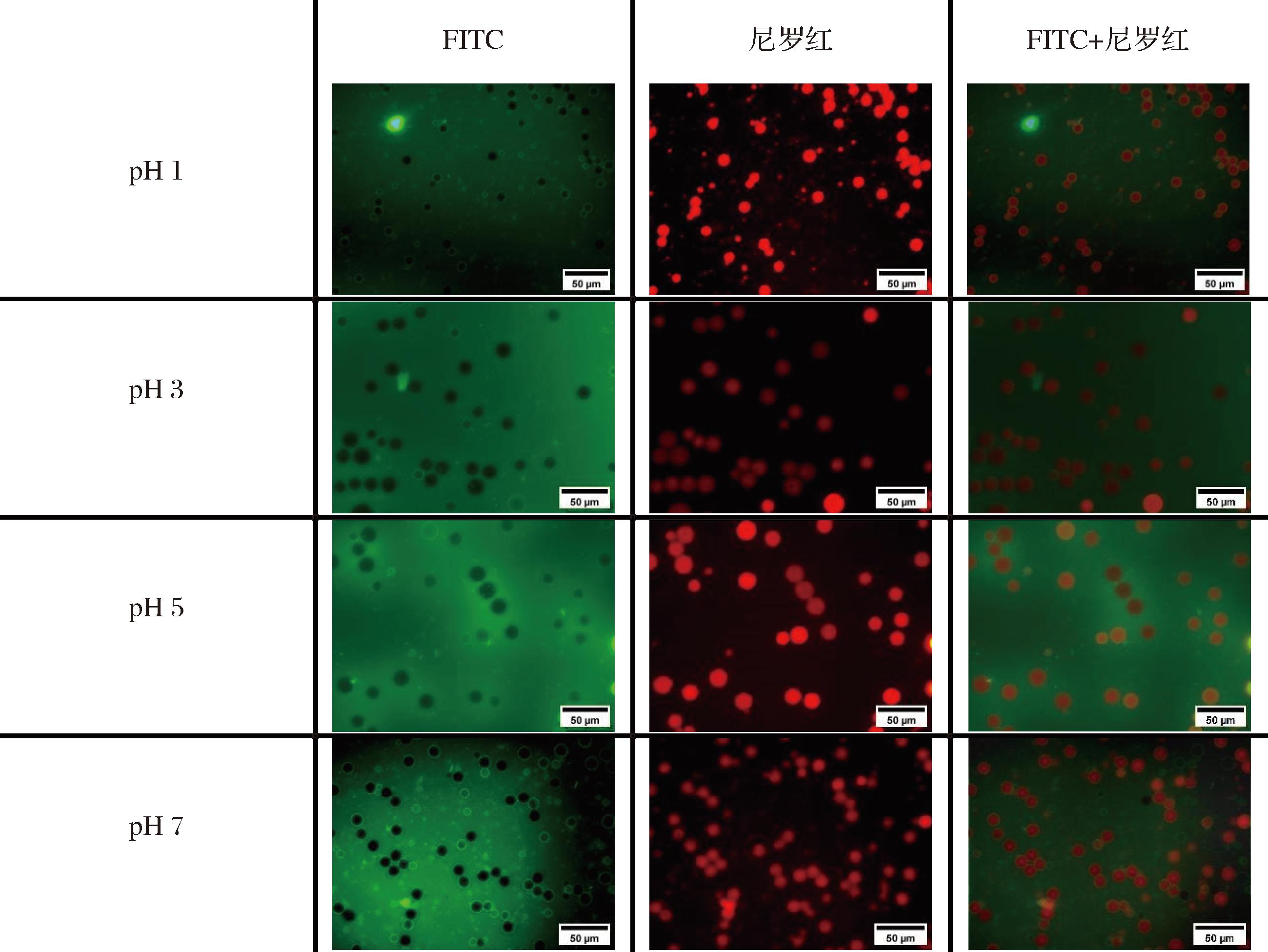
图9 CAS乳液的多重荧光染色图像
Fig.9 Multiple fluorescence staining of CAS emulsion
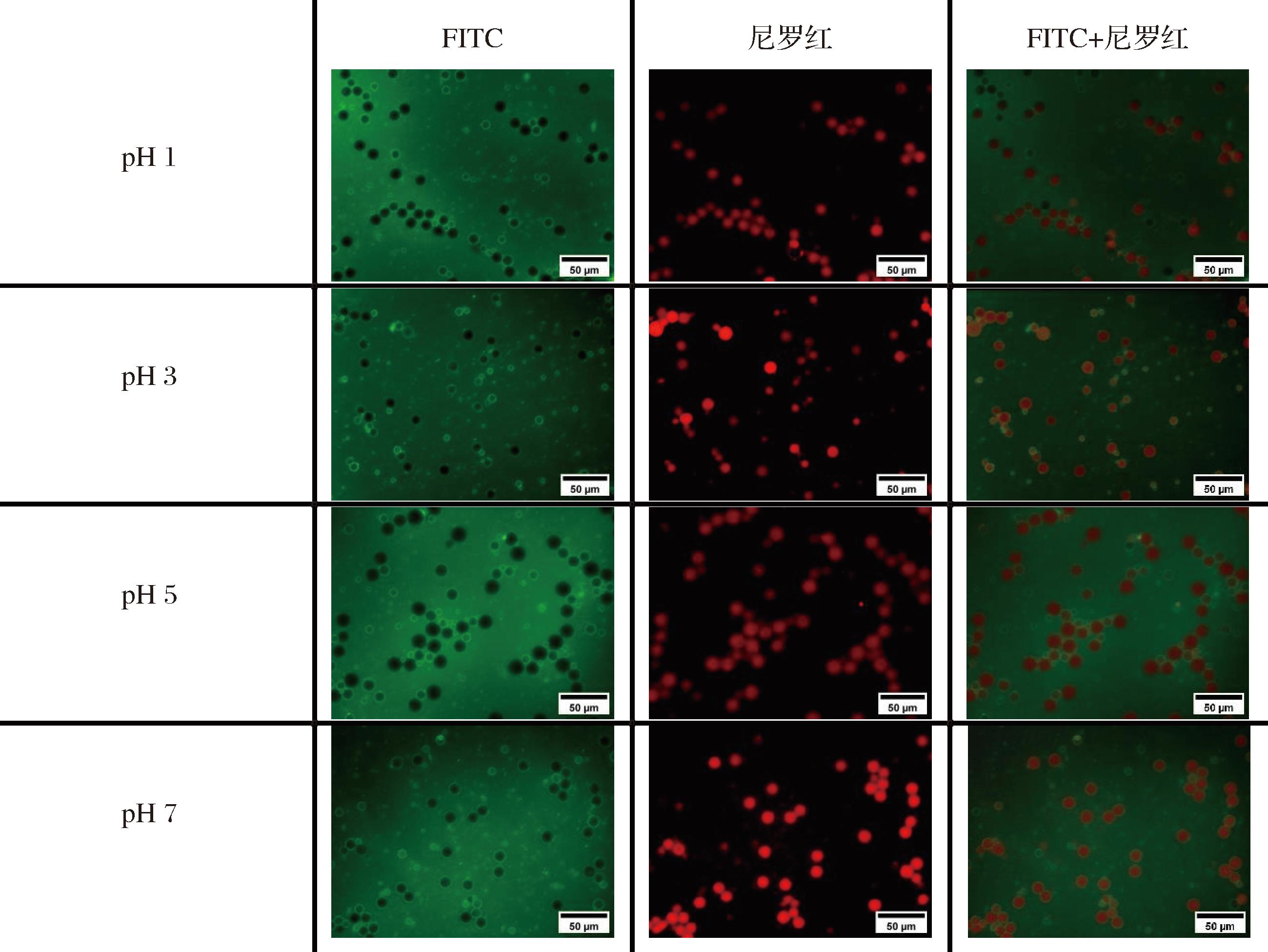
图10 5 h乳液的多重荧光染色图像
Fig.10 Multiple fluorescence staining of 5 h emulsion
3 结果与讨论
本研究制备了酪蛋白-罗望子多糖糖基化复合物,探究酪蛋白-罗望子多糖复合物的酸稳定性。结果表明,随着反应时间的延长,接枝度、中间产物含量和褐变指数均呈现增加趋势。反应5 h的复合物接枝度达到22.3%,褐变指数为0.19,中间产物含量为0.32。红外光谱分析证实了CAS与TSP之间发生了相互作用,CAS-TSP复合物的α-螺旋含量升高,β-折叠含量降低,表明其二级结构发生了改变。在pH值为5时,CAS溶液出现沉淀,而反应5 h的复合物溶液保持澄清透明,表明溶液的酸稳定性得到了提升。此外,CAS-TSP复合物的接触角大于CAS,表明其表面疏水性增强,更倾向于形成O/W型乳液。在不同pH值(1.0~7.0)条件下,与CAS乳液相比,CAS-TSP糖基化复合物制备的乳液乳化稳定性和乳化活性显著提升,且乳液粒径的变化幅度较小。这些结果表明,在CAS与TSP结合后,CAS-TSP糖基化复合物溶液及其乳液的酸稳定性均得到显著改善,本研究为酪蛋白在乳制品中的应用提供了理论依据。
[1] 安悦嘉, 曹雪妍, 杨梅, 等.pH值对酪蛋白-木糖醇复合物功能和结构特性的影响[J].农产品加工, 2023(15):24-28.AN Y J, CAO X Y, YANG M, et al.Effects of pH on functional and structural properties of casein-xylitol complex[J].Farm Products Processing, 2023(15):24-28.
[2] SHI L.Bioactivities, isolation and purification methods of polysaccharides from natural products:A review[J].International Journal of Biological Macromolecules, 2016, 92:37-48.
[3] 秦娟娟, 杨敏, 陈欣, 等.姜黄素与酪蛋白-海藻酸钠相互作用及复合物性质研究[J/OL].食品与发酵工业,2024.https://doi.org/10.13995/j.cnki.11-1802/ts.040470. QIN J J, YANG M, CHEN X, et al.Interaction between curcumin and casein-sodium alginate and properties of their complexes [J/OL].Food and Fermentation Industry, 2024.https://doi.org/10.13995/j.cnki.11-1802/ts.040470.
[4] 刘丽娅. 酪蛋白酸钠—多糖界面相互作用及其对乳状液稳定性的影响[D].广州:华南理工大学,2011.LIU L Y.Sodium caseinate-polysaccharide interface interaction and its effect on emulsion stability[D].Guangzhou:South China University of Technology,2011.
[5] 钱冠林. 干湿法多糖-酪蛋白糖基化产物的功能特性及二级结构的对比分析[D].沈阳:沈阳农业大学, 2023.QIAN G L.Comparative analysis of functional properties and secondary structure of polysaccharide-casein glycosylated products by dry and wet process[D].Shenyang:Shenyang Agricultural University, 2023.
[6] 于梦丽, 陈雨, 林凤岩, 等.物理-酶耦合修饰大豆蛋白凝胶特性的研究进展[J].食品与发酵工业, 2025, 51(5):351-360.YU M L, CHEN Y, LIN F Y, et al.Advances in characterization of physically-enzymatically coupled modified soy protein gels[J].Food and Fermentation Industry, 2025, 51(5):351-360.
[7] 刘郁琪, 覃小丽, 阚建全, 等.酪蛋白与可溶性大豆多糖的酶促糖基化产物制备及其性能分析[J].食品科学, 2020, 41(19):74-82.LIU Y Q, QIN X L, KAN J Q, et al.Preparation and properties of enzymatic glycosylation products of casein with soluble soybean polysaccharide[J].Food Science, 2020, 41(19):74-82.
[8] 付淼. TGase诱导的壳寡糖糖基化与交联对两种蛋白质的性质影响[D].哈尔滨:东北农业大学,2016.FU M.Effects of TGase-induced oligochitosanglycation and cross-linking on theproperties of two proteins[D].Harbin:Northeast Agricultural University,2016.
[9] 彭秀清. 大豆多糖共价交联调控大豆蛋白乳化性质及相关分子机制[D].广州:华南理工大学,2019.PENG X Q.Emulsifying properties and related molecularmechanism of soy glycinin regulated by covalentcross-linking with soy soluble polysaccharide[D].Guangzhou:South China University of Technology, 2019.
[10] 张诗璇. 乳清蛋白-菊粉复合物的制备、表征及功能特性的研究[D].兰州:兰州大学,2023.ZHANG S X.Study on the preparation, characterization,and functional properties of whey protein-inulin conjugates[D].Lanzhou:Lanzhou University, 2023.
[11] 冯思瑞. 多糖复合和糖基化改性对大豆分离蛋白的结构、物化特性及乳化功能的影响[D].杭州:浙江工商大学,2022.FENG S R.Effects of polysaccharide complex and glycosylation modification on structure, physicochemical properties and emulsifying function of soybean protein isolate[D].Hangzhou:Zhejiang Gongshang University, 2022.
[12] 吴周山, 李晨, 薛瑞, 等.不同分子量的葡聚糖-花生分离蛋白接枝复合物的制备及其性质[J].食品工业科技, 2019, 40(1):51-57.WU Z S, LI C, XUE R, et al.Preparation and properties of grafted conjugates with dextran in different molecular weights-peanut protein isolates[J].Science and Technology of Food Industry, 2019, 40(1):51-57.
[13] 张璐璐. 蛋白/淀粉复合纳米胶粒的微流控设计及其乳液递送系统的构建[D].广州:华南理工大学,2020.ZHANG L L.Microfluidic design of protein/starch composite nanomicles and construction of emulsion delivery system[D].Guangzhou:South China University of Technology, 2020.
[14] TER HAAR R, SCHOLS H A, GRUPPEN H.Effect of saccharide structure and size on the degree of substitution and product dispersity of α-lactalbumin glycated via the Maillard reaction[J].Journal of Agricultural and Food Chemistry, 2011, 59(17):9378-9385.
[15] 李灵诚. 大米蛋白糖基化接枝产物的制备及理化与功能特性研究[D].南宁:广西大学,2020.LI L C.Study on the preparation,physicochenmicaland functional properties of rice proteinglycosylated graft products[D].Nanning:Guangxi University, 2020.
[16] 王佳琦. 乳清蛋白—菊粉干/湿糖基化复合物理化及抗氧化特性研究[D].长春:吉林大学,2018.WANG J Q.Study on the effects of dry/moist glycosylation on the physicochemicaland antioxidant properties of whey protein-inulin complex[D].Changchun:Jilin University, 2018.
[17] 王丹, 李河, 张志军, 等.紫苏籽粕蛋白糖基化产物结构及功能特性[J].浙江大学学报(农业与生命科学版), 2023, 49(4):557-565.WANG D, LI H, ZHANG Z J, et al.Structural and functional properties of the glycosylated products of perilla seed meal proteins[J].Journal of Zhejiang University (Agriculture and Life Sciences), 2023, 49(4):557-565.
[18] 郭东起, 殷秀秀, 程焕, 等.甘草多糖与酪蛋白的相互作用及乳化性能[J].中国食品学报.2023, 23(12):12-19.GUO D Q, YIN X X, CHENG H, et al.The interaction mechanism and emulsifying properties of glycyrrhiza polysaccharide and casein[J].Chinese Journal of Food Science.2023, 23(12):12-19.
[19] JIA X, LI L C, TENG J W, et al.Glycation of rice protein and D-xylose pretreated through hydrothermal cooking-assisted high hydrostatic pressure:Focus on the structural and functional properties[J].LWT, 2022, 160:113194.
[20] 张晓曦, 王鹏, 王丽爽, 等.挤压处理对大米蛋白-菊粉挤压共聚物结构和理化性质的影响[J].河南工业大学学报(自然科学版), 2023, 44(1):26-35.ZHANG X X, WANG P, WANG L S, et al.Effect of extrusion treatment on the structure and physicochemical properties of rice protein-inulin extruded conjugates[J].Journal of Henan University of Technology (Natural Science Edition), 2023, 44(1):26-35.
[21] 刘安军, 胡颖娜, 刘彩红, 等.酪蛋白-卡拉胶体系的流变特性及其相互作用研究[J].现代食品科技, 2014, 30(11):23-27.LIU A J, HU Y N, LIU C H, et al.Study on the rheology and interactions of casein-carrageenan system[J].Modern Food Science and Technology, 2014, 30(11):23-27.
[22] 冯婷婷. 豌豆蛋白—果胶-EGCG复合物稳定皮克林乳液的机制与风味包埋特性[D].无锡:江南大学,2022.FENG T T.Mechanism of stabilizing Pickering emulsionsand flavor encapsulation properties by pea protein-pectin-EGCG complexes[D].Wuxi:Jiangnan University, 2022.
[23] 郑雅丹, 游寅寅, 杨鹏, 等.热修饰大豆分离蛋白与改性魔芋胶糖基化对产物抗水化特性的影响研究[J].包装工程, 2023, 44(11):116-123.ZHENG Y D, YOU Y Y, YANG P, et al.Effect of glycosylation of heat-modified soy protein and modified konjac gum on hydration resistance of products[J].Packaging Engineering, 2023, 44(11):116-123.
[24] LI J, XU X E, CHEN Z X, et al.Zein/gum Arabic nanoparticle-stabilized Pickering emulsion with thymol as an antibacterial delivery system[J].Carbohydrate Polymers, 2018, 200:416-426.
[25] YANG H, SU Z W, MENG X H, et al.Fabrication and characterization of Pickering emulsion stabilized by soy protein isolate-chitosan nanoparticles[J].Carbohydrate Polymers, 2020, 247:116712.
[26] ZHAO J W, CHANG B Y, HU Y T, et al.Adsorption mechanism of soy protein amyloid fibrils with different morphological structures at the interface of oil-in-water emulsion[J].Food Hydrocolloids, 2025, 162:110899.
[27] 姜来, 王佳蓉, 王雪梅, 等.松仁蛋白-刺槐豆胶共价复合物结构表征及对Pickering乳液稳定性影响[J/OL].食品科学技术学报.1-21[2025-06-25].http://kns.cnki.net/kcms/detail/10.1151.TS.20241213.1141.002.html.JIANG L, WANG J R, WANG X M, et al.Characterization of the covalent complex of pine kernel protein-locust bean gum and its effect on the stability of Pickering emulsion[J/OL].Journal of Food Science and Technology.1-21[2025-06-25].http://kns.cnki.net/kcms/detail/10.1151.TS.20241213.1141.002.html.
[28] 王丹. 大豆蛋白—壳寡糖聚合物的酶促合成及性质表征[D].大连:大连工业大学,2015.WANG D.Enzymatic preparation of soy protein-oligochitosan polymer and its properties[D].Dalian:Dalian Polytechnic University, 2015.
[29] 武婳. 基于酪蛋白/麦芽糊精相互作用的全营养乳液制备及稳定性研究[D].无锡:江南大学,2023.WU W. Preparation and stability study of total nutritionemulsion based on casein/maltodextrin interaction[D].Wuxi:Jiangnan University, 2023.
[30] 孙艺. 热促稳定Pickering乳液的构建、机制及在包埋番茄红素异构化中的应用[D].重庆:西南大学, 2022.SUN Y.Construction and mechanism of thermally promotingstable Pickering emulsion and its application in theisomerization of encapsulated lycopene[D].Chongqing:Southwest University, 2022.
[31] 陈星. 基于乳清分离蛋白-岩藻多糖复合物稳定的乳液制备及其应用研究[D].长春:吉林大学,2024.CHEN X.Preparation and application of emulsion stabilized based on whey protein isolate-fucoidan complex[D].Changchun:Jilin University, 2024.
[32] 李宛蓉. 糖基化乳清分离蛋白纤维的制备、改性及其在Pickering乳液体系中的应用研究[D].武汉:武汉轻工大学,2020.LI W R.Preparation and modification of glycosylated whey protein fiber isolate and its application in Pickering emulsion system[D].Wuhan:Wuhan University of Light Industry, 2020.