5-羟基色氨酸(5-hydroxytryptophan, 5-HTP)是一种功能性食品原料,是加纳籽提取物中的主要化学成分之一[1]。5-HTP一直以来作为一种有益的膳食补充剂被进行使用,动物实验和临床试验均表明其安全性,目前也未有任何证据表明其有害性[2]。5-HTP作为色氨酸的代谢中间产物,是合成神经递质5-羟色胺(5-hydroxytryptamine, 5-HT)的重要前体。5-HT在调节情绪、睡眠和食欲等方面发挥着关键作用[3-5],因此,5-HTP被广泛应用于抗抑郁药物和膳食补充剂等领域。然而,5-HTP在生物体内的半衰期较短[6],口服后1~2 h内达到血液浓度峰值,约4 h后被完全代谢,难以在体内持续发挥作用,需频繁服用以维持疗效。此外,高剂量的5-HTP可能引发恶心、呕吐等副作用[7],进而影响患者的依从性。这些不足限制了5-HTP在临床和功能性食品中的应用效果。为了延长5-HTP在生物体内的作用时间,提高其稳定性和生物利用度,并降低副作用的发生率,开发合适的食品运载体系,通过包埋技术实现5-HTP的缓释,成为一种有效的解决方案。
食品运载体系是一种创新的递送技术,通过食品级材料有效地封装生物活性成分,如维生素、抗氧化剂和药物等,以实现保护、缓释和定向释放等功能[8]。目前,食品运载体系主要包括纳米颗粒、凝胶珠、乳液、脂质体和微胶囊等。这些体系在调控活性物质释放行为、增强稳定性和提高生物利用度方面展现出显著优势。其中,纳米颗粒、凝胶珠和乳液被选作本研究的对象,主要是基于它们在5-HTP这一水溶性小分子物质包埋和缓释中的潜在优势。纳米颗粒因其小尺寸和大表面积,能够显著提高小分子物质的稳定性和生物利用度,并通过载体优化设计实现针对性的释放控制[9]。以往研究表明,纳米颗粒体系已成功应用于多种水溶性小分子物质的包埋,例如维生素C和多酚类化合物[10-11],表现出优异的稳定性和缓释性能,显示了其在提升水溶性小分子物质应用潜力方面的优势。凝胶珠由于其良好的生物相容性和可调节的网状结构,能够有效包埋和缓释各种小分子物质[12]。研究表明,凝胶珠的交联度和孔隙结构可精确调控,从而调节物质的释放速率[13],因而在延长药物释放时间和提高药物稳定性方面具有显著优势,具有在5-HTP包埋研究中的潜在应用价值。乳液体系通过其独特的液滴结构和制备灵活性,能够有效包埋和缓释多种类型的活性成分[14]。乳液中的油相和水相比例、界面活性剂的选择以及制备条件的调控,都显著影响活性物质的释放行为[15]。以往的应用研究表明,乳液对脂溶性和水溶性物质具有良好的包埋效果和稳定性[16],尤其在控制释放速率和改善生物利用度方面表现出显著优势。
鉴于这些研究成果,推测纳米颗粒、凝胶珠和乳液这3种运载体系同样能够有效包埋5-HTP,并在其释放控制方面展现出潜力。因此,本研究旨在系统评估这3种体系对5-HTP的包埋和缓释性能,为其在功能食品中的应用提供新的技术方案和理论支持。
1 材料与方法
1.1 材料与试剂
5-HTP、聚甘油蓖麻醇酸酯(polyglycerol polyricinoleate,PGPR)、胰蛋白酶,上海迈瑞尔生化科技有限公司;海藻酸钠,上海麦克林生化科技有限公司;羧甲基壳聚糖、玉米淀粉、β-环糊精、大豆油,上海阿拉丁生化科技有限公司;分离乳清蛋白(whey protein isolate,WPI)、胰脂肪酶,上海源叶生化科技有限公司;胃蛋白酶,美国Sigma-Aldrich公司;柠檬酸钠及其他试剂,国药集团。
1.2 仪器与设备
RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;PSI高压均质机,上海普丽盛融合机械设备有限公司;C-MAG HS磁力搅拌器,IKA仪器公司;Nicolet iS20傅里叶变换红外光谱仪(Fourier transform infrared spectrometer,FTIR),美国尼高力仪器公司;TA.XTC-18质构仪,北京微讯超技仪器技术有限公司;Zetasizer Nano ZS纳米激光粒度仪,英国马尔文公司;CR30NX超高速冷冻离心机,德国艾本德仪器公司;LGJ-10C冷冻干燥机,北京松源华兴科技发展有限公司;TCS SP8激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM),德国徕卡显微系统公司;Sigma 500扫描电子显微镜(scanning electron microscope,SEM),德国蔡司公司;Apreo 2S Cryo生物冷冻扫描电镜显微镜(Cryo-SEM),美国FEI公司;Alliance e2695 HPLC仪,美国沃特世公司;Orbitrap Exploris 120液相色谱-质谱联用仪(liquid chromatography-mass spectrometer,LC-MS),赛默飞世尔科技有限公司;THZ-98A恒温振荡培养箱,上海一恒科学仪器有限公司。
1.3 方法
1.3.1 纳米颗粒的制备
将5-HTP和玉米淀粉按1∶2(质量比)溶于超纯水后,将70%~75%乙醇溶液和玉米淀粉溶液以1∶1的体积比混合,在0.4 mL/min的速度下逐滴加入,同时搅拌,并进行超声波处理1 h。旋蒸除去乙醇后,按β-环糊精∶玉米淀粉=1∶2(质量比)加入体系,然后在50 ℃、700 r/min条件下磁力搅拌过夜。再次超声1 h,12 000×g离心15 min,弃去上清液,并将沉淀冷冻干燥,得到包封5-HTP的纳米颗粒。
1.3.2 凝胶珠的制备
将海藻酸钠和羧甲基壳聚糖按质量比1∶2溶于超纯水(终质量浓度10 g/L),搅拌至透明。加入1 mg/mL的5-HTP溶液,搅拌均匀。缓慢搅拌下,用1 mL注射器将混合物滴加至柠檬酸钠溶液(终质量浓度5 g/L,pH 2.5)中,交联反应1 h,随后,收集凝胶珠并用超纯水洗涤3次,最终得到包封5-HTP的凝胶珠。
1.3.3 乳液的制备
制备之前,所有溶液用0.1 mol/L NaOH或HCl调至pH=7。5-HTP(10 g/L)溶于海藻酸钠(20 g/L)溶液中,搅拌均匀以制备内水相。疏水乳化剂PGPR(质量分数4.5%)溶于大豆油中,搅拌均匀以制备油相。将两相按m(内水相)∶m(油相)=3∶7混合,并使用高速分散机在12 000 r/min下均质2 min制备初级W/O乳液。外水相是乳清蛋白分离物(40 g/L)和海藻酸钠(20 g/L)溶液进行混合。将m(初级W/O乳液)∶m(外水相)=2∶8混合,再次使用高速分散机在8 000 r/min下均质2 min得到包封5-HTP的乳液。
1.3.4 包封率与负载率的测定
对于凝胶珠,收集交联反应1 h后的柠檬酸钠溶液及洗涤液,过滤并用HPLC测定游离的5-HTP含量。对于纳米颗粒,取1 mL纳米颗粒悬液,6 000×g离心10 min,沉淀用超纯水洗涤3次后,过滤上清液并用HPLC测定游离的5-HTP含量。对于乳液,取1 mL乳液,在室温下6 000×g离心10 min,过滤下清液并用HPLC测定外水相中的5-HTP含量。所有测量均重复3次。包封率与装载率计算如公式(1)、公式(2)所示:
包封率![]()
(1)
装载率![]()
(2)
式中:m1,添加的5-HTP总质量,mg;m2,未被包封的5-HTP质量,mg;m3,食品运载体系质量,mg。
1.3.5 弹性、硬度测定
使用质构仪测定凝胶珠的弹性与硬度[17]。选择TPA模式,P/75探头,测试速率及测后速率为1 mm/s,压缩程度为5 mm,停留时间为5 s。
1.3.6 含水量测定
将制备好的水凝胶珠在4 ℃下放置12 h,用滤纸擦干表面水分后称质量。含水量按公式(3)计算:
含水率![]()
(3)
式中:m0,凝胶珠的原始质量,mg;m1,冻干珠的质量,mg。
1.3.7 粒径、zeta电位与聚合物分散性指数(polymer dispersity index,PDI)测定
取1 mL乳液或纳米颗粒溶液,用超纯水稀释10倍后,使用纳米激光粒度仪检测其粒径、zeta电位与PDI。
1.3.8 SEM观察
样品喷金后,使用SEM观察冻干凝胶珠、纳米颗粒及乳液的表面微观结构。
1.3.9 LSCM观察
将乳液进行荧光染色后,使用LSCM观察其微观结构。大豆油用0.1%的尼罗红(质量分数)染色,外层水相中的WPI用1%的尼罗蓝(质量分数)染色,染色时间为1 h。在488、633 nm激发波长下进行观察和成像。
1.3.10 FTIR测定
将样品冻干后,使用FTIR在室温下检测4 000~650 cm-1的红外光谱。
1.3.11 溶胀度测定
通过测定不同pH条件下的溶胀率来评估凝胶珠的溶胀行为。将干燥后的凝胶珠放入37 ℃的磷酸氢二钠-柠檬酸缓冲液(pH 2~8)中孵育。在特定时间点取出凝胶珠,除去表面液体后称质量。溶胀比计算如公式(4)所示:
溶胀比![]()
(4)
式中:m3,溶胀珠的质量,mg;m2,干燥珠的质量,mg。
1.3.12 体外胃肠模拟消化
使用模拟胃肠液测定不同食品运载体系中包封的5-HTP释放率。根据INFOGEST共识方案制备模拟胃液(pH=3.0)和模拟肠液(pH=7.4)[18]。
分别将3种包封5-HTP的体系样品和空载制剂经冻干各取1 mg加入37 ℃提前预热的9 mL模拟胃液中,同时加入1 mL胃蛋白酶溶液,在37 ℃下200 r/min振荡孵育2 h。每隔15 min吸取20 μL消化液,然后将吸取的消化液立即放入4 ℃以终止反应,同时向体系中补充20 μL的添加胃蛋白酶的模拟胃液。模拟胃液环境消化2 h后,用1 mol的HCl和NaOH将体系调节pH至7.4,添加18 mL提前预热的模拟肠液,同时加入2 mL胰蛋白酶和胰脂肪酶混合溶液,继续在37 ℃下200 r/min振荡孵育10 h。每隔30 min吸取20 μL消化液,同样将吸取的消化液立即放入4 ℃,同时向体系中补充同样体积的添加胰蛋白酶和胰脂肪酶的模拟肠液。每个体系均设置3个平行。
将20 μL消化液样品在4 ℃、12 000×g离心15 min,过滤上清液,使用HPLC检测溶液中的5-HTP含量。使用空载制剂消化的上清液作为标准品稀释样品液。体外释放率计算如公式(5)所示:
体外释放率![]()
(5)
1.3.13 HPLC测定
使用Waters Atlantis T3色谱柱(250 mm×4.6 mm,5 μm)进行物质分离,流动相A为0.01 mol/L PBS,使用磷酸调pH值至4.0,流动相B为乙腈。梯度洗脱方法为5% B,0~1 min;95% B,1~12 min;95% B,12~15 min;5% B,15~16 min;5% B,16~20 min。流速1 mL/min,柱温35 ℃。进样体积10 μL,使用荧光检测器进行检测,激发波长280 nm,发射波长360 nm。使用外标法进行定量。
1.3.14 LC-MS测定
使用DIONEX UltiMate 3000 HPLC系统与Q-Exactive质谱联用检测,分离色谱柱为ACQUITY UPLC® BEH C18柱(1.7 μm,100 mm×2.10 mm)。进样量为2 μL,流动相A为0.1%甲酸水,流动相B为乙腈。柱温为35 ℃,样品室温度为4 ℃,流速为0.3 mL/min。梯度洗脱方法为5% B,0~3 min;30% B,3~9 min;100% B,9~12 min;100% B冲洗至13.5 min;5% B,13.5~15 min。质谱条件为正离子扫描模式,喷雾电压3 500 V,离子源温度320 ℃,氮气作为质谱的保护气和辅助气。
1.3.15 数据处理与分析
每个实验均重复3次。实验数据表示为“平均值±标准差”或中位数-四分位距,用Graphpad Prism 9.4等软件对数据进行统计分析。使用Shapiro-Wilk法对数据进行正态性检验。对于符合正态分布的数据,采用非配对t检验、单因素方差分析(one-way analysis of variance,ANOVA)和Dunnett’s事后检验分析数据显著性;对于非正态分布的数据,采用Kruskal Wallis非参数检验和Dunnett’s事后检验分析显著性。P<0.05表示存在显著差异,事后多重检验P值均采用FDR进行矫正。
2 结果与分析
2.1 结构表征
2.1.1 包封能力分析
包封能力是衡量食品运载体系对功能性成分有效包埋能力的重要指标。通过对凝胶珠、纳米颗粒和乳液3种体系的5-HTP包封能力进行定量分析。如图1所示,乳液的包封率最高,达(93.19±5.15)%;纳米颗粒次之,包封率为(79.14±0.23)%;凝胶珠的包封率相对较低,仅为(59.68±6.76)%。在负载量方面,乳液体系显著低于另外两种体系,仅为(0.61±0.28)%;凝胶珠的负载量为(25.35±5.51)%;而纳米颗粒的负载量最高,达到63.16%~63.50%。这种差异可能与纳米颗粒的纳米尺度及其较高的比表面积有关,能够更有效地包封5-HTP,减少其在制备过程中的逸失和降解。乳液的高包封率表明其具有良好的封闭性能,这可能归因于其稳定的双层结构,但其极低的负载量则反映了材料利用率的不足。凝胶珠的包封能力较低,可能是由于在凝胶形成过程中,部分5-HTP发生逸失所致。
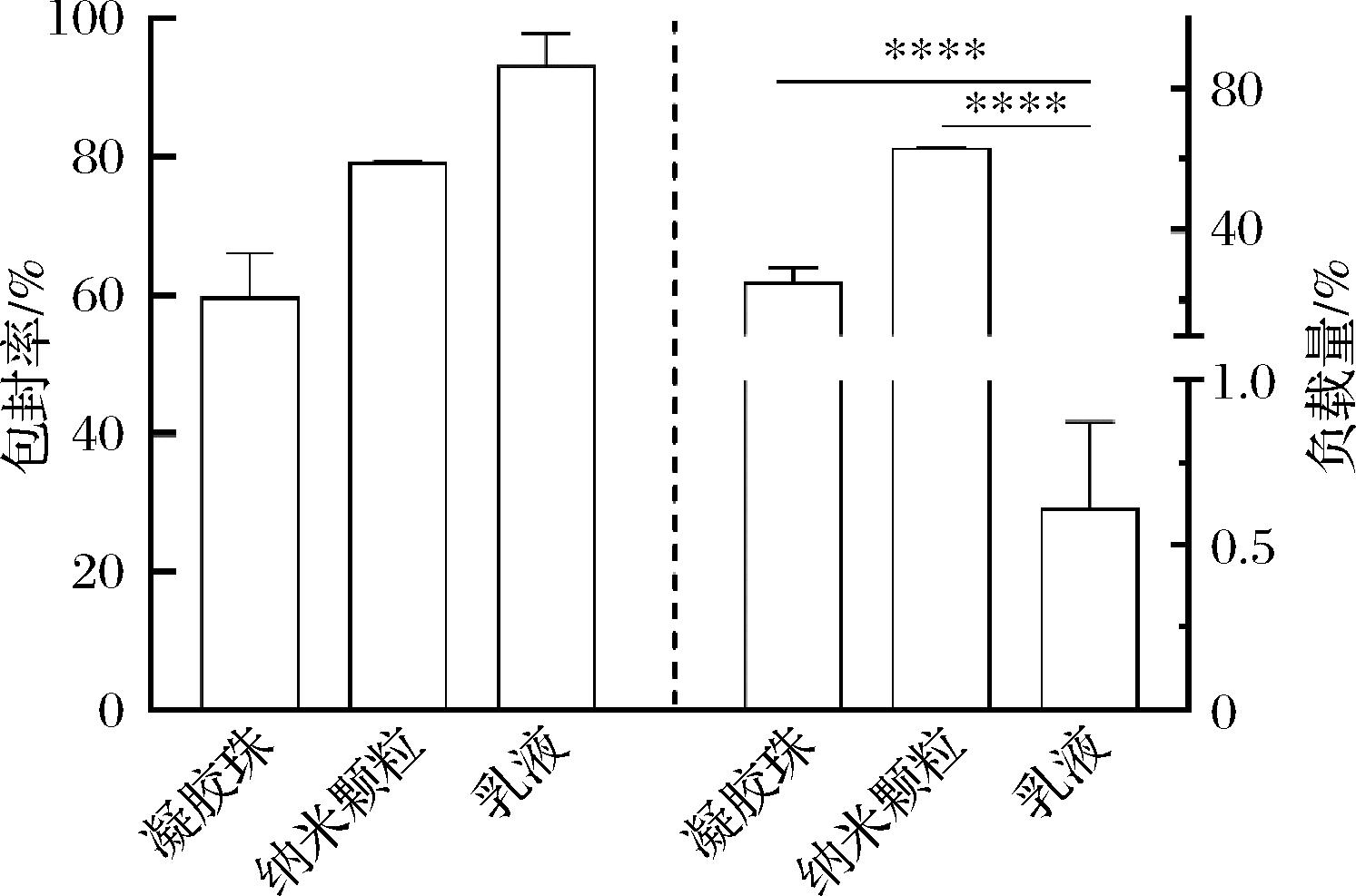
图1 食品运载体系的包封率和装载率
Fig.1 Encapsulation and loading rates of food delivery systems
注:****表示差异极显著(P<0.000 1)。
此外,由于各体系材料特性和工作机理的不同,难以比较不同食品运载体系之间的材料浓度差异对包封效果的影响。因此,本研究特别关注如何通过食品运载体系实现5-HTP的食品包埋,从而实现缓释的可能性。基于现有研究进展,对能够实现5-HTP包封所构建的3种食品运载体系,进行了包封5-HTP能力效果的横向比较,发现纳米颗粒对5-HTP显著的高负载量。
2.1.2 质构特性分析
硬度和弹性是反映凝胶珠内部结构特性的基本质构参数,持水力衡量凝胶珠的水分保持能力,三者是评估凝胶珠品质的重要指标[19]。由表1可知,凝胶珠的弹性达到约182.79,说明其能够承受一定的应力而不发生永久性变化,硬度为(159.62±14.87) g,不易发生破裂,性能较好,所制备的凝胶珠表现出优良的弹性和硬度。此外凝胶珠具有较高的持水力,说明凝胶网络与水分子之间的结合比较紧密,这有利于维持结构的稳定性。对于纳米颗粒和乳液,粒径、zeta电位及PDI是表征其质构特性的关键参数。根据表1数据显示,纳米颗粒的平均粒径约为215 nm,PDI为0.28,表明其颗粒分布均匀且稳定性良好。乳液的平均粒径则约为13.56 μm,PDI为0.47,尽管粒径较大,但较低的PDI说明乳液体系仍具备一定的稳定性。2种体系的zeta电位均为负值,这可能是由于5-HTP中的羟基(—OH)等官能团的存在,使其表面带有较多负电荷,表明5-HTP得到了有效包封。此外,纳米颗粒的zeta电位绝对值更大,意味着其表面能够吸附更多的5-HTP,这与其较高的负载量相一致,进一步说明了纳米颗粒在5-HTP包埋方面的优势。
表1 食品运载体系的质构表征
Table 1 Textural characteristics of food delivery systems

理化指标凝胶珠理化指标纳米颗粒理化指标乳液硬度/g159.62±14.87粒径/nm215.38±6.37粒径/μm13.56±0.13弹性182.79±19.53zeta电位/mV-30.28±0.15zeta电位/mV-38.15±0.04持水力/%65.36±9.29PDI0.28±0.02PDI0.47±0.05
2.1.3 微观结构分析
SEM可以对运载体系表面形貌与整体形态进行图像表征,以进一步揭示凝胶珠和纳米颗粒的包封效果及形态特征。如图2-A所示,冻干后的凝胶珠表面存在褶皱和折痕,这与水凝胶网络在固化过程中的协同作用有关[20]。同时,其表面无微孔且呈致密结构,表明制备的凝胶珠能够为包封的5-HTP提供良好的保护作用。图2-B所示为纳米颗粒的形态特征,纳米颗粒整体呈规则且均匀分布的球形,其表面具有一层皱褶状且分布不均匀的物质,这与纳米颗粒的形成过程密切相关[21]。β-环糊精的加入使得包埋5-HTP的纳米颗粒表面得以嵌合,并且在一定程度上实现了二次吸附5-HTP,这一特性有助于提高5-HTP的包封效率,也解释了纳米颗粒高负载量的原因。乳液的形态表征采用了LSCM和Cryo-SEM进行观察分析。乳液经尼罗红染色油相及尼罗蓝染色外层乳化剂后,使用LSCM观察其微观结构(图2-C),结果显示油相液滴呈规则圆形,绿色荧光与红色荧光的重叠表明形成了W/O乳液,而内部水相不发荧光则表明外部水相未渗透到内部水相,证实了W/O/W乳液的形成[22]。同时,Cryo-SEM观察(图2-D)显示,乳滴分布均匀,添加的海藻酸钠使乳液形成致密的三维网状结构[23],油滴嵌在网格内,有效阻止了油相聚集,从而提高了乳液体系的稳定性。然而,由于乳液的双层结构,5-HTP的总量相对于总壁材量较少,这也解释了乳液负载量明显低于其他两种包埋体系的原因。
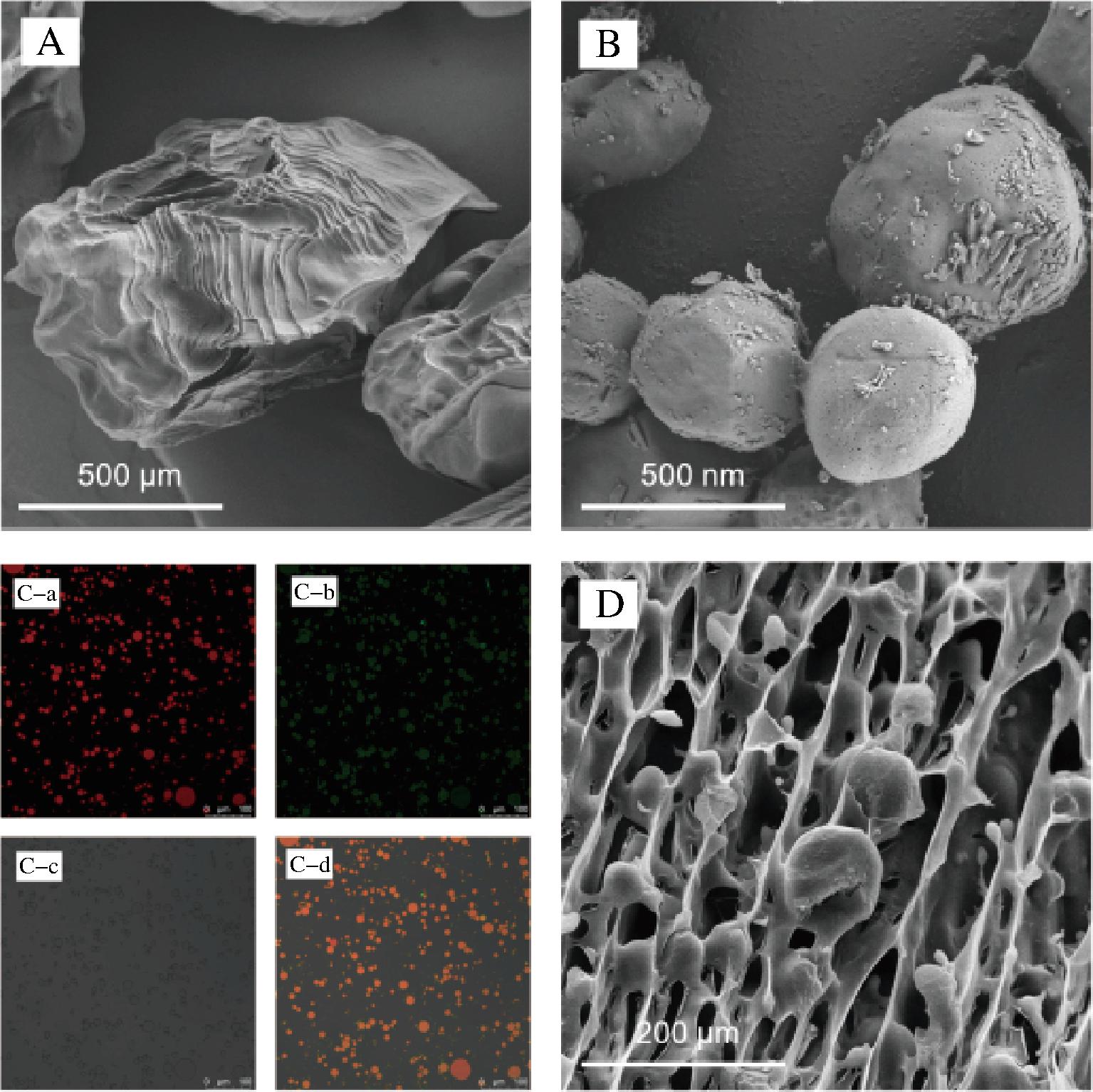
A-冻干凝胶珠的SEM图;B-冻干纳米颗粒的SEM图;C-a-乳液的尼罗红染色图;C-b-乳液的尼罗兰染色图;C-c-乳液的明场图;C-d-乳液的荧光染色和明场叠加图;D-乳液的Cryo-SEM图
图2 食品运载体系的微观结构
Fig.2 Microstructure of food delivery systems
2.2 FTIR分析
通过FTIR分析5-HTP与不同食品运载体系各组分之间的相互作用,以解析3种负载5-HTP食品运载体系的形成机制,结果如图3所示。
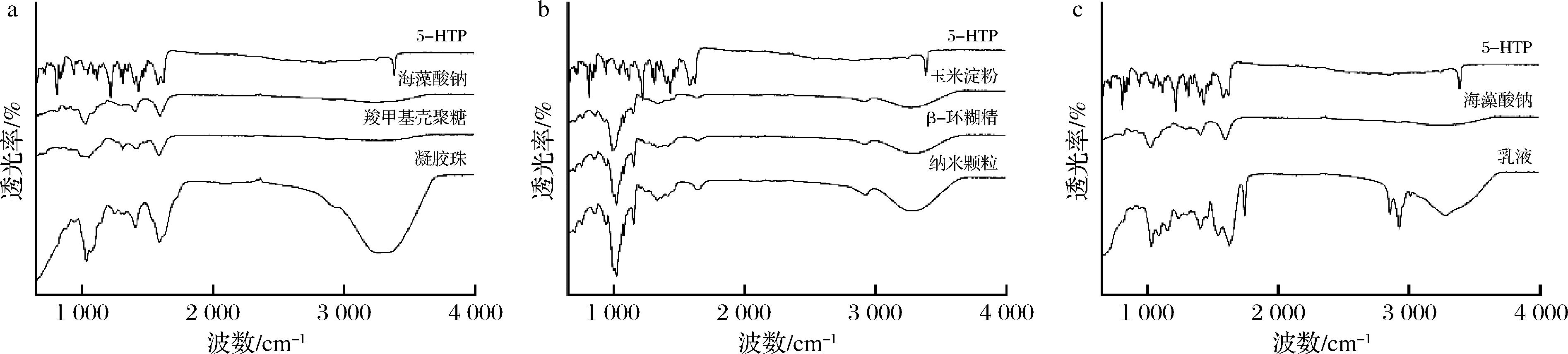
a-凝胶珠;b-纳米颗粒;c-乳液
图3 不同样品的FTIR图
Fig.3 FTIR spectra of different samples
首先,5-HTP的FTIR光谱显示,3 382 cm-1的特征峰对应于胺基(—NH2)的N—H伸缩振动,3 225 cm-1的特征峰对应于羟基(—OH)的O—H伸缩振动;此外,1 612 cm-1的吸收峰与C![]() C芳香环的振动有关,反映了5-HTP分子中的吲哚环结构。这些结果与现有研究一致[24],验证了5-HTP的分子特性。
C芳香环的振动有关,反映了5-HTP分子中的吲哚环结构。这些结果与现有研究一致[24],验证了5-HTP的分子特性。
在凝胶珠体系中,海藻酸钠和羧甲基壳聚糖作为主要壁材进行对比分析。FTIR结果显示(图3-a),3 425、3 228 cm-1处分别出现了—CH和—OH的伸缩振动峰,表明这些基团参与了凝胶珠的形成。1 734~1 724 cm-1处的特征峰对应于质子化的羧基(—COOH),进一步表明该基团可能通过与—OH基团形成氢键来稳定凝胶结构[25]。1 620 cm-1处的不对称拉伸振动峰与电离的羧基(—COO-)相关,反映了凝胶珠中存在酸性基团。此外,海藻酸钠在1 020、1 040 cm-1的C—O伸缩振动峰在凝胶珠中分别移动至1 023、1 036 cm-1;羧甲基壳聚糖在1 573、1 070 cm-1的峰也分别移动至1 579、1 080 cm-1。这些峰的移动表明,在凝胶珠的形成过程中,2种聚合物与5-HTP之间存在显著的分子相互作用,尤其是氢键作用在促进负载5-HTP凝胶珠的形成和稳定中起到了关键作用。
在纳米颗粒体系中(图3-b),通过FTIR光谱对玉米淀粉、β-环糊精、5-HTP和纳米颗粒的相互作用进行了比较研究。结果显示,玉米淀粉、β-环糊精和纳米颗粒中—OH的伸缩振动峰分别出现在3 328、3 334、3 325 cm-1附近,这些峰位的微小差异表明在纳米颗粒形成过程中,—OH基团参与了氢键的形成,促进了分子间和分子内的相互作用[26]。纳米颗粒中—OH吸收峰的轻微位移至3 325 cm-1,以及透光率的增加,可能反映了氢键网络的增强[27]。此外,2 831 cm-1处的C—H伸缩振动峰在玉米淀粉和β-环糊精中出现,而在5-HTP中未见此峰,表明这些振动主要源于淀粉和β-环糊精,并在纳米颗粒中得以保留,说明5-HTP在纳米颗粒的形成过程中得到了有效的包封。玉米淀粉和β-环糊精的C![]() O吸收峰分别出现在1 619、1 620 cm-1,而在纳米颗粒中,该峰略微移动至1 622 cm-1,提示在包埋过程中,5-HTP的C
O吸收峰分别出现在1 619、1 620 cm-1,而在纳米颗粒中,该峰略微移动至1 622 cm-1,提示在包埋过程中,5-HTP的C![]() O基团与玉米淀粉和β-环糊精之间可能存在氢键或范德华力等相互作用。此外,1 029 cm-1处的C—O伸缩振动峰在β-环糊精和纳米颗粒中出现,但在纳米颗粒中峰值移动至1 026 cm-1,这表明该峰主要由β-环糊精提供,并且在纳米颗粒中通过物理包裹或弱的非共价相互作用保持其原有的化学结构。基于FTIR分析,5-HTP被有效地包埋在由玉米淀粉和β-环糊精制备的纳米颗粒中,氢键和其他弱相互作用(如范德华力)在纳米颗粒的形成和稳定中发挥了至关重要的作用,从而确保了5-HTP的高效包封和稳定性。
O基团与玉米淀粉和β-环糊精之间可能存在氢键或范德华力等相互作用。此外,1 029 cm-1处的C—O伸缩振动峰在β-环糊精和纳米颗粒中出现,但在纳米颗粒中峰值移动至1 026 cm-1,这表明该峰主要由β-环糊精提供,并且在纳米颗粒中通过物理包裹或弱的非共价相互作用保持其原有的化学结构。基于FTIR分析,5-HTP被有效地包埋在由玉米淀粉和β-环糊精制备的纳米颗粒中,氢键和其他弱相互作用(如范德华力)在纳米颗粒的形成和稳定中发挥了至关重要的作用,从而确保了5-HTP的高效包封和稳定性。
在乳液体系中(图3-c),通过FTIR光谱可以观察到—OH伸缩振动吸收峰的位移,乳液中的—OH峰移动至3 299 cm-1,相较于海藻酸钠和5-HTP光谱中的位置有所变化,这表明氢键在乳液的形成过程中发挥了重要作用[28]。同时,乳液中的2 920 cm-1峰值强度显著增加,反映了乳化剂海藻酸钠的结构在乳液体系中得到了保持。C![]() O吸收峰在海藻酸钠的光谱中出现在1 599 cm-1,5-HTP出现在1 615、1 569 cm-1,而在乳液中,C
O吸收峰在海藻酸钠的光谱中出现在1 599 cm-1,5-HTP出现在1 615、1 569 cm-1,而在乳液中,C![]() O吸收峰出现在1 612、1 579 cm-1,并且发生了一定程度的位移,表明5-HTP的这些基团在乳液中得到了有效保留,可能是由于与海藻酸钠的C
O吸收峰出现在1 612、1 579 cm-1,并且发生了一定程度的位移,表明5-HTP的这些基团在乳液中得到了有效保留,可能是由于与海藻酸钠的C![]() O基团存在相互作用。1 040 cm-1处的C—O伸缩振动峰在海藻酸钠光谱中出现,而在乳液中则移动至1 019 cm-1,这一峰的移动表明,乳液形成过程中C—O键的化学结构基本得以保持,主要通过物理包裹或弱的非共价相互作用与其他组分结合。综上所述,结合FTIR分析结果,包封5-HTP的双层乳液得以成功形成,氢键及其他弱相互作用(如范德华力)在乳液的形成和稳定性中发挥了关键作用。
O基团存在相互作用。1 040 cm-1处的C—O伸缩振动峰在海藻酸钠光谱中出现,而在乳液中则移动至1 019 cm-1,这一峰的移动表明,乳液形成过程中C—O键的化学结构基本得以保持,主要通过物理包裹或弱的非共价相互作用与其他组分结合。综上所述,结合FTIR分析结果,包封5-HTP的双层乳液得以成功形成,氢键及其他弱相互作用(如范德华力)在乳液的形成和稳定性中发挥了关键作用。
2.3 稳定性分析
2.3.1 凝胶珠的溶胀性分析
凝胶珠的溶胀性在其胃肠道中递送和释放包封物质的过程中起着关键作用,并对其整体稳定性产生重要影响[29]。为评估水凝胶珠的溶胀性能,本研究在模拟胃肠道pH值的最低值(pH=2)和最高值(pH=8)范围内条件下,测定了其溶胀比,结果如图4所示。
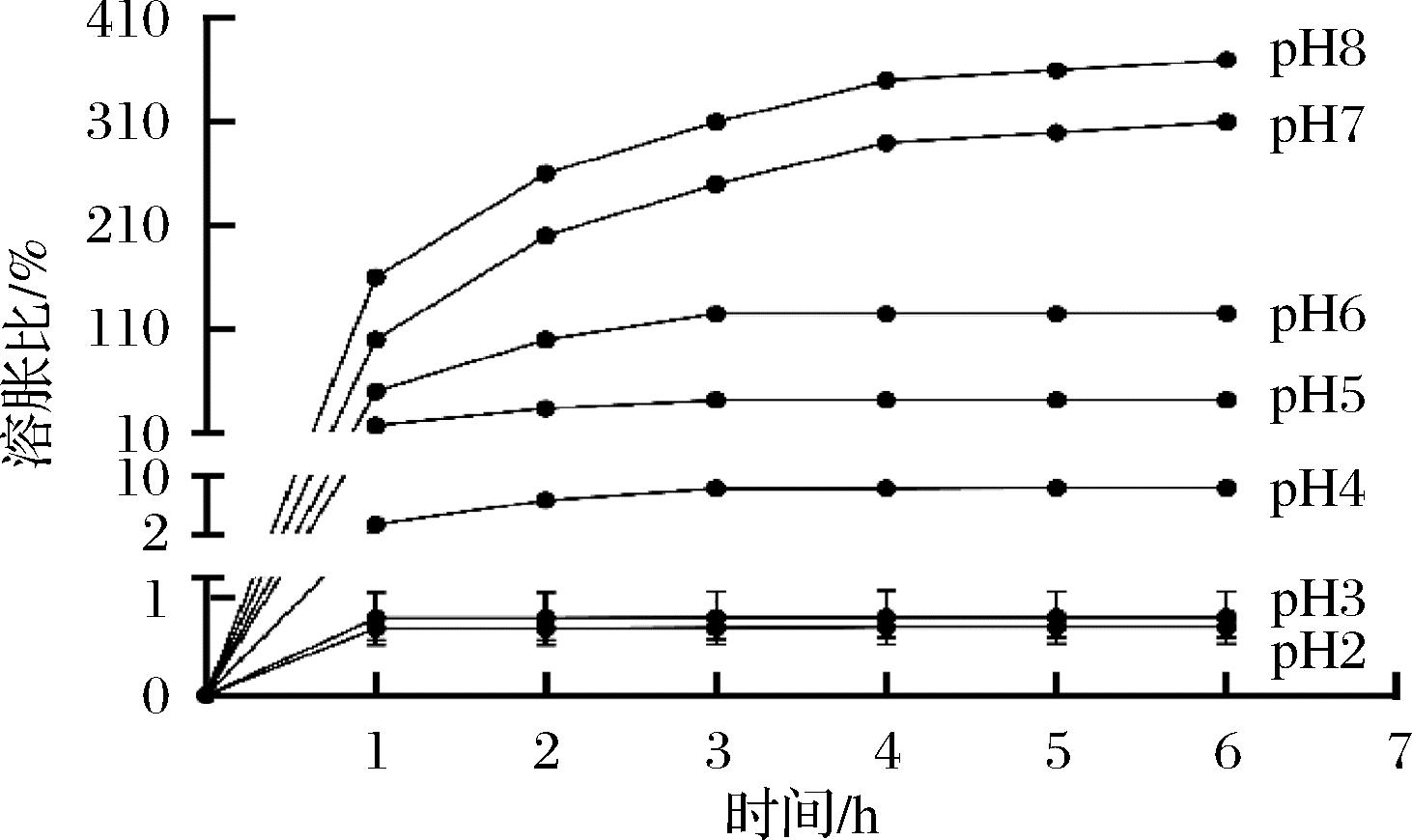
图4 凝胶珠的溶胀度随pH和时间的变化
Fig.4 Swelling degree of the gel beads varies with pH and time
溶胀初期,各pH条件下的水凝胶珠均表现出快速吸水现象,溶胀比迅速增加。然而,溶胀比的增长幅度因pH值不同而异,随着时间的推移,溶胀行为逐渐显现出差异化趋势。在pH=2和pH=3的强酸性条件下,水凝胶珠的溶胀比几乎无显著变化,始终维持在1%以下。这表明在强酸性环境中,水凝胶珠的吸水能力受到严重抑制,推测认为,在低pH条件下,凝胶内的羧基等酸性基团未能充分电离,同时海藻酸钠和羧甲基壳聚糖2种聚合物与柠檬酸之间发生强相互作用,包括—COOH和—OH基团之间的氢键,以及—NH3+和—COO-基团之间的静电相互作用,导致水凝胶网络结构紧密,从而限制了水分子的进入。
相比之下,在pH=4、pH=5和pH=6的条件下,水凝胶珠的溶胀比虽然有所提升,但整体仍然相对较低,最终趋于10%~100%。这表明在这些pH条件下,水凝胶珠的吸水能力有所增强,且随pH值的升高更加显著,由于部分羧基基团电离,导致凝胶网络结构发生一定程度的膨胀。在pH=7和pH=8的中性及弱碱性环境中,水凝胶珠的溶胀比显著高于其他pH条件,最终稳定在约300%左右,这说明在较高pH值下,羧基基团逐渐电离为—COO-,引发静电排斥效应,导致水凝胶网络结构松散,从而允许更多的水分子进入凝胶网络。
以上结果表明,不同pH条件对水凝胶珠的溶胀性能具有显著影响,溶胀比随pH值的升高而增加,尤其在中性及弱碱性条件下表现最佳。这说明通过海藻酸钠和羧甲基壳聚糖制备的凝胶珠具有良好的pH敏感性,能够有效防止包封的5-HTP在酸性环境中过早释放。
2.3.2 纳米颗粒和乳液的稳定性分析
图5展示了纳米颗粒和乳液在不同pH值及NaCl浓度下的粒径、zeta电位与PDI的变化情况。通过这些参数的测定,可以全面评估2种食品运载体系的稳定性[30]。

a-不同pH值下粒径;b-不同pH值下zeta电位;c-不同pH值下PDI;d-不同NaCl浓度下的粒径;e-不同NaCl浓度下zeta电位;f-不同NaCl浓度下PDI
图5 纳米颗粒和乳液的粒径、zeta电位和PDI随离子强度和pH的变化
Fig.5 Particle size, zeta potential, and PDI of nanoparticles and emulsions as a function of ionic strength and pH
由图5-a可见,随着pH值从2升高至8,纳米颗粒和乳液的粒径总体呈现出先保持相对稳定、后逐渐增大的趋势。尤其是在pH=8时,粒径显著增大,表明在碱性环境中,颗粒更易聚集,从而导致粒径增加。zeta电位作为衡量颗粒表面电荷的关键指标,其绝对值越高,体系越稳定。不同pH条件下,纳米颗粒和乳液的zeta电位变化趋势相似(图5-b)。在pH 2~3的范围内,zeta电位显示出较高的正值,而在pH=4时,zeta电位由正转负,并随着pH值的进一步上升,zeta电位的绝对值逐渐增大,这表明在碱性条件下,体系的稳定性有所降低。此外,在不同pH条件下,纳米颗粒和乳液的PDI均保持在0.4左右,表明体系在这些条件下具有良好的分散性,粒径分布较为均匀(图5-c)。尽管pH对PDI的影响不大,但在极端酸性(pH=2)和碱性(pH=8)条件下,PDI略有上升,表明在这些条件下存在轻微的颗粒聚集或分散不均现象。
在离子强度方面,随着NaCl浓度从0升高至2 000 mmol/L,乳液的粒径显著增大,而纳米颗粒的粒径则相对稳定,平均粒径仅略有增加(图5-d)。这是由于高离子强度下,乳液体系的电荷屏蔽效应增强,导致颗粒间的静电排斥力减弱,从而更易聚集。在低盐浓度(0~100 mmol/L)下,纳米颗粒和乳液的zeta电位绝对值较高,表明体系具有较好的稳定性。然而,随着NaCl浓度的增加,zeta电位的绝对值逐渐减小,甚至接近零,表明在高离子强度下,体系的电稳定性显著降低。在不同NaCl浓度下,纳米颗粒和乳液的PDI仍保持在0.4左右,显示出体系的分散性仍然较为稳定。然而,当NaCl浓度超过100 mmol/L时,乳液体系的PDI略有上升,说明高离子强度会导致体系部分聚集或分散不均的现象。
结果表明,纳米颗粒和乳液的稳定性受到pH值和离子强度的显著影响。在高pH值和高盐浓度条件下,粒径增大,zeta电位绝对值降低,表明体系的稳定性减弱。相较之下,低pH值和低盐浓度条件下,体系表现出更佳的稳定性。
2.4 胃肠消化模拟动力学分析
体外模拟消化实验用于评估不同食品运载体系中5-HTP的释放行为,以及其在pH响应和靶向递送方面的特性。
如图6所示,在胃液(pH=3.0)中,乳液体系中的5-HTP释放迅速,2 h内释放率达到44.01%~44.65%,表明乳液体系在缓释效果上的优势有限。相较之下,凝胶珠体系中5-HTP的释放总量始终低于10%,这主要归因于凝胶珠在酸性条件下的溶胀能力较弱,导致5-HTP难以逸出,从而在胃液中实现了对5-HTP的有效保留。尽管凝胶珠体系具备良好的靶向递送性,但其在改善5-HTP短半衰期方面的作用并不显著。相比之下,纳米颗粒体系不仅能够抵抗胃液环境并有效保护5-HTP,还表现出较为缓慢的释放速率。2 h后,纳米颗粒包封的5-HTP在胃环境中的释放率为(19.27±0.58)%,显著提高了5-HTP的稳定性,并有效抑制了其在胃环境中的释放。这表明,玉米淀粉与β-环糊精对低pH环境及胃蛋白酶消化具有较强的抵抗能力。
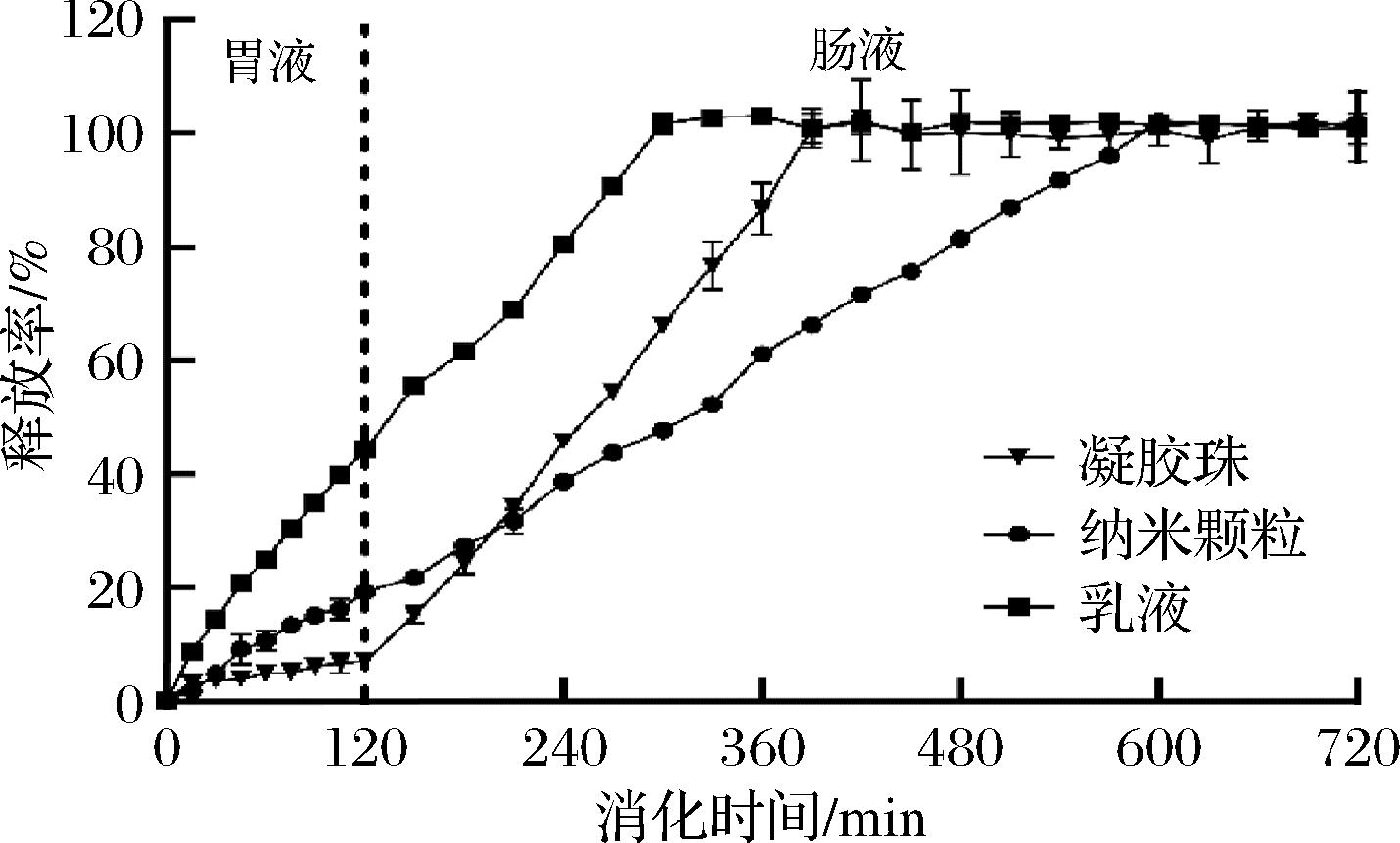
图6 食品运载体系中的5-HTP在模拟胃肠条件下的释放率
Fig.6 Release rate of 5-HTP in food delivery system under simulated gastrointestinal conditions
在进入肠液(120 min后,pH=7.4)后,凝胶珠体系的5-HTP释放速率显著增加。经过4.5 h的肠液模拟消化后,5-HTP几乎完全释放。这是因为在弱碱性环境中,凝胶珠的羧基发生电离[31],导致水凝胶网络的膨胀增加,从而加速了5-HTP的释放。这表明,凝胶珠运载体系虽具备肠道靶向和缓释递送的潜力,但其缓释效果仍不理想。乳液包封的5-HTP在肠液中3 h内完全释放,进一步表明乳液体系并不适用于实现缓释效果。相较而言,玉米淀粉和β-环糊精构建的纳米颗粒包封5-HTP表现出卓越的缓释效果和靶向递送特性。实验结果显示,纳米颗粒体系的整体释放速率较为稳定,在模拟肠液中孵育8 h后,5-HTP完全释放,比凝胶珠的持续释放时间延长了近1倍,比乳液的释放时间长近3倍。这说明纳米颗粒递送的5-HTP在肠道中能够实现有效传递,并具备优异的缓释效果,直至完全释放。
图6清晰展示了不同运载体系在模拟胃肠条件下5-HTP释放效果的显著差异。水凝胶珠在酸性环境中表现出较强的5-HTP保留能力,适合用于防止5-HTP在早期胃液环境中的释放。而乳液体系由于整体释放率较高,不适合作为靶向递送和缓释递送体系。相比之下,纳米颗粒体系在持续释放和肠道靶向递送方面表现更佳,使5-HTP在胃肠道中逐步释放,从而提供更持久的功能效果。这些结果表明,通过合理选择运载体系,可显著提高5-HTP的生物利用度和缓释效果,进而更好地发挥其生物活性。
此研究中,虽未直接观测不同食品运载体系在模拟胃肠环境中的降解或变化情况,但通过检测胃肠消化液中不同时间点的5-HTP含量,计算5-HTP释放率,进而间接表征5-HTP的释放动力学。以往的研究中也指出,不同食品运载体系在模拟胃肠环境中确实会随时间发生不同程度的变化,这些变化对被包封物质的释放产生影响[32]。因此,我们推测不同食品运载体系在胃肠道消化过程中所发生的变化同样也会对5-HTP的释放动力学产生一定影响。后续会继续对此进行深入研究,探究不同食品运载体系在模拟胃肠环境中的降解或变化情况如何具体影响5-HTP的释放动力学。
3 结论
本研究对凝胶珠、纳米颗粒和乳液3种食品运载体系进行体外模拟消化实验,并通过多种表征方法对其包封效果、作用机制、稳定性和释放行为进行了深入分析,评估了不同食品运载体系对5-HTP的缓释效果。首先,通过包封能力和作用机制分析,证实了凝胶珠、纳米颗粒和乳液3种体系均能够有效包封5-HTP,其中纳米颗粒表现出最高的负载量;通过对红外光谱和微观结构的分析,揭示了运载体系内的分子相互作用和形态特征,为深入了解5-HTP的包封机制提供了科学依据。其次,3种体系均提供了良好的物理和化学稳定性,凝胶珠在溶胀性测试中表现出优异的吸水性,而纳米颗粒和乳液体系则展现了较强的环境适应性和储存稳定性。最后,体外模拟消化实验结果表明,纳米颗粒体系显著延缓了5-HTP的释放速度,展现出优异的缓释效果,表明其在体内具有延迟释放和提高生物利用度的潜在优势,相比之下,乳液和凝胶珠体系在缓释时间上不及纳米颗粒。
该研究从缓释制剂的角度,为改善5-HTP的代谢动力学提供了新的思路,并为进一步优化5-HTP的食品载体设计奠定了理论基础。未来可进一步探究新型的5-HTP包埋材料及优化不同运载体系的制备工艺,以提高其对5-HTP的包封效率及缓释能力。
[1] MAFFEI M E.5-hydroxytryptophan (5-HTP):Natural occurrence, analysis, biosynthesis, biotechnology, physiology and toxicology[J].International Journal of Molecular Sciences, 2020, 22(1):181.
[2] DAS Y T, BAGCHI M, BAGCHI D, et al.Safety of 5-hydroxy-L-tryptophan[J].Toxicology Letters, 2004, 150(1):111-122.
[3] SHAW K, TURNER J, DEL MAR C.Tryptophan and 5-hydroxytryptophan for depression[J].Cochrane Database of Systematic Reviews, 2002(1):CD003198.
[4] SUTANTO C N, XIA X J, HENG C W, et al.The impact of 5-hydroxytryptophan supplementation on sleep quality and gut microbiota composition in older adults:A randomized controlled trial[J].Clinical Nutrition, 2024, 43(3):593-602.
[5] PEREZ C I, KALYANASUNDAR B, MORENO M G, et al.The triple combination phentermine plus 5-HTP/carbidopa leads to greater weight loss, with fewer psychomotor side effects than each drug alone[J].Frontiers in Pharmacology, 2019, 10:1327.
[6] JACOBSEN J P R, KRYSTAL A D, KRISHNAN K R R, et al.Adjunctive 5-hydroxytryptophan slow-release for treatment-resistant depression:Clinical and preclinical rationale[J].Trends in Pharmacological Sciences, 2016, 37(11):933-944.
[7] VAN VLIET I M, SLAAP B R, WESTENBERG H G M, et al.Behavioral, neuroendocrine and biochemical effects of different doses of 5-HTP in panic disorder[J].European Neuropsychopharmacology, 1996, 6(2):103-110.
[8] ADITYA N P, ESPINOSA Y G, NORTON I T.Encapsulation systems for the delivery of hydrophilic nutraceuticals:Food application[J].Biotechnology Advances, 2017, 35(4):450-457.
[9] XUE J Y, BLESSO C, LUO Y C.A comprehensive review of nanoparticles for oral delivery in food:Biological fate, evaluation models, and gut microbiota influences[J].Annual Review of Food Science and Technology, 2023, 14:1-33.
[10] ALISHAHIA, MIRVAGHEFI A, TEHRANI M R, et al.Shelf life and delivery enhancement of vitamin C using chitosan nanoparticles[J].Food Chemistry, 2011, 126(3):935-940.
[11] LI H C, SONG J L, LIU C Y, et al.Corn starch/β-Cyclodextrin composite nanoparticles for encapsulation of tea polyphenol and development of oral targeted delivery systems with pH-responsive properties[J].Food Hydrocolloids, 2024, 151:109823.
[12] SMANIOTTO F, ZAFEIRI I, PROSAPIO V, et al.Understanding the encapsulation and release of small molecular weight model actives from alginate fluid gels[J].Food Structure, 2021, 27:100179.
[13] TANAKA H, MATSUMURA M, VELIKY I A.Diffusion characteristics of substrates in Ca-alginate gel beads[J].Biotechnology and Bioengineering, 1984, 26(1):53-58.
[14] LOW L E, SIVA S P, HO Y K, et al.Recent advances of characterization techniques for the formation, physical properties and stability of Pickering emulsion[J].Advances in Colloid and Interface Science, 2020, 277:102117.
[15] LIN D Q, KELLY A L, MIAO S.Preparation, structure-property relationships and applications of different emulsion gels:Bulk emulsion gels, emulsion gel particles, and fluid emulsion gels[J].Trends in Food Science &Technology, 2020, 102:123-137.
[16] XU Z, ZHANG X Y, WU X X, et al.Co-delivery of vitamin C and β-carotene in W/O/W emulsions stabilized by modified aggregated insoluble soybean protein hydrolysate-xanthan gum complexes[J].International Journal of Biological Macromolecules, 2024, 261:129855.
[17] 厉佳怡, 王红磊, 李娅婕, 等.壳聚糖-透明质酸钠-益生菌水凝胶的制备、表征及胃肠道缓释作用[J].食品科学, 2024, 45(9):36-43.LI J Y, WANG H L, LI Y J, et al.Preparation and characterization of chitosan-sodium hyaluronate-probiotic hydrogels and its sustained-release performance in simulated gastrointestinal tract conditions[J].Food Science, 2024, 45(9):36-43.
[18] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14(4):991-1014.
[19] 李鲁, 鲍穗, 张李明, 等.卡拉胶-魔芋胶复合凝胶基香精微胶囊的制备与表征[J].化工进展, 2022, 41(S1):376-381.LI L, BAO S, ZHANG L M, et al.Preparation and characterization of carrageenan-konjac gum hybrid gel for encapsulating fragrance[J].Chemical Industry and Engineering Progress, 2022, 41(S1):376-381.
[20] TAKKA S, GÜREL A.Evaluation of chitosan/alginate beads using experimental design:Formulation and in vitro characterization[J].AAPS PharmSciTech, 2010, 11(1):460-466.
[21] LIU Y W, QIU C, LI X J, et al.Application of starch-based nanoparticles and cyclodextrin for prebiotics delivery and controlled glucose release in the human gut:A review[J].Critical Reviews in Food Science and Nutrition, 2023, 63(23):6126-6137.
[22] HAN L, LU K Y, ZHOU S J, et al.Co-delivery of insulin and quercetin in W/O/W double emulsions stabilized by different hydrophilic emulsifiers[J].Food Chemistry, 2022, 369:130918.
[23] JIANG Z W, TIAN J Q, BAI X Q, et al.Improving probiotic survival using water-in-oil-in-water (W1/O/W2) emulsions:Role of fish oil in inner phase and sodium alginate in outer phase[J].Food Chemistry, 2023, 417:135889.
[24] 聂利芳. 从加纳籽中提取, 分离纯化5-羟基色氨酸的工艺研究[D].西安:西北大学, 2009.NIE L F.Extraction, separation and purification of 5-hydroxytrophan from Griffonia simplicifolia[D].Xi’an:Northwest University, 2009.
[25] METIN A Ü, DO AN D, CAN M.Novel magnetic gel beads based on ionically crosslinked sodium alginate and polyanetholesulfonic acid:Synthesis and application for adsorption of cationic dyes[J].Materials Chemistry and Physics, 2020, 256:123659.
AN D, CAN M.Novel magnetic gel beads based on ionically crosslinked sodium alginate and polyanetholesulfonic acid:Synthesis and application for adsorption of cationic dyes[J].Materials Chemistry and Physics, 2020, 256:123659.
[26] ZENG J, LI G L, GAO H Y, et al.Comparison of A and B starch granules from three wheat varieties[J].Molecules, 2011, 16(12):10570-10591.
[27] SHAHIDI F, PAN Y.Influence of food matrix and food processing on the chemical interaction and bioaccessibility of dietary phytochemicals:A review[J].Critical Reviews in Food Science and Nutrition, 2022, 62(23):6421-6445.
[28] JIANG Y H, CHENG J H, SUN D W.Effects of plasma chemistry on the interfacial performance of protein and polysaccharide in emulsion[J].Trends in Food Science &Technology, 2020, 98:129-139.
[29] MI F L, LIANG H F, WU Y C, et al.pH-sensitive behavior of two-component hydrogels composed of N, O-carboxymethyl chitosan and alginate[J].Journal of Biomaterials Science, Polymer Edition, 2005, 16(11):1333-1345.
[30] HU K, MCCLEMENTS D J.Fabrication of biopolymer nanoparticles by antisolvent precipitation and electrostatic deposition:Zein-alginate core/shell nanoparticles[J].Food Hydrocolloids, 2015, 44:101-108.
[31] LIN Y H, LIANG H F, CHUNG C K, et al.Physically crosslinked alginate/N, O-carboxymethyl chitosan hydrogels with calcium for oral delivery of protein drugs[J].Biomaterials, 2005, 26(14):2105-2113.
[32] OIDTMANN J, SCHANTZ M, M DER K, et al.Preparation and comparative release characteristics of three anthocyanin encapsulation systems[J].Journal of Agricultural and Food Chemistry, 2012, 60(3):844-851.
DER K, et al.Preparation and comparative release characteristics of three anthocyanin encapsulation systems[J].Journal of Agricultural and Food Chemistry, 2012, 60(3):844-851.