辅酶Q10是一种内源性抗氧化剂,存在于人类和其他哺乳动物的细胞膜中。然而,辅酶Q10在人体内的合成量与年龄增长成反比,当水平降低到25%时,将不足以满足人类的需求,易出现高血压、心血管等慢性疾病[1-2]。因此,辅酶Q10作为膳食补充剂对维持人体健康非常重要。但其较差的水溶性和口服生物利用度使其应用受到极大限制[3]。
迄今为止,很多研究利用食品级材料(蛋白质、多糖、脂质等)制备纳米粒子、乳液、脂质体等递送体系改善辅酶Q10的水溶性和口服生物利用度[4-6]。其中,纳米粒子由于其纳米级尺寸具有较高的物理稳定性、对芯材有效的封装和保护等优势,被认为是最有前途的策略之一[7]。然而纳米粒子的制备工艺较为复杂,过程中往往还会涉及到有机试剂的使用,会造成潜在的安全问题。而高压均质技术作为一种新兴的、低能耗的绿色技术。在均质化过程中,样品被迫通过间隙,导致能量转换,进而影响组分的溶解和分散。目前均质化技术主要用于制备乳液,减小油滴的尺寸并进一步提高乳液的稳定性[8]。基于此,高压均质技术在制备纳米粒子方面具有巨大的潜力。
酪蛋白酸钠源自胶束酪蛋白,由4种蛋白(αs1、αs2、β和κ-酪蛋白)组成,具有较好的乳化性能,常被用于稳定乳液。然而在食品应用中它们对环境中pH的高度敏感,限制了其应用。当pH值低于和高于等电点时,酪蛋白酸钠分别具有正电荷和负电荷,体系较为稳定;而在接近等电点(pI=4.6)时,酪蛋白酸钠由于净电荷接近于零,静电排斥力下降,易发生絮凝现象[9]。海藻酸钠是从棕色海藻中提取的一种水溶性阴离子多糖,通常对环境条件(包括pH、离子强度和热处理等)具有更高的稳定性[10]。海藻酸钠也被用于增强玉米醇溶蛋白/酪蛋白酸钠纳米颗粒的理化稳定性[11]。
辅酶Q10的熔点约为50 ℃,在加热过程中可以实现其由晶体向非晶体的转变以及在酪蛋白酸钠/海藻酸钠混合溶液中的溶解。因此,本研究拟通过热驱动结合高压均质技术制备负载辅酶Q10的酪蛋白酸钠/海藻酸钠基纳米粒子,并探究酪蛋白酸钠/海藻酸钠不同比例对辅酶Q10纳米粒子的粒径、多分散性指数(polydispersity index,PDI)、电位、包封率和微观结构等的影响,进一步考察以最佳比例制备辅酶Q10纳米粒子的环境稳定性和模拟体外消化后辅酶Q10的生物可接受率,为新型辅酶Q10膳食补充粉剂的制备提供理论依据和技术支撑。
1 材料与方法
1.1 材料与试剂
辅酶Q10,浙江天草生物科技股份有限公司;海藻酸钠、酪蛋白酸钠、猪黏液蛋白(M2378)、胃蛋白酶(P7125,≥400 U/mg蛋白质)、胰酶(P1750,4×USP 98规范)、脂肪酶(L3126,100~500 U/mg蛋白质),美国Sigma-Aldrich公司;牛胆盐(B8210),北京索莱宝科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
AH-Pilot高压均质机,安拓思纳米技术(苏州)有限公司;HCJ-4A恒温水浴锅,江苏东鹏仪器制造有限公司;HT 7800透射电镜,日立高新技术集团有限公司;Zetasizer Nano ZS纳米粒度仪,英国Malvern Instruments公司;827台式pH计,瑞士Metrohm公司;1260高效液相色谱仪,美国Agilent公司。
1.3 试验方法
1.3.1 载辅酶Q10酪蛋白酸钠/海藻酸钠基纳米粒子的制备
称取1.0 g酪蛋白酸钠和1.0 g海藻酸钠分别溶解于100 g蒸馏水中,制得酪蛋白酸钠溶液(1.0%,质量分数)和海藻酸钠溶液(1.0%,质量分数),置于4 ℃冰箱中备用。将酪蛋白酸钠溶液和海藻酸钠溶液分别按3∶0、2∶1、1∶1、1∶2、0∶3的质量比混合后置于75 ℃水浴锅中,加入辅酶Q10粉末(0.1%,质量分数),600 r/min搅拌15 min至均一的状态后,在90 MPa的条件下进行2次高压均质处理,即可得到载辅酶Q10酪蛋白酸钠/海藻酸钠基纳米粒子。根据酪蛋白酸钠溶液和海藻酸钠溶液不同的质量比例,将其分别命名为L、L∶H=2∶1、L∶H=1∶1、L∶H=1∶2、H。
1.3.2 表观和微观结构分析
利用相机记录载辅酶Q10酪蛋白酸钠/海藻酸钠基纳米粒子的初始外观。
使用透射电镜对样品的微观结构进行观察[12]。先取10 μL样品滴加在铜网上沉淀1 min后用滤纸吸去多余的液体。将10 μL 3%(质量分数)磷钨酸盐染料滴加于铜网上沉淀1 min后用滤纸吸去浮液。常温干燥数分钟后在80~120 kV条件下进行电镜检测成像,获得透射电镜成像结果。
1.3.3 粒径、PDI和电位分析
取0.1 mL纳米粒子样品,用5 mL相同pH的去离子水进行稀释,在室温(25 ℃)条件下使用纳米粒度仪对其粒径、PDI和电位进行测定。
1.3.4 包封率分析
精密称取2 g纳米粒子,加入2 mL正己烷振荡萃取未包封的辅酶Q10,10 000 r/min离心10 min后吸取上层正己烷定容至5 mL,过0.45 μm滤膜处理后通过高效液相色谱仪对辅酶Q10的含量进行测定[6],具体参数:色谱柱为C18柱;流动相为甲醇∶无水乙醇=50∶50(体积比);流速1.2 mL/min;检测波长275 nm;柱温35 ℃;进样量10 μL。
载辅酶Q10纳米粒子包封率按公式(1)计算:
包封率![]()
(1)
式中:m初始,初始添加的辅酶Q10质量,mg;m未包封,未包封的辅酶Q10质量,mg。
1.3.5 稳定性分析
1.3.5.1 pH稳定性
考察了不同pH(3~7)对纳米粒子表观和粒径的影响。通过添加不同量的HCl或NaOH溶液调整pH值。将不同pH的样品室温(25 ℃)平衡1 h后,通过相机和透射电镜记录纳米粒子的外观和微观结构变化,并使用纳米粒度仪对其粒径进行测定。
1.3.5.2 热稳定性
考察了热处理对纳米粒子表观和粒径的影响。将纳米粒子在95 ℃下保持30 min,然后冷却至室温(25 ℃)。通过相机和透射电镜记录热处理前后样品的视觉外观和微观结构变化,并使用纳米粒度仪对其粒径进行测定。
1.3.6 模拟体外消化
根据先前研究中报道的模拟胃肠道模型评估辅酶Q10的生物可接受率并配制模拟口腔液(simulated saliva fluid,SSF)、模拟胃液(simulated gastric fluid,SGF)和模拟肠液(simulated intestinal fluid,SIF)[13]。其中SSF由1.594 mg/mL NaCl,0.328 mg/mL NH4NO3,0.202 mg/mL KCl,0.636 mg/mL KH2PO4,0.308 mg/mL柠檬酸钾,0.021 mg/mL尿酸二氢钠,0.198 mg/mL尿素,0.146 mg/mL乳酸钠盐以及3 mg/mL猪黏液蛋白组成;SGF通过在1 L超纯水中添加2 g NaCl,7 mL 12 mol/L的盐酸和3.2 g胃蛋白酶来制备,并使用1.0 mol/L盐酸将其pH调节至1.2;SIF通过在100 mL超纯水中添加3.67 g CaCl2·2H2O和21.87 g NaCl来制备。在实验过程中,所有溶液均需保持在37 ℃。
a)模拟口腔消化
取7.5 g样品与7.5 mL SSF混合。将其pH值调至6.8后立即在37 ℃、100 r/min条件下孵育10 min。
b)模拟胃消化
将模拟口腔消化后的样品与SGF按1∶1混合,使用NaOH溶液将样品的pH调至2,并在37 ℃、100 r/min条件下孵育2 h。
c)模拟小肠消化
首先用NaOH溶液将模拟胃消化阶段后的样品pH调至7,分别加入2.5 mL脂肪酶(4.8 mg/mL)、2.5 mL胰酶(4.8 mg/mL)、3.5 mL牛胆盐(5 mg/mL)和1.5 mL SIF。并利用低浓度NaOH溶液使其在小肠消化2 h内pH恒定为7.0。
d)辅酶Q10消化稳定性及生物可接受率测定
模拟小肠消化结束后,将消化瓶直接置于冰水浴中10~15 min。随后边搅拌边取部分消化液在4 ℃条件下以15 000 r/min离心30 min,分离中间的胶束层并吸取1 mL,加入1 mL乙醇振荡均匀,再加入5 mL正己烷萃取其中的辅酶Q10,10 000 r/min离心10 min后吸取上清液过0.45 μm滤膜至液相瓶中进行检测,具体参数同1.3.4节。辅酶Q10的消化稳定性及生物可接受率的计算如公式(2)、公式(3)所示:
消化稳定性/%=100×ρDigesta/ρInitial
(2)
生物可接受率/%=100×ρMicelle/ρDigesta
(3)
式中:ρDigesta,消化液中辅酶Q10的质量浓度,mg/mL;ρInitial,初始样品中辅酶Q10的质量浓度,mg/mL;ρMicelle,胶束层中辅酶Q10的质量浓度,mg/mL。
1.3.7 数据统计与分析
所有实验均重复进行3次。实验数据表示为“平均值±标准偏差”,使用SPSS 18.0版本软件进行分析,利用Origin进行作图。P<0.05表示在统计学上有显著差异。
2 结果与分析
2.1 载辅酶Q10纳米粒子理化性质表征
如图1-a所示,不同比例酪蛋白酸钠和海藻酸钠制备的载辅酶Q10纳米粒子都呈黄色且均一稳定的液体,表观无明显差异。然而从图1-b中可以看出,纯酪蛋白酸钠制备的载辅酶Q10纳米粒子(L)粒径仅为(248.33±2.28) nm,PDI为(0.36±0.03)。随着海藻酸钠添加比例的不断增加(L∶H=2∶1~1∶2),粒径逐渐增大,PDI也有所增加。值得注意的是,纯海藻酸钠制备的载辅酶Q10纳米粒子(H)粒径为(1 129.0±39.0) nm,PDI为(0.55±0.01)。这可能是由于海藻酸钠分子相互连接形成网络结构,使辅酶Q10稳定悬浮于其中[14]。
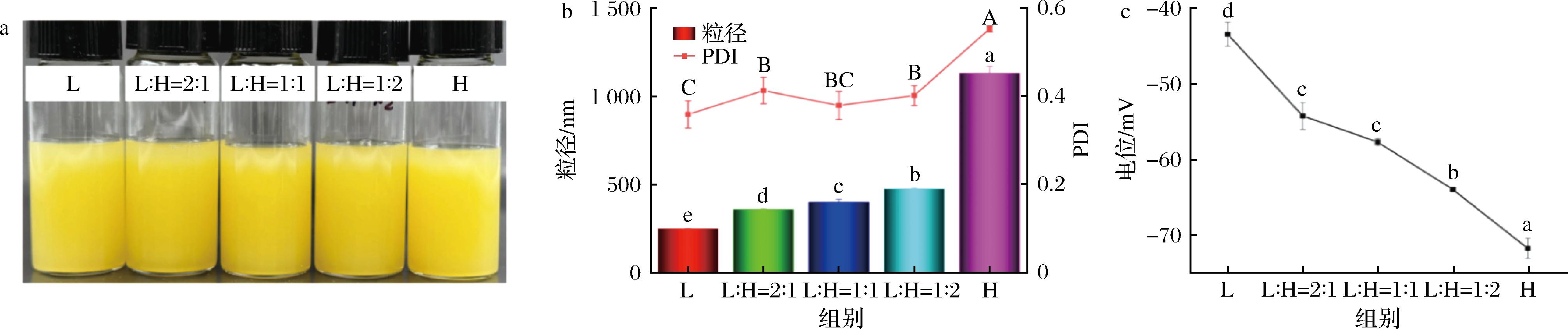
a-表观图;b-粒径和PDI;c-电位
图1 载辅酶Q10纳米粒子表观图、粒径和PDI及电位
Fig.1 Apparent image, particle size, PDI, and zeta potential of coenzyme Q10 loaded nanoparticles
注:不同字母表示差异显著(P<0.05)(下同)。
如图1-c所示,酪蛋白酸钠的电位为(-43.43±1.60) mV,海藻酸钠的电位为(-71.85±1.34) mV,当酪蛋白酸钠和海藻酸钠以不同比例混合时,电位绝对值随着海藻酸钠比例的增加而增大。pH=7时,酪蛋白酸钠和海藻酸钠均带有负电荷,两者的混合物中存在强烈的静电相斥作用,进而两者在体系中以共溶形式存在。这与张春兰等[15]的研究结果一致,pH较高时(pH=7~8),酪蛋白酸钠和果胶都带有负电荷,两者混合后也具有较大的电位绝对值。
载辅酶Q10纳米粒子的微观结构如图2所示,L呈规则的球形,尺寸分布均匀(100~200 nm),随着海藻酸钠添加质量比的增加(L∶H=2∶1~1∶2),颗粒逐渐增大,但仍为表面圆润光滑且规则的球形结构。相较之下,H中的海藻酸钠分子形成的片状结构大小差异较大且形状规整度较差,这与粒径和PDI测定结果一致。

图2 载辅酶Q10纳米粒子的微观结构
Fig.2 Microstructure of coenzyme Q10 loaded nanoparticles
2.2 载辅酶Q10纳米粒子包封率
如图3所示,纳米粒子对辅酶Q10的包封率随海藻酸钠比例的提高呈先增大后减小的趋势,其中L∶H=2∶1的辅酶Q10包封率最高,约为90%。其原因可能是海藻酸钠舒展的多糖链在体系中提供了空间阻隔与物理屏障的作用,有效减少了载有辅酶Q10的酪蛋白酸钠纳米粒子之间的相互碰撞,避免了辅酶Q10的泄露[16]。然而过高含量的海藻酸钠导致其与同具有负电荷的酪蛋白酸钠粒子的静电排斥进一步加强,从而致使酪蛋白酸钠聚集形成更大的颗粒(图2),聚集与大颗粒形成过程中,辅酶Q10的泄露可能是导致其包封率下降的原因。
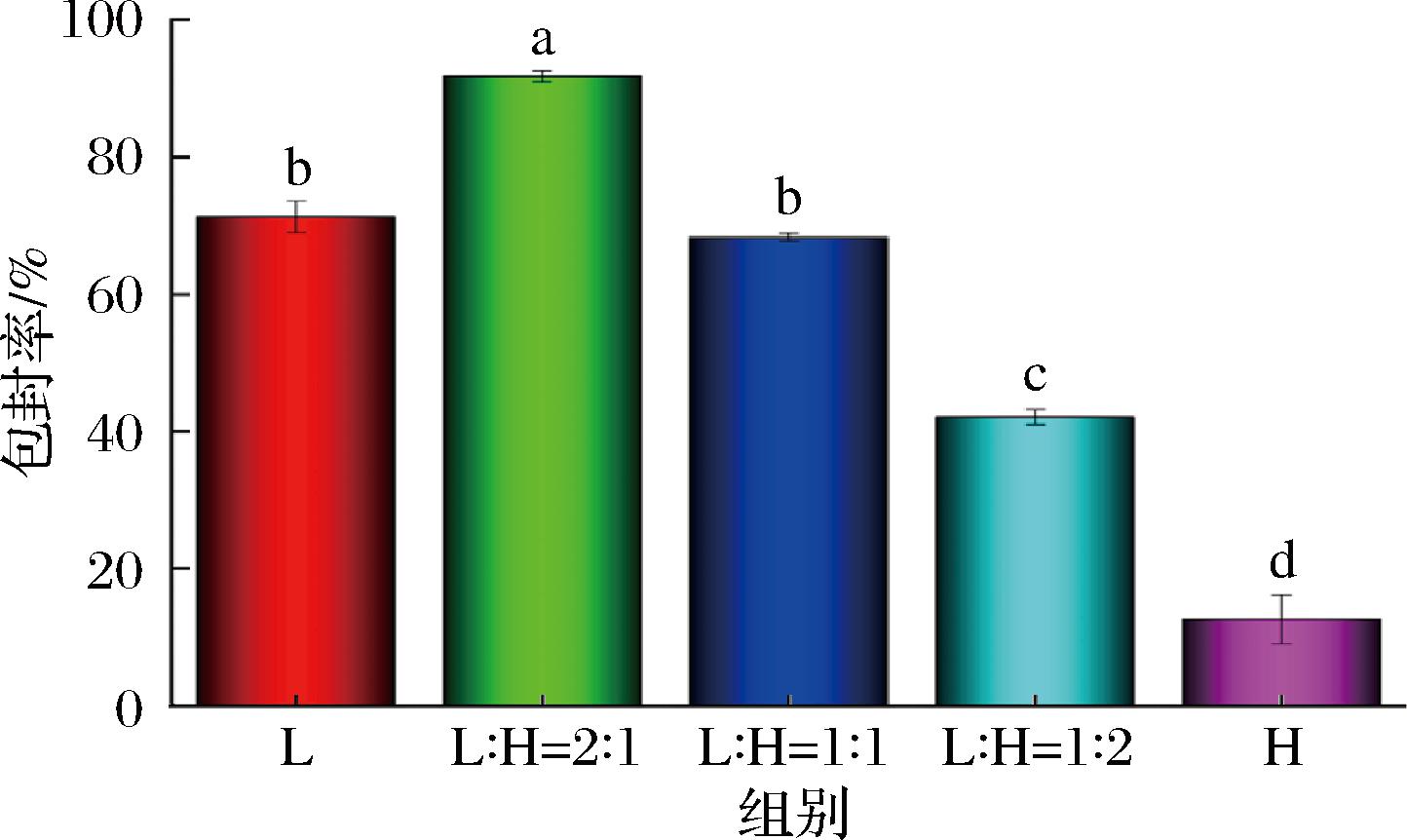
图3 纳米粒子中辅酶Q10的包封率
Fig.3 Encapsulation rate of coenzyme Q10 in nanoparticles
综上,L∶H=2∶1样品具有较为稳定的理化性质和较高的包封率,因此对其环境稳定性和辅酶Q10的生物可接受率进行进一步分析。
2.3 载辅酶Q10纳米粒子环境稳定性分析
2.3.1 pH稳定性
新鲜制备的载辅酶Q10纳米粒子的pH值为6.8。在进一步加工过程中,纳米粒子往往需要面对更复杂的pH条件,因此有必要测定不同pH对载辅酶Q10纳米粒子外观、粒径、包封率和微观结构的影响(图4)。L∶H=2∶1在pH 3~7条件下均较为稳定,表观无明显差异,未出现析出沉淀或沉降等不稳定现象(图4-c)。pH=7时,L∶H=2∶1的粒径最小,为(357.7±4.79) nm。随着pH的逐渐减小,样品粒径逐渐增大,这可能是由于随着pH的降低,酪蛋白酸钠电位由负到正,两者之间的静电相互作用逐渐增强,发生一定程度的聚集,导致粒径有所增大[17]。微观结构显示,随着pH降低,纳米颗粒逐渐增大,这与粒径结果一致。当pH=3时,纳米颗粒表面有明显的凸起和褶皱,证明海藻酸钠在静电相互作用下于纳米颗粒表面附着。此外,纳米粒子在不同pH条件下的包封率结果表明,调节pH的过程会导致包封率略微降低,尤其pH在等电点附近(pH 4~5),推测可能是蛋白质聚集导致部分负载的辅酶Q10泄露。但总体上辅酶Q10的包封率均高于(82.0±0.6)%,说明L∶H=2∶1表现出了广泛的pH稳定性。
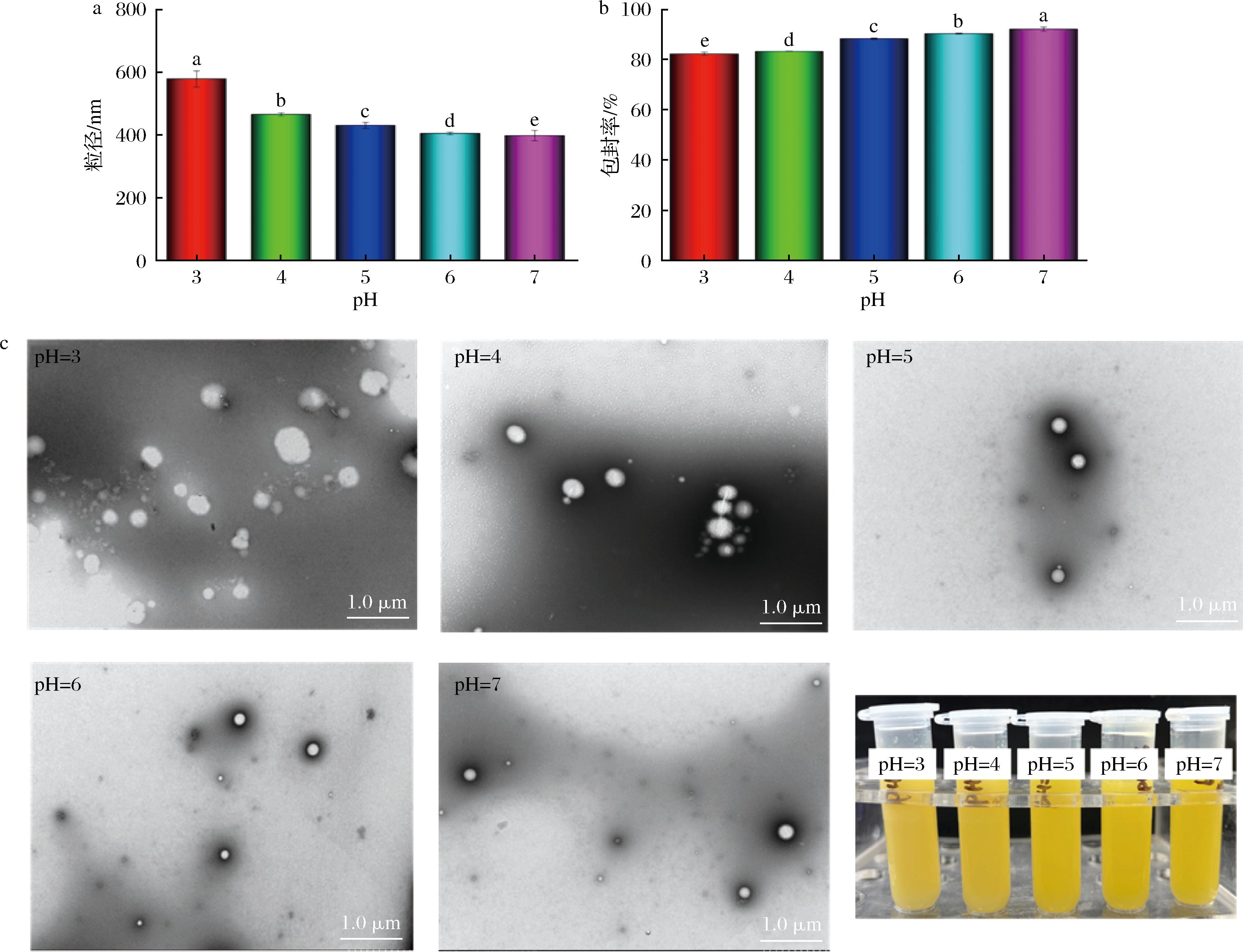
a-粒径;b-包封率;c-微观结构和表观图
图4 载辅酶Q10纳米粒子在不同pH条件下的粒径、包封率、微观结构和表观图
Fig.4 Particle size, encapsulation efficiency, microstructure, and appearance of coenzyme Q10-loaded nanoparticles under different pH conditions
2.3.2 热稳定性
由于热处理广泛应用于食品加工和制备过程,本文测定了加热处理(95 ℃,30 min)对载辅酶Q10纳米粒子外观、粒径、包封率和微观结构的影响(图5)。L∶H=2∶1加热前后均一性良好,粒径和包封率都无明显变化。微观观察显示,加热前后纳米粒子均匀分散,结构无明显变化(图5-c),说明利用热驱动结合高压均质技术制备的载辅酶Q10酪蛋白酸钠和海藻酸钠纳米粒子在热处理过程中具有很强的抗聚集性,表现出良好的热稳定性。
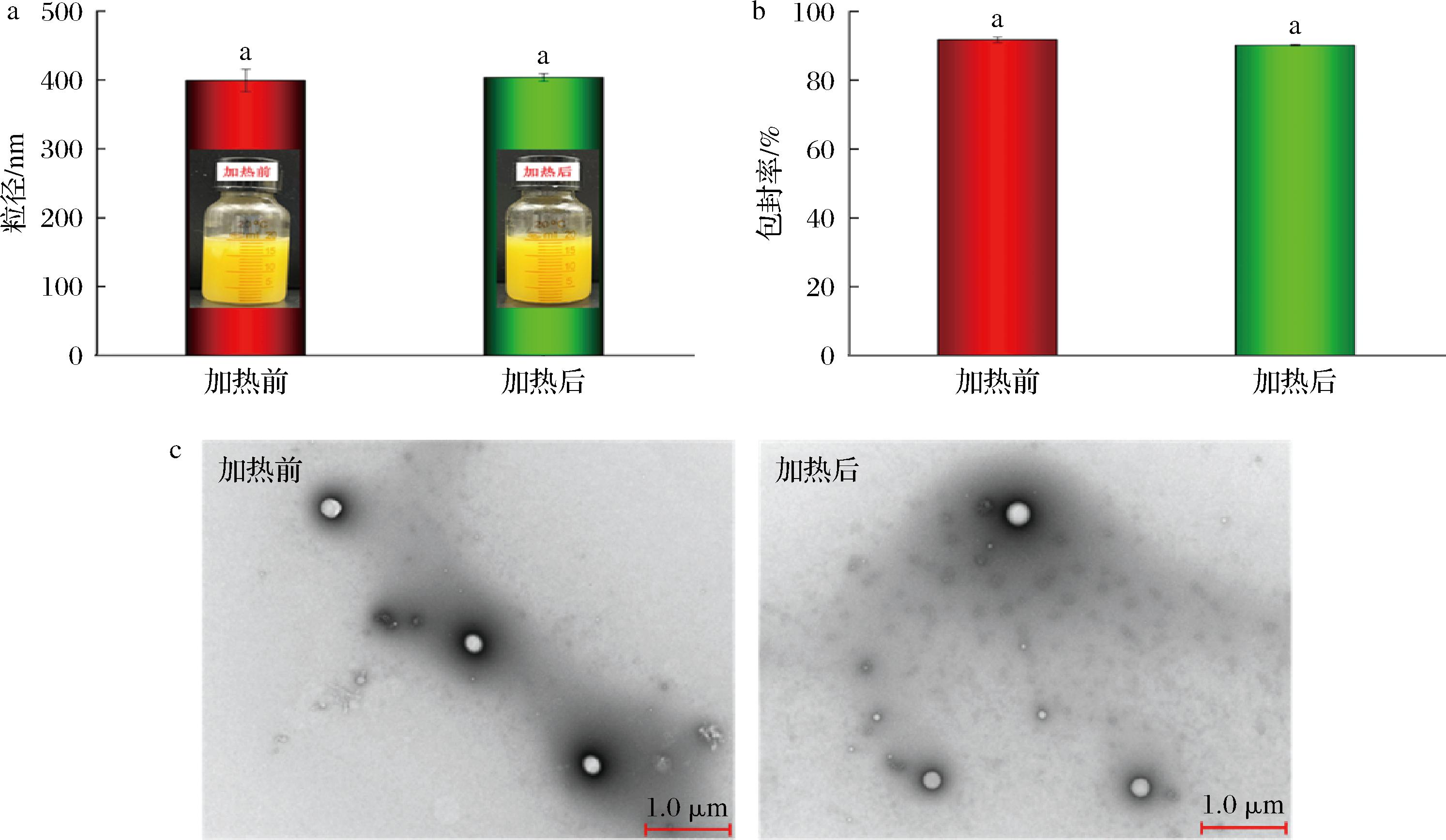
a-表观和粒径;b-包封率;c-微观结构
图5 载辅酶Q10纳米粒子在加热前后(95 ℃,30 min)的表观和粒径,包封率及微观结构变化
Fig.5 Changes in the appearance and particle size, encapsulation efficiency, and microstructure of coenzyme Q10-loaded nanoparticles before and after heating (95 ℃, 30 min)
2.4 辅酶Q10消化稳定性及生物可接受率
如图6-a所示,辅酶Q10原料经过胃肠消化后大约总辅酶Q10的25%被降解。相较之下,纳米粒子对辅酶Q10的包埋显著提高了其消化稳定性(在胃肠消化后损失少于总辅酶Q10的10%),这可能会在一定程度上提高辅酶Q10的生物可接受率。如图6-b所示,辅酶Q10原料在消化过程中主要以晶体形式存在,其胶束澄清透明且无色,几乎全部的辅酶Q10在离心力作用下沉于试管底部,这也表明直接食用辅酶Q10几乎不能被人体所吸收利用。相较之下,L∶H=2∶1样品的胶束呈淡黄色,说明经过热驱动结合高压均质处理制备的载辅酶Q10纳米粒子能够促进辅酶Q10进入胶束而被人体所吸收。生物可接受率通常被认为是进入到小肠中能形成混合胶束的部分[18],通过对辅酶Q10生物可接受率进行测定,结果如图6-b所示,辅酶Q10原料的生物可接受率约为0,而L∶H=2∶1中辅酶Q10的生物可接受率为(9.66±1.57)%,说明纳米粒子对辅酶Q10的包封可以增加其在混合胶束相中的溶解进而显著改善了其吸收性能。
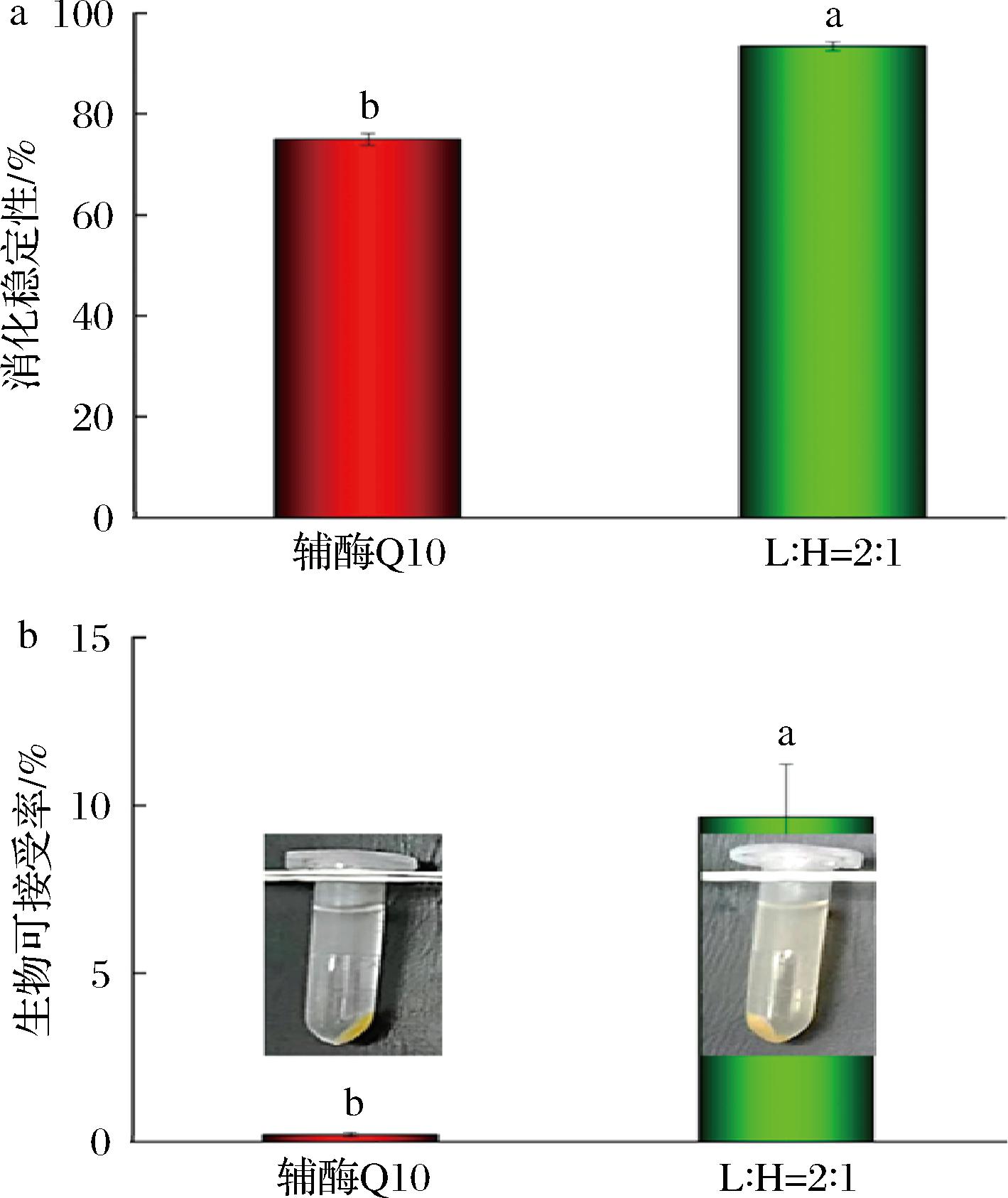
a-消化稳定性;b-胶束表观图和辅酶Q10生物可接受率
图6 载辅酶Q10纳米粒子的模拟体外消化特性
Fig.6 Simulated in vitro digestion characteristics of coenzyme Q10 loaded nanoparticles
3 结论
本研究利用热驱动结合高压均质技术制备了载辅酶Q10的酪蛋白酸钠和海藻酸钠纳米粒子,并探究了两者不同比例对其理化性质、稳定性和辅酶Q10生物可接受率的影响。结果表明,酪蛋白酸钠纳米粒子(L)具有最小的粒径、PDI和电位绝对值,随着海藻酸钠添加比例的增加,粒径、PDI和电位绝对值逐渐增大。当酪蛋白酸钠和海藻酸钠的质量比例为2∶1时,纳米粒子的微观结构呈规则圆滑球形且对辅酶Q10的包封率最高。L∶H=2∶1样品具有广泛的pH稳定性和良好的热稳定性。模拟体外消化实验结果表明:与辅酶Q10原料相比,酪蛋白酸钠和海藻酸钠纳米粒子对辅酶Q10的包封不仅提高了其消化稳定性,还实现了其由晶体向非晶体形式的转变,进而增加其在混合胶束相中的溶解并显著改善其生物可接受率。综上,热驱动结合高压均质技术是制备辅酶Q10纳米粒子的有效手段,对辅酶Q10膳食补充粉剂的开发具有重要意义。
[1] GONZ LEZ-GUARDIA L, YUBERO-SERRANO E M, DELGADO-LISTA J, et al.Effects of the Mediterranean diet supplemented with coenzyme Q10 on metabolomic profiles in elderly men and women[J].The Journals of Gerontology.Series A, Biological Sciences and Medical Sciences, 2015, 70(1):78-84.
LEZ-GUARDIA L, YUBERO-SERRANO E M, DELGADO-LISTA J, et al.Effects of the Mediterranean diet supplemented with coenzyme Q10 on metabolomic profiles in elderly men and women[J].The Journals of Gerontology.Series A, Biological Sciences and Medical Sciences, 2015, 70(1):78-84.
[2] YANG Y K, WANG L P, CHEN L, et al.Coenzyme Q10 treatment of cardiovascular disorders of ageing including heart failure, hypertension and endothelial dysfunction[J].Clinica Chimica Acta, 2015, 450:83-89.
[3] ZHOU H F, LIU G Q, ZHANG J, et al.Novel lipid-free nanoformulation for improving oral bioavailability of coenzyme Q10[J].BioMed Research International, 2014, 2014(1):793879.
[4] WEI Y, ZHANG L, YU Z P, et al.Enhanced stability, structural characterization and simulated gastrointestinal digestion of coenzyme Q10 loaded ternary nanoparticles[J].Food Hydrocolloids, 2019, 94:333-344.
[5] KACI M, BELHAFFEF A, MEZIANE S, et al.Nanoemulsions and topical creams for the safe and effective delivery of lipophilic antioxidant coenzyme Q10[J].Colloids and Surfaces B:Biointerfaces, 2018, 167:165-175.
[6] 方素琼, 陈文荣, 王培建, 等.脂质体提高辅酶Q10稳定性与生物可接受率研究[J].食品与发酵工业, 2024, 50(3):169-173.FANG S Q, CHEN W R, WANG P J, et al.Study on liposomes improving the stability and bioaccessibility of coenzyme Q10[J].Food and Fermentation Industries, 2024, 50(3):169-173.
[7] LIU Q G, SUN Y X, CUI Q, et al.Characterization, antioxidant capacity, and bioaccessibility of coenzyme Q10 loaded whey protein nanoparticles[J].LWT, 2022, 160:113258.
[8] MESA J, HINESTROZA-C RDOBA L I, BARRERA C, et al.High homogenization pressures to improve food quality, functionality and sustainability[J].Molecules, 2020, 25(14):3305.
RDOBA L I, BARRERA C, et al.High homogenization pressures to improve food quality, functionality and sustainability[J].Molecules, 2020, 25(14):3305.
[9] MA X F, CHATTERTON D E W.Strategies to improve the physical stability of sodium caseinate stabilized emulsions:A literature review[J].Food Hydrocolloids, 2021, 119:106853.
[10] PALLANDRE S, DECKER E A, MCCLEMENTS D J.Improvement of stability of oil-in-water emulsions containing caseinate-coated droplets by addition of sodium alginate[J].Journal of Food Science, 2007, 72(9):E518-E524.
[11] LIU Q G, JING Y Q, HAN C P, et al.Encapsulation of curcumin in zein/caseinate/sodium alginate nanoparticles with improved physicochemical and controlled release properties[J].Food Hydrocolloids, 2019, 93:432-442.
[12] YAO Y X, MA L, YU C W, et al.The improvement of tyrosol bioavailability by encapsulation into liposomes using pH-driven method[J].Food Chemistry, 2024, 445:138661.
[13] GAO H X, CHENG C, FANG S Q, et al.Study on curcumin encapsulated in whole nutritional food model milk:Effect of fat content, and partitioning situation[J].Journal of Functional Foods, 2022, 90:104990.
[14] LIM X Y, LI J, YIN H M, et al.Stabilization of essential oil:Polysaccharide-based drug delivery system with plant-like structure based on biomimetic concept[J].Polymers, 2023, 15(16):3338.
[15] 张春兰, 张璐璐, 谭慧林, 等.果胶-酪蛋白酸钠纳米复合物的特性[J].食品工业, 2019, 40(2):194-197.ZHANG C L, ZHANG L L, TAN H L, et al.The characteristics of pectin-casein compound[J].The Food Industry, 2019, 40(2):194-197.
[16] 王擎宇, 王梦遥, 黄慧敏, 等.果胶/酪蛋白酸钠复合运载体系的构建及对番茄红素的控释机理[J].食品科学, 2020, 41(19):83-89.WANG Q Y, WANG M Y, HUANG H M, et al.Construction of pectin/sodium caseinate composite delivery system and controlled release mechanism of incorporated lycopene from it[J].Food Science, 2020, 41(19):83-89.
[17] 翁玲, 张彦慧, 张若宁, 等.玉米醇溶蛋白-海藻酸钠纳米颗粒的制备及其负载姜黄素的研究[J].中国食品添加剂, 2024, 35(3):25-34.WENG L, ZHANG Y H, ZHANG R N, et al.Preparation of zein sodium alginate nanoparticles and their loading with curcumin[J].China Food Additives, 2024, 35(3):25-34.
[18] SALVIA-TRUJILLO L, MCCLEMENTS D J.Enhancement of lycopene bioaccessibility from tomato juice using excipient emulsions:Influence of lipid droplet size[J].Food Chemistry, 2016, 210:295-304.