绿茶目前是我国产量和销量最高的茶类,具有清香持久、醇厚鲜爽回甘的风味特征。但夏季绿茶滋味苦涩,感官品质差,消费者接受度和销量较低[1],导致夏季茶鲜叶弃采严重、资源利用率低,阻碍茶产业健康发展。名优绿茶茶汤的整体味道包括苦味、涩味、甜味和鲜味[2],而夏季绿茶中主要味道为苦味和涩味[3],造成两者滋味品质差异明显。由于茶汤的滋味品质主要受非挥发性成分对成茶的滋味贡献度及非挥发性成分滋味交互的影响[4],因此,减少茶汤中苦味和涩味物质,增加甜味和鲜味物质含量,可能是改善夏季绿茶茶汤口感的重要手段。
外源酶已广泛应用于食品工业来改善产品的口感、质地和风味品质[5],目前糖苷酶、蛋白酶、纤维素酶、单宁酶和果胶酶等外源酶已广泛应用于茶叶加工领域,起到改善茶汤滋味和香气品质的作用。基于此,前期团队人员比较了6种外源酶(单宁酶、漆酶、β-葡萄糖苷酶、脂肪氧合酶、蛋白酶和纤维素酶)对夏季绿茶茶汤感官品质的影响,并筛选出纤维素酶和单宁酶进一步研究。纤维素酶(EC 3.2.1.4)多用于红茶加工,在增强茶汤抗氧化能力、降低茶汤苦涩味和增加芳香类化合物含量等方面具有重要作用[6]。CHIANG等[7]发现纤维素酶处理显著降低了夏秋红茶中总儿茶素、部分儿茶素和茶多酚含量,增加了茶汤的爽口性和抗氧化生物活性。缪凤等[8]发现1.5 g/L的纤维素酶有助于改善红茶风味品质,成茶滋味醇厚、花香馥郁持久。由于单宁酶(EC 3.1.1.20)可水解酯型儿茶素和单宁,而酯型儿茶素是绿茶茶汤中苦味和涩味的主要贡献化合物[9],同时可水解单宁与植物的苦味显著正相关,因此通过水解作用,单宁酶可降低植物中的苦涩味。ZHANG等[10]发现单宁酶可以通过破坏酯键来降低绿茶茶汤中酯型儿茶素和水解单宁的含量,从而改善茶汤苦涩味,提高茶汤的甜味、回甜味和整体可接受性。CAO等[11]利用单宁酶处理改善了秋绿茶产品口感,使秋绿茶回味甘甜,苦味和涩味降低。这些报道均表明,外源酶对改善茶叶和茶汤口感方面具有较大应用潜力。此外,与单一外源酶相比,复合酶因含有不同比例的外源酶,且它们以不同的方式起作用,因此常具有协同增效的效果[12]。虽然报道过单一外源酶对茶叶口感具有积极作用,但都集中在外源酶对品质成分或感官品质的影响,复合酶对夏季绿茶茶汤的滋味影响及导致口感变化的关键化合物仍不清楚。而随着分析技术如广泛靶向代谢组学的发展,能为代谢物积累的过程提供更有价值的见解,同时也提供了一种高通量的化合物与食品感官性状相关联的方法[13]。
为探究外源酶对夏季绿茶茶汤苦涩味的影响及其关键代谢物,本研究拟通过感官评价、电子舌和广泛靶向代谢组学,对不同外源酶处理的茶汤进行了苦涩味量化评价和代谢物分析。并利用加权基因共表达网络分析(weighted gene co-expression network analysis, WGCNA),基于不同外源酶处理下茶汤的代谢数据集和感官特性评分构建共表达网络,进一步鉴定与苦/涩属性高度相关的关键代谢物。本研究旨在阐明外源酶在改善夏茶茶汤口感中的作用及关键代谢物,以期为夏绿茶茶汤滋味品质改善、茶饮料滋味精确调控和夏季鲜叶资源的合理利用提供依据。
1 材料与方法
1.1 材料与仪器
茶鲜叶于2022年6月中旬采摘自本地茶园基地(北纬29°75′,东经105°71′,海拔440 m),品种为蜀永1号,采摘标准为1芽2~3叶;单宁酶(纯度200 U/g)、漆酶(纯度120 U/g)、β-葡萄糖苷酶(纯度100 U/g)、脂肪氧合酶(纯度50 000 U/g)、蛋白酶(纯度10 000 U/g),上海源叶生物科技有限公司;纤维素酶(纯度10 000 U/g),上海麦克林生化科技有限公司;盐酸奎宁、单宁酸、柠檬酸、葡萄糖、谷氨酸钠、NaCl(均为分析纯),重庆铂锶钛科技有限公司;Isenso Smartongue电子舌,上海瑞玢智能科技有限公司;Scientz-100F真空冷冻干燥机,宁波新芝生物科技股份有限公司;Retsch MM400冷冻研磨仪,弗尔德(上海)仪器设备有限公司;ACQUITY UPLC I-Class PLUS超高液相色谱,沃特世科技(上海)有限公司;6CR-25型揉捻机,浙江上洋机械有限公司。
1.2 实验方法
1.2.1 夏季绿茶加工及茶汤制备
茶鲜叶采摘后置于萎凋槽中进行摊放(摊叶厚度5~10 cm,每隔2 h左右轻翻1次),摊放4~6 h后采用滚筒杀青机进行杀青,摊凉后采用揉捻机揉捻20~28 min(空揉捻3~5 min,加压揉捻8~10 min,重揉捻6~8 min,空揉捻3~5 min),解块后干燥(毛火100~110 ℃、10~15 min,足火90 ℃、25~30 min)得成品茶。采用破碎机粉碎成品茶,过筛(40目),取筛下茶粉,用蒸馏水(1∶50,质量比)在85 ℃下提取15 min,600目筛网过滤后迅速冷却至常温25 ℃,待用。
1.2.2 夏季绿茶茶汤的外源酶处理
本研究共设4个处理:处理1:未加酶的夏季绿茶茶汤(对照,control check,CK);处理2:10 g/L纤维素酶,55 ℃、60 min(单一纤维素酶,cellulase treatment,CT);处理3:4 g/L单宁酶,30 ℃、60 min(单一单宁酶,tannase treatment,TT);处理4:10 g/L纤维素酶,55 ℃、60 min后,采用4 g/L单宁酶,30 ℃、60 min(纤维素酶-单宁酶复合,cellulase-tannase treatment,CTT)。外源酶处理过程中,每隔20 min搅拌1次,酶处理完毕后,对单宁酶和纤维素酶进行热处理灭活(90 ℃,10 min),水解产物8 500 r/min离心10 min,然后快速冷却至常温(25 ℃)。每组处理重复3次,用于感官审评、电子舌和代谢组学分析。
1.2.3 感官审评
采用滋味等效量化法(十分制)对茶汤的苦味和涩味强度打分[14]。审评小组由重庆市农业科学院茶叶研究所7名茶叶审评人员组成(3男4女,25~50岁)。采用随机编码对茶汤进行密码审评,茶汤入口7~8 s后对苦味强度打分,吐出溶液后3~4 s内对涩味强度进行评分。一个样品评分结束5 min后,对下一个茶汤的苦涩味强度打分。每个样品重复3次。
1.2.4 电子舌分析
为确保采集数据的可靠性和稳定性,数据采集前,对电子舌进行自检、活化、校准和诊断。取酶处理后的茶汤,冷却到室温(25 ℃)后将其倒入电子舌专用测定杯中采集数据,完成后,用蒸馏水清洗传感器2次,检测和清洗交替进行,样品检测重复6次,取3次稳定数据进行后续分析。参照常睿等[15]的方法进行偏最小二乘(partial least square,PLS)分析建模并预测酶处理后茶汤中苦涩滋味属性浓度。
1.2.5 代谢组学分析
1.2.5.1 茶汤代谢物的提取
茶汤经真空冷冻干燥后,称取50 mg冻干粉,加入1 000 μL提取液[V(甲醇)∶V(乙腈)∶V(水)=2∶2∶1],涡旋混匀30 s。加入钢珠,采用45 Hz研磨仪处理10 min后,冰浴超声波处理10 min,并于-20 ℃静置1 h。离心(4 ℃,12 000 r/min,15 min),取500 μL上清液于EP管中,采用真空浓缩器进行浓缩干燥。加入160 μL提取液[V(乙腈)∶V(水)=1∶1]复溶,混匀30 s后冰浴超声波处理10 min,再次离心(4 ℃,12 000 r/min,15 min),取120 μL上清液过膜(0.22 μm滤膜),保存于-20 ℃待测。
1.2.5.2 色谱条件
色谱柱:Waters HSS-T3(1.8 μm,2.1 mm×100 mm);流动相A为含0.1%甲酸和5 mmol/L乙酸铵水溶液,流动相B为0.1%甲酸乙腈溶液,梯度程序A/B:98∶2(0 min)、98∶2(1.5 min)、50∶50(5 min)、2∶98(9 min)、2∶98(10 min)、98∶2(11 min)、98∶2(14 min);流速0.35 mL/ min;柱温50 ℃;进样量2 μL。
1.2.5.3 质谱条件
电喷雾离子源;温度550 ℃;离子喷雾电压5 500 V(正离子模式)/-4 500 V(负离子模式);离子源气体I、气体II和气帘气分别设置为50、55和35 psi,碰撞诱导电离参数为中等。在三重串联四级杆质谱(triple quadrupole mass spectrometry,QQQ)和线性离子阱质谱(linear ion trap mass spectrometry,LIT)模式下分别用10和100 μmol/L聚丙二醇溶液进行仪器调谐和质量校准。QQQ扫描使用多反应监测模式(multiple reaction monitoring,MRM),并将碰撞气体(N2)设置为中等。通过进一步的去簇电压(declustering potential,DP)和碰撞能(collision energy,CE)优化,完成各个MRM离子对的DP和CE。根据每个时期内洗脱的代谢物,在每个时期监测一组特定的MRM离子对。
1.2.5.4 代谢物的定性定量分析
基于自建数据库GB-PLANT公共代谢物信息数据库,根据二级谱信息进行定性分析,为避免干扰,分析时去除了同位素、含K+、Na+、NH4+的重复信号以及来自其他较大分子的碎片离子的重复信号。同时参考公共数据库(MassBank、KNApSAcK、HMDB、MoTo DB和METLIN)分析代谢物结构。代谢物定量采用QQQ质谱仪的MRM模式,MRM模式中,四级杆首先筛选目标物质的前体离子(母离子),排除掉其他分子质量物质对应的离子来初步排除干扰;其次前体离子经碰撞室诱导电离后形成很多碎片离子,通过三重四级杆过滤选择出所需要的特征单碎片离子,同时消除非目标离子的干扰,从而提高定量结果的精度和可重复性。获得不同样本的代谢物质谱分析数据后,对所有物质质谱峰进行峰面积积分,并使用MultiaQuant软件对不同样品中同一代谢物的质谱峰进行积分校正,每个峰的面积代表相应物质的相对含量。
1.3 数据分析
分别采用T检验和正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis, OPLS-DA)模型计算各化合物的差异显著性P值以及变量投影重要性(variable important in projection,VIP)值 。以VIP值≥1.0、|log2 (fold change)|≥1和P<0.05为标准,筛选差异代谢物。使用R语言(3.6.1版本)进行主成分分析(principal component analysis,PCA)、层次聚类分析(hierarchical cluster analysis,HCA)、OPLS-DA、WGCNA,并作图。
2 结果与分析
2.1 不同外源酶处理后茶汤的滋味得分和电子舌分析
由图1-a电子舌预测浓度可知,酶处理组间的苦味和涩味预测浓度无显著差异,但均显著低于CK(P<0.05)。如图1-b感官得分所示,TT和CTT处理组的苦味得分显著低于CK和CT处理组,同时,CTT处理组的涩味得分最低且与其他组别均具有显著差异(P<0.05),表明CTT处理能在一定程度上改善夏绿茶茶汤苦涩味,这可能与外源酶对茶汤滋味改善具有积极影响和复合酶协同增效有关。
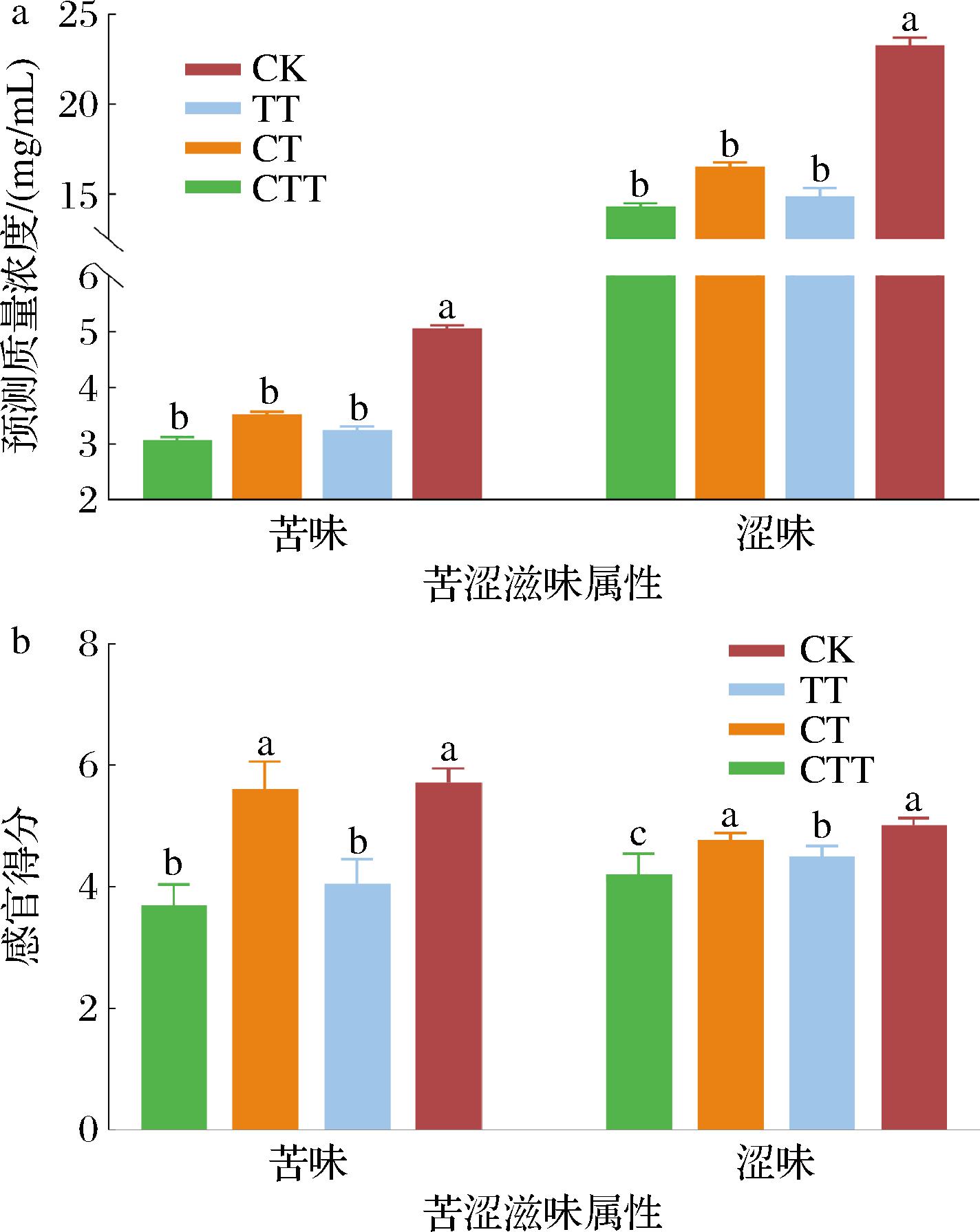
a-茶汤样品中苦/涩味预测质量浓度;b-茶汤样品的苦/涩味得分
图1 不同酶制剂处理下茶汤苦/涩味预测浓度和得分
Fig.1 Predictied concentration and scores of bitterness and astringency
2.2 不同外源酶处理下茶汤非挥发性代谢物分析
通过UPLC共检测到576种代谢物,包括55种氨基酸、19种苯丙素、36种多酚、112种黄酮类、7种醌类、27种脂质、46种生物碱、60种糖及醇类、59种萜类、5种维生素、14种甾体、15种香豆素、3种木脂素、49种有机酸、24种核苷酸、2种杂氧蒽酮、8种酸类、7种酮类、1种醛类和27种其他类等20类化合物(图2-a)。主成分得分如图2-b所示,第一、二主成分的总变异系数为60.55%(PC1=39.7%,PC2=20.85%),相同处理的茶汤聚集良好且与其他样品明显分离,说明代谢差异显著,与茶汤的感官审评和电子舌检测结果一致(图1)。在PC1方向上,处理样品按照酶制剂不同从CTT、CT、TT和CK组进行排列,说明在PC1方向上CTT诱导的茶汤中非挥发性代谢物变化与CK差异最大。对鉴定出的代谢物进行热图分析,结果如图2-c所示,每组重复样品聚在一起,说明重复间的相似性好,数据可靠性高。所有样品中代谢物可形成左右2个分支,其中CK与CT、TT、CTT组均具有不同的代谢产物,说明他们的代谢过程存在显著差异(P<0.05),同时CTT与CK中非挥发性化学成分上调或下调的趋势完全相反,说明其代谢物的变化是最为显著的。
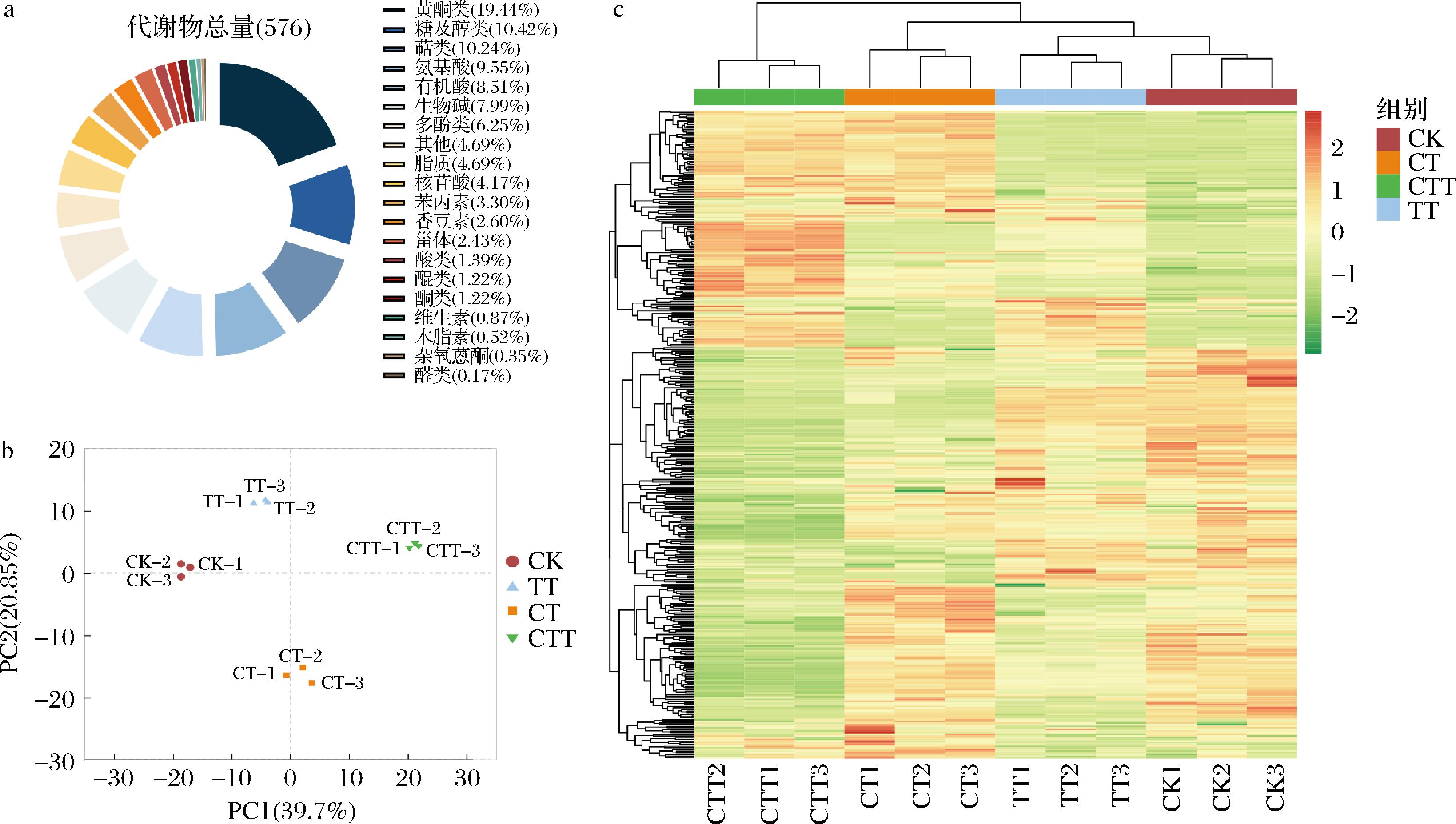
a-576种代谢物及分类;b-PCA得分图;c-代谢物热图
图2 不同酶制剂处理茶汤非挥发性代谢物分析
Fig.2 Non-volatile metabolite profiles of infusion treated with different enzymes
2.3 不同外源酶处理下茶汤非挥发性差异代谢物分析
采用OPLS-DA模型对4个处理进行两两比较,处理间差异代谢物的变化如图3所示。如图3-a和图3-b所示,CK与CTT一共有178种差异代谢物,其中经CTT处理后含量升高的差异代谢物81种,含量降低的差异代谢物97种,而CK与CT和TT的差异代谢物分别为75和58种,上调差异代谢物分别为38和32种,下调差异代谢物分别为37和26种,说明CTT处理对茶汤中一些关键代谢物质活性影响最大。参与3个酶处理组与对照组的差异代谢物共192种。
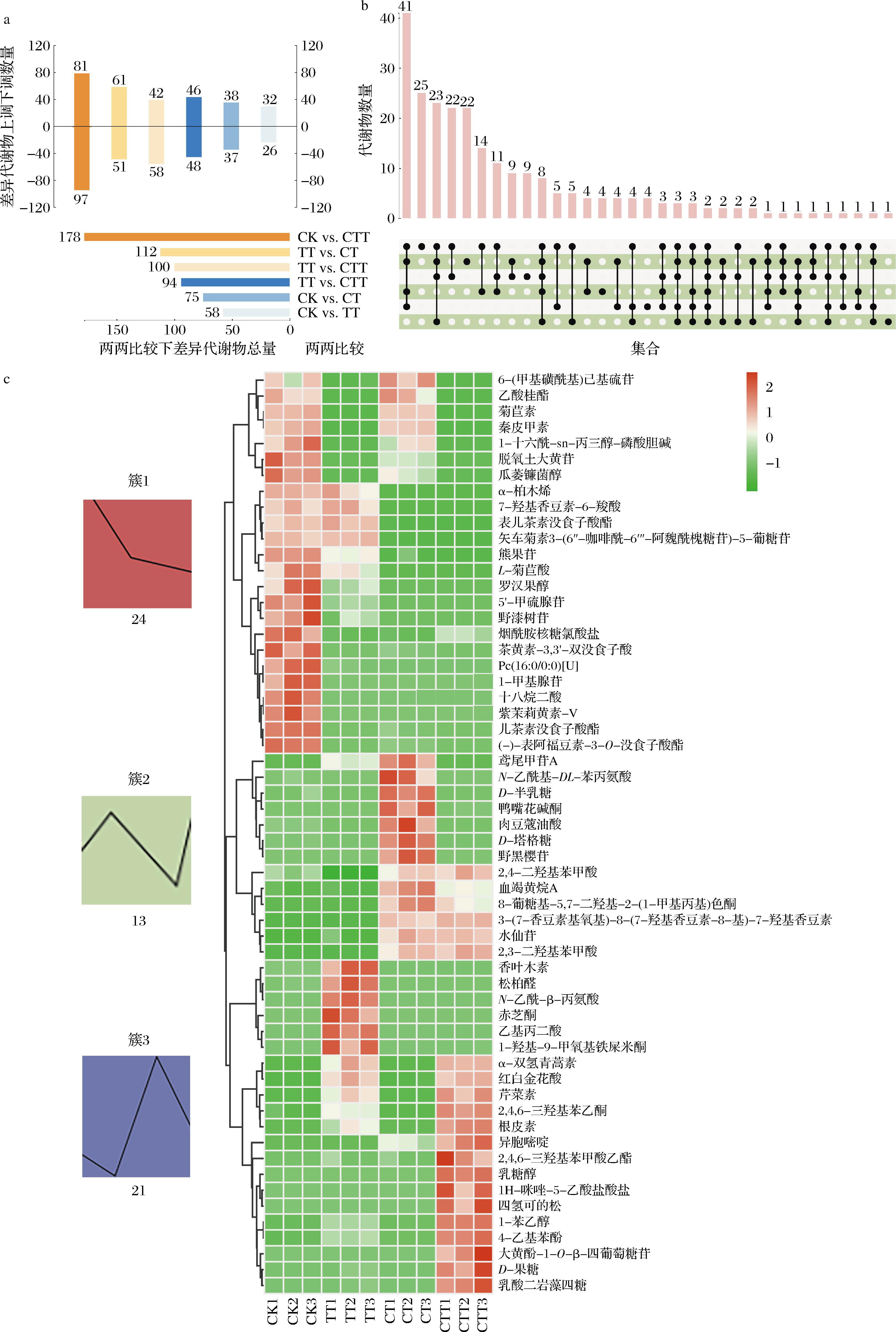
a-茶汤各两两比较差异代谢物的总量及上下调数量;b-两两比较下代谢物的upset图;c-前58种差异代谢物的热图和K-means聚类结果
图3 基于配对比较的差异代谢物分析
Fig.3 Different metabolites based on paired-comparison
为进一步比较酶处理后与CK的茶汤中差异代谢物变化,再结合倍数变化对数值|log2 (fold change)|≥3筛选出前58种差异代谢物并对其进行分层聚类和热图分析(图3-c)。4个处理下茶汤的代谢物变化趋势可分为3类。24种代谢物在外源酶作用下含量持续降低(簇1),包括秦皮甲素、1-甲基腺苷、1-十六酰-sn-丙三醇-磷酸胆碱、7-羟基香豆素-6-羧酸、罗汉果醇和乙酸桂酯等,主要涉及倍半萜类和三萜类生物合成、糖酵解、黄酮及黄酮醇等代谢途径。13种代谢物在CK中含量较低(簇2),包括2,4-二羟基苯甲酸、水仙苷、2,3-二羟基苯甲酸、野黑樱苷、3-(7-香豆素基氧基)-8-(7-羟基香豆素-8-基)-7-羟基香豆素、N-乙酰基-DL-苯丙氨酸、D-塔格糖和D-半乳糖等。但经外源酶处理后,这些代谢物含量显著高于未添加酶制剂的茶汤,这说明茶汤中上述13种物质受到外源酶的影响,可能通过氰基氨基酸、次生代谢产物和半乳糖等代谢途径生成。此外,还有21种代谢物,如α-双氢青蒿素、乳糖醇、芹菜素、红白金花酸、根皮素等(簇3),与上述13种代谢物具有相似的变化趋势,即在CK中含量较低,经外源酶处理后含量升高,推测与类黄酮、异黄酮、黄酮及黄酮醇以及次生代谢产物生物合成等途径相关;但乙基丙二酸、N-乙酰-β-丙氨酸(β-丙氨酸代谢)、赤芝酮、1-羟基-9-甲氧基铁屎米酮这4种代谢物,经TT处理后,含量显著升高,但在CT和CTT处理下,含量降低,但终含量高于CK。据报道,纤维素酶能参与木质素、低聚糖、果胶等碳水化合物的代谢[16],而单宁酶参与的代谢途径较为复杂,可能包括类黄酮、黄酮及黄酮醇、氨基酸、碳水化合物等代谢途径,这是由于单宁酶的底物常与生物大分子如多糖、蛋白质、纤维素等进行络合且本身能降解多酚类化合物[17]。因此,酶处理与对照组间代谢物的变化可能是通过这些代谢途径进行的。
CK中富含与苦味和涩味相关的多酚类化合物,如黄烷醇类(表儿茶素没食子酸酯)、黄酮类化合物(野漆树苷)、花色苷[矢车菊素3-(6″-咖啡酰-6‴-阿魏酰槐糖苷)-5-葡糖苷]以及酚酸类化合物(L-菊苣酸)(簇1,图3-c)。据报道,这些多酚类化合物会增强茶汤苦涩味[18]。此外,秦皮甲素作为一种苦味剂,推测会对茶汤苦味产生重要影响,这些物质可能导致CK的口感明显偏苦涩(图1)。与CK、CT和TT相比,CTT中富含乳酸二岩藻四糖、乳糖醇、D-果糖以及根皮素(簇3,图3-c)。食物基质中的脂质(如乳酸二岩藻四糖)通过减少水体积和水相与口腔的接触表面积,对苦味、涩味起到了重要的屏障作用[19]。作为甜味剂,乳糖醇和D-果糖广泛应用于食品工业,而根皮素为二氢查尔酮类化合物,是一种天然的苦味抑制剂和风味改良剂。上述物质可能共同导致CTT在感官评价中苦/涩味较轻(图1)。
2.4 基于WGCNA的代谢物与滋味特性关联分析
为明确外源酶处理引起茶汤滋味改善的关键化合物,通过WGCNA构建起576种代谢物与茶汤味道特征的共表达网络,结果如图4所示。由图4-a和图4-b可知,通过WGCNA发现了6个模块,黄色和蓝色模块是关键模块,其中,黄色模块与茶汤的苦涩味得分(r>0.85)及苦涩味预测浓度呈极显著负相关(r>0.72,P<0.01),蓝色模块与苦涩味预测浓度呈负相关(r>0.61,P<0.05),因此选择最关键的黄色模块进行后续分析。通过比较分析黄色模块中富集的化合物与192种差异代谢物的异同,得到12种差异代谢物(图4-c),发现这些化合物主要富集在CTT处理,说明CTT处理对茶汤滋味改善影响最为明显,与前期研究结果一致。
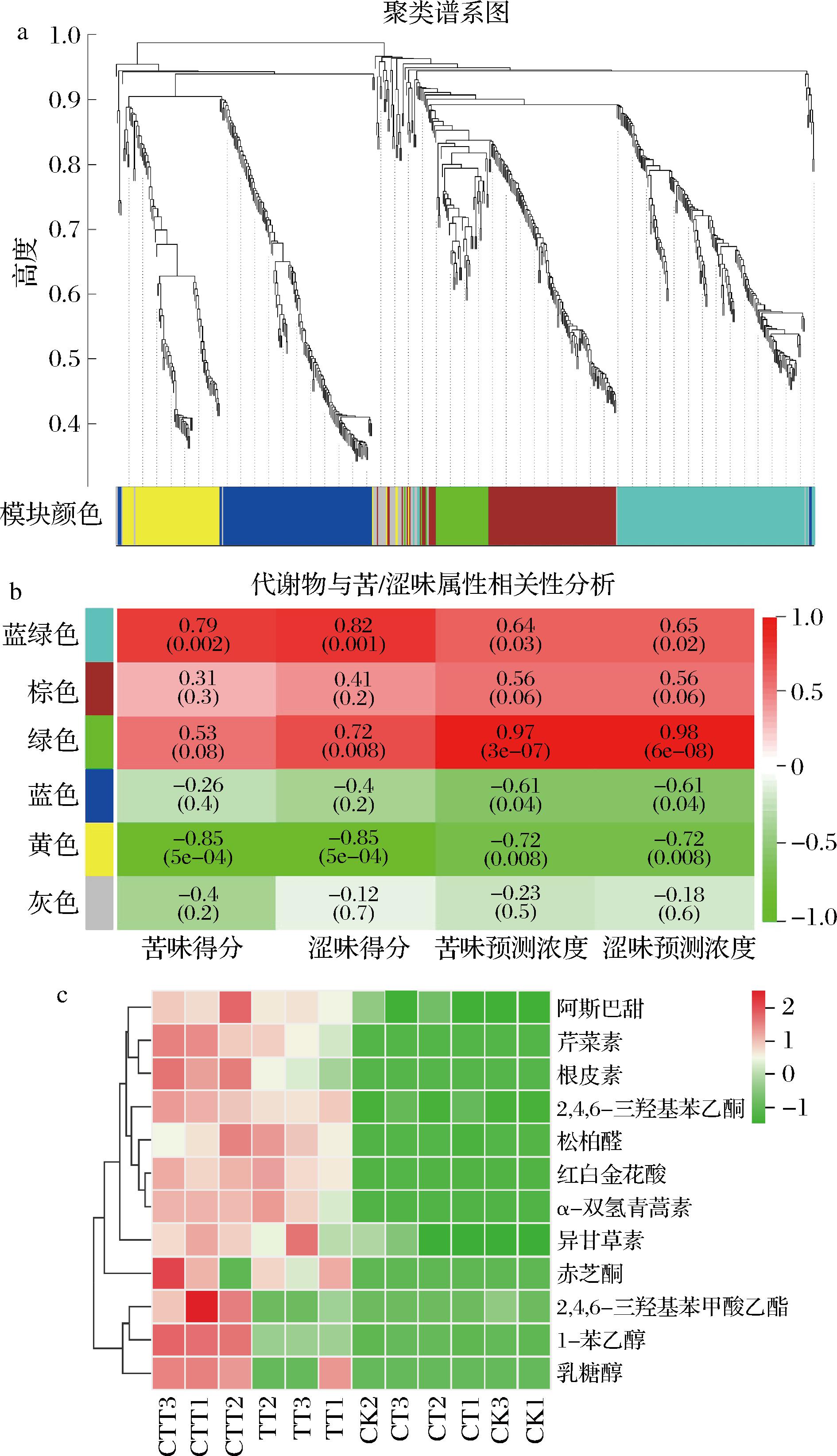
a-共表达模块的分层聚类树状图;b-与苦涩味属性相关的6个模块;c-与苦涩味属性高度相关的差异代谢物热图
图4 不同处理下茶汤中576种代谢物与苦/涩味属性的相关性分析
Fig.4 Correlations of 576 metabolites and the taste attributes in tea infusions with different treatments
如图4-c所示,12种差异代谢物主要包括阿斯巴甜、芹菜素、根皮素、2,4,6-三羟基苯乙酮、松柏醛、红白金花酸、α-双氢青蒿素、异甘草素、赤芝酮、2,4,6-三羟基苯甲酸乙酯、1-苯乙醇和乳糖醇。其中,5种物质与滋味相关,包括芹菜素、根皮素、乳糖醇、异甘草素和阿斯巴甜。芹菜素和根皮素均为天然黄酮类化合物,据报道,黄酮类化合物在食品中一般呈苦/涩味,例如STARK等[20]认为芹菜素吡喃糖苷是烘焙可可关键的涩味贡献物,而根皮素作为一种天然的苦味抑制剂和风味改良剂,不仅能抑制食品中苦味从而改善口感,还能掩盖高强度甜味剂的不良风味。WEI等[21]研究表明根皮素的2′-β-D-葡萄糖苷衍生物根皮苷是南川大树红茶的关键甜味贡献物,因此黄酮类化合物的滋味特性还需要结合感官组学进一步分析。乳糖醇、异甘草素和阿斯巴甜都是食品工业常见的甜味剂,均具有强烈的甜味,研究表明,通过味的消杀作用,甜味会抑制苦味和涩味[22-23]。1-苯乙醇是茶叶中具有花香和蜂蜜气味的代表性风味化合物[24],通过研究发现[25],食品中的风味成分可通过香气-滋味互作来增强风味感知能力,同时香气和滋味描述语间还存在一致的关系,即呈甜香的物质可显著提高食品的甜味[26]。此外,CTT组还富集了5种具有生理功能的活性成分[27-29],大多数化合物具有抗炎的健康功效,由此可见复合酶处理在开发功能性茶汤方面可能具有潜在的应用前景。
3 结论与讨论
夏季绿茶滋味苦涩、感官品质差,而外源酶能改善茶叶滋味,但造成滋味改善的关键化合物仍不清晰。本文采用滋味等效量化法、电子舌和广泛靶向代谢组学对经酶制剂处理后夏季绿茶茶汤的苦涩味及代谢物特征进行了研究。感官审评和电子舌分析结果表明,经外源酶处理的茶汤苦味和涩味预测浓度均显著低于对照组(P<0.05),复合酶效果最佳。通过广泛靶向代谢组学分析,共检测出576种化合物,其中192种代谢物为区分酶处理组与对照组的显著差异化合物。WGCNA关联分析表明,与苦/涩味属性高度相关的关键代谢物有12种,包括4种呈甜味物质、1种香气化合物以及5种生理活性成分。本研究表明复合酶处理可能产生了呈甜味物质和呈甜香化合物来改善夏季绿茶茶汤口感。本研究可为茶汤滋味品质改善、茶饮料滋味的精确调控及功能性茶饮料的开发提供依据。此外,由于本研究对外源酶处理的茶汤仅进行了广泛靶向代谢组学分析,未进行绝对定量,后期上述12种关键化合物还需进一步验证;另外,产生了5种生理活性成分,主要具有抗炎的健康功效,有必要通过细胞或者小鼠实验对其功能性进行研究。
[1] XU W P, SONG Q S, LI D X, et al.Discrimination of the production season of Chinese green tea by chemical analysis in combination with supervised pattern recognition[J].Journal of Agricultural and Food Chemistry, 2012, 60(28):7064-7070.
[2] YU P G, YEO A S L, LOW M Y, et al.Identifying key non-volatile compounds in ready-to-drink green tea and their impact on taste profile[J].Food Chemistry, 2014, 155:9-16.
[3] XU Y Q, ZHANG Y N, CHEN J X, et al.Quantitative analyses of the bitterness and astringency of catechins from green tea[J].Food Chemistry, 2018, 258:16-24.
[4] ZHANG L, CAO Q Q, GRANATO D, et al.Association between chemistry and taste of tea:A review[J].Trends in Food Science &Technology, 2020, 101:139-149.
[5] WANG X L, XU K J, TAN Y M, et al.Possibilities of using de novo design for generating diverse functional food enzymes[J].International Journal of Molecular Sciences, 2023, 24(4):3827.
[6] EJAZ U, SOHAIL M, GHANEMI A.Cellulases:From bioactivity to a variety of industrial applications[J].Biomimetics, 2021, 6(3):44.
[7] CHIANG S H, YANG K M, WANG S Y, et al.Enzymatic treatment in black tea manufacturing processing:Impact on bioactive compounds, quality, and bioactivities of black tea[J].LWT, 2022, 163:113560.
[8] 缪凤, 王俊懿, 朱海燕.外源纤维素酶对江华苦茶红茶品质的影响[J].食品工业科技, 2021, 42(17):38-46.MIAO F, WANG J Y, ZHU H Y.Effects of exogenous cellulase on the quality of black tea of JiangHua-KuCha[J].Science and Technology of Food Industry, 2021, 42(17):38-46.
[9] NARUKAWA M, KIMATA H, NOGA C, et al.Taste characterisation of green tea catechins[J].International Journal of Food Science &Technology, 2010, 45(8):1579-1585.
[10] ZHANG Y N, YIN J F, CHEN J X, et al.Improving the sweet aftertaste of green tea infusion with tannase[J].Food Chemistry, 2016, 192:470-476.
[11] CAO Q Q, ZOU C, ZHANG Y H, et al.Improving the taste of autumn green tea with tannase[J].Food Chemistry, 2019, 277:432-437.
[12] BENUCCI I, R O SEGADE S, CERRETI M, et al.Application of enzyme preparations for extraction of berry skin phenolics in withered winegrapes[J].Food Chemistry, 2017, 237:756-765.
O SEGADE S, CERRETI M, et al.Application of enzyme preparations for extraction of berry skin phenolics in withered winegrapes[J].Food Chemistry, 2017, 237:756-765.
[13] FAN F Y, HUANG C S, TONG Y L, et al.Widely targeted metabolomics analysis of white peony teas with different storage time and association with sensory attributes[J].Food Chemistry, 2021, 362:130257.
[14] GUO X Y, HO C T, SCHWAB W, et al.Effect of the roasting degree on flavor quality of large-leaf yellow tea[J].Food Chemistry, 2021, 347:129016.
[15] 常睿, 罗红玉, 张丽, 等.不同萎凋温度和时间对夏季白茶品质的影响[J].南方农业学报, 2023, 54(7):2060-2070.CHANG R, LUO H Y, ZHANG L, et al.Effects of different withering temperatures and times on the quality of summer white tea[J].Journal of Southern Agriculture, 2023, 54(7):2060-2070.
[16] PATEL A K, SINGHANIA R R, SIM S J, et al.Thermostable cellulases:Current status and perspectives[J].Bioresource Technology, 2019, 279:385-392.
[17] ABDULHAMEED S, RAKHY S, SWAROOP S K.Green Bio-processes[M].Berlin:Springer Nature, 2019:357-381.
[18] WANG H J, HUA J J, YU Q Y, et al.Widely targeted metabolomic analysis reveals dynamic changes in non-volatile and volatile metabolites during green tea processing[J].Food Chemistry, 2021, 363:130131.
[19] BANERJEE S, JOSHI U, SINGH A, et al.Lipids for taste masking and taste assessment in pharmaceutical formulations[J].Chemistry and Physics of Lipids, 2021, 235:105031.
[20] STARK T, BAREUTHER S, HOFMANN T.Sensory-guided decomposition of roasted cocoa nibs (Theobroma cacao) and structure determination of taste-active polyphenols[J].Journal of Agricultural and Food Chemistry, 2005, 53(13):5407-5418.
[21] WEI F, LUO L Y, ZENG L.Characterization of key sweet taste compounds in Camellia nanchuanica black tea[J].LWT, 2023, 182:114858.
[22] GREEN B G, LIM J, OSTERHOFF F, et al.Taste mixture interactions:Suppression, additivity, and the predominance of sweetness[J].Physiology &Behavior, 2010, 101(5):731-737.
[23] 阚建全,庞杰, 赵永焕, 等. 食品化学[M]. 北京:中国农业大学出版社,2008.KAN J Q, PANG J, ZHAO Y H, et al.Food Chemistry[M].Beijing:2nd ed.China Agricultural University Press, 2008.
[24] 杨娟, 徐泽, 吴全, 等.重庆针形名优绿茶香气特征及成分分析[J].食品与发酵工业, 2022, 48(18):256-264;270.YANG J, XU Z, WU Q, et al.Analysis of aroma characteristics and components of Chongqing famous needle shaped green tea[J].Food and Fermentation Industries, 2022, 48(18):256-264;270.
[25] GUICHARD E, BARBA C, THOMAS-DANGUIN T, et al.Multivariate statistical analysis and odor-taste network to reveal odor-taste associations[J].Journal of Agricultural and Food Chemistry, 2020, 68(38):10318-10328.
[26] BARBA C, BENO N, GUICHARD E, et al.Selecting odorant compounds to enhance sweet flavor perception by gas chromatography/olfactometry-associated taste (GC/O-AT)[J].Food Chemistry, 2018, 257:172-181.
[27] 张慧, 郑璞, 陈鹏程.微生物法转化丁香酚产松柏醛[J].食品与发酵工业, 2016, 42(11):82-85;90.ZHANG H, ZHENG P, CHEN P C.Degradation of eugenol into coniferyl aldehyde by Gibberella strain ZH-34[J].Food and Fermentation Industries, 2016, 42(11):82-85;90.
[28] SEVC KOV
KOV Z, POUR M, NOV
Z, POUR M, NOV K D, et al.Chemical properties and biological activities of cyclopentenediones:A review[J].Mini Reviews in Medicinal Chemistry, 2014, 14(4):322-331.
K D, et al.Chemical properties and biological activities of cyclopentenediones:A review[J].Mini Reviews in Medicinal Chemistry, 2014, 14(4):322-331.
[29] PHAM D Q, PHAM H T, HAN J W, et al.Extracts and metabolites derived from the leaves of Cassia alata L.exhibit in vitro and in vivo antimicrobial activities against fungal and bacterial plant pathogens[J].Industrial Crops and Products, 2021, 166:113465.
 cial for the improvement of the taste quality of tea soup, precise control of tea beverage taste and utilization of the summer tea leaves.
cial for the improvement of the taste quality of tea soup, precise control of tea beverage taste and utilization of the summer tea leaves.