西索米星(sisomicin)是一种氨基糖苷类抗生素,由小单孢菌属产生的次级代谢产物[1]。并且,西索米星化学结构与庆大霉素相似,可作为庆大霉素合成的中间体[2],西索米星的生物合成途径如图1所示。此外,西索米星作为前体物还可进一步合成萘替米星(netilmicin)[3]和普拉佐米星(plazomicin)[4],而经化学结构改造后的萘替米星能显著降低肾毒性,可用于治疗革兰氏阴性杆菌所致的严重感染,因而西索米星具有广阔的应用前景和良好的经济效益。
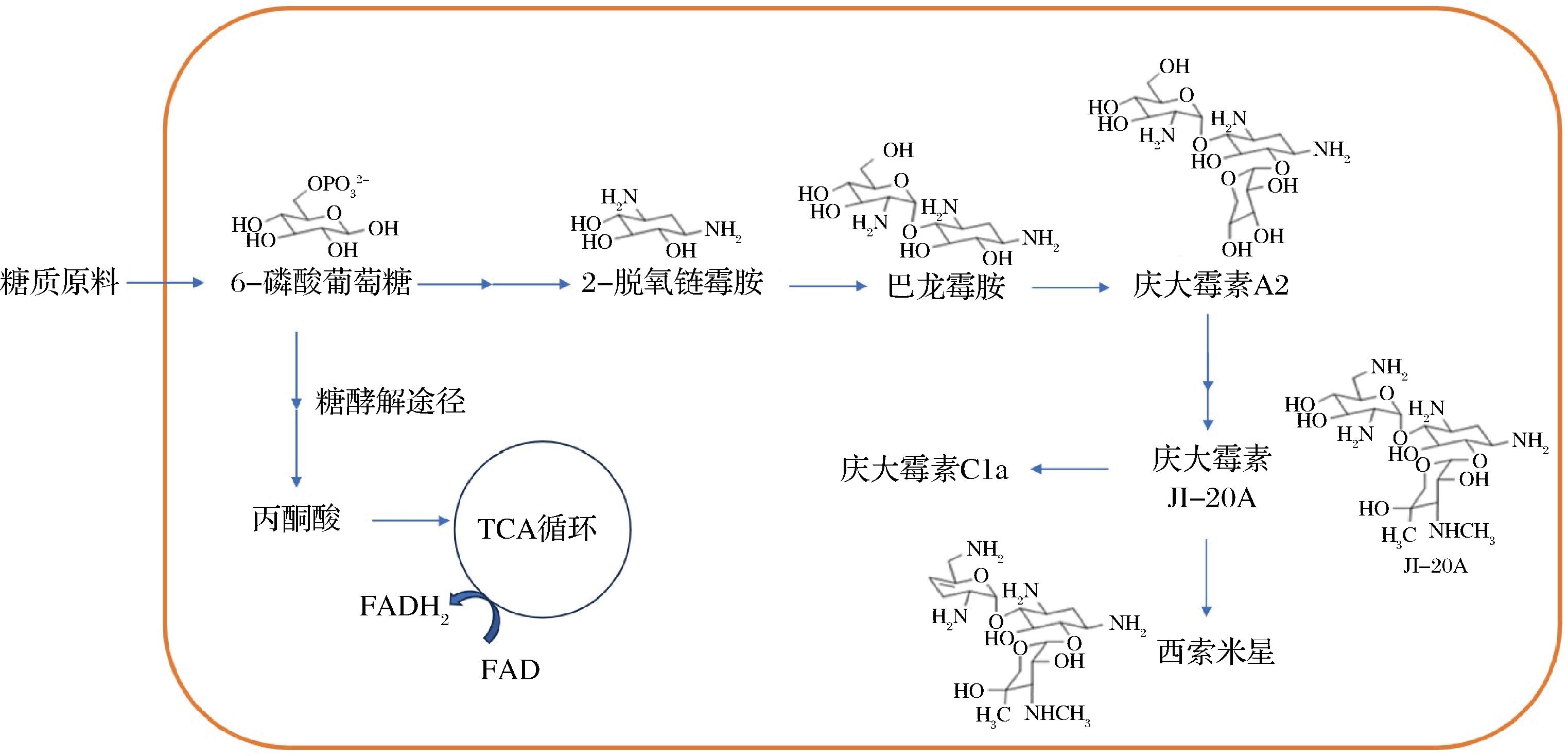
图1 西索米星的生物合成途径
Fig.1 Biosynthetic pathway of sisomicin
西索米星的主要生产工艺是微生物发酵法,常见的生产菌株为小单孢菌。由于野生型菌株积累西索米星的能力较低,提高西索米星效价的主要策略是高产菌株的选育,直接克隆天然产物的代谢途径在异源宿主中进行表达从而实现目标产物的高效合成已成为一种重要的菌种选育策略[5],然而,西索米星的合成途径及相关调控机制有待进一步解析[6-7],且针对西索米星生产菌株的分子改造技术尚有待发展。因此,传统的诱变育种仍然是有效的菌种选育手段。起初主要是针对生产菌株的诱变育种[8],之后,针对原生质体的诱变育种因具有更高的诱变效率而备受关注[9]。在此基础上,开展碳氮源、营养因子以及溶氧策略的发酵工艺优化是进一步提高西索米星高效合成的有效策略[8,10-11]。
组学技术(包括基因组学、转录组学和代谢组学等)的发展,为菌株代谢差异的分析提供了方便[12],并为进一步的代谢改造及基于代谢调控的发酵优化提供了指导[12]。代谢组学是通过定性定量地分析代谢产物变化来研究生物体系的一门技术,代谢组学直接联系基因型和表型,通过分析不同基因型代谢物的变化可以确定不同未知基因的功能,已成功应用于抗生素帕马霉素[13]等生产菌株的代谢差异分析。
本课题组前期制备了伊尼奥小单孢菌原生质体,通过化学诱变育种选育出一株高产菌株[14],该研究首先比较了出发菌株和突变菌株的发酵特性,而后结合代谢网络分析出发菌株和突变菌株的代谢特征,进而利用代谢组学方法探究突变菌株高效合成西索米星的代谢变化。在此基础上,选择影响较大的代谢物,考查其添加对西索米星合成的影响,为菌株的进一步改造和基于代谢调控的发酵优化提供了指导和参考。
1 材料与方法
1.1 菌株与材料
西索米星生产菌株出发菌株伊尼奥小单孢菌OG-1和高产菌株伊尼奥小单孢菌H6-32均为本实验室保存。Bacillus pumilus [CMCC(B) 63 202]为本实验室保存菌株,用于西索米星生物效价的鉴定。西索米星标准品(仅用于效价测定),中国食品药品检定研究院;玉米淀粉,阿拉丁(上海)工业公司;玉米浆干粉,源叶生物(上海)科技有限公司;牛肉粉、抗生素鉴定培养基,索莱宝(北京)科技有限公司;黄豆饼粉、鱼粉,无锡卓和药业有限公司;其他试剂均购自国药集团有限公司。
1.2 实验仪器
KQ-800KDE超声波清洗器,昆山市超声仪器有限公司;TGL-18M冷冻离心机,上海卢湘仪离心机仪器有限公司;HYL-C组合式摇床,太仓强乐实验设备有限公司;UV-2000Z紫外分光光度计,尤尼柯(上海)仪器有限公司;Starter 5000 pH计,奥豪斯国际商贸(上海)有限公司;CT65A高压蒸汽灭菌锅,上海伯能仪器有限公司;DW-86L728J超低温冰箱,海尔集团公司;ADVENTURER电子天平,奥豪斯国际商贸(上海)有限公司。
1.3 培养基及培养方法
1.3.1 培养基
斜面培养基(g/L):可溶性淀粉10,蔗糖5,KNO3 1,NaCl 0.5,K2HPO4 0.5,CaCO3 3,FeSO4·7H2O 0.5,琼脂粉20。
种子培养基(g/L):玉米淀粉30,黄豆饼粉20,玉米浆1,CaCO3 3,MgSO4·7H2O 1,pH 7.2~7.4。
发酵培养基(g/L):玉米淀粉20,黄豆饼粉40,白糊精40,玉米浆干粉6,DL-蛋氨酸2.5,MgSO4·7H2O 0.3,CoCl2·6H2O 0.02,K2HPO4 0.5,CaCO3 3,pH 7.0~7.2。
1.3.2 培养方法
在相同的发酵条件下,发酵培养西索米星出发菌株OG-1和高产菌株H6-32,每组设置6个平行,分别于菌株的对数生长期(36 h)、产物合成初期(72 h)和产物合成后期(120 h)取样,发酵液液氮速冻,保存于超低温冰箱(-80 ℃)。
1.4 分析方法
伊尼奥小单孢菌的生物量检测方法为菌体干重法,西索米星的生物效价检测方法采用管碟法[15],总糖浓度检测方法为DNS法。
1.5 代谢组学分析
本次LC-MS分析的仪器平台为赛默飞公司的超高效液相色谱串联傅里叶变换质谱UHPLC-Q Exactive HF-X系统。
色谱条件:色谱柱为ACQUITY UPLC HSS T3(100 mm×2.1 mm i.d., 1.8 μm;Waters, Milford, USA);流动相A为95%水+5%乙腈(含0.1%甲酸,体积分数,下同),流动相B为47.5%乙腈+47.5%异丙醇+5%水(含0.1%甲酸),进样量为3 μL,柱温为40 ℃。
1.6 数据处理分析
实验数据均用“平均值±标准差”处理,处理结果使用统计学软件SPSS进行分析,并根据需要利用ANOVA来验证统计分析结果,P<0.05被认为具有统计学意义。
2 结果与分析
2.1 出发菌株和突变菌株的发酵特性比较
首先考察了出发菌株伊尼奥小单孢菌OG-1和高产菌株伊尼奥小单孢菌H6-32的发酵特性,结果如图2所示,发酵到136 h时,菌体生物量(湿重)分别为320 mg/mL和380 mg/mL,高产菌株较出发菌株提高了18.8%(图2-a);产物西索米星的效价分别为1 042 U/mL和1 486 U/mL,高产菌株较出发菌株提高了42.6%(图2-b);产物西索米星的效价对菌体的得率Yp/x分别为3.26 U/mg和3.91 U/mg,高产菌株较出发菌株提高了19.9%(图2-c);产物西索米星的效价对底物的得率Yp/s分别为353.8 U/g和190.8 U/g,高产菌株较出发菌株提高了85.4%(图2-d)。上述结果表明高产菌株具有更优的西索米星合成性能,且经过优化后可进一步提升西索米星的合成能力[14]。探索高产菌株和出发菌株的代谢差异对于菌株的进一步改造和基于代谢调控的发酵优化具有指导性意义。
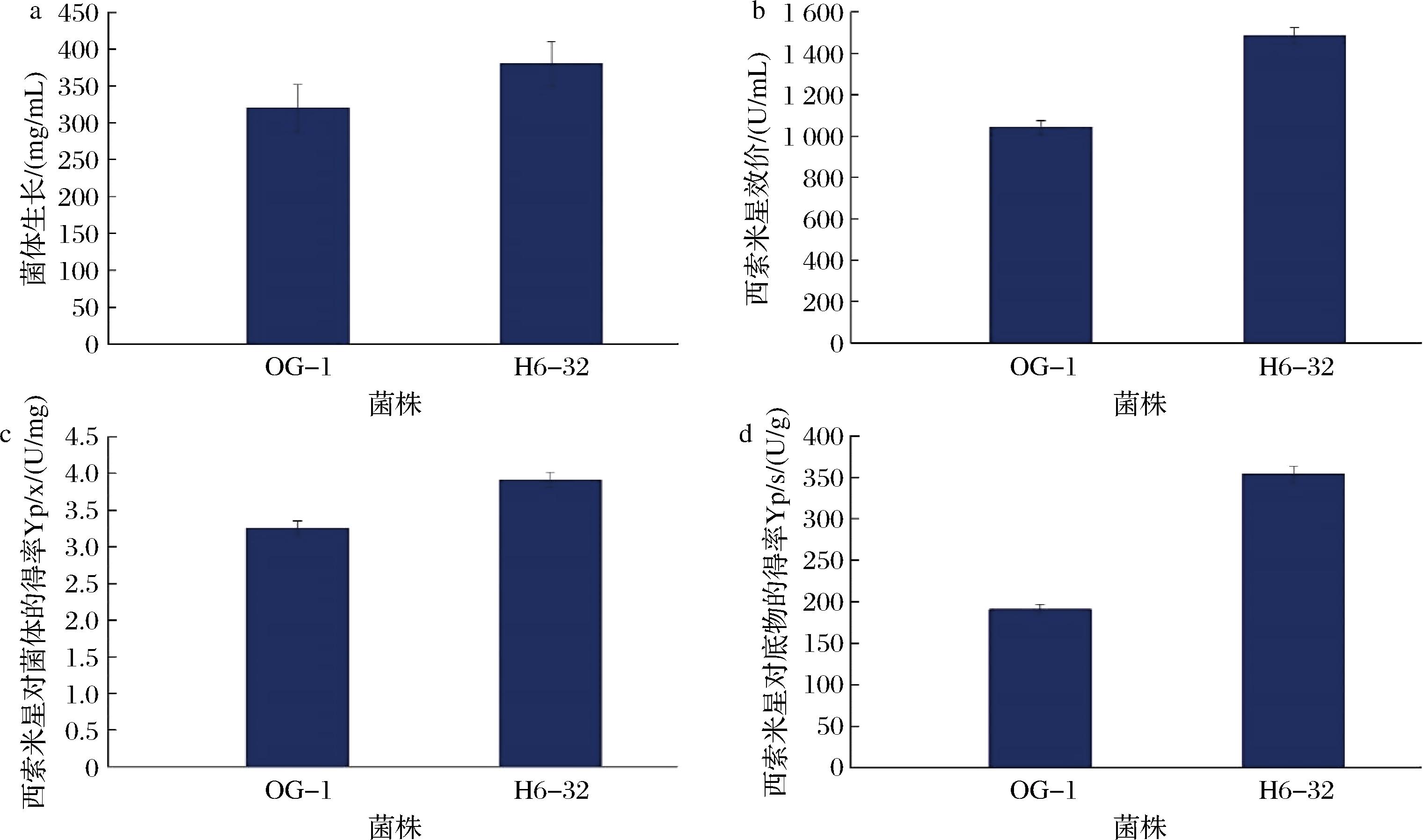
a-菌体生长(湿重);b-西索米星效价;c-西索米星对菌体的得率;d-西索米星对底物的得率
图2 出发菌株OG-1和高产菌株H6-32的发酵特性
Fig.2 Fermentation profile of the parent strain OG-1 and the mutant strain H6-32
2.2 样本比较分析
2.2.1 样本相关性热图
根据代谢物在不同样本间的表达情况,对样本的进行相关性热图分析(图3)和主成分分析(principal component analysis,PCA),评价组内样本的相似性和组间样本的差异性。首先对样本进行相关性分析,结果表明,相同时间的样本比不同时间样本显示出更强的相关性。

图3 样本相关性热图
Fig.3 Sample correlation heat map
2.2.2 样本相关性热图
对样本进行偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA)。由图4可知,样品呈现组内聚集,组间分离的特点,说明各组样品代谢具有显著差异。另外,PLS-DA置换检验中R2Y和Q2在正负离子模式下的值分别为,正:0.202和-0.657,负:0.198和-0.612 4。以上结果均表明模型拟合良好,可预测性强,适合后续数据分析。
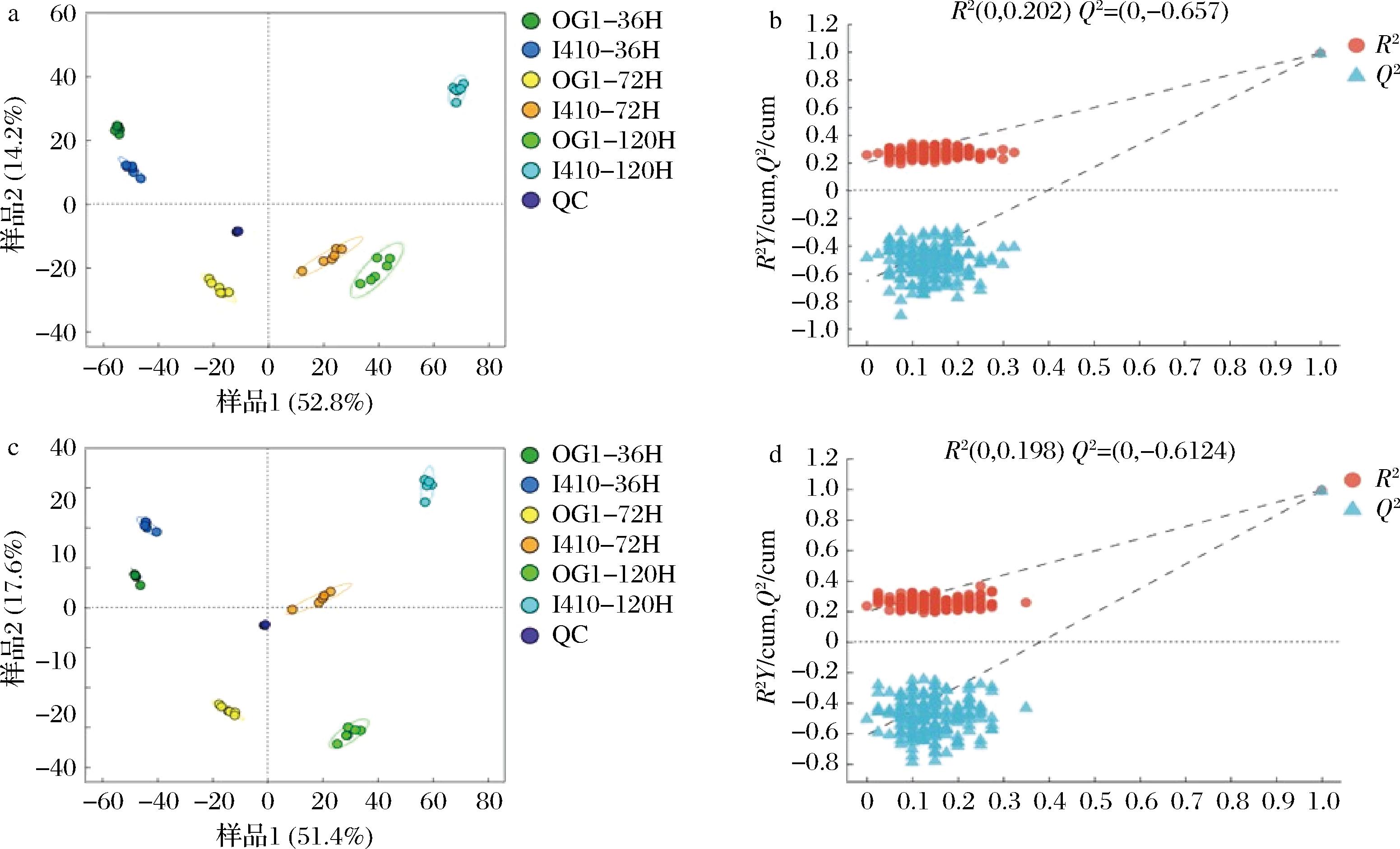
a-正离子模式下的PLS-DA得分图;b-正离子模式下的置换检验图;c-负离子模式下的PLS-DA得分图;d-负离子模式下的置换检验图
图4 正、负离子模式下的PLS-DA得分图和置换检验图
Fig.4 PLS-DA score chart and permutation test chart for positive and negative ion modes
2.3 代谢物注释分析
2.3.1 KEGG代谢物分类
KEGG Compound是小分子、生物聚合物和其他与生物系统相关的化学物质的集合。KEGG Compound分类是按照代谢物参与的生物学功能层级等级进行分类。将鉴定的代谢物比对到KEGG Compound数据库,结果显示,脂类代谢物数量最多,共60种,且脂类中数量最多的是磷脂,占39种;其次是氨基酸,一共有22种;羧酸有12种;单糖类有11种,另外,辅因子和维生素各有4种(图5-a)。
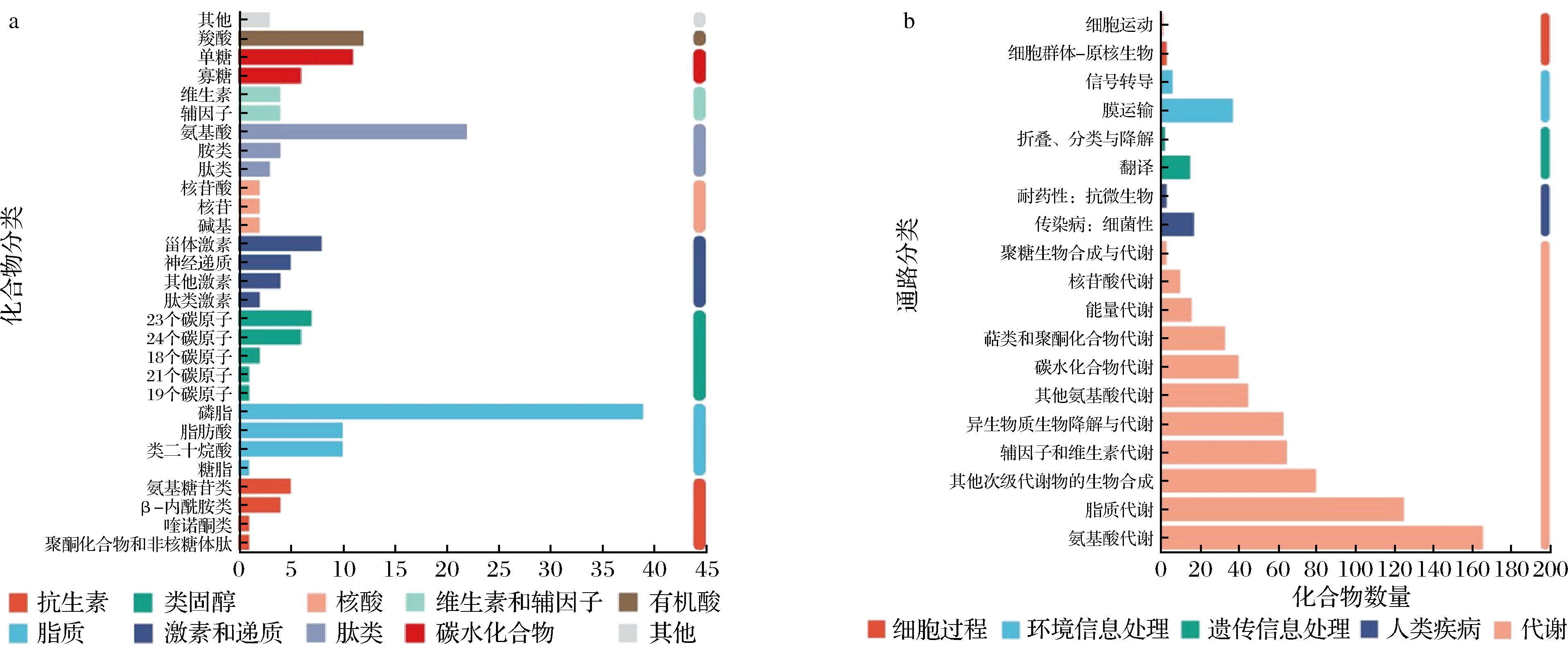
a-KEGG代谢物分类图;b-KEGG功能通路分析
图5 KEGG化合物分类图和代谢物KEGG通路分析
Fig.5 KEGG compound classification diagram and metabolite KEGG pathway analysis
2.3.2 KEGG功能通路分析
KEGG代谢通路可分为7大类:代谢(metabolism)、遗传信息处理(genetic information processing)、环境信息处理(environmental information processing)、细胞过程(cellular processes)、生物体系统(organismal systems)、人类疾病(human diseases)、药物开发(drug development)。条形的颜色表示不同代谢途径类别。对代谢物进行KEGG通路分析,结果显示,绝大部分代谢物属于代谢类,且在代谢类中最多的是氨基酸代谢,其次是脂质代谢和次级代谢物的生物合成,以及辅因子类的代谢(图5-b)。
2.4 差异代谢物分析
2.4.1 发酵不同时期的差异代谢物
2株菌在不同发酵时期的代谢物差异显著,结果显示,发酵36 h时鉴定出673个差异代谢物,这些代谢物中,有207个差异代谢物显著上调和466个差异代谢物显著下调;发酵72 h时鉴定出623个差异代谢物,这些代谢物中,286个差异代谢物显著上调和337个差异代谢物显著下调;发酵120 h时,鉴定出656个差异代谢物,这些代谢物中,388个差异代谢物显著上调和268个差异代谢物显著下调。其中有170个差异代谢物的丰度在3个发酵时间均存在显著差异(图6-a)。接下来,对重要类型的差异代谢物进行比较分析。
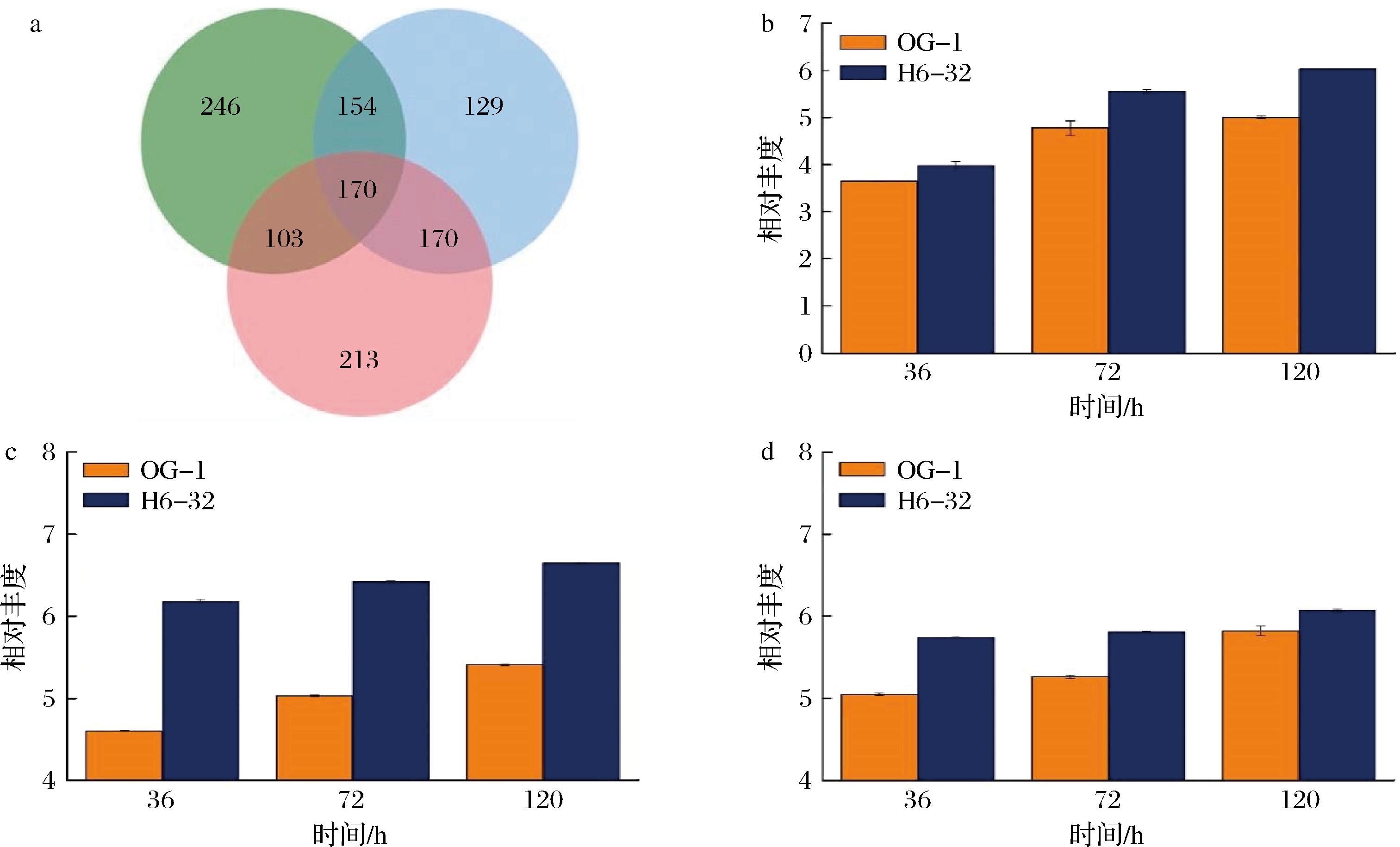
a-不同代谢物的韦恩图;b-黄素单核苷酸(FMN);c-赖氨酸;d-组氨酸
图6 OG-1和H6-32不同发酵时期差异代谢物Venn图和关键代谢物变化
Fig.6 Venn diagram of different metabolites of OG-1 and H6-32 in different fermentation periods and changes in key metabolites
2.4.2 与中心代谢途径相关的关键代谢物变化
在三羧酸循环中,主要的差异代谢物为氧化磷酸化反应涉及到的黄素单核苷酸(flavin mononucleotide,FMN)。FMN在高产菌株H6-32中的丰度较对照菌株OG-1分别提高了9.26%、16.32%和20.44%(图6-b)。FMN和黄素腺嘌呤二核苷酸(flavin adenosine dinucleotide,FAD)是黄酶的辅基,且FMN和腺苷酸结合可进一步转化为FAD,高产菌株中黄素单核苷酸具有更高的丰度,表明FAD作为辅因子参与的反应可得到增强[16],而需要FAD作为辅因子参与的三羧酸循环可为西索米星的合成提供更多的前体物以及更充足的能量供给。
2.4.3 与氨基酸代谢相关的关键代谢物变化
考察了诱变前后菌株氨基酸在发酵过程中(36~120 h)的变化情况,研究结果显示,赖氨酸和组氨酸在高产菌株H6-32中的丰度显著高于OG-1。赖氨酸在OG-1和H6-32中的丰度呈现上升的趋势,较OG-1在H6-32中的相对丰度分别提高了34.3%、27.6%和22.9%(图6-c);组氨酸在OG-1和H6-32中的相对丰度呈现上升的趋势,较OG-1,在H6-32中的丰度分别提高了13.7%、10.4%和4.3%(图6-d)。该研究中,氨基酸的添加提高了西索米星的合成,其中赖氨酸的添加对西索米星效价提高效果更好。类似的发现已有报道,雷帕霉素突变菌株中胞内赖氨酸具有更高的浓度预示着赖氨酸在雷帕霉素的合成中发挥着重要的作用[17]。
2.4.4 与抗生素代谢相关的关键代谢物变化
在出发菌株OG-1和高产菌株H6-32的发酵过程中,有多种抗生素的丰度发生了变化。目标产品西索米星的丰度在发酵过程中呈现上升的趋势,且H6-32的丰度高于OG-1(图7-a);N-乙酰氨基葡萄糖在发酵过程中呈现出先上升后下降的趋势,特别是H6-32发酵到120 h时N-乙酰氨基葡萄糖的丰度显著下降,预示着强化N-乙酰氨基葡萄糖的转化与西索米星高效合成具有相关性(图7-b);对于庆大霉素C2的丰度,OG-1中呈现先上升再下降的趋势,而H6-32中呈现下降的趋势(图7-c);萘替米星的丰度在OG-1和H6-32中的变化趋势基本一致(图7-d)。西索米星和庆大霉素C2具有类似的合成途径[6-7],巴龙霉胺(paromamine)是西索米星和庆大霉素C2共同的前体[6],而D-氨基葡萄糖可能是巴龙霉胺的前体物[18]。关于庆大霉素C2的合成机制[19]与改造策略[20]已有报道,为后续研究提供了参考。针对N-乙酰氨基葡萄糖的显著变化,其原因一方面可能是N-乙酰氨基葡萄糖和D-氨基葡萄糖在代谢途径上存在关联性[21],N-乙酰氨基葡萄糖的变化会影响D-氨基葡萄糖的代谢通量,进而影响到西索米星前体物巴龙霉胺的合成;另一方面,N-乙酰氨基葡萄糖与细胞壁的结构有关,其含量的改变会影响到细胞壁的结构[22]。
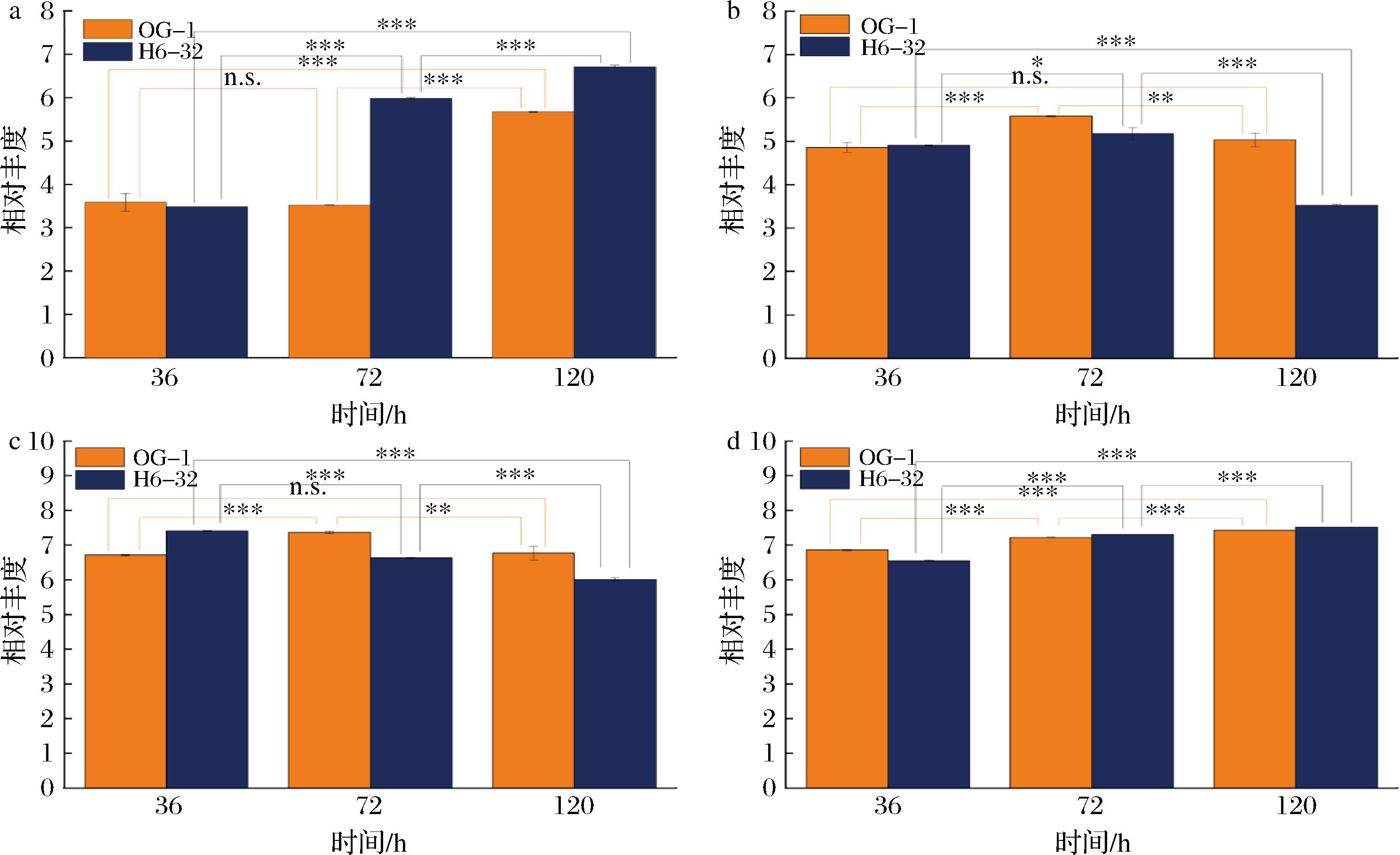
a-西索米星;b-N-乙酰氨基葡萄糖;c-庆大霉素C2;d-萘替米星
图7 与抗生素代谢相关的关键代谢物在不同发酵时期的丰度
Fig.7 The abundances of key metabolites associated with antibiotic metabolism in different fermentation periods
注:**表示差异极显著,P<0.01;***表示差异极其显著,P<0.001;n.s表示差异不显著,P>0.05。
2.5 基于差异代谢物分析探究强化西索米星合成的策略
通过以上分析发现,中心代谢途径中的FMN、氨基酸代谢途径中的赖氨酸和组氨酸、以及抗生素代谢途径相关的N-乙酰氨基葡萄糖的丰度均对西索米星的合成造成显著影响,其中,赖氨酸丰度的差异最大。基于此,该研究首先考查了不同浓度赖氨酸的添加对高产菌株H6-32合成西索米星的影响。研究结果如图8-a所示,随着添加浓度的增加,西索米星的效价呈上升趋势,当赖氨酸的添加质量浓度为3 g/L时,西索米星的效价为1 682 U/mL,较对照不添加时增加了13.2%。进一步增加赖氨酸的浓度,西索米星的效价趋于稳定;在此基础上,该研究进一步考查了最优赖氨酸添加浓度的最佳添加时间。研究结果如图8-b所示,研究发现,24 h添加时,西索米星的效价为1 870 U/mL,较发酵起始时添加提高了11.2%,较不添加时提高了25.8%,过早过晚添加对西索米星合成的促进作用均较小。类似地,赖氨酸等氨基酸在雷帕霉素的合成中发挥着重要的作用,进一步研究发现赖氨酸的添加,导致雷帕霉素的效价增加到添加前的2.4倍[17]。对于微白黄链霉菌(Streptomyces albidoflavus)合成尼博霉素,赖氨酸与前体物质及CoA的供给有关[23]。并且,赖氨酸与雷帕链霉菌(S.rapamycinicus)合成雷帕霉素有关[24]。对于本研究中赖氨酸促进西索米星合成的机制有待进一步深入研究。
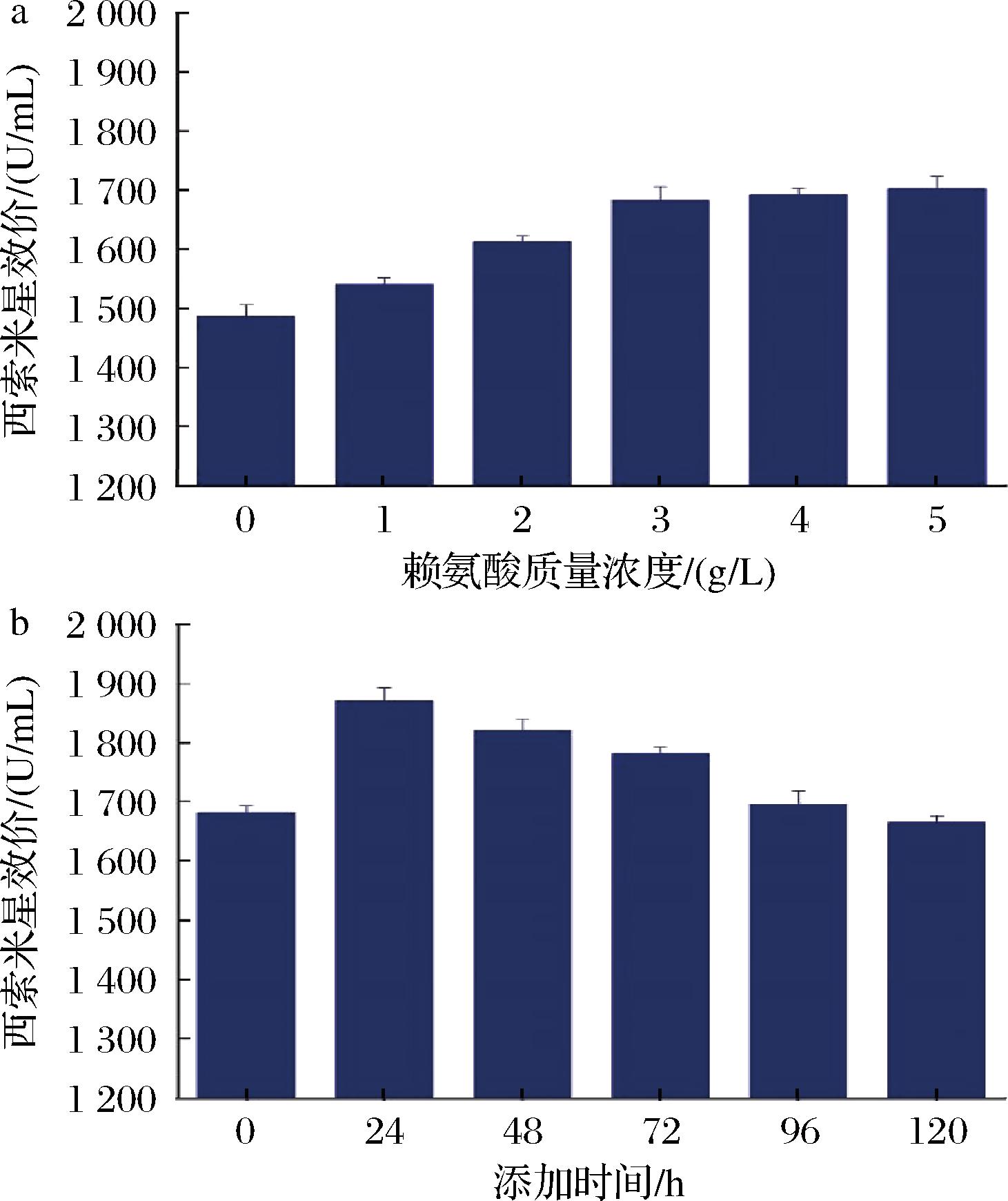
a-质量浓度;b-时间
图8 赖氨酸的添加对高产菌株H6-32合成西索米星的影响
Fig.8 Effects of lysine addition on the sisomycin synthesis by the mutant strain H6-32
3 结论与讨论
该研究以课题组前期选育的西索米星高产菌株和出发菌株为研究对象,在考察其发酵特性差异的基础上,利用非靶向代谢组学技术对其代谢差异进行分析,KEGG功能通路分析发现:绝大部分代谢物属于代谢类,其中最多的代谢物涉及到氨基酸代谢,其次是脂质代谢和次级代谢物的生物合成以及辅因子类的代谢。进一步分析发现高产菌株和出发菌株在不同发酵时期的代谢物差异显著,并基于代谢物差异,考查了代谢物的添加对西索米星合成的影响,主要研究结论如下:a)中心代谢途径中的主要差异代谢物为FMN;b)氨基酸代谢途径中的主要差异代谢物为赖氨酸和组氨酸;c)与西索米星合成途径相关的主要差异代谢物N-乙酰氨基葡萄糖的丰度显著下调;d)通过在合适时间添加适宜浓度的赖氨酸可强化西索米星的合成。上述发现可为西索米星生产菌株的进一步选育和发酵优化提供指导和参考。
[1] BECKERB, COOPER M A.Aminoglycoside antibiotics in the 21 st century[J].ACS Chemical Biology, 2013, 8(1):105-115.
[2] 吴亮亮, 常莹莹, 邓子新, 等.庆大霉素及其相关产物在工业底盘细胞中的高效合成[J].合成生物学, 2022, 3(6):1277-1291.WU L L, CHANG Y Y, DENG Z X, et al.Efficient synthesis of gentamicin and its related products in industrial chassis cells[J].Synthetic Biology Journal, 2022, 3(6):1277-1291.
[3] ZHANG F M, WANG Y T, YUAN Y, et al.Silver nanoparticles modified by β-cyclodextrin and γ-alumina as substrate for quantitative SERS detection of netilmicin[J].Talanta, 2023, 253:124054.
[4] NGO D, MAGA A A J, TRAN T, et al.Inhibition of enzymatic acetylation-mediated resistance to plazomicin by silver ions[J].Pharmaceuticals, 2023, 16(2):236.
A A J, TRAN T, et al.Inhibition of enzymatic acetylation-mediated resistance to plazomicin by silver ions[J].Pharmaceuticals, 2023, 16(2):236.
[5] TAO W X, CHEN L, ZHAO C H, et al.In vitro packaging mediated one-step targeted cloning of natural product pathway[J].ACS Synthetic Biology, 2019, 8(9):1991-1997.
[6] HONG W R, GE M, ZENG Z H, et al.Molecular cloning and sequence analysis of the sisomicin biosynthetic gene cluster from Micromonospora inyoensis[J].Biotechnology Letters, 2009, 31(3):449-455.
[7] NI X P, SUN Z P, GU Y W, et al.Assembly of a novel biosynthetic pathway for gentamicin B production in Micromonospora echinospora[J].Microbial Cell Factories, 2016, 15:1.
[8] 陈剑锋, 陈浩, 张元兴, 等.西索米星发酵工艺条件的优化[J].过程工程学报, 2006, 6(3):445-449.CHEN J F, CHEN H, ZHANG Y X, et al.Optimization of fermentation conditions on sisomicin biosynthesis[J].The Chinese Journal of Process Engineering, 2006, 6(3):445-449.
[9] 郑明坤, 黄家滨, 李友明, 等.ARTP诱变结合抗性筛选选育西索米星高产菌株[J].中国抗生素杂志, 2021, 46(1):42-48.ZHENG M K, HUANG J B, LI Y M, et al.Breeding of high-yield sisomicin strain through the combination of ARTP mutagenesis and resistance screening[J].Chinese Journal of Antibiotics, 2021, 46(1):42-48.
[10] 沈淑琳, 李会, 张晓梅, 等.西索米星生产菌株的诱变选育及工艺优化[J].食品与生物技术学报, 2023, 42(8):11-20.SHEN S L, LI H, ZHANG X M, et al.Mutation breeding of sisomicin producing strain and optimization of fermentation process[J].Journal of Food Science and Biotechnology, 2023, 42(8):11-20.
[11] LEE J H, GIL G H, CHO Y J, et al.Factors affecting sisomicin production by Micromonospora inyoensis[J].Korean Journal Apply Microbiol Bioengineer, 1986,14(5):355-358.
[12] LIAN C C, ZHANG M, MAO J Q, et al.Transcriptomic and metabolomic analyses for providing insights into the influence of polylysine synthetase on the metabolism of Streptomyces albulus[J].Microbial Cell Factories, 2022, 21(1):224.
[13] 刘秀雨. 基于代谢组学的白黄链霉菌TD-1帕马霉素高产技术研究[D].天津:天津科技大学;2023.LIU X Y.Study on the technology of Streptomyces alboflavus TD-1 with high pamamycin production based on metabonomics[D].Tianjin:Tianjin University of Science and Technology, 2023.
[14] XU J G, SHEN S L, HU Z H, et al.Enhanced production of sisomicin in Micromonospora inyoensis by protoplast mutagenesis and fermentation optimization[J].Applied Biochemistry and Biotechnology, 2024, 196(9):6459-6472.
[15] 国家药典委员会. 中华人民共和国药典:2010年版[M].增补本.北京:中国医药科技出版社, 2014.Chinese Pharmacopoeia Commission.Pharmacopoeia of the People’s Republic of China 2010[M].Beijing:China Medical Science Press.
[16] QIN Z J, YU S Q, CHEN J, et al.Dehydrogenases of acetic acid bacteria[J].Biotechnology Advances, 2022, 54:107863.
[17] WANG B H, LIU J, LIU H H, et al.Comparative metabolic profiling reveals the key role of amino acids metabolism in the rapamycin overproduction by Streptomyces hygroscopicus[J].Journal of Industrial Microbiology &Biotechnology, 2015, 42(6):949-963.
[18] REINHART K L Jr, MALIK J M, NYSTROM R S, et al.Biosynthetic incorporation of (1-13C) glucosamine and (6-13C) glucose into neomycin[J].Journal of the American Chemical Society, 1974, 96(7):2263-2265.
[19] LI S C, DOS SANTOS BURY P, HUANG F L, et al.Mechanistic insights into dideoxygenation in gentamicin biosynthesis[J].ACS Catalysis, 2021, 11(19):12274-12283.
[20] KONG Z J, TIAN T T, WANG R J, et al.Enhanced activity of C-3′ and C-4′ dideoxygenation of the aminoglycoside GenB3 by a semi-rational design strategy[J].Molecular Catalysis, 2024, 565:114380.
[21] 刘歆璐, 陈冯千芮, 张嘉颀, 等.氨基葡萄糖及N-乙酰氨基葡萄糖的生物合成研究进展[J].食品与发酵工业, 2023, 49(4):304-311.LIU X L, CHEN F, ZHANG J Q, et al.Research progress on the biosynthesis of glucosamine and N-acetyl glucosamine[J].Food and Fermentation Industries, 2023, 49(4):304-311.
[22] 牛文泽, 胡辉, 储炬, 等.棘孢小单孢菌绛红变种细胞壁肽聚糖对庆大霉素吸附机制的初步研究[J].中国抗生素杂志, 2003, 28(2):65-69.NIU W Z, HU H, CHU J, et al.Preliminary study of the mechanism of gentamicin bound by peptidoglycan of the cell wall of Micromonospora echinospore var[J].Chinese Journal of Antibiotics, 2003, 28(2):65-69.
[23] STEGMÜLLER J, RODR GUEZ ESTÉVEZ M, SHU W, et al.Systems metabolic engineering of the primary and secondary metabolism of Streptomyces albidoflavus enhances production of the reverse antibiotic nybomycin against multi-resistant Staphylococcus aureus[J].Metabolic Engineering, 2024, 81:123-143.
GUEZ ESTÉVEZ M, SHU W, et al.Systems metabolic engineering of the primary and secondary metabolism of Streptomyces albidoflavus enhances production of the reverse antibiotic nybomycin against multi-resistant Staphylococcus aureus[J].Metabolic Engineering, 2024, 81:123-143.
[24] HE W Y, WANG W F, MA J X, et al.Crossregulation of rapamycin and elaiophylin biosynthesis by RapH in Streptomyces rapamycinicus[J].Applied Microbiology and Biotechnology, 2022, 106(5-6):2147-2159.