鸡蛋清是鸡蛋的主要成分,体积约为全蛋的57%~58.5%,蛋白质含量约为12%,作为一种常用的动物源蛋白质,其良好的起泡性在充气食品体系(如烘焙)中应用广泛,通过形成稳定而细腻的泡沫赋予食品特定的质构[1]。大豆分离蛋白的蛋白质含量超过90%,是一种重要的植物蛋白资源[2],拥有很强的表面活性,可降低空气/油-水界面的表面张力。研究表明[3],食品蛋白的结构多功能性及两亲性使它们能够在某些条件下与食品中其他化合物通过氢键、静电相互作用和疏水相互作用结合,且与单一蛋白质相比,复合蛋白可以调节来自单一来源的蛋白质的技术功能特性,一些混合蛋白质体系在调节蛋白凝胶质地、乳液稳定性和起泡性能方面都非常有效。廖安等[4]发现在蛋清粉里添加大豆分离蛋白会影响蛋白质的带电状态,从而改变蛋白质的相互作用,以提高蛋清粉的起泡性能。有研究表明[5]添加大豆肽可以有效改善蛋清粉的起泡性,两者形成的灵活结构有利于其在气-液界面快速吸附,形成高弹性泡沫膜,但对泡沫稳定性的影响较小。起泡性和泡沫稳定性是衡量蛋白起泡性能的2个关键要素,所以对复合蛋白整体起泡性能的改善至关重要。
菊粉是植物中的储备性多糖,主要见于菊科植物,具有降低血糖、控制血脂、防便秘及治疗肥胖症等优异功效。一般作为增稠剂、糖脂替代品等被广泛应用于面制品、肉制品、饮料等各类食品中。已经发现,蛋白质-多糖在空气-水界面的络合增强了蛋白质的发泡性能,因为蛋白质-多糖之间的相互作用产生了高弹性界面膜。SUN等[6]发现在3%麦芽糖糊精存在下,通过增强表面疏水性和降低表面张力提高了蛋清蛋白发泡性能。![]() 等[7]发现黄原胶和卡拉胶都能够增加蛋清泡沫体系的密度以获得黏弹性泡沫。大豆分离蛋白与不同的带电多糖如壳聚糖、瓜耳豆胶、结冷胶通过氢键、弱静电相互作用等获得了更好的发泡性能[8]。研究还发现[9]添加一定浓度的菊粉对大豆分离蛋白的起泡性能也有明显的改良作用。综上,多糖对单一来源的蛋白质起泡性能均有良好的改善作用。此外,已有研究[10]提出高替代量的金针菇蛋白不利于肌原纤维蛋白复合凝胶的形成,但利用金针菇可溶性多糖改性金针菇蛋白显著提高了肌原纤维蛋白复合蛋白凝胶的品质。
等[7]发现黄原胶和卡拉胶都能够增加蛋清泡沫体系的密度以获得黏弹性泡沫。大豆分离蛋白与不同的带电多糖如壳聚糖、瓜耳豆胶、结冷胶通过氢键、弱静电相互作用等获得了更好的发泡性能[8]。研究还发现[9]添加一定浓度的菊粉对大豆分离蛋白的起泡性能也有明显的改良作用。综上,多糖对单一来源的蛋白质起泡性能均有良好的改善作用。此外,已有研究[10]提出高替代量的金针菇蛋白不利于肌原纤维蛋白复合凝胶的形成,但利用金针菇可溶性多糖改性金针菇蛋白显著提高了肌原纤维蛋白复合蛋白凝胶的品质。
目前对于多糖调节复合蛋白起泡性能的有关研究尚未报道。因此,本研究基于蛋清和大豆分离蛋白制备复合蛋白,再辅以菊粉制备多糖-复合蛋白复合物,并对该复合物进行表征,探究菊粉对复合蛋白起泡性能的影响,并对复合机理进行探究,为进一步应用和开发复合蛋白提供试验基础。
1 材料与方法
1.1 材料与试剂
鸡蛋,雅安市名山区黄家鲜养鸡场;大豆分离蛋白(≥90%),上海麦克林生化科技股份有限公司;菊粉(≥90%),上海市生工生物工程股份有限公司;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS),上海瑞永生物科技有限公司;NaOH、盐酸,成都市科隆化学品有限公司;PBS,北京索莱宝科技有限公司。
1.2 仪器与设备
HH-6J恒温磁力搅拌水浴锅,常州恩培仪器制造有限公司;JD100-3型电子天平,沈阳龙腾电子有限公司;RCD-1A高速均质乳化机,常州越新仪器制造有限公司;BZ1508手持充电式搅拌器,浙江嘉曼公司;Zetasizer Nano动态光纳米粒度电位仪,马尔文仪器公司;LGJ-18S冷冻干燥机,新艺超声设备有限公司;Lumina荧光分光光度计、Nicolet IS10傅里叶变换红外光谱仪,美国赛默飞公司;DYCZ-240电泳仪及电源,北京市六一仪器厂;L1物联智能可见分光光度计,上海佑科仪表有限公司。
1.3 实验方法
1.3.1 菊粉对蛋清-大豆分离蛋白起泡性能的影响
1.3.1.1 蛋清-大豆分离蛋白-菊粉复合物的制备
将新鲜完好的鸡蛋表面清洗消毒(4 g/L NaOH溶液浸泡3 min)后手动打碎分离。取蛋清用高速均质机分散,转速10 000 r/min均质4 min后用120目标准筛过滤[11],除去泡沫后获得原蛋清。
将原蛋清分散在蒸馏水中制备蛋白浓度为1%的蛋清,称取适量大豆分离蛋白溶解在蒸馏水中于磁力搅拌器上搅拌6 h后放入4 ℃冰箱静置过夜使其充分水合,过滤除去不溶物质得到蛋白浓度为1%的大豆分离蛋白。参照张燕鹏等[12]的方法,将蛋清和大豆分离蛋白分别按照质量比为4∶1混合,用0.1 mol/L HCl溶液将复合物pH值调至7,室温下搅拌1 h使其充分作用得到蛋清-大豆分离蛋白复合蛋白溶液,并将其作为试验对照组。随后将复合蛋白pH值调至8,分别添加0.2%、0.4%、0.6%、0.8%和1%的菊粉,40 ℃水浴反应60 min,反应完毕后立即冷却至室温后测定其起泡性能。
1.3.1.2 蛋清-大豆分离蛋白-菊粉复合物起泡性能的测定
参照CHEN等[13]的方法并稍作修改,将20 mL(V1)样品置于50 mL离心管中,使用搅拌器搅打1 min使溶液起泡,同时记录搅打后0 min和30 min的泡沫体积,起泡性(foam ability,FA)和泡沫稳定性(foam stability,FS)的计算如公式(1)、公式(2)所示:
(1)
(2)
式中:V2,0 min的泡沫体积,mL;V3,静置30 min后的泡沫体积,mL。
1.3.2 蛋清-大豆分离蛋白-菊粉复合物复合机理探究
1.3.2.1 粒径和ζ-电位
将样品稀释至1 mg/mL,使用动态光纳米粒度电位仪测定粒径分布及ζ-电位。测试参数为:颗粒类型:蛋白质,折射率1.45;分散相:水,折射率1.33。
1.3.2.2 十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)
参照PANOZZO等[14]的方法,将样品稀释至10 mg/mL,取15 μL样品与等体积的2倍上样缓冲液于沸水中混合反应5 min,冷却后取10 μL样品进行染色分析。
1.3.2.3 傅里叶红外光谱
参考XUE等[15]的方法,将样品冷冻干燥后研磨成粉,取30 mg样品与3 g烘干的KBr混合碾磨,制成薄片,在4 000~400 cm-1波数下,以空白KBr为背景收集样品红外光图谱。分辨率为4 cm-1,扫描次数32次。
1.3.2.4 表面疏水性
制备ANS作为疏水性荧光探针,用10 mmol/L PBS将样品稀释至0.1~0.5 mg/mL,pH值为7.2。设定激发波长390 nm,发射波长470 nm和狭缝宽度5 nm的条件。取20 μL ANS溶液(pH 7.2,8 mmol/L)与4 mL样品混合避光反应15 min,以荧光强度和蛋白浓度的初始斜率表征为表面疏水性[16]。
1.3.2.5 游离巯基含量
根据ZHAO等[17]的方法。游离巯基含量测定方法如下:将样品溶液调整至10 mg/mL,取0.5 mL样品加入4 mL Tris-Gly缓冲溶液(pH 8.0),充分混合后,向其中加入0.5 mL Ellman试剂(0.4 g 5,5-二硫代-2-硝基苯甲酸[5,5′-dithiobis-(2-nitrobenzoic acid),DTNB]溶于Tris-Gly缓冲液,定容至100 mL)。将混合物于40 ℃水浴反应15 min。通过紫外-可见分光光度计在412 nm波长处测得吸光度值A,以计算游离巯基基团,计算如公式(3)所示:
游离巯基![]()
(3)
式中:A,在412 nm处的吸光度;C,样品质量浓度,mg/mL;D,稀释倍数。
1.4 数据分析
所有试验均进行了3次重复,数据以“平均值±标准差”表示,采用SPSS 21软件进行数据处理(P<0.05,表示显著),采用Origin 2022软件进行图像绘制。
2 结果与分析
2.1 菊粉对蛋清-大豆分离蛋白起泡性能的影响
起泡性能的2个关键要素分别为FA和FS,起泡性定义为产生泡沫的能力,表征为泡沫体积的增加量,泡沫稳定性定义为泡沫在单位时间内的稳定性,表征为泡沫在一定时间内的液体析出率。如图1所示,与复合蛋白相比,添加菊粉的复合物起泡性和泡沫稳定性都得到显著提高。当菊粉添加量为0.8%时,蛋清-大豆分离蛋白-菊粉复合物起泡性和泡沫稳定性最好,起泡性由162.5%提升到201.88%,泡沫稳定性由47.68%提升到59.94%。
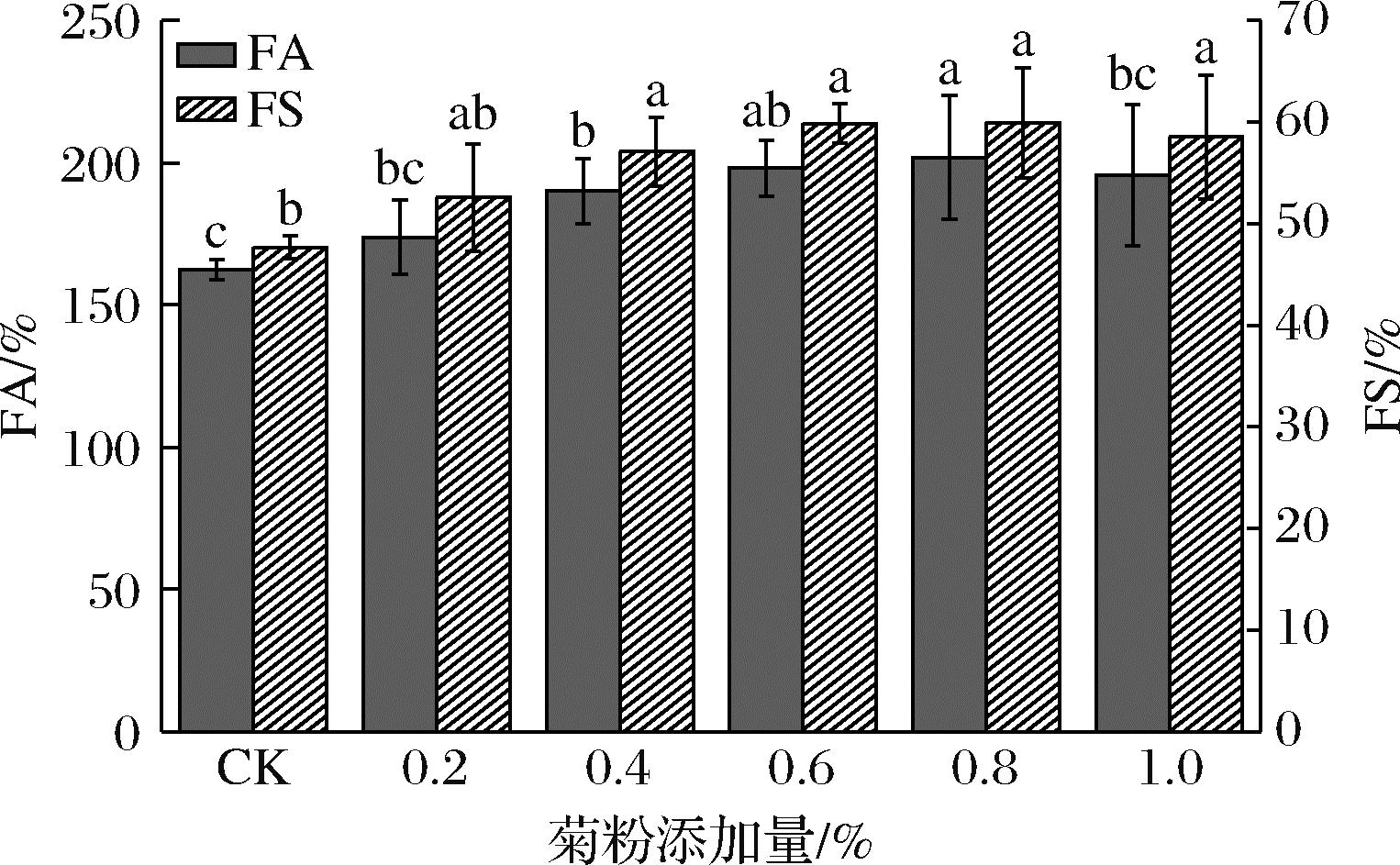
图1 菊粉对蛋清-大豆分离蛋白起泡性能的影响
Fig.1 Effect of inulin on the foaming properties of egg white-soy protein isolate
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 蛋清-大豆分离蛋白-菊粉复合物复合机理分析
2.2.1 粒径大小及ζ-电位分析
如图2-a所示,与空白组相比,添加菊粉的复合物平均粒径都显著降低,这可能是因为菊粉的加入使得复合蛋白聚集状态发生改变,结构变得松散,菊粉与其结合形成更加紧凑的复合物,所以粒径减小。另外从图2-b的ζ-电位图中也可以看出复合物的电位绝对值随着菊粉含量的增加呈现下降趋势。复合蛋白在pH值为8的条件下带负电荷,而菊粉本身不带电荷,这种情况下两者不会产生静电相互作用。但菊粉影响了复合蛋白的聚集状态,使其空间结构发生变化,暴露出的正电荷基团中和了部分负电荷基团,导致表面电势降低。ζ-电位的降低表明蛋白质分子与菊粉之间的排斥作用减小,两者更容易相互结合,空间结构发生改变[18],复合物能够快速吸附至界面形成黏弹性膜,提高了复合物的起泡性能。
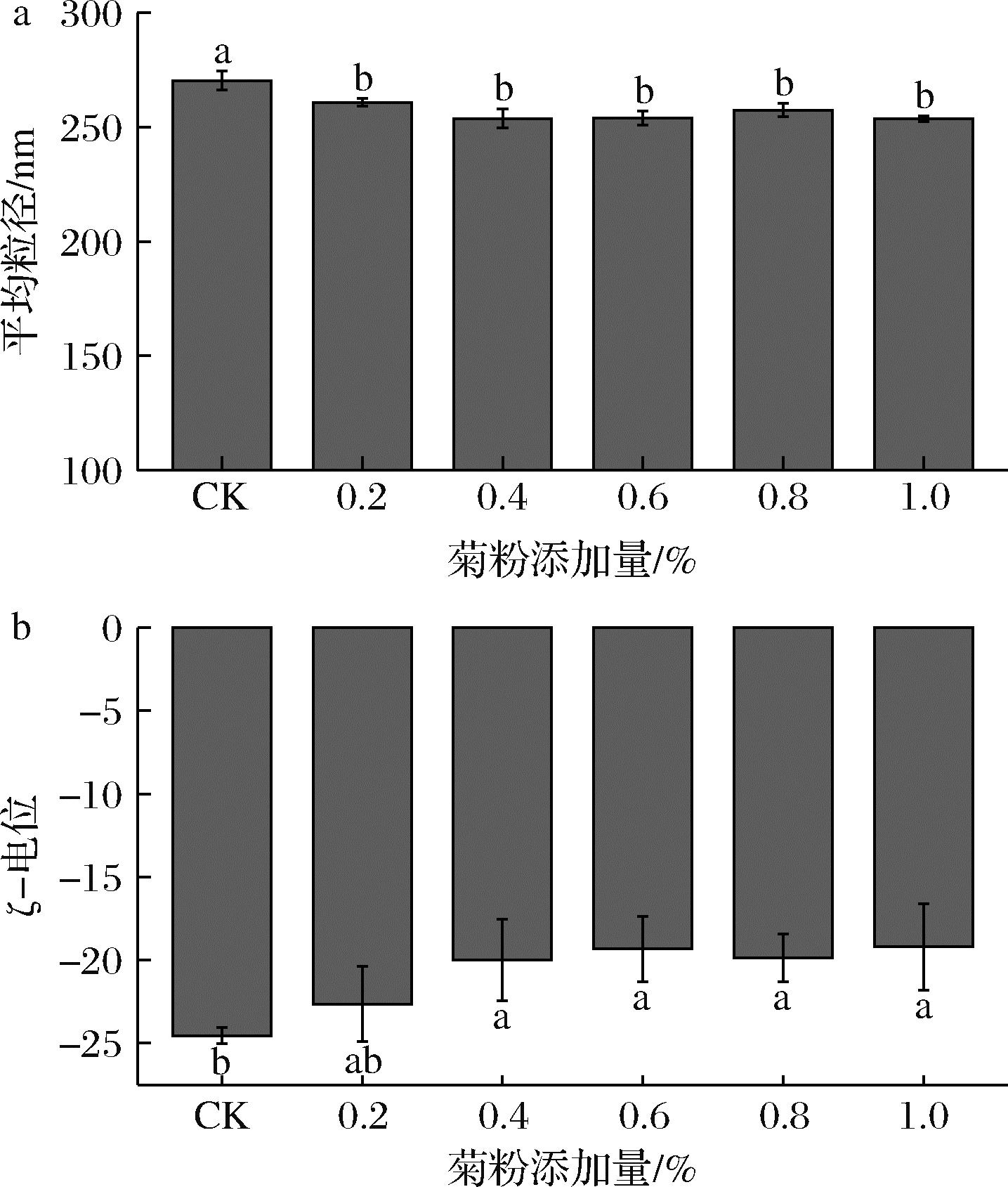
a-平均粒径图;b-Zeta电位图
图2 蛋清-大豆分离蛋白-菊粉复合物粒径及ζ-电位的变化
Fig.2 Changes in particle size and ζ-potential of egg white-soy protein isolate-inulin complexes
2.2.2 SDS-PAGE分析
SDS-PAGE用于分析蛋白质的一级结构变化。由图3可知,相比于蛋清蛋白与大豆分离蛋白,CK组复合蛋白的各特征分子条带更加清晰可见。不同菊粉添加量下的复合物条带分布无明显差异,没有条带消失或出现新的条带,说明菊粉与复合蛋白反应过程中保留了蛋白完整的一级结构。但相较于空白组,随着菊粉含量的增加,0.6%和0.8%菊粉添加量下的溶菌酶(15 kDa)条带颜色最浅,结合复合物起泡性能结果,这可能是因为复合物形成过程中菊粉结合部分溶菌酶生成了利于泡沫形成的更大分子的聚合物。卵清蛋白、卵转铁蛋白、7S α、α′、β亚基和11S A亚基(35~100 kDa)条带的蛋白质种类和丰度未出现显著差异,除此之外,卵黏蛋白(>140 kDa)高分子质量条带随着菊粉的增加逐渐变浅,表明菊粉的加入也会使得高分子聚合物部分解离,这与粒径分布结果一致。所以复合蛋白在菊粉存在下既有解离又有聚集,进一步证明了菊粉的加入改变了蛋白质聚集状态。
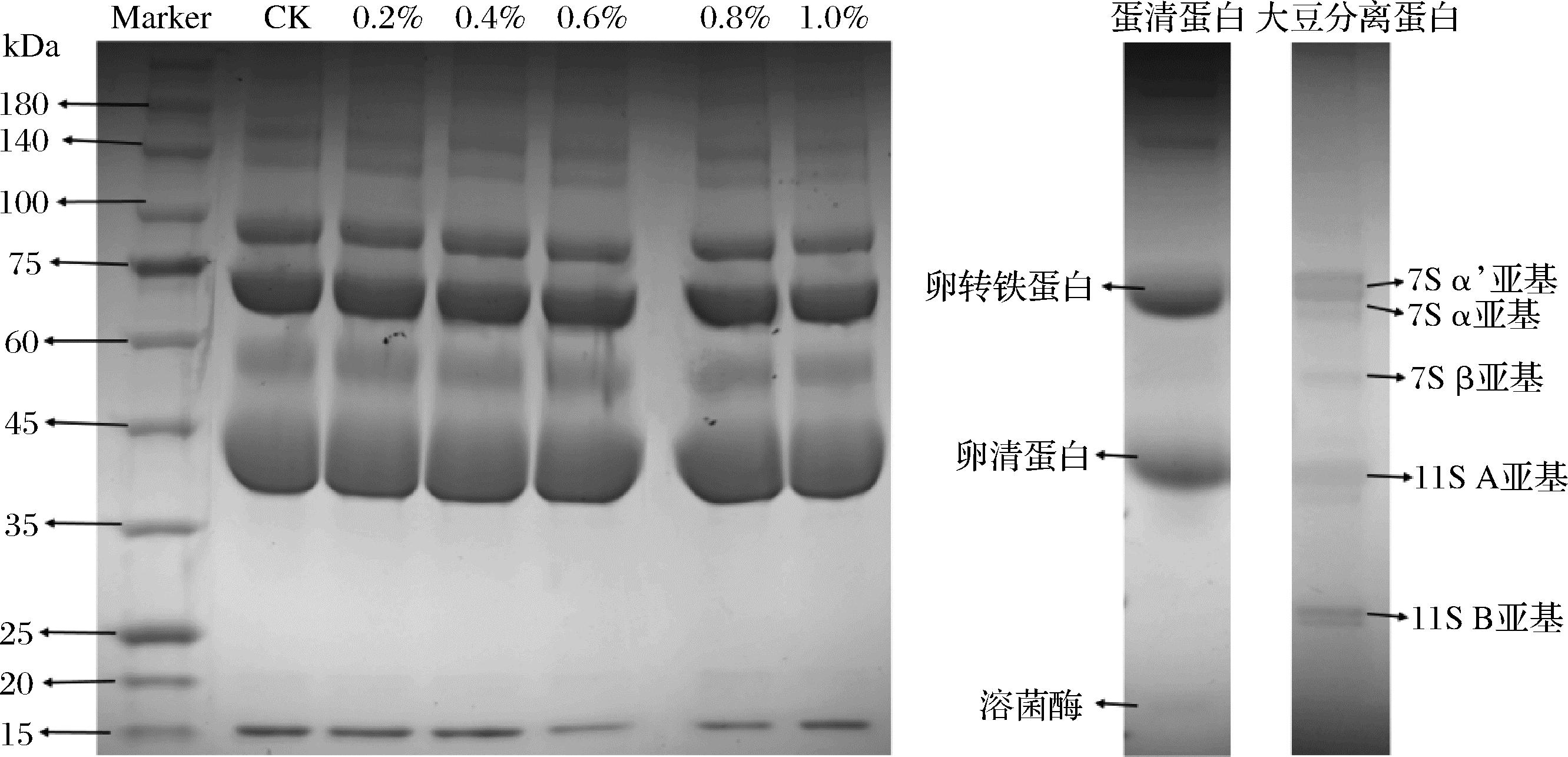
图3 蛋清-大豆分离蛋白-菊粉复合物凝胶电泳的变化
Fig.3 Changes in gel electrophoresis of egg white-soy protein isolate-inulin complexes
2.2.3 傅里叶红外光谱分析
此外,对傅里叶红外光谱图进行分析可以探究蛋白质二级结构的变化。由图4-b可知,相较于未添加菊粉的复合蛋白,添加菊粉的复合物光谱图没有出现新的吸收峰,说明没有新的共价键形成。随着菊粉含量的增加,复合物谱图在3 000~3 750 cm-1(O—H、N—H基团伸缩振动)处吸收峰逐渐增强,且当复合蛋白与菊粉结合时,峰值由3 300 cm-1移至3 305 cm-1,这说明菊粉与复合蛋白之间形成的氢键含量增加[19]。
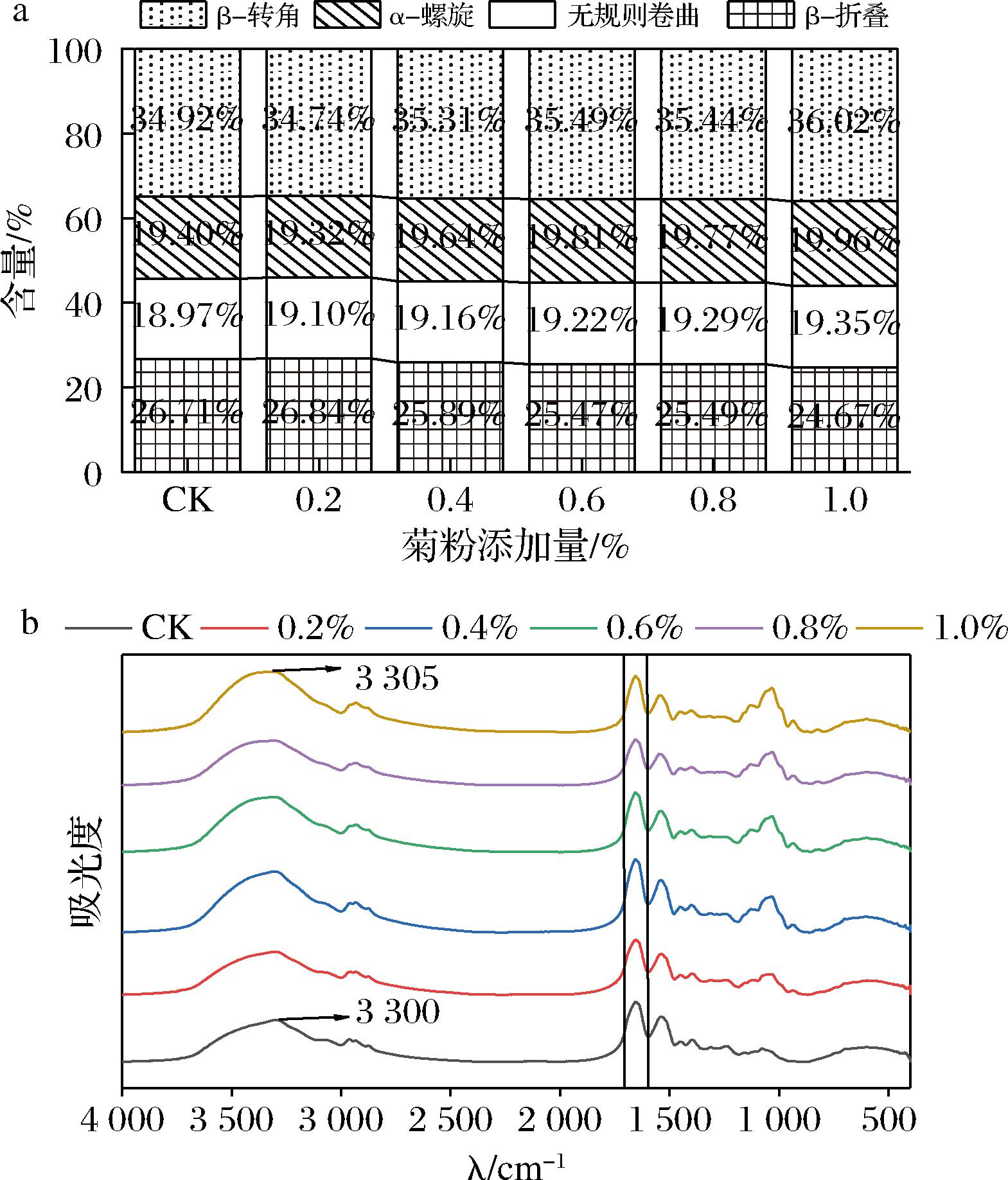
a-二级结构含量图;b-红外光谱图
图4 蛋清-大豆分离蛋白-菊粉复合物红外光谱图及二级结构含量的变化
Fig.4 Infrared spectroscopy and changes in secondary structure content of egg white-soy protein isolate-inulin complexes
复合蛋白在1 655 cm-1和1 536 cm-1处的吸收峰分别对应C![]() O伸缩振动(酰胺Ⅰ带)与C—N伸缩振动(酰胺Ⅱ带),酰胺Ⅰ带特征峰通常用于分析蛋白质二级结构的变化,蛋白质的二级结构中,α-螺旋和β-折叠是有序的,β-转角相对松散且部分有序,无规则卷曲松散且无序。添加菊粉的复合物酰胺Ⅰ带特征峰明显增强,说明菊粉的加入会使复合蛋白的二级结构发生转化。如图4-a所示,与复合蛋白相比,添加菊粉的复合物β-折叠含量下降,β-转角、无规则卷曲和α-螺旋含量都有不同程度的增加。说明复合物的形成过程中,既发生了有序结构的解离,也存在无序结构的聚集。β-折叠结构的减少说明复合物发生了去折叠,α-螺旋重新折叠,进一步证明了氢键的增强[20-21],有助于形成更多的分子间相互作用。综上,菊粉可以与复合蛋白通过形成氢键导致蛋白质构象改变,进而促进蛋白质在空气-水界面的吸附与重排。
O伸缩振动(酰胺Ⅰ带)与C—N伸缩振动(酰胺Ⅱ带),酰胺Ⅰ带特征峰通常用于分析蛋白质二级结构的变化,蛋白质的二级结构中,α-螺旋和β-折叠是有序的,β-转角相对松散且部分有序,无规则卷曲松散且无序。添加菊粉的复合物酰胺Ⅰ带特征峰明显增强,说明菊粉的加入会使复合蛋白的二级结构发生转化。如图4-a所示,与复合蛋白相比,添加菊粉的复合物β-折叠含量下降,β-转角、无规则卷曲和α-螺旋含量都有不同程度的增加。说明复合物的形成过程中,既发生了有序结构的解离,也存在无序结构的聚集。β-折叠结构的减少说明复合物发生了去折叠,α-螺旋重新折叠,进一步证明了氢键的增强[20-21],有助于形成更多的分子间相互作用。综上,菊粉可以与复合蛋白通过形成氢键导致蛋白质构象改变,进而促进蛋白质在空气-水界面的吸附与重排。
2.2.4 表面疏水性分析
表面疏水性是蛋白质的疏水基团与溶液中水的极性基团接触数量的指标[22],通过比较蛋白质的亲水/疏水特性可以分析蛋白质三级结构的变化,也可以用来表征蛋白质与多糖的相互作用。如图5所示,以复合蛋白为对照,当添加少量菊粉时,菊粉处于极性环境[23],倾向于自发地与蛋白质上的疏水基团结合,以减弱复合物的界面自由能,从而诱导更多的疏水基团暴露。当添加更多菊粉(0.4%、0.6%和0.8%)时,复合物表面疏水性明显下降,这可能是因为菊粉与复合蛋白之间发生非共价相互作用,菊粉与蛋白分子暴露的部分疏水区域结合。同时由于菊粉的加入使得复合蛋白结构变得松散,表面结构的亲水基团与更多的水分子结合,疏水基团隐藏在了分子内部,导致表面疏水性下降。也可能是菊粉带入额外的亲水性羟基基团改变了环境的极性,亲水性增强,则疏水性下降[24]。而表面疏水性的降低依赖于蛋白质与蛋白质和蛋白质与多糖的相互作用,添加适当浓度菊粉形成的气-液界面膜接触面适中,阻止了气泡粗化,起泡性能增强[25]。此外,过量的菊粉可能通过氢键与蛋白质上的羧基和氨基相互作用,并增强某些侧链基团的疏水性。
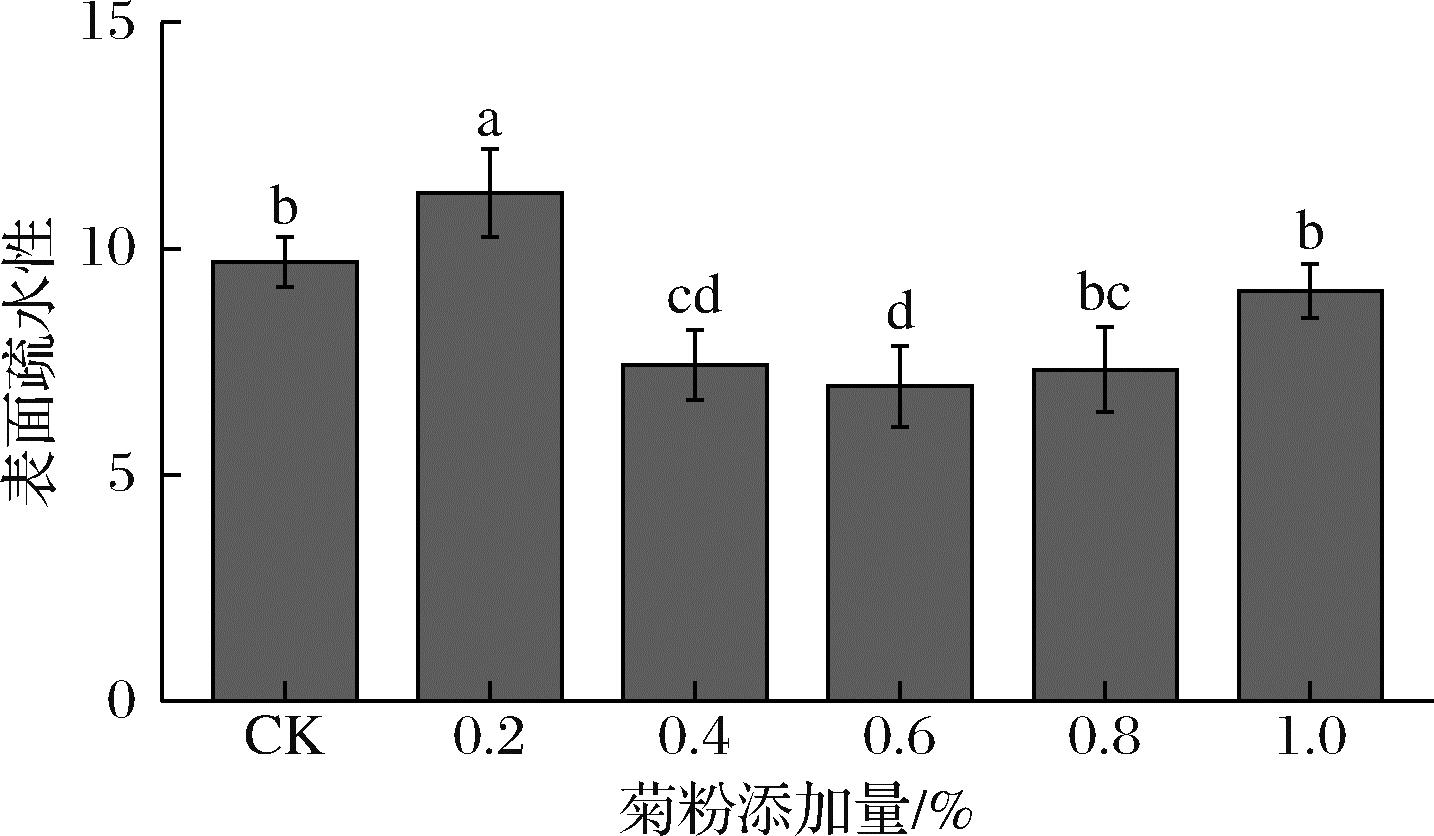
图5 蛋清-大豆分离蛋白-菊粉复合物表面疏水性的变化
Fig.5 Changes in surface hydrophobicity of egg white-soy protein isolate-inulin complexes
2.2.5 游离巯基含量分析
由图6可知,添加菊粉的复合物游离巯基含量都高于复合蛋白,且复合物游离巯基含量随着菊粉添加量的增多呈现先降低后增加的趋势,菊粉添加量为0.8%时复合物游离巯基含量最多。一般情况下,游离巯基的增加源于蛋白质内部结构的展开引起的内部巯基基团暴露,或者是蛋白质亚基解离、二硫键断裂产生巯基,而游离巯基降低则可能是因为巯基之间重新形成二硫键导致的。与空白组相比,添加0.2%菊粉,分子结构展开,大量游离巯基暴露出来。随着菊粉的继续增加,菊粉与复合蛋白聚结,阻止蛋白质完全展开,游离巯基含量降低,这与WANG等[9]的研究结果一致。由于大量菊粉的加入改变了蛋白质的聚集状态,诱导蛋白质结构展开,二硫键断裂又会引起游离巯基含量的增加。这与之前的研究[26]结果一致,即游离巯基的增加有助于改善泡沫膜的形成。
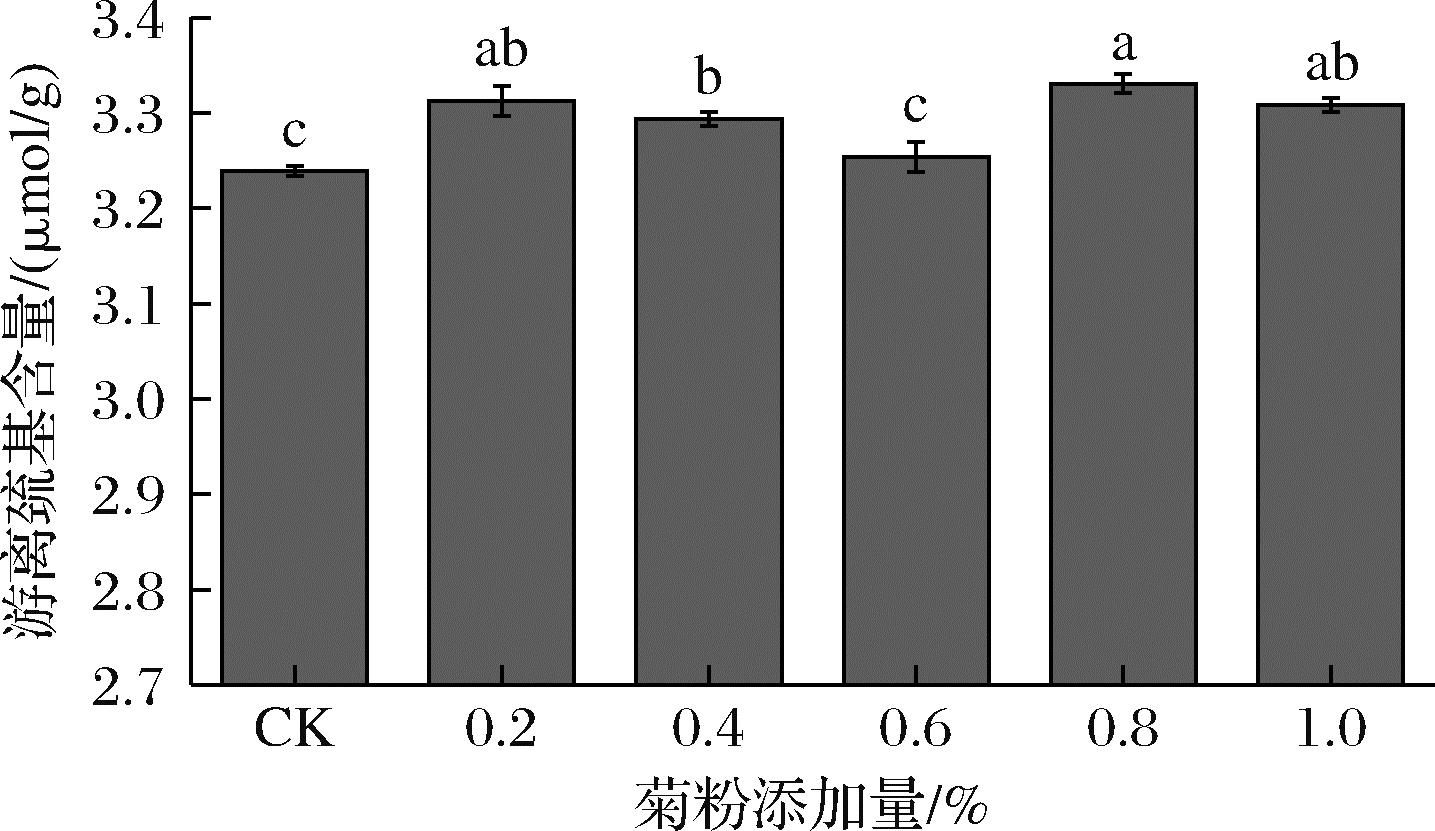
图6 蛋清-大豆分离蛋白-菊粉复合物游离巯基含量的变化
Fig.6 Changes in free sulfhydryl content of egg white-soy protein isolate-inulin complexes
3 结论
本文探究了菊粉对蛋清-大豆分离蛋白复合蛋白体系起泡性能的影响并对其复合机理进行初步探究。菊粉添加量为0.8%时复合物起泡性能效果最好,添加菊粉主要对复合蛋白聚集状态及分子间作用力产生影响,从而影响蛋白质的功能特性。菊粉使复合蛋白结构舒展,分子间排斥作用减小,游离巯基暴露,β-折叠减少,α-螺旋含量增加,促进了氢键的增强。即菊粉与复合蛋白之间没有形成新的化学键,而是通过氢键与蛋白质上的羧基和氨基相互作用,从而在蛋白质分子周围产生亲水基团,表面疏水性下降,蛋白质构象改变,促进了蛋白质在界面处的吸附与重排。综上,菊粉的添加可以改善复合蛋白的起泡性能,为复合蛋白起泡性能在食品中的应用提供一定的理论基础。
[1] 刘尚丞, 张思原.蛋清粉的加工特性及改性研究进展[J].中国家禽, 2022, 44(6):100-106.LIU S C, ZHANG S Y.Research progress on processing properties and modification of egg white powder[J].China Poultry, 2022, 44(6):100-106.
[2] SINGH P, KUMAR R, SABAPATHY S N, et al.Functional and edible uses of soy protein products[J].Comprehensive Reviews in Food Science and Food Safety, 2008, 7(1):14-28.
[3] ALVES A C, TAVARES G M.Mixing animal and plant proteins:Is this a way to improve protein techno-functionalities?[J].Food Hydrocolloids, 2019, 97:105171.
[4] 廖安, 吴卫国.大豆-鸡蛋清复合蛋白粉功能性质的研究[J].现代食品科技, 2013, 29(7):1606-1610.LIAO A, WU W G.Functional properties of soybean-eggwhite protein composite blends[J].Modern Food Science and Technology, 2013, 29(7):1606-1610.
[5] 唐婷婷. 小分子肽改善蛋清粉起泡性能及改性蛋清粉在天使蛋糕中的应用[D].南昌:江西农业大学, 2022.TANG T T.Improvement of foaming ability of egg white powder by small molecule peptide and application of modified egg white powder in angel cake[D].Nanchang:Jiangxi Agricultural University, 2022.
[6] SUN J J, CHANG C H, SU Y J, et al.Impact of saccharides on the foam properties of egg white:Correlation between rheological, interfacial properties and foam properties[J].Food Hydrocolloids, 2022, 122:107088.
[7] ![]() D, PTASZEK P, KRUK J, et al.The role of hydrocolloids in mechanical properties of fresh foams based on egg white proteins[J].Journal of Food Engineering, 2014, 121:128-134.
D, PTASZEK P, KRUK J, et al.The role of hydrocolloids in mechanical properties of fresh foams based on egg white proteins[J].Journal of Food Engineering, 2014, 121:128-134.
[8] HAN Y M, ZHU L, ZHANG H, et al.Understanding the foam stability mechanisms of complex formed by soy protein isolate and different charged polysaccharides:Air/water interfacial behavior and rheological characteristics[J].International Journal of Biological Macromolecules, 2024, 268:131583.
[9] WANG M M, YANG S, SUN N, et al.Soybean isolate protein complexes with different concentrations of inulin by ultrasound treatment:Structural and functional properties[J].Ultrasonics Sonochemistry, 2024, 105:106864.
[10] 胡静荣. 金针菇蛋白及可溶性多糖对肌原纤维蛋白凝胶特性的影响[D].太谷:山西农业大学, 2022.HU J R.Effect of Flammulina velutipes protein and solublepolysaccharide on the gel properties of myofibrillarprotein[D].Taigu:Shanxi Agricultural University, 2022.
[11] 常超, 胡文圆, 伍金娥.蛋粉加工过程中微生物关键控制点的研究[J].安徽农业科学, 2012, 40(16):8962-8964.CHANG C, HU W Y, WU J E.Study on microbiological critical control points in egg powder processing[J].Journal of Anhui Agricultural Sciences, 2012, 40(16):8962-8964.
[12] 张燕鹏, 张曼君, 刁云春, 等.复合米糠蛋白-卵白蛋白的起泡特性及相关机理分析[J].食品科学, 2022, 43(12):81-86.ZHANG Y P, ZHANG M J, DIAO Y C, et al.Foaming characteristics and underlying mechanism of rice bran protein-ovalbumin mixtures[J].Food Science, 2022, 43(12):81-86.
[13] CHEN Y X, MA M H.Foam and conformational changes of egg white as affected by ultrasonic pretreatment and phenolic binding at neutral pH[J].Food Hydrocolloids, 2020, 102:105568.
[14] PANOZZO A, MANZOCCO L, CALLIGARIS S, et al.Effect of high pressure homogenisation on microbial inactivation, protein structure and functionality of egg white[J].Food Research International, 2014, 62:718-725.
[15] XUE H, XU M, LIAO M F, et al.Effects of tea and Illicium verum braise on physicochemical characteristics, microstructure, and molecular structure of heat-induced egg white protein gel[J].Food Hydrocolloids, 2021, 110:106181.
[16] FU X, LIU Q, TANG C Q, et al.Study on structural, rheological and foaming properties of ovalbumin by ultrasound-assisted glycation with xylose[J].Ultrasonics Sonochemistry, 2019, 58:104644.
[17] ZHAO Y, CHEN Z Y, LI J K, et al.Formation mechanism of ovalbumin gel induced by alkali[J].Food Hydrocolloids, 2016, 61:390-398.
[18] DING L X, LU L Z, SHENG L, et al.Mechanism of enhancing foaming properties of egg white by super critical carbon dioxide treatment[J].Food Chemistry, 2020, 317:126349.
[19] LACROIX M, LE T C, OUATTARA B, et al.Use of γ-irradiation to produce films from whey, casein and soya proteins:Structure and functionals characteristics[J].Radiation Physics and Chemistry, 2002, 63(3-6):827-832.
[20] ELLEPOLA S W, CHOI S M, MA C Y.Conformational study of globulin from rice (Oryza sativa) seeds by Fourier-transform infrared spectroscopy[J].International Journal of Biological Macromolecules, 2005, 37(1-2):12-20.
[21] XUE F, LI C, ZHU X W, et al.Comparative studies on the physicochemical properties of soy protein isolate-maltodextrin and soy protein isolate-gum Acacia conjugate prepared through Maillard reaction[J].Food Research International, 2013, 51(2):490-495.
[22] 刘俊锋. 超声波处理、磷酸化结合TGase交联复合改性对蛋清热凝胶硬度及持水力的影响[D].雅安:四川农业大学, 2023.LIU J F.Effects of ultrasonic treatment, phosphorylation combined with TGase cross-linking on the hardness and water holdingcapacity of egg white thermal gel[D].Ya’an:Sichuan Agricultural University, 2023.
[23] HAN K Y, LI S S, YANG Y L, et al.Mechanisms of inulin addition affecting the properties of chicken myofibrillar protein gel[J].Food Hydrocolloids, 2022, 131:107843.
[24] 周思多. 膳食多酚与大豆蛋白相互作用及其复合物功能性质研究[D].南京:南京农业大学, 2019.ZHOU S D.Study on the interaction of dietary polyphenols with soy bean protein and the functional properties of their complexes[D].Nanjing:Nanjing Agricultural University, 2019.
[25] 吴鹏. 菊粉和海藻糖对虾蛄磷酸化肌原纤维蛋白特性的影响及在虾肉丸中的应用[D].天津:天津商业大学, 2018.WU P.Effect of inulin and trehalose on properties of phosphorylated myofibrillar protein from mantis shrimp and their application in shrimp meatballs[D].Tianjin:Tianjin University of Commerce, 2018.
[26] 段汝清. 瓜尔豆胶酶解物对蛋清蛋白的改性研究[D].无锡:江南大学, 2016.DUAN R Q.Study on the modification of eggwhite protein with guar gum hydrolysate[D].Wuxi:Jiangnan University, 2016.