蛋白质是青稞中含量第二的组分,其理化性质会对青稞制品的品质与风味产生重大影响。与小麦、玉米等传统谷类相比,青稞中蛋白质的氨基酸种类丰富,配比合理,含有人体所需要的8种必需氨基酸(尤其富含赖氨酸),所以其具有非常大的营养潜力,是优质的植物蛋白质来源[1]。但是青稞蛋白(highland barley protein,HBP)的功能特性并不理想,通常存在溶解度较低、持水持油能力、凝胶特性较差等缺陷,凝胶性是青稞蛋白最重要的特性之一,青稞蛋白通过热变性形成三维凝胶网络并将水分及其他物质束缚其中[2],而凝胶网络的强度和稳定性决定了肉类类似物及其他相关产品基质的流变、质地、微观结构和感官特性[3]。目前青稞蛋白较差的凝胶性限制了其在食品中的应用。
因此在食品加工时通常采用物理、化学方法来改善青稞蛋白的结构和功能特性以提高其加工性能,提高青稞蛋白的适用性,例如添加谷氨酰胺转氨酶或超声波处理。根据先前的研究[1,4],发现添加TGase酶会催化青稞蛋白链内或间谷氨酰胺和赖氨酸残基形成ε-(γ-谷氨基)赖氨酸异肽(G-L键),实现分子间或分子内交联(聚合)反应,这提高了青稞蛋白质的分子间作用力,导致不溶性蛋白聚集体的形成和溶解度的降低,并形成了更加致密的凝胶网络。超声波处理则会促进青稞蛋白结构展开,使其内部分子基团暴露从而促进了青稞蛋白和水的相互作用从而提高了溶解度等特性。刘永慧等[5]使用低温等离子体处理青稞蛋白,发现会破坏青稞蛋白的表面形态,改变分子结构进而改善青稞蛋白的溶解度等性质。上述方法显著改善了青稞蛋白的特性,但是酶法改性的过程并不可控,其安全性并不容易保证,因此亟需寻找一种安全可控的改性方法来改善青稞蛋白的性质。多糖-蛋白质复合物是一种常见的食品混合系统,可用作调节蛋白质特性的绿色实用方法[6]。
基于多糖的亲水胶体具有优异的增稠性和乳化性,能够显著提高食品加工过程中的品质[7]。据报道,相较于阳离子型多糖(如壳聚糖)和中离子型多糖(如瓜儿豆胶),阴离子型多糖可以表现出更高的持水能力及改善质构特性的效果[8],其可能对蛋白凝胶具有更好的改善效果。海藻酸钠是一种阴离子型亲水胶体,主要由β-D-甘露糖醛酸和α-L-古洛糖醛酸构成,其具有优良的增稠性与凝胶性,是一种安全绿色的食品添加剂。目前,海藻酸钠已被广泛用于与蛋白质混合体系的构建,KIM等[9]发现海藻酸钠提高了二元乳清/豌豆蛋白乳液的稳定性,提高了乳制品/植物蛋白混合物的功能性。LI等[10]发现海藻酸钠能够提高乳铁蛋白的热稳定性,高浓度时可以保护蛋白的二级结构。因此,推测海藻酸钠会对青稞蛋白的凝胶性质产生积极影响,但海藻酸钠对植物性蛋白的影响研究尚且很少。
目前海藻酸钠对青稞蛋白的影响及机理尚不清楚,因此,本章研究不同浓度的海藻酸钠对青稞蛋白持水性及凝胶强度的影响,通过测定其分子力,研究其二级结构、热稳定性、荧光光谱及微观结构的变化来探讨凝胶机理,为青稞蛋白性质改良和扩大其在食品中的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
青稞粉,青海青藏部落农牧开发有限公司;海藻酸钠(分析纯,纯度90%),上海阿拉丁生化科技股份有限公司;其余试剂均为分析纯。
1.2 仪器设备
TA.XT Plus质构仪,英国Stable Micro Systems公司;TGA550型热重分析仪,美国TA公司;LSM800激光共聚焦显微镜(confocal laser scanning microscope, CLSM),德国卡尔蔡司;F-4700荧光分光光度计,日本日立公司。
1.3 青稞蛋白的提取
参照刘立品[11]的方法稍做修改,将青稞打粉过100目筛,按照料液比1∶10将青稞粉溶于去离子水中,调pH值至10.5,于30 ℃水浴搅拌8 h,然后5 000 r/min离心10 min,取上清液,用盐酸调pH值至4.5,静置30 min后离心,收集沉淀,用去离子水洗沉淀3次,冷冻干燥机干燥后,研磨并过80目筛,置于4 ℃冰箱中备用。蛋白纯度参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中凯氏定氮法,测得蛋白质纯度为(83.8±3.03)%。
1.4 测定方法
1.4.1 凝胶样品制备
配制质量浓度为1、3、5 g/L的海藻酸钠溶液,将6 g青稞蛋白分散在20 mL溶液中,充分搅拌后4 ℃过夜备用。将混合溶液在95 ℃加热30 min,迅速置于凉水中冷却,4 ℃储存24 h,一部分用于凝胶性质的测定,一部分冷冻干燥后用于蛋白结构的测定。
1.4.2 持水力(water hold capacity, WHC)测定
采用离心法测定凝胶的持水力[12]。8 000 r/min离心15 min,用滤纸除去离心管的水分,称量离心后凝胶和离心管的总质量,按照公式(1)计算WHC。
(1)
式中:m1,离心前凝胶和离心管总质量,g;m2,离心后凝胶与离心管总质量,g;m0,样品质量,g。
1.4.3 青稞蛋白凝胶强度的测定
使用质构仪对青稞蛋白热诱导凝胶强度进行测定,参考LI等[13]的方法,选择P0.5探头进行测定,测前、中、后速度分别为2、1、2 mm/s,测试距离5 mm,触发力1 g。
1.4.4 表面疏水性测定
根据ZHANG等[14]描述的方法检测表面疏水性。配制成5 mg/mL蛋白溶液,涡旋30 s让蛋白分散均匀,然后加入400 μL 1 mg/mL的溴酚蓝指示剂混合涡旋30 s。最后在室温下振荡摇晃10 min后4 000 r/min离心10 min,用0.01 mol/L磷酸缓冲液(pH=7)将上清液稀释10倍,短暂涡旋30 s后,在595 nm处读取吸光度A,以磷酸缓冲液做空白。按照公式(2)计算HBP表面疏水性。
溴酚蓝结合量![]()
(2)
式中:A1、A2分别为磷酸盐溶液和样品的吸光度。
1.4.5 荧光光谱
参考GUO等[15]的方法,使用0.01 mol/L磷酸盐缓冲液(pH=7)配制5 mg/mL的蛋白溶液,室温振荡1 h后,使用荧光分光光度计进行测定,测试条件:激发波长280 nm,发射波长280~500 nm,狭缝5 nm。
1.4.6 青稞蛋白自由巯基和总巯基测定
参照LI等[13]的方法并略微修改。自由巯基(—SH)的测定:称取100 mg蛋白粉末,加入4.7 g盐酸胍,将其溶解于Tris-甘氨酸缓冲液(pH=8.0,0.086 mol/L Tris、0.09 mol/L甘氨酸、4 mmol/L乙二胺四乙酸)并定容至10 mL,放置在旋涡混合器振荡2 min,随后在4 ℃,3 000 r/min的条件下离心10 min。吸取1 mL样品上清液加入4 mL(8 mol/L 脲溶液+5 mol/L盐酸胍溶液)溶液和0.05 mL 4 mg/mL 的5,5-二硫代双硝基苯甲酸溶液。溶液在暗处反应20 min后于412 nm处测定吸光度。
总巯基的测定:吸取1 mL上清液样品加入4 mL(8 mol/L脲+5 mol/L盐酸胍)溶液和0.1 mL β-巯基乙醇,于室温下反应1 h后加入10 mL 120 g/L三氯乙酸溶液,继续反应1 h后在4 ℃,3 000×g的条件下离心2 min。倒去上清液,用5 mL 120 g/L三氯乙酸分2次洗沉淀,每次洗沉淀都以15 000×g的条件下离心2 min,后将沉淀物溶解于10 mL 8 mol/L脲溶液,然后加入0.08 mL 4 mg/mL的5,5-二硫代双硝基苯甲酸溶液,最后吸取1 mL该液,再加入5 mL Tris-甘氨酸缓冲液(pH=8.0),在412 nm处测定溶液的吸光度。游离巯基与总巯基含量的计算如公式(3)所示。
(3)
式中:73.53由106/13 600推导而来(13 600为埃尔曼试剂摩尔吸光度);A412,412 nm处的吸光度;D,稀释系数(游离巯基取6.02,总巯基取10);C,样品浓度,mg(干物)/mL。
1.4.7 蛋白质二级结构的测定
将样品与干燥后的KBr按比例混合研磨后压片,在傅里叶红外光谱仪中测定,波长为400~4 000 cm-1,分辨率为4 cm-1,扫描次数32。通过Omnic和Peakfit计算蛋白质的二级结构。
1.4.8 热稳定性的测定
参考GUO等[15]的方法,使用热重分析仪测试HBP的热稳定性。称量约1 mg样品,30~600 ℃,加热速率20 ℃/min,N2流速50 mL/min。
1.4.9 蛋白质中化学力的测定
根据ZHAO等[16]的方法略加修改,通过凝胶在不同变性溶液中的溶解度来确定凝胶中的化学相互作用力。在相同质量的凝胶样品中分别加入一定量的下列溶剂。溶剂S1为超纯水,溶剂S2包括S1和0.086 mol/L Tris-0.09 mol/L Glycine-4 mmol/L-Na2EDTA(pH 8.0),溶剂S3由S2和5 g/L SDS组成,溶剂S4由S3和8 mol/L尿素组成。将凝胶和溶剂充分混合,在室温下充分反应20 min,25 ℃水浴20 min。然后,将混合物在8 000 r/min离心10 min。使用BCA试剂盒测定上清液蛋白质含量。
1.4.10 激光共聚焦显微镜观察
用CLSM观察青稞蛋白样品网络分布,参考LEI等[17]的方法。使用1 g/L罗丹明B按照1∶50的体积比对样品中的蛋白质进行染色,按照1.4.1节中方法加热并尽快冷却至室温,上镜观察。罗丹明B在543 nm处被激发,接收波长为561~700 nm。
1.5 试验数据处理方法
使用SPASS 27软件进行显著性差异分析,用Origin 2021进行图表绘制,数据表示为“平均值±标准误差”。
2 结果与分析
2.1 添加海藻酸钠对HBP持水性的影响
持水性反映了蛋白质加热冷却后的凝胶网络保持水分的能力,一般较低的持水性会表现出较弱的凝胶质量和稳定性[18]。不同样品的持水性如图1-a所示,与HBP相比,添加海藻酸钠会显著提升凝胶的持水性,且随海藻酸钠添加量的升高,凝胶的持水性显著上升,从未添加时的23.4%提高至59.4%(添加量0.5%)。持水性的升高归因于海藻酸钠的亲水性,能够吸收大量的水分子从而将其保持在凝胶网络中,提高凝胶的持水性。WANG等[12]发现一种植物多糖能够提高大豆蛋白凝胶的持水性,当多糖含量较高时会在凝胶网络之间产生很强的相互作用从而锁住更多的水分,这对凝胶强度提高具有积极作用[19]。
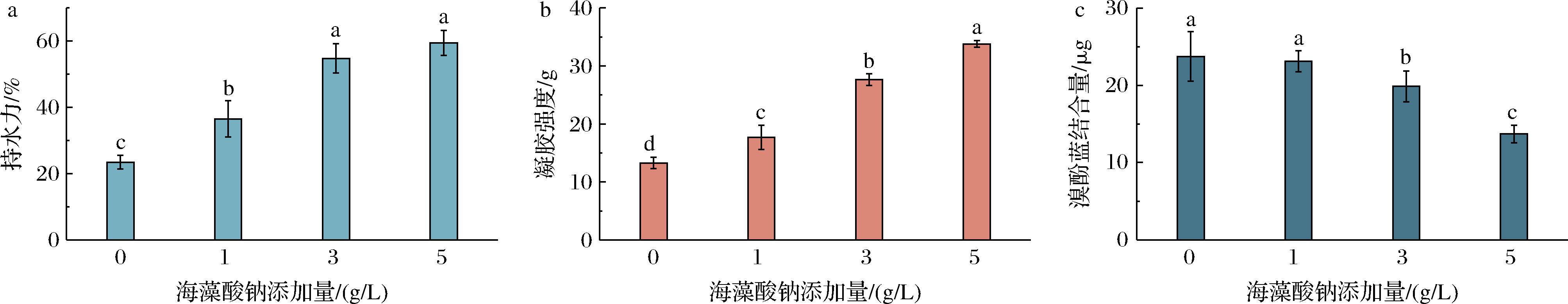
a-持水性;b-凝胶强度;c-表面疏水性
图1 不同添加量的海藻酸钠对HBP的持水性、凝胶强度、表面疏水性的影响
Fig.1 Effects of different addition of sodium alginate on water holding capacity, gel strength, and surface hydrophobicity of HBP
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 添加海藻酸钠对HBP凝胶强度的影响
样品的凝胶强度常用来表征凝胶网络的聚集能力。样品凝胶强度与胶体浓度之间的关系如图1-b所示,样品凝胶强度随海藻酸钠添加量的增大而增高,从13.28 g增加到33.79 g。WANG等[12]研究发现,Mesona blumes多糖能够提高大豆蛋白凝胶的强度是因为多糖提高了疏水及氢键相互作用;GE等[20]发现凝胶强度能够反应样品的持水性,凝胶强度越强,说明凝胶网络越紧凑,从而能够锁住更多的水分子,进而表现出更高的持水性,这一结果与持水性的结果相吻合,说明海藻酸钠能够提高青稞蛋白凝胶的强度,这弥补了青稞蛋白凝胶性较差、强度偏低的缺陷。
2.3 添加海藻酸钠对HBP表面疏水性的影响
蛋白质表面疏水性可以用来反应结构的变化,可以当作反应如乳化和凝胶特性等功能特性[21]。如图1-c所示,添加海藻酸钠降低了HBP的表面疏水性,且与浓度呈现相关性,蛋白表面疏水性从23.73 μg降低至13.69 μg,表明添加胶体会使青稞蛋白暴露的疏水残基减少,这一方面海藻酸钠分子中的多糖链的屏蔽作用阻止了溴酚蓝与疏水性基团的结合,从而降低了蛋白表面疏水性[22],另一方面,胶体分子与HBP之间的疏水相互作用会促进蛋白质分子聚集,从而降低了蛋白表面疏水性[23]。据报道,蛋白表面疏水性的水平与蛋白凝胶的稳定性有关,较低的蛋白表面疏水性通过改善结构有序性来提高体系稳定性,而该值较高时会破坏氢键从而影响凝胶网络的形成[13]。因此,海藻酸钠可以通过减少影响暴露的疏水残基来降低HBP的表面疏水性从而改善凝胶体系的稳定性。
2.4 荧光光谱分析
荧光光谱是研究蛋白质构象发生改变的一种重要工具,蛋白质荧光通常与色氨酸和酪氨酸残基暴露有关[24],其中色氨酸的荧光对所处环境的极性非常敏感,因此发射光谱会受到微环境的影响,从而能够反应蛋白质的结构特性的信息[25]。从图2可知,蛋白荧光峰值出现在350 nm附近,海藻酸钠的添加会降低HBP的荧光强度,说明添加海藻酸钠可以与HBP发生相互作用从而使得色氨酸残基被掩埋,不被激发,进而引起荧光猝灭[26]。XING等[22]将此归因于多糖促进了蛋白质聚集体的形成。虽然荧光强度有所降低,但是荧光的最大吸收波长却未发现有显著变化,表明其对蛋白质发色团的微环境没有太大改变。ZHANG等[27]在研究豆类植物与阴离子多糖的相互作用结果时也发现了这一结论。
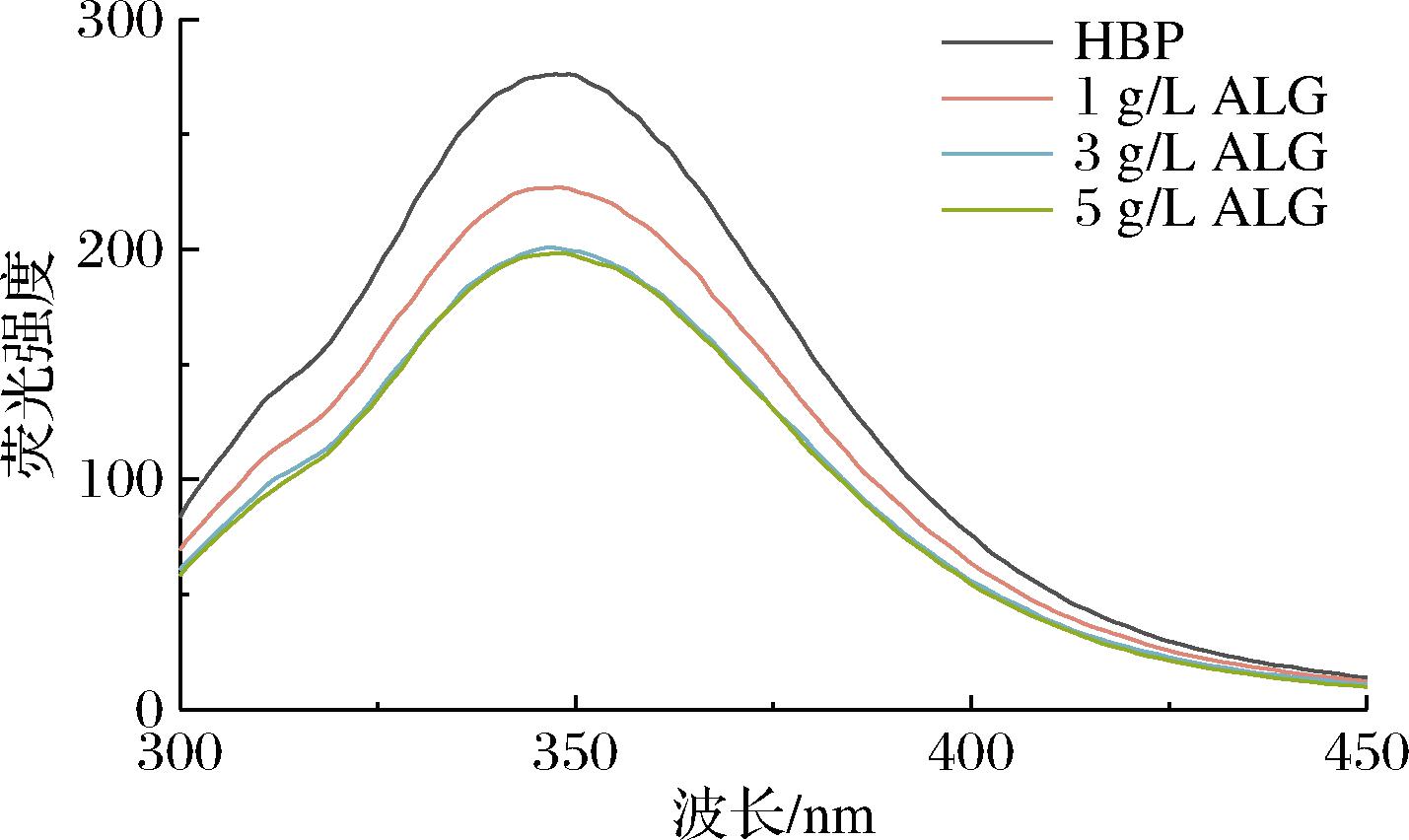
图2 海藻酸钠添加量对HBP内源荧光的影响
Fig.2 Effect of sodium alginate supplemental level on intrinsic fluorescence of HBP
2.5 海藻酸钠对HBP巯基含量的影响
二硫键是由蛋白质中的巯基通过共价交联形成的,对蛋白结构的强度及稳定性有着重要的影响[28]。由于食品加工过程中常涉及到加热,因此考察了热处理及添加海藻酸钠对青稞蛋白中巯基的影响。由图3可知,相较于未热处理时的青稞蛋白(N-HBP),加热会降低HBP中游离巯基和总巯基的含量,这可能是因为加热使得蛋白质结构展开,导致蛋白中的游离巯基和总巯基转化为非二硫键含硫化合物,从而使其含量降低[13]。而添加海藻酸钠后游离巯基进一步降低,且总巯基含量变化不显著,说明巯基可能进一步转化为二硫键,这与先前的报告一致,可能归因于海藻酸钠会激活巯基官能团并诱导新的分子间二硫键的桥接,这可能会改善HBP的凝胶结构[29]。LEI等[17]研究k-卡拉胶对藻蓝蛋白的影响时也发现了类似的现象,他们认为卡拉胶在凝胶中充当交联剂,能够使蛋白质分子聚集并促进凝胶结构的形成。
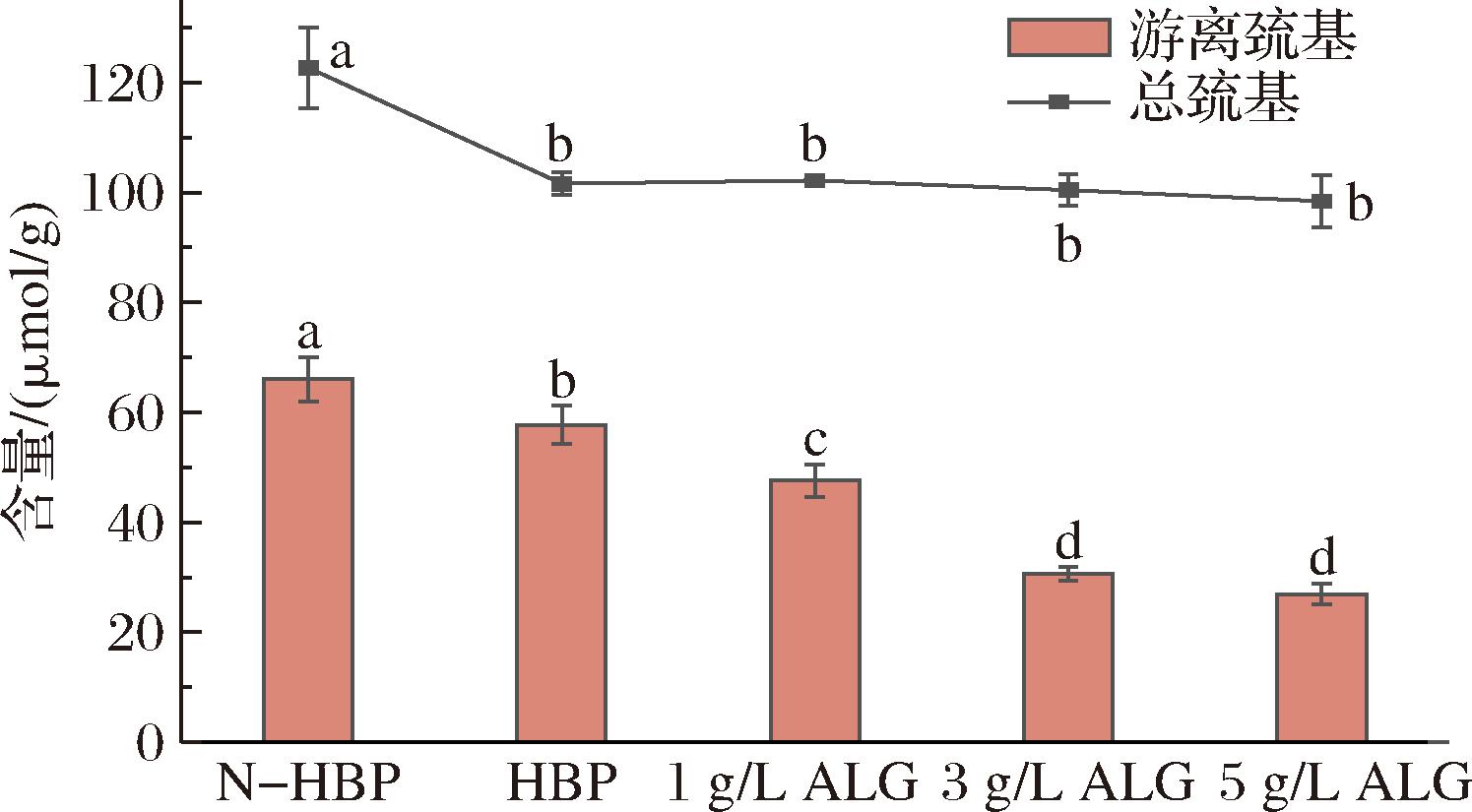
图3 不同浓度海藻酸钠对HBP巯基含量的影响
Fig.3 Effect of different concentrations of sodium alginate on the sulfhydryl content of HBP
2.6 FT-IR结果分析
FT-IR可以用于检测蛋白质的结构变化和混合系统中涉及的相互作用,不同样品的红外光谱图如图4所示,加入海藻酸钠后所有样品的红外图谱均未出现新的峰,说明海藻酸钠的添加对青稞蛋白官能团并没有影响,这与先前的研究结果一致[30-32]。样品在1 600~1 700 cm-1、1 500~1 600 cm-1处的条带分别为酰胺Ⅰ带与酰胺Ⅱ带[29],其中,酰胺Ⅰ带通常用来反应蛋白质的二级结构变化,包括β折叠(1 612~1 640 cm-1和1 681~1 690 cm-1)、无规则卷曲(1 643~1 649 cm-1)、α螺旋(1 650~1 660 cm-1)和β转角(1 660~1 670 cm-1)。通过对酰胺Ⅰ带图谱进行去卷积并拟合二阶导数处理,得到其二级结构的相对含量如图4-b所示,可以发现HBP的主要结构是β折叠与α螺旋,这与CHEN等[4]的研究一致。经过加热之后,相较于N-HBP,HBP的α螺旋含量下降,β折叠含量升高,说明热处理会诱导α螺旋向β折叠的转变。这可能是因为加热促进了蛋白质部分变形及结构的展开[33]。且β折叠含量的增加归因于蛋白质分子间的相互聚集,加热会提高蛋白质分子的疏水相互作用,变性的HBP分子会通过β折叠相互作用而使蛋白质相互聚集[34]。可以发现,添加海藻酸钠后会使β折叠含量提高2.7%,α螺旋降低3%,但是却没有统计学意义,这与LI等[13]的研究结果一致。海藻酸钠分子中均富含羟基,其能够为HBP提高更紧密的网络,从而在蛋白质变性过程中保留更多的β折叠结构[35],β折叠是一种更稳定的网络结构[36],其对凝胶强度具有积极作用,这也解释了之前的凝胶强度的结果。

a-红外光谱;b-二级结构的影响
图4 海藻酸钠对HBP红外光谱及二级结构的影响
Fig.4 Effect of sodium alginate on the infrared spectrum and secondary structure of HBP
2.7 添加海藻酸钠对HBP中化学作用力的影响
蛋白质复合凝胶的网络主要通过静电相互作用、疏水相互作用、氢键等相互作用力来稳定,这些相互作用力可被不同的溶剂破坏。具体来说,Tris-甘氨酸缓冲液用于破坏静电相互作用,疏水相互作用被SDS破坏,尿素可以破坏氢键,β巯基乙醇可以破坏二硫键[37]。因此,S2与S1、S3与S2、S4与S3、S5与S4之间的溶解度差异分别对应于静电相互作用、疏水相互作用、氢键和二硫键的相互作用强度。
从图5中可知,二硫键与疏水相互作用强度最高,表明这2种力是HBP-海藻酸钠体系中的主要作用力。从图5-a可知,添加海藻酸钠会使疏水相互作用强度显著降低,在加热时,蛋白质会变性伸展,这会增加蛋白质氨基酸侧链中的疏水性基团的暴露,而添加海藻酸钠产生的高空间位阻会促进蛋白质分子聚集[17],减少暴露的疏水基团,从而降低了疏水相互作用,这与表面疏水性和荧光光谱的结果一致。

a-化学力;b~d-热稳定性
图5 不同浓度海藻酸钠对HBP的化学力与热稳定性的影响
Fig.5 Effects of different concentrations of sodium alginate on the chemical force and thermal stability of HBP
注:图a中不同指标上方的字母表示不同海藻酸钠添加量下该指标存在显著性差异(P<0.05),图d为图c的局部放大图。
二硫键是由暴露的巯基发生共价交联形成,对蛋白质的结构有重要影响[38],二硫键含量随着胶体的添加而显著升高,暴露的巯基相互靠近并氧化或—SH与—SS的交换反应是二硫键含量升高的主要原因。离子键含量的略微升高可能是因为海藻酸钠本质属于阴离子型多糖,其添加会改变HBP分子的电荷分布,从而使静电相互作用发生变化[28]。
氢键强度往往与持水性的趋势一致,与HBP相比,凝胶体系的氢键强度上升,这与持水性的结果一致,归因于海藻酸钠侧链上丰富的羟基,会与水之间形成氢键,从而提高了氢键强度[18]。以上结果解释了2.2节中凝胶强度提高的原因,添加海藻酸钠会提高复合凝胶中的氢键、静电相互作用与二硫键,这加强了青稞蛋白与海藻酸钠之间的相互作用,从而形成更加密集的网络结构。
2.8 添加海藻酸钠对HBP热稳定性的影响
利用蛋白质的TG曲线来评估海藻酸钠的不同添加量对HBP热稳定性的影响。不同样品的热重曲线如图所示,从图5-b可以看出,样品在加热的温度范围内共经历3个失重阶段。第一段发生在30~120 ℃,这是由于结合水的损失所引起[13];第二阶段发生在130~380 ℃左右,这时肽键、S—S、O—N键等发生断裂,从而使蛋白质分子质量进一步损失[15];第三阶段发生在380~600 ℃,质量的损失归因于固体残渣继续灰化[39]。
导数热重曲线反映了加热过程中失重率的变化,如图5-c所示,所有样品均出现2个降解峰,第一个降解峰出现在60 ℃左右,可以观察到添加胶体之后质量损失出现减慢且温度向更高的方向移动,表明在胶体存在的情况下,水分子保留能力更强,这与之前持水性的结果保持一致。XING等[22]在研究枸杞多糖对大豆分离蛋白热性质的影响时也得到了类似的结论。从图5-d中可以看出,添加海藻酸钠后,HBP的最高降解速率温度会向更高的温度移动,说明海藻酸钠的掺入形成了更稳定的三维结构,能够提高HBP的热稳定性。
2.9 CLSM观察
不同样品的激光共聚焦图像如图6所示,HBP被罗丹明B染成红色,画面中的黑色为海藻酸钠分子或水。

a-0;b-1 g/L;c-3 g/L;d-5 g/L
图6 不同浓度海藻酸钠对HBP微观结构的影响
Fig.6 Effects of different concentrations of sodium alginate on the microstructure of HBP
图6-a为未添加胶体时的青稞蛋白,其表现出均匀的微观结构,蛋白质较为分散,且多为小聚集体。随着胶体的添加,红色区域开始聚集形成较大的聚集体,这是由于海藻酸钠本质上是阴离子型多糖,其在与HBP相互作用时会由于热力学不相容的特性从而导致出现相分离,使得蛋白质分子开始聚集,这验证了蛋白质的荧光结果,ZHANG等[40]对比豌豆蛋白与添加0.5%果胶的豌豆蛋白时,也发现了大聚集体的形成,根据报道,更大、多的聚集体有助于改善蛋白凝胶的黏弹性[21]。且随着添加胶体浓度的升高,较高的空间位阻会使蛋白相的表观浓度得到升高,蛋白质分子之间的距离减少,并通过范德华力促进蛋白质簇的碰撞形成更大的聚集体。
3 结论
本研究探讨了不同浓度海藻酸钠对青稞蛋白持水性、凝胶强度、热稳定性的影响,研究了蛋白质二级、三级结构的变化,并探讨了其凝胶机制。结果表明,添加海藻酸钠能够显著提高青稞蛋白的持水力与凝胶强度且具有浓度依赖性,说明海藻酸钠能够改善青稞蛋白的凝胶性质。海藻酸钠的添加对青稞蛋白的二级结构没有显著影响,但是其却能够促进蛋白质聚集体的形成从而使得色氨酸残基被掩藏进而影响蛋白质三级结构,CLSM的结果也验证了海藻酸钠的添加会促进蛋白质聚集体的形成。热重分析结果表明,海藻酸钠提高了青稞蛋白的热稳定性,通过测定蛋白质分子力,发现海藻酸钠添加显著提高了分子间的氢键、二硫键以及静电相互作用的强度,降低了疏水相互作用。综上,本研究为海藻酸钠对青稞蛋白凝胶行为的影响提供了理论依据,并揭示了其潜在的机制,为青稞蛋白的性能改善提供了新的途径。
[1] LIA J, GUO Z H, WANG Z R, et al.Effect of multiple-frequency ultrasound-assisted transglutaminase dual modification on the structural, functional characteristics and application of Qingke protein[J].Ultrasonics Sonochemistry, 2023, 94:106317.
[2] HU W M, XU X D, WANG X Y, et al.Effect of curdlan on the gel properties and interactions of whey protein isolate gels[J].International Journal of Biological Macromolecules, 2024, 277:134161.
[3] 于梦丽, 陈雨, 林凤岩, 等.物理-酶耦合修饰大豆蛋白凝胶特性的研究进展[J].食品与发酵工业, 2025,51(5):351-360.YU M L, CHEN Y, LIN F Y, et al.Advances in characterization of physically-enzymatically coupled modified soy protein gels[J].Food and Fermentation Industries, 2025,51(5):351-360.
[4] CHEN H J, GUO Z H, WANG Z R, et al.Structural and physicochemical properties of the different ultrasound frequency modified Qingke protein[J].Ultrasonics Sonochemistry, 2023, 94:106338.
[5] 刘永慧, 田亚凝, 张永琥, 等.低温等离子体技术对青稞蛋白结构及功能特性的影响[J].食品工业科技, 2024, 45(22):81-88.LIU Y H, TIAN Y N, ZHANG Y H, et al.Effects of cold plasma technology on the structural and functional properties of highland barley protein[J].Science and Technology of Food Industry, 2024, 45(22):81-88.
[6] FENG S M, SUN Y X, WANG D, et al.Effect of adjusting pH and chondroitin sulfate on the formation of curcumin-zein nanoparticles:Synthesis, characterization and morphology[J].Carbohydrate Polymers, 2020, 250:116970.
[7] SHAO P, ZHU Y Q, QIN M P, et al.Hydrodynamic behavior and dilute solution properties of Ulva fasciata algae polysaccharide[J].Carbohydrate Polymers, 2015, 134:566-572.
[8] 姚静. 海藻酸钠分子量对肌原纤维蛋白凝胶保水的影响及机制[D].合肥:合肥工业大学, 2016.YAO J.Effect and its mechanism of sodium alginate molecular weight on the water holding capacity of myofibrillar protein gel[D].Hefei:Hefei University of Technology, 2016.
[9] KIM W, WANG Y, SELOMULYA C.Impact of sodium alginate on binary whey/pea protein-stabilised emulsions[J].Journal of Food Engineering, 2022, 321:110978.
[10] LI Q Y, LAN H J, ZHAO Z T.Protection effect of sodium alginate against heat-induced structural changes of lactoferrin molecules at neutral pH[J].LWT, 2019, 99:513-518.
[11] 刘立品. 青稞蛋白质结构与功能特性的研究[D].杨凌:西北农林科技大学, 2015.LIU L P.The studies on structural and functional properties of the hulless barley protein[D].Yangling:Northwest A &F University, 2015.
[12] WANG W J, SHEN M Y, JIANG L, et al.Influence of Mesona blumes polysaccharide on the gel properties and microstructure of acid-induced soy protein isolate gels[J].Food Chemistry, 2020, 313:126125.
[13] LI Y L, QI X, RONG L Y, et al.Effect of gellan gum on the rheology, gelling, and structural properties of thermally induced pea protein isolate gel[J].Food Hydrocolloids, 2024, 147:109379.
[14] ZHANG Y M, PUOLANNE E, ERTBJERG P.Mimicking myofibrillar protein denaturation in frozen-thawed meat:Effect of pH at high ionic strength[J].Food Chemistry, 2021, 338:128017.
[15] GUO Z H, LIU M, XIANG X W, et al.Effects of inulins with various molecular weights and added concentrations on the structural properties and thermal stability of heat-induced gliadin and glutenin gels[J].LWT, 2021, 149:111891.
[16] ZHAO H B, CHEN J, HEMAR Y, et al.Improvement of the rheological and textural properties of calcium sulfate-induced soy protein isolate gels by the incorporation of different polysaccharides[J].Food Chemistry, 2020, 310:125983.
[17] LEI Y C, ZHAO X, LI D, et al.Effects of κ-carrageenan and guar gum on the rheological properties and microstructure of phycocyanin gel[J].Foods, 2022, 11(5):734.
[18] ZHENG H N, BEAMER S K, MATAK K E, et al.Effect of κ-carrageenan on gelation and gel characteristics of Antarctic krill (Euphausia superba) protein isolated with isoelectric solubilization/precipitation[J].Food Chemistry, 2019, 278:644-652.
[19] DU Y N, YAN J N, XU S Q, et al.Formation and characteristics of curcumin-loaded binary gels formed from large yellow croaker (Pseudosciaena crocea) roe protein isolate and gellan gum[J].Food Chemistry, 2023, 405:134759.
[20] GE J, SUN C X, CHANG Y Y, et al.Heat-induced pea protein isolate gels reinforced by panda bean protein amyloid fibrils:Gelling properties and formation mechanism[J].Food Research International, 2022, 162:112053.
[21] WANG X F, HE Z Y, ZENG M M, et al.Effects of the size and content of protein aggregates on the rheological and structural properties of soy protein isolate emulsion gels induced by CaSO4[J].Food Chemistry, 2017, 221:130-138.
[22] XING H R, LIU X G, HU Y F, et al.Effect of Lycium barbarum polysaccharides on heat-induced gelation of soy protein isolate[J].Food Hydrocolloids, 2024, 147:109323.
[23] URUAKPA F O, ARNTFIELD S D.Surface hydrophobicity of commercial canola proteins mixed with κ-carrageenan or guar gum[J].Food Chemistry, 2006, 95(2):255-263.
[24] CHEN L H, LIU T Q.Interaction behaviors between chitosan and hemoglobin[J].International Journal of Biological Macromolecules, 2008, 42(5):441-446.
[25] ST NCIUC N, BANU I, BOLEA C, et al.Structural and antigenic properties of thermally treated gluten proteins[J].Food Chemistry, 2018, 267:43-51.
NCIUC N, BANU I, BOLEA C, et al.Structural and antigenic properties of thermally treated gluten proteins[J].Food Chemistry, 2018, 267:43-51.
[26] VETRI V, MILITELLO V.Thermal induced conformational changes involved in the aggregation pathways of beta-lactoglobulin[J].Biophysical Chemistry, 2005, 113(1):83-91.
[27] ZHANG L N, LIANG R W, LI L.The interaction between anionic polysaccharides and legume protein and their influence mechanism on emulsion stability[J].Food Hydrocolloids, 2022, 131:107814.
[28] ZHOU Y, DAI H J, MA L, et al.Effect and mechanism of psyllium husk (Plantago ovata) on myofibrillar protein gelation[J].LWT, 2021, 138:110651.
[29] JIANG S S, MA Y Y, WANG Y H, et al.Effect of κ-carrageenan on the gelation properties of oyster protein[J].Food Chemistry, 2022, 382:132329.
[30] SOUZA C J F, GARCIA-ROJAS E E.Interpolymeric complexing between egg white proteins and xanthan gum:Effect of salt and protein/polysaccharide ratio[J].Food Hydrocolloids, 2017, 66:268-275.
[31] GAO Y F, LUO C, ZHANG J Y, et al.Konjac glucomannan improves the gel properties of low salt myofibrillar protein through modifying protein conformation[J].Food Chemistry, 2022, 393:133400.
[32] ALAVI F, EMAM-DJOMEH Z, YARMAND M S, et al.Cold gelation of curcumin loaded whey protein aggregates mixed with k-carrageenan:Impact of gel microstructure on the gastrointestinal fate of curcumin[J].Food Hydrocolloids, 2018, 85:267-280.
[33] TANG C H, MA C Y.Heat-induced modifications in the functional and structural properties of vicilin-rich protein isolate from kidney (Phaseolus vulgaris L.) bean[J].Food Chemistry, 2009, 115(3):859-866.
[34] CHEN Y, WANG T, ZHANG Y F, et al.Effect of moderate electric fields on the structural and gelation properties of pea protein isolate[J].Innovative Food Science &Emerging Technologies, 2022, 77:102959.
[35] HUA X Y, SIM S Y J, HENRY C J, et al.The extraction of buckwheat protein and its interaction with kappa-carrageenan:Textural, rheological, microstructural, and chemical properties[J].International Journal of Biological Macromolecules, 2024, 260:129427.
[36] S NCHEZ-GONZ
NCHEZ-GONZ LEZ I, CARMONA P, MORENO P, et al.Protein and water structural changes in fish surimi during gelation as revealed by isotopic H/D exchange and Raman spectroscopy[J].Food Chemistry, 2008, 106(1):56-64.
LEZ I, CARMONA P, MORENO P, et al.Protein and water structural changes in fish surimi during gelation as revealed by isotopic H/D exchange and Raman spectroscopy[J].Food Chemistry, 2008, 106(1):56-64.
[37] CHU L L, YANG L C, LI J G, et al.Effect of Smilax China L.starch on the gel properties and interactions of calcium sulfate-induced soy protein isolate gel[J].International Journal of Biological Macromolecules, 2019, 135:127-132.
[38] NI N, WANG Z Y, HE F, et al.Gel properties and molecular forces of lamb myofibrillar protein during heat induction at different pH values[J].Process Biochemistry, 2014, 49(4):631-636.
[39] CHEN H J, LI H Y, WU Y H, et al.Functionality differences between esterified and pregelatinized esterified starches simultaneously prepared by octenyl succinic anhydride modification and its application in dough[J].International Journal of Biological Macromolecules, 2024, 260:129594.
[40] ZHANG D, CHEN D, PATEL B, et al.Pectin as a natural agent for reinforcement of pea protein gel[J].Carbohydrate Polymers, 2022, 298:120038.