驼肉具有高蛋白质、低脂肪和低胆固醇等特点,是公认的绿色、营养均衡、鲜嫩味美的肉类食品。研究发现,驼肉pH值适中、大理石花纹分布均匀、系水力较高[1]。骆驼腱子肉相较其他部位虽然弹性、硬度等指标较大,但总氨基酸含量较高,保水性能较好[2-3]。在我国西北戈壁荒漠地区,驼肉已是牧民优质蛋白质的来源,且驼肉氨基酸种类齐全,属于完全营养蛋白[4-5]。
动物屠宰后,因呼吸和血液循环停止,使肌肉细胞死亡,肌肉组织中有氧代谢活动停止并转为无氧代谢方式,其中最主要的能量代谢方式是糖酵解。糖酵解途径是无氧条件下,肌糖原经过一系列的酶促反应分解成乳酸并产生能量的过程[6],该过程可以持续至肌肉中相关酶活性丧失或肌糖原含量不足为止。随着乳酸的不断累积,肌肉的pH值由活体肌肉的7.0最终降至5.7左右[7]。肉的品质会随pH值的变化而改变,因此通过调控糖酵解途径来改变肌肉中乳酸的积累程度,进而间接改善肌肉的pH值,达到改善肉品质的效果。研究表明,肌肉组织中初始糖原含量较高,糖原酵解潜力强,而随着乳酸不断积累,极限pH下降,肌红蛋白变性,导致肉色变亮变白[8]。若宰后肌糖原含量不足,pH值偏高,系水力变大,肌细胞水分过多,肌纤维会因紧密排列不发生收缩而变硬,使肌肉的剪切力增加,嫩度下降[9]。
蛋白质磷酸化反应对肌肉内部的众多生理反应都有重要影响。糖酵解相关酶的活性受蛋白质磷酸化修饰的影响,进而影响糖酵解进程并可能会对肉色、持水性和嫩度等产生影响。HUANG等[10]研究表明,宰后前期磷酸化水平高的猪肉具有较快的pH值下降速率,且经磷酸化修饰的丙酮酸激酶和磷酸丙糖异构酶与宰后猪肉pH值下降有关。摆玉蔷[11]研究发现,不同糖酵解速率组羊肉糖原磷酸化酶磷酸化水平和酶活性差异显著,宰后羊肉中磷酸化修饰后的糖原磷酸化酶活性较高。刘满顺[12]探究了蛋白质磷酸化修饰调控羊肉品质机理,发现高品质羊肉糖酵解酶活性较高,能加快羊肉排酸和促进肉品质改善;低品质羊肉则相反。陈丽娟等[13]发现在宰后4 h内低嫩度组羊肉蛋白质磷酸化水平显著高于高嫩度组,并且鉴定到的磷酸化蛋白质大多与肌节功能调节、糖酵解、肌肉收缩有关,表明蛋白质磷酸化可通过调控这些环节间接影响宰后肌肉嫩度,并在另外一项研究中得到了证实[14]。畜肉宰后成熟过程中蛋白质在磷酸化水平上发生了显著变化,但在总蛋白水平上相对稳定。研究表明,蛋白质磷酸化可能通过调控葡萄糖代谢和肌肉收缩相关蛋白的功能,在肉质形成过程中发挥关键作用,从而影响宰后肌肉的糖酵解过程[15]。
本研究通过测定宰后不同成熟期驼肉乳酸、肌糖原、葡萄糖和葡萄糖6-磷酸含量以及己糖激酶、磷酸果糖激酶、丙酮酸激酶、乳酸脱氢酶、糖原磷酸化酶活性,分析驼肉不同成熟时期糖酵解潜力和相关酶活性的变化规律。进一步,采用4D-Label free非标记定量蛋白质组学技术,检测不同成熟期驼肉磷酸化蛋白质的差异,并结合生物信息学方法分析差异蛋白质的功能,进而反映驼肉宰后不同成熟期磷酸化蛋白质差异的变化及其对肉品质的影响机制,旨在为改善驼肉品质提供数据支持。
1 材料与方法
1.1 驼肉样本的采集与试验主要试剂
试验所使用的驼肉样本取自内蒙古自治区乌兰察布市四子王旗乌拉特戈壁红驼。选取6峰平均年龄4岁左右、体制相近且健康戈壁红驼。屠宰后立即收集骆驼后腿肉,剔除表面筋膜、脂肪,切小块后,分成6组,放入1.8 mL冻存管中,液氮保存,并送往实验室后转移至-80 ℃超低温保存、备用。
葡萄糖含量、肌糖原含量、乳酸含量、葡萄糖-6-磷酸含量试剂盒,上海酶联生物科技有限公司;己糖激酶活性、磷酸果糖激酶活性、丙酮酸激酶活性检测试剂盒、BCA蛋白含量检测试剂盒,北京索莱宝科技有限公司;乳酸脱氢酶、糖原磷酸化酶活性检测试剂盒,上海酶联生物科技有限公司;High-SelectTM Fe-NTA磷酸化肽段富集试剂盒,赛默飞世尔科技公司。
1.2 仪器与设备
Centrifuge 5810R冷冻离心机,德国Eppendorf 公司;T6紫外-可见分光光度计,北京普析通用仪器有限责任公司;SYNERGY HIMF酶标仪,美国BioTek公司;Tetra Cell 165-8001电泳仪RAD,伯乐生命医学产品(上海)有限公司;tims TOF Pro质谱仪、NanoElute超高效液相色谱仪,德国Bruker公司;超低温冰箱,海尔生物医疗股份有限公司;FE28型pH计,梅特勒-托利多仪器有限公司;C-LM3B肌肉嫩度仪,上海精密科学仪器有限公司。
1.3 实验方法
1.3.1 驼肉样本的处理
取出驼肉样本,置于4 ℃条件下成熟。驼肉样本分为3组,分别在成熟第0、1、3天时取出(取出的驼肉样本在4 ℃条件下成熟1 h记为成熟第0天,简称D0、D1、D3),待后续检测分析使用。
1.3.2 品质指标的测定
pH值:按照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》中规定方法进行测定。取5 g肉样,匀浆后,用漏斗过滤然后将pH计探头清洗干净并吸干,探头插入肉样中,点击测定键,等到仪器pH读数稳定后,记录测定结果。每个肉样分别测3次,并取平均值。
蒸煮损失:对加热前的肉样称重(m1),在80 ℃恒温水浴锅中加热至中心温度70 ℃,称重为m2,蒸煮损失计算如公式(1)所示:
蒸煮损失![]()
(1)
剪切力:参照NY/T 1180—2006《肉嫩度的测定 剪切力测定法》,略有修改。将样本尺寸修剪为6 cm×3 cm×3 cm的整块肉样,置于蒸煮袋中恒温水浴加热,肉样中心温度达到70 ℃时,取出冷却,吸水纸吸干样品表面液体,将肉柱置于剪切仪上测定,取平均值作为肉样的剪切力值,判定肉样嫩度。
1.3.3 糖酵解相关指标测定
糖酵解潜力可以由肌肉中的初始糖原、葡萄糖、葡萄糖-6-磷酸和乳酸等综合反映[16]。参照试剂盒说明书测定不同成熟期驼肉中乳酸、肌糖原、葡萄糖、葡萄糖-6-磷酸含量。驼肉糖酵解潜力值计算如公式(2)所示[17]:
糖酵解能力=2×(C1+C2+C3)+C4
(2)
式中:C1,肌糖原含量,mmol/(g prot);C2,葡萄糖含量,mmol/(g prot); C3,葡萄糖-6-磷酸,mmol/(g prot); C4,乳酸含量,mmol/(g prot)。
1.3.4 糖酵解相关酶活性的测定
采用试剂盒的方法对不同成熟期驼肉中己糖激酶、磷酸果糖激酶、丙酮酸激酶、乳酸脱氢酶及糖原磷酸化酶活性进行测定。
1.3.5 磷酸化蛋白质组学
1.3.5.1 驼肉蛋白质的提取和肽段的酶解
驼肉样品中加入适量蛋白提取裂解液(4%SDS, 100 mmol/L的Tris-HCl, pH 7.6)提取蛋白质,并用BCA试剂盒测蛋白质的浓度。每份样品与5倍上样缓冲液以体积比5∶1混匀,沸水浴5 min,然后进行SDS-PAGE分析(体积分数为4%~20%预制梯度胶,恒压180 V,45 min),并用考马斯亮蓝R-250染色。每个样品取适量,采用过滤辅助蛋白质组制备(filter aided proteome preparation,FASP)方法进行胰蛋白酶酶解[18],并借助C18 Cartridge对肽段脱盐处理。
1.3.5.2 磷酸化肽段富集
采用High-SelectTM Fe-NTA磷酸化肽段富集试剂盒,按照说明书上的操作方法进行磷酸化肽段的富集。
1.3.5.3 LC-MS/MS分析
质谱分析在tims TOF Pro质谱仪上进行,与NanoElute超高液相色谱仪联用60 min。多肽与缓冲液A (0.1%甲酸)混合,并装载在C18反相色谱柱上;用缓冲液B (84%乙腈和0.1%甲酸)进行线性梯度洗脱,流速300 nL/min。在离子模式下运行质谱仪,并在100~1 700 m/z,1/k0为0.6~1.6的质量范围内采集离子迁移率质谱图,然后进行10次PASEF MS/MS循环(目标强度1.5 k,阈值2 500)。
1.4 生物信息学分析
采用新一代离子淌度质谱的磷酸化4D-Label free定量蛋白质组学技术进行磷酸化蛋白质数量鉴定和定量结果分析;采用韦恩图展示不同成熟期驼肉样本磷酸化蛋白质的数量。利用STRING数据库(http://string-db.org/)和APT-Bio Cloud分析云平台进行差异蛋白质分析。差异蛋白质以表达倍数(fold change,FC)(FC>2.0为上调表达;FC<0.5为下调表达)且P-value<0.05为标准进行筛选,并绘制差异蛋白质结果柱状图和火山图。利用GO和KEGG数据库对差异蛋白质进行功能注释和关键代谢通路的分析。
1.5 数据处理
每个试验平行3次,结果以“平均值±标准差”表示。统计数据采用SPSS 26软件进行单因素分析和Pearson相关性分析,用邓肯检验进行显著性分析。借助GraphPad Prism绘制柱形图和火山图。用Origin 2021绘制韦恩图。采用Blast2Go(https://www.blast2 go.com/)软件对差异蛋白质进行GO功能分析。利用KAAS (KEGG Automatic Annotation Server)软件,对目标蛋白质集合进行KEGG通路注释。
2 结果与分析
2.1 驼肉不同成熟期品质的变化
随着成熟时间的延长,驼肉pH值从D0的5.90下降至D3的5.65,呈显著下降趋势(P<0.05)。pH值的降低可能是由于宰后肌肉组织内糖原分解,产生乳酸,从而导致了pH值的下降。蒸煮损失呈先上升后下降趋势(P<0.05)。剪切力能够反映驼肉的嫩度,与D0相比,D3驼肉的剪切力值显著上升(P<0.05)(表1)。
表1 不同成熟期驼肉品质的变化
Table 1 Changes of camel meat quality at different postmortem aging
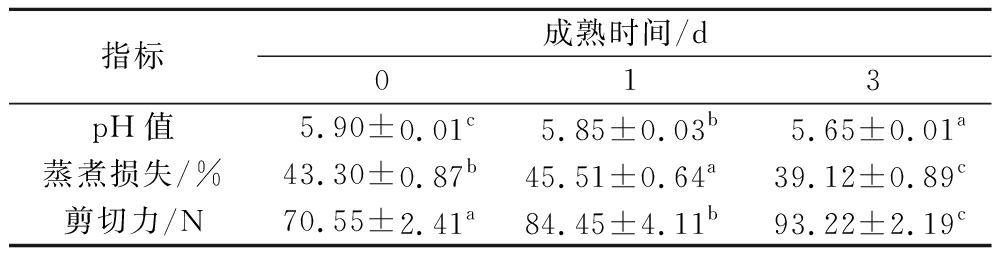
指标成熟时间/d013pH值5.90±0.01c5.85±0.03b5.65±0.01a蒸煮损失/%43.30±0.87b45.51±0.64a39.12±0.89c剪切力/N70.55±2.41a84.45±4.11b93.22±2.19c
注:表中行肩标不同字母表示不同成熟时间差异显著(P<0.05)(下同)。
2.2 驼肉不同成熟期糖酵解潜力的变化规律
糖酵解潜力是肌肉组织进行糖原分解,机体在氧气不足或无氧参与时会激发糖酵解能力满足机体所需的能量供应。肌糖原含量是糖酵解过程的重要因素。随着宰后成熟时间的延长,驼肉肌糖原、葡萄糖和葡萄糖-6-磷酸含量呈现逐渐下降趋势(图1)。驼肉肌糖原和葡萄糖含量在不同成熟期差异显著(P<0.05),分别由D0的(6.08±0.19)和(3.82±0.31) mmol/(g prot)降低至D3的(1.67±0.43)和(1.04±0.48) mmol/(g prot)。与成熟D0相比,D1驼肉中葡萄糖-6-磷酸含量显著下降至(853.25±42.02) nmol/(mg prot)(P<0.05),而成熟D1和D3间无显著差异(P>0.05)。以上变化是由于宰后驼肉伴随无氧糖酵解进程,进而导致了肌糖原、葡萄糖和葡萄糖-6-磷酸含量被逐渐消耗。乳酸是糖酵解途径的产物,驼肉中乳酸的含量由成熟期D0的(0.56±0.13) mmol/(g prot)逐渐升高至D3的(1.19±0.01) mmol/(g prot),说明糖酵解过程在持续进行,导致乳酸不断堆积(图1-b)。糖酵解潜力是表示无氧酵解代谢能力大小的指标,驼肉的糖酵解潜力从宰后成熟期D0的(25.8±1.11) mmol/(g prot)逐渐降至D3的(8.2±1.5) mmol/(g prot),表明驼肉在宰后不同成熟时期糖酵解潜力逐渐减小;成熟D1和D3驼肉中乳酸含量无显著差异(P>0.05)。研究表明,动物屠宰后肌细胞立即建立缺氧状态,引起细胞能量水平迅速下降,从而激活一系列糖酵解酶,增强糖酵解活力,促进糖原转化为乳酸[19-20]等。
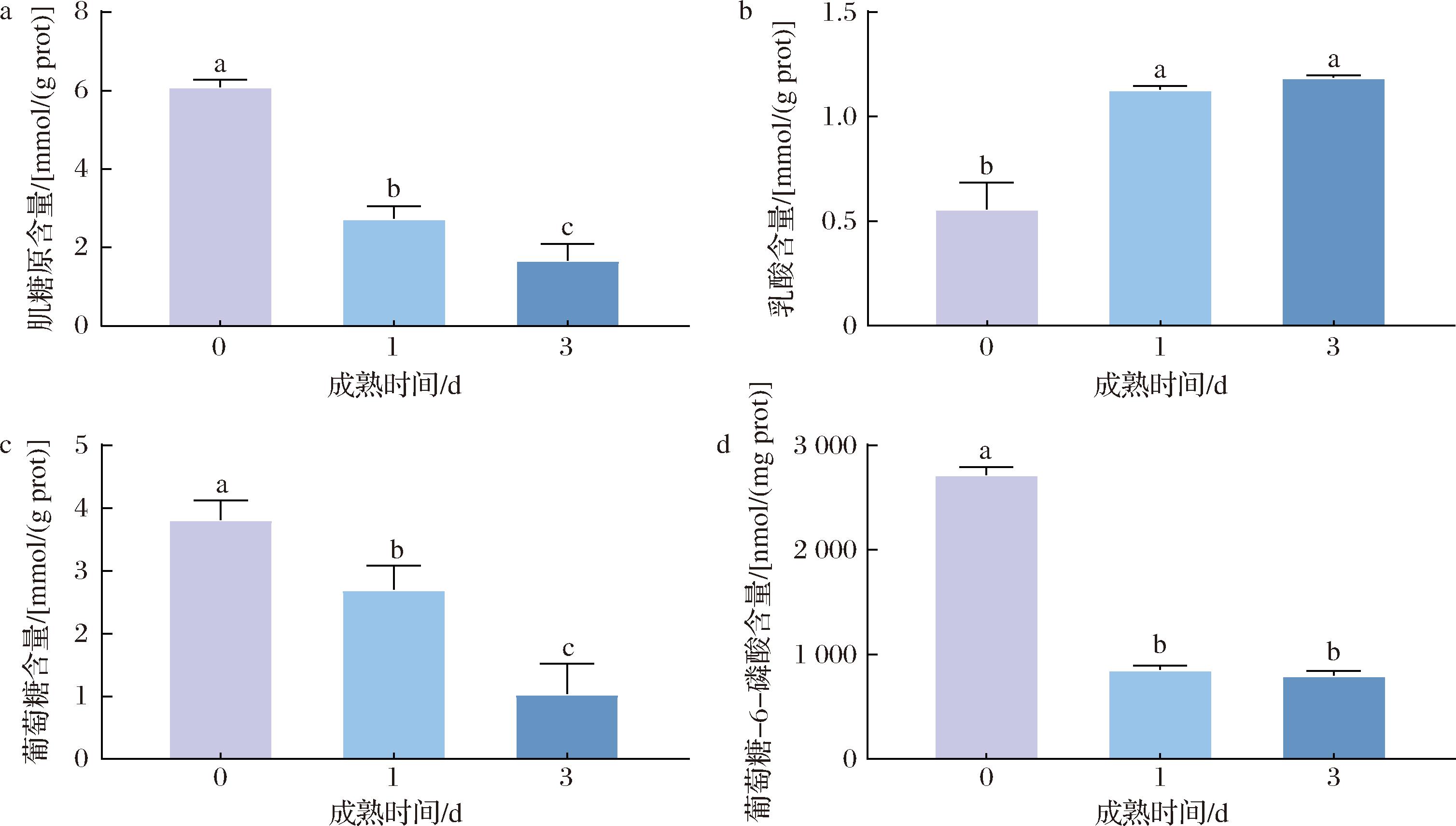
a-肌糖原含量;b-乳酸含量;c-葡萄糖含量;d-葡萄糖-6-磷酸含量
图1 不同成熟期驼肉糖酵解潜力相关指标
Fig.1 Related indicator of glycolysis potential of camel meat at different postmortem aging
注:图中标有不同字母表示不同成熟时间差异显著(P<0.05)。
2.3 驼肉不同成熟期糖酵解相关酶活性的变化
糖酵解影响宰后肉成熟与腐败,糖酵解及其相关酶活性的变化对肉品质的变化至关重要[7]。随着成熟时间的延长,驼肉乳酸脱氢酶、磷酸果糖激酶、己糖激酶和糖原磷酸化酶活性呈现逐渐下降趋势,而丙酮酸激酶活性逐渐升高。与D0相比,D3驼肉己糖激酶、磷酸果糖激酶活性显著降低(P<0.05),而D1与D3间差异不显著(P>0.05)。乳酸脱氢酶反映的是糖酵解代谢水平,在D0驼肉中乳酸脱氢酶的活性为(4.38±0.23) U/(mg prot),随着成熟时间的延长显著降低至D3的(3.58±0.40) U/(mg prot)(P<0.05),表明糖酵解速率逐渐降低,这与郑晓寒[21]的研究结果一致。驼肉中糖原磷酸化酶活性由D0的(40.17±1.65) U/(mg prot)显著降低至D3的(25.08±1.09) U/(mg prot)(P<0.05)(表2)。
表2 不同成熟期驼肉糖酵解相关酶活性变化 单位:U/mg prot
Table 2 Changes of glycolysis-related enzyme activities of camel meat at different postmortem aging
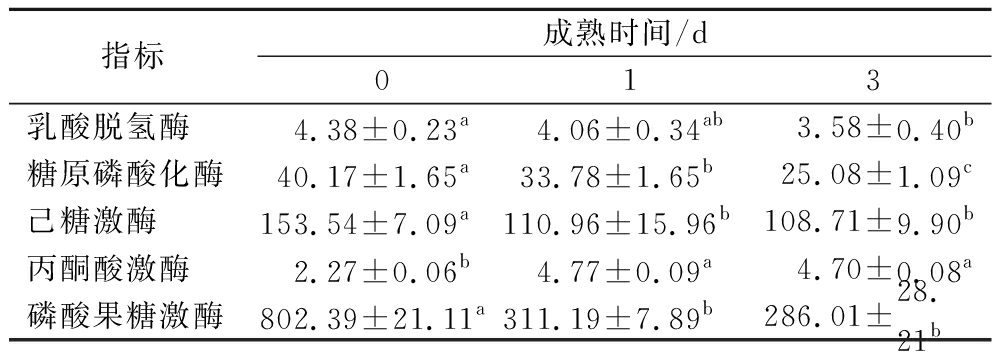
指标成熟时间/d013乳酸脱氢酶4.38±0.23a4.06±0.34ab3.58±0.40b糖原磷酸化酶40.17±1.65a33.78±1.65b25.08±1.09c己糖激酶153.54±7.09a110.96±15.96b108.71±9.90b丙酮酸激酶2.27±0.06b4.77±0.09a4.70±0.08a磷酸果糖激酶802.39±21.11a311.19±7.89b286.01±28.21b
2.4 磷酸化蛋白质组学分析
2.4.1 驼肉磷酸化蛋白质质谱鉴定
对不同成熟期驼肉样本进行了磷酸化蛋白质组学测定,共鉴定到磷酸化蛋白质、磷酸化肽段、磷酸化位点的数目分别1 840、5 434和9 214个,其中722个修饰蛋白上有2 268条可定量磷酸化肽段及2 874个可定量磷酸化位点(图2-a)。韦恩图的结果显示,在D0的驼肉样本中共鉴定到1 104个磷酸化蛋白质,D1天共鉴定到1 402个,D3天共鉴定到1 308个磷酸化蛋白质。在3个成熟期驼肉样本中有871个共有磷酸化蛋白质,并在D0、D1、D3驼肉样本中鉴定到了81、256和174个独有蛋白质(图2-b)。
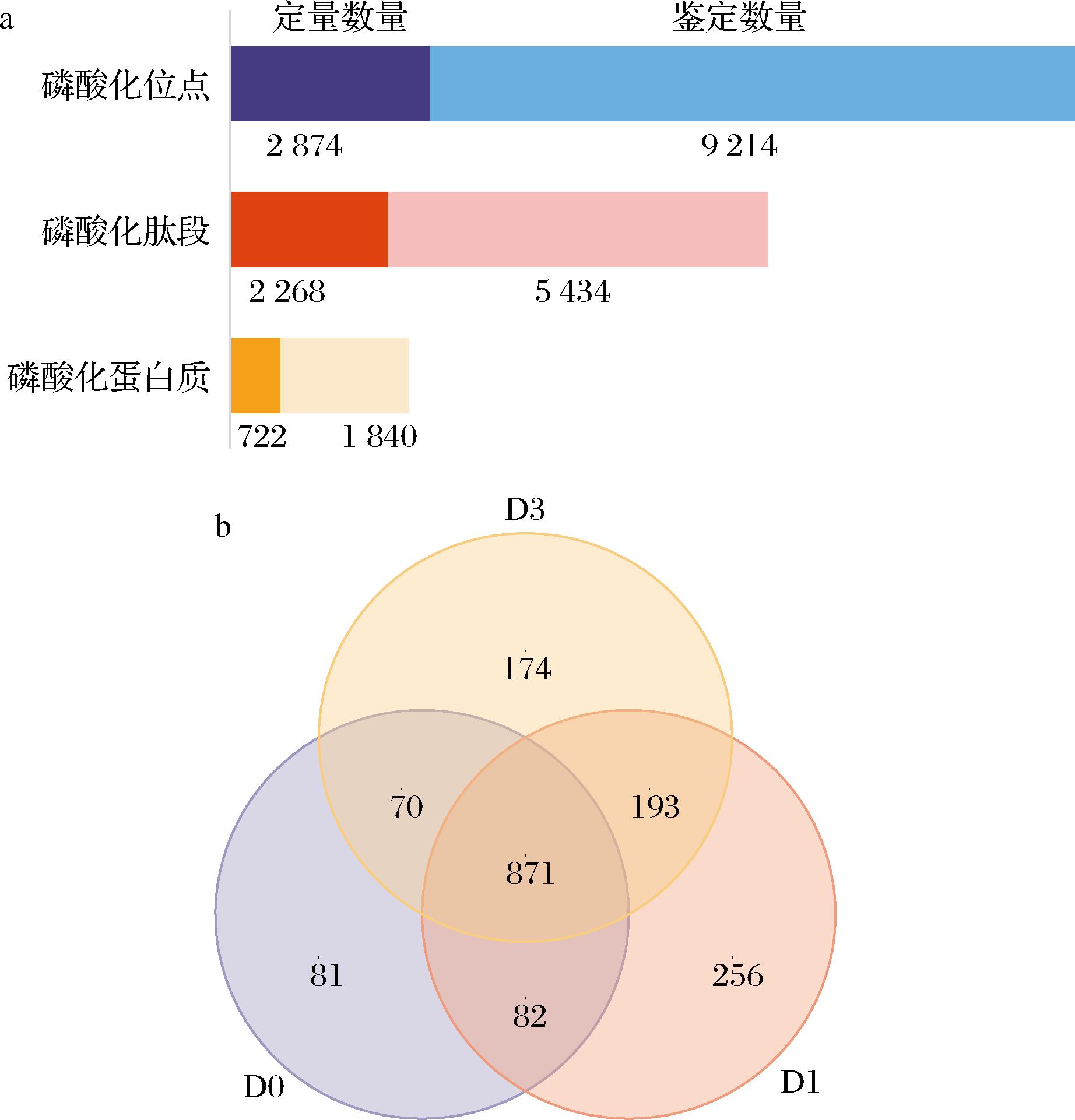
a-鉴定与定量结果;b-磷酸化蛋白质韦恩图
图2 不同成熟期驼肉蛋白质鉴定与定量结果
Fig.2 Protein identification and quantitative results of camel meat of at different postmortem aging
2.5 驼肉差异磷酸化蛋白质分析
为了分析驼肉不同成熟期差异表达的磷酸化蛋白质,以FC(FC>2.0为上调表达;FC<0.5为下调表达)且P-value<0.05为标准进行了筛选(图3)。在D0和D1中共鉴定到46个差异蛋白质,其中显著上调的差异蛋白质有6个,40个差异蛋白质显著下调。在D0和D3中共鉴定到35个差异蛋白质,其中显著上调和下调的差异蛋白质分别为6个和29个。在D1和D3驼肉中共鉴定到16个差异蛋白质,其中11个上调,5个下调。进一步,通过火山图展示组间磷酸化蛋白质的差异结果(P<0.05),其中蓝色表示显著下调(FC<0.5),红色表示显著上调(FC>2.0),灰色表示无显著性(图4)。
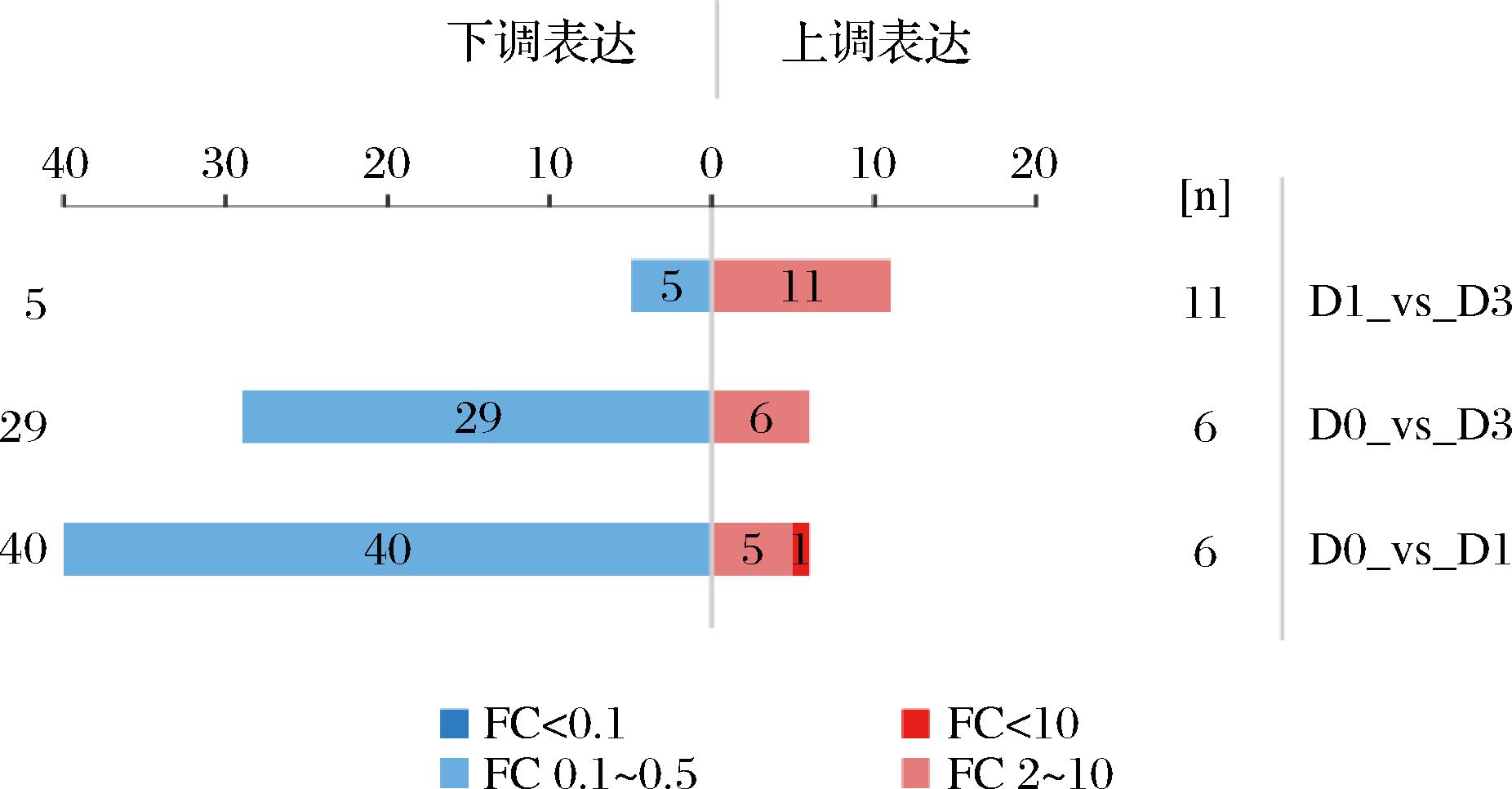
图3 不同成熟期驼肉差异磷酸化蛋白质定量结果
Fig.3 Quantitative results of differential phosphorylated proteins of camel meat at different postmortem aging
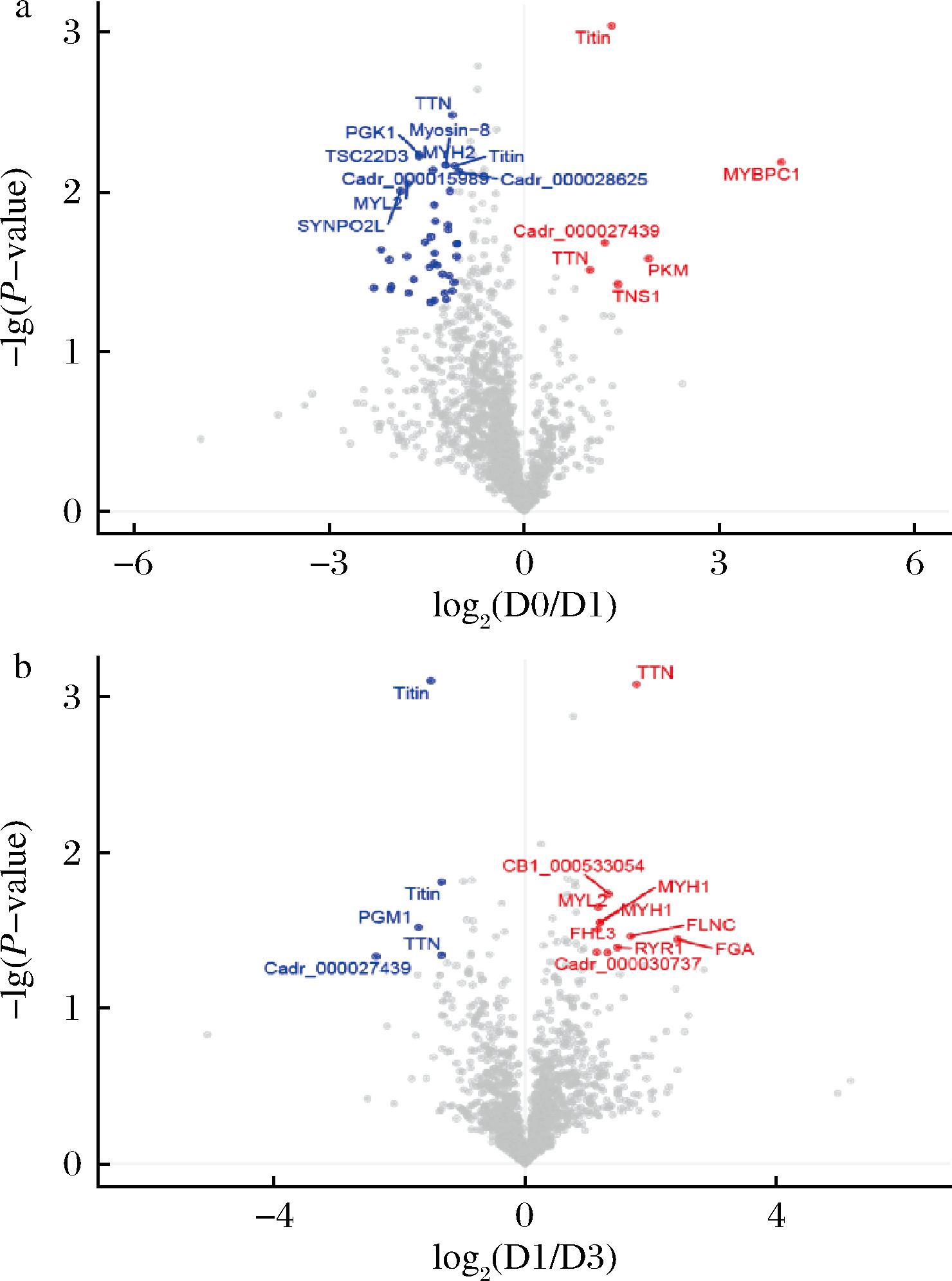
a-D0/D1;b-D1/D3
图4 不同成熟期驼肉差异磷酸化蛋白质火山图
Fig.4 Differentially phosphorylated protein volcano map of camel meat at different postmortem aging
驼肉成熟D0与D1相比(表3),肌球蛋白结合蛋白C(登录号A0A8B8U475)和丙酮酸激酶(登录号A0A8B8S5T0)显著高表达(差异倍数达到了2倍以上),其中前者的差异倍数达到了15.537倍。肌球蛋白结合蛋白C在肌肉收缩和舒张功能的调节上起着重要作用。随着宰后成熟时间的延长,驼肉中的肌糖原逐渐减少,合成肌肉收缩的主要能量来源ATP也逐渐降低,使肌肉伸缩性变差,肌肉变得松弛,导致了D1驼肉肌球蛋白结合蛋白C的含量显著下降。
表3 驼肉不同成熟期差异蛋白质
Table 3 Differential proteins in camel meat at different postmortem aging
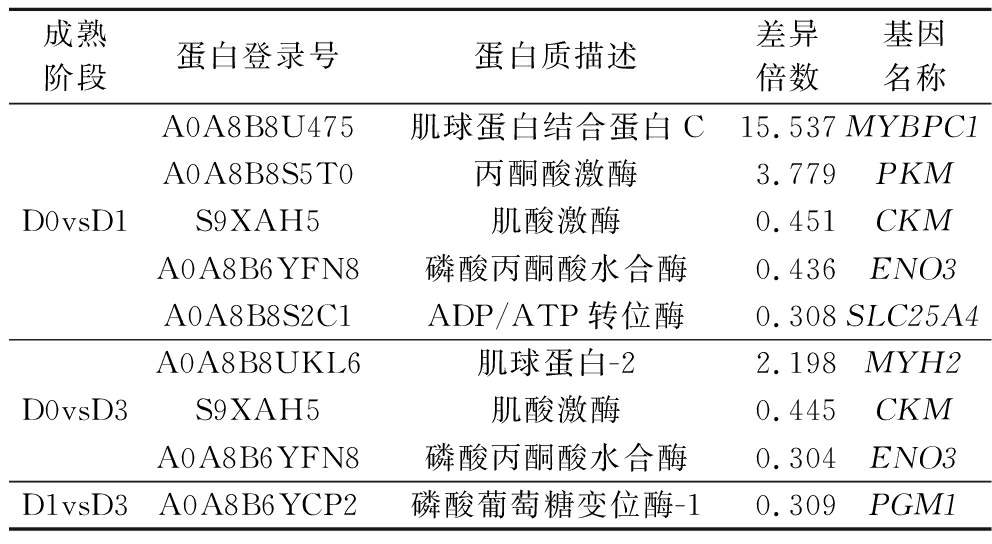
成熟阶段蛋白登录号蛋白质描述差异倍数基因名称D0vsD1A0A8B8U475肌球蛋白结合蛋白C15.537MYBPC1A0A8B8S5T0丙酮酸激酶3.779PKMS9XAH5肌酸激酶0.451CKMA0A8B6YFN8磷酸丙酮酸水合酶0.436ENO3A0A8B8S2C1ADP/ATP转位酶0.308SLC25A4D0vsD3A0A8B8UKL6肌球蛋白-22.198MYH2S9XAH5肌酸激酶0.445CKMA0A8B6YFN8磷酸丙酮酸水合酶0.304ENO3D1vsD3A0A8B6YCP2磷酸葡萄糖变位酶-10.309PGM1
注:D0vsD1-成熟0 d与成熟1 d相比;D0vsD3-成熟0 d与成熟3 d相比;D1vsD3-成熟1 d与成熟3 d相比。
丙酮酸激酶是糖酵解途径的最后一个限速酶,催化糖酵解最后一步反应,其活性变化影响糖酵解进程。D0与D3相比,肌酸激酶(登录号S9XAH5)、磷酸丙酮酸水合酶(登录号A0A8B6YFN8)和ADP/ATP转位酶(登录号A0A8B8S2C1)显著下调,而肌球蛋白-2(登录号 A0A8B8UKL6)表现出高表达。肌酸激酶可以促进肌肉收缩、调节肌肉代谢、促进能量转化和维持细胞正常功能等。宰后驼肉处于无氧呼吸,在肌肉处于僵直期时,不再进行肌肉收缩等过程,使得D1的肌酸激酶的表达量高于D0。与D1相比,D3中磷酸葡萄糖变位酶-1(登录号A0A8B6YCP2)显著下降。研究发现,磷酸丙酮酸水合酶主要在肌肉中表达,与硬肉组相比,磷酸丙酮酸水合酶减少了嫩肉的氧化损伤[22]。此外,磷酸丙酮酸水合酶、肌球蛋白结合蛋白C和肌球蛋白调节轻链2丰度在3组间差异显著。研究表明,MYBPC1在肌动蛋白-肌球蛋白相互作用中发挥调节作用,并通过与2种蛋白结合,影响牛肉的剪切力[23]。驼肉宰后成熟期MYBPC1的差异显著,可作为影响驼肉品质的潜在指标物。
2.6 相关性分析
对筛选到的差异蛋白质与糖酵解相关酶活性进行Pearson相关性分析。结果显示(表4),乳酸脱氢酶活性与SLC25A4呈显著负相关(P<0.05)。糖原磷酸化酶和磷酸果糖激酶活性与MYBPC1和MYH2呈显著正相关(P<0.05),与CKM和SLC25A4呈显著负相关(P<0.05)。磷酸果糖激酶与PGM1呈显著负相关(P<0.05)。丙酮酸激酶活性与MYBPC1和MYH2呈显著负相关(P<0.05),与CKM、SLC25A4和PGM1呈显著正相关(P<0.05)。己糖激酶活性与ENO3呈极显著负相关(P<0.01),与MYBPC1、PKM和MYH2呈显著正相关(P<0.05),与CKM和SLC25A4呈显著负相关(P<0.05)。
表4 差异蛋白质与糖酵解相关酶活性的相关性分析
Table 4 Correlation analysis between differential proteins and glycolysis-related enzyme activities
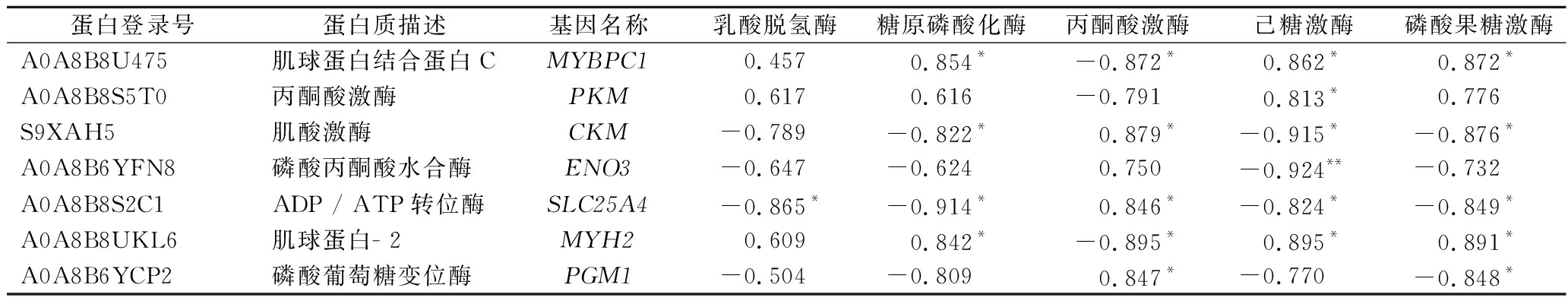
蛋白登录号蛋白质描述基因名称乳酸脱氢酶糖原磷酸化酶丙酮酸激酶己糖激酶磷酸果糖激酶A0A8B8U475肌球蛋白结合蛋白CMYBPC10.457 0.854*-0.872*0.862*0.872*A0A8B8S5T0丙酮酸激酶PKM0.617 0.616 -0.791 0.813*0.776 S9XAH5肌酸激酶CKM-0.789 -0.822*0.879*-0.915*-0.876*A0A8B6YFN8磷酸丙酮酸水合酶ENO3-0.647 -0.624 0.750 -0.924**-0.732 A0A8B8S2C1ADP / ATP转位酶SLC25A4-0.865*-0.914*0.846*-0.824*-0.849*A0A8B8UKL6肌球蛋白- 2MYH20.609 0.842*-0.895*0.895*0.891*A0A8B6YCP2磷酸葡萄糖变位酶PGM1-0.504 -0.809 0.847*-0.770 -0.848*
注:*表示显著相关(P<0.05);**表示极显著相关(P<0.01)。
2.7 差异磷酸化蛋白质功能富集分析
对不同成熟期驼肉筛选出的差异磷酸化蛋白质进行了GO功能富集分析(图5)。驼肉中差异磷酸化蛋白质参与的生物学过程主要是与糖酵解相关的磷酸原代谢、磷酸原的生物合成、磷酸肌酸代谢以及磷酸肌酸的生物合成等过程。参与的细胞组成包括肌球蛋白复合体、肌动蛋白细胞骨架、细胞骨架等。肌酸激酶、磷酸转移酶活性(含氮基团作为受体)、肌动蛋白结合、三磷酸腺苷结合、腺苷酸核苷酸结合、腺苷酸核糖核苷酸集合、药物结合等是驼肉磷酸化蛋白质富集的主要分子功能,这些蛋白质在驼肉不同成熟阶段的肉质变化中具有显著影响。研究发现肌钙蛋白质C、肌动蛋白质、肌酸激酶等具有多种抗应激功能,与肉品质有很高的相关性,可作为肌肉嫩度的生物标记物[24]。
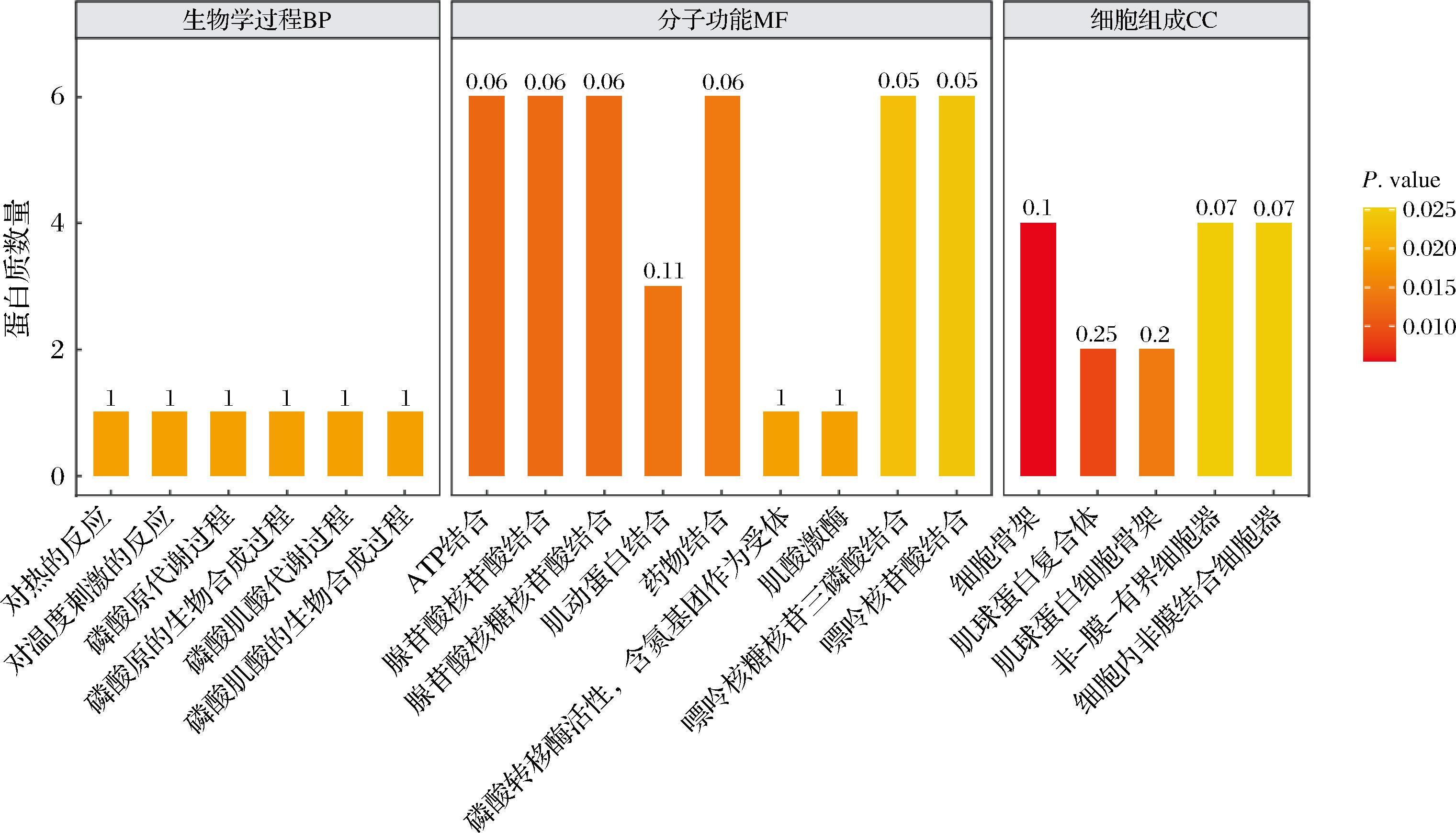
图5 差异蛋白质的GO功能富集分析(前20)
Fig.5 GO functional enrichment analysis of differential proteins (top 20)
2.8 差异磷酸化蛋白质KEGG通路分析
驼肉不同成熟期差异蛋白质中KEGG显著性富集的代谢通路有14个(表5)。运动蛋白和中性粒细胞胞外陷阱的形成是驼肉D0和D1差异蛋白质主要参与的通路,其中共检测到6个差异蛋白质。D0与D3相比,差异的磷酸化蛋白质显著富集在心肌收缩、心肌细胞中的肾上腺素能信号、运动蛋白和环腺苷酸信号途径通路中,其中共检测到12个差异蛋白质。而D1和D3组间的差异磷酸化蛋白质主要集中在淀粉和蔗糖代谢、半乳糖代谢、心肌收缩、N-聚糖的生物合成、多种类型N-聚糖生物合成和HIF-1信号等通路中。研究指出,磷酸化的肌原纤维蛋白在肌肉收缩和细胞连接中起重要作用,磷酸化调节也参与了肌原纤维蛋白稳定性的调控。淀粉和蔗糖代谢、半乳糖代谢显著下调的原因可能是随着成熟时间的延长由于肌糖原被不断消耗,促使驼肉中半乳糖、淀粉和蔗糖转变为糖原,然后进入其他代谢途径。
表5 差异磷酸化蛋白质KEGG通路分析
Table 5 KEGG pathway analysis of differentially phosphorylated proteins

成熟阶段通路差异蛋白质上调/下调D0vsD1运动蛋白A0A8B7K601 A0A8B8TZT0 A0A8B8UJU5上调中性粒细胞胞外陷阱的形成A0A8B7KE68 A0A8B8S2C1 A0A8B8SR44下调D0vsD3心肌收缩A0A8B7K601 A0A8B8T6M4 A0A8B8TGZ6下调心肌细胞中的肾上腺素能信号A0A8B7K601 A0A8B8T6M4 A0A8B8TDF0下调运动蛋白A0A8B7K601 A0A8B8T6M4 A0A8B8TZT0 A0A8B8UKL6下调环腺苷酸信号途径A0A8B6YEJ5 A0A8B8TDF0下调D1vsD3淀粉和蔗糖代谢A0A8B6YCP2 S9WTL5下调半乳糖代谢A0A8B6YCP2下调半乳糖代谢A0A8B6Y9G2 A0A8B8UG44上调RNA降解A0A8B6Y9G2 A0A8B6YFN8上调Apelin信号通路A0A8B7K601 A0A8B8TM14上调心肌收缩A0A8B7K601 A0A8B8TGZ6上调N-聚糖的生物合成A0A8B8R9P6上调多种类型的N-聚糖生物合成A0A8B8R9P6上调VEGF信号通路A0A8B8RBY3上调长时程抑制A0A8B8TM14上调HIF-1信号通路A0A8B6Y9G2 A0A8B6YFN8上调
注:FC>2.0为上调表达;FC<0.5为下调表达且P-value<0.05为标准进行了筛选。
3 结论
随着宰后成熟时间的延长,驼肉pH值逐渐下降,蒸煮损失呈先上升后下降,而剪切力逐渐上升。驼肉糖酵解潜力以及糖酵解相关酶活性如己糖激酶、磷酸果糖激酶、乳酸脱氢酶活性呈下降趋势,而丙酮酸激酶活性呈上升趋势。在不同成熟期驼肉中鉴定到的差异蛋白质主要富集在磷酸原代谢、磷酸原生物合成、磷酸肌酸代谢等通路中,并与糖酵解相关酶活性呈显著相关(P<0.05),其中己糖激酶活性与ENO3的表达量呈极显著负相关(P<0.01)。该研究为驼肉宰后肉品质的变化及控制提供了数据支持及参考。
[1] 李秀丽, 双全, 乌云, 等.阿拉善双峰骆驼肉品质分析[J].食品科技, 2012, 37(7):120-123.LI X L, SHUANG Q, WU Y, et al.Analysis on quality of Alxa Bactrian camel meat[J].Food Science and Technology, 2012, 37(7):120-123.
[2] 刘玥如. 不同年龄双峰驼不同部位肉品质特性的研究[D].呼和浩特:内蒙古农业大学, 2021.LIU Y R.Study on meat quality characteristics of different parts of Bactrian camels at different ages[D].Hohhot:Inner Mongolia Agricultural University, 2021.
[3] KADIM I T, MAHGOUB O, PURCHAS R W.A review of the growth, and of the carcass and meat quality characteristics of the one-humped camel (Camelus dromedaries)[J].Meat Science, 2008, 80(3):555-569.
[4] 李琳. 驼肉宰后成熟过程中营养品质与肌原纤维蛋白特性的变化研究[D].呼和浩特:内蒙古农业大学, 2023.LI L.Changes of nutritional quality and myofibrillin properties of camel meat during postmortem aging[D].Hohhot:Inner Mongolia Agricultural University, 2023.
[5] 杨丽, 傅樱花, 张兆肖, 等.骆驼肉的营养价值、食用品质及加工现状[J].肉类研究, 2018, 32(6):55-60.YANG L, FU Y H, ZHANG Z X, et al.Current status of nutritional value, meat quality and processing of camel meat[J].Meat Research, 2018, 32(6):55-60.
[6] MOOKERJEE S A, NICHOLLS D G, BRAND M D.Determining maximum glycolytic capacity using extracellular flux measurements[J].PLoS One, 2016, 11(3):e0152016.
[7] CHAUHAN S S, ENGLAND E M.Postmortem glycolysis and glycogenolysis:Insights from species comparisons[J].Meat Science, 2018, 144:118-126.
[8] 杨媛媛, 李敬, 赵青余, 等.猪肌肉糖原酵解潜力的影响因素及其营养调控研究进展[J].中国畜牧杂志, 2019, 55(11):8-15.YANG Y Y, LI J, ZHAO Q Y, et al.Factors affecting the glycolysis potential of pig muscle and its nutritional regulation[J].Chinese Journal of Animal Science, 2019, 55(11):8-15.
[9] 冯跃进, 顾宪红.热应激对猪肉品质的影响及其机制的研究进展[J].中国畜牧兽医, 2013, 40(2):96-99.FENG Y J, GU X H.Research progress on the effect of heat stress on meat quality and its mechanism in pigs[J].China Animal Husbandry &Veterinary Medicine, 2013, 40(2):96-99.
[10] HUANG H G, LARSEN M R, KARLSSON A H, et al.Gel-based phosphoproteomics analysis of sarcoplasmic proteins in postmortem porcine muscle with pH decline rate and time differences[J].Proteomics, 2011, 11(20):4063-4076.
[11] 摆玉蔷. 蛋白质磷酸化对肉羊宰后糖原磷酸化酶活性的调节机制[D].北京:中国农业科学院, 2020.BAI Y Q.The regulation mechanism of protein phosphorylation on activity of glycogen phosphorylase in postmortem lamb meat [D].Beijing:Chinese Academy of Agricultural Sciences, 2020.
[12] 刘满顺. 蛋白质磷酸化修饰对羊肉品质影响研究[D].西安:陕西师范大学, 2017.LIU M S.THE effect of protein phosphorylation onthe ovine meat quality[D].Xi’an:Shaanxi Normal University, 2017.
[13] 陈立娟, 李欣, 杨扬, 等.不同嫩度羊肉肌浆蛋白质磷酸化水平随宰后成熟时间变化的研究[J].现代食品科技, 2015, 31(4):95-101.CHEN L J, LI X, YANG Y, et al.Analyzing the changes in sarcoplasmic protein phosphorylation with respect to postmortem ageing times in mutton with different levels of tenderness[J].Modern Food Science and Technology, 2015, 31(4):95-101.
[14] CHEN L J, LI X, NI N, et al.Phosphorylation of myofibrillar proteins in post-mortem ovine muscle with different tenderness[J].Journal of the Science of Food and Agriculture, 2016, 96(5):1474-1483.
[15] HUANG H G, LARSEN M R, PALMISANO G, et al.Quantitative phosphoproteomic analysis of porcine muscle within 24 h postmortem[J].Journal of Proteomics, 2014, 106:125-139.
[16] 李艳娇. 日粮淀粉水平与类型对育肥猪生长和肉品质的影响及其作用机制研究[D].南京:南京农业大学, 2016.LI Y J.Effects and mechanisms of dietary starch levels and types on growth and meat quality of finishing pigs[D].Nanjing:Nanjing Agricultural University, 2016.
[17] MONIN G, SELLIER P.Pork of low technological quality with a normal rate of muscle pH fall in the immediate post-mortem period:The case of the Hampshire breed[J].Meat Science, 1985, 13(1):49-63.
[18] WI NIEWSKI J R, ZOUGMAN A, NAGARAJ N, et al.Universal sample preparation method for proteome analysis[J].Nature Methods, 2009, 6(5):359-362.
NIEWSKI J R, ZOUGMAN A, NAGARAJ N, et al.Universal sample preparation method for proteome analysis[J].Nature Methods, 2009, 6(5):359-362.
[19] ENGLAND E M, MATARNEH S K, SCHEFFLER T L, et al.Altered AMP deaminase activity may extend postmortem glycolysis[J].Meat Science, 2015, 102:8-14.
[20] GRAHAME HARDIE D.Energy sensing by the AMP-activated protein kinase and its effects on muscle metabolism[J].Proceedings of the Nutrition Society, 2011, 70(1):92-99.
[21] 郑晓寒. 不同极限pH值牛肉宰后初期糖代谢分析[D].泰安:山东农业大学, 2016.ZHENG X H.Glycolysis analysis of different ultimate pH beef during early postmortem time[D].Taian:Shandong Agricultural University, 2016.
[22] MALHEIROS J M, BRAGA C P, GROVE R A, et al.Influence of oxidative damage to proteins on meat tenderness using a proteomics approach[J].Meat Science, 2019, 148:64-71.
[23] GAGAOUA M, TROY D, MULLEN A M.The extent and rate of the appearance of the major 110 and 30 kDa proteolytic fragments during post-mortem aging of beef depend on the glycolysing rate of the muscle and aging time:An LC-MS/MS approach to decipher their proteome and associated pathways[J].Journal of Agricultural and Food Chemistry, 2021, 69(1):602-614.
[24] BELDARRAIN L R, ALDAI N, PICARD B, et al.Use of liquid isoelectric focusing (OFFGEL) on the discovery of meat tenderness biomarkers[J].Journal of Proteomics, 2018, 183:25-33.