高血压作为一种慢性疾病,广泛存在于中高龄人群中[1]。研究表明,常年的高血压会导致心血管疾病[2]、肾脏疾病[3]、脑卒中[4]等疾病发病率的提升。据报道,世界上超过25%的人口患有高血压[5],高血压的病因与多器官和激素系统的相互作用密切相关,其中肾素-血管紧张素-醛固酮系统和激肽释放酶-激肽系统是人体内2个相互拮抗的激素系统,在调节人体血压中起着重要作用[6]。血管紧张素转换酶(angiotensin-converting enzyme,ACE)是这2个激素系统的关键调节因子之一[7],在肾素-血管紧张素-醛固酮系统中,血管紧张素Ⅰ(angiotensin I,AngⅠ)在ACE的催化下转化为强效血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ),是ACE催化下最强的血管收缩剂之一[8];在激肽释放酶-激肽系统中,ACE通过2次作用将缓激肽(一种血管扩张剂)降解为缓激肽1-7和缓激肽1-5而使其失活,从而导致血压升高[9]。因此,ACE已被选定为控制和治疗人体高血压疾病的潜在靶点。然而,目前临床治疗高血压使用的ACE抑制剂(如卡托普利[10]和雷米普利[11]等)在降低血压的同时会引起刺激性咳嗽、血管性水肿和低血压等各种副作用[12]。相比于药物,天然的生物活性物质由于其高疗效和低副作用风险在过去几十年中备受关注[13]。据研究报道,绿豆、米糠、鱼、猪、小麦胚芽和甜高粱籽粒等天然蛋白质中均含有具有ACE抑制活性的二肽、三肽或四肽等短链肽[14-17]。我国传统中医药典籍《中国动物药》中记载:牛骨具有多种药用价值,长期服用能够有效降低人体血压。牛骨作为肉类工业未充分利用的副产品,在一些国家,牛骨废料被用来生产生物柴油、瓷器或肥料[18],其附加值未得到显著的提升。新鲜牛骨的蛋白质含量约为12%,其中95%的牛骨蛋白是胶蛋白[19]。近年来,随着畜产品需求的增加,动物骨的开发利用受到了大量关注。尽管我国传统中医早已开始使用牛骨治疗高血压,然而到目前为止,世界范围内对牛骨的深加工产物研究严重不足。以牛骨为原材料,通过水解、分离和鉴定对其含有的ACE抑制活性物质进行研究的报道更为有限。本研究以牛骨为原料,采用酶解法制备了具有高ACE抑制活性的牛骨水解物(bovine bone hydrolysate, BBH),并采用超滤、凝胶柱层析和反向液相色谱结合Nano-LC-ESI-MS/MS技术,从BBH中分离纯化并鉴定了一种新的ACE抑制活性肽,同时还通过模拟分子对接和大鼠血浆抗性实验,对牛骨ACE抑制肽的作用机制及其酶解的抗性进行了分析,以期为畜产品加工副产物-牛骨附加值的提升及综合利用提供数据支撑。
1 材料与方法
1.1 材料与试剂
牛骨,南京乐购超市;胃蛋白酶、ACE(来自兔肺)、马尿酰-L-组氨酰-L-亮氨酸(Hippuryl-L-histidyl-L-leucine,HHL)、乙腈(acetonitrile,ACN)(HPLC级),美国Sigma-Aldrich公司;甲酸,德国Fluka公司;超滤膜,美国EMD Millipore公司;Sephadex G-25凝胶,瑞典Amersham Bioscience公司;自发性高血压大鼠(SHRs,12周龄),中国北京VitalRiver实验动物科技有限公司;其他所有试剂均为分析级。
1.2 仪器与设备
高压锅,中国浙江苏泊尔有限公司;100目高速研磨机,中国天津仪器有限公司;HH-4恒温水浴锅,苏州威尔实验用品有限公司;LC20020985手持pH计,上海力辰邦西仪器科技有限公司;1236 HPLC仪、自动进样器、色谱柱Lichrospher100,C18(4.6 mm×100 mm, 3.5 μmol/L),美国安捷伦科技公司;Nano-LC-MS/MS 3000系统,美国赛默飞科技有限公司。
1.3 实验方法
1.3.1 牛骨粉的制备
剔除牛腿骨上粘连的碎肉和骨髓,并进行彻底的清洗后使用蒸馏水浸泡牛骨2 h,以去除血水;在高压锅中以121 ℃和0.1 MPa的压力加热4 h以脱脂,脱脂后的牛骨在40 ℃下干燥24 h,以去除多余的水分;利用高速研磨机将干燥后的牛骨研磨成粉并过100目筛以除去大颗粒碎骨,在-20 ℃条件下进行冷冻干燥,以备后续使用。
1.3.2 BBH的制备
首先将牛骨粉溶解于0.3 mol/L的EDTA溶液(牛骨粉与溶液的比例为1∶10,g∶mL,pH 7.0)中,并在4 ℃下搅拌2 d以去除Ca2+,期间每6 h换液1次。之后,4 ℃、12 000×g离心15 min,分离出脱钙骨粉。将脱钙骨粉与去离子水混合(60 g/L),使用2 mol/L HCl溶液调节pH值至2.0,并加入胃蛋白酶,在37 ℃下搅拌6 h后,沸水浴(100 ℃)处理10 min以灭活胃蛋白酶。冷却后,4 ℃、12 000×g离心10 min,取上清液(即BBH)后测定其ACE抑制率。
1.3.3 牛骨水解液酶解条件优化
为了确定获得最高ACE抑制率的BBH的最佳水解工艺参数,本研究在单因素试验的基础上,采用响应面法对其工艺参数进行优化,以水解时间(h)、底物质量浓度(g/100 mL,即牛骨粉与蒸馏水的比例)、以及E/S比(%,即胃蛋白酶与牛骨粉的比例)作为自变量,BBH的ACE抑制率为因变量,根据Box-Behnken的实验设计原则,利用Design Expert®软件8.0.6在3个不同的水平下(E/S分别为0.25%、0.75%、1.25%,底物浓度分别为4、6、8 g/100 mL,酶解时间分别为4、6、8 h)进行响应面试验。整个实验设计包含了17个独立的处理点,其中5个为中心点,每个处理点进行3次重复试验。
1.3.4 多肽ACE抑制活性的测定
BBH的ACE抑制率根据ZHANG等[20]所采用的HPLC法略作修改后进行测定。首先,将待测样品与5 mmol/L的HHL(溶于0.1 mol/L的硼酸缓冲液,pH 8.3,含有0.3 mol/L NaCl溶液)以1∶5的比例混合,并在37 ℃下预培养5 min(以硼酸缓冲液作为对照,每个样品使用6种不同的浓度)。然后,取20 μL的ACE(0.1 U/mL)与预培养的混合物混合,在37 ℃恒温下放置40 min。反应结束后,用250 μL的1 mol/L HCl溶液终止反应,后进行HPLC分析,流动相由A(85%去离子水、0.1%三甲胺和0.1%甲酸,体积分数)和B(15%乙腈、0.1%三乙胺和0.1%甲酸,体积分数)组成,波长为228 nm,流速为1 mL/min。测定结果通过比较是否添加抑制剂的峰面积计算样品的ACE抑制率。通过拟合ACE抑制作用与样品肽浓度图中的线性回归方程,利用剂量-反应曲线计算各样品组的相对IC50值。样品中肽的含量根据XING等[21]的方法进行评估。ACE抑制率计算如公式(1)所示。
ACE抑制率![]()
(1)
式中:A1,空白对照组的峰面积;A2,样品组的峰面积。
1.4 ACE抑制肽的分离纯化
1.4.1 超滤分离
采用不同截留分子质量的超滤膜对BBH进行初步分离。使用截留分子质量为10 kDa的超滤膜进行过滤,收集分子质量>10 kDa的组分,标记为U-I;使用截留分子质量为3 kDa的超滤膜对之前过滤得到的滤液进行再次过滤,收集分子质量在3~10 kDa的组分,标记为U-Ⅱ,同时收集分子质量<3 kDa的组分,标记为U-Ⅲ。将收集到的所有组分进行冷冻干燥处理,并分别取样测定其体外ACE抑制活性,收集活性较高的组分保存至-80 ℃冰箱中进行下一步实验。
1.4.2 Sephadex G-25凝胶分离
为了进一步纯化超滤后得到的组分,采用Sephadex G-25凝胶对超滤过后的多肽组分进行进一步的分离纯化。在4 ℃的条件下,将超滤后的组分通过Sephadex G-25凝胶柱进行分离,使用超纯水作为洗脱液,并保持流速为1.50 mL/min的洗脱液。通过自动馏分收集器收集在280 nm波长处出现的各个洗脱峰组分,分别标记为G-Ⅰ、G-Ⅱ和G-Ⅲ。将所有收集到的组分冷冻干燥处理后取样测定其体外ACE抑制活性,收集活性较高的组分保存至-80 ℃冰箱中进行下一步实验。
1.4.3 反相高效液相色谱(reversed-phase HPLC,RP-HPLC)分析
对高活性多肽组分进一步分离纯化,本研究利用Zorbax 300SB-C18反相柱(4.6 mm×150 mm,5 μm)分析柱,依据XING等[22]的方法,对凝胶层析后的多肽组分进行进一步的分离纯化。具体操作:采用线性梯度洗脱系统对100 μL溶解的肽(10 mg/mL)进行分离。流动相A由超纯水和0.1%(体积分数)甲酸组成,流动相B为100%(体积分数)乙腈,流速设定为0.8 mL/min,梯度操作:0~10 min,B相比例从0%线性增加至5%;10~25 min,B相比例从5%增加至10%;25~40 min,B相比例从10%增加至15%;40~55 min,B相比例从15%增加至20%;55~70 min,B相比例从20%增加至25%;70~85 min,B相比例达到100%。在215 nm波长下检测洗脱峰,并收集具有最强ACE抑制作用的组分进行冷冻干燥保存。
1.5 牛骨源ACE抑制肽的多肽序列鉴定
1.5.1 Nano-LC-ESI-MS/MS法鉴定多肽序列
为明确分离纯化后收集到的ACE抑制活性最强的冻干组分中的多肽序列,采用Dionex Ultimate Nano-LC-MS/MS 3000系统和四极离子阱Orbitrap(LTQ-Orbitrap-XL)光谱仪对多肽氨基酸序列进行分析[22]。具体操作如下:
液相洗脱条件:使用Hypersil GOLD C18色谱柱(2.1 mm×100 mm,3 μm),流动相A为超纯水(含0.1%甲酸),流动相B为80%乙腈(含0.08%甲酸)。梯度洗脱程序设置为:0~1.5 min,B相比例从0%增加至3%;1.6~19 min,B相比例从3%增加至35%;20~26 min,B相比例从35%增加至95%;26~30 min,B相比例从95%回到3%。流速200 nL/min,柱温35 ℃,样品装载量3 μL。
质谱分析条件:使用Thermo Fisher LTQ Obitrap XL Nano离子源,喷雾电压设置为2.2 kV。质谱扫描时间设定为90 min,实验模式为数据依赖模式,扫描范围覆盖100~1 800 m/z。动力学模式采用高能碰撞离解,碰撞能力设定为40%,激活q值0.25,激活时间30 ms。
多肽序列测定:通过Peaks Studio 8.5的从头测序程序,系统分析质谱数据。首先,对收集的质谱数据进行预处理,以消除噪声、校正系统误差,并优化信号强度。随后,利用Peaks Studio 8.5中集成的先进算法,进行从头测序分析。最后,在获得高质量的候选肽段列表后,进行多维度的综合评估。综合评估包括与已知ACE抑制肽的序列比对、肽段长度分布的统计分析、氨基酸组成模式的识别等。
最终,精确解析出了牛骨源ACE抑制肽的具体序列。
1.5.2 分子对接技术
为深入解析牛骨源ACE抑制肽(Gly-Phe-Ser-Gly-Phe-Arg,GPSGPR)与ACE活性位点的相互作用机制,本研究利用DiscoveryStudio3.5软件中的CDOCKER模块进行ACE抑制肽与ACE酶的计算机分子模拟对接研究。CDOCKER模块是一个基于CHARMm力场的对接程序,它利用软核电位和可选的网格表示来模拟配体分子与受体活性位点之间的相互作用。在此过程中,本研究采用高分子动力学和模拟退火方法,随机搜索受体活性位点附近的小分子构象,并对每个构象进行优化。具体步骤如下:首先,引入GPSGPR的分子模型,为提高模拟准确性、促进分子间相互作用和加速模拟过程进行必要的优化,包括加氢、加CHARMm力场和Momany-Rone电荷。随后,对ACE受体(PDB∶1086a)也进行优化,包括加氢、添加CHARMm力场和Momany-Rone电荷,并通过软件自动识别定义其活性中心。最后,利用CDOCKER模块进行对接研究,以揭示GPSGPR与ACE活性位点的详细作用机制。
1.5.3 GPSGPR的肽酶抗性
为了评估牛骨源ACE抑制肽(GPSGPR)的体内稳定性,本研究采用CAO等[7]描述的肽酶/蛋白酶抗性测定方法进行研究。将从自发性高血压大鼠(SHRs,12周龄)中获取的新鲜血浆,在37 ℃条件下与GPSGPR混合,确保GPSGPR的最终质量浓度为0.2 mg/mL。然后,在0、0.5、1、2、4、6 h的时间点收集等量的血浆肽,并与3倍体积的甲醇混合,后离心处理(14 000×g,4 ℃,15 min),收集上清液并通过X Bridge® Peptide BEH C18(5 μm, 4.6 mm×250 mm)HPLC进行分析。
色谱条件设置为:流速0.96 mL/min,流动相A为超纯水(含0.1%甲酸),流动相B为乙腈。梯度洗脱条件为:0~15.2 min,B相比例从3%线性增加至65%;15.2~25.2 min,B相比例维持在65%;25.2~30.2 min,B相比例从65%快速增加至95%;30.2~40 min,B相比例回到3%。依据各时间点的GPSGPR残留量通过色谱峰面积相对于零点的百分比来评估GPSGPR在动物血浆中的肽酶抗性。
1.6 数据分析
本研究采用SPSS 25.0进行数据的统计分析。每个实验条件被重复3次,以消除随机误差的影响,所有结果均表示为“平均数±标准误差”。选用Duncan’s Multiple Range Test统计方法计算不同均值之间是否存在显著性差异,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 GPSGPR提取工艺的优化
团队前期单因素试验结果显示,对制备高ACE抑制率BBH影响较大的三大主要酶解因素:酶解时间、底物质量浓度和酶底物比(E/S),为获取ACE抑制肽的最优制备工艺,本研究在酶解时间(4~8 h)、底物质量浓度(4~8 g/100 mL)、酶底比(0.25%~1.25%)组合参数下进行响应面优化实验,以探究高ACE抑制率BBH的最优酶解工艺参数。利用DesignExpert8.0.6软件进行多元二次回归方程分析,构建所需数学模型。该模型是一个拟合二阶多项式,其表达式为:Y=74.88+1.95A+2.85B+2.71C+0.27AB+0.77AC-1.38BC-6.12A2-2.01B2-3.25C2[A代表酶解时间,B代表底物质量浓度,C代表酶与底物比(E/S)]。
如表1所示,回归模型方差分析结果显示回归模型的P值为0.000 4(P<0.01),表明该模型具有显著的统计意义。同时,模型的拟合不足分析P值为0.117 9(P>0.05),表明模型的拟合不足不显著,即所选模型是合适的。模型的回归系数(R2)和修正系数(RAdj2)分别为0.961 8和0.912 7,这表明模型对实验数据的拟合程度良好,实验误差较小。因此,该模型能够可靠地预测和解释不同酶解时间、底物质量浓度和E/S比对ACE抑制肽提取效率的影响。
表1 响应面二次模型的方差分析
Table 1 Analysis of variance for a quadratic model of the response surface
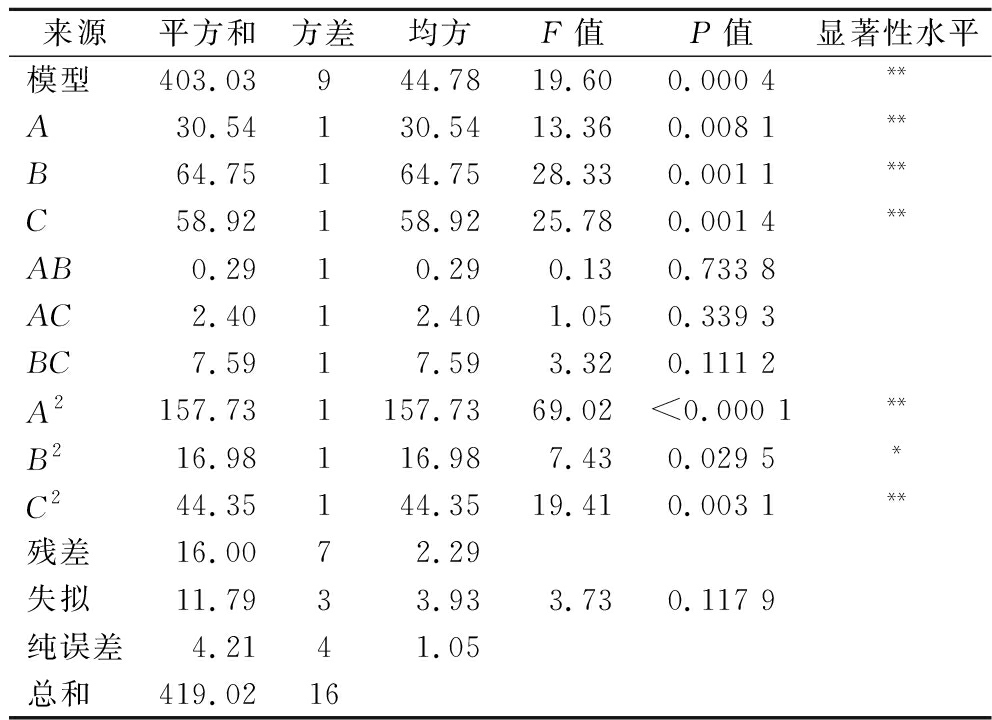
来源 平方和方差均方F值P值显著性水平模型403.03944.7819.600.000 4**A30.54130.5413.360.008 1**B64.75164.7528.330.001 1**C58.92158.9225.780.001 4**AB0.2910.290.130.733 8AC2.4012.401.050.339 3BC7.5917.593.320.111 2A2157.731157.7369.02<0.000 1**B216.98116.987.430.029 5*C244.35144.3519.410.003 1**残差16.0072.29失拟11.7933.933.730.117 9纯误差4.2141.05总和419.0216
注:*,P<0.05;**,P<0.01;R2=0.961 8, RAdj2=0.912 7。
为了直观地展示三大主要因素对BBH的ACE抑制率的影响,利用DesignExpert 8.0.6软件绘制了响应面图和等高线图(图1)。3个不同因素影响下的响应面图均呈现出开口向下的状态,这表明在3大不同因素交错影响下,BBH的ACE抑制率均存在最优条件点,使得BBH的ACE抑制率达到最高。等高线图中的曲线均围绕该点形成一个顶点,进一步证实了这一点。通过软件模拟,得到了牛骨水解产物获得最高ACE抑制率的最佳工艺参数:酶解时间为6.38 h,底物浓度为7.23 g/100 mL,E/S为0.91%。在这些条件下,BBH的理论ACE抑制率预计可达76.36%。为方便调控、减少工艺波动,提高工艺的稳定性和可控性,确保生产过程的连续性和产品的一致性,对酶解工艺参数进行了微调:酶解时间设定为6.5 h,底物浓度调整为7.5 g/100 mL,E/S保持为0.9%,验证实验结果显示,该反应条件下制得的牛骨酶解液的ACE平均抑制率可达78.01%,与理论预测值相近,表明基于响应面法优化的提取工艺参数既准确又可靠。
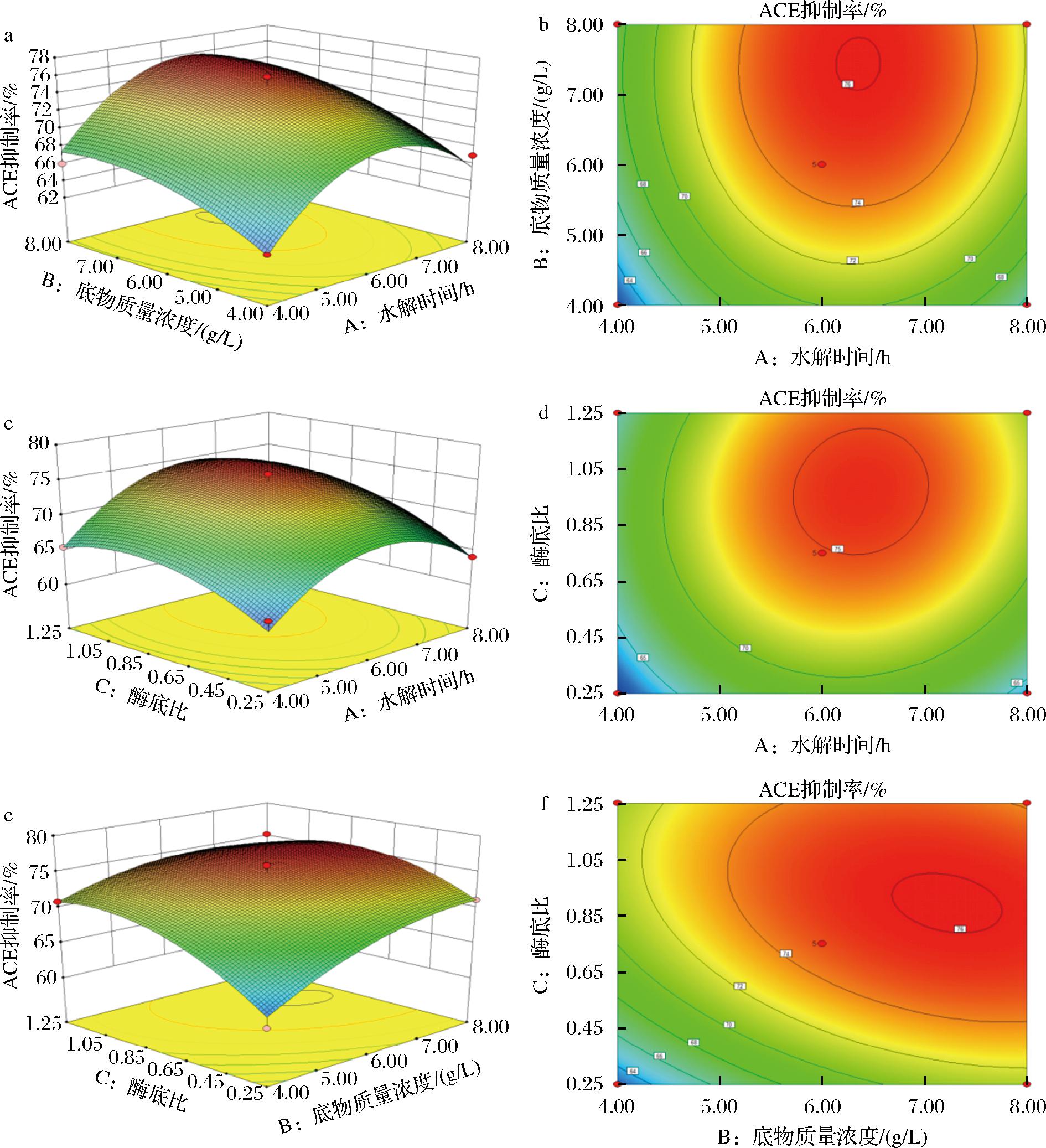
a/b-水解时间与底物质量浓度之间的交互作用;c/d-水解时间与酶底比之间的交互作用;e/f-底物质量浓度与酶底比之间的交互作用
图1 各因素交互作用对牛骨酶解液ACE抑制率影响的响应面图及等高线图
Fig.1 Response surface and contour plots of the interaction of various factors on the ACE inhibition rate of BBH
2.2 牛骨源ACE抑制肽的分离纯化
2.2.1 超滤技术
研究表明,蛋白质水解产物的生物活性与肽的分子质量(molecular weight,MW)之间存在显著的关联[23]。因此,本实验利用不同分子量的超滤膜系统对BBH的进行分离,以探究不同分子质量肽段的ACE抑制活性。通过超滤处理,BBH被分离成3个组分:U-Ⅰ(MW>10 kDa)、U-Ⅱ(10 kDa>MW>3 kDa)和U-Ⅲ(MW<3 kDa)。如表2所示,对BBH及其3个超滤组分的ACE抑制活性进行了测定。结果显示,U-Ⅲ组分的ACE抑制活性最高[IC50=(0.048 8±0.002) mg/mL],显著高于BBH[IC50=(0.102 3±0.002) mg/mL]和其他2个组分[U-I:IC50=(0.318 5±0.005) mg/mL;U-Ⅱ:IC50=(0.100 2±0.004) mg/mL]。这一发现与BHASKAR等[24]和LIN等[25]的研究结果相吻合,他们发现从马克兰面粉水解物和库拉酪蛋白水解物中分离出的低分子量(MW<3kDa)组分具有比高分子质量组分更高的ACE抑制活性。这一现象可归因于相比高分子质量多肽,低分子质量肽更容易进入ACE的活性位点,进而使其更加有效地与ACE结合并抑制其催化活性。
表2 BBH及其超滤后3种组分的ACE抑制能力(IC50)
Table 2 ACE inhibitory activity (IC50) of BBH and its three fractions after ultrafiltration
ACE抑制能力BBHU-ⅠU-ⅡU-ⅢIC50/(mg/mL)0.102 3±0.002b0.318 5±0.005a0.100 2±0.003b0.048 8±0.001c
注:同行数据小写字母不同表示差异显著(P<0.05)。
2.2.2 SephadexG-25凝胶层析
收集超滤获得的U-Ⅲ组分,通过填充有Sephadex G-25的凝胶排阻色谱柱对其进行进一步的分离纯化。如图2-a所示,Sephadex G-25的凝胶排阻色谱柱将U-Ⅲ组分分离成GF-1、GF-2和GF-3三个主要的多肽组分。如图2-b所示,对各组分ACE抑制活性进行测定,结果表明,GF-2组分多肽对ACE的抑制能力[IC50=(0.007±0.002) mg/mL],显著优于GF-1[IC50=(0.183 8±0.005) mg/mL]和GF-3[IC50=(0.234 1±0.005) mg/mL]。这表明,虽然肽的分子量是影响ACE抑制活性的重要因素之一,但并非唯一决定因素,这是由于多肽链上亲水性氨基酸残基的存在和分布可通过影响多肽与ACE活性位点的相互作用来进一步调控其ACE抑制能力[26]。
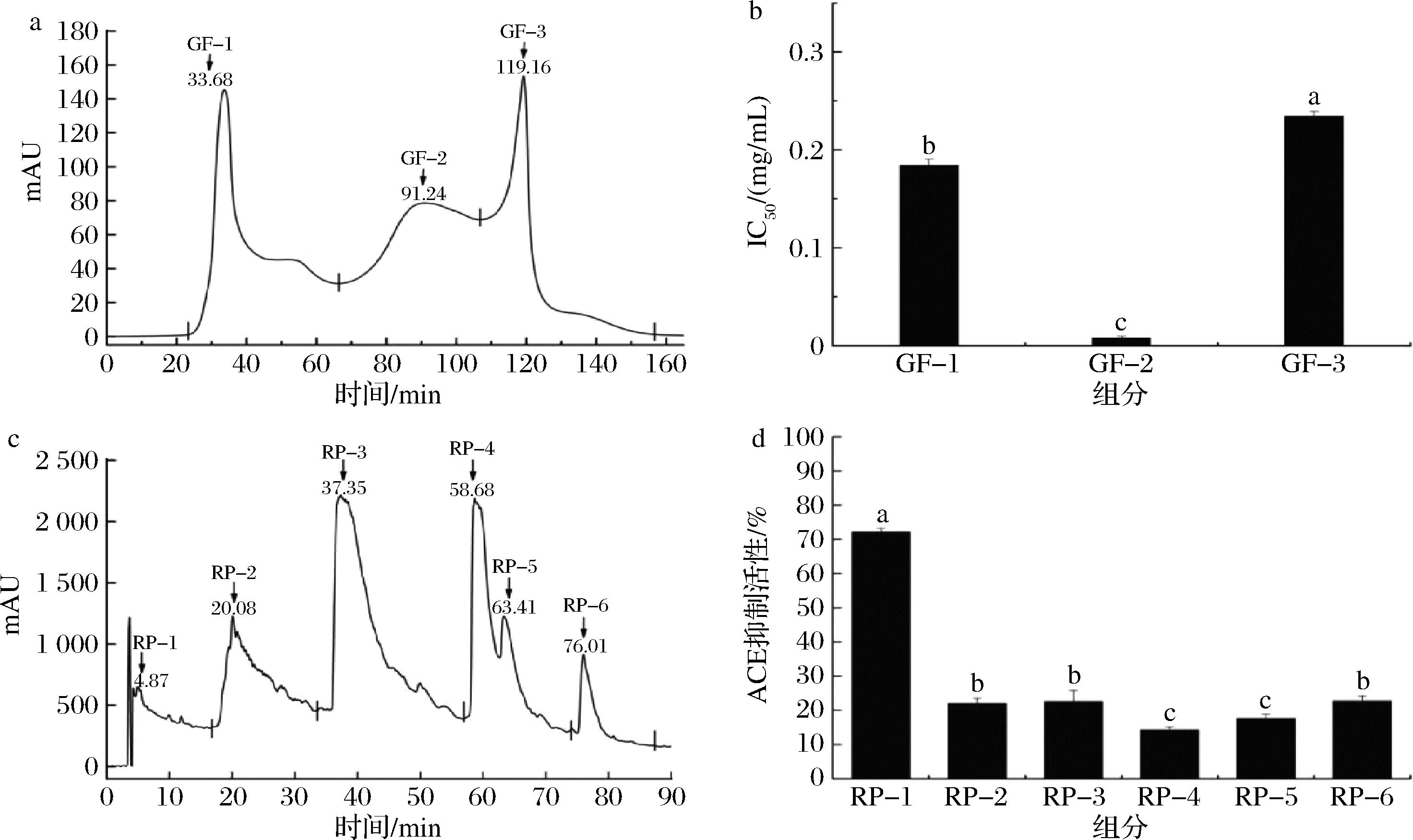
a-U-Ⅲ的Sephadex G-25尺寸排阻色谱图谱;b-Sephadex G-25层析分离的不同肽组分的ACE抑制活性;c-GF-1的RP-HPLC图谱;d-RP-HPLC分离的不同肽组分的ACE抑制活性
图2 多柱色谱串联法分离纯化U-Ⅲ组分中高活性ACE抑制肽
Fig.2 Separation and purification of highly active ACE inhibitory peptides from U-Ⅲ components using multi column chromatography tandem method
注:小写字母不同表示显著差异(P<0.05)(下同)。
2.2.3 RP-HPLC
将收集到的GF-2多肽组分(10 mg/mL)进行更进一步的分离纯化,共纯化得到6个馏分(RP-1、RP-2、RP-3、RP-4、RP-5和RP-6)。如图2-c所示,GF-2组分的洗脱谱清晰展示了各馏分的分布。收集洗脱图谱中的各峰,并经过冻干处理后进行ACE抑制活性测定(肽质量浓度为0.1 mg/mL)。结果显示,RP-1峰具有最强的ACE抑制活性(73.34%±3%,IC50=0.003 mg/mL,图2-d)。为进一步研究多肽结构与功能关系,研究人员通过连续的层析分离和纯化对RP-1组分进行收集,后利用Nano-LC-ESI-MS/MS技术对其进行氨基酸序列分析。
2.3 牛骨源ACE抑制肽氨基酸序列鉴定及活性验证
采用Nano-LC-ESI-MS/MS技术对ACE抑制活性最高的RP-1片段进行深入的氨基酸序列分析(图3-a)。从RP-1片段中,成功鉴定出了一条具有高ACE抑制能力的小分子质量(570 Da)生物活性肽Gly-Pro-Ser-Gly-Pro-Arg (GPSGPR)(图3-b)。ACE的活性位点通常无法容纳大分子质量的肽段[27],且大多数具有降压活性的肽段序列相对较短,通常包含2~12个氨基酸残基[28],GPSGPR的序列长度和结构特点使其成为一个潜在的ACE抑制剂。为了验证GPSGPR的ACE抑制活性,研究人员通过化学合成法合成了该多肽(纯度:96.54%),并对其进行了体外ACE抑制活性评价,结果显示合成肽GPSGPR的IC50值低至382.16 μmol/L,表明其具有显著的ACE抑制能力。研究表明,ACE抑制肽C末端氨基酸残基组成及序列结构对于其ACE抑制能力具有重要影响[28],大多数ACE抑制肽在C端三肽残基中包含疏水氨基酸,如Arg、Leu、Ala、Val、Ile、Tyr和Phe等,这些疏水氨基酸可以与ACE活性位点的疏水口袋形成稳定的疏水相互作用,同时辅以氢键、静电作用及范德华力,精准地结合至ACE的特异性结合位点(如S1、S1′、S2),这种多层次的相互作用机制能够有效抑制ACE对血管紧张素I的催化水解活性[29]。研究发现肽段LHLPLR相较于LHLPLP显示出更高的ACE抑制活性,这表明C末端疏水氨基酸残基R在促进肽与ACE结合和抑制ACE活性中的重要作用[26]。GPSGPR的C末端为R-Arg残基,其胍基结构能够显著影响其与ACE的结合,并增强其抑制ACE活性的能力。另外,研究还表明上述疏水氨基酸还可以通过提高肽在细胞膜等脂质结构中的溶解度,促进肽穿过细胞膜,进而提升其在细胞内的ACE抑制能力[26]。综上所述,GPSGPR作为一种新的ACE抑制肽,其C末端的疏水氨基酸残基对其降压活性起到了关键作用,为高血压等心血管疾病的治疗提供了新的潜在药物分子。

a-使用Nano-LC-ESI-MS/MS获得的R-1的LC-MS色谱图;b-GPSGPR的MS/MS谱图
图3 Nano-LC-ESI-MS/MS(GPSGPR)鉴定的BBH新型肽
Fig.3 A novel peptides from BBH identified by Nano-LC-ESI-MS/MS (GPSGPR)
2.4 GPSGPR的ACE抑制活性分析及其计算机分子模拟对接
为了深入探究GPSGPR与ACE之间的分子相互作用机制,研究人员利用Discovery Studio 3.5软件构建了GPSGPR与ACE的分子模拟对接模型,该对接模型揭示了抑制剂GPSGPR与ACE之间潜在的结合位点,确定了GPSGPR与ACE的最佳结合位置。模型对接发现GPSGPR与ACE的潜在相互作用能值为-94.34 kcal/mol,这表明GPSGPR与ACE间存在较为稳定的结合。GPSGPR与ACE结合的最佳对接结构图清晰地显示,GPSGPR被ACE活性中心的氨基酸残基紧密包绕(图4-a)。另外,分子对接模拟还进一步揭示了GPSGPR与ACE之间的相互作用细节,GPSGPR能够通过氢键和范德华力与ACE的多个氨基酸残基形成稳定的结合(图4-b),具体而言,模拟对接结果显示GPSGPR可与ACE的Cys370、Thr372、Glu162、Gln281、Tyr523和Lys511残基形成氢键,这些氢键在稳定对接配合物和抑制酶催化方面起到了关键作用;此外,GPSGPR还可与ACE的Phe391、Cys352、His387、Thr371、Ala356、Val518、Glu376、Thr166、Phe512和Phe527残基形成范德华键,这能够显著提升GPSGPR对于ACE催化活性的抑制能力。ACE作为锌依赖性金属肽酶M2家族的一员,其活性中心包含一个Zn2+和3个主要活性口袋。分子对接模拟表明,GPSGPR的氨基酸残基与这些活性口袋的氨基酸残基能够形成稳定的氢键,GPSGPR中的氨基酸残基可以与ACE活性中心的3个主要活性口袋(S1、S2和S1′)形成稳定的氢键。S1口袋中的Tyr523和Lys511、S2口袋中的Gln281以及S1′口袋中的Glu162与GPSGPR中的氨基酸残基之间形成的氢键稳定距离分别为4.82、6.45、5.94 Å和4.07 Å,这些稳定的氢键可能是GPSGPR能够显著抑制ACE的催化活性的关键。此外,GPSGPR还可以通过范德华力和静电相互作用与ACE中Zn2+和氨基酸残基(His383、His387和Glu411)构成的正四面体结构结合,这可能潜在地阻碍了ACE与Zn2+的结合,从而降低了ACE的催化活性。以上实验结果,可为GPSGPR显著抑制ACE催化活性的作用机制提供分子层面的见解。
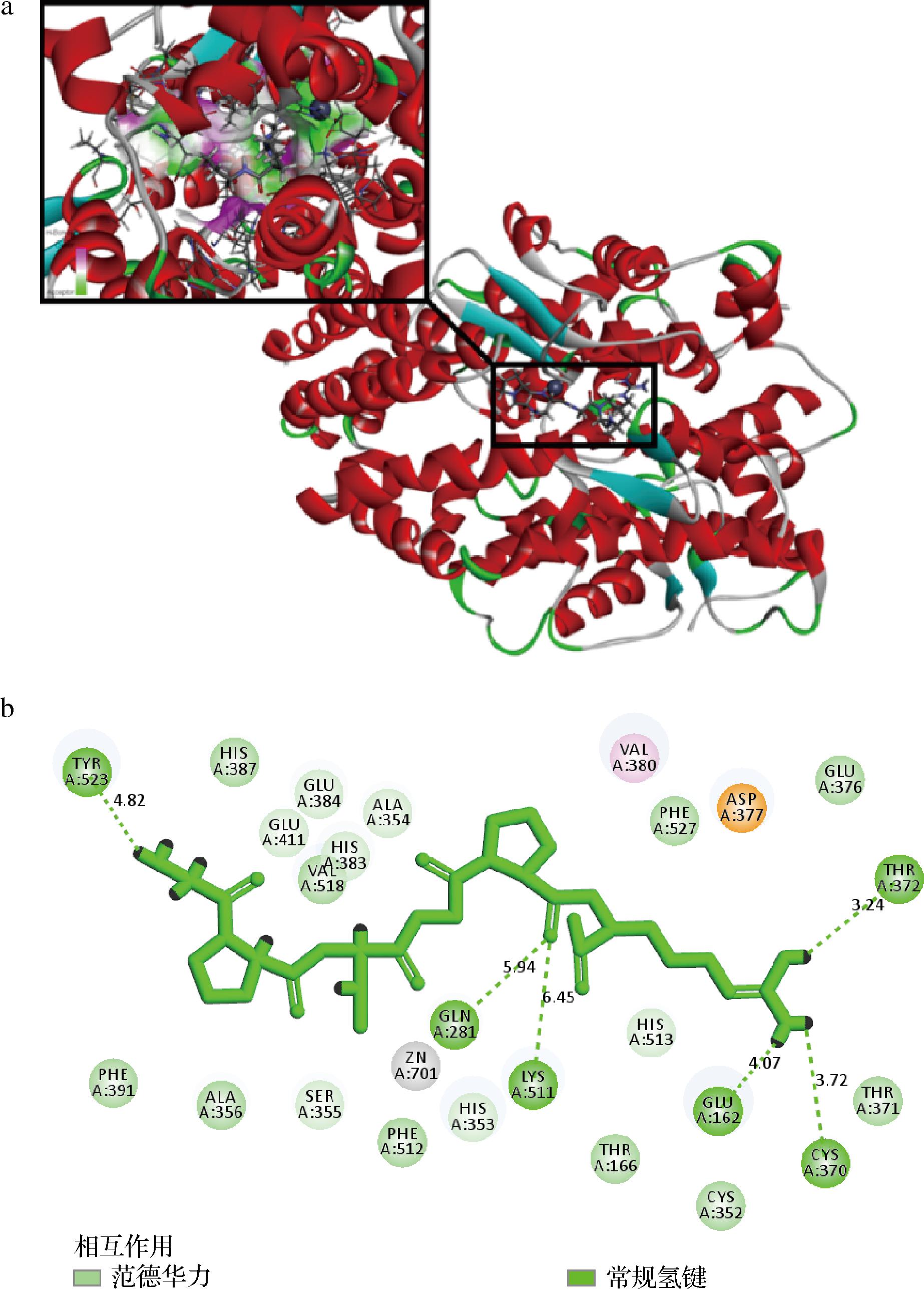
a-GPSGPR与ACE结合的最佳对接结构图(PDB∶1O8A),左上图显示了GPSGPR 和 ACE 组合区域的放大视图(GPSGPR以棒式模型的形式呈现);b-GPSGPR和ACE氨基酸残基相互作用的二维图
图4 GPSGPR与ACE(PDB∶1O8A)的分子互作模式图
Fig.4 Molecular Interaction Modes of GPSGPR and ACE(PDB∶1O8A)
2.5 GPSGPR的血浆稳定性分析
图5所示的实验结果详细描述了GPSGPR(Gly-Pro-Ser-Gly-Pro-Arg)对大鼠血浆中肽酶降解的抗性。实验数据清晰地表明,随着培养时间的延长,GPSGPR在37 ℃的大鼠血浆中发生了一定程度的降解。经过6 h的培养后,GPSGPR仍保留了约50.1%的原始量,这意味着有大约一半的GPSGPR未被血浆中的肽酶/蛋白酶所消化(图5),这表明GPSGPR在体外血浆环境中具有良好的肽酶消化抗性。QUIR S等[30]的研究发现,在血浆中孵育2 h后,HLPLP的含量降低至50%以下,类似地,有研究表明,二肽WQ在人血清中的半衰期仅为2.3 h,而三肽LPG和RWQ在血浆中孵育30 min后几乎检测不到残留含量[31]。此外,药代动力学实验显示,IPP、LPP和VPP在模型猪体内经静脉给药后的消除半衰期分别仅为2.5、1.9 min和2.0 min[32]。与其他肽类化合物在血浆中的降解速率相比,这些对比数据进一步强调了GPSGPR在血浆中具有相对稳定的特性。然而,需要注意的是,尽管GPSGPR在体外显示出了对肽酶的较强抗性,但其对体内ACE活性的实际影响仍需通过进一步的体内实验来确定。这是因为生物活性肽的生物活性与其在生物体内的生物利用度密切相关,而生物利用度受到多种生物过程的影响,包括肽的降解速率、吸收、分布、代谢和排泄等。因此,未来的研究将需要评估GPSGPR在动物模型中的生物利用度及其对ACE活性的实际影响。
S等[30]的研究发现,在血浆中孵育2 h后,HLPLP的含量降低至50%以下,类似地,有研究表明,二肽WQ在人血清中的半衰期仅为2.3 h,而三肽LPG和RWQ在血浆中孵育30 min后几乎检测不到残留含量[31]。此外,药代动力学实验显示,IPP、LPP和VPP在模型猪体内经静脉给药后的消除半衰期分别仅为2.5、1.9 min和2.0 min[32]。与其他肽类化合物在血浆中的降解速率相比,这些对比数据进一步强调了GPSGPR在血浆中具有相对稳定的特性。然而,需要注意的是,尽管GPSGPR在体外显示出了对肽酶的较强抗性,但其对体内ACE活性的实际影响仍需通过进一步的体内实验来确定。这是因为生物活性肽的生物活性与其在生物体内的生物利用度密切相关,而生物利用度受到多种生物过程的影响,包括肽的降解速率、吸收、分布、代谢和排泄等。因此,未来的研究将需要评估GPSGPR在动物模型中的生物利用度及其对ACE活性的实际影响。
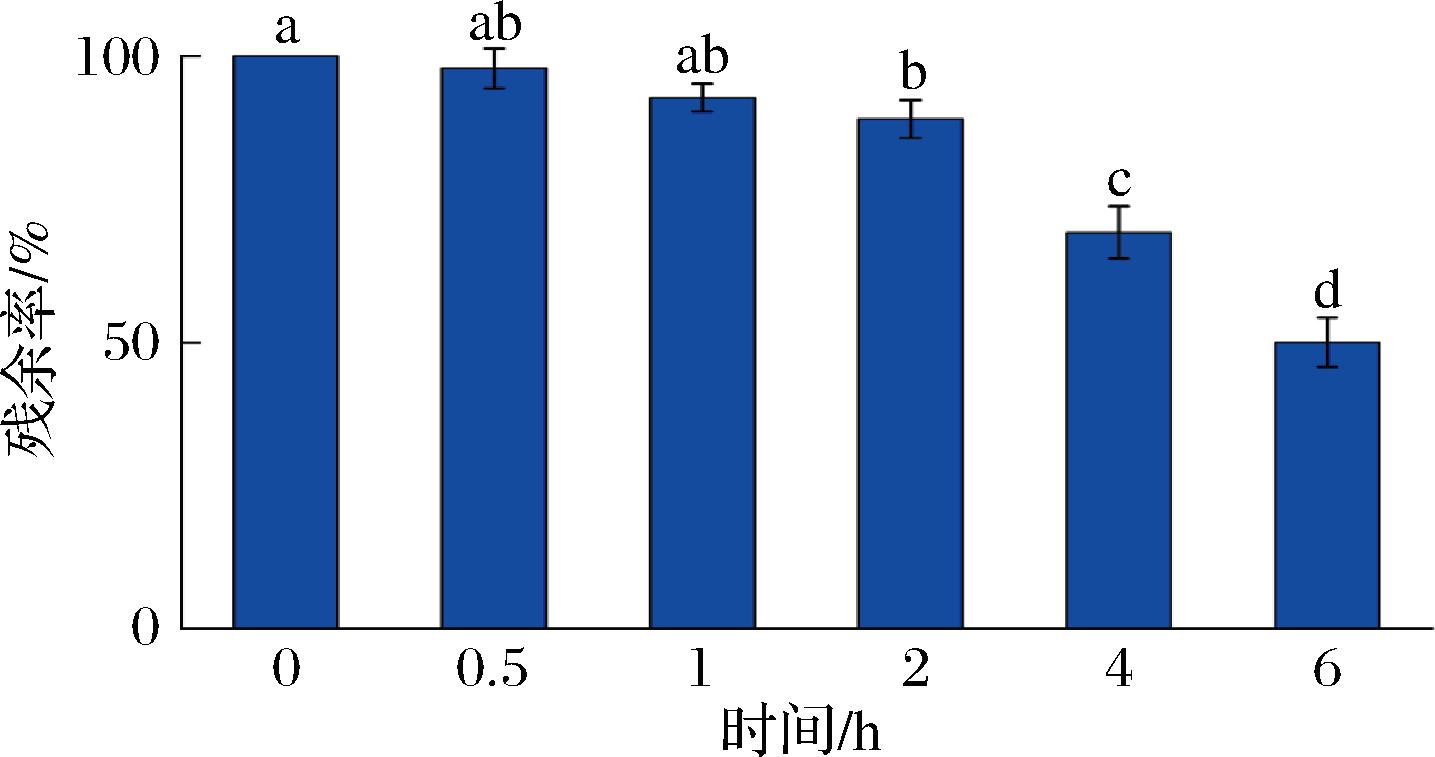
图5 大鼠血浆不同孵育时间后GPSGPR的残余率
Fig.5 Residual ratio of GPSGPR after incubation different time with rat plasma
3 结论
本研究系统地探究了酶解时间、底物质量浓度以及酶与底物质量比(E/S)3个关键因素对于牛骨水解物ACE抑制活性的影响,并通过响应面法优化得到了最佳的提取工艺参数;随后,利用超滤技术和多重色谱柱分离纯化技术,本研究成功获得了具有高度ACE抑制活性的高纯度牛骨水解产物GPSGPR,另外,本研究还利用分子模拟对接实验对GPSGPR与ACE相互作用机制进行预测,GPSGPR可与ACE的多个关键氨基酸残基(包括Cys370、Thr372、Glu162、Gln281、Tyr523和Lys511)形成稳定的氢键,同时还可与Phe391、Cys352、His387、Thr371、Ala356、Val518、Glu376、Thr166、Phe512和Phe527等残基形成范德华键,这些相互作用,特别是与ACE活性口袋(Tyr523、Lys511、Gln281和Glu162)和Zn2+四面体(His387)形成的强氢键和范德华力,是GPSGPR对ACE高抑制活性的主要原因;最后,本研究利用大鼠血清酶抗实验对GPSGPR在大鼠血浆中的肽酶抗性进行了研究,研究发现体外培养6 h后GPSGPR仍能保持50.01%的完整性,这不仅揭示了GPSGPR在抑制ACE活性方面的潜在应用,同时也证明了牛骨作为一种生产功能性食品成分的巨大潜力。本研究不仅可为未被充分利用肉类副产品牛骨附加值的提升提供新的思路,也可为开发新型降压药物或功能性食品提供新的原料来源和科学依据。
[1] KAURA, KEHINDE B A, SHARMA P, et al.Recently isolated food-derived antihypertensive hydrolysates and peptides:A review[J].Food Chemistry, 2021, 346:128719.
[2] TOWNSEND N, WILSON L, BHATNAGAR P, et al.Cardiovascular disease in Europe:Epidemiological update 2016[J].European Heart Journal, 2016, 37(42):3232-3245.
[3] LEVEY A S, ECKARDT K U, DORMAN N M, et al.Nomenclature for kidney function and disease:Report of a kidney disease:Improving global outcomes (KDIGO) consensus conference[J].Kidney International, 2020, 97(6):1117-1129.
[4] OKAGU I U, EZEORBA T P C, AHAM E C, et al.Recent findings on the cellular and molecular mechanisms of action of novel food-derived antihypertensive peptides[J].Food Chemistry:Molecular Sciences, 2022, 4:100078.
[5] LEUNG A A, WILLIAMS J V A, TRAN K C, et al.Epidemiology of resistant hypertension in Canada[J].Canadian Journal of Cardiology, 2022, 38(5):681-687.
[6] MAALIKI D, ITANI M M, ITANI H A.Pathophysiology and genetics of salt-sensitive hypertension[J].Frontiers in Physiology, 2022, 13:1001434.
[7] CAO S M, WANG Y, HAO Y J, et al.Antihypertensive effects in vitro and in vivo of novel angiotensin-converting enzyme inhibitory peptides from bovine bone gelatin hydrolysate[J].Journal of Agricultural and Food Chemistry, 2020, 68(3):759-768.
[8] LI C C, LIU K F, CHEN S A, et al.Gaussian accelerated molecular dynamics simulations investigation on the mechanism of angiotensin-converting enzyme (ACE) C-domain inhibition by dipeptides[J].Foods, 2022, 11(3):327.
[9] CHEN R Y, MIAO Y L, HAO X, et al.Investigation on the characteristics and mechanisms of ACE inhibitory peptides by a thorough analysis of all 8000 tripeptides via binding free energy calculation[J].Food Science &Nutrition, 2021, 9(6):2943-2953.
[10] REPOVAK, STANKO P, BAKA T, et al.Lactacystin-induced kidney fibrosis:Protection by melatonin and captopril[J].Frontiers in Pharmacology, 2022, 13:978337.
[11] BOUCHENAKI H, DANIGO A, BERNARD A, et al.Ramipril alleviates oxaliplatin-induced acute pain syndrome in mice[J].Frontiers in Pharmacology, 2021, 12:712442.
[12] O’CONNOR J, GARCIA-VAQUERO M, MEANEY S, et al.Bioactive peptides from algae:Traditional and novel generation strategies, structure-function relationships, and bioinformatics as predictive tools for bioactivity[J].Marine Drugs, 2022, 20(5):317.
[13] WANG L Y, NIU D T, WANG X Y, et al.A novel machine learning strategy for the prediction of antihypertensive peptides derived from food with high efficiency[J].Foods, 2021, 10(3):550.
[14] SONKLIN C, ALASHI M A, LAOHAKUNJIT N, et al.Identification of antihypertensive peptides from mung bean protein hydrolysate and their effects in spontaneously hypertensive rats[J].Journal of Functional Foods, 2020, 64:103635.
[15] XING L J, LIU R, CAO S M, et al.Meat protein based bioactive peptides and their potential functional activity:A review[J].International Journal of Food Science &Technology, 2019, 54(6):1956-1966.
[16] ARDIANSYAH, ARIFFA F, MARYAM ASTUTI R, et al.Non-volatile compounds and blood pressure-lowering activity of Inpari 30 and Cempo Ireng fermented and non-fermented rice bran[J].AIMS Agriculture and Food, 2021, 6(1):337-359.
[17] HERES A, MORA L, TOLDR F.Bioactive and sensory di- and tripeptides generated during dry-curing of pork meat[J].International Journal of Molecular Sciences, 2023, 24(2):1574.
F.Bioactive and sensory di- and tripeptides generated during dry-curing of pork meat[J].International Journal of Molecular Sciences, 2023, 24(2):1574.
[18] CAO S M, WANG Y, XING L J, et al.Structure and physical properties of gelatin from bovine bone collagen influenced by acid pretreatment and pepsin[J].Food and Bioproducts Processing, 2020, 121:213-223.
[19] CAO S M, WANG Z X, XING L J, et al.Bovine bone gelatin-derived peptides:Food processing characteristics and evaluation of antihypertensive and antihyperlipidemic activities[J].Journal of Agricultural and Food Chemistry, 2022, 70(32):9877-9887.
[20] ZHANG T, LI M, FU X D, et al.Purification and charicterization of angiotensin I-converting enzyme (ACE) inhibitory peptides with specific structure X-Pro[J].European Food Research and Technology, 2019, 245(8):1743-1753.
[21] XING L J, HU Y Y, HU H Y, et al.Purification and identification of antioxidative peptides from dry-cured Xuanwei ham[J].Food Chemistry, 2016, 194:951-958.
[22] XING L J, LIU R, GAO X G, et al.The proteomics homology of antioxidant peptides extracted from dry-cured Xuanwei and Jinhua ham[J].Food Chemistry, 2018, 266:420-426.
[23] 沈嘉森, 苏永昌, 陈晓婷, 等.龙须菜ACE抑制肽的体外稳定性和抗氧化活性研究[J].食品工业科技, 2022, 43(7):384-392.SHEN J S, SU Y C, CHEN X T, et al.Study on in vitro stability and antioxidant activity of ACE inhibitory peptide from Gracilaria lemaneiformis[J].Science and Technology of Food Industry, 2022, 43(7):384-392.
[24] BHASKAR B, ANANTHANARAYAN L, JAMDAR S.Purification, identification, and characterization of novel angiotensin I-converting enzyme (ACE) inhibitory peptides from alcalase digested horse gram flour[J].LWT, 2019, 103:155-161.
[25] LIN K, ZHANG L W, HAN X, et al.Novel angiotensin I-converting enzyme inhibitory peptides from protease hydrolysates of Qula casein:Quantitative structure-activity relationship modeling and molecular docking study[J].Journal of Functional Foods, 2017, 32:266-277.
[26] DING L, ZHANG Y, JIANG Y Q, et al.Transport of egg white ACE-inhibitory peptide, Gln-Ile-Gly-Leu-Phe, in human intestinal Caco-2 cell monolayers with cytoprotective effect[J].Journal of Agricultural and Food Chemistry, 2014, 62(14):3177-3182.
[27] MORIKAWA R, TOJI K, KUMAGAI Y, et al.ACE inhibitory effect of the protein hydrolysates prepared from commercially available nori product by pepsin-trypsin digestion[J].European Food Research and Technology, 2022, 248(1):243-251.
[28] WANG J, WANG G L, CHEN N, et al.Characterization of structural, functional and antioxidant properties and amino acid composition of pepsin-derived glutelin-1 hydrolysate from walnut processing by-products[J].RSC Advances, 2021, 11(31):19158-19168.
[29] TAWALBEH D, AL-U’DATT M H, WAN AHMAD W A N, et al.Recent advances in in vitro and in vivo studies of antioxidant, ACE-inhibitory and anti-inflammatory peptides from legume protein hydrolysates[J].Molecules, 2023, 28(6):2423.
[30] QUIR S A, D
S A, D VALOS A, LASUNCI
VALOS A, LASUNCI N M A, et al.Bioavailability of the antihypertensive peptide LHLPLP:Transepithelial flux of HLPLP[J].International Dairy Journal, 2008, 18(3):279-286.
N M A, et al.Bioavailability of the antihypertensive peptide LHLPLP:Transepithelial flux of HLPLP[J].International Dairy Journal, 2008, 18(3):279-286.
[31] TAGA Y, HAYASHIDA O, ASHOUR A, et al.Characterization of angiotensin-converting enzyme inhibitory activity of X-hyp-gly-type tripeptides:Importance of collagen-specific prolyl hydroxylation[J].Journal of Agricultural and Food Chemistry, 2018, 66(33):8737-8743.
[32] VAN DER PIJL P C, KIES A K, TEN HAVE G A M, et al.Pharmacokinetics of proline-rich tripeptides in the pig[J].Peptides, 2008, 29(12):2196-2202.