燕窝,作为传统的滋补珍品,在亚洲饮食文化中占据独特地位。其主要来源为雨燕科金丝燕属的多种鸟类所筑之巢,在我国古代医药典籍中早有记载,如《本草纲目拾遗》称其 “味甘淡平,大养肺阴,化痰止嗽,补而能清,为调理虚损痨瘵之圣药”,彰显其在滋养肺阴、化痰止咳及调理虚损等方面的卓越功效[1],为其药用价值奠定深厚历史根基。燕角是金丝燕最先吐出燕窝粘在木梁上的部分,结构比较坚硬厚实,往往需要更长的泡发时间[2]。在燕窝加工流程里,燕角常因形态与位置而被视作边角余料遭舍弃。然而,经现代研究剖析,燕角和燕窝在营养方面没有本质区别,均富含蛋白质、碳水化合物、矿物质及唾液酸等多种营养成分,其中蛋白质含量超 50%,唾液酸含量约占 10%[3],与燕窝主体成分高度一致,具备深度开发利用的潜力,将其转化为高附加值产品成为资源优化的关键路径。
近年,燕窝在护肤领域的研究逐渐成为热点[4],其酶解产物备受关注。早期研究聚焦于燕窝整体提取物的护肤功效,发现其对皮肤保湿、抗氧化、抗炎及美白等具有积极作用[3]。伴随技术演进,酶解技术为燕窝研究开辟新的路径,众多研究团队深入探究燕窝酶解产物的成分与功效,发现酶解可提升燕窝中活性成分的释放与生物利用度,其富含小分子肽和游离唾液酸展现出独特护肤优势[5-6]。从保湿功效看,特定酶解产物可上调丝聚蛋白及其相关基因表达[7],强化皮肤屏障的保湿能力。在抗氧化功效上,能有效清除自由基、增强抗氧化酶活性、抑制氧化应激相关信号通路[8]。在美白方面,可抑制酪氨酸酶活性、下调黑色素生成相关基因表达及信号通路传导,减少黑色素合成[8]。同时与传统水解方法相比,酶解工艺条件温和,有利于保护燕窝中营养成分的结构和活性。而且酶作为生物催化剂,通常是无毒、无害的,用于酶解燕窝不会产生有害副产物。然而,目前对燕角有效成分提取工艺及应用价值的研究尚显缺乏,且现有研究在酶解工艺优化、活性成分精准筛选、作用机制深度阐释及功效稳定性验证等方面仍有可拓展的空间,部分研究仍停留在单一功效层面,缺乏多维度、系统性评估。
本研究以燕角为原料,采用酶解技术制备活性提取物,优化工艺参数,促进燕角的加工利用。运用多元方法,从抗氧化、抗炎、保湿和美白等多个维度综合考察燕角酶解产物的功效,进而评估燕角酶解产物对皮肤保护方面的潜在价值。研究结果有望为燕窝的资源开发利用以及护肤产品原料创新提供技术指导与科学依据。
1 材料与方法
1.1 材料与试剂
燕角,小仙炖生物科技有限公司;风味蛋白酶(20 U/mg)、中性蛋白酶(100 U/mg)、碱性蛋白酶(200 U/mg)、木瓜蛋白酶(800 U/mg)、胃蛋白酶(30 U/mg)、胰蛋白酶(250 U/mg)、L-酪氨酸、酪氨酸酶、透明质酸酶、透明质酸钠、弹性蛋白酶,上海源叶生物科技有限公司;DPPH自由基清除能力试剂盒、ABTS阳离子自由基清除能力试剂盒、NO测定试剂盒,南京建成生物工程研究所;弹性蛋白,上海麦克林生化科技股份有限公司;NaHSO4、CaCl2、NaOH、邻苯二胺盐酸盐、对二甲氨基苯甲醛、无水乙醇、硼酸、醋酸等为分析纯,甲醇、乙腈为色谱纯,国药集团化学有限公司;PBS,美国Gibco公司;二甲基亚砜(dimethyl sulfoxide,DMSO,细胞培养级),索莱宝有限公司;TNF-α、IL-1β、IL-6 ELISA试剂盒,厦门慧嘉生物科技有限公司;噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)、H2O2、LPS、人真皮成纤维细胞(human dermal fibroblasts,HDF),Sigma-Aldrich有限公司。
1.2 仪器与设备
HH-3A数显恒温水浴锅,常州国华电器有限公司;ST3100型pH计,美国OHAUS公司;TXA-120恒温振荡培养箱,太仓市强乐实验设备有限公司;5804R台式高速冷冻离心机,德国Eppendorf公司;EPOCH1 96 孔板酶标仪,美国Bio Tek仪器公司;NIKON ECLIPSE CI-S倒置荧光显微镜,日本尼康公司;CJ-1F超净台,上海沪净医疗器械有限公司;LC-20AT液相色谱仪,日本SHIMADZU公司。
1.3 实验方法
1.3.1 燕角酶解产物制备
称取1.0 g燕角,以1∶30(g∶mL)料液比加入纯净水充分泡发后剪碎,沸水浴炖煮25 min后,利用均质机均质,分别调节料液pH值至各蛋白酶最适pH值,加入各蛋白酶,设置恒温振荡器温度至各蛋白酶最适温度进行酶解,酶解结束后沸水浴灭酶15 min,冷却至室温后5 000 r/min离心15 min,取上清液,于-20 ℃保存备用。
1.3.2 燕角酶解的单因素实验
按1.3.1节的方法制备燕角酶解液。在酶底比5 000 U/g、料液比1∶30(g∶mL)、酶解时间4 h条件下,分别添加风味蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、胃蛋白酶、胰蛋白酶在各酶最适pH值下进行酶解。取酶解液测定DPPH自由基清除能力、ABTS阳离子自由基清除能力和蘑菇酪氨酸酶活性抑制率指标,考察不同蛋白酶对酶解液指标的影响,确定燕角酶解最优蛋白酶。
同时,固定其他酶解参数条件,分别以酶底比(5 000、6 000、7 000 U/g),料液比(1∶20、1∶30、1∶40,g∶mL),酶解时间(8、12、16 h)为单因素变量,考察酶底比、料液比和酶解时间对酶解效果的影响。
1.3.3 燕角酶解的正交试验
在单因素试验基础上进行3因素3水平的正交试验,为考虑各因素之间交互作用,建立各因素与抗氧化活性和美白活性的相互联系,选择酶底比(A)、料液比(B)、酶解时间(C)为因素变量,ABTS阳离子自由基清除能力(X1)和蘑菇酪氨酸酶抑制率(X2)为响应变量(Y=0.5X1+0.5X2),以确定燕角酶解的最适参数条件。
表1 正交水平表
Table 1 Orthogonal horizontal table

水平A酶底比/(U/g)B料液比/(g∶mL)C酶解时间/h15 0001∶20826 0001∶301237 0001∶4016
1.3.4 DPPH自由基清除能力测定
采用DPPH自由基清除能力试剂盒,使用无水甲醇将Trolox标准液梯度稀释,绘制标准曲线。测定管中加入400 μL的样品溶液和600 μL的工作液,混匀,室温 25 ℃避光静置 30 min,4 000 r/min离心 5 min, 波长 517 nm测定吸光度。计算燕角酶解液DPPH自由基清除率,代入到标准曲线中得到酶解液DPPH自由基清除能力。空白组以等体积80%(体积分数)甲醇代替样本,对照组以等体积80%甲醇代替工作液。DPPH自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A0,空白组的吸光度;Ai,测定组的吸光度;Aj,对照组的吸光度。
1.3.4 ABTS阳离子自由基清除能力测定
采用ABTS阳离子清除能力试剂盒,使用去离子水将Trolox标准液梯度稀释,绘制标准曲线。使用96孔酶标板,在测定孔中加入10 μL待测样本、20 μL应用液和170 μL ABTS工作液,混匀,室温静置6 min,波长405 nm测定吸光度,代入到标准曲线中得到酶解液ABTS阳离子自由基清除能力。空白组以等体积蒸馏水代替待测样本。
1.3.5 蘑菇酪氨酸酶抑制率测定
样品组加入100 μL PBS、40 μL样品和20 μL L-酪氨酸混匀,室温放置10 min,再加入酪氨酸酶溶液,室温反应3 h后测定475 nm处的吸光度。对照组以等体积PBS代替样品,空白组以等体积PBS代替L-酪氨酸。酶解液蘑菇酪氨酸酶抑制率计算如公式(2)所示:
蘑菇酪氨酸酶活性抑制率![]()
(2)
式中:A0,对照组空白OD 值;A1,对照组OD 值;B0,样品组空白OD 值;B1,样品组OD 值。
1.3.6 唾液酸含量测定
用邻苯二胺衍生法[9],称取酶解产物粉末0.5 g,加入5 mL NaHSO4溶液,置于80 ℃水浴中加热后取出并冷却至室温,再次称重并用超纯水补足消耗的质量。加入5 mL邻苯二胺盐酸盐溶液,再次将锥形瓶置于80 ℃水浴中加热40 min后取出,避光冷却至室温。将冷却后的溶液用0.22 μm滤膜过滤。取1 mL定容后的试剂于棕色液相小瓶中,进行HPLC分析。
1.3.7 体外保湿率测定
准确称取酶解产物粉末0.5 g于称量瓶中,加入1.5 g的去离子水,记录此时的总质量为m0,转动称量瓶至样品完全吸收水分。将称量瓶放入装有干微粉硅胶的低湿度干燥器中,于室温下静置,每隔一段时间t后取出称重并记录总质量为mt。体外保湿率的计算如公式(3)所示:
(3)
式中:A,体外保湿率,%;m0,初始时刻酶解产物和去离子水的总质量,g;mt,t时刻酶解产物和剩余水分的总质量,g。
1.3.8 透明质酸酶抑制率测定
采用张培凤等[10]的方法,并作适当改进。在离心管中依次加入0.5 mL酶解产物溶液、透明质酸酶溶液,振荡混合均匀,置于水浴锅中,恒温20 min。依次在各离心管中加入0.5 L CaCl2溶液,振荡混合均匀,置于水浴锅中。恒温20 min后,依次在各管加入0.25 mL透明质酸钠溶液,振荡混合均匀,置于水浴锅中。恒温40 min后,加入0.5 mL NaOH溶液、0.1 mL 硼酸钠溶液,振荡混合均匀,置于沸水浴3 min。取出后冷却至室温,加入1.5 mL对二甲氨基苯甲醛、HCl、醋酸的混合溶液,置于水浴锅中。恒温20 min后取出,吸取各离心管中溶液200 μL置于酶标板里,扫描波长,测试样品吸光度值。透明质酸抑制率计算如公式(4)所示:
透明质酸抑制率![]()
(4)
式中:T0,样品溶剂在酶和底物反应中的吸光度;T,样品在酶和底物反应中的吸光度。
1.3.9 弹性蛋白酶抑制率测定
取2 mL用37 ℃预热的硼酸盐溶液配制的2 mg/mL的弹性蛋白酶溶液,加入2 mL不同浓度的风味蛋白酶酶解产物溶液,充分涡旋混匀,在37 ℃、400 r/min摇床振荡20 min。随后立即加入5 mL、0.5 mol/L的PBS(pH 6.0),涡旋混匀后在5 000 r/min下离心15 min,吸取上清液并测定其在495 nm处的吸光值。对照组以等体积蒸馏水代替酶解液,空白组不加入弹性蛋白酶溶液。弹性蛋白酶抑制率计算如公式(5)所示:
弹性蛋白酶抑制率![]()
(5)
式中:As0,样品空白组吸光度;Ac0,对照空白组吸光度;As,样品组吸光度;Ac,对照组吸光度。
1.3.10 细胞实验
培养细胞:取对数生长期的HDF接种于96孔酶标板上,将细胞配制为2×104 个/mL的单细胞悬浮液,每孔接种100 μL,置于37 ℃、5% CO2的培养箱培养24 h,使细胞完全贴壁后,按如下步骤完成细胞实验。
1.3.10.1 细胞毒性试验
利用MTT法测定不同浓度的酶解产物对HDF的细胞毒性,得到细胞实验的安全浓度范围。取完成培养后的细胞,用PBS清洗,加入不同浓度的样品溶液,置于培养箱中孵育24 h。移去培养基,加入MTT溶液孵育2 h。移去培养基,加入150 μL的DMSO溶剂,使紫色结晶完全溶解。在570 nm 波长处检测细胞的OD值。HDF细胞存活率计算如公式(6)所示:
细胞存活率![]()
(6)
1.3.10.2 氧化损伤实验
参照ZHANG等[11]的方法并做适当修改, 利用H2O2溶液孵育细胞,构建细胞氧化损伤模型。取上述培养细胞,移去培养基用PBS清洗2次,加入由培养基稀释的不同浓度的酶解产物溶液,于培养箱中孵育4 h。移去培养基,加入300 μmol/L H2O2,置于培养箱中孵育2 h。采用MTT法测定细胞的存活率。
1.3.10.3 炎症损伤实验
利用脂多糖(lipopolysaccharide, LPS)孵育细胞,构建细胞炎症损伤模型。取上述培养细胞,移去培养基,用PBS清洗2次,向96孔板中加入不同浓度的培养基稀释的LPS溶液(0、0.5、1.0、2.0、5.0 μg/mL),置于培养箱中孵育24 h后用试剂盒测定NO释放量,并确定LPS的最佳诱导浓度,用于后续实验。
将完全贴壁的细胞分为干预组和预防组,其中干预组细胞首先用2 μg/mL的LPS,置于培养箱中孵育24 h后移去培养基,加入不同浓度的酶解产物溶液,于培养箱中孵育24 h,用试剂盒测定NO释放量,同时利用ELISA试剂盒测定TNF-α、IL-1和IL-6含量。预防组细胞首先加入不同浓度的酶解产物溶液,置于培养箱中孵育24 h后移去培养基,加入最佳诱导浓度的LPS,于培养基中孵育24 h,用试剂盒测定其NO释放量以及TNF-α、IL-6和IL-1β含量。
1.3.10.4 中波紫外线(ultraviolet B-rays,UVB)照射损伤实验
利用紫外灯照射细胞,构建细胞UVB照射损伤模型。取上述培养细胞,将细胞分为干预组和预防组,其中干预组细胞首先移去培养基,用PBS清洗2次后,向96孔板各孔中加入150 μL PBS,置于紫外灯下照射3 min,移去PBS,加入不同浓度的酶解产物溶液,置于培养箱中孵育24 h,采用MTT法测定细胞存活率。预防组细胞首先移去培养液,用PBS清洗2次后,加入不同浓度的酶解产物溶液,置于培养箱中孵育24 h,移去培养液并用PBS清洗2次,向96孔板各孔中加入150 μL PBS,置于紫外灯下照射3 min,采用MTT法测定细胞存活率。
1.4 数据处理与分析
所有实验均设置3组以上平行实验,实验所得结果用“平均值±标准差”表示,数据通过GraphPad Prism 8.0软件进行分析和绘图,同时使用SPSS 23.0软件对实验数据进行单因素方差分析(one-way ANOVA),采用Duncan检验进行显著性分析,显著性水平为P<0.05。
2 结果与分析
2.1 不同蛋白酶对燕角的酶解效果
以对DPPH自由基、ABTS阳离子自由基清除能力和蘑菇酪氨酸酶活性抑制率为指标,分别评价风味蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、胃蛋白酶、胰蛋白酶的酶活力。如表2所示,经过6种酶的水解所获得的酶解产物对蘑菇酪氨酸酶的抑制率分别为37.931%、4.310%、18.319%、1.724%、23.707%、34.052%,其中经过风味蛋白酶的水解后的产物对蘑菇酪氨酸酶活性抑制率最高。与王鑫[12]实验结果一致,燕碎风味蛋白酶解产物的抗氧化性和美白活性显著增强。同时,利用风味蛋白酶酶解产物DPPH自由基清除能力达到24.591 μg Trolox/mL,ABTS阳离子自由基清除能力可达0.956 mmol/L Trolox,皆高于其余5种蛋白酶。实验测得风味蛋白酶为最适工具酶,有利于提高酶解产物的美白活性。
表2 不同酶对燕角的酶解效果
Table 2 Enzymatic hydrolysis effect of different enzymes on swallow horn
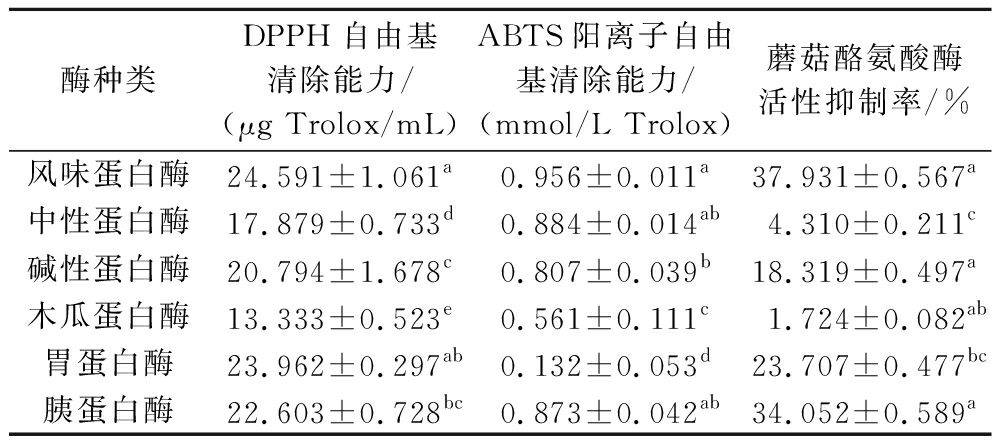
酶种类DPPH自由基清除能力/(μg Trolox/mL)ABTS阳离子自由基清除能力/(mmol/L Trolox)蘑菇酪氨酸酶活性抑制率/%风味蛋白酶24.591±1.061a0.956±0.011a37.931±0.567a中性蛋白酶17.879±0.733d0.884±0.014ab4.310±0.211c碱性蛋白酶20.794±1.678c0.807±0.039b18.319±0.497a木瓜蛋白酶13.333±0.523e0.561±0.111c1.724±0.082ab胃蛋白酶23.962±0.297ab0.132±0.053d23.707±0.477bc胰蛋白酶22.603±0.728bc0.873±0.042ab34.052±0.589a
注:同列不同字母表示样本之间具有显著性差异,P<0.05。
2.2 风味蛋白酶水解燕角的单因素实验
如图1-a所示,在酶底比4 000~6 000 U/g范围内,随着酶底比增加,所得产物抗氧化活性及美白活性显著增加,当酶底比为6 000 U/g时达到最大,而继续增大酶底比可能会导致酶相互附着,降低酶与底物的传质效率,反而会降低反应效率。因此,结合酶解产物ABTS阳离子自由基清除能力和蘑菇酪氨酸酶活性抑制率综合考虑,6 000 U/g酶底比较为合适,此条件下,ABTS阳离子自由基清除能力为0.584 mmol/L Trolox、蘑菇酪氨酸酶活性抑制率为34.645%。如图1-b所示,在料液比1∶20~1∶50(g∶mL)范围内随着料液比的降低,酶解产物抗氧化活性及美白活性均显著降低,可能是由于随着底物浓度降低,使得蛋白酶与底物之间的碰撞机率降低,抑制酶解。因此,1∶20(g∶mL)料液比较为合适,此条件下,ABTS阳离子自由基清除能力为1.318 mmol/L Trolox、蘑菇酪氨酸酶活性抑制率为39.626%。如图1-c所示,在酶解时间4~12 h范围内随着酶解时间的增长,产物抗氧化活性及美白活性增加,当酶解时间为12 h达到最大,但当酶解时间延长至16 h后,产物抗氧化活性及美白活性反而降低,可能是由于随着时间的增长产物中部分抗氧化活性成分出现分解,且酶的催化活性会降低。因此,12 h酶解时间较为合适,此条件下,ABTS阳离子自由基清除能力为0.916 mmol/L Trolox、蘑菇酪氨酸酶活性抑制率为47.247%。
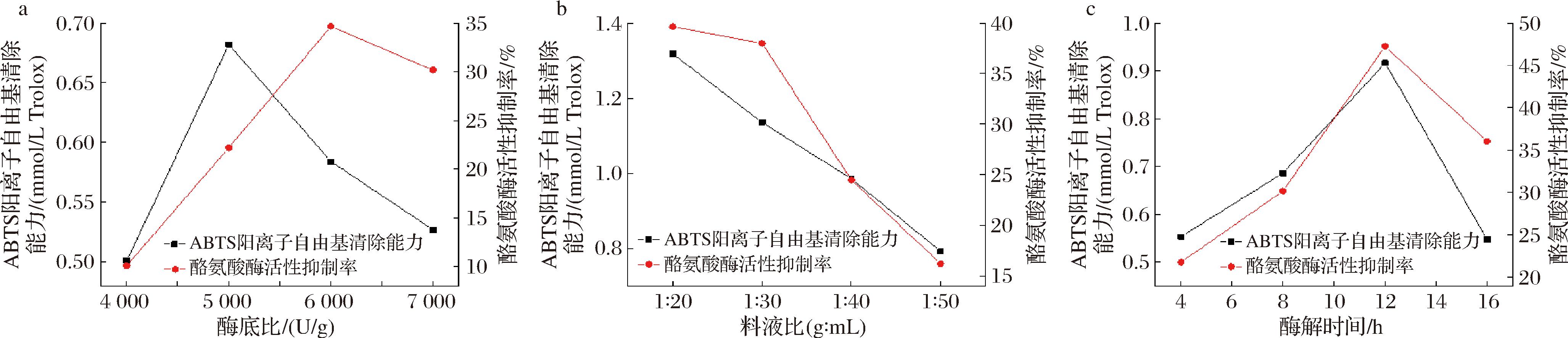
a-酶底比;b-料液比;c-酶解时间
图1 酶底比、料液比、酶解时间对风味蛋白酶解燕角的影响
Fig.1 Effects of enzyme-to-substrate ratio, solid-liquid ratio, and enzymatic hydrolysis time on flavor proteolysis of swallow horn
2.3 酶解燕角的正交试验
燕角酶解工艺正交试验结果与极差分析如表3所示,方差分析如表4所示,3个自变量中,Rj值越大,则代表该因素的影响越大,可知3种因素对风味酶解燕角的作用程度为酶解时间>料液比>酶底比,表明酶解时间对风味酶酶解效果影响显著大于其余2个因素(P<0.05)。K值越大,对应水平越优,可知优水平为A3、B1、C2。综合考虑,当酶底比、料液比和酶解时间分别为7 000 U/g、1∶20(g∶mL)和12 h为最佳酶解条件。
表3 正交试验结果极差分析表
Table 3 Range analysis of orthogonal experimental results
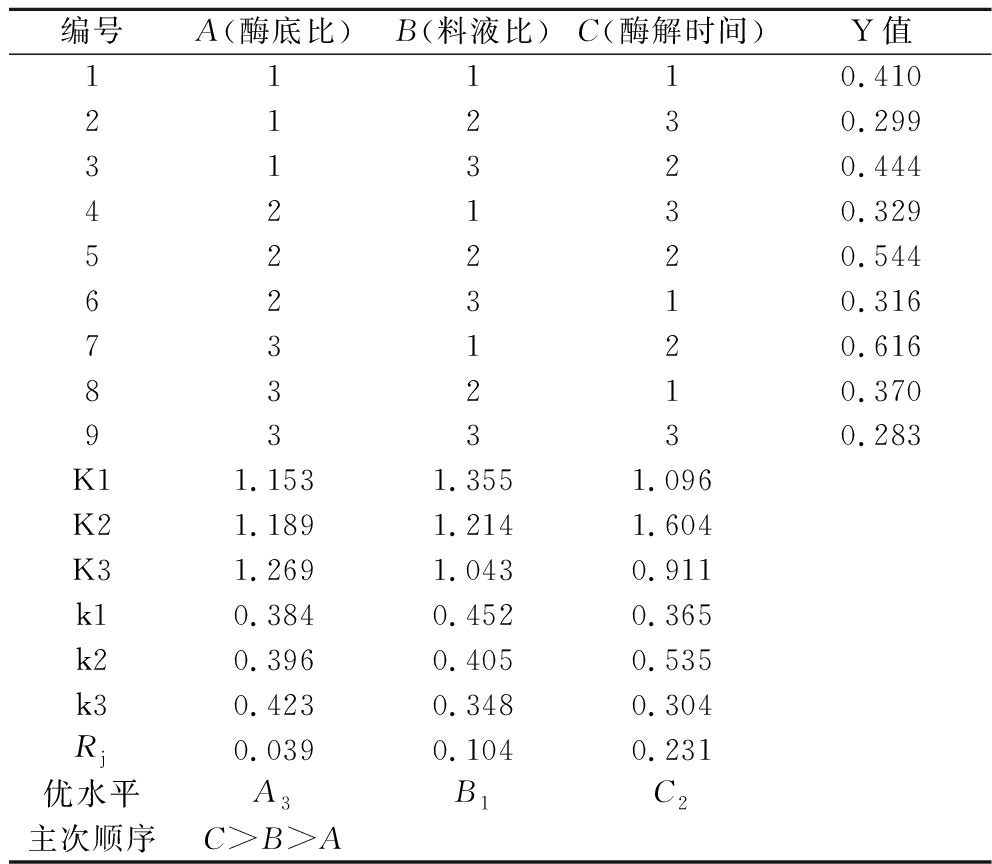
编号A(酶底比)B(料液比)C(酶解时间)Y值11110.41021230.29931320.44442130.32952220.54462310.31673120.61683210.37093330.283K11.153 1.355 1.096 K21.189 1.214 1.604 K31.269 1.043 0.911 k10.3840.4520.365k20.3960.4050.535k30.4230.3480.304Rj0.0390.1040.231优水平A3B1C2主次顺序C>B>A
表4 正交试验结果方差分析表
Table 4 Analysis of variance of orthogonal experimental results
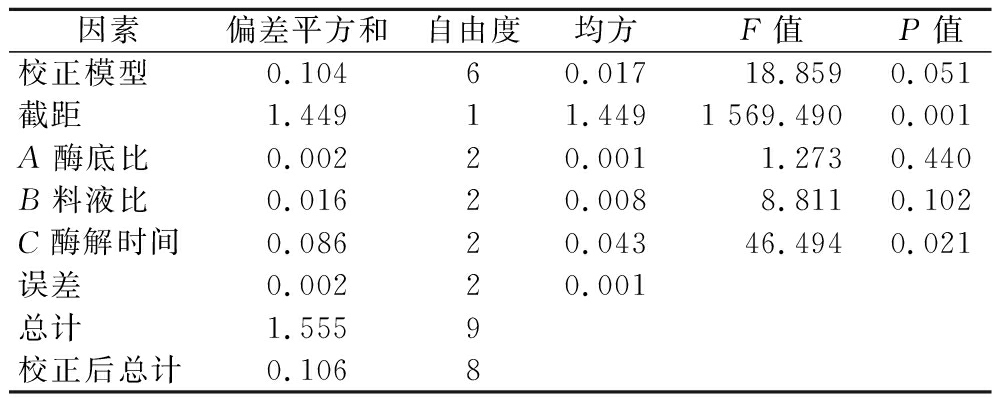
因素偏差平方和自由度均方F值P值校正模型0.10460.017 18.8590.051截距1.44911.4491 569.4900.001A酶底比0.00220.0011.2730.440B料液比0.01620.0088.8110.102C酶解时间0.08620.04346.4940.021误差0.00220.001总计1.5559校正后总计0.1068
2.4 唾液酸含量测定
唾液酸在保湿、抗皱、抗氧化等方面具有重要作用,其存在进一步增强了酶解产物对皮肤的有益功效。实验测得风味蛋白酶酶解燕角产物中的唾液酸含量约为(7.04±0.13)%,与ZHANG等[13]研究结果一致。燕角虽然是燕窝废弃料,但是有相当含量的唾液酸。并且酶解实验所筛选的酶解条件能够较好地保留燕角中的唾液酸。这不仅证实了酶解产物的功能性,也验证了所选酶解条件的可靠性。
2.5 体外保湿率测定
保湿是皮肤护理的重要方面,良好的保湿性能有助于维持皮肤水分平衡,减少皮肤干燥和皱纹的产生。如图2所示,在干燥硅胶环境中,风味蛋白酶酶解产物的保湿率随着实验的进行而持续下降,在实验开始的8 h以内,保湿率始终保持在60%以上,表明在8 h以内酶解产物具有良好的保湿作用,而12 h时,保湿率降至(48.80±2.57)%,保湿能力下降。该结果与蔡延渠等[14]实验结果一致,干燥硅胶环境下的丙三醇和海藻酸钠的保湿率在6 h后出现快速下降。原因可能是在放置8 h后, 作为保湿剂的酶解产物保持水分能力与环境相对湿度达到动态平衡, 散失到环境中的水分子与保湿剂吸附空气中的水分子数几乎相当。本研究中酶解产物的保湿能力为其在护肤品中的应用提供了基础。
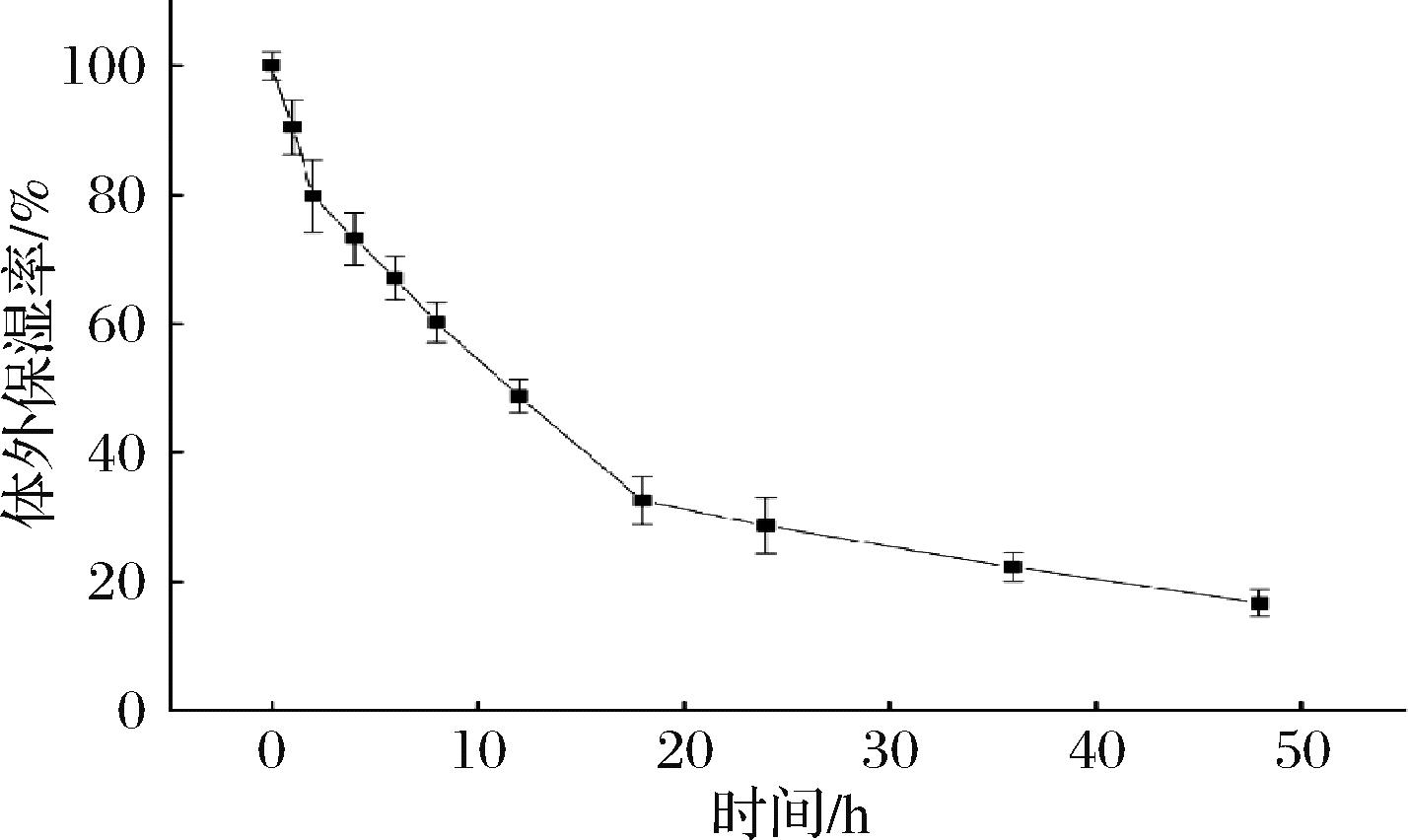
图2 风味蛋白酶酶解产物体外保湿率随时间的变化
Fig.2 Changes of moisture retention rate of flavor protease hydrolysates in vitro with time
2.6 透明质酸酶抑制率测定
透明质酸是一种酸性黏多糖,可以保持皮肤湿润、抗皱并具有抗敏作用,抑制透明质酸酶可维持其功能[15]。透明质酸酶抑制率是评价物质的抗过敏活性的重要指标。如图3所示,风味蛋白酶酶解产物对透明质酸酶有较好的抑制效果,2 mg/mL酶解产物的透明质酸酶抑制率为(64.0±0.5)%,高于60%,抑制效果较好。随着酶解产物浓度的升高,其透明质酸酶抑制率也不断上升,因此适宜浓度的酶解产物在应用于护肤品抗敏成分方面有良好的应用潜力。
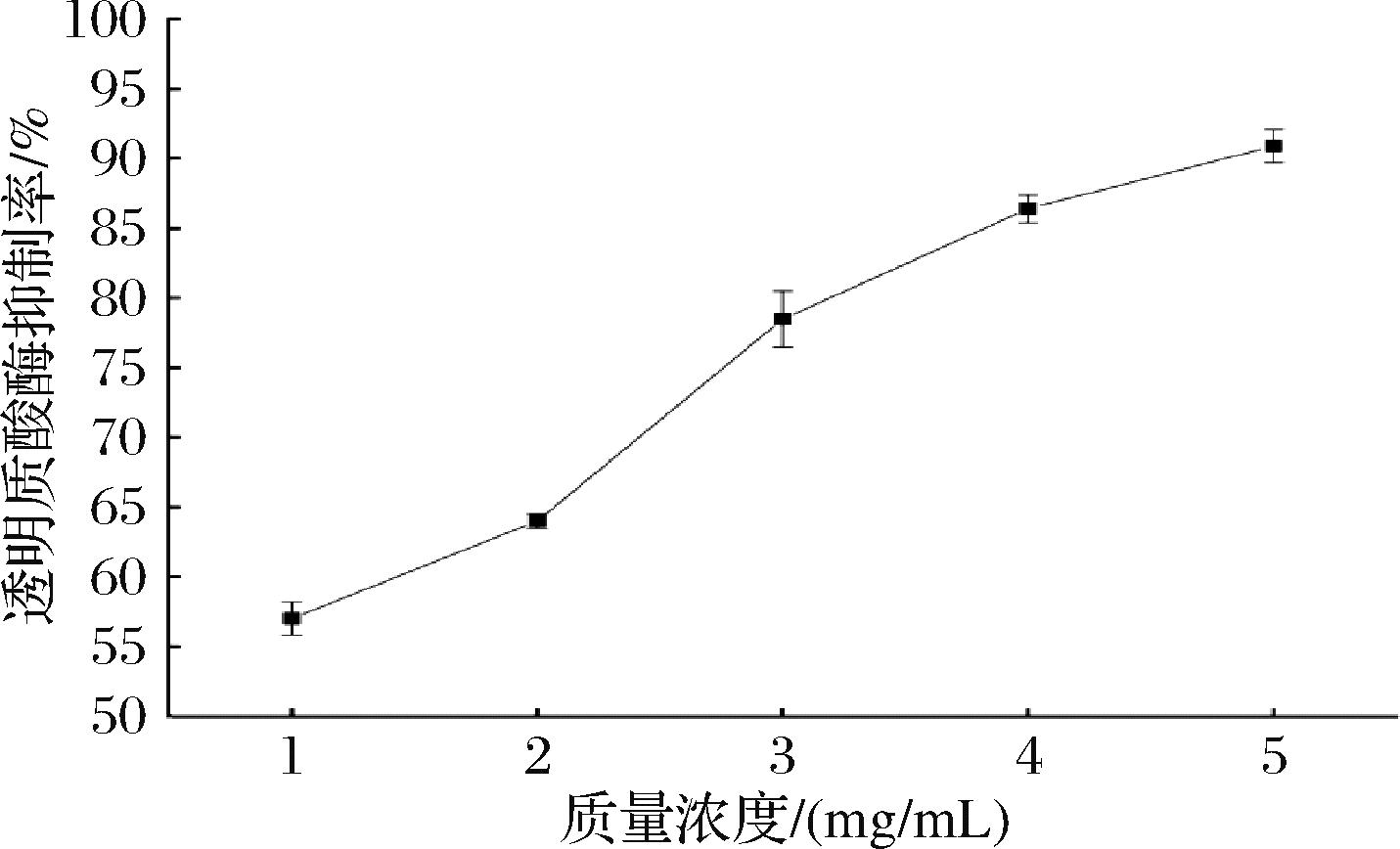
图3 不同质量浓度风味蛋白酶酶解产物的透明质酸酶抑制率
Fig.3 Hyaluronidase inhibition rate of flavor protease hydrolysates at different concentrations
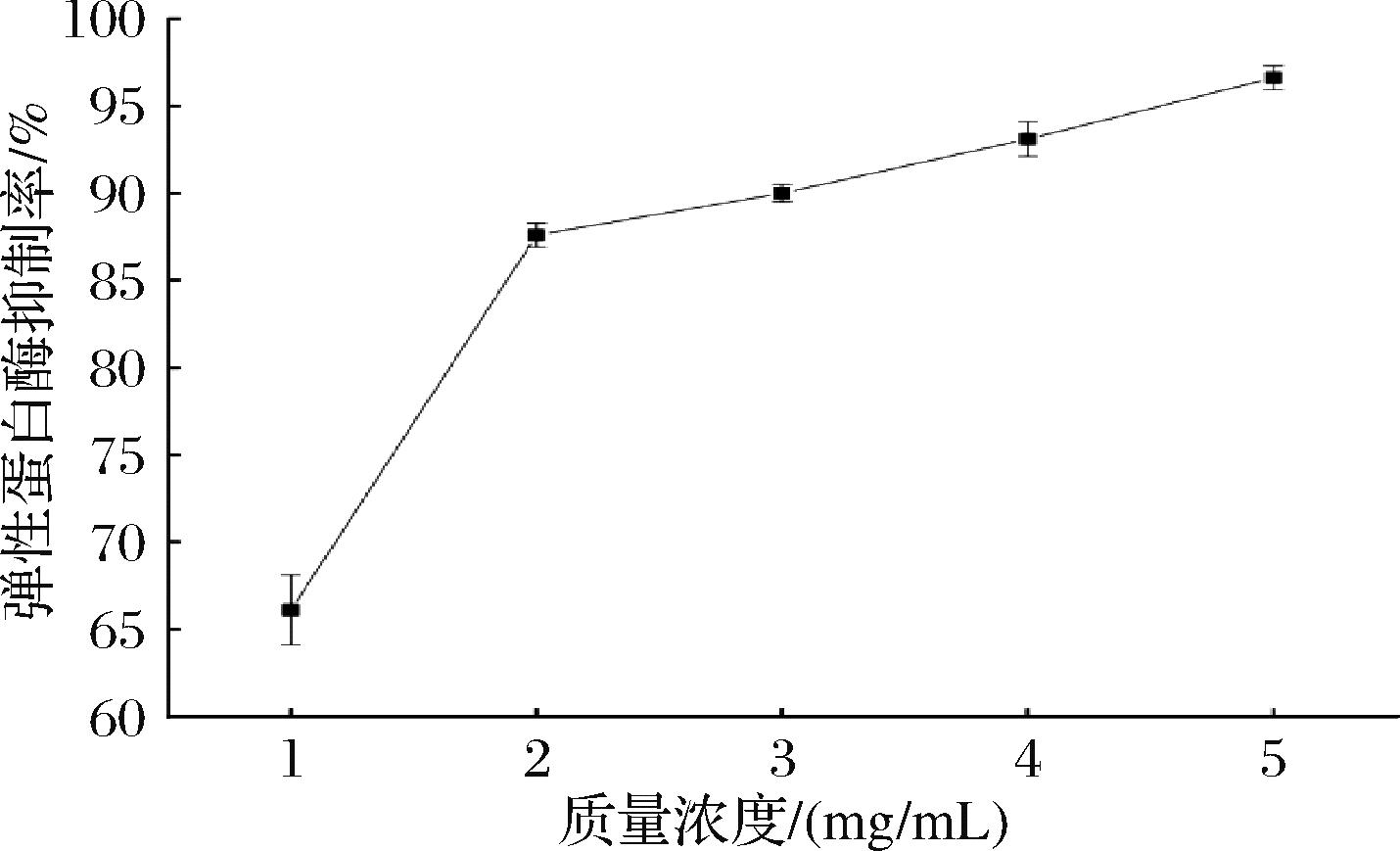
图4 不同质量浓度风味蛋白酶酶解产物的弹性蛋白酶抑制率
Fig.4 Elastase inhibition rate of flavor protease hydrolysates at different concentrations
2.7 弹性蛋白酶抑制率测定
弹性蛋白酶不仅能够降解包括弹性蛋白在内的大部分胞外基质蛋白,还能激活其他基质金属蛋白酶活性,加速真皮层细胞外基质的降解,从而导致人类皮肤真皮层正常的结构和功能被严重损害,使皮肤产生明显的皱纹,失去弹性[16-17]。因此,抑制弹性蛋白酶活性在一定程度上能起到减缓皮肤老化的作用。如图5所示,在酶解产物质量浓度为2 mg/mL时,弹性蛋白酶抑制率为(87.6±0.7)%,高于80%,且随着酶解产物浓度的升高,其弹性蛋白酶抑制率也不断上升,其稳定性较好。可能由于燕角中存在的一些特殊氨基酸(如Gly和Leu)可与弹性蛋白酶结合抑制其活性[14],因此适宜浓度的酶解产物有潜力用于护肤品中作为弹性蛋白酶的天然抑制剂,起到减缓皮肤老化的效果。同时,有研究者在对40~60岁女性进行为期12周的试验中,发现燕窝提取物组皮肤皱纹值显著降低,表明燕窝提取物在改善皮肤皱纹和老化方面有效[18]。
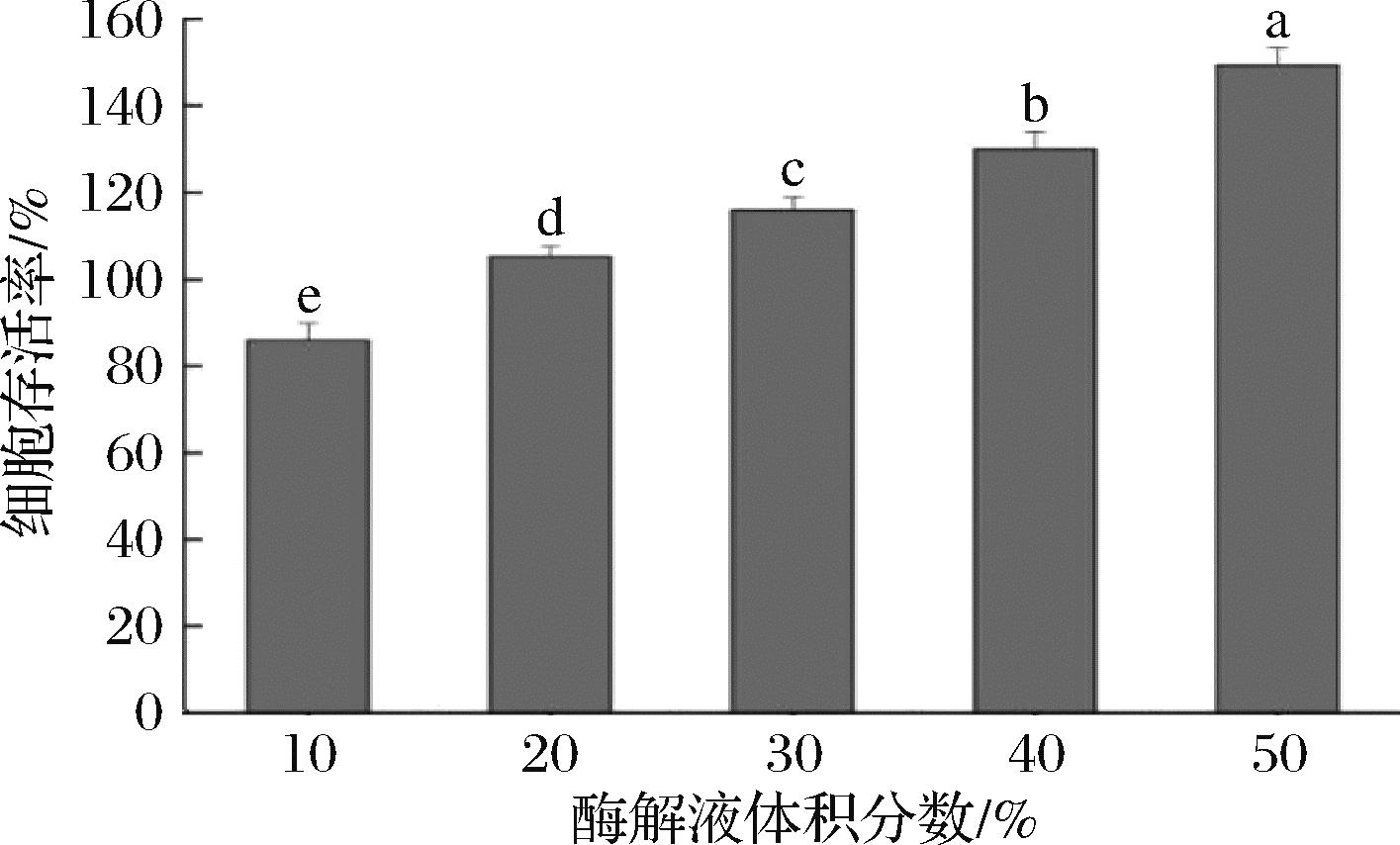
图5 风味蛋白酶酶解产物的细胞增殖抑制作用
Fig.5 Inhibitory effect of flavor protease hydrolysates on cell proliferation
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.8 细胞实验
2.8.1 细胞毒性实验
利用MTT法测定在不同浓度风味蛋白酶酶解产物作用下HDF的存活率,评价不同浓度酶解产物的细胞增殖抑制作用,并选择合适的酶解产物浓度用于后续的细胞实验。HDF主要存在于真皮层,其增殖和迁移能刺激新的细胞外基质生成并促进伤口的愈合,在皮肤创面愈合中起到重要的修复作用[19-20]。如图5所示,经体积分数10%的酶解液培养的HDF存活率为85.96%,而其余4组不同浓度酶解产物培养的HDF存活率均大于100%,考虑到实验中可能存在的误差,细胞存活率>80%即可视作无细胞毒性,因此可认为该酶解产物对HDF无毒。随着酶解浓度加大,细胞存活率上升。可能是较高浓度酶解产物含有更多营养成分,如活性肽、唾液酸等,能为HDF生长提供充足物质,促进细胞代谢和增殖,提升存活率。出于实验严谨性的考虑,在细胞存活率>100%的组别中分别选择2组(酶解液体积分数分别为20%和50%),用于后续的实验研究。
2.8.2 氧化损伤实验
如图6所示,与未经处理过的空白组相比,H2O2处理过的模型组细胞存活率显著降低至16.31%(P<0.05)。与不添加风味蛋白酶酶解产物的模型组相比,添加浓度为20%和50%的酶解液细胞存活率显著上升至96.64%和122.45%(P<0.05)。董建辉等[21]采用H2O2诱导人胚肺成纤维细胞(MRC-5)构建氧化应激损伤模型评价燕窝肽的抗氧化活性,发现燕窝水提物和燕窝肽在200~400 μg/mL时能显著增加超氧化物歧化酶活力和降低细胞内活性氧自由基含量,刺激细胞增殖。结果表明,风味蛋白酶酶解产物具有良好的抗氧化损伤能力,并且高浓度酶解产物的抗氧化损伤的效果更好。
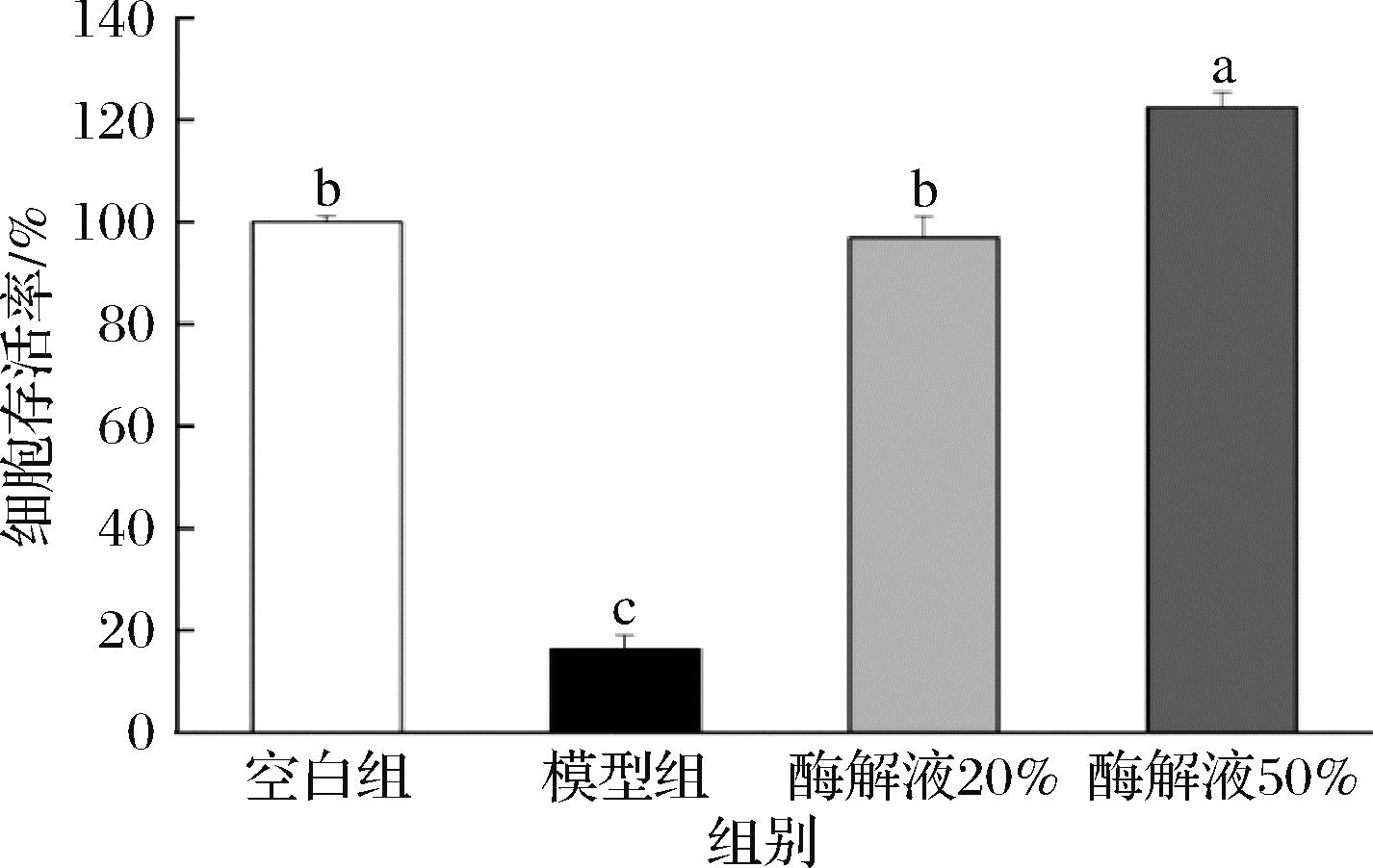
图6 风味蛋白酶酶解产物对H2O2诱导的HDF细胞存活率的影响
Fig.6 Effect of flavor protease hydrolysates on H2O2-induced HDF cell viability
2.8.3 炎症损伤实验
如图7所示。当LPS质量浓度为2 μg/mL时,细胞NO释放量为47.63 μmol/L,处于中等水平,细胞炎症损伤水平不至于过高致使实验结果无区分度或过低致使效果不显著,适用于后续炎症损伤实验。
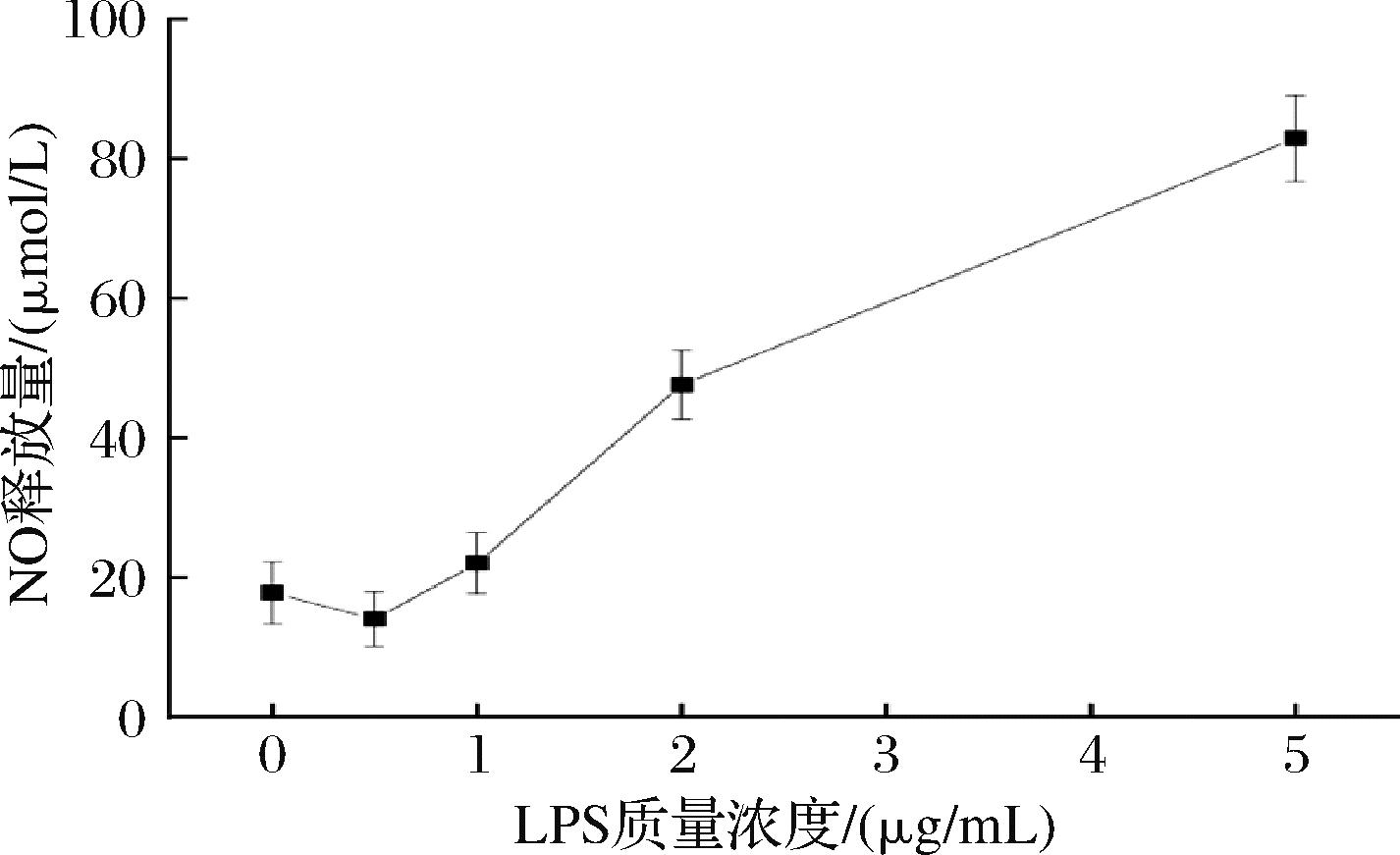
图7 不同质量浓度LPS诱导的HDF细胞NO释放量
Fig.7 NO contents induced by different concentrations of LPS in HDF cells
将实验细胞分为预防组和干预组,分别进行不同处理后测定HDF细胞的NO释放量以及TNF-α、IL-1、IL-6含量,评估酶解产物对于细胞炎症损伤的抵抗及修复能力。由图8可知,与对照组相比,预防组和干预组的细胞NO释放量皆显著降低,且高浓度组细胞的NO释放量低于低浓度组,预防组细胞的NO释放量低于干预组。在LPS诱导下,细胞内NO作为炎症介质过量产生,会加重细胞氧化应激损伤以及组织损伤。何转霞等[22]利用香烟烟雾联合LPS诱导细胞炎症模型,发现模型组产生NO释放量明显较空白组多。实验表明,风味蛋白酶解产物可以降低LPS诱导细胞内NO释放量,具有一定的抗氧化活性。
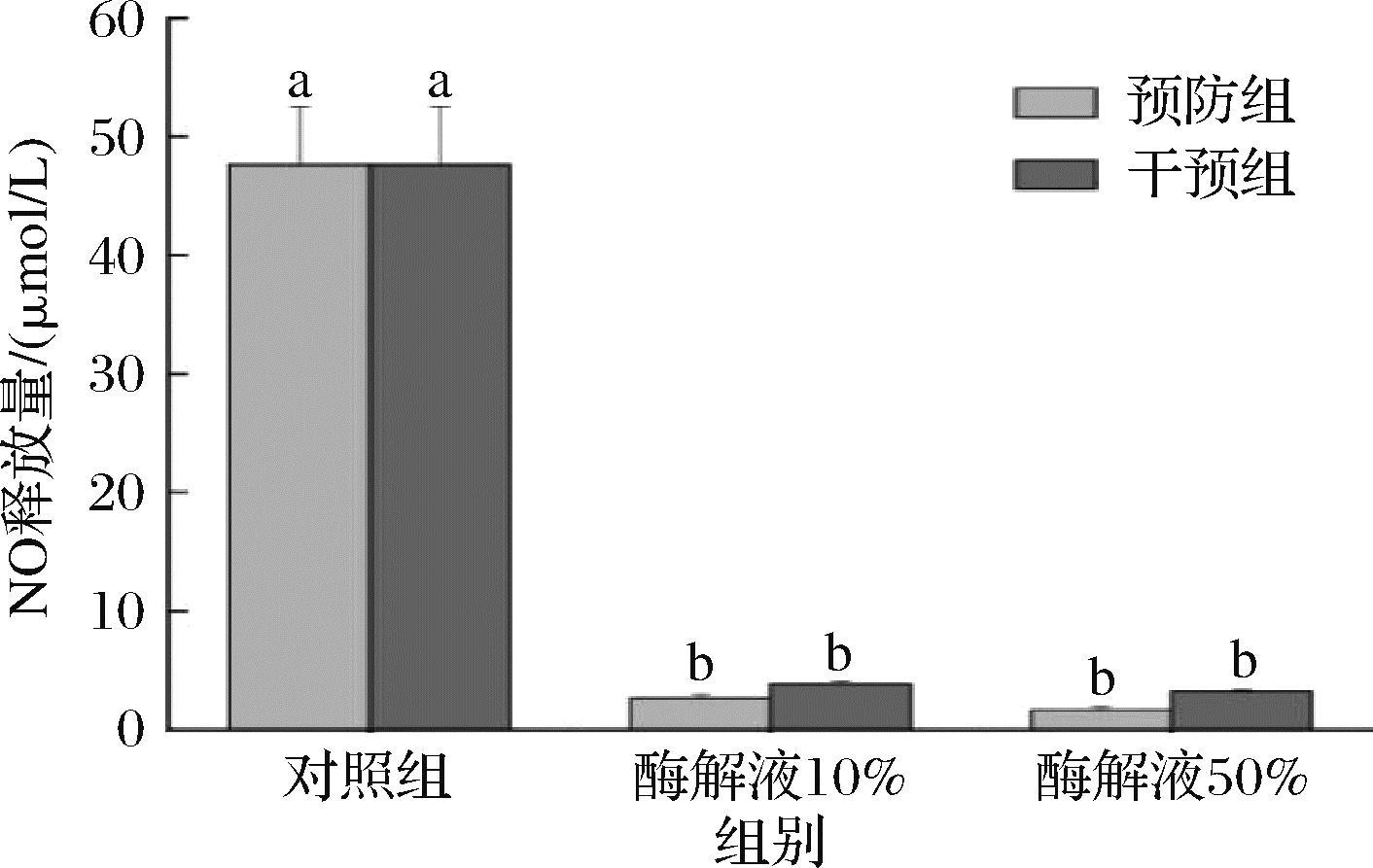
图8 风味蛋白酶酶解产物对LPS诱导的细胞NO释放量的影响
Fig.8 Effect of flavor protease hydrolysates on LPS-induced cellular NO release
实验测得的TNF-α、IL-1和IL-6这3项指标的结果相类似,由图9可知。与空白组相比,模型组细胞中TNF-α、IL-1和IL-6含量皆显著增加(P<0.05)。与模型组相比,预防组和干预组细胞中TNF-α、IL-1和IL-6含量皆显著降低(P<0.05)。LAI等[7]发现用二硝基苯甲酸诱导的小鼠皮肤中TNF-α、IL-1和IL-6等炎症因子表达增加,经燕窝酶解产物处理后,这些炎症因子的表达受到抑制与本研究结果一致。如图9-c和图9-d所示,其中预防组细胞中IL-6含量和干预组细胞中TNF-α含量出现高浓度组炎性因子含量低于低浓度组(P<0.05)的情况。同时,预防组与干预组细胞中炎症因子水平无明显差异。实验结果表明,风味蛋白酶酶解产物具有良好的抗炎及炎症损伤修复能力,且酶解产物浓度越高,其抗炎效果越好。

a-预防组TNF-α;b-预防组IL-1;c-预防组IL-6;d-干预组TNF-α;e-干预组IL-1;f-干预组IL-6
图9 风味蛋白酶酶解产物对LPS诱导HDF细胞TNF-α、IL-1和 IL-6水平的影响
Fig.9 Effects of flavor protease hydrolysates on the contents of TNF-α, IL-1, and IL-6 in LPS-induced HDF cells
2.8.4 UVB照射损伤实验
将实验细胞分为预防组和干预组,利用紫外灯照射构建UVB照射损伤模型[23],测定各组细胞的存活率,评估酶解产物对于细胞UVB照射损伤的抵抗及预防能力,实验结果如图10所示。紫外线UVB照射后,预防组中未添加风味蛋白酶酶解产物的模型组细胞存活率为31.33%,添加20%风味蛋白酶酶解液的细胞存活率为133.74%,添加50%风味蛋白酶酶解液的细胞存活率为222.35%;干预组中未添加风味蛋白酶酶解产物的模型组细胞存活率为76.58%,添加20%风味蛋白酶酶解液的细胞存活率为167.94%,添加50%风味蛋白酶酶解液的细胞存活率为183.74%。与不添加风味蛋白酶酶解产物的空白组相比,模型组细胞存活率显著下降(P<0.05)。经酶解液处理后细胞存活率皆显著上升(P<0.05),且高浓度组的细胞存活率显著高于低浓度组(P<0.05)。MASUDA等[24]以无毛小鼠为模型,研究了燕窝提取物对紫外线辐射诱导的皮肤损伤的影响,发现口服燕窝提取物有助于减少紫外线辐射引起的皮肤损伤,高剂量组小鼠皮肤水分含量显著高于对照组,且皮肤组织中凋亡表皮细胞数量明显减少。本研究结果表明,酶解实验配制的风味蛋白酶酶解产物具有良好的抗UVB照射及UVB照射损伤修复能力,且高浓度酶解产物抵抗UVB的效果更好。
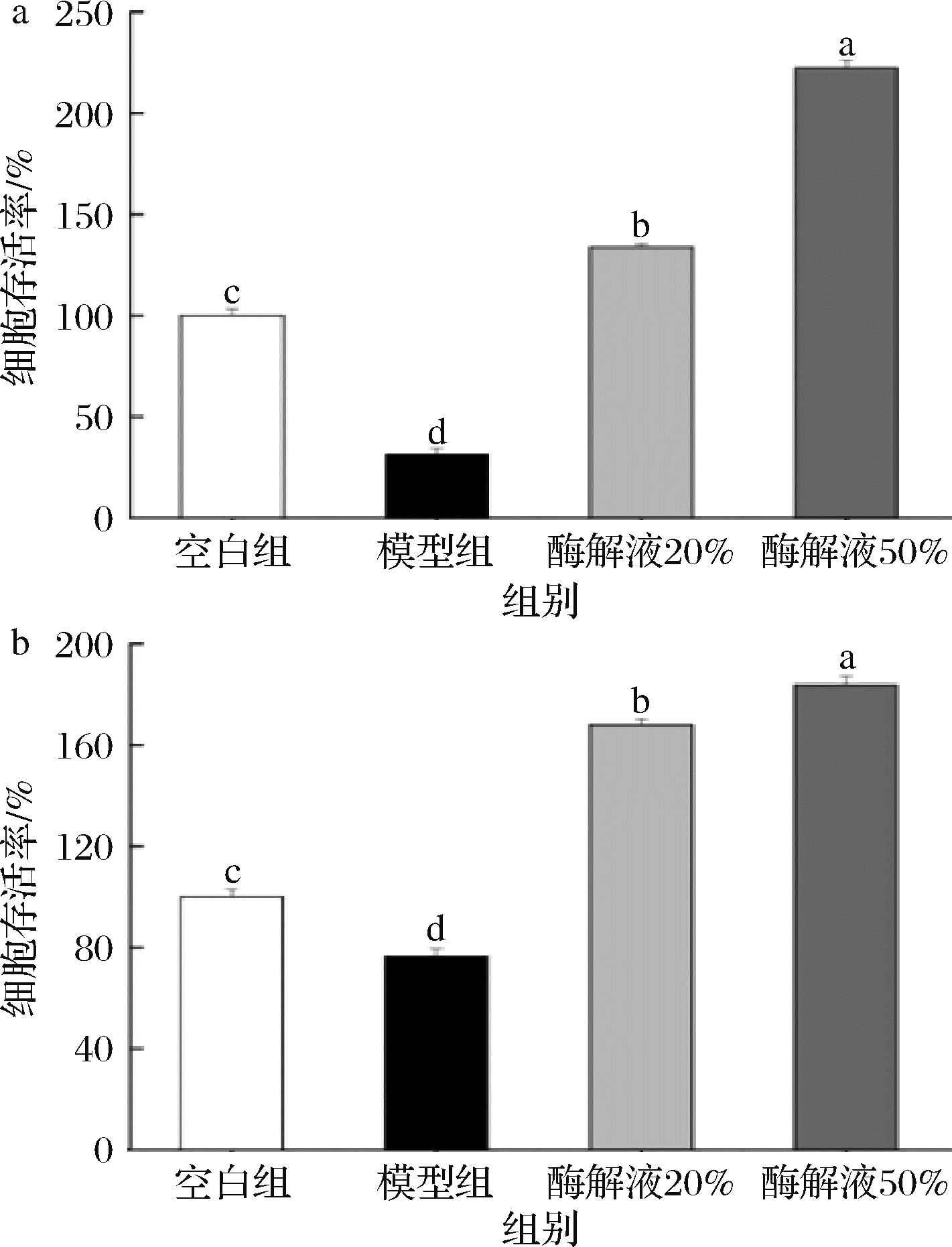
a-预防组;b-干预组
图10 风味蛋白酶酶解产物对UVB诱导的HDF细胞存活率的影响
Fig.10 Effect of flavor protease hydrolysate on UVB-induced HDF cell viability
3 结论
风味蛋白酶解燕角产物的抗氧化活性在筛选的6种蛋白酶产物中最高,最佳酶解条件为酶底比7 000 U/(g底物)、料液比 1∶20(g∶mL)、酶解时间12 h。燕角唾液酸含量与燕窝相当。燕角酶解产物保湿效果良好,8 h 内体外保湿率超 60%。且在抗过敏和抗衰老方面具备良好潜力,2 mg/mL 时透明质酸酶抑制率>60%,1 mg/mL 时弹性蛋白酶抑制率>60%。同时,细胞毒性实验证实其对人皮肤成纤维细胞无毒性,氧化、炎症、UVB 照射损伤实验表明它还具备抗氧化损伤、抗炎及损伤修复能力。综上,燕角酶解产物表现出多方面皮肤保护功效,无细胞毒性,可作为功能性成分用于护肤品,为护肤品行业提供了一种天然、有效的原料选择,应用前景良好。
[1] BIR, ZHANG D, QUAN R, et al.Edible bird’s nest alleviates pneumonia caused by tobacco smoke inhalation through the TNFR1/NF-κB/NLRP3 pathway[J].Food Science &Nutrition, 2024, 12(6):4196-4210.
[2] LI L F, CHENG H Y, LANG J, et al.An oligosaccharide marker for rapid authentication of edible bird’s nest[J].Food Chemistry, 2023, 409:135334.
[3] KIM O K, KIM D, LEE M, et al.Standardized edible bird’s nest extract prevents UVB irradiation-mediated oxidative stress and photoaging in the skin[J].Antioxidants, 2021, 10(9):1452.
[4] 张晨曦, 林小仙, 张维悦, 等.燕窝对不同周期女性潜在调控作用的研究进展[J].食品与发酵工业, 2023, 49(5):328-336.ZHANG C X, LIN X X, ZHANG W Y, et al.Research progress of the potentially regulatory effect of edible bird’s nest on females in different lifecycles[J].Food and Fermentation Industries, 2023, 49(5):328-336.
[5] 王梦花, 林小仙, 琚萌萌, 等.唾液酸的制备和生物活性研究进展[J].药学研究, 2022, 41(9):600-604.WANG M H, LIN X X, JU M M, et al.Research progress in preparation and biological activity of sialic acid[J].Journal of Pharmaceutical Research, 2022, 41(9):600-604.
[6] 李敬, 钟文俊, 王晓云, 等.响应面法优化燕窝唾液酸的提取工艺[J].中药材, 2017, 40(7):1670-1674.LI J, ZHONG W J, WANG X Y, et al.Optimization of extraction technology of sialic acid from bird’s nest by response surface methodology[J].Journal of Chinese Medicinal Materials, 2017, 40(7):1670-1674.
[7] LAI Q W S, GUO M S S, WU K Q, et al.Edible bird’s nest, an Asian health food supplement, possesses moisturizing effect by regulating expression of filaggrin in skin keratinocyte[J].Frontiers in Pharmacology, 2021, 12:685982.
[8] NOOR H S M, ARIFF R M, CHANG L S, et al.Enzymatic recovery of glycopeptides from different industrial grades edible bird’s nest and its by-products:Nutrient, probiotic and antioxidant activities, and physicochemical characteristics[J].Food Science and Human Wellness, 2022, 11(6):1555-1564.
[9] 王慧, 倪坤仪, 王玉.燕窝中唾液酸的含量测定[J].药物分析杂志, 2006, 26(9):1251-1253.WANG H, NI K Y, WANG Y.Determination of sialic acid in Edible bird’s nest[J].Chinese Journal of Pharmaceutical Analysis, 2006, 26(9):1251-1253.
[10] 张培凤, 钟小超, 胡胜兵, 等.透明质酸酶活性抑制实验的影响因素研究[J].精细与专用化学品, 2023, 31(8):43-45; 53.ZHANG P F, ZHONG X C, HU S B, et al.Study of factors influencing hyaluronidase activity inhibition experiments[J].Fine and Specialty Chemicals, 2023, 31(8):43-45; 53.
[11] ZHANG Y D, IMAM M U, ISMAIL M.In vitro bioaccessibility and antioxidant properties of edible bird’s nest following simulated human gastro-intestinal digestion[J].BMC Complementary and Alternative Medicine, 2014, 14:468.
[12] 王鑫. 具有高美白活性燕碎肽的制备研究[D].无锡:江南大学, 2021.WANG X.Study on preparation of edible bird’s nest peptide with high whitening activity [D].Wuxi:Jiangnan University, 2021.
[13] ZHANG T T, WU J R, ZHAN X B.Dietary sialic acids:Distribution, structure, and functions[J].Critical Reviews in Food Science and Nutrition, 2024, 64(24):8609-8632.
[14] 蔡延渠, 董碧莲, 邓剑壕, 等.改良桃胶多糖的吸湿保湿性能及体外透皮吸收研究[J].广州中医药大学学报, 2018, 35(4):711-716.CAI Y Q, DONG B L, DENG J H, et al.Study on moisture-absorption and moisture-retention properties and in-vitro percutaneous absorption of improved peach gum polysaccharose[J].Journal of Guangzhou University of Traditional Chinese Medicine, 2018, 35(4):711-716.
[15] 阿斯根, 奚桢浩, 岑莲, 等.功能化透明质酸在生物医药领域的研究进展[J].石油化工, 2024, 53(8):1080-1088.A S G, XI Z H, CEN L, et al.Research progress of functionalized hyaluronic acid in biomedicine[J].Petrochemical Technology, 2024, 53(8):1080-1088.
[16] 曹义苗, 高宏旗, 高聪, 等.高低海拔的山茶花活性成分及护肤功效研究[J].日用化学品科学, 2024, 47(1):29-32.CAO Y M, GAO H Q, GAO C, et al.Study on skin care efficacy of the active ingredients in Camellia japonica flowers at high and low altitudes[J].Detergent &Cosmetics, 2024, 47(1):29-32.
[17] 李进, 代嫚婷, 牟亚萍, 等.滇牡丹雄蕊提取物的化学成分、体外抗氧化和护肤活性研究[J].食品与发酵工业, 2024, 50(17):186-197.LI J, DAI M T, MOU Y P, et al.Chemical composition, in vitro antioxidant, and skin-protective activities of Paeonia delavayi Franch stamen extract[J].Food and Fermentation Industries, 2024, 50(17):186-197.
[18] KIM H M, LEE Y M, KIM E H, et al.Anti-wrinkle efficacy of edible bird’s nest extract:A randomized, double-blind, placebo-controlled, comparative study[J].Frontiers in Pharmacology, 2022, 13:843469.
[19] 慕彰磊, 张建中.皮肤屏障与特应性皮炎[J].临床皮肤科杂志, 2019, 48(11):707-709.MU Z L, ZHANG J Z.Skin barrier and atopic dermatitis[J].Journal of Clinical Dermatology, 2019, 48(11):707-709.
[20] 张雨彤, 魏梦雅, 任倩倩, 等.化妆品植物原料(Ⅵ):在抗衰老化妆品中的研究与开发[J].日用化学工业, 2021, 51(11):1052-1059.ZHANG Y T, WEI M Y, REN Q Q, et al.Botanical cosmetic ingredients(Ⅵ) Research and development of anti-aging skincare ingredients from plants[J].China Surfactant Detergent &Cosmetics, 2021, 51(11):1052-1059.
[21] 董建辉, 田巧基, 段素芳, 等.燕窝提取物的抗氧化及促进表皮细胞生长活性比较[J].食品与发酵工业, 2019, 45(17):73-78.DONG J H, TIAN Q J, DUAN S F, et al.Comparative study on anti-oxidation and promotion activity of epidermal cell growth of edible bird’s nest water extract[J].Food and Fermentation Industries, 2019, 45(17):73-78.
[22] 何转霞, 齐鑫鑫, 刘涛.CSE联合LPS诱导制备BEAS-2B细胞炎症损伤模型的正交实验研究[J].毒理学杂志, 2022, 36(4):316-320; 325.HE Z X, QI X X, LIU T.Orthogonal experimental study of BEAS-2B cell inflammatory injury model induced by CSE combined with LPS[J].Journal of Toxicology, 2022, 36(4):316-320; 325.
[23] 殷庆飞, 陈田.人真皮成纤维细胞受长波紫外线辐照引起基因表达动态变化[J].日用化学工业, 2021, 51(9):874-880.YIN Q F, CHEN T.Dynamic changes of gene expression induced by long-wave ultraviolet radiation in human dermal fibroblasts[J].China Surfactant Detergent &Cosmetics, 2021, 51(9):874-880
[24] MASUDA S, MAKIOKA-ITAYA Y, IJICHI T, et al.Edible bird’s nest extract downregulates epidermal apoptosis and helps reduce damage by ultraviolet radiation in skin of hairless mice[J].Journal of Clinical Biochemistry and Nutrition, 2022, 70(1):33-36.