山西老陈醋(Shanxi aged vinegar, SAV)风味独特、品质优良,且富含多种营养及功能成分[1],其生产过程包括大曲制备、原料准备、发酵、熏醅、淋醋和陈酿这6个主要的连续阶段。新淋出的SAV(新醋)即可食用,但往往其口感生硬、酸味刺激且不协调、香气淡薄,同时还伴有不良杂味,综合品质未达到最佳状态。因此,GB/T 19777—2013《地理标志产品 山西老陈醋》中规定SAV的自然陈酿周期在12个月以上。
SAV的自然陈酿通常是将新醋放置于陈酿池或陶缸中,经历“夏伏晒、冬捞冰”,此过程主要是水分蒸发和去除的浓缩效应,同时也伴随着复杂的理化变化[2],期间各种成分相互作用、演变,直至SAV在口感、香气以及品质稳定性等方面与新醋表现出明显差异。研究表明,陈酿可综合改善与提升SAV的品质、风味、营养及功能性[3],且这些品质特性的改善和提升与陈酿时长密切相关[4]。挥发性风味成分(volatile flavor components, VFCs)是食醋风味品质的关键指标,它们直接影响着消费者对产品的感官认知和喜好程度[5]。迄今,研究者先后在SAV两个陈酿时期[6]、陈酿前后[7]、市售成品醋[8-9]等方面对VFCs进行了研究、比较与分析,但是对长期陈酿SAV中VFCs的种类、含量及动态变化规律、各时期的特征VFCs以及不同陈酿阶段间的差异VFCs等还尚未有研究涉及到,这将会限制对SAV陈酿期间风味品质变化机理的揭示与认知。
基于此,本研究以9个不同陈酿时期的SAV为研究对象,以VFCs为分析侧重点,采用顶空固相微萃取-气相色谱-质谱联用(headspace solid-phase microextraction-gas chromatography-mass spectrometry, HS-SPME-GC-MS)技术进行测定,结合主成分分析(principal component analysis, PCA)、正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA)等多元统计方法进行分析,旨在揭示SAV长期陈酿过程中VFCs的含量变化及产生、消退规律,明确不同陈酿时期的重要和差异VFCs,为今后深入探寻形成SAV风味品质差异的原因、实现风味特征靶向调控等奠定基础。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 SAV样品
于SAV酿造企业在相同工艺条件下分别采集酿造的SAV样品,包括新醋(未经陈酿的新淋醋,即陈酿0年)、陈酿1、2、3、5、6、8、10和15年共9个处于不同陈酿时期的SAV,测定之前摇匀后取样,并尽快测定。
1.1.2 主要试剂
2-辛醇(分析纯,CAS号:123-96-6),南京国药集团化学试剂有限公司;色谱甲醇和分析纯试剂NaCl、NaOH、酒石酸钾钠、CuSO4,天津市瑞金特化学品有限公司。
1.1.3 主要仪器设备
STARER3100型酸度计,上海Ohaus仪器有限公司;722型可见分光光度计,上海舜宇恒平科学仪器有限公司;50/30 μm碳分子筛/聚二甲基硅氧烷(DVB/CAR/PDMS)纤维萃取头、20 mL顶空进样瓶,美国Supelco公司;DA-5MS非极性色谱柱(30 m×250 μm×0.25 μm),美国Agilent公司;AOC 5000进样器、TRACE 1300气相色谱-质谱联用仪,美国赛默飞世尔科技有限公司;BSA224S电子天平,赛多利斯科学仪器(北京)有限公司;单通道移液器,德国Eppendorf公司。
1.2 试验方法
1.2.1 醋液理化指标测定方法
不同陈酿年份的醋液样品pH值、总酸、还原糖、总酯和氨基酸态氮含量测定均按GB/T 19777—2013《地理标志产品 山西老陈醋》中规定的方法进行;色率测定参考陈建红等[10]的方法进行。
1.2.2 醋液VFCs萃取方法
先将纤维萃取头在气相色谱仪的进样口于250 ℃老化至无杂峰,时间为30 min。将醋样混合均匀,准确吸取2.5 mL,小心加到顶空进样瓶中,然后加入20 μL的2-辛醇溶液(提前溶解于色谱纯甲醇中,质量浓度为1.6 g/L,作为内标物)和1.5 g NaCl,加盖密封后用力摇匀,之后将顶空瓶放入孵化炉,孵化炉的搅拌速度100 r/min,孵化温度45 ℃并保持30 min。接着将已经老化好的萃取头插入顶空瓶中,使萃取头尖端与液面保持1.5 cm的距离,随后推出纤维头进行顶空吸附萃取40 min。萃取完毕后直接进样,在250 ℃的进样口温度下解吸5 min。
1.2.3 GC-MS联用参数
色谱条件:DA-5MS非极性色谱柱(30 m×250 μm×0.25 μm);载气氦气(He);流速1 mL/min;分流比5∶1;进样口温度250 ℃;程序升温过程为:起始温度40 ℃保持3 min,然后以4 ℃/min升温至150 ℃,保持1 min,再以8 ℃/min的速度升至250 ℃,保持6 min。
质谱条件:电子电离源(EI);接口温度280 ℃,离子源温度250 ℃,溶剂延迟时间1.5 min,电子能量70 eV,扫描质量范围43~500 amu。
1.2.4 VFCs的定性鉴别与定量分析
定性鉴定:通过随机自带的NIST 08谱库检索,结合人工图谱解析,选取匹配度>80%并结合保留指数(retention index, RI),比较公开文献或NIST化学网络数据库(https://DOI.org/10.18434/T4D303)中各VFC的RI值进行定性,定性过程中剔除硅氧烷烃类等无明显风味贡献或柱流失的成分;RI定性方法:将C8~C30正构烷烃作为标准物,在与样品相同的色谱条件下进样分析,RI按公式(1)进行计算。
(1)
式中:RI,保留指数;n和n+1,未知VFC流出前、后正构烷烃碳原子数;tn和tn+1,前、后相邻正构烷烃的保留时间,min;ti,未知VFC在气相色谱中的保留时间(tn<t<tn+1),min。
定量分析:将各VFC的色谱峰面积与内标物(2-辛醇)的峰面积进行比较,计算出每种VFC相对于2-辛醇的含量。按公式(2)计算:
某种VFC的质量浓度/(μg/L)=
(2)
1.3 数据统计与分析方法
每个处理至少重复3次。采用Excel 2017和SPSS 20.0进行数据统计与差异显著性分析(差异显著性水平设为P<0.05);采用R 4.0.3进行Pearson相关性分析;使用Simca 14.1软件进行多元统计分析[包括PCA、层次聚类分析(hierarchical cluster analysis,HCA)和OPLS-DA],获得VIP值并绘制相关图形;用SPSS 20.0对各种VFCs进行Student’s t检验和差异倍数(Log2FC)分析,以VIP>1、P<0.05及Log2FC≥2或≤0.5为条件来筛选不同陈酿阶段之间的标志性差异VFCs。
2 结果与分析
2.1 不同陈酿年份SAV理化指标分析
表1数据显示SAV陈酿过程中总酸、氨基酸态氮含量持续上升,还原糖、总酯含量在波动中上升(P<0.05),说明陈酿有助于这几类物质的富集,它们的积累有助于综合提升SAV的营养以及酸、鲜、甜、香等风味品质;色率也在不断升高(P<0.05),这一方面可归因于陈酿过程的浓缩效应,另一方面是由于类黑精等色素类物质的产生和积累所导致;而pH值仅在很小的范围内波动,说明SAV是一个复杂的缓冲体系,可以缓冲乙酸的尖酸味,使得口感更加柔和、不刺激。
表1 SAV不同陈酿时期的理化指标
Table 1 Physicochemical indicators of SAV during different aging periods
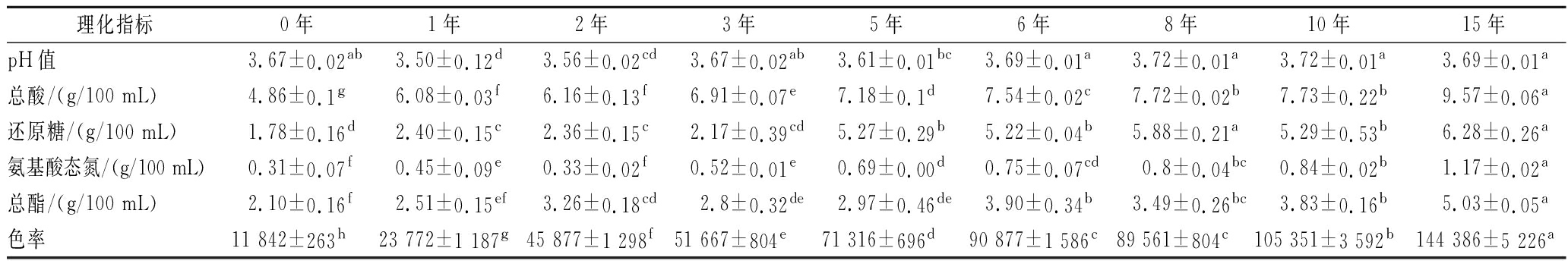
理化指标0年1年2年3年5年6年8年10年15年pH值3.67±0.02ab3.50±0.12d3.56±0.02cd3.67±0.02ab3.61±0.01bc3.69±0.01a3.72±0.01a3.72±0.01a3.69±0.01a总酸/(g/100 mL)4.86±0.1g6.08±0.03f6.16±0.13f6.91±0.07e7.18±0.1d7.54±0.02c7.72±0.02b7.73±0.22b9.57±0.06a还原糖/(g/100 mL)1.78±0.16d2.40±0.15c2.36±0.15c2.17±0.39cd5.27±0.29b5.22±0.04b5.88±0.21a5.29±0.53b6.28±0.26a氨基酸态氮/(g/100 mL)0.31±0.07f0.45±0.09e0.33±0.02f0.52±0.01e0.69±0.00d0.75±0.07cd0.8±0.04bc0.84±0.02b1.17±0.02a总酯/(g/100 mL)2.10±0.16f2.51±0.15ef3.26±0.18cd2.8±0.32de2.97±0.46de3.90±0.34b3.49±0.26bc3.83±0.16b5.03±0.05a色率11 842±263h23 772±1 187g45 877±1 298f51 667±804e71 316±696d90 877±1 586c89 561±804c105 351±3 592b144 386±5 226a
注:同行数据上标不同字母表明存在显著性差异(P<0.05)。
2.2 不同陈酿年份SAV中VFCs的组成及含量
从9个不同陈酿时期的SAV中共检测出116种VFCs,其中醇类18种、酯类33种、酸类26种、醛类9种、酮类10种、杂环类9种、酚类5种、其他6种,各类和每种VFCs在陈酿过程中的总含量情况分别见图1和电子版增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.041865)。
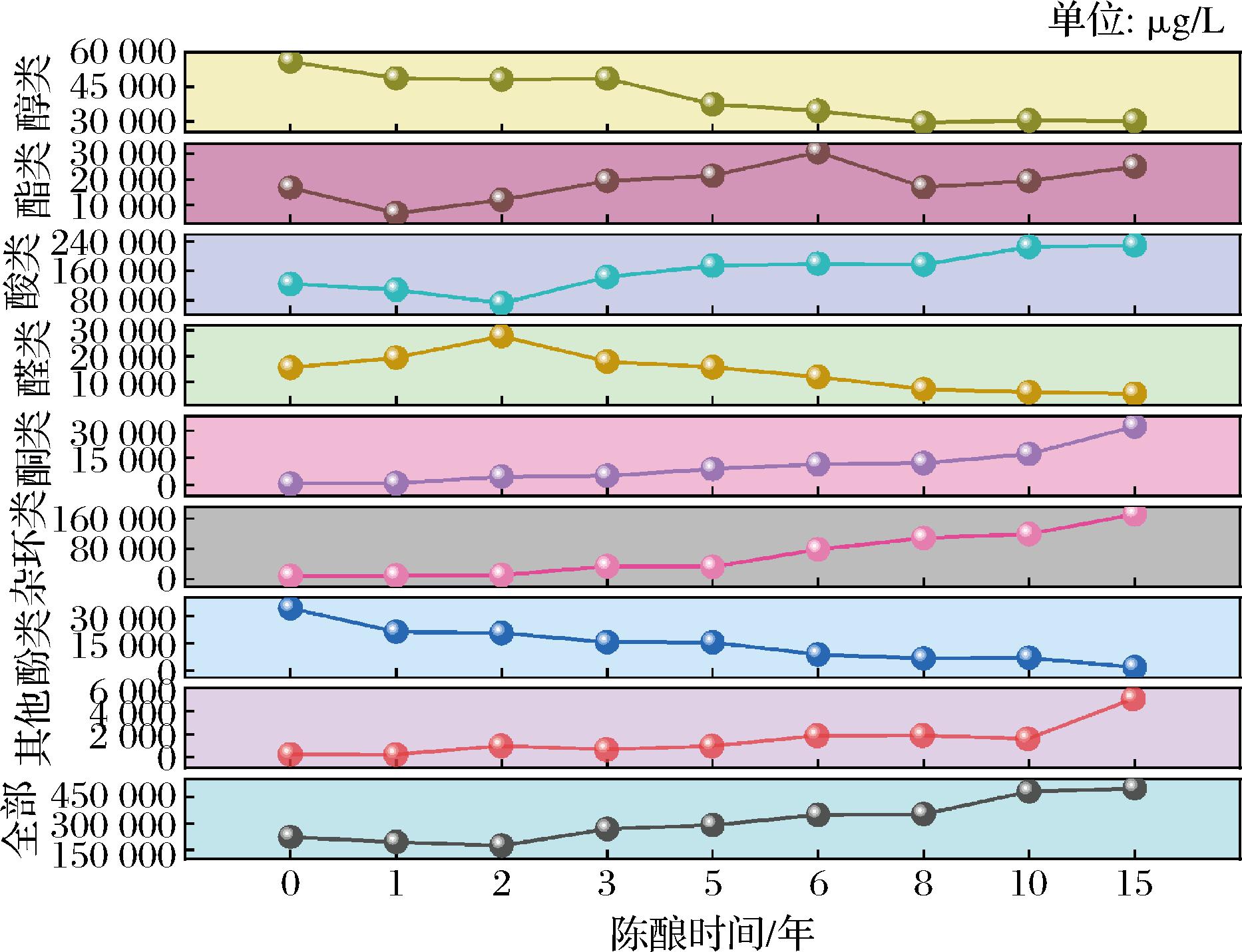
图1 SAV不同陈酿时期各类VFCs含量及其变化
Fig.1 Content of various types of VFCs and their changes during different aging periods of SAV
在长达15年的陈酿时期内,SAV的VFCs总含量先略有下降,随后不断上升,表明陈酿前期以挥发效应为主,后期以浓缩效应为主(图1),至陈酿15年时VFCs的总含量高达498 777.26 μg/L,为新醋时期的2.22倍,说明总体而言陈酿有利于VFCs的富集。SAV的VFCs种类和含量发生了显著变化,有些VFCs在陈酿过程中逐渐减少直至消失,有些则在该过程中产生(电子版增强出版附表1)。
含量较高的醇类物质主要有苯乙醇、2,3-丁二醇、3,4-二甲基-3-己醇和2,4-二甲基-3-庚醇。醇类物质总含量在整个陈酿期间不断减少,尤其是乙醇和2,3-丁二醇。有研究表明,温度越高,醇类物质含量降低程度越明显[11]。本次SAV醇类物质含量变化与范梦蝶等[12]对SAV晾晒前后的VFCs相对含量变化的研究结果相一致。
酯类种类最多,它们在食醋风味构成中占据重要作用。在陈酿初期(0~1年),挥发性酯类总含量明显下降,尤其以乳酸乙酯和DL-2-羟基-4-甲基戊酸乙酯的含量下降幅度为最大,说明这些酯类物质在陈酿过程中会被降解从而大量消失,在镇江香醋的陈酿过程中乳酸乙酯也保持类似的变化趋势[13]。随后酯类总含量逐渐上升(1~5年)直至平稳(5~15年),说明在长期陈酿过程中,酯类物质的产生和分解基本达到动态平衡;含量较高的酯类物质主要包括乙酸苯乙酯、丁二酸单甲基酯、DL-2-羟基-4-甲基戊酸乙酯、甲酸新戊酯、乙酸乙酯等,它们含量变化情况总体说明陈酿中期有利于酯类的积累。这可能是因为陈酿早期酯类水解反应强于合成反应,而随着陈酿时间的延长,在SAV酸性体系中,酯类处于连续酯化形成和水解消耗的动态平衡状态,加之陈酿的浓缩效应,从而表现为含量上升,长期陈酿时酯类会发生分解或者作为前体物质进入了其他复杂化合物的代谢途径中,因此后期在峰值之下保持含量平稳。研究表明,酯类的这种水解-酯化平衡状态受多种因素的影响,如酸或醇类的含量、体系pH、陈酿温度等[14]。
乙酸是含量最高的挥发性酸类物质,也是SAV的基础成分,新醋时期其含量为98 220.09 μg/L,由于挥发、氧化、降解、酯化、水解等作用[15],到陈酿2年内其含量逐步下降至63 972.54 μg/L,在随后的陈酿过程中则不断上升,至陈酿15年时含量高达216 804.15 μg/L,升高近3.4倍。乙酸的这一变化趋势与CHEN等[16]以及AL-DALALI等[17]对SAV的研究结果类似,但与SAV晾晒前、后[12]以及镇江香醋[13]和浙江玫瑰醋[10]的研究结果不一致,这可能是因为不同研究所关注的陈酿时长不同且不同食醋的陈酿方式不同等原因所导致。本次检测出的含量较高的挥发性酸类物质还包括苯甲酸、丙酸、2,3-丁烷二醇二醋酸、(R)-3-羟基丁酸、异丁酸、异戊酸、2-酮戊二酸、正己酸等,它们变化情况各有差异,但都大致表现出中期含量升高、后期含量降低的趋势。此外,SAV中还含有2-甲基丁酸、甲基丙二酸、3-氨基丁酸、正戊酸、庚酸、辛酸、壬酸等挥发性酸,它们含量虽低,但也可为SAV提供不同的酸味层次。
醛类是食醋中发生化学转化过程中的关键中间体,其含量和种类会影响到食醋的颜色和风味等品质。本次共检测出9种醛类物质,含量最高的为糠醛(平均11 030.48 μg/L),它可为食醋提供烧烤味、焦糖味、坚果香等风味[18]。其含量先上升后下降,在浙江玫瑰醋中其含量变化情况也类似[10],这可能是由于在陈酿后期糠醛可能与其他物质发生缩合反应,生成新的化合物[19];苯甲醛主要通过美拉德反应及氨基酸反应产生[20],其含量变化趋势不明显;此外,苯乙醛、壬醛、5-甲基糠醛、3,5-二甲基苯甲醛主要在陈酿中后期被检出,而4,4-二甲基己醛和2,4-二甲基苯甲醛则随着陈酿进程逐渐消失。
酮类总含量在陈酿阶段持续提高,3-羟基-2-丁酮是SAV的主要风味物质,也是形成吡嗪的前体物质[21],同时也是本次检测出的含量最高的酮类物质,其含量在整个陈酿阶段不断升高近78倍,2,3-丁二酮也表现出类似的趋势,而仲辛酮在陈酿期间含量变化趋势不大;甲基乙二酮、2-羟基-3-戊酮、苯乙酮、异水菖蒲酮、3,4,5,6,7,8-六氢-1(2H)-萘酮在陈酿后期检出,但3-乙酰基-2-丁酮的含量却是在前期上升之后,后期检测不出。总体而言,陈酿过程有利于酮类物质的产生和积累。
共检测出9种杂环类物质,其中6种为吡嗪类,含量最高的为四甲基吡嗪,在陈酿15年期间其含量由7 574.72 μg/L持续升高至163 201.82 μg/L;其次为2,3,5-三甲基吡嗪,15年陈酿期间含量升高了8.15倍;另外,除了2,5-二乙基吡嗪在陈酿阶段消失外,其余6种杂环类物质均是在陈酿期间新产生,包括2,3-二甲基吡嗪、2,3-二乙基吡嗪、2,3-二甲基-5-乙基吡嗪、2,4,5-三甲基恶唑、四氢-2-甲基-2-呋喃、乙酰呋喃,说明陈酿过程有利于杂环类风味物质的产生和积累。LIANG等[7]和张磊等[22]的研究也发现陈酿会促进SAV中以四甲基吡嗪为主的多种杂环类物质含量的增加,可促进SAV风味的形成。
通常认为酚类物质与木质素的降解和微生物代谢有关[7]。SAV中酚类物质总含量较低,且在陈酿过程中表现出持续下降的趋势;2,4-二叔丁基苯酚为本次检出的含量最高的酚类物质,这与TESFAYE等[23]对雪利醋陈酿过程中酚类物质的变化趋势一致;酚类物质在陈酿过程中的消退机理及对醋的贡献还有待深入研究。6种其他挥发性物质(主要是烷烃和环烷烃类物质)的总含量在SAV陈酿过程中持续上升,这种趋势可能主要归因于陈酿过程的浓缩效应。
2.3 VFCs与SAV陈酿时长的相关性
采用Pearson相关性研究分析了SAV中各VFC含量变化与陈酿时间的相关性,共筛选出13种与陈酿时长显著高度相关(|相关系数|>0.7且P<0.05)的VFCs,可用来指示陈酿进度,并对其含量进行预测,结果见表2。可以看出,共有10种VFCs与陈酿时长呈正相关,这些物质大多都具有丰富的香气特征,如3-羟基-2-丁酮和2,3-丁二酮具有奶油香味、四甲基吡嗪可提供焦咖啡味的烘烤香、2,3,5-三甲基吡嗪有烤土豆的香味、2,4,5-三甲基恶唑具有烘烤、焦糖和清香香气,它们含量的增加能够进一步增强SAV陈酿的香气特征,同时也能增强其功能特性(例如研究表明四甲基吡嗪有强心、增强冠脉循环、抗血栓等作用[24]);有3种VFCs与陈酿时长呈显著负相关,表明它们在SAV陈酿过程中含量有明显降低,也可作为表征SAV陈酿度的潜在指标,为进一步探究陈酿过程中VFCs成消机理以及靶向调控陈酿进度提供理论依据和参考。
表2 VFCs与SAV陈酿时长的Pearson相关性分析及含量预测结果
Table 2 Pearson correlation analysis and content prediction results of VFCs and SAV aging duration
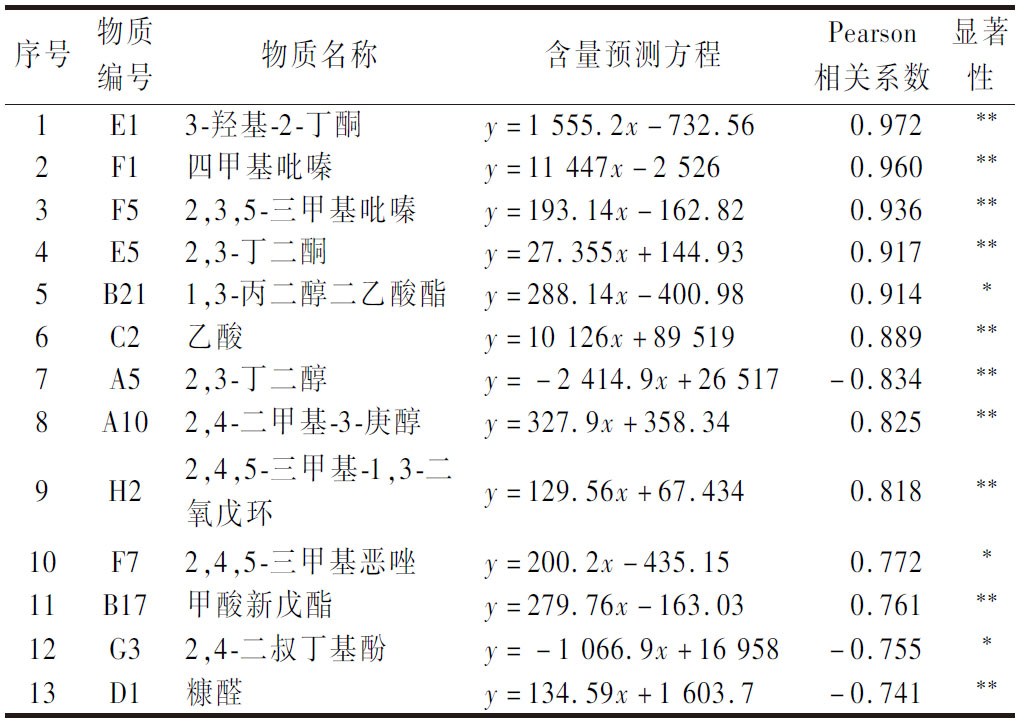
序号物质编号物质名称含量预测方程Pearson相关系数显著性1E13-羟基-2-丁酮y=1 555.2x-732.56 0.972**2F1四甲基吡嗪y=11 447x-2 5260.960**3F52,3,5-三甲基吡嗪y=193.14x-162.820.936**4E52,3-丁二酮y=27.355x+144.930.917**5B211,3-丙二醇二乙酸酯y=288.14x-400.980.914*6C2乙酸y=10 126x+89 5190.889**7A52,3-丁二醇y=-2 414.9x+26 517-0.834**8A102,4-二甲基-3-庚醇y=327.9x+358.340.825**9H22,4,5-三甲基-1,3-二氧戊环y=129.56x+67.4340.818**10F72,4,5-三甲基恶唑y=200.2x-435.150.772*11B17甲酸新戊酯y=279.76x-163.030.761**12G32,4-二叔丁基酚y=-1 066.9x+16 958-0.755*13D1糠醛y=134.59x+1 603.7-0.741**
注:**和*分别表示在0.01和0.05水平上显著相关;含量预测方程中y代表该物质的含量(单位:μg/L),x代表陈酿年份(单位:年)。
2.4 多元统计分析
2.4.1 PCA与HCA
SAV陈酿期间VFCs组成复杂,每一种成分变化情况也不尽相同。为此,用多元统计分析方法对VFCs进行分析,以进一步寻找SAV不同陈酿时期的重要特征化合物,有利于明晰SAV陈酿的本质特点。
首先对不同陈酿年份SAV的VFCs进行PCA分析(图2-a),提取到2个主成分,贡献率分别为71.6%和10.3%,累计贡献率为81.9%,基本可以反映样品整体信息。所有样品均在95%的置信区间内,且随着陈酿过程的进行,样品间具有明显的区域分布特征,大体表现为绕着中心位置顺时针移动,而相同陈酿年份(图中相同颜色的样本点)则彼此非常靠近,说明相同陈酿年份的SAV具有高度相似的组成和含量;HCA结果(图2-b)可以将整个SAV陈酿时期分为4个阶段:第一阶段(S1)包括新醋、陈酿1和2年的样品,第二阶段(S2)包括陈酿3、5和6年的样品,第三阶段(S3)包括陈酿8和10年的样品,第四阶段(S4)为陈酿15年样品。由于PCA是无监督分析模型,不能去除未控制变量对数据造成的影响,但由图2-c可看出,所有样品均在95% Hotelling T2置信区间内,未发现超出该置信区间的样本,因此可进一步对样品中的VFCs进行OPLS-DA分析。

a-PCA得分图;b-HCA样品结果;c-Hotelling T2 分布图
图2 SAV不同陈酿时期VFCs的PCA与HCA分析
Fig.2 PCA and HCA analysis of VFCs during different aging periods of SAV
2.4.2 OPLS-DA
为进一步获得导致2.4.1节中4个阶段的差异代谢物信息,采用有监督的正交偏最小二乘判别分析(OPLS-DA模型)对4个阶段的样本进行分析,以寻找不同阶段之间关键的差异VFCs。所建立的OPLS-DA模型R2X=0.689,说明模型较优;模型解释率R2Y与预测率Q2分别为0.885和0.785,说明该模型对变量的拟合优度和预测优度均较高;采用置换检验来验证模型的可靠性,对样本随机改变顺序,结果表明经200次的随机排列,R2>Q2,且Q2回归线的截距小于0(图3-a),说明该模型可以对数据进行有效预测,且没有过度拟合。从OPLS-DA因子载荷图(图3-b)可看出所有样本点全处在95%的置信区间内,且4个不同阶段的样本能明显区分开,说明分组合理且各组之间差异明显。图3-b可以看出随着陈酿年份的增长,样本组成发生着较大变化,大致表现为沿着PC1的负轴方向移动,而每一时期都有与之高度相关的VFCs,它们围绕在各样本周围也发生着类似的区位变化,因此可用该模型进一步对不同陈酿年份SAV中的特征VFCs进行分析:A5(2,3-丁二醇)、B20(丁二酸单甲基酯)、G1(5-甲基愈创木酚)、C15(庚酸)、C17(4-甲基辛酸)、G3(2,4-二叔丁基酚)、D1(糠醛)等物质是S1时期SAV中的特征VFCs;B11(己酸苯乙酯)、C19(2-癸酸)、B31(9-十八碳-12-烯酸甲酯)、C4(甲基丙二酸)、D5(5-甲基糠醛)、A13(2-硝基-2-烯-1-醇)、C10(异戊酸)、C25(羟基异己酸)、B33(琥珀酸二乙酯)、C11(4-甲基戊酸)等是S2时期SAV中的特征VFCs;F2(2,3-二甲基吡嗪)、A3(糠醇)、B3(乙酸呋喃甲酯)、C20(壬烯酸)、E9(异水菖蒲酮)等是S3时期SAV中的特征VFCs;F5(2,3,5-三甲基吡嗪)、C7[(R)-3-羟基丁酸]、H1(十四烷)、E4(4-羟基-2-丁酮)、B1(乙酸甲酯)、B17(甲酸新戊酯)、H2(2,4,5-三甲基-1,3-二氧戊环)、A16[3-(甲硫基)-1-丙醇]、B28(3-甲基乙酸丙酯)、C24(2,3-丁烷二醇二醋酸)、A7(2,3-二甲基-3-戊醇)、E1(3-羟基-2-丁酮)、F1(四甲基吡嗪)等是S4时期SAV中的特征VFCs。
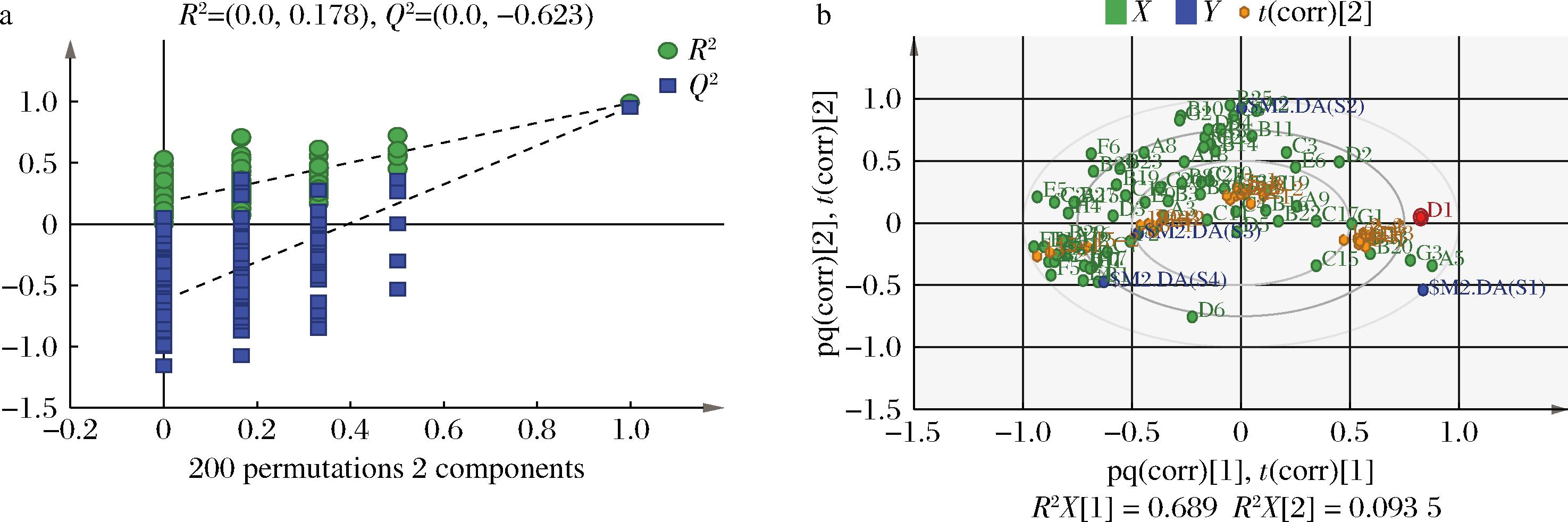
a-内部交叉验证图;b-因子载荷图
图3 SAV不同陈酿阶段VFCs的OPLS-DA
Fig.3 OPLS-DA of VFCs at different aging stages of SAV
2.4.3 不同陈酿阶段SAV中差异VFCs分析
为分析不同陈酿阶段SAV中主要VFCs差异,对相邻两阶段(即S2与S1、S3与S2、S4与S3)的数据分别进行OPLS-DA建模,绘制出S-plot图,得到变量投影重要性的可视化表达(图4),同时筛选出不同阶段之间的标志性差异风味物质[25],分析结果列于表3中。
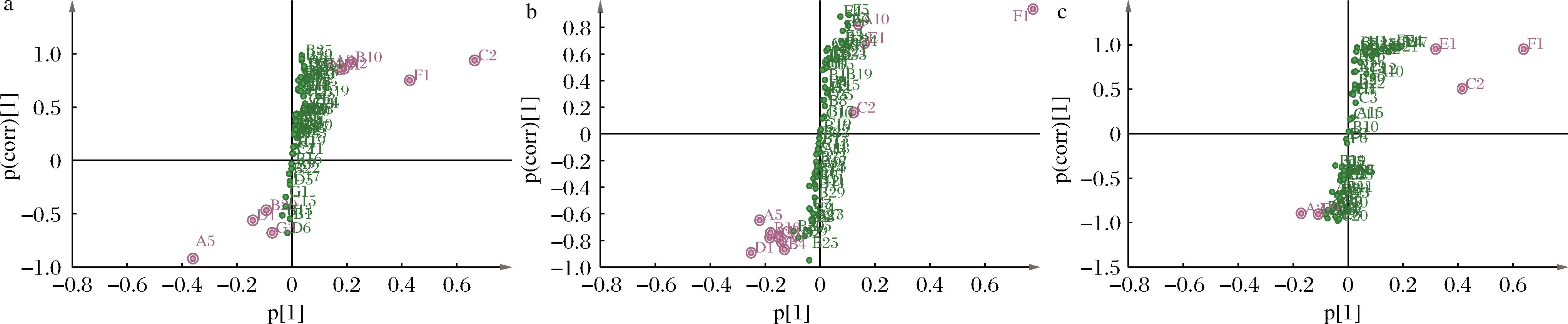
a-S2与S1阶段比较;b-S3与S2阶段比较;c-S4与S3阶段比较
图4 SAV相邻陈酿阶段S-plot图
Fig.4 S-plot diagrams of SAV adjacent aging stages
表3 SAV不同陈酿阶段差异VFCs筛选结果
Table 3 Screening results for differential VFCs at different aging stages of SAV
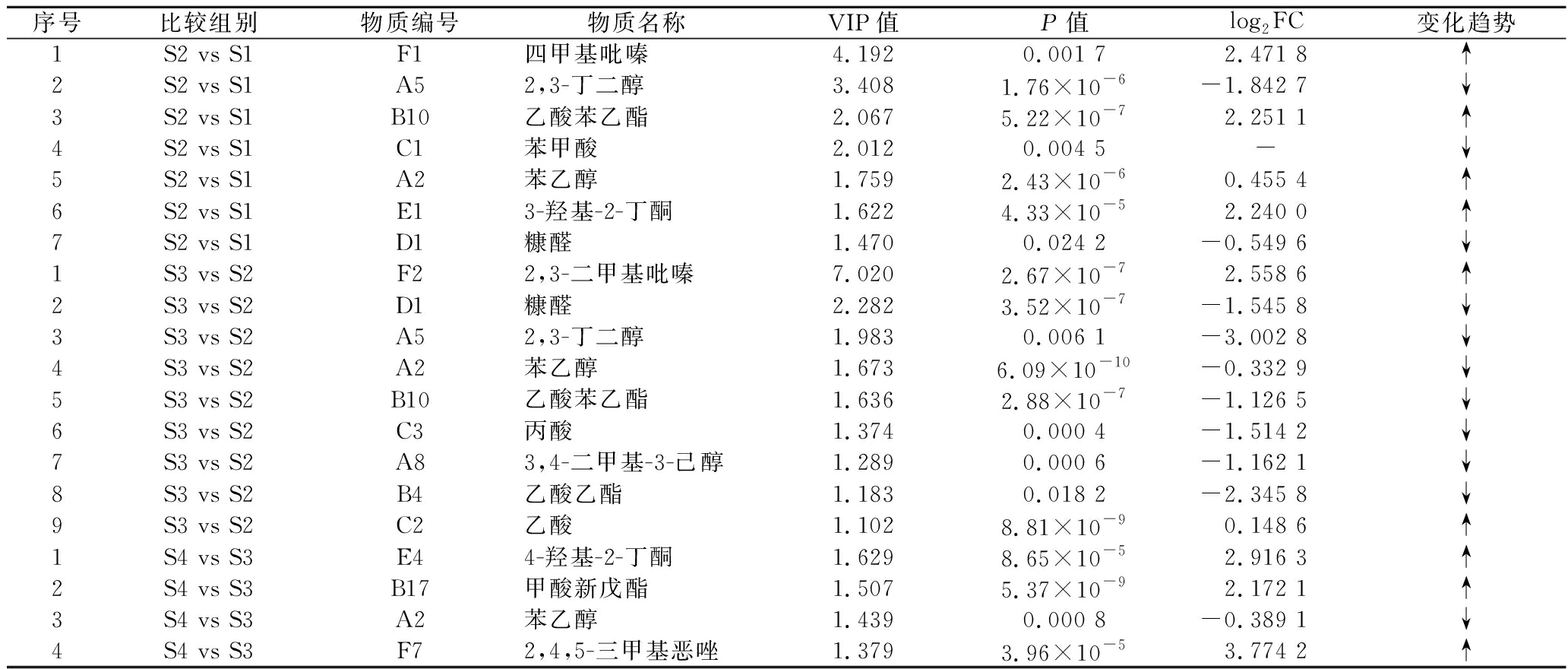
序号比较组别物质编号物质名称VIP值P值log2FC变化趋势1S2 vs S1F1四甲基吡嗪4.1920.001 72.471 8↑2S2 vs S1A52,3-丁二醇3.4081.76×10-6-1.842 7↓3S2 vs S1B10乙酸苯乙酯2.0675.22×10-72.251 1↑4S2 vs S1C1苯甲酸2.0120.004 5-↓5S2 vs S1A2苯乙醇1.7592.43×10-60.455 4↑6S2 vs S1E13-羟基-2-丁酮1.6224.33×10-52.240 0↑7S2 vs S1D1糠醛1.4700.024 2-0.549 6↓1S3 vs S2F22,3-二甲基吡嗪7.0202.67×10-72.558 6↑2S3 vs S2D1糠醛2.2823.52×10-7-1.545 8↓3S3 vs S2A52,3-丁二醇1.9830.006 1-3.002 8↓4S3 vs S2A2苯乙醇1.6736.09×10-10-0.332 9↓5S3 vs S2B10乙酸苯乙酯1.6362.88×10-7-1.126 5↓6S3 vs S2C3丙酸1.3740.000 4-1.514 2↓7S3 vs S2A83,4-二甲基-3-己醇1.2890.000 6-1.162 1↓8S3 vs S2B4乙酸乙酯1.1830.018 2-2.345 8↓9S3 vs S2C2乙酸1.1028.81×10-90.148 6↑1S4 vs S3E44-羟基-2-丁酮1.6298.65×10-52.916 3↑2S4 vs S3B17甲酸新戊酯1.5075.37×10-92.172 1↑3S4 vs S3A2苯乙醇1.4390.000 8-0.389 1↓4S4 vs S3F72,4,5-三甲基恶唑1.3793.96×10-53.774 2↑
注:表中“S2 vs S1”代表SAV陈酿第二与第一阶段比较;“S3 vs S2”代表SAV陈酿第三与第二阶段比较;“S4 vs S3”代表SAV陈酿第四与第三阶段比较;“↑”与“↓”分别代表相邻两个阶段后一阶段与前一阶段比较,每种差异物质含量升高或降低情况;“-”表示某物质仅在相邻两阶段的一个阶段中存在,无法获得差异比较数值。
从表3可看出,S2与S1时期相比,共筛选出7种显著差异的VFCs,其中A5(2,3-丁二醇)、C1(苯甲酸)、D1(糠醛)含量显著下降,F1(四甲基吡嗪)、B10(乙酸苯乙酯)、A2(苯乙醇)、E1(3-羟基-2-丁酮)含量显著上升;S3与S2时期相比,共筛选出9种显著差异的VFCs,其中F2(2,3-二甲基吡嗪)和C2(乙酸)含量显著上升,其余7种差异物质的含量均显著下降;S4与S3时期相比,共筛选出4种显著差异的VFCs,分别是E4(4-羟基-2-丁酮)、B17(甲酸新戊酯)、A2(苯乙醇)、F7(2,4,5-三甲基恶唑),除了A2(苯乙醇)含量显著下降外,其余3种差异VFCs含量均显著升高。综上,该20种VFCs可作为SAV不同陈酿时期的标志性差异物质,这可为SAV陈酿进度的判断和调控提供理论依据和技术参考。有研究表明,3-羟基-2-丁酮、2,3-丁二醇、四甲基吡嗪、糠醛、苯乙醇在镇江香醋陈酿过程中含量变化明显,它们同时也是镇江香醋短期和长期陈酿差异贡献最大的特征化合物[13];糠醛、2,3-丁二酮、3-羟基-2-丁酮、乙酸乙酯、苯乙醇也是浙江玫瑰醋陈酿5个月和2.5年的挥发性差异主要物质[10]。由此可见,不同食醋在不同陈酿时期的差异风味物质有其共同之处,但也有各自的差异,值得后续深入研究。
综上所述SAV陈酿进度的VFCs含量变化表现为线性上升或降低,区分不同陈酿阶段的差异VFCs主要表现为在2个相邻阶段含量显著升高或降低且差异倍数较大,各陈酿阶段的特征VFCs主要表现为在某一阶段含量较高。综合分析2.4节各部分结果,发现有多种VFCs在不同分析角度均起到关键作用,例如A2(苯乙醇)在4个阶段中均是差异物质,说明其含量变化波动较大;E1(3-羟基-2-丁酮)、D1(糠醛)、A5(2,3-丁二醇)和几种杂环类物质[F1(四甲基吡嗪)、F2(2,3-二甲基吡嗪)、F5(2,3,5-三甲基吡嗪)、F7(2,4,5-三甲基恶唑)]既可指示陈酿进度,又是某一阶段的特征物质,同时也是至少区分2个相邻阶段的差异物质,说明这些物质的含量变化具有一致性或协同性,可作为反映SAV陈酿进度或区分不同阶段的标志性物质,今后可深入探究它们在陈酿过程中的产生与消退机理。
3 结论
对山西老陈醋长达15年陈酿期内的9个不同陈酿年份样品进行分析,发现色率和几种常规营养成分含量均不断上升;116种VFCs的总含量在长期陈酿过程中明显升高,其中酯类种类最多、酸类含量最高,VFCs变化情况体现了SAV风味物质组成的复杂性以及在陈酿过程中物质产生、消退和变化的多样性;共筛选出13种可指示陈酿进度的VFCs,它们大多数正相关于陈酿时长,包括3-羟基-2-丁酮、四甲基吡嗪等,可作为表征SAV陈酿度的潜在指标,为进一步探究陈酿过程中VFCs成消机理以及靶向调控陈酿进度奠定基础。
SAV的15年陈酿时长可被划分为S1(新醋、陈酿1和2年)、S2(陈酿3、5和6年)、S3(陈酿8和10年)和S4(陈酿15年)4个阶段;OPLS-DA模型确定出2,3-丁二醇和丁二酸单甲基酯等、己酸苯乙酯和2-癸酸等、2,3-二甲基吡嗪和糠醇等、2,3,5-三甲基吡嗪和(R)-3-羟基丁酸等分别是S1~S4阶段的特征VFCs;2,3-丁二醇等7种物质、2,3-二甲基吡嗪等9种物质、4-羟基-2-丁酮等4种物质分别是S2与S1阶段、S3与S2阶段、S4与S3阶段的差异VFCs。综合多元统计结果,发现3-羟基-2-丁酮、糠醛、2,3-丁二醇和几种杂环类物质(四甲基吡嗪、2,3-二甲基吡嗪、2,3,5-三甲基吡嗪、2,4,5-三甲基恶唑)既可指示陈酿进度,又是某一阶段的特征物质,同时也是至少区分2个相邻阶段的差异物质,说明这些物质的含量变化具有一致性或协同性,可作为反映SAV陈酿进度或区分不同阶段的标志性VFCs。研究结果可为SAV陈酿进度的判断和调控提供理论依据和技术参考,今后可进一步研究这几种标志性物质在陈酿过程中的成消机理及其与风味品质的相关性。
[1] NIE Z Q, ZHENG Y, DU H F, et al.Dynamics and diversity of microbial community succession in traditional fermentation of Shanxi aged vinegar[J].Food Microbiology, 2015, 47:62-68.
[2] 林汲, 赵红年, 李圣云, 等.山西老陈醋新醋催陈工艺优化研究[J].中国酿造, 2019, 38(9):69-73.LIN J, ZHAO H N, LI S Y, et al.Optimization of accelerated aging technology of original Shanxi aged vinegar[J].China Brewing, 2019, 38(9):69-73.
[3] ZHU H, FALCONE P M, QIU J, et al.Effect of ageing on rheological properties and quality of Shanxi aged vinegar[J].IOP Conference Series:Earth and Environmental Science, 2020, 615(1):012096.
[4] XIA T, YAO J H, ZHANG J, et al.Evaluation of nutritional compositions, bioactive compounds, and antioxidant activities of Shanxi aged vinegars during the aging process[J].Journal of Food Science, 2018, 83(10):2638-2644.
[5] LIANG S, LIU Y, YUAN S, et al.Study of consumer liking of six Chinese vinegar products and the correlation between these likings and the volatile profile[J].Foods, 2022, 11(15):2224.
[6] 苗志伟, 刘玉平, 陈海涛, 等.两种陈酿期山西老陈醋挥发性成分分析[J].食品科学, 2010, 31(24):380-384.MIAO Z W, LIU Y P, CHEN H T, et al.Analysis of volatile components in Shanxi overmature vinegar with different aging periods[J].Food Science, 2010, 31(24):380-384.
[7] LIANG J J, XIE J C, HOU L, et al.Aroma constituents in Shanxi aged vinegar before and after aging[J].Journal of Agricultural and Food Chemistry, 2016, 64(40):7597-7605.
[8] 王宏霞. 不同陈酿年份四大名醋风味和功能性成分的比较[D].晋中:山西农业大学, 2021.WANG H X.Comparison of flavor and functional components of different aging years in the four famous Chinese vinegars[D].Jinzhong:Shanxi Agricultural University, 2021.
[9] 郑宇, 赵翠梅, 吴亚楠, 等.山西老陈醋风味物质组成特征及风味轮分析[J].食品科学技术学报, 2019, 37(4):24-34.ZHENG Y, ZHAO C M, WU Y N, et al.Composition of characteristic flavor components and analysis of flavor wheel for Shanxi aged vinegar[J].Journal of Food Science and Technology, 2019, 37(4):24-34.
[10] 陈建红, 沈海锋, 杨明, 等.陈酿时间对玫瑰醋挥发性风味物质的影响[J].食品工业科技, 2024, 45(3):270-276.CHEN J H, SHEN H F, YANG M, et al.Effect of aging time on volatile flavor substances of rosy vinegar[J].Science and Technology of Food Industry, 2024, 45(3):270-276.
[11] 穆晓静, 方冠宇, 蒋予箭.基于多元统计方法分析陈酿条件对浙江玫瑰醋香气成分的影响[J].食品科学, 2020, 41(14):262-270.MU X J, FANG G Y, JIANG Y J.Effect of aging conditions on volatile flavor compounds of Zhejiang rosy vinegar evaluated by multivariate statistical analysis[J].Food Science, 2020, 41(14):262-270.
[12] 范梦蝶, 王天泽, 杜文斌, 等.山西老陈醋晾晒前、后挥发性香味物质比较分析[J].中国食品学报, 2019, 19(12):229-242.FAN M D, WANG T Z, DU W B, et al.Comparison of volatile flavor compounds in Shanxi aged vinegar before and after aging[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(12):229-242.
[13] 简东振. 镇江香醋陈酿香气变化及其影响因素研究[D].镇江:江南大学, 2021.JIAN D Z.Study on aroma changes and influencing factors of Zhenjiang aromatic vinegar during aging[D].Zhenjiang:Jiangnan University, 2021.
[14] CALLEJ N R M, TORIJA M J, MAS A, et al.Changes of volatile compounds in wine vinegars during their elaboration in barrels made from different woods[J].Food Chemistry, 2010, 120(2):561-571.
N R M, TORIJA M J, MAS A, et al.Changes of volatile compounds in wine vinegars during their elaboration in barrels made from different woods[J].Food Chemistry, 2010, 120(2):561-571.
[15] LIU L C, HU H Y, YU Y P, et al.Characterization and identification of different Chinese fermented vinegars based on their volatile components[J].Journal of Food Biochemistry, 2021, 45(3):e13670.
[16] CHEN T, GUI Q, SHI J J, et al.Analysis of variation of main components during aging process of Shanxi Aged Vinegar[J].Acetic Acid Bacteria, 2013, 2(1s):31-38.
[17] AL-DALALI S, ZHENG F P, LI H H, et al.Characterization of volatile compounds in three commercial Chinese vinegars by SPME-GC-MS and GC-O[J].LWT, 2019, 112:108264.
[18] ROCHA S M, COIMBRA M A, DELGADILLO I.Occurrence of furfuraldehydes during the processing of Quercus suber L.cork.Simultaneous determination of furfural, 5-hydroxymethylfurfural and 5-methylfurfural and their relation with cork polysaccharides[J].Carbohydrate Polymers, 2004, 56(3):287-293.
[19] GONG M, ZHOU Z L, LIU S P, et al.Formation pathways and precursors of furfural during Zhenjiang aromatic vinegar production[J].Food Chemistry, 2021, 354:129503.
[20] CHARNOCK H M, PICKERING G J, KEMP B S.The Maillard reaction in traditional method sparkling wine[J].Frontiers in Microbiology, 2022, 13:979866.
[21] XU S Z, MA Z W, CHEN Y, et al.Characterization of the flavor and nutritional value of coconut water vinegar based on metabolomics[J].Food Chemistry, 2022, 369:130872.
[22] 张磊, 王争争, 李婷, 等.不同陈酿时间山西老陈醋中功能成分的变化分析[J].中国调味品, 2015, 40(6):43-46.ZHANG L, WANG Z Z, LI T, et al.Analysis of functional components during aging process of Shanxi aged vinegar[J].China Condiment, 2015, 40(6):43-46.
[23] TESFAYE W, MORALES M L, GARC A-PARRILLA C M, et al.Optimising wine vinegar production:Fermentation and ageing[J].Applied Biotechnology Food Science and Policy, 2003, 1:109-114.
A-PARRILLA C M, et al.Optimising wine vinegar production:Fermentation and ageing[J].Applied Biotechnology Food Science and Policy, 2003, 1:109-114.
[24] LIANG S D, XU C S, ZHOU T, et al.Tetramethylpyrazine inhibits ATP-activated currents in rat dorsal root ganglion neurons[J].Brain Research, 2005, 1040(1-2):92-97.
[25] WANG H, LIU Z Q, WANG S Y, et al.UHPLC-Q-TOF/MS based plasma metabolomics reveals the metabolic perturbations by manganese exposure in rat models[J].Metallomics, 2017, 9(2):192-203.