单核细胞增生李斯特菌(Listeria monocytogenes,LM)是一种革兰氏阳性食源性致病菌。LM引发健康人群患李斯特菌病相对罕见,但在易感人群(孕妇、新生儿以及65岁以上的人群)和极易感人群(免疫功能低下的人群,如艾滋病患者、癌症患者和器官移植患者)中易引发侵袭性李斯特菌病,导致脑膜炎、败血症、孕妇的流产、死产或胎儿出生缺陷等,致死率高达20%~30%[1]。2017—2018年,南非爆发了历史上最严重的LM事件,其中937例确诊病例中有193例死亡[2]。2021年,美国4个州爆发了由奶酪引起的单增李斯特菌病13例,其中1例死亡[3]。2018—2020年间,北京发现李斯特菌病106例[4]。以上流行病学数据表明,LM严重威胁人类健康,因此,控制LM食品污染对保障全球公众健康至关重要。
LM对不利环境耐性较强,能耐高盐、低温、低氧浓度和低pH值,可以在食品加工厂内的环境生态位中持续数十年。LM多在各种生食、乳制品和即食食品中被检出。2001—2020年期间,中国、美国、伊朗等在内的多个国家中,LM在生鱼和即食食品中的污染率分别为5.8%和14.5%[5]。近年研究显示,LM对抗生素、消毒剂和其他生物防治剂的耐受性有增强的趋势。25株LM定期暴露在苯扎氯铵(benzalkonium chloride,BC)后耐受性增加,其最小抑菌浓度(minimal inhibit concentration,MIC)显著增加了5倍[6]。2013—2014年期间,在土耳其博卢分离的LM对头孢曲松钠、氨苄西林和青霉素耐药,耐药率分别为79.7%、17.9%和1.6%[7]。2019—2021年上海市嘉定区零售禽肉中LM对头孢西丁、克林霉素、苯唑西林、四环素的耐药率分别为100%、17.07%、17.07%和12.20%[8]。天然抑菌剂主要来源于动物、植物和微生物,均有较强的抗菌作用,但植物来源的抑菌剂易提取、耐药性低、稳定性好,且抗菌范围更广,与多糖、萜类、生物碱等植物成分相比,多酚在植物提取物中的含量相对较高,具有广泛的应用前景。筛选和开发天然物质作为抑菌添加物代替抗生素,控制LM的耐药性,并有效抑制食品中的LM污染,已成为新的研究热点和未来食品工业的发展趋势。
植物多酚是植物中的天然酚类结构化合物,因具有潜在的抗氧化、抗炎、抗菌和抗癌活性受到研究者的关注。多酚类化合物可根据结构的复杂程度将其分为单体和多聚体,一般分为五类,分别是黄酮类、茋类、酚酸类、木脂素类化合物和植物精油,酚环的数量和结构特征使每种酚类物质具有独特的物理、化学和生物学性质。植物多酚通常通过破坏细菌的细胞膜,引起细胞内功能的变化,破坏细胞的完整性从而抑制细菌生长。由于多酚物质的健康益处和对LM等食源性致病菌的抑菌作用,开发可用于食品中的多酚类抑菌剂将有可能成为未来替代化学或合成抑菌剂的有效策略。
目前,植物多酚抑制LM的研究中主要集中在抑菌效果的评价、抑菌机制的解析以及在食品中的应用效果等方面。近年来,2种以上植物多酚复配或植物多酚与其他抑菌剂联合使用,被发现在不同的食物基质中能够获得比植物多酚的单一使用更优的抑菌效果,因此在抑制LM方面取得了较多的研究进展。虽然国内外已有一些研究者针对植物多酚抑制LM作用进行了综述性讨论,但对植物多酚对LM的联合抑菌、抑制LM生物膜等方面的讨论和回顾还不够完善,也缺少对抑菌机制进展的系统性总结。本综述首先总结了植物多酚的分类、结构和生物活性;其次,总结并讨论了植物多酚对LM生长和生物膜形成的抑制效果,并强调在不同类型食品基质中直接或与其他手段联用时对LM的抑制作用。最后,重点综述并讨论了植物多酚对LM的抑制机制。本文将为进一步开展植物多酚抑制LM的研究以及未来植物多酚作为食品抑菌剂的应用提供科学参考。
1 植物多酚的来源及其分类
1.1 黄酮类化合物
黄酮类化合物是植物不同部位产生的最大一类小分子次生代谢物之一(超过6 000种不同的羟基化多酚),在植物中起到对抗微生物感染等环境胁迫以及调节细胞生长的作用。所有黄酮类化合物均来源于芳香族氨基酸、苯丙氨酸和酪氨酸,由2个苯环通过3个碳原子连接作为其基本骨架(C6-C3-C6),通常以苷类糖苷的形式积聚在植物细胞的液泡中(表1)。黄酮的性质取决于基本骨架上羟基、甲氧基和糖苷侧基的排列,一般基于中心杂环的氧化程度将黄酮类化合物分为7个亚类:黄酮醇、黄酮、异黄酮、花青素、黄烷酮、黄烷醇和查尔酮[9]。研究表明,黄酮类化合物对病原微生物具有抑制作用,例如,耐甲氧西林金黄色葡萄球菌、表皮葡萄球菌、粪肠球菌、大肠杆菌等,可以通过破坏细菌细胞膜的完整性、抑制电子传递链和ATP合成、螯合金属离子、抑制细菌毒素等方式抑制细菌生长[10]。
表1 植物多酚分类
Table 1 Classification of plant polyphenols

多酚化合物名称碳架结构主要化合物黄酮类黄酮黄酮醇黄烷酮黄烷醇C6-C3-C6芹菜素、木犀草素、黄岑黄素、白杨素槲皮素、杨梅素、芦丁、山奈酚、高良姜素柚皮素、橙皮素儿茶素、表儿茶素、表没食子儿茶素、表儿茶素没食子酸酯、表没食子儿茶素没食子酸酯、原花青素(缩合单宁)酚酸类羟基苯甲酸类C6-C1羟基苯甲酸、没食子酸、原儿茶酸、鞣花酸、可水解的单宁(没食子单宁、鞣花单宁)羟基肉桂酸类C6-C3肉桂酸、香豆酸、芥子酸、没食子酸、香草酸、丁香酸、丁香苷、阿魏酸、咖啡酸、绿原酸、迷迭香酸、姜黄素二苯乙烯类(茋类)二苯乙烯C6-C2-C6白藜芦醇、白藜芦醇-反式-二氢二聚体木脂素类木脂素(C6-C3)n新木脂素类、芥子醇、松伯醇植物精油挥发油丁香酚、香芹酚、百里香酚、薄荷醇
1.2 酚酸类化合物
酚酸类是植物中主要酚类之一,以酯、糖苷或酰胺的形式存在,但很少以游离形式存在。酚酸通常是具有2种不同碳框架的化合物,即羟基肉桂酸和羟基苯甲酸,其变化主要是芳香环上羟基的数量和位置。羟基苯甲酸由苯甲酸生成,具有共同的C6-C1结构,最常见包括没食子酸、香草酸、丁香酸和原儿茶酸。另一方面,羟基肉桂酸具有C6-C3结构,常见的有咖啡酸、阿魏酸、对香豆酸和芥子酸(表1)。此外,不同酚酸表现出不同的抗菌和抗氧化特性,这主要受到羟基和甲氧基官能团以及芳香环上取代基的影响。与羟基苯甲酸相比,羟基肉桂酸的抗菌作用更强。例如,绿原酸对大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌、核盘菌和灰霉菌都有较好的抑制作用。
1.3 木脂素类化合物
木脂素是植物中普遍存在的双酚类化合物,由2种针叶醇(单木质醇)残基通过植物细胞壁中苯丙素的生化途径结合而成,是一种具有光学活性的天然二聚体化合物。木脂素的分子骨架仅有2个苯丙烷(C6-C3)单元(表1),其结构多样性源于2个苯丙烷单元的各种连接模式,苯丙烷单元在β-β位置连接形成二聚体,在70多个植物科中已经描述了200多种不同的木脂素。木脂素在植物中发挥对病原体和害虫入侵的防御功能,也具有潜在的抗氧化、抗炎活性、抗肿瘤、抗病毒等生理活性,对结核分枝杆菌、表皮葡萄球菌有抑制作用[11]。
1.4 二苯乙烯类化合物
二苯乙烯类化合物又称茋类化合物,多存在于葡萄科、豆科、荆芥科和龙脑香科等植物科,是植物为了抵御外部压力(如病毒、真菌和细菌的攻击)而合成的植物抗毒素。二苯乙烯类化合物的基本结构由14个碳原子(C6-C2-C6)组成(表1),其中双键乙烯桥连接2个苯基环,2个环中的1个环含有2个羟基,而另一个环可能在不同位置具有取代的羟基或甲氧基。白藜芦醇(resveratrol,RSV)来源于各种植物,如葡萄藤、松树、浆果、豆类,石榴、花生和大豆是研究最广泛的二苯乙烯类化合物[12]。RSV是1种天然抗菌剂,对LM、金黄色葡萄球菌、大肠杆菌、鼠伤寒沙门氏菌等食源性致病菌表现出抑菌活性。此外,可通过羟基化、甲氧基化、糖基化或异戊二烯化等化学改变提高天然二苯乙烯类化合物的效力和理化性质,表现出更广泛的生物活性,包括抗癌、抗菌、抗氧化、抗血小板聚集和植物毒性[13]。
2 植物多酚对LM生长的抑菌效果
单一酚类物质或植物提取的含酚类混合物对LM的抑菌效果如表2所示。在单一酚类中,与其他单一酚相比,香芹酚在相对低的浓度下就可抑制LM的生长,且香芹酚最小抑菌浓度(minimal inhibit concentration,MIC)与最低杀菌浓度(minimum bactericidal concentration,MBC)的浓度相同;在植物提取物中,有效成分为酒石酸的葡萄籽提取物MIC值最低,对LM的抑制作用最好,而在所获得的MBC数据中,山核桃提取物MBC的范围相对较低。蓝莓提取物在高浓度下能够有效抑制LM的生长。在绿茶、白茶、红茶提取物中,白茶的抑菌圈直径更大,而废咖啡提取物的抑菌圈直径范围则大于绿茶、白茶、红茶提取物,相较之下对LM的抑制效果更强。
表2 植物多酚抑制LM效果
Table 2 Inhibitory effect of plant polyphenols on LM
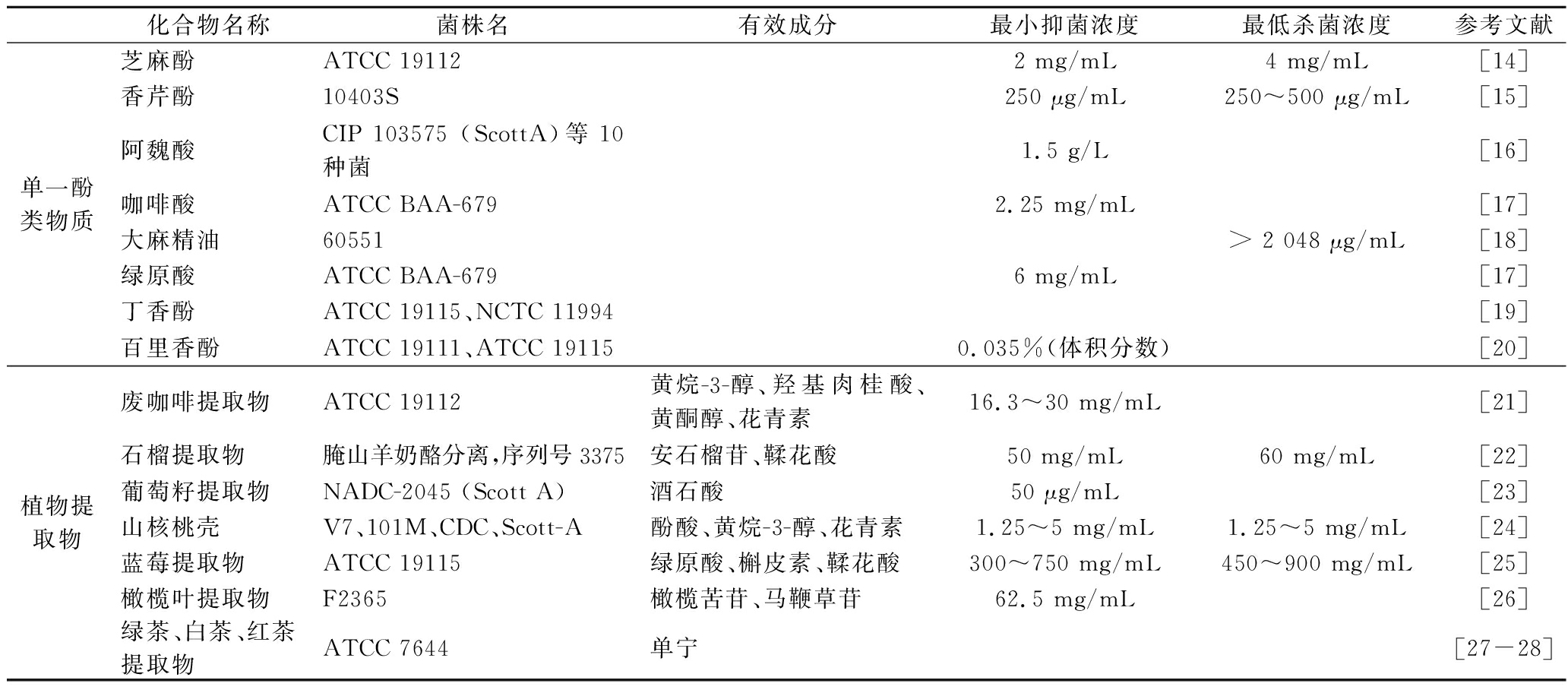
化合物名称菌株名有效成分最小抑菌浓度最低杀菌浓度参考文献单一酚类物质芝麻酚ATCC 191122 mg/mL4 mg/mL[14]香芹酚10403S250 μg/mL250~500 μg/mL[15]阿魏酸CIP 103575 (ScottA)等10种菌1.5 g/L[16]咖啡酸ATCC BAA-6792.25 mg/mL[17]大麻精油60551> 2 048 μg/mL[18]绿原酸ATCC BAA-6796 mg/mL[17]丁香酚ATCC 19115、NCTC 11994[19]百里香酚ATCC 19111、ATCC 191150.035%(体积分数)[20]植物提取物废咖啡提取物ATCC 19112黄烷-3-醇、羟基肉桂酸、黄酮醇、花青素16.3~30 mg/mL[21]石榴提取物腌山羊奶酪分离,序列号3375安石榴苷、鞣花酸50 mg/mL60 mg/mL[22]葡萄籽提取物NADC-2045 (Scott A)酒石酸50 μg/mL[23]山核桃壳V7、101M、CDC、Scott-A酚酸、黄烷-3-醇、花青素1.25~5 mg/mL1.25~5 mg/mL[24]蓝莓提取物ATCC 19115绿原酸、槲皮素、鞣花酸300~750 mg/mL450~900 mg/mL[25]橄榄叶提取物F2365橄榄苦苷、马鞭草苷62.5 mg/mL[26]绿茶、白茶、红茶提取物ATCC 7644单宁[27-28]
表3 植物多酚对LM生物膜的抑制作用
Table 3 Inhibitory effect of plant polyphenols on LM biofilm

化合物名称有效成分化合物浓度菌株名抑菌途径食品接触表面抑制效果参考文献植物提取物桑苷光合色素6.25、12.5、25 μg/mLATCC 19111、ATCC 19112、ATCC 19115抑制细胞-表面相互作用和细胞-细胞相互作用24孔微量滴定板生物膜降低量60%~90%[31]橄榄叶提取物橄榄苦苷7.8 mg/mLF2365消除LM鞭毛96孔微量滴定板略微抑制生物膜形成[26]丁香提取物丁香酚25、12.5、6.25 g/LATCC 19615肉桂提取物肉桂醛25、12.5、6.25 g/LATCC 19615降低细胞外DNA的合成、下调生物膜中毒力基因的表达聚苯乙烯表面丁香热/冷提取物(2.5%~0.625%)显著降低生物膜中的活菌量(P<0.5)[38]聚苯乙烯表面肉桂热提取物(2.5%~0.625%)显著降低生物膜中的活菌量(P<0.5)[38]单一酚类物质大麻精油256、128、64 μg/mL60551、66785、75227、82468、97885、02470、09707、56053、31829、77660、80466下调编码鞭毛运动基因96孔微量滴定板256、128、64 μg/mL的大麻精油可以分别减少25%~69%、32%~73%和15%~65%的生物膜[18]阿魏酸>5 000 μg/mLATCC 15313没食子酸>5 000 μg/mLATCC 15313破坏细胞质膜稳定性和通透性、抑制细菌外排泵功能、抑制细菌Ⅱ型脂肪酸的合成以及与蛋白质的相互作用聚苯乙烯表面生物膜代谢活性降低 12%[34]聚苯乙烯表面生物膜代谢活性降低 99.5%[34]香芹酚0.10%和0.12%(体积分数)ATCC 19113减少细胞外聚合物基质聚丙烯表面/MBECTM板生物膜减少量为2.86和3.81 lg CFU/peg(MBECTM板)、3.65和4.26 lg CFU/cm2(聚丙烯表面)[36]麝香香酚0.08%(体积分数)ATCC 19113、ATCC 19117、ATCC 15313丁香酚0.30%(体积分数)ATCC 19113、ATCC 19117、ATCC 15313改变生物膜中的细胞形态橡胶表面/MBECTM板减少量为2.3 lg CFU/cm2(橡胶表面)和2.4 lg CFU/peg(MBECTM板)[37]橡胶表面/MBECTM板减少量为1.5 lg CFU/cm2(橡胶表面)和1.6 lg CFU/peg(MBECTM板)[37]
植物多酚种类十分丰富,已有不少研究探讨了植物多酚单一化合物或混合酚类对LM的作用。在这些研究中,多使用标准菌株作为研究对象,而对包括耐药菌、不同分子分型菌株、食品或临床的分离株的研究不足。另外,大部分研究多以培养基等理想介质作为研究基质,对复杂食品体系中多酚的应用效果研究有待开展。
3 植物多酚对LM生物膜形成的抑制作用
生物膜是嵌入自产细胞外聚合物(extracellular polymeric substances,EPS)(包括蛋白质、多糖和细胞外DNA)的细菌细胞的无柄群落。生物膜中的LM,在食品加工环境中比浮游LM相比耐受性增强,难以用普通方法去除,可对食品造成持续污染。在黏附到接触表面的数分钟至数小时内,可以依靠范德华力、静电力或疏水作用力等作用去除LM生物膜,此后LM会通过共价键或离子键与接触表面形成更强的作用力,此时只能通过剪切力或化学法破坏其附着能力而去除生物膜[29]。由于LM可以黏附在食品(蔬菜、水果和肉类)和食品接触材料(不锈钢、聚苯乙烯、橡胶和玻璃)上形成生物膜,污染食品,因此,控制食品和食品加工环境中LM的生物膜形成,对保障食品安全极为重要。
植物多酚可以抑制LM生物膜的形成。例如MARINI等[18]研究表明在所测试的11株菌株中,256、128、64 μg/mL的大麻精油可以分别减少25%~69%、32%~73%和15%~65%的生物膜。LIU等[30]研究表明肉桂醛、丁香酚、白藜芦醇和百里醌能分别在80、160、50、6.25 μg/mL的质量浓度下有效抑制牛肉加工厂中LM 118的生物膜形成。黄酮类化合物主要通过抑制细菌运动和初始黏附等机制抑制LM形成生物膜。SIVARANJANI等[31]发现桑苷(2,3,4,5,7-五羟基黄酮)在细菌生物膜形成的早期阶段,可能通过抑制细胞-表面相互作用和细胞-细胞相互作用,影响细胞在生物和非生物表面的初始黏附,进而抑制LM的初始生物膜形成。另外,由于鞭毛的存在会影响细菌的黏附作用,因此鞭毛对LM的生物膜形成至关重要。例如,橄榄叶提取物(olive leaf extract,OLE)在7.8 mg/mL质量浓度下略微抑制LM中生物膜的形成,这可能与其能消除LM鞭毛相关[26]。葡萄茎提取物含有丰富的黄酮类化合物和酚酸类化合物,不同酚类化合物(没食子酸、儿茶酚、2-羟基肉桂酸、咖啡酸、香草酸、丁香酸、对库马酸、阿魏酸、芸香苷、槲皮素)通过相互作用,抑制细菌运动并改变细菌表面能,从而抑制LM对食品接触物表面的黏附和生物膜的形成[32]。GEMMELL等[33]研究发现19种浓度为50 μmol/L的黄酮可以抑制血清型分别为4b和1/2b的2株LM在不锈钢板上形成的生物膜。
酚酸类物质可以通过作用于细菌的细胞膜、抑制细菌合成蛋白质等细胞外聚合物来抑制生物膜的形成。BORGES等[34]研究阿魏酸和没食子酸对LM生物膜形成的作用,发现二者通过破坏细胞质膜稳定性和通透性、抑制细菌外排泵功能、抑制细菌Ⅱ型脂肪酸的合成以及与蛋白质的相互作用抑制生物膜的形成。KIM等[35]研究了咖啡酸、阿魏酸和芥子酸接枝壳聚糖对LM的抗菌潜力,并观察到酚酸接枝壳聚糖比未修饰的壳聚糖呈现出更好的抗菌和抗生物膜活性,这主要是由于酚类接枝增加LM细胞膜的通透性进而降低了生物膜的黏附性。总之,酚酸类物质单独或与其他材料联合使用对LM生物膜的形成都能够有很好的抑制作用。
植物多酚不仅可以破坏LM细胞形态,而且可以影响LM细胞内各物质的合成和基因表达,从而抑制LM生物膜的形成。ASHRAFUDOULLA等[36]发现用0.10%(体积分数)和0.12%(体积分数)的香芹酚可通过减少细胞外聚合物基质,改变生物膜的细胞表面形态,发挥对LM的抗生物膜作用。HOSSAIN等[37]研究表明麝香草酚和丁香酚显著改变生物膜中的细胞形态并抑制生物膜的形成,可能与干扰细菌运动和菌落形成、影响参与生物膜形成过程的基因表达、降解群体感应(quorum sensing,QS)信号分子有关。BANERJI等[38]研究发现丁香和肉桂水2种香料提取物可以通过降低细胞外DNA的合成、下调生物膜中毒力基因的表达,显著分散LM形成的生物膜,降低LM的活力。
综上,植物多酚对LM生物膜的形成有很好的抑制作用,其中对酚酸、黄酮、和植物精油抑制LM生物膜的研究相对较多,对茋类和木脂素类抑制LM生物膜的研究相对较少,今后可以开展茋类和木脂素类多酚对LM生物膜的抑制效果。在生物膜形成的初始和成熟阶段,酚类化合物对生物膜的抑制效果有很大差异。因此,探究植物多酚对生物膜的抑制机制可详细到生物膜形成的不同阶段。另外,大部分研究集中在植物多酚对生物膜形成初期阶段的抑制效果评价方面,而对已形成的生物膜清除效果方面研究较少。目前大多研究表明,植物多酚对不锈钢片等材料上的LM生物膜有抑制作用,对LM在不同材料上生物膜抑制的研究有待验证。此外由于LM也可在食品表面形成生物膜,因此也有必要深入研究植物多酚对食物基质中生物膜的抑制效果,并强化食物基质中植物多酚的稳定性和安全性研究。
4 植物多酚抑制LM的机制
4.1 抑制LM的运动和生长
植物多酚能够通过限制鞭毛发挥作用从而降低LM的运动能力,导致LM无法获取营养,生长受到限制(图1)。研究显示,橄榄叶提取物含有橄榄苦苷和马鞭草苷,62.5 mg/mL提取物可以完全抑制LM的生长,单独使用25 mg/mL的橄榄苦苷和马鞭草苷对LM的生长抑制率分别为94%和100%,这种抑制作用与细菌鞭毛消除,细菌运动性降低有关[26]。由于LM可以通过鞭毛泳动获取营养来源,BORGES等[34]研究发现,在接种阿魏酸和没食子酸24 h后会导致LM泳动的完全抑制,这2种酚酸均能抑制细菌的运动和黏附能力。肉桂提取物含有肉桂醛、肉桂酸、丁香酚和精油多种代谢物,栗子壳含有单宁和儿茶素等酚类化合物,PARK等[39]研究发现将肉桂提取物和栗子壳提取物与ε-聚赖氨酸混合使用可以降低LM的疏水性、自动聚集和泳动能力,从而抑制LM的生长。

图1 植物多酚抑制LM的机制
Fig.1 Mechanism of inhibition of LM by plant polyphenols
研究表明植物精油也可以抑制LM的运动,降低LM在表面的扩散范围。COIMBRA等[40]研究发现百里香精油对3株LM LMG 13305、LMG 16779和LMG 16780具有较高的抑菌活性,使这3株LM的运动直径分别从(14.63±0.50)、(17.22±2.12)、(13.12±0.97) mm 减小到(9.18±0.60)、(6.85±1.13)、(6.66±0.84) mm。MARINI等[18]研究发现,大麻精油对所测试的11株LM中均有抑制作用,与对照组相比,256 μg/mL的大麻精油可以使11株LM菌落直径显著减小50.0%~79.8%,并且菌株没有显示出典型的伞状生长。大麻精油存在时LM易形成聚集体,其鞭毛被困在簇内,因此电镜下观察到的鞭毛较少,说明大麻精油可以抑制LM的运动性。百里醌是植物精油的活性成分,MIAO等[41]研究发现百里醌对所测试的6株不同LM的MIC为6.25~12.50 μg/mL,且百里醌质量浓度为0.39、0.78、1.56 μg/mL时,细菌的泳动能力与对照组相比分别减少了25.35%、37.33%和38.02%。因此,植物多酚可以通过限制细菌鞭毛运动、降低细菌疏水性、自动聚集和泳动能力等方式抑制LM生长,这种抑菌机制有助于控制LM形成生物膜,然而在生物膜形成上是否具有明确的抑制作用还需要进一步验证。
4.2 干扰LM的细胞膜功能
细菌的细胞质膜负责渗透调节、呼吸和运输过程、肽聚糖的生物合成和交联以及脂质的生物合成,为了完成所有这些功能,膜的完整性是一个先决条件,膜的破坏会直接或间接地导致代谢功能障碍,最终导致细菌死亡。酚类物质的抑菌活性与羟基官能团的存在有关,羟基通过氢键与细菌的细胞膜相互作用,可导致细菌去极化,影响质子动力势,改变细胞膜通透性,从而导致细胞死亡,酚类化合物中羟基的相对位置会影响其抑菌功效。
植物多酚作用于LM的细胞壁和细胞膜,影响细胞壁和细胞膜的正常功能(图1)。BISHA等[23]研究表明葡萄籽提取物中含有丰富的原花青素,在pH 3.5~7.0对LM都有较好的抗菌活性,较低和较高浓度的葡萄籽提取物分别通过改变细胞膜的通透性导致细胞裂解来破坏细胞膜的完整性,从而导致LM细胞受损和细胞内核酸物质的释放,抑制LM的生长。BORGES等[42]研究了没食子酸和阿魏酸对LM细胞膜的作用,发现没食子酸和阿魏酸可以改变细胞膜的疏水性,导致细胞膜表面负电荷减少、细胞膜局部破裂、膜孔洞形成、细胞内成分泄漏,最终使细胞死亡。DE SOUSA GUEDES等[43]研究发现,0.625 μL/mL薄荷精油直接掺入菠萝汁和芒果汁中,可通过破坏细胞质膜、增加通透性和细胞膜去极化以及抑制外排泵和呼吸活性的多个靶点使LM细胞失活,从而减少果汁中的细菌数量。植物多酚改变了细胞膜的通透性并使其裂解从而使细胞死亡达到对LM的抑制作用。
植物多酚会干扰LM细胞表面电荷,引起膜电位变化,使细胞发生超极化或去极化来破坏细胞膜上的各项生理活动(图1)。LIU等[44]研究发现4-羟基苯乙酸能完全抑制LM ATCC 19115生长的最低浓度为15.61 mmol/L,4-羟基苯乙酸可以通过破坏细胞膜,扰乱细胞表面电荷,导致电解质泄漏增加,从而抑制LM的生长。LI等[45]研究表明,异硫氰酸苄酯(benzyl isothiocyanate,BITC)和白藜芦醇协同处理能很好抑制LM的活性,其通过破坏细胞膜,使更多的抑菌物质进入细胞,并诱导细胞内活性氧(reactive oxygen species,ROS)激增,细胞膜超极化,发挥抑菌作用。BAI等[46]研究表明,百里醌和乳酸链球菌素联用能够作用于细胞膜,通过引起膜电位的改变,破坏膜的完整性和功能,抑制LM的活性,并且二者联用比单独使用抑菌能力更强。CHURKLAM等[15]研究发现,香芹酚可以多靶点作用于细菌细胞壁和细胞膜,通过增加细菌膜的通透性和细胞膜去极化,破坏细胞膜导致细胞裂解,抑制细菌的呼吸活动和核苷酸代谢。MORA-PALE等[47]发现,白藜芦醇-反式二氢二聚体(茋类化合物白藜芦醇的一种氧化产物)可以通过扰乱膜电位并且抑制DNA旋转酶阻碍DNA合成来引起细胞形态的改变。因此,对细菌细胞膜的作用被认为是植物多酚抑制细菌生长或生物膜形成的主要机制之一。
植物多酚会干扰LM细胞内蛋白质和ATP合成,引起细胞代谢紊乱,从而抑制LM的活力(图1)。细菌中蛋白质组的适应和形成主要涉及细胞周期控制、细胞分裂、细胞运动、碳水化合物、丙酮酸、核苷酸和氮代谢、辅助因子和维生素以及应激反应等。LANCIOTTI等[48]评估了亚致死剂量的抗菌剂(乙醇、柠檬醛、香芹酚、E-2-己烯醛和百里香精油)处理对LM Scott A中蛋白组学的影响,经抗菌物质处理1 h后LM中有223个蛋白点的蛋白质合成水平增加或减少,其中,细胞形状决定蛋白MreB、碳水化合物代谢蛋白、核苷酸和氮代谢相关蛋白质的表达水平均降低,影响LM的正常生长。在细胞呼吸作用中,细胞膜上电子传递链产生跨膜质子梯度,这是合成ATP所必需的,这个过程由具有ATP酶活性的多种酶催化,而植物多酚能破坏细胞膜使ATP流失、干扰质子动力、改变ATP酶构象、或抑制ATP酶相关亚基的表达,进而影响ATP合成[49]。GILL等[50]研究显示,5 mmol/L的丁香酚和40 mmol/L肉桂醛能抑制葡萄糖缺乏培养基中LM生成ATP,而在葡萄糖丰富的培养基中培养后,仅有肉桂醛处理与细菌的细胞膜相互作用,造成细胞内离子泄露,从而分散质子动力,导致LM细胞内ATP快速消耗。同样OUSSALAH等[51]也发现牛至精油和冬香草精油可以破坏LM的细胞膜,诱导细胞内ATP浓度的消耗。GONG等[52]研究发现含有多酚的甜菜根提取物可以降低LM细胞内ATP和ROS的表达水平,影响细胞膜电位,使细胞膜快速去极化,从而影响细胞正常生理活动。虽然多数研究发现,植物多酚作用下细胞内外ATP浓度发生显著改变,但是其影响该ATP合成通路的关键位点,或与ATP合成酶的相互作用机制,仍需要进一步探索。
4.3 调控LM相关毒力基因
植物多酚可以调控LM相关基因的表达,降低LM的生长、生物膜形成能力以及毒力水平(图1)。研究发现,0.78、1.56 μg/mL百里醌可以显著下调prfA(转录调节因子编码基因)、flaA(鞭毛蛋白基因)、agrA(QS反应调节因子)、hly(李斯特菌溶菌素O基因)和sigB(应激反应因子)的转录,降低与宿主细胞的黏附和侵袭有关的plcB(磷脂酰胆碱磷脂酶编码基因)和inlB(内化蛋白调控基因)的转录水平,进而降低细菌的毒力、生长和生物膜形成能力[41]。2 mg/mL芝麻酚也被证明可以通过显著下调生物膜黏附蛋白基因bapL、毒力基因plcB的表达抑制生物膜的形成,也可通过显著下调毒力基因inlA、inlB、actA、hly、sigB和prfA的表达,抑制LM对HepG2、Caco-2和BeWo细胞的体外黏附和入侵作用[53-54]。GUAN等[55]研究了肉桂醛在低温下对猪肉中LM的抑制作用,发现在4 ℃下添加1 μL/g肉桂醛可以抑制抗逆性相关基因sigB、luxS、cspA、cspB和cspD的表达,降低关键毒力调控基因prfA的表达水平。PARK等[39]研究发现,将肉桂提取物和栗子壳提取物与ε-聚赖氨酸混合使用可以降低LM鞭毛蛋白基因flaA、关键毒力调控基因prfA、细菌表面蛋白基因inlA的表达水平。MARINI等[18]发现,256 μg/mL的大麻精油可以通过下调prfA,以及与运动相关基因flaA、motA和motB的表达量,降低LM对人体Caco-2细胞的侵袭效率(从25.9%到97%)。LIU等[44]在研究中也发现,4-羟基苯乙酸可降低LM三种毒力因子(prfA、hlyA和inlA)的表达水平。BANERJI等[38]发现12.5 g/L的丁香和肉桂混合提取物可以显著降低LM毒力调控基因(lapB、actA、flaA、prfA和inlA)的表达。CUI等[56]研究表明,辣木油处理可以在不同程度上降低LM毒力基因(prfA、plcA、hly、actA、plcB、inlA和inlB)的表达,从而抑制LM的活性。ZHANG等[57]研究表明丁香精油处理可以下调agrA、agrC、agrD、prfA基因的表达水平,上调sigB基因的表达水平,从而调控生物膜的形成。因此,植物多酚对LM的抑制作用可能是一个涉及多基因参与的协同调控过程。植物多酚通过影响LM毒力调控基因、抗逆相关基因、群体感应和运动相关基因的表达,干扰LM的正常生长、生物膜形成以及后续对宿主的毒力潜力。植物多酚相比其他化学抑菌剂或物理抑菌手段而言,作用较为温和,多数情况不能快速、完全的杀灭细菌,因此植物多酚作用下是否能降低菌株的毒力也是植物多酚抑菌研究中的重要评估部分,因此在验证植物多酚抑菌效果的基础上进一步全面评估它对LM毒力表达的影响也是重要的研究方向。
上述研究显示,酚酸和精油类多酚的抑菌机制主要归为对LM运动性的抑制作用。酚酸、精油、黄酮及茋类多种植物多酚主要通过有效干扰LM细胞膜功能发挥抑菌作用。其中,酚酸和精油类植物多酚同时能通过调控LM相关毒力抑制细菌毒性。不同种类的植物多酚对LM的抑菌机制存在差异,今后可从分子层面全面解析不同结构特征多酚类物质的分子机制。
5 酚类物质在联合抑菌中的作用
5.1 酚类物质与其他抑菌剂联用的效果
很多植物多酚已被证明对LM具有很强的抑制作用,也有部分多酚虽然可以抑制LM的生长,但抑制效果较为微弱,所以,近年针对2种及以上的多酚联合使用或多酚与其他抑菌剂联合使用对LM抑菌效果的研究成为了新的研究热点。多数研究已经证明相比单一酚类化合物,几种化合物联用可能起到相加或协同抑菌的效果。APOSTOLIDIS等[58]研究了牛至-蔓越莓(主要酚类化合物为鞣花酸和迷迭香酸)协同使用,在添加乳酸钠时的抗菌潜力,发现在肉汤和肉类中牛至-蔓越莓(50∶50)溶液在0.75 g/L的最终使用浓度和20 g/L的乳酸钠联用相比单独使用,更好地抑制了LM的生长。LI等[45]研究表明,白藜芦醇与有机硫化物异硫氰酸苄酯联用能明显减缓25、4 ℃鸡肉中LM的生长。酚类物质与其他抗菌物质的联用,一方面可以起到提高或维持抑菌效果的作用,另一方面可以减少食品中化学防腐剂或抗生素的使用量。例如,为了减少肉制品中可危害人类健康的亚硝酸盐用量,XI等[59]发现添加蔓越莓粉和葡萄籽提取物对熟肉(亚硝酸盐处理过的腌制熟肉)进行处理,不仅可以显著减少LM的生长,而且与硝酸盐单独使用相比,蔓越莓处理使亚硝酸盐的残留量更低。
另外,酚类物质还可以弥补一些常用抗菌物质的LM抗性、复杂食品体系LM抑菌能力不足等缺点。其中与乳酸链球菌素(Nisin)的相关研究最多。例如WU等[60]研究发现,芝麻酚和乳酸链球菌素对LM的生长具有显著的协同抑制作用,其中芝麻酚可以弥补乳酸链球菌在中性和碱性条件下的食物或某些特定的真实食物介质(如牛奶)中无法发挥作用的缺陷。RUIZ等[61]研究了乳酸链球菌素、迷迭香在4 ℃下对接种在即食真空包装火鸡丁火腿上的LM的抗菌活性,0.5%乳酸链球菌素+1%迷迭香和0.5%乳酸链球菌素+20 mmol/L EDTA+1%迷迭香处理在第0天时,使LM的数量分别减少了4.20、4.11 lg CFU/g。CHURKLAM等[15]研究表明,将香芹酚(62.5 μg/mL)和乳酸链球菌素(25 μg/mL)添加到香肠中,可抑制香肠中LM的生长,与单独使用乳酸链球菌素或单独使用香芹酚相比,组合处理的样品在贮藏4 d后,细菌的生长率显著降低。HOSSAIN等[37]研究也表明,与单一抗菌剂相比,250 IU/mL的乳酸链球菌素与百里酚和丁香酚联合使用能发挥更强的抗生物膜活性。
因此,植物多酚作为一种温和的灭菌手段,直接添加到食品表面就可以抑制对LM的生长,可以一定程度上减少亚硝酸盐、乳酸链球菌素等一些传统的添加剂的使用量,但是一些植物多酚可能会由于颜色或气味影响食品的感官品质。因此未来还需要在评估抑菌效果的同时,验证食品的品质指标。目前大部分联合抑菌研究多集中在表型上抑菌效果的调查,而针对联用时抑菌机制的系统研究不足。
5.2 酚类与其他材料或抑菌手段联用的效果
将酚类物质添加到食品包装材料中也可以起到有效抑制LM的作用。例如,将含有白藜芦醇等丰富酚类化合物的葡萄籽提取物,添加到大豆分离蛋白可食用薄膜中,可以显著提高薄膜的厚度、穿刺和拉伸强度,也能通过协同作用干扰LM细胞膜的功能,导致细菌生长迟缓,从而灭活LM[62]。葡萄籽提取物浸渍壳聚糖薄膜在冷藏过程中可以抑制香肠上的LM[63]。ESPITIA等[64]研究发现,将百里香精油(主要抑菌成分为麝香草酚和香芹酚)加入到制备的巴西莓食用薄膜中显示出良好的抗LM活性。含有丁香精油和百里香精油组合的壳聚糖膜对LM有较强的抑制作用,这可能是由于精油中酚类化合物破坏了细菌的细胞膜,增加细胞膜通透性[65]。壳聚糖作为一种环保的天然材料,因其优异的成膜性能在食品保鲜方面有较好的应用,酚酸-壳聚糖生物材料也具有抑制微生物生长和延缓腐败过程的能力,将阿魏酸、咖啡酸和芥子酸等酚酸与壳聚糖复合使用,可以破坏壳聚糖的结晶过程增加水溶性,从而增强壳聚糖的生物活性,有效抑制LM的生长[66]。以上研究显示植物多酚应用到可食用薄膜中,不仅可以有效提高薄膜的稳定性,且酚类物质的存在能够提高对细菌的抑制效果,是未来食品工业加工非常具有潜力的应用策略。
此外,植物多酚与其他物理、生物、化学手段联用也可以达到更好的抑菌效果。YOON等[67]研究表明,百里香酚、醋酸和超声联合使用对鲜食(莴苣和萝卜芽)上的LM有很好的抑制作用,可降低3.23至≥4.48 lg CFU/g的LM。KITSIOU等[68]研究发现,葡萄籽提取物仅可以在含有黄原胶的模型中显著抑制LM的生长,然而将葡萄籽提取物与低温等离子体(cold atmospheric plasma,CAP)联合使用,在黄原胶单独存在或者黄原胶与蛋白和脂肪同时存在的复杂模型中,对LM均有良好的抑制作用。AO等[69]以辣木提取物(主要为黄酮)和亚硒酸盐为原料合成了生物硒纳米颗粒,结果发现生物硒纳米颗粒在质量浓度分别为7、0.7、0.07 mg/mL时,对LM的抑制直径分别为(30.00±0.00)、(14.67±1.76)、(8.00±0.00) mm,并能有效清除生三文鱼上的LM,且无细胞毒性。CACCIATORE等[70]研究发现1.67 mg/mL的香芹酚包埋在奇亚籽黏液纳米颗粒和亚麻籽黏液纳米颗粒中,与单独的香芹酚溶液相比,可增强香芹酚抑菌效果的稳定性,并且均可抑制LM的生长。因此,与一种多酚单独使用相比,联合其他方法不仅可以提高材料的稳定性,同时能够达到更好的达到LM抑菌效果。但是,部分物理和化学手段可能会影响多酚的作用效果或破坏食品品质,因此,联合作用中各手段的参数选择,酚类物质种类的选择至关重要。对于效果较好的联合抑菌手段,其抑菌机制的解析以及其在真实食品体系中的验证也需要进一步的研究。
6 植物多酚在实际食品中的应用
LM常在肉制品、奶制品、水产和水果蔬菜中检出。例如2014—2016年间,南非地区肉类和肉制品中LM的总检出率为14.7%[71]。2023年,在中国广东、江西、湖北、四川的工厂中收集203个杏鲍菇样本中,LM的污染率为14.3%[72]。2016年期间,在智利南部10个不同地区抽取的奶酪样品中,LM的污染率为4.1%[73]。
将植物多酚添加到液体或涂抹于固体食品表面可以抑制LM的生长。例如,WU等[60]研究发现,在巴氏杀菌牛奶基质中,添加芝麻酚48 h内可以抑制5.25 lg CFU/mL的LM。BISHA等[23]研究发现,将低质量浓度(100 μg/mL)的含有丰富酚类物质的葡萄籽提取物应用到西红柿农产品洗涤剂中,可以减少1 lg CFU/mL的细菌量。NICOLAU-LAPE A等[74]研究表明,2.5 g/L阿魏酸可以在7 d内抑制LM在鲜切苹果和甜瓜中的生长,且不影响鲜切苹果和甜瓜的理化品质。BOMBELLI等[75]研究发现,光甘草定(黄酮类物质)在浓度为50、100、250 μg/g时可以显著抑制哈密瓜中LM的生长,在质量浓度为100 μg/mL时可以抑制冷熏鲑鱼培养基中LM的生长并长达14 d。
A等[74]研究表明,2.5 g/L阿魏酸可以在7 d内抑制LM在鲜切苹果和甜瓜中的生长,且不影响鲜切苹果和甜瓜的理化品质。BOMBELLI等[75]研究发现,光甘草定(黄酮类物质)在浓度为50、100、250 μg/g时可以显著抑制哈密瓜中LM的生长,在质量浓度为100 μg/mL时可以抑制冷熏鲑鱼培养基中LM的生长并长达14 d。
脂质氧化是肉制品品质下降、货架期减短的主要原因,植物多酚可以作为抗氧化剂保护食品免受氧化酸败。添加不同植物基的多酚提取物可以减少鱼肉产品的脂质氧化分解并延长其保质期[76]。WU等[77]研究表明,芝麻酚可以在72 h内使金枪鱼片上的LM菌落量降低1.29 lg CFU/mL,并显著延缓金枪鱼片的脂质氧化。SHAN等[78]将新鲜生猪肉用肉桂、牛至、丁香、石榴皮和葡萄籽提取物分别进行涂抹处理,观察对生猪肉中LM的抑制作用,结果表明,它们对LM均有抑制作用,可以延长LM的滞后期,其中,丁香和肉桂对LM的抑制效果最好。植物多酚或提取物可用作肉类中的多功能防腐剂。
7 结论与展望
本文探讨了植物多酚对LM的抑制效果,分析讨论了植物多酚抑菌机制,包括可以通过靶向LM的细胞壁、细胞膜、鞭毛、相关基因等,抑制LM生长和毒力表达,并且植物多酚在不同种类食物基质上有良好的抑菌作用。但目前植物多酚在食物基质中抑制LM方面也存在一定问题。a)大多数用于抑菌研究的是植物提取物,植物提取物构成复杂,有些植物的有效成分不清楚,需要利用纯化和检测手段分离并验证提取物中的有效抑菌成分;b)对植物多酚抑制LM机制的研究还不够深入,部分物质抑菌机制尚未完全明确;c)由于食品基质组分较为复杂,可能会降低植物多酚的有效性,因此想要达到良好的抑菌效果,食品中需要添加更高的多酚浓度,而浓度若大于常规浓度,则可能对食品的感官、品质等产生不良影响,甚至危害人体健康,因此需要进一步验证植物多酚在食品中的稳定性和有效性;d)天然来源的植物多酚作为抑菌剂更加安全,但关于植物多酚的毒性、药效学、药物相互作用以及添加到食品基质中是否有副作用等的研究较少,并且缺乏具体的法规来规范其使用;e)植物多酚容易降解、受到环境中光照和温度等因素的影响而发生变质。多酚的抑菌活性取决于它们特定的结构、化学反应特征、氧化还原电位等,因此,将多酚应用到不同的食品基质中可能会诱导食品基质中DNA损伤和促氧化机制的发生,从而导致植物多酚发生变质。
针对以上问题,今后可在以下方面开展研究:a)进一步分离、提取、鉴定植物提取物中的多酚成分并进行表征,系统探究单一成分多酚的抑菌机制;b)进一步研究植物多酚与食品成分之间、不同种类多酚之间、多酚与其他天然食品添加剂或其他栅栏技术之间的协同作用,使多酚既能在较低浓度下达到更好的抑菌效果,又能最大化降低多酚给食品感官属性带来的负面影响;c)进一步验证多酚的安全剂量、功效、安全性、人体毒性等,规范多酚的使用和最大允许限度;d)进一步优化多酚提取技术,强化对多酚活性成分和安全性分析的研究,深入开展多酚包装技术和保存方式的探讨,以延长植物多酚的作用时间,充分发挥其抑菌作用。总之,由于植物多酚作为抗LM制剂在未来食品工业中潜力巨大,未来还需要在植物多酚安全性、实用性、抑菌机制方面开展深入研究。
[1] HERNANDEZ-MILIAN A, PAYERAS-CIFRE A.What is new in listeriosis?[J].BioMed Research International, 2014, 2014:358051.
[2] THOMAS J, GOVENDER N, MCCARTHY K M, et al.Outbreak of listeriosis in South Africa associated with processed meat[J].New England Journal of Medicine, 2020, 382(7):632-643.
[3] PALACIOS A, OTTO M, FLAHERTY E, et al.Multistate outbreak of Listeria monocytogenes infections linked to fresh, soft hispanic-style cheese - United States, 2021[J].MMWR.Morbidity and Mortality Weekly Report, 2022, 71(21):709-712.
[4] NIU Y L, WANG T Y, ZHANG X A, et al.Risk factors for sporadic listeriosis in Beijing, China:A matched case-control study[J].Epidemiology and Infection, 2022, 150:1-21.
[5] ZAKRZEWSKI A J, GAJEWSKA J, CHAJ![]() CKA-WIERZCHOWSKA W, et al.Prevalence of Listeria monocytogenes and other Listeria species in fish, fish products and fish processing environment:A systematic review and meta-analysis[J].Science of The Total Environment, 2024, 907:167912.
CKA-WIERZCHOWSKA W, et al.Prevalence of Listeria monocytogenes and other Listeria species in fish, fish products and fish processing environment:A systematic review and meta-analysis[J].Science of The Total Environment, 2024, 907:167912.
[6] YU T, JIANG X B, ZHANG Y G, et al.Effect of benzalkonium chloride adaptation on sensitivity to antimicrobial agents and tolerance to environmental stresses in Listeria monocytogenes[J].Frontiers in Microbiology, 2018, 9:2906.
[7] ARSLAN S, BAYTUR S.Prevalence and antimicrobial resistance of Listeria species and subtyping and virulence factors of Listeria monocytogenes from retail meat[J].Journal of Food Safety, 2019, 39(1):e12578.
[8] CHEN P C, CHENG F Z, HUANG Q, et al.Distribution and antimicrobial resistance characterization of Listeria monocytogenes in poultry meat in Jiading district, Shanghai[J].Journal of Food Protection, 2024, 87(3):100234.
[9] SHEN N, WANG T F, GAN Q, et al.Plant flavonoids:Classification, distribution, biosynthesis, and antioxidant activity[J].Food Chemistry, 2022, 383:132531.
[10] G RNIAK I, BARTOSZEWSKI R, KR
RNIAK I, BARTOSZEWSKI R, KR LICZEWSKI J.Comprehensive review of antimicrobial activities of plant flavonoids[J].Phytochemistry Reviews, 2019, 18(1):241-272.
LICZEWSKI J.Comprehensive review of antimicrobial activities of plant flavonoids[J].Phytochemistry Reviews, 2019, 18(1):241-272.
[11] N
 EZ-MOJICA G, V
EZ-MOJICA G, V ZQUEZ-RAM
ZQUEZ-RAM REZ A L, GARC
REZ A L, GARC A A, et al.New cyclolignans of Larrea tridentata and their antibacterial and cytotoxic activities[J].Phytochemistry Letters, 2021, 43:212-218.
A A, et al.New cyclolignans of Larrea tridentata and their antibacterial and cytotoxic activities[J].Phytochemistry Letters, 2021, 43:212-218.
[12] BOSTANGHADIRI N, PORMOHAMMAD A, CHIRANI A S, et al.Comprehensive review on the antimicrobial potency of the plant polyphenol resveratrol[J].Biomedicine &Pharmacotherapy, 2017, 95:1588-1595.
[13] VINOTH KUMAR P, SHOBIKA M, ROOPAN S M, et al.A mini review:Recent progress in light-mediated synthesis of carbon-carbon bonded stilbene analogues[J].Tetrahedron, 2023, 135:133341.
[14] LI Z S, WU M J, YAN H, et al.Antibacterial effect and possible mechanism of sesamol against foodborne pathogens[J].Foods, 2024, 13(3):435.
[15] CHURKLAM W, CHATURONGAKUL S, NGAMWONGSATIT B, et al.The mechanisms of action of carvacrol and its synergism with nisin against Listeria monocytogenes on sliced bologna sausage[J].Food Control, 2020, 108:106864.
[16] TAKAHASHI H, KASHIMURA M, KOISO H, et al.Use of ferulic acid as a novel candidate of growth inhibiting agent against Listeria monocytogenes in ready-to-eat food[J].Food Control, 2013, 33(1):244-248.
[17] ZHANG F Y, ZHAI T H, HAIDER S, et al.Synergistic effect of chlorogenic acid and caffeic acid with fosfomycin on growth inhibition of a resistant Listeria monocytogenes strain[J].ACS Omega, 2020, 5(13):7537-7544.
[18] MARINI E, MAGI G, FERRETTI G, et al.Attenuation of Listeria monocytogenes virulence by Cannabis sativa L.essential oil[J].Frontiers in Cellular and Infection Microbiology, 2018, 8:293.
[19] DIMITRIJEVI M, GRKOVI
M, GRKOVI N, BO
N, BO KOVI
KOVI M, et al.Inhibition of Listeria monocytogenes growth on vacuum packaged rainbow trout (Oncorhynchus mykiss) with carvacrol and eugenol[J].Journal of Food Safety, 2019, 39(1):e12553.
M, et al.Inhibition of Listeria monocytogenes growth on vacuum packaged rainbow trout (Oncorhynchus mykiss) with carvacrol and eugenol[J].Journal of Food Safety, 2019, 39(1):e12553.
[20] BYUN K H, HAN S H, CHOI M W, et al.Control of Listeria monocytogenes in food industry by a combination treatment of natural aromatic compound with Listeria-specific bacteriophage cocktail[J].Food Research International, 2024, 177:113859.
[21] MONENTE C, BRAVO J, VITAS A I, et al.Coffee and spent coffee extracts protect against cell mutagens and inhibit growth of food-borne pathogen microorganisms[J].Journal of Functional Foods, 2015, 12:365-374.
[22] GULLON B, PINTADO M E, PÉREZ- LVAREZ J A, et al.Assessment of polyphenolic profile and antibacterial activity of pomegranate peel (Punica granatum) flour obtained from co-product of juice extraction[J].Food Control, 2016, 59:94-98.
LVAREZ J A, et al.Assessment of polyphenolic profile and antibacterial activity of pomegranate peel (Punica granatum) flour obtained from co-product of juice extraction[J].Food Control, 2016, 59:94-98.
[23] BISHA B, WEINSETEL N, BREHM-STECHER B F, et al.Antilisterial effects of gravinol-s grape seed extract at low levels in aqueous media and its potential application as a produce wash[J].Journal of Food Protection, 2010, 73(2):266-273.
[24] YEMMIREDDY V K, CASON C, MOREIRA J, et al.Effect of pecan variety and the method of extraction on the antimicrobial activity of pecan shell extracts against different foodborne pathogens and their efficacy on food matrices[J].Food Control, 2020, 112:107098.
[25] SHEN X, SUN X H, XIE Q C, et al.Antimicrobial effect of blueberry (Vaccinium corymbosum L.) extracts against the growth of Listeria monocytogenes and Salmonella Enteritidis[J].Food Control, 2014, 35(1):159-165.
[26] LIU Y H, MCKEEVER L C, MALIK N S A.Assessment of the antimicrobial activity of olive leaf extract against foodborne bacterial pathogens[J].Frontiers in Microbiology, 2017, 8:113.
[27] CHIBANE L B, DEGRAEVE P, FERHOUT H, et al.Plant antimicrobial polyphenols as potential natural food preservatives[J].Journal of the Science of Food and Agriculture, 2019, 99(4):1457-1474.
[28] GRANATO D, DO PRADO-SILVA L, ALVARENGA V O, et al.Characterization of binary and ternary mixtures of green, white and black tea extracts by electrospray ionization mass spectrometry and modeling of their in vitro antibacterial activity[J].LWT, 2016, 65:414-420.
[29] FINN L, ONYEAKA H, O’NEILL S.Listeria monocytogenes biofilms in food-associated environments:A persistent Enigma[J].Foods, 2023, 12(18):3339.
[30] LIU Y G, DONG P C, ZHU L X, et al.Effect of four kinds of natural antimicrobial compounds on the biofilm formation ability of Listeria monocytogenes isolated from beef processing plants in China[J].LWT, 2020, 133:110020.
[31] SIVARANJANI M, GOWRISHANKAR S, KAMALADEVI A, et al.Morin inhibits biofilm production and reduces the virulence of Listeria monocytogenes:An in vitro and in vivo approach[J].International Journal of Food Microbiology, 2016, 237:73-82.
[32] VAZQUEZ-ARMENTA F J, BERNAL-MERCADO A T, LIZARDI-MENDOZA J, et al.Phenolic extracts from grape stems inhibit Listeria monocytogenes motility and adhesion to food contact surfaces[J].Journal of Adhesion Science and Technology, 2018, 32(8):889-907.
[33] GEMMELL C T, PARREIRA V R, FARBER J M.Controlling Listeria monocytogenes growth and biofilm formation using flavonoids[J].Journal of Food Protection, 2022, 85(4):639-646.
[34] BORGES A, SAAVEDRA M J, SIM ES M.The activity of ferulic and gallic acids in biofilm prevention and control of pathogenic bacteria[J].Biofouling, 2012, 28(7):755-767.
ES M.The activity of ferulic and gallic acids in biofilm prevention and control of pathogenic bacteria[J].Biofouling, 2012, 28(7):755-767.
[35] KIM G, DASAGRANDHI C, KANG E H, et al.In vitro antibacterial and early stage biofilm inhibitory potential of an edible chitosan and its phenolic conjugates against Pseudomonas aeruginosa and Listeria monocytogenes[J].3 Biotech, 2018, 8(10):439.
[36] ASHRAFUDOULLA M, RAHAMAN MIZAN M F, PARK S H, et al.Antibiofilm activity of carvacrol against Listeria monocytogenes and Pseudomonas aeruginosa biofilm on MBECTM biofilm device and polypropylene surface[J].LWT, 2021, 147:111575.
[37] HOSSAIN M I, RAHAMAN MIZAN M F, TOUSHIK S H, et al.Antibiofilm effect of nisin alone and combined with food-grade oil components (thymol and eugenol) against Listeria monocytogenes cocktail culture on food and food-contact surfaces[J].Food Control, 2022, 135:108796.
[38] BANERJI R, MAHAMUNE A, SAROJ S D.Aqueous extracts of spices inhibit biofilm in Listeria monocytogenes by downregulating release of eDNA[J].LWT, 2022, 154:112566.
[39] PARK Y J, KANG C E, KIM J H, et al.Antibacterial mechanism of mixed natural preservatives (ε-poly-lysine, cinnamon extract, and chestnut inner shell extract) against Listeria monocytogenes[J].LWT, 2023, 177:114572.
[40] COIMBRA A, CARVALHO F, DUARTE A P, et al.Antimicrobial activity of Thymus zygis essential oil against Listeria monocytogenes and its application as food preservative[J].Innovative Food Science &Emerging Technologies, 2022, 80:103077.
[41] MIAO X, LIU H H, ZHENG Y Y, et al.Inhibitory effect of thymoquinone on Listeria monocytogenes ATCC 19115 biofilm formation and virulence attributes critical for human infection[J].Frontiers in Cellular and Infection Microbiology, 2019, 9:304.
[42] BORGES A, FERREIRA C, SAAVEDRA M J, et al.Antibacterial activity and mode of action of ferulic and Gallic acids against pathogenic bacteria[J].Microbial Drug Resistance, 2013, 19(4):256-265.
[43] DE SOUSA GUEDES J P, DE SOUZA E L.Investigation of damage to Escherichia coli, Listeria monocytogenes and Salmonella Enteritidis exposed to Mentha arvensis L.and M.piperita L.essential oils in pineapple and mango juice by flow cytometry[J].Food Microbiology, 2018, 76:564-571.
[44] LIU Y J, SHI C H, ZHANG G L, et al.Antimicrobial mechanism of 4-hydroxyphenylacetic acid on Listeria monocytogenes membrane and virulence[J].Biochemical and Biophysical Research Communications, 2021, 572:145-150.
[45] LI Z L, WU H Y, LIU J N, et al.Synergistic effects of benzyl isothiocyanate and resveratrol against Listeria monocytogenes and their application in chicken meat preservation[J].Food Chemistry, 2023, 419:135984.
[46] BAI F T, GUO D, WANG Y Y, et al.The combined bactericidal effect of nisin and thymoquinone against Listeria monocytogenes in tryptone soy broth and sterilized milk[J].Food Control, 2022, 135:108771.
[47] MORA-PALE M, BHAN N, MASUKO S, et al.Antimicrobial mechanism of resveratrol-trans-dihydrodimer produced from peroxidase-catalyzed oxidation of resveratrol[J].Biotechnology and Bioengineering, 2015, 112(12):2417-2428.
[48] LANCIOTTI R, BRASCHI G, PATRIGNANI F, et al.How Listeria monocytogenes shapes its proteome in response to natural antimicrobial compounds[J].Frontiers in Microbiology, 2019, 10:437.
[49] 萨仁高娃, 胡文忠, 冯可, 等.植物精油及其成分对病原微生物抗菌机理的研究进展[J].食品科学, 2020, 41(11):285-294.SARENGAOWA, HU W Z, FENG K, et al.Antimicrobial mechanisms of essential oils and their components on pathogenic bacteria:A review[J].Food Science, 2020, 41(11):285-294.
[50] GILL A O, HOLLEY R A.Mechanisms of bactericidal action of cinnamaldehyde against Listeria monocytogenes and of eugenol against L.monocytogenes and Lactobacillus sakei[J].Applied and Environmental Microbiology, 2004, 70(10):5750-5755.
[51] OUSSALAH M, CAILLET S, LACROIX M.Mechanism of action of Spanish oregano, Chinese cinnamon, and savory essential oils against cell membranes and walls of Escherichia coli O157:H7 and Listeria monocytogenes[J].Journal of Food Protection, 2006, 69(5):1046-1055.
[52] GONG S Y, JIAO C Q, GUO L.Antibacterial mechanism of beetroot (Beta vulgaris) extract against Listeria monocytogenes through apoptosis-like death and its application in cooked pork[J].LWT, 2022, 165:113711.
[53] YAN H, WU M J, GAO B R, et al.Inhibition and eradication of Listeria monocytogenes biofilm using the combined treatment with nisin and sesamol[J].LWT, 2024, 198:116015.
[54] WU M J, DONG Q L, SONG Y Y, et al.Effects of nisin and sesamol on biofilm formation and virulence of Listeria monocytogenes[J].Food Control, 2024, 160:110348.
[55] GUAN P, WANG X J, DONG Z J, et al.Cinnamaldehyde inactivates Listeria monocytogenes at a low temperature in ground pork by disturbing the expression of stress regulatory genes[J].Food Bioscience, 2023, 51:102277.
[56] CUI H Y, LI H, LI C Z, et al.Inhibition effect of Moringa oil on the cheese preservation and its impact on the viability, virulence and genes expression of Listeria monocytogenes[J].LWT, 2020, 134:110163.
[57] ZHANG C H, LI C Z, ABDEL-SAMIE M A, et al.Unraveling the inhibitory mechanism of clove essential oil against Listeria monocytogenes biofilm and applying it to vegetable surfaces[J].LWT, 2020, 134:110210.
[58] APOSTOLIDIS E, KWON Y I, SHETTY K.Inhibition of Listeria monocytogenes by oregano, cranberry and sodium lactate combination in broth and cooked ground beef systems and likely mode of action through proline metabolism[J].International Journal of Food Microbiology, 2008, 128(2):317-324.
[59] XI Y, SULLIVAN G A, JACKSON A L, et al.Use of natural antimicrobials to improve the control of Listeria monocytogenes in a cured cooked meat model system[J].Meat Science, 2011, 88(3):503-511.
[60] WU M J, DONG Q L, SONG X, et al.Effective combination of nisin and sesamol against Listeria monocytogenes[J].LWT, 2023, 176:114546.
[61] RUIZ A, WILLIAMS S K, DJERI N, et al.Nisin, rosemary, and ethylenediaminetetraacetic acid affect the growth of Listeria monocytogenes on ready-to-eat turkey ham stored at four degrees Celsius for sixty-three days[J].Poultry Science, 2009, 88(8):1765-1772.
[62] SIVAROOBAN T, HETTIARACHCHY N S, JOHNSON M G.Physical and antimicrobial properties of grape seed extract, nisin, and EDTA incorporated soy protein edible films[J].Food Research International, 2008, 41(8):781-785.
[63] FRIEDMAN M.Antibacterial, antiviral, and antifungal properties of wines and winery byproducts in relation to their flavonoid content[J].Journal of Agricultural and Food Chemistry, 2014, 62(26):6025-6042.
[64] ESPITIA P J P, AVENA-BUSTILLOS R J, DU W X, et al.Physical and antibacterial properties of açaí edible films formulated with thyme essential oil and apple skin polyphenols[J].Journal of Food Science, 2014, 79(5):M903-M910.
[65] EL-ZEHERY H R A, ZAGHLOUL R A, ABDEL-RAHMAN H M, et al.Novel strategies of essential oils, chitosan, and nano- chitosan for inhibition of multi-drug resistant:E.coli O157:H7 and Listeria monocytogenes[J].Saudi Journal of Biological Sciences, 2022, 29(4):2582-2590.
[66] ZHOU Q, LAN W Q, XIE J.Phenolic acid-chitosan derivatives:An effective strategy to cope with food preservation problems[J].International Journal of Biological Macromolecules, 2024, 254:127917.
[67] YOON J H, KIM J Y, BAE Y M, et al.Control of Salmonella enterica serovar Typhimurium and Listeria monocytogenes on lettuce and radish sprouts by combined treatments with thymol, acetic acid, and ultrasound[J].Food Control, 2023, 147:109588.
[68] KITSIOU M, PURK L, IOANNOU C, et al.On the evaluation of the antimicrobial effect of grape seed extract and cold atmospheric plasma on the dynamics of Listeria monocytogenes in novel multiphase 3D viscoelastic models[J].International Journal of Food Microbiology, 2023, 406:110395.
[69] AO B, LV J, YANG H M, et al.Moringa oleifera extract mediated the synthesis of Bio-SeNPs with antibacterial activity against Listeria monocytogenes and Corynebacterium diphtheriae[J].LWT, 2022, 165:113751.
[70] CACCIATORE F A, MADERS C, ALEXANDRE B, et al.Carvacrol encapsulation into nanoparticles produced from Chia and flaxseed mucilage:Characterization, stability and antimicrobial activity against Salmonella and Listeria monocytogenes[J].Food Microbiology, 2022, 108:104116.
[71] MATLE I, MBATHA K R, LENTSOANE O, et al.Occurrence, serotypes, and characteristics of Listeria monocytogenes in meat and meat products in South Africa between 2014 and 2016[J].Journal of Food Safety, 2019, 39(4):e12629.
[72] XU J, WU S, LIU M, et al.Prevalence and contamination patterns of Listeria monocytogenes in Pleurotus eryngii (king oyster mushroom) production plants[J].Frontiers in Microbiology, 2023, 14:1064575.
[73] BARR A C, SINGER R S, BUENO I, et al.Tracing Listeria monocytogenes contamination in artisanal cheese to the processing environments in cheese producers in southern Chile[J].Food Microbiology, 2020, 90:103499.
A C, SINGER R S, BUENO I, et al.Tracing Listeria monocytogenes contamination in artisanal cheese to the processing environments in cheese producers in southern Chile[J].Food Microbiology, 2020, 90:103499.
[74] NICOLAU-LAPE A I, AGUIL
A I, AGUIL -AGUAYO I, BOBO G, et al.Ferulic acid application to control growth Listeria monocytogenes and Salmonella enterica on fresh-cut apples and melon, and its effect in quality parameters[J].Postharvest Biology and Technology, 2022, 186:111831.
-AGUAYO I, BOBO G, et al.Ferulic acid application to control growth Listeria monocytogenes and Salmonella enterica on fresh-cut apples and melon, and its effect in quality parameters[J].Postharvest Biology and Technology, 2022, 186:111831.
[75] BOMBELLI A, ARAYA-CLOUTIER C, VINCKEN J P, et al.Impact of food-relevant conditions and food matrix on the efficacy of prenylated isoflavonoids glabridin and 6, 8-diprenylgenistein as potential natural preservatives against Listeria monocytogenes[J].International Journal of Food Microbiology, 2023, 390:110109.
[76] ALI M, IMRAN M, NADEEM M, et al.Oxidative stability and Sensoric acceptability of functional fish meat product supplemented with plant - polyphenolic optimal extracts[J].Lipids in Health and Disease, 2019, 18(1):35.
[77] WU M J, DONG Q L, YAN H, et al.Bacteriostatic potential of nisin and sesamol combination against Listeria monocytogenes in chilled raw tuna fillets[J].LWT, 2023, 183:114924.
[78] SHAN B, CAI Y Z, BROOKS J D, et al.Antibacterial and antioxidant effects of five spice and herb extracts as natural preservatives of raw pork[J].Journal of the Science of Food and Agriculture, 2009, 89(11):1879-1885.