病原微生物耐药性已成为全球共同关注的问题,而抗生素的滥用是导致病原菌产生耐药性的主要原因。据调查,医院开的处方药物中有30%~50%的抗生素是非必要使用的[1],这种过度使用抗生素的现象加速了耐药病原菌的扩散。数据显示,2019年全球因感染抗生素耐药菌而死亡的人数已经有近127万人[2],死亡率已经超过了疟疾、肺结核和艾滋病[3]。最初,抗生素的发现曾彻底改变了传统治疗细菌感染的方式。1928年,英国细菌学家弗莱明发现了第1个抗生素——青霉素,这也是第一个实现商业化的抗生素[4],从此开启了抗生素药物时代。然而,在青霉素问世不久,就出现了对青霉素产生耐药性的细菌。研究表明,病原微生物对某一种抗生素产生耐药性仅需要1~2年[5]。尽管新型抗生素的开发仍在继续,但其发现的速度远远跟不上耐药性的产生速度,给公共健康带来了极大的威胁。因此,寻找一种高效、安全且不易产生耐药性的抗菌药物变得尤为紧迫。
近年来,研究人员不断从自然界生物体内发现具有广谱抑菌活性的小肽——抗菌肽。相比抗生素,抗菌肽具有安全、低残留、不易引发耐药性等优势[6]。抗菌肽不仅对革兰氏阴性菌和阳性菌均有活性,而且还展现出独特的抑菌机制:由于抗菌肽带有正电荷且富含疏水性氨基酸,它们能靶向结合带负电荷的细菌细胞膜,聚集在细胞膜表面,改变膜的流动性和结构,从而抑制细菌生长;此外,抗菌肽还可嵌入细胞膜,破坏膜的完整性,引发胞质泄漏,最终导致细胞死亡[7]。这种非特异性抑菌机制显著减少了细菌产生耐药性的可能性,因此抗菌肽被认为是未来替代抗生素的新型抑菌药物,在医药、畜牧业、农业等领域中备受期待。然而,目前大部分抗菌肽来源于动物、昆虫和植物体内,产量低且提取困难,这限制了抗菌肽在市场上的应用。因此,实现抗菌肽的大规模生产变得至关重要。
随着重组DNA技术的成熟,利用异源表达系统大规模生产抗菌肽已成为研究热点。毕赤酵母是目前最常用的异源蛋白表达宿主之一,已有上千种蛋白在毕赤酵母中成功表达,包括胰岛素、人血清白蛋白和表皮生长因子等[8],毕赤酵母在实验室水平和工业规模均得到广泛应用,并展现出重要的商业价值。因此,毕赤酵母有希望成为抗菌肽的生产平台,实现高效、低成本的大规模制备抗菌肽的目标。
1 抗菌肽的研究进展及应用
1.1 抗菌肽的研究进展
抗菌肽是一类由10~50个氨基酸组成的具有广谱抑菌活性的小分子多肽。它们是生物体抵御外来有害微生物的重要防御屏障,同时能调节宿主免疫系统,对细菌、真菌、癌细胞甚至是病毒都有一定的抑制作用[9]。人类对抗菌肽的研究可以追溯到1939年,DUBOS从土壤中的芽孢杆菌菌株中发现了一种能够诱导小鼠抵抗肺炎链球菌感染的抗菌肽,并将其命名为Gramicidin[10]。随后,BOMAN从惜古比天蚕(Hyalophora cecropia)中提取出一种具有α-螺旋结构的抗菌肽-天蚕素(Cecropin)[10]。此后,研究人员不断从植物、动物、微生物等不同来源发现大量新型抗菌肽。根据抗菌肽数据库(antimicrobial peptide database,APD)统计,截至2024年1月,共鉴定出3 940个抗菌肽,其中包括383个来源于细菌,29个来源于真菌,250个来源于植物,2 463个来源于动物,190个预测抗菌肽和314个合成抗菌肽。
抗菌肽的结构多样,主要依据其二级结构可分为α-螺旋型、β-折叠型、环状抗菌肽链和延伸型肽[11],如表1所示。其中,α-螺旋抗菌肽是研究得最广泛的一类抗菌肽,同时具有疏水性和亲水性,比较典型的是从蛙皮肤中提取出来蛙皮素(magainins)[12]和从蚕蛾中分离出来的天蚕素[13]。β-折叠型抗菌肽广泛存在于动物和植物中,其结构比α-螺旋型抗菌肽更加复杂,通常含有不同数量的二硫键,增强了肽链的稳定性。环状抗菌肽因其具有高度稳定的结构和优良的膜渗透性,在生物医药领域具有应用前景。延伸型抗菌肽不具备典型的二级结构,富含特定的氨基酸,例如脯氨酸(Pro)、色氨酸(Trp)、精氨酸(Arg)和组氨酸(His)等[14],这类抗菌肽可穿透病原菌的细胞膜,发挥抑菌作用。
表1 抗菌肽的结构类型
Table 1 Structural types of antimicrobial peptides

结构类型结构特点典型抗菌肽α-螺旋具有两亲性[15]天蚕素、蛙皮素β-折叠含有二硫键thanatin、protegrin-1环状结构稳定、不易被蛋白酶水解多黏菌素、达托霉素延伸型富含Pro、Gly和Trpapidaecins、gloverin
1.2 抗菌肽的应用
随着抗生素在医药和畜牧业等领域的广泛使用,抗生素耐药性问题日益严峻。为减少抗生素滥用及其带来的耐药性和环境污染,开发有效的替代物成为全球关注的焦点。由于抗菌肽的非特异性抑菌机制难以诱发耐药性,因此具备成为新型抗菌药物的潜力。
目前已有239种抗菌肽通过了美国食品药物监督管理局认证[16],其中有7种抗菌肽通过临床试验并实现商业化。如多黏菌素B和多黏菌素E用于治疗多种耐药革兰氏阴性杆菌引起的感染[11]。P-113可抑制人口腔中的念珠菌,改善牙龈健康[17]。在抗肿瘤领域,来自寄生蜂Melecta albifrons毒液的抗菌肽Melectin[18]和蛇毒抗菌肽[19]都显示出一定的抗肿瘤活性,且对正常细胞毒性低。此外,抗菌肽在促进伤口愈合方面也有潜力[20],例如抗菌肽AP-57在伤口敷料中的应用[21]。
在畜牧业中,抗菌肽可以作为抗菌剂和饲料添加剂,有助于预防动物疾病和提高生产效率[22]。如饲料中添加乳铁蛋白可以改善猪肠道健康[23],在鸡饲料中添加抗菌肽能够有效提高鸡的存活率并预防疾病爆发[24],抗菌肽indolicidin已经被批准用于牛乳腺炎治疗[25-26]。因此开发抗菌肽作为抗菌剂、替代饲料中抗生素,有望解决畜牧业中的抗生素耐药性问题,同时还能确保动物的健康。
在农业中,由于农用抗生素的滥用,大大加速了欧文菌、假单胞菌属等植物病原菌对抗生素耐药性[27],抗菌肽作为生物农药,能够替代抗生素和化学农药,减少污染并降低耐药风险。如抗菌肽MaltDef1能杀线虫并抑制其繁殖[28],乳酸菌抗菌肽对茄科雷尔氏菌有明显抑制作用,且对植物生长无不良影响[29]。
在食品行业中,抗菌肽有望用于提升食品安全和质量。如乳酸链球菌素(Nisin)可抑制革兰氏阳性菌及芽孢杆菌孢子,是一种高效安全且无副作用的食品防腐剂。人β-防御素130展现了广谱抗菌活性,对食源性病原菌有效且对哺乳动物细胞几乎无毒性[30]。
抗菌肽在医药、畜牧业、农业和食品领域展现出广阔应用前景,有望成为应对耐药性和提升健康水平的新型解决方案。
2 抗菌肽在毕赤酵母中的异源表达
近年来,研究人员对抗菌肽的抑菌机制和活性进行了持续深入的探究,探索了抗菌肽在医药、畜牧业、农业等领域的应用前景。这使得抗菌肽的扩大生产成为了迫切需求。然而,直接从天然来源分离和纯化抗菌肽的过程较复杂,且产量低,仅限应用于早期鉴定的阶段。随着重组DNA技术和异源蛋白表达系统的成熟,使得抗菌肽的大规模生产不再是一个难题。
毕赤酵母(Pichia pastoris)是一种甲醇营养型酵母,能够以甲醇作为唯一的碳源和诱导物,已经成功地发展成为一种广泛用于生产各种异源蛋白的表达宿主。一些重组蛋白已在毕赤酵母中实现了g/L水平的产量,例如朱宏宇等[31]以毕赤酵母为表达宿主,成功将肌醇产量提高到36.7 g/L。相比于其他异源蛋白表达系统,毕赤酵母有诸多优势[32]:1)遗传背景清晰,且遗传操作技术简单;2)其具备有生产高水平胞内和胞外蛋白的能力;3)毕赤酵母具有能够对重组蛋白进行翻译后加工的能力;4)毕赤酵母生产重组蛋白的成本低,适合高密度发酵。因此,利用毕赤酵母作为抗菌肽生产的细胞工厂已经成为研究热点。近年来,已有多种抗菌肽成功在毕赤酵母中表达,但是,不同抗菌肽在毕赤酵母中的表达产量差异显著,范围从几毫克每升到几百毫克每升不等,但均未达到g/L的水平,因此抗菌肽在毕赤酵母的表达还需要进一步优化。表2总结了近5~10年不同来源的抗菌肽在毕赤酵母中的表达。
表2 不同来源的抗菌肽在毕赤酵母中的表达
Table 2 Expression of antimicrobial peptides from different sources in P.pastoris
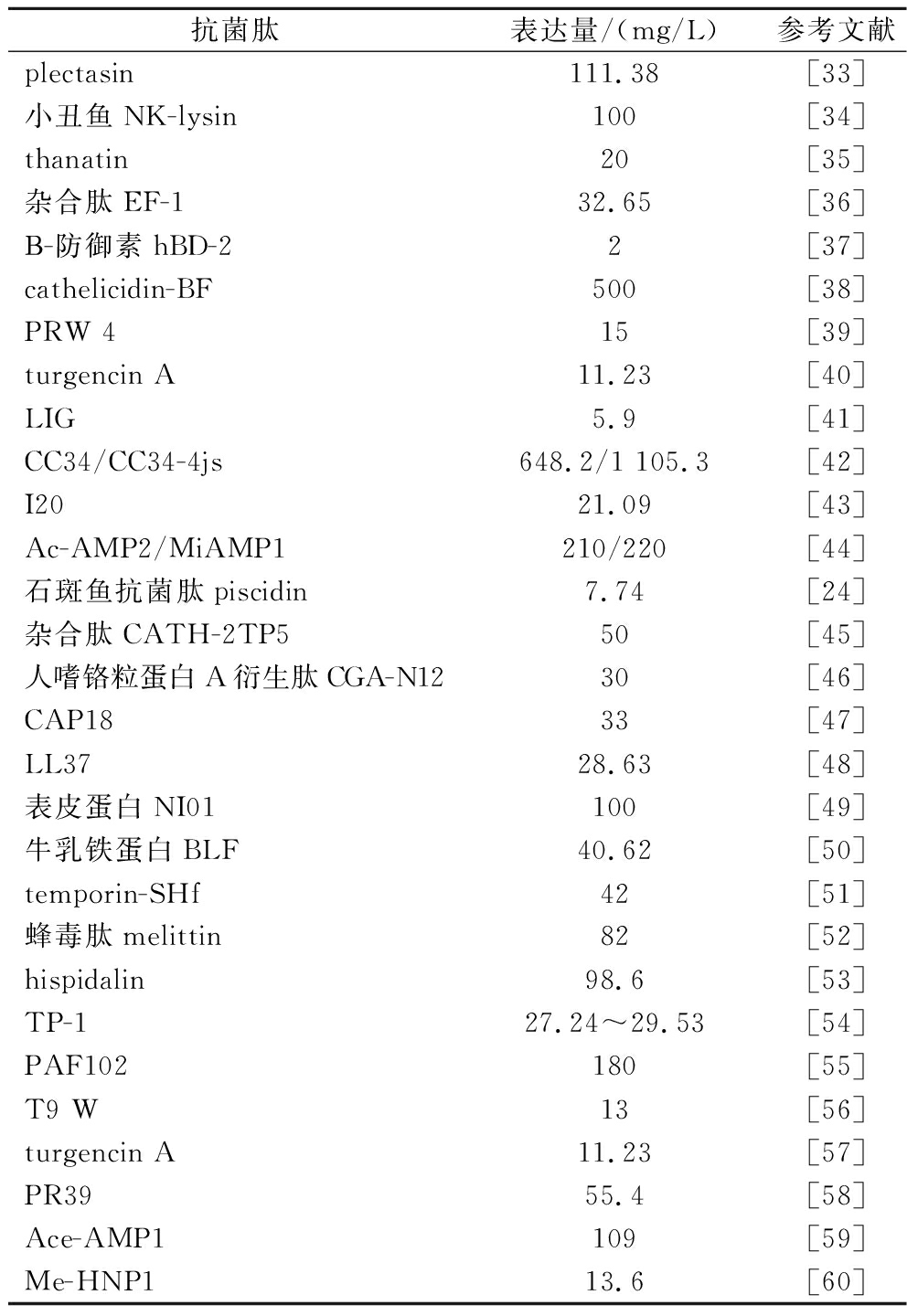
抗菌肽表达量/(mg/L)参考文献plectasin111.38[33]小丑鱼NK-lysin100[34]thanatin20[35]杂合肽EF-132.65[36]Β-防御素hBD-22[37]cathelicidin-BF500[38]PRW 415[39]turgencin A11.23[40]LIG5.9[41]CC34/CC34-4js648.2/1 105.3[42]I2021.09[43]Ac-AMP2/MiAMP1210/220[44]石斑鱼抗菌肽piscidin7.74[24]杂合肽CATH-2TP550[45]人嗜铬粒蛋白A衍生肽CGA-N1230[46]CAP1833[47]LL3728.63[48]表皮蛋白NI01100[49]牛乳铁蛋白BLF40.62[50]temporin-SHf42[51]蜂毒肽melittin82[52]hispidalin98.6[53]TP-127.24~29.53[54]PAF102180[55]T9 W13[56]turgencin A11.23[57]PR3955.4[58]Ace-AMP1109[59]Me-HNP113.6[60]
3 抗菌肽在毕赤酵母中表达的优化策略
尽管毕赤酵母表达系统的遗传操作已得到很好的开发,但重组蛋白高效表达仍面临挑战,例如表达量低、蛋白折叠错误和分泌障碍等。因此,抗菌肽在毕赤酵母中的高效表达仍有进一步优化的空间。近年来,随着代谢工程技术的进步,一些优化策略为提升抗菌肽的表达提供了新的思路。
3.1 密码子偏爱性优化
基因中的密码子不仅决定氨基酸序列,还直接影响翻译效率。不同生物对同一氨基酸使用的密码子有所偏好,频繁使用的称为偏爱密码子。研究表明,在高表达基因中使用偏爱密码子有助于提高翻译效率,相反,罕见密码子可能降低表达水平[61]。若抗菌肽基因中的密码子与毕赤酵母偏好不一致,可能导致无法正常翻译出蛋白,甚至导致翻译提前终止。因此,在构建重组抗菌肽表达载体之前,必须先根据毕赤酵母的密码子偏爱性对抗菌肽的基因序列进行优化,包括调整密码子使用偏差和GC含量,去除重复序列和不必要的基因序列。例如,钊倩倩等[62]优化人组织因子的胞外活性区序列后,使胞外重组蛋白含量提高了1.5倍。王艳慧等[63]通过密码子优化,将梭子蟹抗菌肽的表达量提高了4倍。WANG等[64]通过优化猫干扰素的密码子,使其表达量翻倍。因此,密码子优化被证明是提高重组蛋白产量的有效策略。
3.2 启动子的选择
启动子是决定基因表达效率的关键元件。启动子不仅能够促进基因表达,同时也对基因的表达状态产生重要影响。毕赤酵母的启动子分为甲醇诱导型和组成型两类。AOX1启动子(pAOX1)是常用的甲醇诱导型启动子,当毕赤酵母在以甲醇以外的其他碳源环境下生长时,比如葡萄糖、甘油,pAOX1会被严格抑制,需在耗尽其他碳源后通过添加甲醇激活[65]。这种阻遏和诱导起着开关作用,可以在不同的培养条件启动和阻遏重组蛋白表达。但是pAOX1也存在一些局限性,甲醇具有毒性且易燃,使其在工业生产中应用受到限制。因此需要替代的诱导型启动子或pAOX1变体,使其可以在不使用甲醇的情况下诱导,且仍能达到高水平表达。1997年,WATERHAM等[66]首次分离得到甘油醛-3-磷酸脱氢酶启动子(pGAP),这是一种强组成型启动子,因其不需要甲醇诱导,避免了甲醇使用途中带来的潜在危害和风险,使其更适合大规模生产,目前已被用于许多外源蛋白的组成型表达。
3.3 基因剂量
基因剂量,即转录水平的RNA丰度,是决定重组蛋白表达效率的主要限制因素之一[67]。细胞中蛋白质的表达与mRNA水平相关,而毕赤酵母基因组中的基因拷贝数与mRNA水平呈现正相关。因此,通过多拷贝基因策略,即通过优化插入的外源基因的数量,以构建具有高表达效率的重组酵母菌株,可显著提升重组蛋白产量。例如,PENG等[68]构建了1~4拷贝的冷适应壳聚糖酶重组表达菌株,其中4拷贝菌株的酶活性是1拷贝的3.86倍。LIU等[69]研究发现,通过增加葡聚糖酶基因的剂量,构建了1~7拷贝菌株,当葡聚糖酶基因拷贝数达到7时,酶活性提升了3倍。然而,根据研究表明,并不是基因拷贝数越多,目的基因表达量越高,当基因拷贝数超过一定数值时,目的基因表达量会出现下降趋势,这可能是因为蛋白质表达水平的升高影响了宿主菌株的代谢。例如,DAI等[70]为了提高嗜热内切葡聚糖酶在毕赤酵母中的表达,构建了多拷贝菌株。然而,当基因拷贝数超过3时,菌株表现出内切葡聚糖酶活性降低的现象。因此,基因剂量的优化需要根据重组蛋白的特性进行,并非在所有情况下基因拷贝数都与目的基因表达量成正比。
3.4 信号肽的选择和优化
信号肽是一段能够被信号识别颗粒识别的短肽,能够引导新合成的重组蛋白质分泌到正确的通路[71]。α-factor信号肽是毕赤酵母常用的分泌信号,当α-factor信号肽C端的二碱基序列Lys84-Arg85被KEX2蛋白酶识别并剪切后[72],成熟蛋白被分泌到胞外。为了提升分泌效率,研究人员通过密码子优化、定向进化、添加间隔序列和位点定向诱变等方式优化信号肽[71]。例如,张娜等[73]通过优化α-factor信号肽序列的密码子,将葡萄糖氧化酶活力提高了2倍。UTAMI等[74]将α-factor信号肽截短后,使得人胰岛素前体的分泌量提高了9倍。梁启星等[75]用信号肽SP1替换α-factor信号肽的前体信号肽区序列,使肠激酶的表达量提高了2.1倍。这些结果表明信号肽的选择和优化对蛋白的表达和分泌至关重要。当信号肽与不同的异源蛋白融合时,可以表现出不同的效率。因此,筛选更多的宿主信号肽可以提供潜在的替代方案,以促进外源抗菌肽的分泌表达。
3.5 蛋白伴侣
当外源基因以高拷贝数策略优化表达时,可能会出现外源蛋白的过度表达导致酵母细胞的分泌压力增加[76],蛋白伴侣的共表达可以有效促进重组蛋白的分泌。蛋白伴侣通过协助蛋白折叠、二硫键形成、信号肽去除等过程,提高重组蛋白的表达和分泌效率。常用的伴侣包括BiP/Kar2p、PDI和Hac1p等[77],已被广泛用于增强蛋白质分泌。例如,WANG等[78]过共表达多个伴侣蛋白后,人溶菌酶的分泌显著提高。JIANG等[79]通过共表达PDI和CPR5,使酶活力提高了6倍。虽然之前的研究表明,蛋白伴侣的共同表达可以成功增强蛋白质的分泌,但需要注意的是,伴侣蛋白的效果因蛋白和宿主不同而异,并不总是起着积极作用。例如,HUANG等[80]发现,共表达ERO1对毕赤酵母产米黑根毛霉脂肪酶有负向影响。SAMUEL等[81]的研究也发现Kar2p的共表达不利于南极假丝酵母脂肪酶的生产。因此,探索新的伴侣蛋白有望促进毕赤酵母中多种重组抗菌肽的折叠和分泌,并对影响分泌效率的因素有更深入的了解。
3.6 发酵条件的优化
除了以上优化方式,发酵条件也对重组蛋白的表达有重要影响。如pH、温度和甲醇浓度需根据蛋白性质优化,由于不同蛋白质的功能特性不同,毕赤酵母对甲醇的需求、最适培养温度、pH等条件也不同。毕赤酵母的生长适宜pH范围在3.0~7.0,但是毕赤酵母产蛋白质的最佳pH值可能会因菌株类型、重组蛋白的功能和性质而变化,因此优化pH值对重组蛋白的产量至关重要。研究表明,毕赤酵母生长的最佳温度在28~30 ℃,过高的温度可能会导致细胞死亡并释放蛋白酶,降解目的蛋白[82]。此外,甲醇虽能诱导蛋白表达,但过高浓度也会抑制细胞生长。因此,甲醇浓度需严格控制在适当范围内。
4 结论与展望
抗生素耐药性已成为全球公共卫生的重大挑战,严重削弱了抗生素的治疗效果,甚至导致某些抗生素失效。随着耐药性问题的加剧,抗菌肽因其具有广谱、高效的抑菌活性以及较低的耐药性风险而成为新型抗菌药物的重要候选。目前,虽然已经有3 000多种抗菌肽被鉴定,但因天然提取过程复杂且产量有限,只有少数被批准用于商业化应用。毕赤酵母作为一种成熟的异源蛋白表达宿主,已成功用于表达多种重组蛋白,展现了在抗菌肽生产中的巨大潜力。此外,尽管抗菌肽具备广谱抑菌活性,但迄今为止尚未报道有抑制酵母细胞生长的抗菌肽存在,因此毕赤酵母有望成为大规模生产抗菌肽的工具。
实现抗菌肽的广泛应用仍需克服多个挑战,例如,天然来源的抗菌肽的结构并不稳定,且部分抗菌肽因对哺乳动物细胞的毒性未能获得临床批准[83]。因此未来研究需要着力于以下几个方面:1)提高抗菌肽稳定性、降低其对细胞的毒性。近年来,已有研究者对抗菌肽进行了人工修饰,使其衍生物在多方面的性能上优于天然来源的抗菌肽和传统抗生素。例如,通过聚乙二醇化、乙酰化、二聚化、脂化、环化以及肽钉接等技术手段[84-85],优化了抗菌肽的结构,从而有效提升了其稳定性和活性。此外,利用生物相容性纳米载体包埋抗菌肽[86]以及增加抗菌肽中赖氨酸的数量[87]可显著降低其对哺乳动物细胞的毒性。2)深入研究抗菌肽抑菌机制,明确其作用靶点及分子机理,为优化设计提供理论支持。3)加强对不同来源抗菌肽的安全性和毒性评估,确保其在临床和各领域中的安全使用。
随着生物技术的进步及其生产工艺的完善,抗菌肽将逐步成为替代传统抗生素的关键工具,帮助应对微生物耐药性问题,并推动绿色农业和畜牧业的发展,为人类健康与可持续发展提供有效支持。
[1] AIESH B M, NAZZAL M A, ABDELHAQ A I, et al.Impact of an antibiotic stewardship program on antibiotic utilization, bacterial susceptibilities, and cost of antibiotics[J].Scientific Reports, 2023, 13(1):5040.
[2] COLLABORATORS A R.Global burden of bacterial antimicrobial resistance in 2019:A systematic analysis[J].Lancet, 2022, 399(10325):629-655.
[3] GOW N A R, JOHNSON C, BERMAN J, et al.The importance of antimicrobial resistance in medical mycology[J].Nature Communications, 2022, 13(1):5352.
[4] CHEN L, KUMAR S, WU H Y.A review of current antibiotic resistance and promising antibiotics with novel modes of action to combat antibiotic resistance[J].Archives of Microbiology, 2023, 205(11):356.
[5] MURPHY K E, SLOAN G F, LAWHERN G V, et al.Advances in antibiotic drug discovery:Reducing the barriers for antibiotic development[J].Future Medicinal Chemistry, 2020, 12(22):2067-2087.
[6] RIMA M, RIMA M, FAJLOUN Z, et al.Antimicrobial peptides:A potent alternative to antibiotics[J].Antibiotics, 2021, 10(9):1095.
[7] JI S Q, AN F Y, ZHANG T W, et al.Antimicrobial peptides:An alternative to traditional antibiotics[J].European Journal of Medicinal Chemistry, 2024, 265:116072.
[8] 朱泰承, 李寅.毕赤酵母表达系统发展概况及趋势[J].生物工程学报, 2015, 31(6):929-938.ZHU T C, LI Y.Recent development of Pichia pastoris system:Current status and future perspective[J].Chinese Journal of Biotechnology, 2015, 31(6):929-938.
[9] SABATIER J M.Antibacterial peptides[J].Antibiotics, 2020, 9(4):142.
[10] BORAHA, DEB B, CHAKRABORTY S.A crosstalk on antimicrobial peptides[J].International Journal of Peptide Research and Therapeutics, 2021, 27(1):229-244.
[11] LI X, ZUO S Y, WANG B, et al.Antimicrobial mechanisms and clinical application prospects of antimicrobial peptides[J].Molecules, 2022, 27(9):2675.
[12] 宋雪莹, 高圣玥, 宋岩, 等.蛙皮抗菌肽及其在畜禽生长性能、免疫功能、消化能力及疾病防治中的作用[J].饲料工业, 2023, 44(11):8-13.SONG X Y, GAO S Y, SONG Y, et al.Effects of antimicrobial peptides from frog skin on growth performance, immune function, digestive ability and disease prevention of livestock and poultry[J].Feed Industry, 2023, 44(11):8-13.
[13] 卞璐. 昆虫抗菌肽天蚕素的研究进展[J].中国动物保健, 2021, 23(4):116;123.BIAN L.Research progress of insect antibacterial peptide cecropin[J].China Animal Health, 2021, 23(4):116;123.
[14] CHEN N, JIANG C.Antimicrobial peptides:Structure, mechanism, and modification[J].European Journal of Medicinal Chemistry, 2023, 255:115377.
[15] ZHANG R, XU L J, DONG C M.Antimicrobial peptides:An overview of their structure, function and mechanism of action[J].Protein and Peptide Letters, 2022, 29(8):641-650.
[16] CIULLA M G, GELAIN F.Structure-activity relationships of antibacterial peptides[J].Microbial Biotechnology, 2023, 16(4):757-777.
[17] CHENG K T, WU C L, YIP B S, et al.High level expression and purification of the clinically active antimicrobial peptide P-113 in Escherichia coli[J].Molecules, 2018, 23(4):800.
[18] LIANG X L, YAN J X, LU Y W, et al.The antimicrobial peptide melectin shows both antimicrobial and antitumor activity via membrane interference and DNA binding[J].Drug Design, Development and Therapy, 2021, 15:1261-1273.
[19] DE MOURA G A, DE OLIVEIRA J R, ROCHA Y M, et al.Antitumor and antiparasitic activity of antimicrobial peptides derived from snake venom:A systematic review approach[J].Current Medicinal Chemistry, 2022, 29(32):5358-5368.
[20] MIAO F Z, LI Y, TAI Z G, et al.Antimicrobial peptides:The promising therapeutics for cutaneous wound healing[J].Macromolecular Bioscience, 2021, 21(10):2100103.
[21] YANG M J, TANG M, MA X J, et al.AP-57/C10orf99 is a new type of mutifunctional antimicrobial peptide[J].Biochemical and Biophysical Research Communications, 2015, 457(3):347-352.
[22] LIANG Q P, LIU Z M, LIANG Z Y, et al.Development strategies and application of antimicrobial peptides as future alternatives to in-feed antibiotics[J].Science of The Total Environment, 2024, 927:172150.
[23] ROBLES RAMIREZ O, OSUNA G, PLISSON F, et al.Antimicrobial peptides in livestock:A review with a one health approach[J].Frontiers in Cellular and Infection Microbiology, 2024, 14:1339285.
[24] TAI H M, HUANG H N, TSAI T Y, et al.Dietary supplementation of recombinant antimicrobial peptide Epinephelus lanceolatus piscidin improves growth performance and immune response in Gallus gallus domesticus[J].PLoS One, 2020, 15(3):e0230021.
[25] TOMASINSIG L, DE CONTI G, SKERLAVAJ B, et al.Broad-spectrum activity against bacterial mastitis pathogens and activation of mammary epithelial cells support a protective role of neutrophil cathelicidins in bovine mastitis[J].Infection and Immunity, 2010, 78(4):1781-1788.
[26] SAEED S I, MERGANI A, AKLILU E, et al.Antimicrobial peptides:Bringing solution to the rising threats of antimicrobial resistance in livestock[J].Frontiers in Veterinary Science, 2022, 9:851052.
[27] TANG R, TAN H, DAI Y, et al.Application of antimicrobial peptides in plant protection:Making use of the overlooked merits[J].Frontiers in Plant Science, 2023, 14:1139539.
[28] YU L, YANG M J, JIANG D, et al.Antibacterial peptides from Monochamus alternatus induced oxidative stress and reproductive defects in pine wood nematode through the ERK/MAPK signaling pathway[J].Pesticide Biochemistry and Physiology, 2023, 194:105511.
[29] TIWARI I, BHOJIYA A A, PRASAD R, et al.Putative role of anti-microbial peptide recovered from Lactiplantibacillus spp.in biocontrol activity[J].Current Microbiology, 2024, 81(3):88.
[30] DONG B, LIN Y J, SU Z W, et al.Recombinant human β-defensin130 inhibited the growth of foodborne bacteria through membrane disruption and exerted anti-inflammatory activity[J].Food Science and Biotechnology, 2022, 31(7):893-904.
[31] 朱宏宇, 王晓璐, 刘亚君, 等.产肌醇毕赤酵母细胞工厂的优化[J].微生物学通报, 2023, 50(9):3731-3746.ZHU H Y, WANG X L, LIU Y J, et al.Optimization of a Komagataella phaffii cell factory for producing inositol[J].Microbiology China, 2023, 50(9):3731-3746.
[32] CEREGHINO J L, CREGG J M.Heterologous protein expression in the methylotrophic yeast Pichia pastoris[J].FEMS Microbiology Reviews, 2000, 24(1):45-66.
[33] LIANG X X, JIANG H, SI X D, et al.Boosting expression level of plectasin in recombinant Pichia pastoris via 2A self-processing peptide assembly[J].Applied Microbiology and Biotechnology, 2022, 106(9-10):3669-3678.
[34] YU D P, ZHAO H H, WEN Y M, et al.Characterization and functional evaluation of NK-lysin from clownfish (Amphiprion ocellaris)[J].Fishes, 2023, 8(11):533.
[35] PIPIYA S O, KUDZHAEV A M, MIRZOEVA N Z, et al.Bioengineering the antimicrobial activity of yeast by recombinant thanatin production[J].Antibiotics, 2023, 12(12):1719.
[36] LI Z X, CHENG Q, GUO H N, et al.Expression of hybrid peptide EF-1 in Pichia pastoris, its purification, and antimicrobial characterization[J].Molecules, 2020, 25(23):5538.
[37] ÇOBANO LU
LU  , ARSLAN E, YAZ
, ARSLAN E, YAZ C
C A, et al.Expression of human β-defensin 2 (hBD-2) in Pichia pastoris and investigation of its binding efficiency with ACE-2[J].The Protein Journal, 2023, 42(4):399-407.
A, et al.Expression of human β-defensin 2 (hBD-2) in Pichia pastoris and investigation of its binding efficiency with ACE-2[J].The Protein Journal, 2023, 42(4):399-407.
[38] DONG X F, SHAN H, WANG S B, et al.High expression of antimicrobial peptides cathelicidin-BF in Pichia pastoris and verification of its activity[J].Frontiers in Microbiology, 2023, 14:1153365.
[39] ZHAN N, WANG T Y, ZHANG L C, et al.A eukaryotic expression strategy for producing the novel antimicrobial peptide PRW4[J].Brazilian Journal of Microbiology, 2020, 51(3):999-1008.
[40] DONG C M, LI M R, ZHANG R, et al.The expression of antibacterial peptide turgencin A in Pichia pastoris and an analysis of its antibacterial activity[J].Molecules, 2023, 28(14):5405.
[41] ZHAO L, LI L, HU M Y, et al.Heterologous expression of the novel dimeric antimicrobial peptide LIG in Pichia pastoris[J].Journal of Biotechnology, 2024, 381:19-26.
[42] ZHAO Z H, ZHANG C X, LI J, et al.Effect of tandem repeats of antimicrobial peptide CC34 on production of target proteins and activity of Pichia pastoris[J].Protein Expression and Purification, 2023, 212:106342.
[43] HUO X C, WANG P X, ZHAO F X, et al.High-efficiency expression of a novel antimicrobial peptide I20 with superior bactericidal ability and biocompatibility in Pichia pastoris and its efficiency enhancement to aquaculture[J].Aquaculture, 2024, 579:740149.
[44] HUANG Y N, GAO L G, LIN M, et al.Recombinant expression of antimicrobial peptides in Pichia pastoris:A strategy to inhibit the Penicillium expansum in pears[J].Postharvest Biology and Technology, 2021, 171:111298.
[45] AHMAD B, HANIF Q, WEI X B, et al.In vitro impact of yeast expressed hybrid peptide CATH-2TP5 as a prophylactic measure toward sepsis and inflammation[J].Frontiers in Bioengineering and Biotechnology, 2020, 8:454.
[46] LI X H, FAN Y, LIN Q, et al.Expression of chromogranin A-derived antifungal peptide CGA-N12 in Pichia pastoris[J].Bioengineered, 2020, 11(1):318-327.
[47] NIKPOOR M, LOHRASBI-NEJAD A, ZOLALA J.Heterologous expression and functional characterization of CAP18 from Oryctolagus cuniculus[J].Reports of Biochemistry &Molecular Biology, 2022, 10(4):622-632.
[48] ZHAN N, ZHANG L C, YANG H, et al.Design and heterologous expression of a novel dimeric LL37 variant in Pichia pastoris[J].Microbial Cell Factories, 2021, 20(1):143.
[49] KJELDSEN A, KAY J E, BAXTER S, et al.The fluorescent protein iLOV as a reporter for screening of high-yield production of antimicrobial peptides in Pichia pastoris[J].Microbial Biotechnology, 2022, 15(7):2126-2139.
[50] ZHANG X Y, XI Z W, ZHAO H T, et al.Efficient heterologous expression of bovine lactoferrin in Pichia pastoris and characterization of antibacterial activity[J].Systems Microbiology and Biomanufacturing, 2025, 5(1):237-248.
[51] 王莲哲, 江宏浩, 唐宜飞, 等.新型抗菌肽Temporin-SHf在毕赤酵母中的表达及诱导条件优化[J].食品与发酵工业, 2020, 46(14):98-102.WANG L Z, JIANG H H, TANG Y F, et al.Expression of novel antibacterial peptide Temporin-SHf in Pichia pastoris and optimization of induction conditions[J].Food and Fermentation Industries, 2020, 46(14):98-102.
[52] 李天阳, 张爱忠, 李俊, 等.含抗菌肽CC31毕赤酵母工程菌培养基及其培养条件的优化[J].中国生物制品学杂志, 2020, 33(2):197-202.LI T Y, ZHANG A Z, LI J, et al.Optimization of culture medium and culture condition for recombinant Pichia pastoris containing CC31[J].Chinese Journal of Biologicals, 2020, 33(2):197-202.
[53] MENG D M, LI W J, SHI L Y, et al.Expression, purification and characterization of a recombinant antimicrobial peptide Hispidalin in Pichia pastoris[J].Protein Expression and Purification, 2019, 160:19-27.
[54] LI H M, ALI Z, LIU X L, et al.Expression of recombinant tachyplesin I in Pichia pastoris[J].Protein Expression and Purification, 2019, 157:50-56.
[55] POPA C, SHI X Q, RUIZ T, et al.Biotechnological production of the cell penetrating antifungal PAF102 peptide in Pichia pastoris[J].Frontiers in Microbiology, 2019, 10:1472.
[56] LAN J, MA Q Y, LI J Z, et al.Expression of T9W in Pichia pastoris and the protective roles of T9W in ICR Mice[J].Biotechnology Letters, 2020, 42(1):67-78.
[57] 张瑞. 抗菌肽Turgencin A在毕赤酵母中重组表达及其抗菌活性特性研究[D].天津:天津科技大学, 2023.ZHANG R.Recombinant expression of antimicrobial peptide Turgencin A in saccharomyces cerevisiae and characterization of its antibacterial activity[D].Tianjin:Tianjin University of Science and Technology, 2023.
[58] 虞维红. 利用荧光蛋白做分子信标的非甲醇诱导表达PR39高表达毕赤酵母菌株的构建和筛选[D].广州:暨南大学, 2019.YU W H.Construction and selection of non-methanol induction Pichia pastoris strain with high expression PR39 using fluorescentprotein as molecular beacon[D].Guangzhou:Jinan University, 2019.
[59] 林明, 姜路花, 余挺.Ace-AMP1过表达毕赤酵母工程菌株的构建及其对梨青霉病的抑制作用[J].浙江大学学报(农业与生命科学版), 2019, 45(1):39-46.LIN M, JIANG L H, YU T.Overexpression of Ace-AMP1 in Pichia pastoris on enhancing the inhibition of blue mold on pears[J].Journal of Zhejiang University (Agriculture and Life Sciences), 2019, 45(1):39-46.
[60] 于婷. 杂合抗菌肽Me-HNP1基因设计及其在毕赤酵母中的表达[D].长春:吉林农业大学, 2020.Yu T.Design of the hybrid antibacterial peptide Me-HNP1 gene and its expression in Pichia pastoris[D].Changchun:Jilin Agricultural University, 2020.
[61] KRÜGER M K, SØRENSEN M A.Aminoacylation of hypomodified tRNAGlu in vivo[J].Journal of Molecular Biology, 1998, 284(3):609-620.
[62] 钊倩倩, 张秀华, 刘飞.人组织因子的密码子优化及其在毕赤酵母中的高水平发酵制备[J].药物生物技术, 2021, 28(1):1-5.ZHAO Q Q, ZHANG X H, LIU F.Codon optimization and high level fermentation of human tissue factor in Pichia pastoris[J].Pharmaceutical Biotechnology, 2021, 28(1):1-5.
[63] 王艳慧, 陶妍.三疣梭子蟹PtCrustin2抗菌肽基因优化及其在毕赤酵母中高效表达[J].生物学杂志, 2019, 36(4):42-46.WANG Y H, TAO Y.Gene optimization for swimming crab PtCrustin2 antimicrobial peptide and its efficient expression in Pichia pastoris[J].Journal of Biology, 2019, 36(4):42-46.
[64] WANG Y X, JIANG S, JIANG X X, et al.Cloning and codon optimization of a novel feline interferon omega gene for production by Pichia pastoris and its antiviral efficacy in polyethylene glycol-modified form[J].Virulence, 2022, 13(1):297-309.
[65] 李会宣, 董向峰, 高健.Pichia pastoris醇氧化酶基因AOX1启动子研究进展[J].生物技术, 2013, 23(4):83-87.LI H X, DONG X F, GAO J.Progress in promoter of alcohol oxidase gene aox1 from Pichia pastoris[J].Biotechnology, 2013, 23(4):83-87.
[66] WATERHAM H R, DIGAN M E, KOUTZ P J, et al.Isolation of the Pichia pastoris glyceraldehyde-3-phosphate dehydrogenase gene and regulation and use of its promoter[J].Gene, 1997, 186(1):37-44.
[67] CHE Z Q, CAO X Y, CHEN G G, et al.An effective combination of Codon optimization, gene dosage, and process optimization for high-level production of fibrinolytic enzyme in Komagataella phaffii (Pichia pastoris)[J].BMC Biotechnology, 2020, 20(1):63.
[68] PENG Y H, WANG Y P, LIU X Y, et al.Expression and surface display of an acidic cold-active chitosanase in Pichia pastoris using multi-copy expression and high-density cultivation[J].Molecules, 2022, 27(3):800.
[69] LIU C, GONG J S, SU C, et al.Increasing gene dosage and chaperones co-expression facilitate the efficient dextranase expression in Pichia pastoris[J].LWT, 2023, 181:114753.
[70] DAI W L, DONG H F, ZHANG Z K, et al.Enhancing the heterologous expression of a thermophilic endoglucanase and its cost-effective production in Pichia pastoris using multiple strategies[J].International Journal of Molecular Sciences, 2023, 24(19):15017.
[71] DUAN G D, DING L M, WEI D S, et al.Screening endogenous signal peptides and protein folding factors to promote the secretory expression of heterologous proteins in Pichia pastoris[J].Journal of Biotechnology, 2019, 306:193-202.
[72] FULLER R S, STERNE R E, THORNER J.Enzymes required for yeast prohormone processing[J].Annual Review of Physiology, 1988, 50:345-362.
[73] 张娜, 闫亚茹, 武运, 等.信号肽优化提高葡萄糖氧化酶在毕赤酵母中的表达量[J].中国农业科技导报, 2023, 25(2):211-219.ZHANG N, YAN Y R, WU Y, et al.Signal peptide optimization increases glucose oxidase expression in Pichia pastoris[J].Journal of Agricultural Science and Technology, 2023, 25(2):211-219.
[74] UTAMI N, NURDIANI D, HARIYATUN H, et al.Full-length versus truncated α-factor secretory signal sequences for expression of recombinant human insulin precursor in yeast Pichia pastoris:A comparison[J].Journal of Genetic Engineering and Biotechnology, 2023, 21(1):67.
[75] 梁启星, 石竟成, 金学荣, 等.肠激酶在毕赤酵母中的分泌表达优化[J].生物工程学报, 2020, 36(8):1689-1698.LIANG Q X, SHI J C, JIN X R, et al.Optimization of enterokinase secretion in Pichia pastoris[J].Chinese Journal of Biotechnology, 2020, 36(8):1689-1698.
[76] LIU C, GONG J S, SU C, et al.Pathway engineering facilitates efficient protein expression in Pichia pastoris[J].Applied Microbiology and Biotechnology, 2022, 106(18):5893-5912.
[77] VIJAYAKUMAR V E, VENKATARAMAN K.A systematic review of the potential of Pichia pastoris (Komagataella phaffii) as an alternative host for biologics production[J].Molecular Biotechnology, 2024, 66(7):1621-1639.
[78] WANG Y S, WANG B Q, GAO Y H, et al.Highly efficient expression and secretion of human lysozyme using multiple strategies in Pichia pastoris[J].Biotechnology Journal, 2023, 18(11):2300259.
[79] JIANG L X, GUAN X, LIU H J, et al.Improved production of recombinant carboxylesterase FumDM by co-expressing molecular chaperones in Pichia pastoris[J].Toxins, 2023, 15(2):156.
[80] HUANG J J, ZHAO Q Y, CHEN L X, et al.Improved production of recombinant Rhizomucor miehei lipase by coexpressing protein folding chaperones in Pichia pastoris, which triggered ER stress[J].Bioengineered, 2020, 11(1):375-385.
[81] SAMUEL P, PRASANNA VADHANA A K, KAMATCHI R, et al.Effect of molecular chaperones on the expression of Candida antarctica lipase B in Pichia pastoris[J].Microbiological Research, 2013, 168(10):615-620.
[82] ESKANDARI A, NEZHAD N G, LEOW T C, et al.Current achievements, strategies, obstacles, and overcoming the challenges of the protein engineering in Pichia pastoris expression system[J].World Journal of Microbiology &Biotechnology, 2023, 40(1):39.
[83] KHABBAZ H, KARIMI-JAFARI M H, SABOURY A A, et al.Prediction of antimicrobial peptides toxicity based on their physico-chemical properties using machine learning techniques[J].BMC Bioinformatics, 2021, 22(1):549.
[84] LOURENÇO A L P, RIOS T B, DA SILVA  P, et al.Peptide stapling applied to antimicrobial peptides[J].Antibiotics, 2023, 12(9):1400.
P, et al.Peptide stapling applied to antimicrobial peptides[J].Antibiotics, 2023, 12(9):1400.
[85] MIGO D, NEUBAUER D, KAMYSZ W.Hydrocarbon stapled antimicrobial peptides[J].The Protein Journal, 2018, 37(1):2-12.
D, NEUBAUER D, KAMYSZ W.Hydrocarbon stapled antimicrobial peptides[J].The Protein Journal, 2018, 37(1):2-12.
[86] CRESTI L, CAPPELLO G, PINI A.Antimicrobial peptides towards clinical application-a long history to be concluded[J].International Journal of Molecular Sciences, 2024, 25(9):4870.
[87] 肖浩然. 一种抗菌肽M4的设计及应用[D].成都:电子科技大学, 2024.XIAO H R.Design and application of an antimicrobial peptide M4.Chengdu:University of Electronic Science and Technology of China, 2024.