木质纤维素是世界上最丰富、成本最廉价的资源[1],有巨大的再利用价值。我国是农业大国,每年农业产生的废弃物数量庞大。其中,木质纤维素中的半纤维素是由几种不同类型的单糖(木糖、半乳糖、葡萄糖、甘露糖等)和糖醛酸以不同比例构成的异质多聚体,占木质纤维组织总量的20%~30%[2],是大自然中除纤维素之外含量最丰富的多糖[3]。半纤维素结合在纤维组织的表层[4],其在秸秆、甘蔗、玉米芯、麸皮等废弃物中含量较高。半纤维素组成中以木聚糖含量最高,是自然界中含量仅次于纤维素的生物聚合物,是植物半纤维素的主要成分[5]。木聚糖的含量和结构因不同的生物种类而有所差别[6],其含量在15%~35%,主链骨架主要由木糖单元经β-1,4-糖苷键连接而成,化学式为(C5H8O4)n。木聚糖自然条件下很难彻底分解,但微生物所产木聚糖酶可将半纤维素中的木聚糖水解成可利用的低聚木糖[7]。
木聚糖酶是一种重要的糖苷水解酶类,能将木聚糖水解成低聚木糖,广泛应用于饲料、造纸、食品、营养保健、生物染料、医药等行业[8]。因此,木聚糖酶的研究具有巨大的工业应用前景和商业潜力。木聚糖酶是自然界中分布十分广泛的一类酶,迄今为止在动物、植物组织、原生动物以及微生物等中均有发现[9],但主要来源还是微生物。大多数商业木聚糖酶都是从真菌中提取出来的,这主要是由于它们的酶产量较高。然而,由于真菌的生长周期较长,而且大部分的木聚糖酶极端环境耐受性差,因此在造纸、饲料等工业生产应用中受到限制。细菌木聚糖酶因易于培养、生产率高、催化活性强和在极端条件下耐受性好而备受关注[10]。所以,从自然界中筛选和鉴定具有优良性能的细菌源木聚糖酶,不仅有助于克服现有技术的局限性,还能进一步推动木聚糖酶在各行业中的广泛应用,为实现资源的有效转化和环境保护做出重要贡献。
本研究通过筛选自然界土壤中高产木聚糖酶的微生物,成功分离出一株木聚糖酶活性显著的细菌菌株。经过形态学和分子生物学鉴定、菌株发酵产酶条件探索与相关的酶学特性分析,对该菌株的生物学和木聚糖酶的特性有了较深入的认识。以期增进对木聚糖酶发酵菌株的理解,而且为半纤维素向能源物质的工业化转化奠定了理论和技术基础,具有重要的科研价值和广阔的应用潜力。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株
土壤采集于茂名露天矿生态公园。
1.1.2 主要试剂药品
山毛榉木木聚糖,上海源叶生物高分子材料公司;玉米芯粉、细麸皮、黄豆饼粉、玉米浆干粉,北京鸿润宝顺科技有限公司;Premix Ex Taq Hot Start Version、DNA marker,Takara公司;葡萄糖、木糖、羧甲基纤维素钠、胰蛋白胨、琼脂粉、酵母粉、(NH4)2SO4及其他试剂,生工生物工程(上海)股份有限公司。
1.1.3 培养基
斜面培养基配方(g/L):葡萄糖20、酵母膏5、琼脂20、ddH2O定容至1 L。
基础发酵培养基(g/L):细麸皮20、蛋白胨5、KH2PO4 1、MgSO4·7H2O 0.5、(NH4)2SO4 2、CaCl2 4、ddH2O定容至1 L。
碳源优化培养基(g/L):各种碳源(玉米芯粉、葡萄糖、黄豆饼粉、木聚糖、羧甲基纤维素钠、几丁质、酵母粉、细麸皮)20、(NH4)2SO4 2、KH2PO4 1、MgSO4·7H2O 0.5、CaCl2 4、ddH2O定容至1 L。
氮源优化培养基(g/L):各种氮源[酵母粉、胰蛋白胨、(NH4)2SO4] 5、细麸皮 20、KH2PO4 1、MgSO4·7H2O 0.5、CaCl2 4、ddH2O定容至1 L。
1.2 仪器与设备
HH-2型恒温水浴锅,常州越新仪器制造有限公司;DH43D型电热恒温培养箱,天津市泰斯特仪器有限公司;LC-LX-H185C型高速离心机、JT-D型电子天平,上海力辰邦西仪器科技有限公司;THZ-98C型恒温振荡摇床,上海一恒科学仪器有限公司;LX-B50L型立式压力蒸汽高压灭菌器,合肥华泰医疗设备有限公司;722 N型可见光分光光度计,上海菁华科技仪器有限公司;SW-CJ-1D型单人超净工作台,苏州净化设备有限公司;NA-1型PCR仪,翌圣生物科技(上海)股份有限公司。
1.3 实验方法
1.3.1 菌株的分离纯化
称取5 g土壤加入已装有45 mL无菌水,放置于30 ℃、200 r/min摇床中充分振荡30 min。进一步将土壤悬液梯度稀释至10-5~10-7,分别取100 μL上述3个稀释液均匀涂布于以木聚糖为唯一碳源的固体筛选培养基,待水分挥发后放置于30 ℃的培养箱培养3 d。
1.3.2 菌株的分子鉴定
扩增16S rDNA序列引物为27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′[11],并委托生工生物工程(上海)股份有限公司对菌株16S rDNA进行测序,将测序结果序列与NCBI网站上已公布的序列信息进行BLAST比对,进一步使用MEGA 7.0软件通过邻接法(neighbor-joining method)构建系统发育树[12]。
1.3.3 DNS法测定木聚糖酶活性
采用参考文献[13]所述比色法测定还原糖含量。取200 μL粗酶液加入800 μL pH 6.0的1%(质量分数)木聚糖中,在55 ℃下酶解30 min后立即加入2 mL DNS试剂,将其置于沸水中加热10 min;结束后采用冰浴降温,测定OD540处的吸光度。用经高温失活的粗酶溶液作为空白对照组。
1.3.4 产酶条件的优化
发酵培养基成分优化:配制碳源、氮源优化培养基,在碳源优化培养基中替换不同的碳源(细麸皮、玉米芯粉、葡萄糖、木聚糖、羧甲基纤维素钠、酵母粉、几丁质、黄豆饼粉)或在氮源优化培养基中替换不同的氮源[酵母粉、蛋白胨、(NH4)2SO4],于37 ℃、180 r/min振荡摇床培养,以发酵粗酶液的木聚糖酶活力为参考指标来确定筛选菌株的最佳发酵碳源、氮源。每组实验重复3次。
发酵条件的优化:配制发酵温度优化培养基与发酵初始pH培养基,对发酵时间(24、48、72 h和96 h)、发酵温度(25、30、35 ℃和40 ℃)、初始pH(4、5、6、7、8、9、10)进行试验,最后以发酵粗酶液的木聚糖酶活力为参考指标来确定筛选菌株的最适发酵条件。每组实验重复3次。
1.3.5 酶学性质研究
1.3.5.1 木聚糖酶的最适温度
在pH 7.0环境条件下,设置一系列温度梯度(30、40、45、50、55 ℃和60 ℃)为粗酶液催化木聚糖降解温度,按照1.3.3节方法测定不同温度的酶活力,以此分析木聚糖酶的最优反应温度。
1.3.5.2 木聚糖酶的最适pH
在已确定的木聚糖酶最佳反应温度下,调整反应体系的pH值(3~10),考察不同pH对催化反应的影响。按照1.3.3节所述的实验方法,测定木聚糖酶活力来确定木聚糖酶的最适pH。
1.3.5.3 木聚糖酶的温度稳定性
将粗酶液分别置于不同温度(30、40、45、50、55 ℃和60 ℃)下孵育1 h,然后在最适反应条件下根据1.3.3节所述方法测定木聚糖酶活力,以考察酶的温度稳定性。
1.3.5.4 木聚糖酶的pH稳定性
将粗酶液分别置于不同pH值(3~10)缓冲液中保温1 h。然后在最适条件下依据1.3.3节所述的实验方法测定木聚糖酶活力,从而考察其pH稳定性。
1.3.5.5 金属离子与化学试剂对木聚糖酶活力的影响
为考察不同金属离子与化学试剂对木聚糖酶活力的影响,分别将粗酶液与含有10 mmol/L不同金属离子(Ni2+、Mg2+、Ca2+、Zn2+、Cu2+、Co2+、Mn2+、Fe2+、Fe3+)或乙二胺四乙酸(ethylene diamine tetraacetie acid,EDTA)、十二烷基磺酸钠(sodium dodecyl sulfate,SDS)溶液混合,同时以高温灭活的粗酶液作为对照,按照1.3.3节所述的实验方法测定木聚糖酶活力,以分析不同金属离子与化学试剂对酶活力的影响。
2 结果与分析
2.1 菌株的筛选与鉴定
2.1.1 菌株的筛选与酶活力测定
采集茂名露天矿公园的土壤,通过梯度稀释,在以木聚糖为唯一碳源的固体筛选培养基上长出54株菌株,挑取不同菌株到基础发酵培养基发酵培养5 d。木聚糖酶活性如表1所示,测得有4株菌株的木聚糖酶活性较高,其酶活力高低依次是XLY1>XLY2>XLY4>XLY3,其中活力最高为XLY1菌株,因此挑取这一菌株进行下一步试验。
表1 菌株所产木聚糖酶的酶活力 单位:U/mL
Table 1 Enzyme activity of xylanase produced by strains
菌株编号XLY1XLY2XLY3XLY4酶活力38.61±2.6521.65±3.4816.58±2.2220.26±2.67
2.1.2 形态学鉴定
平板上的XLY1菌落具有明显的形态特征,如颜色为灰白色,表面光滑,质地湿润,菌落较大且形状不规则,使用接种环易挑取。采用革兰氏染色法进行光学显微观察,细胞呈椭圆至短棒状,染色后细胞呈蓝紫色,表明XLY1菌株为革兰氏阳性菌(图1)。
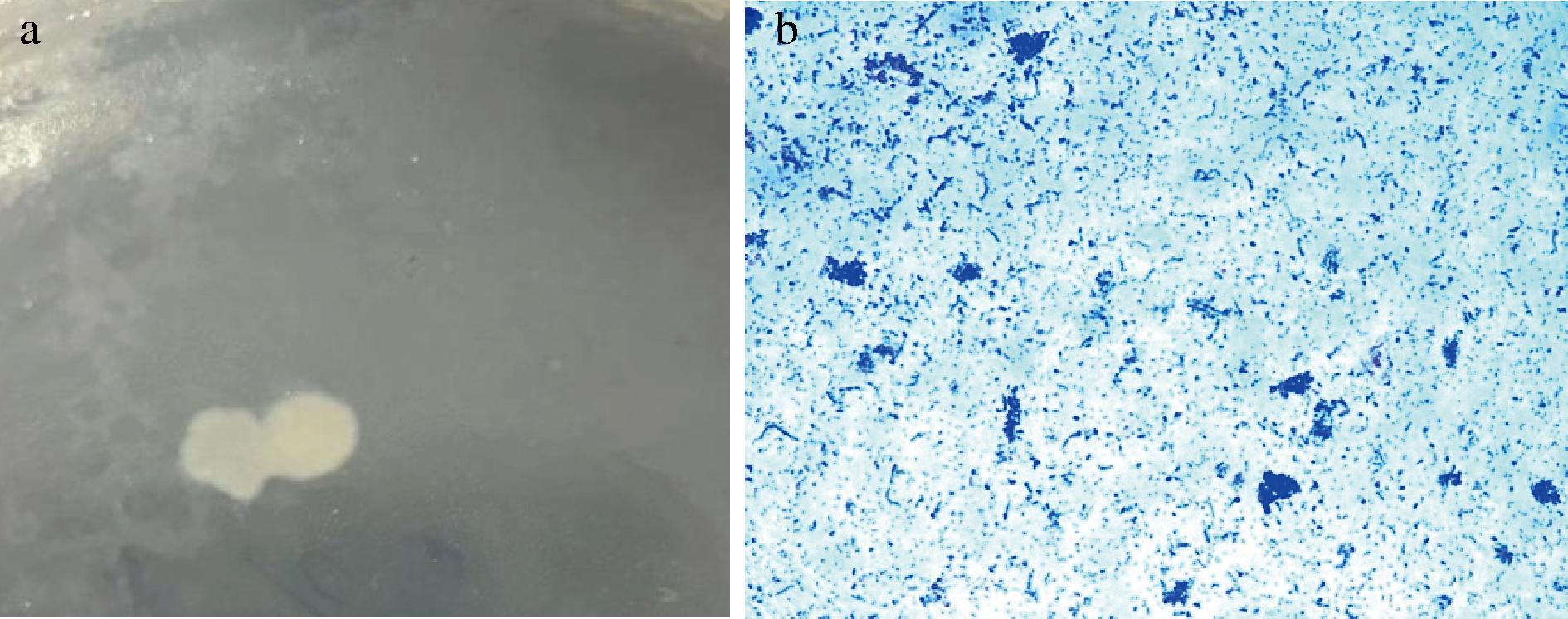
a-形态图;b-显微观察图
图1 XLY1菌株菌落形态图及革兰氏染色
Fig.1 Bacterial colony morphology map and gram staining of XLY1 strain
2.1.3 分子生物学鉴定
提取XYL1菌株基因组,使用通用引物27F和1492R扩增其16S rDNA,扩增结果如图2所示。在大约1 500 bp处有一条明显的DNA条带,大小与细菌16S rDNA理论值1 540 bp相符。将条带进行切胶回收纯化,委托生工生物工程(上海)股份有限公司进行测序。

M-DNA marker;1-XYL1菌株。
图2 XYL1菌株的16S rDNA扩增电泳图
Fig.2 16S rDNA of XYL1 strain amplification electrophoresis image
将测序结果输入在线网站NCBI BLAST进行序列比对,比对结果如图3-a所示,XYL1菌株的16S rDNA序列与赖氨酸芽孢杆菌属(Lysinibacillus)的覆盖率高,可达99%以上,与Lysinibacillus xylanilyticus strain T6(GenBank登录号:OR285154.1)、Lysinibacillus sp.strain Firmi-71(GenBank登录号:MH683160.1)、Lysinibacillus sp.JCM 28310(GenBank登录号:LC133657.1)菌株的16S rDNA相似度分别高达99.31%、99.24%、99.17%。
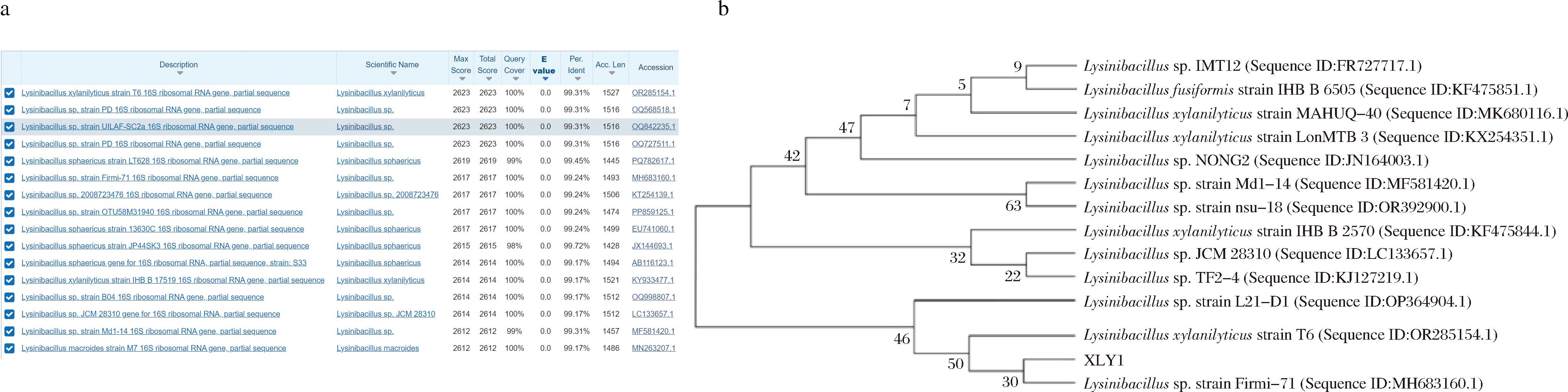
a-XYL1菌株的16S rDNA序列比对结果;b-基于16S rDNA基因序列构建系统发育进化树
图3 XYL1菌株的分子生物学鉴定
Fig.3 Molecular biology identification of XYL1 strain
通过NCBI BLAST比对后,随机选取若干个菌株的16S rDNA序列与XYL1序列使用MEGA7.0软件构建系统进化树。结果表明,XLY1菌株与登录号为MH683160.1的赖氨酸芽孢杆菌株同源性最高,聚为一枝,并与OR285154.1相邻(图3-b)。从菌株形态学和分子生物学鉴定来看,XLY1菌株被鉴定为赖氨酸芽孢杆菌(Lysinibacillus),并命名为Lysinibacillus sp.XYL1。
2.2 产木聚糖酶发酵培养条件优化
2.2.1 碳源的优化
不同碳源对发酵产酶的影响结果如图4-a所示,结果表明XLY1菌株能利用单糖(葡萄糖)或者降解其他大分子生物质转化为菌株自身生长的碳来源,继而合成各种生物大分子。其中,在所研究的碳源中,以细麸皮为碳源所产生的木聚糖酶活力最高(28.71 U/mL),故细麸皮为最佳碳源。原因可能是麸皮的主要成分包含46%的非淀粉多糖,其中阿拉伯木聚糖约为70%,约占麸皮组成的20%[14],对木聚糖酶有较好的诱导作用,表明该菌的木聚糖酶合成为诱导型[15]。另外,麸皮还可作为微生物生长的氮源,可在菌株生长过程中为其核酸、蛋白质等物质的合成提供原料,影响到微生物的生长代谢和蛋白合成量。
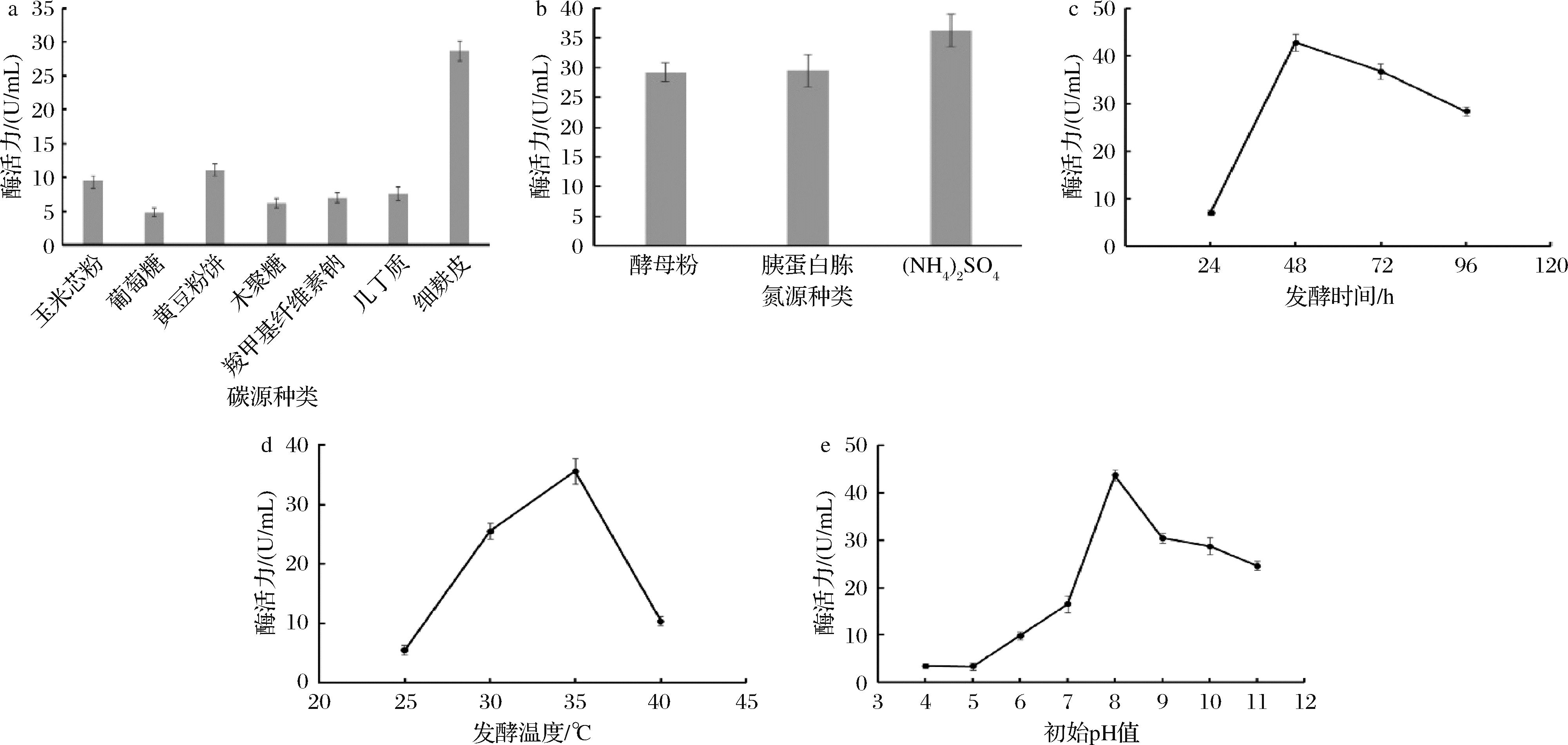
a-不同碳源对产木聚糖酶的影响;b-不同氮源对产木聚糖酶的影响;c-不同发酵时间对产木聚糖酶的影响;d-不同发酵温度对产木聚糖酶的影响;e-不同初始pH值对对产木聚糖酶的影响
图4 XLY1菌株产木聚糖酶的发酵培养条件优化
Fig.4 Optimization of fermentation conditions for xylanase production by XLY1 strain
此外,该菌也能分泌纤维素酶和甲壳素酶来分别降解羧甲基纤维素钠和几丁质成为可利用的寡糖供菌体生长代谢利用。木聚糖作为碳源所产木聚糖酶活力仅为6.21 U/mL,远低于细麸皮,可能原因是木聚糖提供的营养成分比较单一,合成的木聚糖酶降解木聚糖成为寡糖的量难以满足菌株生长代谢的碳源供给,造成菌株生长量低而合成的木聚糖酶总量低。
2.2.2 氮源的优化
不同氮源对发酵产酶的影响结果如图4-b所示,XLY1菌株对3种试验的氮源吸收利用都比较良好,其中以(NH4)2SO4为氮源时获得木聚糖酶活力最高(36.27 U/mL)。(NH4)2SO4溶解于培养基水溶液中生成SO42-和NH4+,NH4+能被微生物快速吸收利用,合成生物大分子。而酵母粉和胰蛋白胨则需要菌株分解成小分子,才能进一步被菌株吸收利用,从而减慢了木聚糖酶等物质来源的合成速度。
2.2.3 发酵时间对产酶的影响
每隔24 h取发酵液离心并测上清液的木聚糖酶活性。由图4-c可知,XLY菌株的木聚糖酶活力随着发酵时间延长体现出酶活力先增高后降低趋势。在发酵时间为48 h时,木聚糖酶的酶活力最优(42.76 U/mL)。48 h后酶活力出现缓慢下降,可能原因是发酵时间过长,培养基营养物质被逐渐消耗殆尽,细胞合成量趋于稳定,大分子合成速度减慢[16]。此外,发酵产生的副产物可能对发酵有负面影响,所产的蛋白酶可能会水解木聚糖酶,从而呈现出木聚糖酶活力下降。所以,发酵最优时间为48 h。
2.2.4 发酵温度对产酶的影响
在培养温度为25~35 ℃时,随着菌株XLY1培养温度的提高,木聚糖酶酶活力也随之增高,并在35 ℃时酶活力达到最大(46.88 U/mL)(图4-d)。在较低的培养温度范围内,温度的提高不但能加快物质的转化速度和物质的分子运动,而且能提高酶的催化反应效率,从而能加快菌株的生长和代谢速度。超过35 ℃后,继续提高培养温度会导致酶活力快速下降,可能原因是温度过高导致酶逐渐变性,蛋白质结构遭到破坏,使酶活性降低;又或者是因为较高的培养温度使菌株内大部分酶活力都下降,影响到菌株的生命物质转化和生长代谢。
2.2.5 初始pH值对产酶的影响
初始pH值为5~8时酶活力呈上涨趋势,尤其是pH 7~8时陡然上升,而后8~11时酶活力呈下降趋势,但也普遍高于酸性条件下的酶活力。所以当初始pH值为8时,发酵产酶效果最佳,酶活力最高可达57.48 U/mL,说明在偏碱性环境下XLY1菌株发酵产木聚糖酶(图4-e)。培养基在呈酸性或过碱时的酶活力均有所下降,可能原因是当环境过酸或过碱时,菌株的其他与生长代谢相关的酶类都受到抑制作用。当pH值为7~8时酶活力陡然上升的原因可能是其接近菌株生长的最适pH,各种酶类呈现最优状态,酶的稳定性与活性基团的解离状态最佳,从而表现出酶活力突增的现象,对细胞生长和产酶都具有积极作用。
2.3 酶学性质的研究
2.3.1 木聚糖酶的最适反应温度
随着反应温度从30 ℃上升至55 ℃,木聚糖酶的酶活力呈现出缓慢提高的趋势,并在55 ℃条件下酶活力达到最大值(图5-a)。超过55 ℃后,酶活力出现下降。从总体来看,在40~60 ℃,木聚糖酶的酶活力都较好,高于64%。
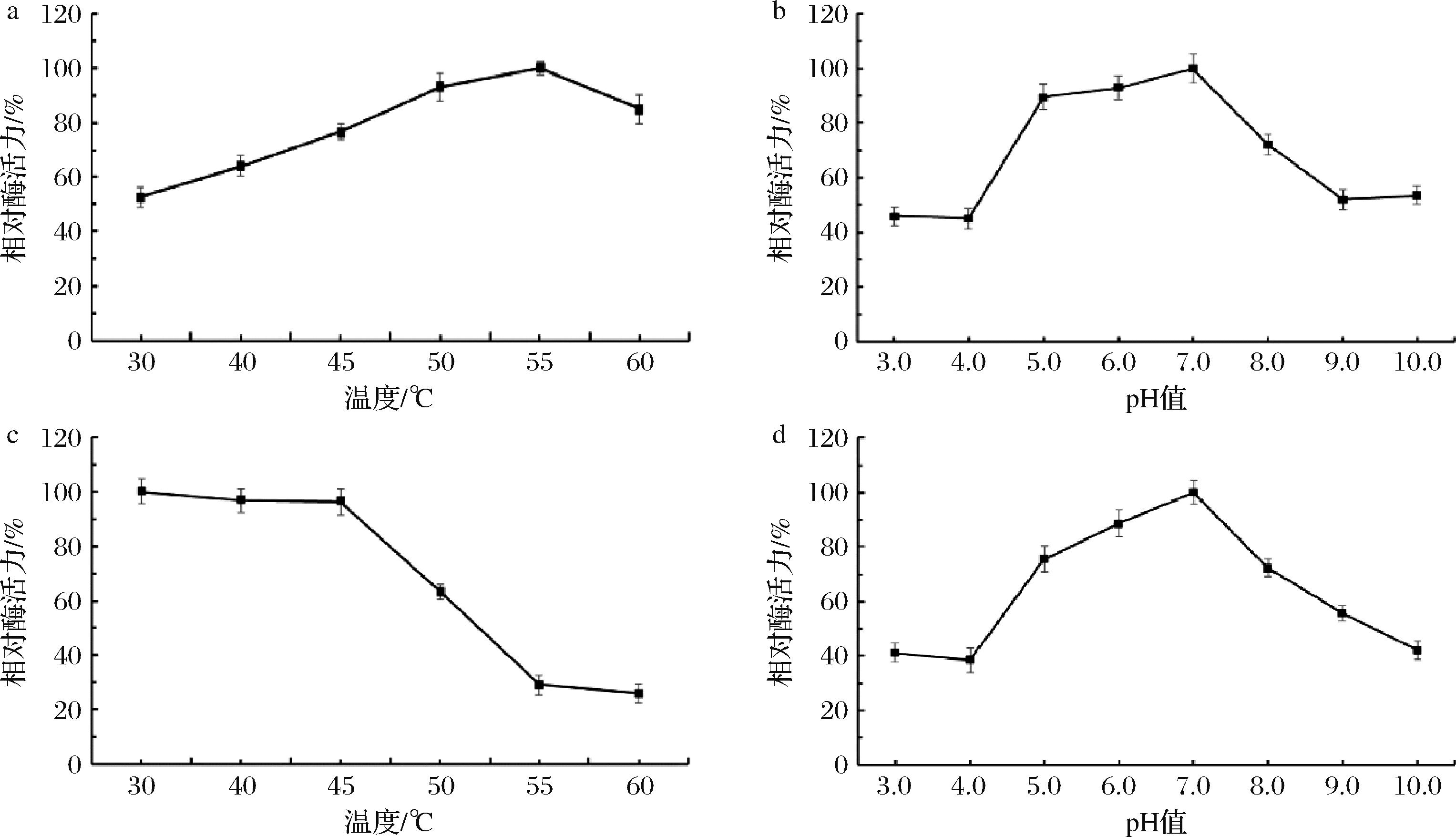
a-温度对木聚糖酶活力的影响;b-pH对木聚糖酶活力的影响;c-木聚糖酶的热稳定性;d-木聚糖酶的pH稳定性
图5 木聚糖酶的酶学性质
Fig.5 Enzymatic properties of xylanase
2.3.2 木聚糖酶的最适pH
通过比较不同pH条件下的酶活力,确定木聚糖酶活力的最适pH。由图5-b可知pH值在5~7时,木聚糖酶的活力保持在89%以上,且在pH 7.0时达到最大值;而在酸性条件(pH 3~4)下,酶活力都较低,剩余酶活力接近45%;当pH值高于7.0,酶活力也快速降低。这一结果表明,该酶在弱酸至中性条件下表现出更高的反应效率,故XLY1菌株所产木聚糖酶更适合在弱酸至中性环境下进行反应。pH值过高或过低会影响酶活力中心上关键氨基酸基团的解离状态,酶蛋白的构象受到不可逆的变化[17],导致木聚糖酶和底物结合力降低或使木聚糖酶的催化功能受损,从而表现出酶活力降低。
2.3.3 温度稳定性
如图5-c所示,在30~50 ℃保温1 h后,木聚糖酶的活力均保持在63%以上,特别地,在30~45 ℃内,木聚糖酶热稳定性十分优异,酶活力接近100%;然而,当温度超过45 ℃后,酶剩余活力开始逐渐降低,直至高于55 ℃后,仍保持微弱的活性。虽然55 ℃为木聚糖酶的最适反应温度(图5-a),而木聚糖酶在此温度下的热稳定性比较差,相对酶活力只有20%左右。这说明温度对酶活力和酶结构稳定性的影响并不完全一致,虽然在高温条件下能加快分子的运动速度和催化速度[18],但是过高的温度也会导致酶分子结构发生不可逆的破坏,导致酶在最适温度附近容易发生热不稳定性[19];除了温度影响外,酶的热稳定性还可能受到pH、离子浓度等其他环境因素的影响,导致其在55 ℃下很容易发生热变性。
2.3.4 木聚糖酶的pH稳定性
木聚糖酶的pH稳定性趋势(图5-d)与pH对其酶活力(图5-b)的影响基本一致。在pH 5~8,木聚糖酶剩余相对酶活力均维持在72%以上,特别是在弱酸至中性环境中,该酶能保持较好的稳定性。可能原因是在pH 5~8木聚糖酶的活性中心结构和离子状态都较为稳定,这有利于保持酶结构稳定性和活性。这表明XLY1菌株所产的木聚糖酶更适合应用于酸性至中性工业环境中,如饲料、酿酒、食品工业等[20]。
2.3.5 金属离子及化学试剂对酶活力的影响
不同金属离子及化学试剂对酶的影响不一,如表2所示,SDS、Co2+、Fe2+、Fe3+对木聚糖酶的活力产生了显著的抑制效果,分别导致酶活力降低至25.91%、66.98%、18.96%和25.44%,而Ni2+、Mg2+、Ca2+、Zn2+、Cu2+、Mn2+对酶催化效率有一定程度的促进作用,其中,Zn2+对酶活力的提升效果尤为显著,达到了131.28%;此外,EDTA对木聚糖酶的催化反应影响相对较小(97.00%),表明该木聚糖酶可能属于非金属酶类。
表2 金属离子与化学试剂对木聚糖酶活力的影响 单位:%
Table 2 The influence of metal ions and chemical reagents on the activity of xylanase
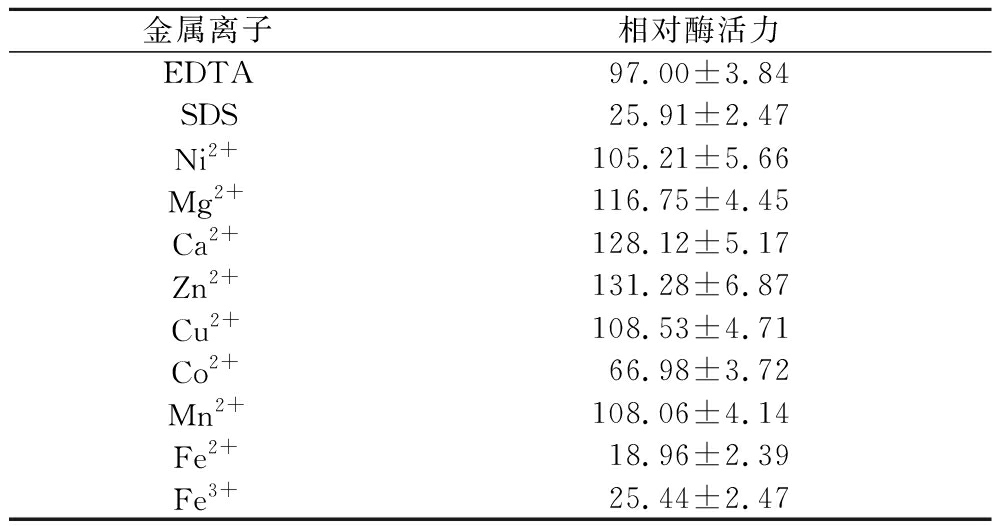
金属离子相对酶活力EDTA97.00±3.84SDS25.91±2.47Ni2+105.21±5.66Mg2+116.75±4.45Ca2+128.12±5.17Zn2+131.28±6.87Cu2+108.53±4.71Co2+66.98±3.72Mn2+108.06±4.14Fe2+18.96±2.39Fe3+25.44±2.47
2.3.6 酶的动力学常数
如图6所示,随着底物木聚糖浓度的不断增大,反应初速度不断加快。当木聚糖质量浓度达到8 mg/mL以上,反应基本趋于平衡。反应初速度随木聚糖质量浓度的变化符合Michaelis-Meten模型,依据Lineweaver-Burk双倒数得到方程式为![]() 14.129,计算得到该木聚糖酶对木聚糖的Km=27.23 mg/mL,Vmax=0.071 mg/(mL·min)。
14.129,计算得到该木聚糖酶对木聚糖的Km=27.23 mg/mL,Vmax=0.071 mg/(mL·min)。
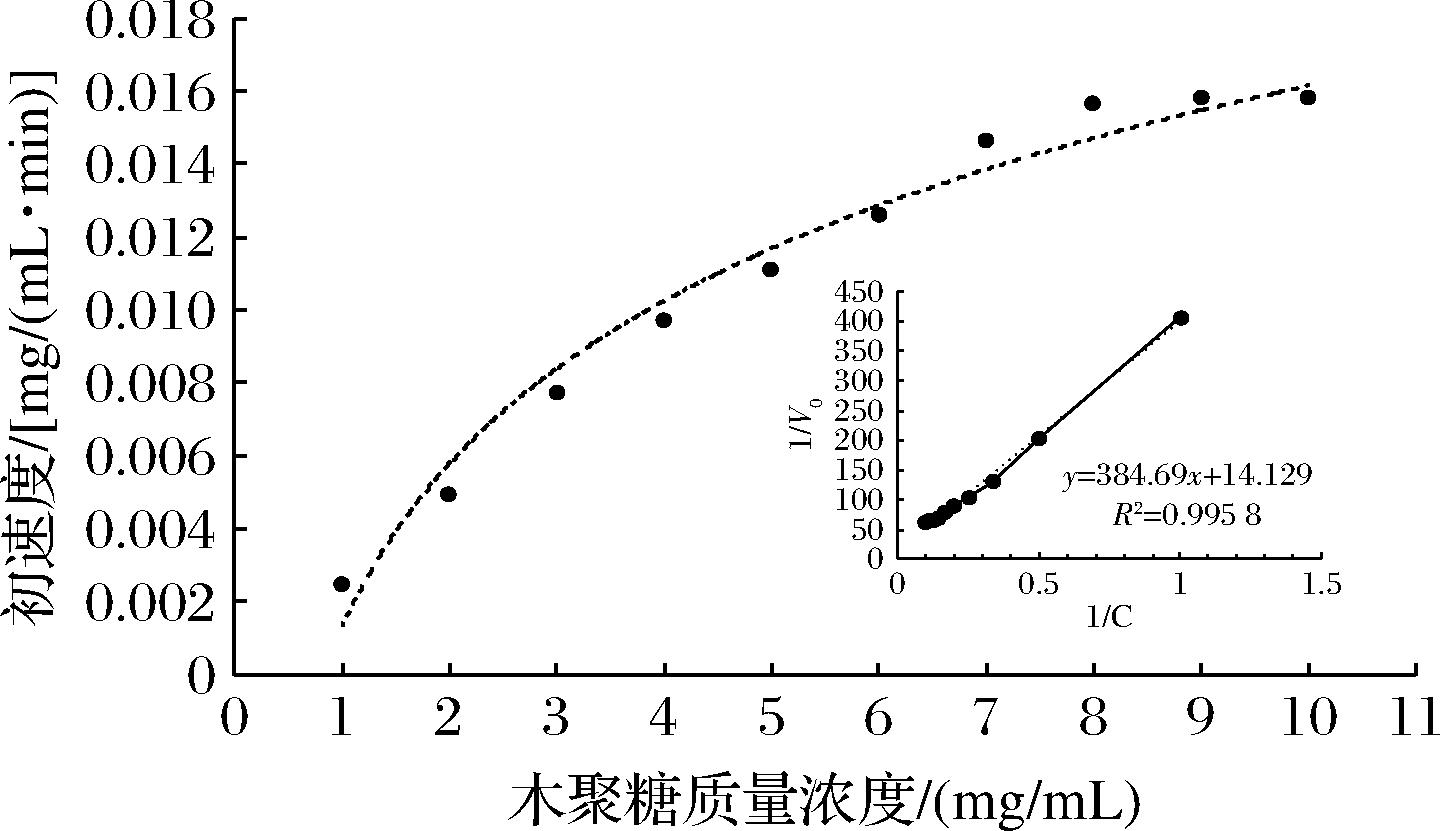
图6 木聚糖酶的动力学分析
Fig.6 Kinetic analysis of xylanase
3 结论
本研究从广东省茂名露天矿公园的土壤中筛选出4株木聚糖酶活力较高的菌株,并且以酶活力最高的菌株为研究对象,经形态学观察和分子鉴定,确定该菌株为赖氨酸芽孢杆菌(Lysinibacillus)。优化了该菌株的最佳培养条件,其最适碳源、氮源、发酵时间、发酵温度、发酵初始pH对菌株分别为细麸皮、(NH4)2SO4、48 h、35 ℃、8。在最优条件下,最大酶活力达到46.88 U/mL。进一步地研究了木聚糖酶的相关酶学性质,其最适催化温度和pH值分别为55 ℃和7。该酶在30~50 ℃保温1 h后具有良好的耐热性,并在55 ℃仍维持约30%的活性。在pH 5.0~8.0,酶活力保持在72%以上,尤其在弱酸性至中性环境下具备较高的酶解能力。金属离子Ni2+、Mg2+、Ca2+、Zn2+、Cu2+、Mn2+能对木聚糖酶有促进作用,尤其是Zn2+可达131.28%。然而,SDS、Co2+、Fe2+和Fe3+对酶活力有较大的抑制作用,而EDTA有轻微的抑制作用,可推测该菌所产的木聚糖酶可能不是金属酶。反应动力学研究表明,木聚糖酶催化木聚糖水解的Km为27.23 mg/mL,Vmax为0.071 mg/(mL·min)。该研究表明XLY1菌株所产的木聚糖酶适合应用于酸性至中性工业环境中,譬如饲料、酿酒、食品工业等。
[1] SUO Y K, LI W Y, WAN L Q, et al.Transcriptome analysis reveals reasons for the low tolerance of Clostridium tyrobutyricum to furan derivatives[J].Applied Microbiology and Biotechnology, 2023, 107(1):327-339.
[2] RUAN T Q, ZHAO X Y, LIU J J.木聚糖酶及其应用研究进展[J].Shandong Food Ferment, 2008(1):42-45.阮同琦, 赵祥颖, 刘建军.木聚糖酶及其应用研究进展[J].山东食品发酵, 2008(1):42-45.
[3] PAULY M, GILLE S, LIU L F, et al.Hemicellulose biosynthesis[J].Planta, 2013, 238(4):627-642.
[4] FARHAT W, VENDITTI R A, HUBBE M, et al.A review of water-resistant hemicellulose-based materials:Processing and applications[J].ChemSusChem, 2017, 10(2):305-323.
[5] YUAN T Q, XU F, HE J, et al.Structural and physico-chemical characterization of hemicelluloses from ultrasound-assisted extractions of partially delignified fast-growing poplar wood through organic solvent and alkaline solutions[J].Biotechnology Advances, 2010, 28(5):583-593.
[6] YU J, PATERSON N, BLAMEY J, et al.Cellulose, xylan and lignin interactions during pyrolysis of lignocellulosic biomass[J].Fuel, 2017, 191:140-149.
[7] 葛慧华, 刘婷, 杨纯, 等.嗜冷嗜酸β-1, 4-木聚糖酶及其钙离子依赖型碳水化合物结合模块[J].微生物学报, 2023, 63(8):3252-3263.GE H H, LIU T, YANG C, et al.Psychrophilic and acidophilic β-1, 4-xylanase and its Ca2+-dependent carbohydrate-binding module[J].Acta Microbiologica Sinica, 2023, 63(8):3252-3263.
[8] JUTURU V, WU J C.Microbial xylanases:Engineering, production and industrial applications[J].Biotechnology Advances, 2012, 30(6):1219-1227.
[9] 张梅娟, 钱朋智, 董力青, 等.一株哈茨木霉的鉴定及固态发酵产木聚糖酶条件研究[J].食品与发酵工业, 2021, 47(3):43-48.ZHANG M J, QIAN P Z, DONG L Q, et al.Identification of Trichoderma harzianum strain and xylanase production condition under solid state fermentation[J].Food and Fermentation Industries, 2021, 47(3):43-48.
[10] CHAKDAR H, KUMAR M, PANDIYAN K, et al.Bacterial xylanases:Biology to biotechnology[J].3 Biotech, 2016, 6(2):150.
[11] DEWA MADE SUKRAMA I, FRANCISKA J, WAYAN SUARDANA I.Evaluation of the bacteriocin produced by strain 9 lactic acid bacteria isolate for biopreservation[J].Veterinary World, 2020, 13(9):2012-2019.
[12] ZHANG F, CHAI C X, NIU R, et al.Genetic characterization of bovine coronavirus strain isolated in Inner Mongolia of China[J].BMC Veterinary Research, 2024, 20(1):209.
[13] 何宇淋, 袁国亿, 王春晓, 等.大米淀粉与米酒酿造中葡萄糖的关联分析[J].食品与发酵工业, 2022, 48(8):28-36.HE Y L, YUAN G Y, WANG C X, et al.Correlation analysis between starch and glucose content in rice wine brewing[J].Food and Fermentation Industries, 2022, 48(8):28-36.
[14] 张梅红. 小麦麸皮阿拉伯木聚糖的制备及益生活性研究[D].北京:中国农业科学院, 2013.ZHANG M H.Study on preparation and prebiotic activity of arabinoxylan from wheat bran[D].Beijing:Chinese Academy of Agricultural Sciences, 2013.
[15] 许正宏. 微生物耐碱性木聚糖酶的合成、调控及底物降解方式的研究[D].无锡:江南大学, 2005.XU Z H.Studies on regulation of microbial alkali-tolerant xylanase synthesis and its mode of substrate hydrolysis[D].Wuxi:Jiangnan University, 2005.
[16] 郭志刚, 都军, 刘瑞芝.紫杉细胞生长过程与营养物质消耗的动态研究[J].清华大学学报(自然科学版), 2002, 42(5):599-602.GUO Z G, DU J, LIU R Z.Kinetic investigation of Taxus cell growth and nutrient consumption[J].Journal of Tsinghua University (Science and Technology), 2002, 42(5):599-602.
[17] 吴晓娟, 张佳妮, 李依, 等.pH酸性偏移结合热处理对米糠蛋白结构的影响[J].中国粮油学报, 2020, 35(10):16-22.WU X J, ZHANG J N, LI Y, et al.Effect of acidic pH-shifting combined with heat treatment on the structure of rice bran protein[J].Journal of the Chinese Cereals and Oils Association, 2020, 35(10):16-22.
[18] XU W, CAI P, YAN M, et al.Molecular dynamics simulation of temperature-dependent flexibility of thermophilic xylose isomerase[J].Chinese Journal of Chemical Physics, 2009, 22(5):467-472.
[19] SCHÖN A, CLARKSON B R, JAIME M, et al.Temperature stability of proteins:Analysis of irreversible denaturation using isothermal calorimetry[J].Proteins:Structure, Function, and Bioinformatics, 2017, 85(11):2009-2016.
[20] 郑亚伦, 夏瑛, 李良, 等.源于解淀粉芽孢杆菌酸性木聚糖酶酶学性质的研究[J].食品与发酵工业, 2020, 46(24):58-65.ZHENG Y L, XIA Y, LI L, et al.Enzymatic properties of acid resistant xylanase from Bacillus amyloliquefaciens[J].Food and Fermentation Industries, 2020, 46(24):58-65.