沙棘(Hippophae rhamnoides L)为多刺落叶性灌木或小乔木,别名黑刺、沙枣等,为胡颓子科、沙棘属植物。沙棘作为一种药食同源植物,是中国藏医、蒙医传统的药物原材,在古代中国就曾作为民间药材使用。沙棘果具有祛痰止咳、活血化瘀、健脾养胃等功效[1],我国也是国内外记载将沙棘进行医药用最早的国家。公元8世纪,“藏医百科全书”《四部医典》中就有关于沙棘多种功效的记载,并给出了相应的药用配方以供参考。著名中医药学家李时珍所著《本草纲目》中也记载了沙棘,对其气味、食效、药效进行了描述[2]。我国在1977年第一次将沙棘正式收录到《中国药典》中,将其列入中药的行列。国家卫生部也在之后批准沙棘为“药食同源”的医药用植物。沙棘的花、果、籽、根和叶都可入药,是天然的植物营养宝库,含有200多种营养价值和药用价值极高且含量丰富的天然生物活性物质,具有多种显著的药理活性和营养功能,譬如调节免疫、护肝、抗癌、抗氧化、抗动脉粥样硬化、抗菌、抗病毒、抗应激、组织再生和改善新陈代谢等药理活性,以及充当天然的食品添加剂和动物饲料等[3]。GHENDOV-MOSANU等[4]考察了加入沙棘浆果粉对小麦面包感官、理化性质、抗氧化性能和保质期的影响,研究发现在小麦面包中添加1%浆果粉可以有效地抑制面包腐败的进程,进而获得更好的口感、保质期及抗氧化性能。
黄酮类化合物是沙棘中一种重要的功能成分,因其独特的物理化学性质而表现出丰富多样的药理活性,如抗炎、抗癌、抗动脉粥样硬化、抗溃疡、解痉、抗抑郁、抗菌、降血压、降糖等多种活性作用。近年来,沙棘中的黄酮类化合物被证实具有辐射防护、激酶抑制和与癌症相关的凋亡活性,它们还在神经类、心血管类疾病以及创伤修复等方面有很好的治疗效果。但黄酮类化合物溶解度差、味苦,直接食用会使消费者产生较强不愉悦感,且存在对光照、温度、pH、氧等外界环境不稳定、敏感,在人体胃肠道渗透性差等缺点,限制了人体对这类物质进行吸收,降低这些活性成分的生物利用率。故需要寻求适当的稳态化技术使添加到食品中的黄酮类化合物能够更好地被人体吸收利用。本文在已有研究的基础上对沙棘黄酮的提取纯化方式、测定方法进行介绍,重点对国内外沙棘黄酮的生物活性进行综述,为沙棘黄酮的高附加值的开发利用提供理论参考及依据。
1 沙棘黄酮类活性成分的种类
沙棘含有多种生物活性成分,如维生素类、黄酮类、萜类、甾醇类、蛋白质、氨基酸、有机酸类、多酚类、类胡萝卜素、生物碱类、脂肪油和脂肪酸类等[5]。在沙棘中,黄酮类化合物作为主要的生物活性物质之一,其中又以黄酮醇为主要成分。而黄酮醇主要是以槲皮素、异鼠李素、杨梅素和山奈酚苷元的糖基化形式存在,其中异鼠李素黄酮醇苷和槲皮素黄酮醇苷占比较高(图1),最高含量占比分别为65%和25%以上[2]。每个黄酮醇苷组中的糖都有很大的不同,较为常见的糖残基是葡萄糖和半乳糖,此外还有鼠李糖、阿拉伯糖、木糖等[5]。与此同时,沙棘黄酮醇苷的组成和含量与沙棘果的成熟度、产地、所属亚种、采摘时间等有密切的关系。
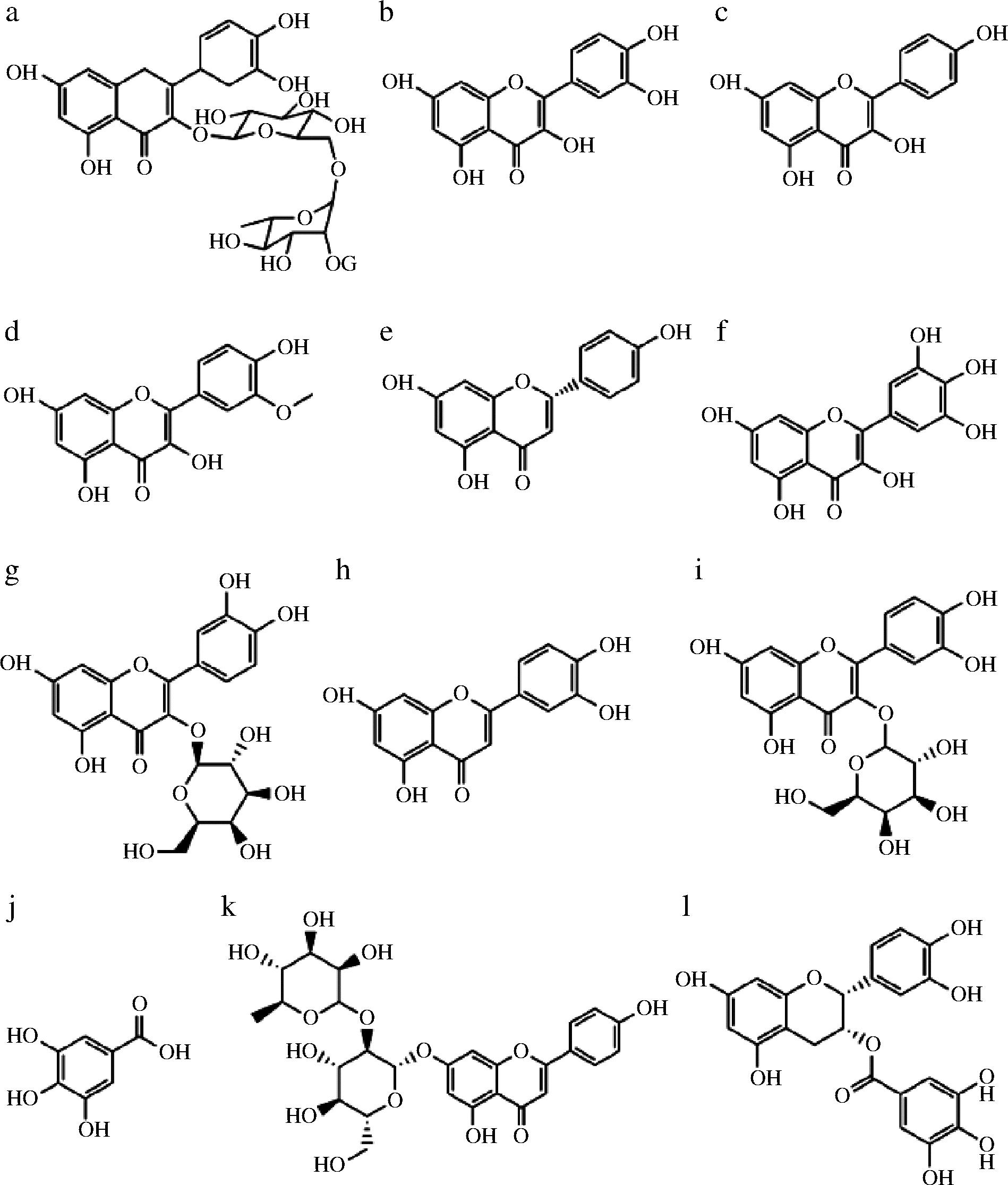
a-芦丁;b-槲皮素;c-山奈酚;d-异鼠李素;e-柚皮素;f-杨梅素;g-金丝桃苷;h-木犀草苷;i-槲皮素-3-葡萄糖苷;j-没食子酸;k-柚皮苷;l-表儿茶素没食子酸酯
图1 沙棘黄酮结构图
Fig.1 Structure of sea buckthorn flavonoids
2 沙棘黄酮的提取方法
目前沙棘黄酮类物质的提取方法种类繁多,大多为传统提取技术,如溶剂浸提法、微波或超声波或酶辅助提取法,还有新兴的提取分离技术,如超临界流体萃取、亚临界水萃取以及离子液体萃取法等。以下综述了其中常用的6种提取方法。
2.1 溶剂提取法
溶剂提取法是通过选择不同的溶剂,利用其极性的大小从样品中萃取出目标成分,因此溶剂的选择决定了提取率和提取效率。由于沙棘中黄酮类化合物多以黄酮苷的形式存在,极性较大,且在水中的溶解度较低,故常使用一定浓度的乙醇或甲醇作为提取溶剂。米智等[6]采用索氏提取法提取山西吕梁沙棘果粉中的黄酮类化合物,通过此方法不仅有效避免了溶剂的挥发,而且因为反复的回流过程增加了萃取反应进行的次数,从而使得目标成分的提取率显著上升,也增加了提取效率,以此为基础确定了沙棘果粉中黄酮的最佳制备工艺:乙醇浓度为75%,料液比为1∶25(g∶mL),萃取时间为2 h,沙棘果粉黄酮平均提取量为2.26%。樊旭等[7]以吉林省蛟河市沙棘果为原材料,采用溶剂回流法提取沙棘黄酮,通过响应面优化实验后得到的最佳提取工艺:乙醇体积分数为90%,料液比为1∶60(g∶mL),回流温度为80 ℃,提取3次,得到黄酮提取率最大值为2.67%。李学玲等[8]将索氏提取法、热回流提取法和超声波提取法3种方法进行比较,分别研究了其对总黄酮的提取效率的影响,最后采用了热回流提取法,并通过单因素和正交试验对其提取工艺进行优化,优选出该方法的最佳提取条件为乙醇体积分数80%,料液比1∶100(g∶mL),提取温度70 ℃,提取时间120 min时,总黄酮提取率可达到1.79%。
溶剂提取法作为一种传统的天然活性物质提取方法,相对于其他提取方法来说更加简便且成本较低,但是由于溶剂提取法试剂消耗量大、提取温度较高、提取时间长和提取过程中会发生一系列水解、氧化、电离反应等,从而会致使黄酮类化合物的损失较大。深度共晶溶剂(deep eutectic solvents, DESs)因其从植物材料中提取天然产物的效率较高而逐渐成为传统有机溶剂的替代品。CUI等[9]首次制备了12种DESs(氯化胆碱作为氢键受体),并与微波辅助提取技术相结合,从沙棘叶片中提取出5种黄酮类成分。研究发现使用DES提取目标黄酮类化合物的效率明显优于使用体积分数70%乙醇,5种主要沙棘黄酮类化合物的总提取率达到20.82 mg/g,是传统提取方法的1.3~2.4倍。
2.2 超声波辅助提取法
在提取植物活性成分的领域中,超声波辅助提取法的原理是利用超声波产生的热效应、空化效应、振动及搅拌等作用,对样品加压以促使细胞壁被破坏,从而加速释放出胞内物质,而且超声波作为介质,短时间增大了大分子的运动速率,使溶剂的穿透力提高,在2个方面的作用下,提高黄酮类成分的溶出速率和溶出率。白生文等[10]以河西走廊产出的沙棘为原料,选取超声波辅助法提取沙棘榨汁提油后剩余的副产品中的总黄酮。经过单因素试验和正交优化试验后,确定最佳提取工艺可使沙棘果渣、沙棘籽粕和果皮渣中的总黄酮提取率最大值达到2.55%、1.90%和0.65%。ALI等[11]采用超声波辅助提取法,研究了深共晶溶剂DESs-6(氯化胆碱和对甲苯磺酸,摩尔质量之比为1∶2)对巴氏枸杞果实中黄酮类化合物的提取工艺,考察了固液比、提取时间、含水量、温度等试验条件对黄酮提取率的影响,最终得到黄酮提取率范围为75.6%~96.9%。LI等[12]首次采用基于双液相系统(乙醇和硫酸铵作为提取分离溶剂)的超声波辅助液-液萃取法从西藏沙棘果实中提取了黄酮类化合物。通过响应面法优化了沙棘果实中的黄酮提取的几个实验变量的最优值:当超声温度50 ℃,料液比99∶1,在2个提取循环中黄酮的提取率为8.30%。LUNTRARU等[13]对比研究了超声波提取和浸渍-再循环法对沙棘汁废弃物中总多酚和黄酮含量的提取效率,发现超声波提取法得到总多酚、黄酮含量更高,且抗氧化活性更强,表明超声波提取法能够实现沙棘果渣等副产品的回收和增值。
2.3 微波提取法
微波提取法是基于微波穿透性加热的原理,利用微波所产生的强烈热效应,利用分子因极化而产生的作用和离子的导电效应,来实现对萃取体系中的部分成分选择性加热,让细胞破裂,从而溶剂更容易进入细胞内,释放出目标物。与传统的回流提取法相比,微波提取法具有提取效率高、速度快、操作简单、溶剂用量少等优点,但需要注意的是要严格控制提取时间,防止提取物因剧烈的热效应发生结构上的变化。LI等[14]采用离子液体超声波/微波辅助同时蒸馏萃取法从沙棘叶片中提取有效成分,通过响应面法优化后,在离子液体为1.0 mol/L 1-丁基-3-甲基咪唑溴盐、液固比为12 mL/g、萃取时间为34 min、微波功率为540 W和固定超声波功率为50 W的条件下,挥发性精油、非挥发性芦丁、槲皮素、山柰酚和异鼠李素得到了较好的分离。尽管微波选择性加热可以提高黄酮、多酚等化合物的产量,但如果采用相同的整体加热速率,则处理时间和工艺的理论能量需求没有差异。因此,如果可以通过电磁设计在扩大规模的工艺中增强微波选择性加热,则可以进一步提高沙棘黄酮的提取率,但是微波对乙醇/水溶剂的穿透深度非常小,这也给微波设备的规模化设计带来了挑战[15]。
2.4 超临界CO2萃取法
超临界流体萃取技术,以超临界流体作为萃取溶剂,因为超临界流体具有黏度低、密度高和扩散率高的特征,可达到较好的分离效果与萃取效果[16],是一项新兴的绿色萃取技术。JAYASHANKAR等[17]采用超临界CO2萃取法提取了沙棘叶中的黄酮,通过对提取物HPLC分析显示,提取的黄酮类化合物为山奈酚和异鼠李素。由于CO2具有价格经济、易达到超临界流体状态和安全无毒易清除等优点,因此常被用于超临界流体萃取技术。超临界CO2萃取技术凭借其节能高效、无溶剂残留、提取物纯度高等优点,已经成为对热不稳定化合物和昂贵药材中生物活性成分提取的有效手段之一。虽然此提取方法合乎现代环境要求,但是进口设备的价格昂贵,无法大量应用于工作领域,致使其工业化研究进程还相对较为缓慢,仍有很大的发展空间。
2.5 酶辅助提取法
酶辅助提取法主要是利用特异性酶分解破坏植物细胞壁,使其结构变松散,减小黄酮与原材料的结合力,让细胞内的活性成分迅速溶出,以提高提取目标物的效率。田建华等[18]采用酶法和超声波联用技术提取了沙棘果渣中的总黄酮,先通过单因素实验的方法对果胶酶添加量、液料比、乙醇浓度、超声波处理时间、超声波提取温度、超声波功率6个因素进行了研究,探究它们对总黄酮提取率的影响,最后通过响应面优化,确定了最佳的提取工艺:添加5.1%的果胶酶,液料比41∶1(mL∶g),提取81 min时沙棘果渣总黄酮提取率最大值为8.91 mg/g。该方法的特点是反应条件温和,而且环境友好,同时因为酶的专一性和结构保持性,提取出的黄酮类化合物结构完整且纯度较高。
2.6 分子烙印技术辅助提取法
分子烙印技术以目标分子作为模板分子,经聚合反应,构筑高度交联的高分子刚性骨架,以获得分子烙印聚合物,采取萃取法去除烙印分子保留与模板分子结构相似的孔穴及对应的可作用位点,从而建立起一种新型的、对目标物质具有选择性的、记忆性的识别材料技术,以此来提取黄酮类化合物。在我国,采用分子烙印技术辅助提取法的频率并不高,尤其是在中药提取方面。采用烙印技术对沙棘黄酮进行提取实验,结果表明:把槲皮素作模板的分子烙印聚合物可有效地从沙棘粗提物中分离得到2种黄酮苷元(槲皮素和异鼠李素)。
3 沙棘黄酮的检测方法
沙棘中总黄酮的含量是衡量其品质的常见的科学指标之一,目前黄酮类化合物的定性测定方法主要有紫外分光光度法、化学检识法、薄层层析法和超高效液相色谱法等。沙棘总黄酮定量测定主要有亚硝酸钠-氯化铝-氢氧化钠法、三氯化铝法、硝酸铝-醋酸钾法和HPLC法。
3.1 亚硝酸钠-氯化铝-氢氧化钠法
亚硝酸钠-氯化铝-氢氧化钠法是用于沙棘黄酮检测较为常见的方式,在碱性条件下,试样溶液中的铝离子将与黄酮化合物产生络合反应,生成红色络合物,用分光光度计进行检测,并建立起吸光度值与相应浓度间的线性关系,从而测定出总黄酮的含量。陈春[19]在严格控制溶剂的浓度、试剂的添加时间、显色时间等条件下,利用亚硝酸钠-氯化铝-氢氧化钠法对沙棘叶、果和果渣中的黄酮进行了检测。
3.2 三氯化铝法
三氯化铝法的原理是金属铝离子与黄酮母核中4位羰基及5位羟基在酸性条件下进行络合,络合产物在波长为400 nm时的吸收峰最大,是一种专属的反应。在采取三氧化铝法对沙棘黄酮进行测定时,因为不同部位的沙棘样品中的黄酮含量存在一定的差别,所以要选择不同的对照标准品,其中选择标准为含量高、结构明确、安全可靠且成熟常用,通过建立标准曲线对其进行验证。
3.3 硝酸铝-醋酸钾法
在弱碱性环境下,利用金属铝离子与黄酮化合物反应生成的络合物发生的显色反应,用分光光度计检测,在波长为500 nm处有最大吸收峰。
3.4 HPLC法
黄酮苷具有极性强、难气化、不稳定的特点,所以HPLC是沙棘黄酮目前主流的检测方法。HPLC法测定沙棘黄酮具有干扰小、重现性好、分析速度快、灵敏度高等优点,目前主要用于沙棘黄酮中芦丁和异鼠李素的检测[20]。
4 沙棘黄酮的纯化方法
纯度低不仅会影响提取物的稳定性,而且会使提取到的沙棘黄酮类物质无法充分发挥其生理功效,因此,对提取物进行纯化是获取目标产物的必要环节。目前,已有多种分离纯化的方法被使用于沙棘黄酮的制备提纯工艺中,譬如大孔吸附树脂吸附法、有机溶剂萃取法、聚酰胺树脂吸附法、薄层色谱法、纸层析法等。其中较为常用的为以下3种纯化方法。
4.1 大孔吸附树脂吸附法
大孔树脂分离技术是目前最常用的一种分离纯化黄酮类化合物的方法,其原理是将待纯化的混合物吸附到树脂后,用一些溶剂洗涤以除去吸附的成分,其中树脂种类、洗脱剂浓度对分离纯化效果有较大的影响。因为大孔吸附树脂的表面是多孔网状结构,所以它拥有很好的吸附性能和筛选作用,能够经过选择合适的吸附和解吸条件进行分离和纯化[21]。黄莎等[22]采用D-101大孔吸附树脂对沙棘黄酮进行吸附实验,结果表明采用动态吸附优于静态吸附。当上样浓度为0.04 mg/mL浸膏、上样体积1 BV、水洗体积3 BV、醇浓度50%、醇洗体积3 BV、上样流速1 BV/h、洗脱流速1 BV/h,此工艺下动态吸附量为8.04 mg/g,吸附率为87.04%,解吸量为8.18 mg/g,解吸率达90%以上。王玉等[23]通过“动态吸附-洗脱”实验得到沙棘黄酮类化合物的最佳制备工艺为70%乙醇洗脱溶液以1 mL/min流速进行洗脱,沙棘黄酮的吸附率与洗脱率均达90%左右,样品中总黄酮纯度达59.07%,纯化后与纯化前相比,纯度提高了3.2倍。MA等[24]通过对上样流速的研究发现,当乙醇体积分数为70%,上样流速为1.5 mL/min时,其纯化效果较好。大孔树脂是建立在动态吸附解析对的过程上,因此,样品的流动速率会直接影响黄酮类化合物在大孔树脂中的扩散速度,进而影响到沙棘黄酮吸附解析效率。大孔树脂分离技术具有选择性好、产品纯度高、干扰因素少、可再生利用和工艺简单等优点而被广泛应用于沙棘黄酮的分离与纯化的研究当中[25]。
4.2 有机溶剂萃取法
根据沙棘黄酮类化合物与所含杂质不同的极性,选择不同极性的溶剂对样品的粗提液进行萃取,进而提纯沙棘黄酮。譬如在提取沙棘叶内物质时,可以通过石油醚来处理其乙醇浸提液,以此去除其中的脂溶性色素(如叶绿素、胡萝卜素等);对于某些天然产物的水提液,可在浓缩后加入一定量高浓度的乙醇,通过离心除去其中的水溶性杂质(如多糖、蛋白质等)。一般情况下,常用甲醇、乙醇等来萃取极性较大的苷元,用乙酸乙酯萃取极性较小的苷元,石油醚一般用于萃取前除色素和脂溶性物质。
4.3 聚酰胺树脂吸附法
聚酰胺树脂吸附法的原理是通过静电引力来吸附溶液中的阴离子,与含有酚羟基的黄酮类化合物形成氢键而产生吸附,与不能形成氢键的杂质进行分离。聚酰胺树脂吸附法的优点在于专属性较强、可逆吸附较为平稳、分离效果好和样品容量较大,故常用于沙棘黄酮的分离与纯化方面的研究。冯爱博等[26]采用此技术对黄酮类化合物进行分离纯化,并以大孔树脂法分离纯化作为对照组实验,得出聚酰胺树脂吸附法具有更好的分离纯化效果,分离纯化后的黄酮的纯度可达58.4%。
5 沙棘黄酮的稳态化技术
大多数黄酮类化合物难以溶于水且稳定性差,同时其味道发苦,不适合直接食用,并且因为黄酮类化合物对光照、温度、pH、氧气等外界因素敏感,在人体胃肠道渗透性差等缺点,限制了人体对这类物质的吸收,降低了人体对沙棘黄酮的利用率。因此,研究人员需要采用适宜的稳态化技术来提高其保存和应用时的稳定性,并促进人体吸收,提高其生物利用性。
纳米乳的粒径小,界面面积增大,提高了难溶性沙棘黄酮的溶解度、吸收性、生物膜透性和生物利用度;油或脂类具有生物相容性、生物可降解性和非诱变性,因此纳米乳对人体健康是安全的;根据需要能够实现靶向或缓释作用;通过纳米乳包埋可以减少沙棘黄酮使用剂量,从而降低毒性,并提供更好的治疗效果;在局部应用的情况下,可以避免首过效应,从而提高沙棘黄酮的功能活性。
微胶囊技术的原理是利用高分子材料把固体、液体或气体包裹起来,使之成为稳定的微小粒子,这样就能在保持芯材原有性质的情况下,实现缓慢释放的目标或者长久保存的目的。通过微胶囊技术可以使沙棘黄酮与外部的环境相隔绝,减少或遮盖沙棘黄酮及其制品的苦味[27]。王卉[28]使用纳米混悬技术改善沙棘黄酮的稳定性,得出制备工艺为:沙棘黄酮丙酮溶液30 mL(槲皮素质量浓度为 620.51 μg/mL、山奈酚质量浓度为261.44 μg/mL、异鼠李素质量浓度为1 578.07 μg/mL),逐滴加入至100 mL 0.1%稳定剂溶液中,通过边加边高速分散,持续分散(1 600 r/min)20 min后,除去乙醇高压均质等方法即可得到沙棘黄酮包埋体。
6 沙棘黄酮的生物活性
沙棘中的黄酮类化合物在抗氧化、抗癌、抗炎、降血糖、降血脂等方面均表现出良好的生物活性。除此之外,沙棘黄酮还具有降低血液黏度、抗动脉粥样硬化、保护心血管和心脏的作用,以及抗菌、抗病毒、解痉挛、免疫调节、保护神经、抗溃疡等生理功能[29]。
6.1 抗氧化作用
沙棘黄酮类成分能有效地清除人体内产生的自由基,具有良好的抗氧化活性,所以它能预防人体因自由基造成的损伤。NILE等[30]的研究中所有黄酮类化合物都表现出显著的抗氧化活性,通过对DPPH、铁还原/抗氧化能力和氧自由基吸收能力测定,其抑制率分别为45.6%~85.5%、32.6%~70.6 %和24.9%~65.5%。根据两者反应的机理,黄酮类化合物可以与自由基的反应性部分发生反应从而使其稳定,自由基被黄酮类化合物还原,以更低的反应活性和更稳定的形式存在,黄酮类化合物就此实现抗氧化的生理功能(图2)。田建华等[18]运用果胶酶与超声波相结合的方式,从沙棘果渣中提取出黄酮类物质,并对其进行DPPH自由基清除能力、超氧阴离子清除能力以及羟自由基清除能力的测定,证明了沙棘黄酮拥有良好的抗氧化作用。CHO等[31]研究发现8月份收获的沙棘叶中总酚和黄酮提取物能够提高神经元PC-12细胞的活力,有效地维持细胞膜完整,降低了细胞内的氧化应激反应,从而具有对抗由氧化应激诱导的线粒体功能障碍的能力并阻止细胞凋亡。
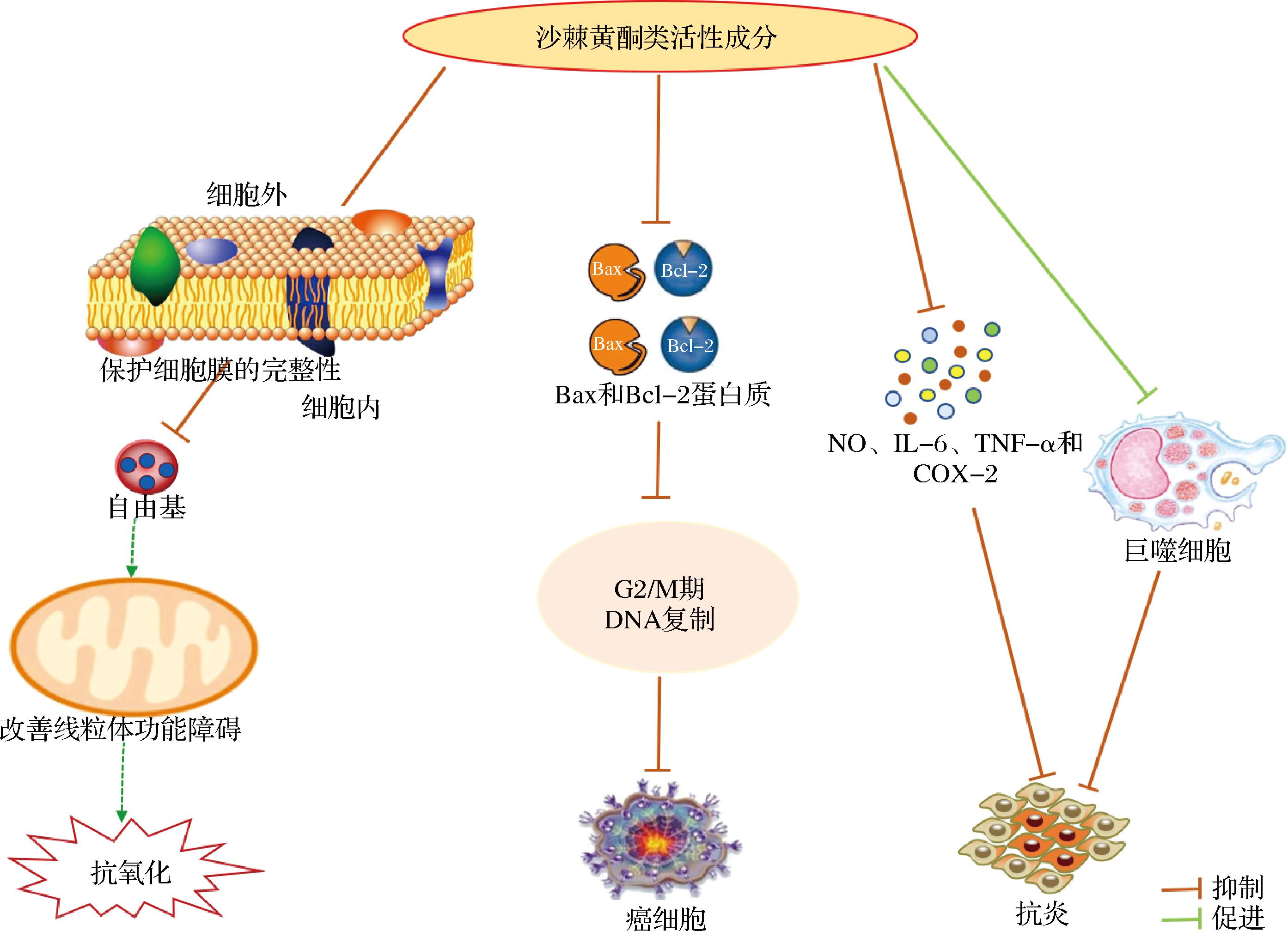
图2 沙棘黄酮发挥抗氧化、抗癌和抗炎作用的机制
Fig.2 The mechanism of antioxidant, anticancer, and anti-inflammatory of sea buckthorn flavonoids
6.2 抗癌作用
沙棘黄酮具有抗增殖特性,能诱导细胞凋亡和刺激免疫系统,不仅如此,沙棘果提取物可以保护线粒体功能完整性免受辐射诱导的氧化应激,因具有辐射防护活性而被列入癌症治疗的范畴[32]。黄酮类化合物可阻滞细胞的生长,并通过p53介导的途径引起细胞凋亡,研究表明,这些黄酮类化合物对乳腺肿瘤细胞的增殖具有抑制作用[33]。山奈酚通过降低血管内皮生长因子的表达活力,导致血管表面细胞增殖的速度减缓和通透性增加,在卵巢癌的治疗中显示出有效的结果。
研究发现沙棘黄酮提取物主要是通过调节Bax和Bcl-2蛋白的表达,使得细胞周期阻滞在G2/M期,从而引起细胞凋亡,在体外实验中还发现可以显著抑制人前列腺癌PC-3细胞的增殖作用(图2)。OLAS等[34]的研究结果表明,云南亚种沙棘的黄酮提取物对人肝癌HepG2细胞增殖活性有较强的抑制作用,其中槲皮素、山奈酚、异鼠李素及其单糖衍生物在此方面效果甚佳。
6.3 抗炎作用
炎症过激反应在现代生活中属于常见病症之一,而沙棘黄酮在抗炎方面具有显著优势。50~250 μg/mL含量范围内的沙棘黄酮能够显著增强巨噬细胞的吞噬能力,并通过调控细胞因子和炎症因子的分泌来控制炎症反应(图2)。付依依等[35]的实验以地塞米松作为阳性对照药物,对大果沙棘中黄酮的抗炎作用进行了研究,结果表明,沙棘黄酮能显著提高LPS诱导的RAW264.7细胞的吞噬能力,抑制细胞因子的释放,其减轻炎症反应的程度可能与细胞中细胞因子NO及炎症因子白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和环氧化酶-2(Cyclooxygenase-2,COX-2)减少有关。
6.4 降血糖和降血脂作用
高脂血症是机体脂肪代谢的一种异常情况,表现为高血糖、负氮平衡、高脂血症、糖尿和酮症等,是多种心血管疾病的常见症状。高脂血症与高血压、脂肪肝、动脉粥样硬化、2型糖尿病等代谢性疾病密切相关。许多研究者已经证明黄酮类化合物可以通过避免葡萄糖吸收或改善糖耐量来降低糖尿病发生风险。柚皮素可以降低糖尿病大鼠小肠刷状缘膜囊泡对葡萄糖的摄取水平,使其水平与正常大鼠相当[33]。王振宇等[36]对大果沙棘黄酮对四氧嘧啶所致糖尿病小鼠的血脂水平的影响进行了研究,实验结果发现沙棘黄酮对四氧嘧啶诱导所致的糖尿病小鼠的血糖和血脂水平有较好的抑制作用,同时沙棘黄酮还能够提高小鼠的胰岛素水平和肝(肌)糖原含量。以高胆固醇诱导的脂滴积累细胞模型为切入点,研究沙棘黄酮提取物的降脂作用,运用网络药理学分析探讨沙棘黄酮的生物活性成分及其抗高脂血症的潜在机制,发现沙棘黄酮提取物可能通过促进胆固醇转化为胆汁酸和胆固醇外流、抑制胆固醇从头合成和加速脂肪酸氧化改善高脂血症[37]。
7 结论
沙棘是我国物产资源极为丰富的天然产物,它同时含有大量的亲脂性抗氧化化合物(主要是类胡萝卜素和生育酚)和亲水性抗氧化化合物(类黄酮、单宁、酚酸和抗坏血酸),在生态保护方面也有巨大的优势,尤其是在新疆地区,因此沙棘的种植面积逐年增加。沙棘黄酮类化合物是一类具有良好生物活性的成分,但是与其他植物果实、叶等中的黄酮相比,目前人们对于沙棘黄酮的研究尚处在初级阶段,人们对沙棘的开发利用还存在着比较多的问题,譬如在提取纯化过程存在有机试剂残留、提取率低、提取纯度低、黄酮制品附加值低等问题。当前,对沙棘黄酮进行提取和纯化的方法主要有以下几种:溶剂浸提法、酶法辅助提取法、大孔树脂吸附法、有机溶剂萃取法、聚酰胺树脂吸附法等。除此之外,还可以将几种纯化方法联用以提高纯化效率。但是,目前黄酮类制品中黄酮类化合物的含量仍然处在较低的放入水平,很难满足市场的需求。如何以简单、廉价、环境友好的方式,高效地合成具有高生物活性的黄酮是目前亟待解决的科学问题。此外,虽然沙棘黄酮具有良好的抗氧化、抗癌、降血糖、降血脂、抗炎、免疫调节、保护神经等功效,但是目前对其生理生活功能的研究仅局限于表观研究,并未通过沙棘黄酮量效和构效关系结合现代分子生物学、代谢组学等技术解析其作用机制。因此,迫切需要现代绿色农产品加工及生产技术如高效分离提取技术、冷冻干燥技术、超微粉碎技术、微胶囊技术、现代分析检测技术等,加快沙棘采后精深加工技术攻关,通过加强对沙棘资源功效成分的研究,沙棘黄酮的构效、量效关系及其作用机理的分析,以此进一步对提高沙棘黄酮的稳定性和生物利用率研究,推进沙棘全株植物及加工副产物资源的高值化利用技术的开发,从而促进开发满足不同人群需求的功能健康食品,实现沙棘产业的健康可持续发展。
[1] GONG G, GUAN Y Y, ZHANG Z L, et al.Isorhamnetin:A review of pharmacological effects[J].Biomedicine &Pharmacotherapy, 2020, 128:110301.
[2] LIU S Y, XIAO P T, KUANG Y J, et al.Flavonoids from sea buckthorn:A review on phytochemistry, pharmacokinetics and role in metabolic diseases[J].Journal of Food Biochemistry, 2021, 45(5):e13724.
[3] LEE S Y, SHON J Y, KANG K O.Nutritional components and antioxidant activities of sea buckthron (Hippophae rhamnoides L.) leaf and berry extracts[J].Journal of the East Asian Society of Dietary Life, 2018, 28(1):31-39.
[4] GHENDOV-MOSANU A, CRISTEA E, PATRAS A, et al.Potential application of Hippophae rhamnoides in wheat bread production[J].Molecules, 2020, 25(6):1272.
[5] CIESAROV Z, MURKOVIC M, CEJPEK K, et al.Why is sea buckthorn (Hippophae rhamnoides L.) so exceptional? A review[J].Food Research International, 2020, 133:109170.
Z, MURKOVIC M, CEJPEK K, et al.Why is sea buckthorn (Hippophae rhamnoides L.) so exceptional? A review[J].Food Research International, 2020, 133:109170.
[6] 米智, 刘荔贞, 武晓红.响应面法优化沙棘果粉黄酮提取工艺的研究[J].中国调味品, 2020, 45(10):148-152.MI Z, LIU L Z, WU X H.Optimization of extraction process of flavonoids from Hippophae rhamnoides Linn.Powder by response surface methodology[J].China Condiment, 2020, 45(10):148-152.
[7] 樊旭, 周鸿立.响应面法优化沙棘黄酮的提取和抗氧化活性的研究[J].河南工业大学学报(自然科学版), 2018, 39(4):85-90.FAN X, ZHOU H L.Optimization of extraction and antioxidant activity of flavonoids from seabuckthorn by response surface methodology[J].Journal of Henan University of Technology (Natural Science Edition), 2018, 39(4):85-90.
[8] 李学玲, 李剑美, 李倩, 等.龙血树叶总黄酮提取工艺的正交实验法优化及体外抗氧化性研究[J].华西药学杂志, 2020, 35(6):617-620.LI X L, LI J M, LI Q, et al.Optimization of extraction process of flavonoids from leaves of Dracaena angustifolia by orthogonal method and study of antioxidant activities in vitro[J].West China Journal of Pharmaceutical Sciences, 2020, 35(6):617-620.
[9] CUI Q, LIU J Z, WANG L T, et al.Sustainable deep eutectic solvents preparation and their efficiency in extraction and enrichment of main bioactive flavonoids from sea buckthorn leaves[J].Journal of Cleaner Production, 2018, 184:826-835.
[10] 白生文, 汤超, 田京, 等.沙棘果渣总黄酮提取工艺及抗氧化活性分析[J].食品科学, 2015, 36(10):59-64.BAI S W, TANG C, TIAN J, et al.Extraction and antioxidant activity of total flavonoids from sea buckthorn pomace[J].Food Science, 2015, 36(10):59-64.
[11] ALI M C, CHEN J, ZHANG H J, et al.Effective extraction of flavonoids from Lycium barbarum L.fruits by deep eutectic solvents-based ultrasound-assisted extraction[J].Talanta, 2019, 203:16-22.
[12] LI L, ZHANG T Y, XING J J, et al.Ethanol/ammonium sulfate ultrasonic-assisted liquid-liquid extraction of flavonoids from Tibetan Sea-buckthorn fruit[J].Journal of Food Processing and Preservation, 2022, 46(5):e16602.
[13] LUNTRARU C M, APOSTOL L, OPREA O B, et al.Reclaim and valorization of sea buckthorn (Hippophae rhamnoides) by-product:Antioxidant activity and chemical characterization[J].Foods, 2022, 11(3):462.
[14] LI C Y, ZHANG J J, ZHAO C J, et al.Separation of the main flavonoids and essential oil from seabuckthorn leaves by ultrasonic/microwave-assisted simultaneous distillation extraction[J].Royal Society Open Science, 2018, 5(7):180133.
[15] GALAN A M, CALINESCU I, TRIFAN A, et al.New insights into the role of selective and volumetric heating during microwave extraction:Investigation of the extraction of polyphenolic compounds from sea buckthorn leaves using microwave-assisted extraction and conventional solvent extraction[J].Chemical Engineering and Processing:Process Intensification, 2017, 116:29-39.
[16] LI R H, XIA Z M, LI B, et al.Advances in supercritical carbon dioxide extraction of bioactive substances from different parts of Ginkgo biloba L[J].Molecules, 2021, 26(13):4011.
[17] JAYASHANKAR B, SINGH D, TANWAR H, et al.Augmentation of humoral and cellular immunity in response to Tetanus and Diphtheria toxoids by supercritical carbon dioxide extracts of Hippophae rhamnoides L.leaves[J].International Immunopharmacology, 2017, 44:123-136.
[18] 田建华, 张春媛, 魏璐.沙棘果渣总黄酮提取工艺优化及抗氧化活性研究[J].天然产物研究与开发, 2021, 33(1):65-72.TIAN J H, ZHANG C Y, WEI L.Study on the extraction technology and antioxidant activity of total flavonoids from the pomace of sea buckthorn[J].Natural Product Research and Development, 2021, 33(1):65-72.
[19] 陈春. 沙棘黄酮检测方法概述[J].山西林业科技, 2018, 47(3):14-17.CHEN C.Detection methods of flavonoids in Hippophae rhamnoides Linn[J].Shanxi Forestry Science and Technology, 2018, 47(3):14-17.
[20] HE N X, WANG Q Y, HUANG H L, et al.A comprehensive review on extraction, structure, detection, bioactivity, and metabolism of flavonoids from sea buckthorn (Hippophae rhamnoides L.)[J].Journal of Food Biochemistry, 2023, 2023(1):4839124.
[21] JIANG H, LI J, CHEN L, et al.Adsorption and desorption of chlorogenic acid by macroporous adsorbent resins during extraction of Eucommia ulmoides leaves[J].Industrial Crops and Products, 2020, 149:112336.
[22] 黄莎, 刘燕梅, 昌琴, 等.D-101大孔吸附树脂纯化沙棘叶黄酮的特性研究[J].食品安全导刊, 2022(28):156-159.HUANG S, LIU Y M, CHANG Q, et al.Study on purification of flavonoids from seabuckthorn leaves by D-101 macroporous adsorption resin[J].China Food Safety Magazine, 2022(28):156-159.
[23] 王玉, 刘琦, 耿杰.沙棘黄酮的分离纯化及其抗运动性疲劳作用[J].食品工业科技, 2020, 41(23):169-174.WANG Y, LIU Q, GENG J.Purification and resisting movement fatigue activity of flavonoids from Hippophae rhamnoides L[J].Science and Technology of Food Industry, 2020, 41(23):169-174.
[24] MA Y Q, SHAO J H, FAN X Z, et al.Optimization of isolation and purification of total flavonoids from Ardisia mamillata Hance roots using macroporous resins, and determination of their antioxidant activity[J].Tropical Journal of Pharmaceutical Research, 2018, 17(5):897.
[25] ISMAIL B B, YUSUF H L, PU Y F, et al.Ultrasound-assisted adsorption/desorption for the enrichment and purification of flavonoids from baobab (Adansonia digitata) fruit pulp[J].Ultrasonics Sonochemistry, 2020, 65:104980.
[26] 冯爱博, 杨光, 贺亮, 等.聚酰胺树脂纯化竹壳类黄酮工艺的研究[J].工业微生物, 2019, 49(3):27-32.FENG A B, YANG G, HE L, et al.Purification of flavonoids from bamboo shell by polyamide resin[J].Industrial Microbiology, 2019, 49(3):27-32.
[27] NEAGU C, MIHALCEA L, ENACHI E, et al.Cross-linked microencapsulation of CO2 supercritical extracted oleoresins from sea buckthorn:Evidence of targeted functionality and stability[J].Molecules, 2020, 25(10):2442.
[28] 王卉. 纳米混悬技术改善大豆苷元、沙棘黄酮的口服生物利用度研究[D].上海:上海中医药大学, 2019.WANG H.Studies on improving bioavailability of daidzein and total flavones of Hippophae rhamnoides L.by nanosuspension technology[D].Shanghai:Shanghai University of Traditional Chinese Medicine,2019.
[29] MA Q G, WEI R R, SHANG D L, et al.Structurally diverse flavonolignans with immunosuppressive and neuroprotective activities from the fruits of Hippophae rhamnoides L[J].Journal of Agricultural and Food Chemistry, 2020, 68(24):6 564-6 575.
[30] NILE S H, KEUM Y S, NILE A S, et al.Antioxidant, anti-inflammatory, and enzyme inhibitory activity of natural plant flavonoids and their synthesized derivatives[J].Journal of Biochemical and Molecular Toxicology, 2018, 32(1):e22002.
[31] CHO C H, JANG H, LEE M, et al.Sea buckthorn (Hippophae rhamnoides L.) leaf extracts protect neuronal PC-12 cells from oxidative stress[J].Journal of Microbiology and Biotechnology, 2017, 27(7):1 257-1 265.
[32] GUO R X, GUO X B, LI T, et al.Comparative assessment of phytochemical profiles, antioxidant and antiproliferative activities of Sea buckthorn (Hippopha⊇ rhamnoides L.) berries[J].Food Chemistry, 2017, 221:997-1 003.
[33] RANA R A C, GULLIYA B.Chemistry and pharmacology of flavonoids- a review[J].Indian Journal of Pharmaceutical Education and Research, 2019, 53(1):8-20.
[34] OLAS B, SKALSKI B, ULANOWSKA K.The anticancer activity of sea buckthorn [Elaeagnus rhamnoides (L.) A.Nelson][J].Frontiers in Pharmacology, 2018, 9:232.
[35] 付依依, 王永霞, 李月, 等.大果沙棘中黄酮的体外抗炎及抗氧化活性研究[J].中国食品添加剂, 2021, 32(10):67-74.FU Y Y, WANG Y X, LI Y, et al.Study on in vitro anti-inflammatory and antioxidant activities of flavonoids from sea buckthorn[J].China Food Additives, 2021, 32(10):67-74.
[36] 王振宇, 刘瑜, 周丽萍.大果沙棘黄酮对糖尿病小鼠血脂与抗氧化水平的影响[J].食品科学, 2010, 31(7):297-301.WANG Z Y, LIU Y, ZHOU L P.Hypolipidemic and antioxidant effects of flavonoids from Hippophae rhamnoides L.pomace in ICR mice with alloxan induced diabetes[J].Food Science, 2010, 31(7):297-301.
[37] XIAO P T, LIU S Y, KUANG Y J, et al.Network pharmacology analysis and experimental validation to explore the mechanism of sea buckthorn flavonoids on hyperlipidemia[J].Journal of Ethnopharmacology, 2021, 264:113380.