民以食为天,食以安为先。在食品行业高速发展的背景下,食品安全检测技术作为保障公众健康的关键防线,在预防食品安全风险中发挥着至关重要的作用[1]。随着科学检测技术的进步,我国的食品安全恶性事件已呈现下降趋势,然而,目前的食品安全仍然面临着较多亟待解决的挑战和困难,如食品添加剂不良添加[2]、农药残留[3]、重金属离子超标[4]、食源性致病菌[5]和霉菌毒素过度繁殖[6]等问题,这不仅影响着人们的生活水准,威胁着人们的健康安全,也有悖于我国的食品安全健全目标。国家卫生健康委员会在2022年制定的《食品安全标准与监测评估“十四五”规划》中明确指出重点工作任务之一—提升食品安全风险的识别与评估水平[7],这对食品安全检测技术提出了更高的要求。
为了确保食品安全性,目前已经开发了许多检测手段用于检测食品中的食品添加剂、农药、重金属离子、食源性致病菌和霉菌毒素等有害物质。传统的化学检测手段如原子吸收光谱法[8]、高效液相色谱法[9]、荧光分析法[10]、气相色谱-质谱联用法[11]等,足以实现对目标物质的定性与定量检测,但这些检测方法却存在检测步骤复杂、检测周期长、检测成本高、检测范围窄等特点。反观,电化学生物传感器具有检测灵敏、设备便携小型化、检测耗时短和成本低等优点,使其在现场检测或资源受限的环境中成为理想选择。电化学生物传感技术是一种将生物体系与电化学方法相结合的新兴技术,利用生物材料的特异性和电化学传感的高灵敏度,用于检测生物分子和分析生物信息[12]。
纳米酶(nanozymes)是一种具有模拟酶活性的功能性纳米材料,能够基于特定的纳米结构催化天然酶的底物并作为酶的代替品,其既有纳米材料本身的理化性质,又有类似酶的催化功能,兼具天然酶与人工酶的优势于一身[13]。此外,纳米酶具有易于制备、成本低廉、可修饰性、稳定性高和耐用性强等优点[14],使其在各个领域引起了广泛关注。目前,各项工作中已报道的纳米酶依据材料大致可以分为:金属基纳米酶(如Au、Ag、Pb、Pt、Pd等纳米粒子[15]);金属氧化物纳米酶(如磁性Fe3O4纳米颗粒、CuO纳米颗粒、Cu2O纳米颗粒、CeO2纳米颗粒、Co3O4纳米颗粒[16]等);碳基纳米材料(如碳纳米、石墨、碳纳米管、富勒烯[17]等);金属有机框架(metal-organic frameworks,MOFs)(如Cu-MOFs、Fe-MOFs、Ce-MOFs、Co-MOFs、Ni-MOFs[18]等)。
纳米酶的高催化活性使其在电化学生物传感检测中起到重要作用,将纳米酶与电化学传感器相结合可以实现高效、灵敏地生物分子检测与分析。目前已经报道的纳米酶有多种催化活性,涵盖了类过氧化物酶(peroxidase,POD)活性、类氧化物酶(oxidase,OXD)活性、类过氧化氢酶(catalase,CAT)活性以及类超氧化物歧化酶(superoxide dismutase,SOD)活性等类酶活性。随着对纳米酶催化活性的不断深入研究,研究人员已经开发了基于纳米酶的电化学生物传感器用于食品安全检测。如CHEN等[19]利用金纳米粒子(gold nanoparticles,AuNPs)修饰的Cu-MOF开发了一种新的电化学生物传感器,用于亚硝酸盐的灵敏测定,LIU等[20]设计了一种基于组氨酸覆盖的金纳米团簇的电化学生物传感器,其OXD活性对3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)氧化过程中起到高效电催化活性,可用于亚硝酸盐的检测。CHEN等[21]开发了一种新型的电化学生物传感器,通过结合辣根过氧化物酶(horseradish peroxidase,HRP)功能化的AuNPs(AuNP/HRP)和高度特异性的生物识别,可实现超灵敏地测定卡那毒素。
目前,已有综述研究报道了纳米酶的制备及其在各种领域的应用。例如,WU等[22]详细综述了纳米酶的材料制备及活性调控;基于MOFs的纳米酶对释放H2O2的生物小分子、重金属离子、真菌毒性代谢产物和抗生素等方面的检测应用[23];ZHANG等[24]对生物纳米酶的结构调控、催化性能及其在生物体系的应用进行了阐述。然而,基于纳米酶的电化学生物传感器在食品安全检测应用的详细综述相对较少。本综述旨在系统梳理近5年内基于纳米酶的电化学生物传感器在食品安全检测领域的研究成果,见图1,并深入探讨其存在的问题与未来发展趋势,为相关研究者提供参考与启示。
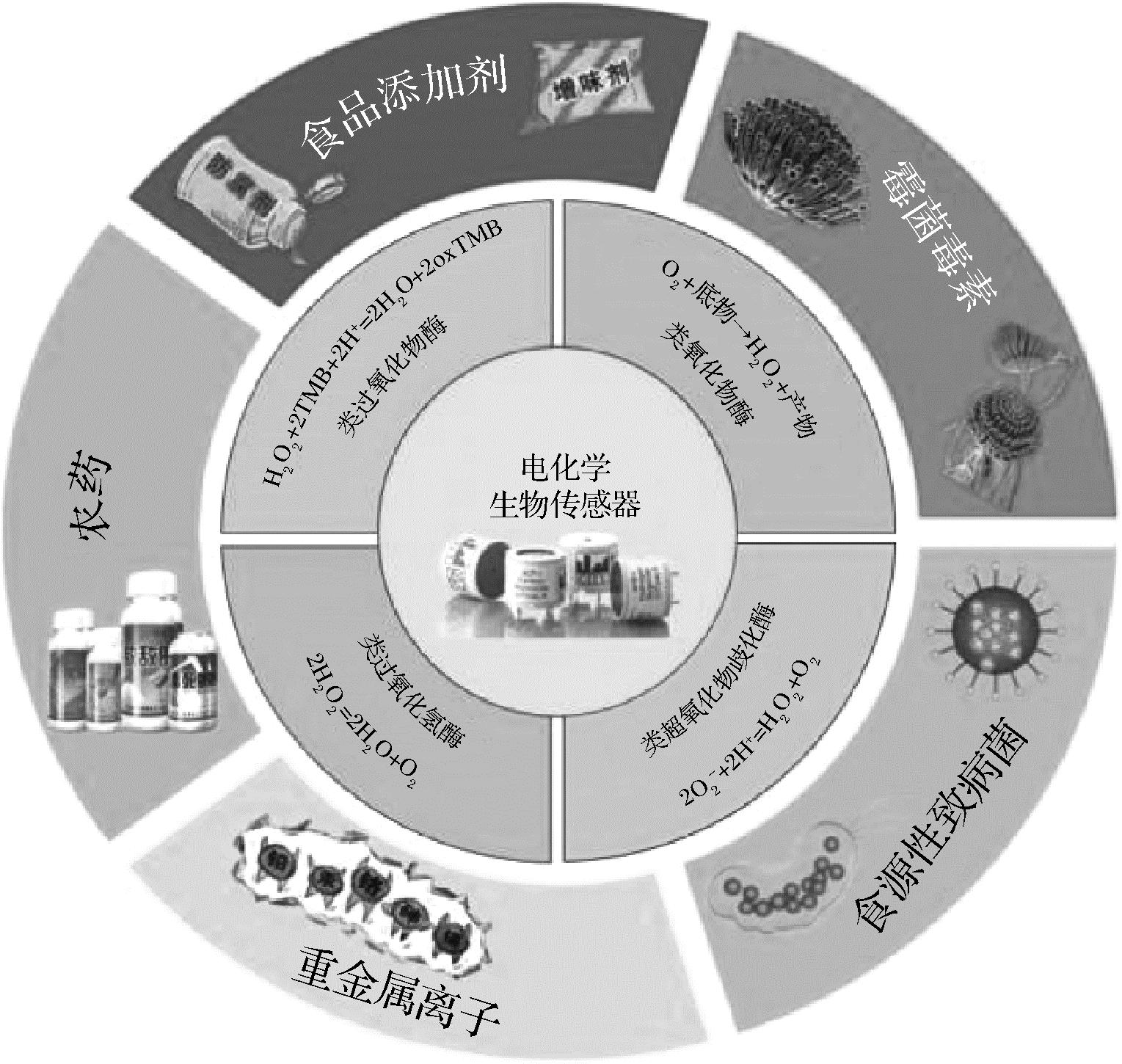
图1 基于纳米酶的电化学生物传感器在食品安全中的检测
Fig.1 Nanozyme based electrochemical biosensors in food safety detection
1 纳米酶的催化活性
纳米材料的组成不同使其表现不同的形貌,如纳米点、纳米棒、纳米管、纳米片、纳米线等[25]。在催化机制上,纳米酶表现出多种优良催化性能,其中包括类POD活性、类OXD活性、类CAT活性、类SOD活性等,其催化机理如图1所示。
1.1 类POD活性
类POD活性是纳米酶中最常见的类酶活性。类POD纳米酶为双底物纳米酶,它能够在第一底物氢受体(如H2O2)存在的条件下,催化氢受体产生大量的氧化自由基,进而将第二反应底物氢供体快速氧化[13]。过氧化物酶还可将H2O2的催化分解和酚类与胺类等化合物的催化氧化相结合,具有消除H2O2和酚类、胺类、苯类、醛类毒性的双重作用,在生物体内发挥着重要作用[26]。具有类POD活性的纳米酶,展现出与天然POD相似的化学催化机理(方程1)。
H2O2+底物![]() 氧化底物+H2O
氧化底物+H2O
(1)
目前,关于类POD活性的纳米酶已被广泛研究和应用。由于具有类POD活性的纳米酶能催化H2O2分解产生羟自由基(·OH)和H2O,因此常见证明纳米酶具有类POD活性的实验方法有:测定TMB是否被氧化为氧化TMB(oxTMB)、邻苯二胺(o-phenylenediamine,OPD)是否氧化为2,3-二氨基吩嗪(phenazine-2,3-diyldiamine,DAP);绘制Michaelis-Menten曲线和Lineweaver-Burk图判断动力学参数,包括最大初速度(Vmax)和米氏常数(Km)。
如ZHU等[27]以立方Cu2O模板,FeCl2·4H2O和Na2S2O3为介质,制备了具有蛋黄壳结构的Cu2O@Fe(OH)3纳米酶,并通过实验证明了其具有类POD活性。结果表明,该纳米酶在H2O2的帮助下可将无色OPD氧化成黄色DAP,其较小的Km表明相比立方Cu2O,Cu2O@Fe(OH)3纳米酶对OPD具有较高的亲和力和更高的类POD活性。其催化机理主要是基于Cu+/Cu2+的Fenton反应和Fe3+/Fe2+的氧化还原反应的转化提高了H2O2分解产生的·OH,并且Cu2O核和Fe(OH)3壳在类POD催化活性中起着协同效应。LOU等[28]通过将蒙脱石和聚乙烯亚胺溶液以特定体积比混合并冻干,制备出粉末状前驱体,经交替使用强碱和强酸溶液处理以及高温煅烧,合成了氮掺杂碳纳米酶,该酶对3种底物(TMB、ABTS和OPD)和H2O2反应时均表现出明显的颜色变化,且具有较大的Vmax和较小的Km。WU等[29]将CeO2纳米球分散在水中,再加入到含有二茂铁的二甲基亚砜中,经理化反应合成Fe@CeO2纳米酶,具有类POD活性。实验结果表明,在Fe@CeO2纳米酶存在下,H2O2和TMB的体系中发生了明显的显色反应,其Km比天然HRP约低15倍和2倍,因此Fe@CeO2纳米酶的双金属共催化具有显著优于天然酶的POD活性。综上所述,利用具有类POD活性的纳米酶加速催化H2O2生成高活性的自由基,并通过自由基与待测小分子相互作用时所产生的物理和化学信号,可以构建可视化、精确微量小分子检测平台。
1.2 类OXD活性
OXD以O2作为氢受体,无需额外添加H2O2等化合物,即可直接将提供氢的底物催化氧化。OXD的适宜温度、适宜pH范围以及对生物体的作用与CAT类似,它能够催化各类有机和无机底物氧化(如TMB、OPD和ABTS),参与细胞信号传导,在生物体内的许多生理和代谢过程中发挥着关键作用。具有OXD活性的纳米酶表现出与OXD类似的催化机制(方程2、方程3)
O2+底物![]() 氧化产物+H2O2
氧化产物+H2O2
(2)
O2+底物![]() 氧化产物+H2O
氧化产物+H2O
(3)
近期,多种新型类OXD纳米酶的合成与催化性能分析为模拟天然酶活性提供了新的视角。如LI等[30]通过自组装策略将组氨酸和CuSO4·5H2O在N,N-二甲基甲酰胺中反应,合成了儿茶酚氧化物酶样纳米酶(catechol oxidase-like nanozyme,CHzyme)纳米酶。该纳米酶的催化机理为儿茶酚被吸附在CHzyme的活性位点上生成中间体1(intermediates,Int-1),儿茶酚羟基上的质子离去后形成中间体2(intermediates,Int-2),纳米酶中的活性Cu(Ⅱ)将儿茶酚氧化为邻苯醌,形成中间体3(intermediates,Int-3)时自身被还原为Cu(I),最后酶活性位点生成的Cu(I)被溶解的O2氧化为Cu(Ⅱ);ZHANG等[31]采用微波辅助合成策略,将氮掺杂的碳点作为介导剂,与H2PtCl6混合形成含Pt的前驱体;再以抗坏血酸为还原剂,PdCl2为金属供体,合成了Pd@Pt双金属核壳纳米球(mesoporous Pt-Pd bimetallic core-shell nanospheres,mPd@Pt NSs)。通过实验证明了mPd@Pt NSs具有类OXD活性,当以TMB为底物,在H2O2不存在时,其催化TMB氧化生成有色产物的最大吸光度为652 nm;同时在N2饱和的溶液中,其催化TMB氧化能力显著下降,表明催化过程中需要O2参与。CHENG等[32]将过渡金属离子和硫脲引入甲酰胺溶液中,水热反应后将前驱体在Ar气氛围中高温热解,使得Fe和Co牢固地锚定在硫掺杂的碳氮化合物上,制备了S-FeCo-NC纳米酶,具有类OXD活性。结果表明,TMB和S-FeCo-NC纳米酶所组成的溶液体系在O2组的吸光度增加到空白组初始值的172.11%,与N2组吸光度下降到初始值的9.41%形成鲜明对比;S-FeCo-NC纳米酶的Km和Vmax分别为0.20 mmol/L和11.58×10-7 mol/(L·s),表明其对TMB具有较高的亲和力和催化速率。综上所述,具有类OXD活性的纳米酶在无需额外加入H2O2的情况下,通过催化氧化反应产生可被捕获的信号,构建多模式集成传感平台,在食品安全和生物标志物检测方面展现出巨大潜力。
1.3 类CAT活性
H2O2是新陈代谢过程中的一种代谢废物,会对生命体造成一定损害,为了避免这种损害,必须将其分解成毒性较小或无毒的物质,而CAT就扮演着分解者这一角色。它通过将H2O2分解成无害的H2O和O2(方程4),从而在保护细胞免受氧化损害方面起着至关重要的作用[33]。
(4)
迄今为止,已经报道了许多具有类CAT活性的纳米酶。由于具有类CAT活性的纳米酶能催化H2O2分解产生O2,因此常见证明纳米酶具有类CAT活性的实验方法有:测定反应后的溶解氧或气相中O2含量;绘制Michaelis-Menten曲线和Lineweaver-Burk图判断动力学参数,包括Vmax和Km;紫外-可见吸收光谱仪测定H2O2吸收峰强度;电子自旋共振光谱仪(electron spin resonance,ESR)测定·OH的清除率。
如CHEN等[34]利用抗坏血酸在AuNPs表面还原H2PtCl6制备出海胆状Pt/Au,随后通过沉淀-溶解-再成核-组装方法和Ostwald熟化机制,在Pt/Au NPs表面形成了介孔CeO2空心球,制备了CeO2@Pt/Au纳米酶,具有类CAT活性。当加入CeO2@Pt/Au纳米酶时,H2O2溶液产生大量气泡;CeO2@Pt/Au体系的吸收峰强度明显低于CeO2和Pt/Au体系;CeO2@Pt/Au对底物H2O2的Vmax值较高,Km值较小,且对H2O2的反应率接近91.7%。QIAO等[35]通过溶胶-凝胶法合成了Ti3C2Tx-NH2纳米片,再将活化的葡萄糖氧化酶(glucose oxidase,GOx)溶液和盐酸多柔比星(doxorubicin hydrochloride,DOX)与Ti3C2Tx-NH2分散液混合,制得Ti3C2Tx-GOx/DOX,与甲氧基聚乙二醇-琥珀酰亚胺基羧甲基酯反应,合成了Ti3C2Tx-GOx/DOX-PEG纳米酶,具有类CAT活性。溶解氧曲线表明该纳米酶能有效地将H2O2转化为溶解的O2,Michaelis-Menten曲线和Lineweaver-Burk图表明其有优良的稳态动力学;加入纳米酶后,H2O2分解产生O2,[Ru(dpp)3]Cl2的荧光在O2的存在下被显著淬灭。LI等[36]通过生物矿化方法,以牡蛎铁蛋白(oyster ferritin,GF1)为模板捕获Mn2+,合成了GF1@Mn纳米酶,具有类CAT活性。Lineweaver-Burk图表明GF1@Mn对底物H2O2的Km值较低,ESR谱图表明在100 μg/mL的GF1@Mn浓度下·OH的清除率可达到99.50%。相比于天然酶,该GF1@Mn纳米酶在不同温度、pH和时间下表现出良好的稳定性。因此,使用大分子蛋白质作为原位合成纳米酶的模板,对提高纳米酶的稳定性和催化效率具有重要意义。综上所述,纳米酶的类过氧化氢酶活性可以高效催化H2O2生成O2,或对·OH展现出优良的清除能力,并产生显著的化学信号,因此可将纳米酶的类CAT活性应用于即时检测领域。
1.4 类SOD活性
在生命体内,超氧阴离子自由基(·O2-)由分子形式的O2还原而得,具有较高的毒性,易造成细胞衰老甚至癌变。超氧化物歧化酶作为一类能催化·O2-歧化生成H2O2和O2的酶(方程5),在机体氧化与抗氧化平衡中起到至关重要的作用[37]。
(5)
在许多纳米材料中,类SOD活性都有所体现。由于具有类SOD活性的纳米酶能催化·O2-分解产生O2,因此常见证明纳米酶具有类SOD活性的实验方法有:测定氯化萘四唑蓝(nitrotetrazolium blue chloride,NBT)是否被·O2-还原成最大吸收波长为560 nm的蓝色甲臢产物;绘制Michaelis-Menten曲线和Lineweaver-Burk图判断Vmax和Km。
如WU等[38]采用一步水热法,在N,N-二甲基甲酰胺溶剂中将VCl3、2-氨基对苯二甲酸、尿素溶液高温混合并搅拌,再缓慢冷却至室温后通过沉淀-溶解-再沉淀的方法合成了钒纳米球(vanadium nanospheres,VNSs),具有类SOD活性,发现随VNSs浓度的增加,NBT被·O2-还原成的蓝色甲臢产物的吸光度明显下降。ZHANG等[39]在混酸中氧化活性炭并经过滤-透析-超过滤得到纯纳米碳点(carbon nanodots,CNDs)溶液,再加入氯铂酸并以NaBH4还原,合成出Pt@CNDs纳米酶,具有类SOD活性,使NBT被还原,在560 nm波长产生吸收峰。同时,·O2-也可被5,5-二甲基-1-吡咯啉-N-氧化物(5,5-dimethyl-1-pyrroline-N-oxide,DMPO)捕获产生DMPO/·OOH加合物;当存在Pt@CNDs纳米酶时,DMPO/·OOH的ESR信号逐渐减弱。此外,还发现CNDs中的羰基是SOD样活性的催化位点,羰基能促进电子转移,在结合·O2-使其分解中起着重要作用。综上所述,碳基纳米酶和金属基纳米酶等可以催化·O2-分解,展现出优良的SOD活性。因此可通过催化过程中的电子转移,构建传感装置用于检测分析。
2 基于纳米酶的电化学生物传感器在食品安全检测中的应用
电化学传感器通过换能器将化学信号转换为电信号,包括电流、电阻(电导)、电势,因此可将电化学传感器分为电流型[40]、阻抗型(电导型[41])和电势型[42]传感器。在检测过程中,可根据其产生的电信号所显示的参数变化实现对待测样品的定量分析。将纳米酶集成到传感系统中,可以利用其催化性能实现信号放大,提高对目标物的检测灵敏度[43]。因此,将基于纳米酶的电化学生物传感器应用于食品安全检测领域,检测食品中的有害物质(食品添加剂、农药、重金属离子、食源性致病菌、霉菌毒素)是一项具有发展前景的研究。
2.1 基于纳米酶的电化学生物传感器检测食品添加剂
随着食品工业的快速发展,食品添加剂已经成为现代食品的重要组成部分。食品添加剂是一类用于改善食品风味、颜色、味道、以及防腐和抗氧化性能的天然或化学合成物质,尽管食品添加剂的兴起能促进食品工业发展,便利人们对食品的更高需求,但是,食品添加剂的不当添加、过量添加等恶性事件频发,危害公众健康,因此其检测显得尤为重要。表1列出了纳米酶的电化学生物传感器检测食品中食品添加剂的应用。
表1 不同纳米酶检测食品中食品添加剂的应用
Table 1 Application of various nanozymes for the detection of food additives in foods
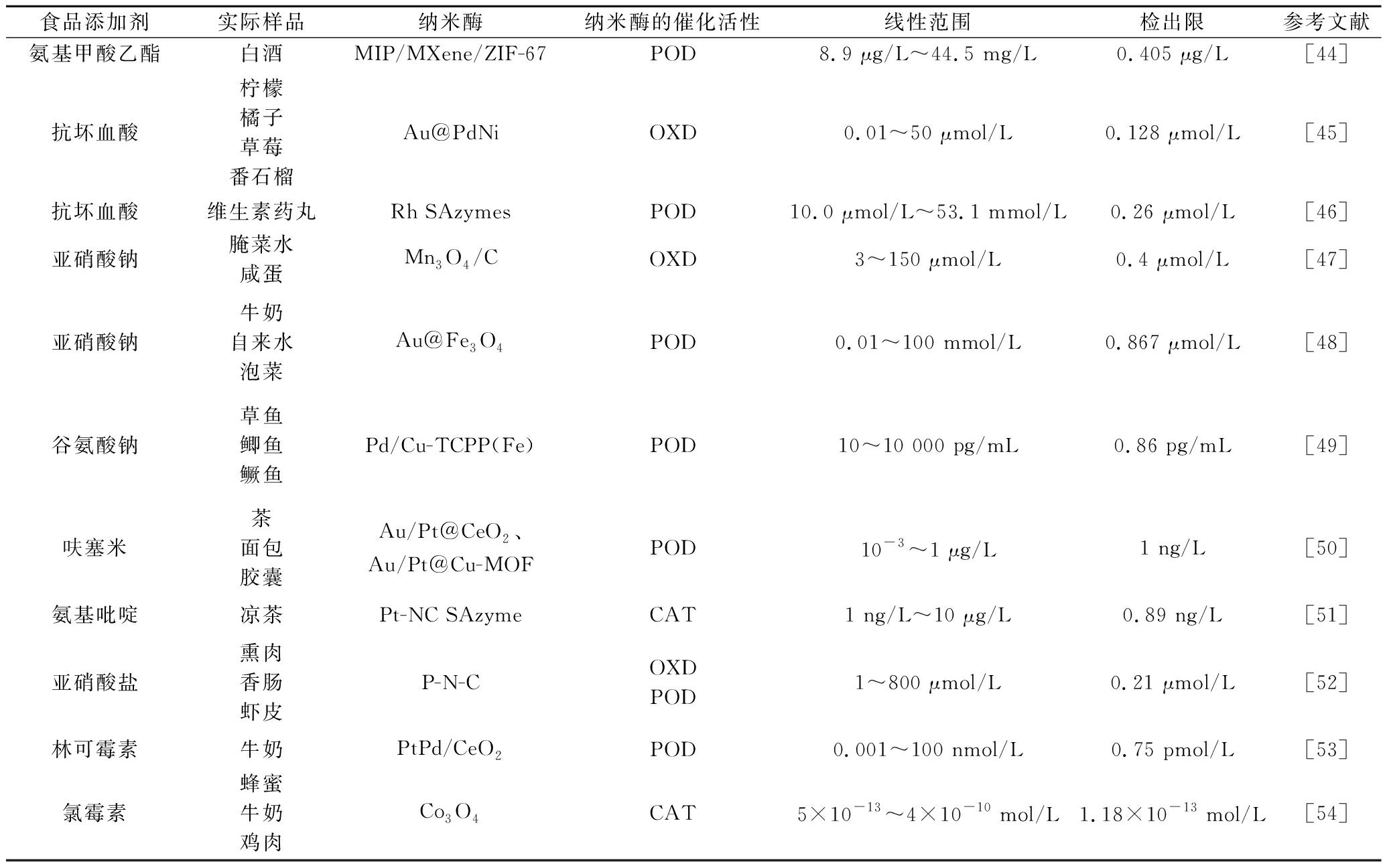
食品添加剂实际样品纳米酶纳米酶的催化活性线性范围检出限参考文献氨基甲酸乙酯白酒MIP/MXene/ZIF-67POD8.9 μg/L~44.5 mg/L0.405 μg/L[44]抗坏血酸柠檬橘子草莓番石榴Au@PdNiOXD0.01~50 μmol/L0.128 μmol/L[45]抗坏血酸维生素药丸Rh SAzymesPOD10.0 μmol/L~53.1 mmol/L0.26 μmol/L[46]亚硝酸钠腌菜水咸蛋Mn3O4/COXD3~150 μmol/L0.4 μmol/L[47]亚硝酸钠牛奶自来水泡菜Au@Fe3O4POD0.01~100 mmol/L0.867 μmol/L[48]谷氨酸钠草鱼鲫鱼鳜鱼Pd/Cu-TCPP(Fe)POD10~10 000 pg/mL0.86 pg/mL[49]呋塞米茶面包胶囊Au/Pt@CeO2、Au/Pt@Cu-MOFPOD10-3~1 μg/L1 ng/L[50]氨基吡啶凉茶Pt-NC SAzymeCAT1 ng/L~10 μg/L0.89 ng/L[51]亚硝酸盐熏肉香肠虾皮P-N-COXDPOD1~800 μmol/L0.21 μmol/L[52]林可霉素牛奶PtPd/CeO2POD0.001~100 nmol/L0.75 pmol/L[53]氯霉素蜂蜜牛奶鸡肉Co3O4CAT5×10-13~4×10-10 mol/L1.18×10-13 mol/L[54]
注:TCPP-卟啉;SAzymes-单原子纳米酶;ZIF-沸石咪唑酸盐框架;MIP-分子印迹聚合物;MXene-具有类石墨烯的二维材料。
纳米酶可催化H2O2分解,产生化学信号,电化学传感器可将化学信号转变为电信号,实现对目标分析物的检测。GE等[45]通过共沉淀Pd2+和Ni2+,在金核上合成了核壳结构的Au@PdNi纳米酶,该纳米酶展现出优良的类氧化物酶活性。Au@PdNi纳米酶的核壳结构提供了较高的比表面积,能增强电子传递,有效改善其电化学行为;此外,Ni的加入提高了材料的电流密度,而Au核与PdNi壳之间的协同电子相互作用则促进了与目标分子的结合和反应。因此,该纳米酶被用于开发一种便携式电化学传感器,实现对抗坏血酸的灵敏检测。QILENG等[50]将Au/Pt纳米颗粒与CeO2和Cu-MOFs结合制备出了具有类POD活性的Au/Pt@Cu-MOF和Au/Pt@CeO2纳米酶,并构建了基于Au/Pt@Cu-MOF和Au/Pt@CeO2两种纳米酶的便携式电化学免疫传感器。电化学传感器检测过程中,电极被一层致密的水凝胶覆盖,从而阻止了Au/Pt@Cu-MOF与H2O2的反应。当加入抗坏血酸钠-2-磷酸后,Au/Pt@CeO2会催化其产生磷酸根离子,使得Au/Pt@Cu-MOF上的水凝胶层降解。当水凝胶层降解后,Au/Pt@Cu-MOF纳米酶能够催化H2O2产生电化学信号。因此,在优化了抗原、抗体和Au/Pt@CeO2-Ab2的稀释比例以及免疫传感器的孵育时间后,实现了对非法添加剂呋塞米的检测。CHEN等[51]将2,4-戊二酸铂封装在ZIF-8的分子笼中,然后热解合成出了Pt-NC SAzyme,并基于具有高效类CAT催化活性的Pt-NC SAzyme,构建了由压力驱动的电化学传感器。Pt-NC SAzyme@Ab2催化H2O2产生O2,不断增大压力,将U型管中的KI溶液推入密封的离心管,与离心管中的CsPbBr3发生反应,实现多色荧光变化。此外,随着U型管中的溶液移入离心管,装置两端的电压会逐渐升高至电源电压。因此,将压力信号转换为荧光和电化学信号,实现了氨基吡啶的检测。综上所述,纳米酶的类酶活性催化H2O2分解,会产生化学信号,通过对化学信号的处理,可将其转变为电流或电压等电信号,以此构建的电化学传感器可用于检测食品添加剂。
2.2 基于纳米酶的电化学生物传感器检测农药
农药是治理病虫草鼠害的有效武器。在种植、养殖或加工过程中使用的农药易残留在食品中,长期摄入含有残留农药的食品,将会引发头晕、腹泻和呕吐等慢性中毒症状,严重情况下将会对人体的内脏、神经系统和免疫系统等器官和组织造成不可逆转的伤害。因此在低限度下识别食品中残留的农药成分至关重要,表2列出了基于纳米酶的电化学生物传感器检测食品中农药残留成分的应用。
表2 不同纳米酶检测食品中农药的应用
Table 2 Application of various nanozymes for the detection of pesticides in foods
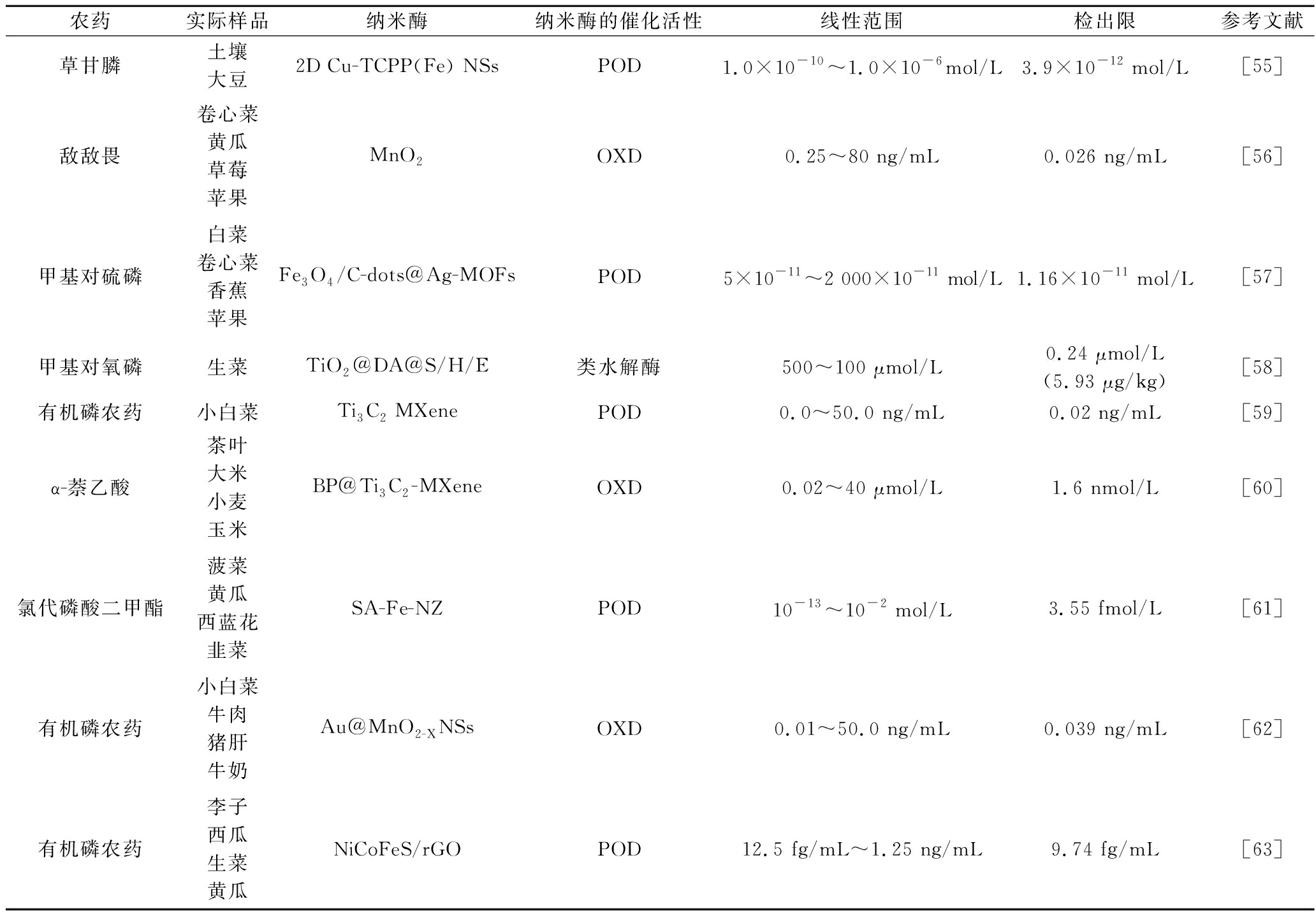
农药实际样品纳米酶纳米酶的催化活性线性范围检出限参考文献草甘膦土壤大豆2D Cu-TCPP(Fe) NSsPOD1.0×10-10~1.0×10-6mol/L3.9×10-12 mol/L[55]敌敌畏卷心菜黄瓜草莓苹果MnO2OXD0.25~80 ng/mL0.026 ng/mL[56]甲基对硫磷白菜卷心菜香蕉苹果Fe3O4/C-dots@Ag-MOFsPOD5×10-11~2 000×10-11 mol/L1.16×10-11 mol/L[57]甲基对氧磷生菜TiO2@DA@S/H/E类水解酶500~100 μmol/L0.24 μmol/L(5.93 μg/kg)[58]有机磷农药小白菜Ti3C2 MXenePOD0.0~50.0 ng/mL0.02 ng/mL[59]α-萘乙酸茶叶大米小麦玉米BP@Ti3C2-MXeneOXD0.02~40 μmol/L1.6 nmol/L[60]氯代磷酸二甲酯菠菜黄瓜西蓝花韭菜SA-Fe-NZPOD10-13~10-2 mol/L3.55 fmol/L[61]有机磷农药小白菜牛肉猪肝牛奶Au@MnO2-XNSsOXD0.01~50.0 ng/mL0.039 ng/mL[62]有机磷农药李子西瓜生菜黄瓜NiCoFeS/rGOPOD12.5 fg/mL~1.25 ng/mL9.74 fg/mL[63]
注:MB-高亚甲基蓝;DA-含有烯二醇单元的化合物;S/H/E-丝氨酸/组胺/谷氨酸;rGO-还原氧化石墨。
目前,已有研究人员利用农药-生物酶-纳米酶之间的相互作用关系,构建高灵敏度检测农药成分的电化学生物传感器。针对有机磷农药(organophosphorus pesticides,OPs)的检测,如YU等[59]将钴掺杂入Ti3C2 MXene,以Ti3C2 MXene为模板,通过定向湿化学法合成出具有良好的水分散性、亲水性的和优异POD活性的二维CMNSs纳米酶,并成功开发出基于电活性物质原位生长的均相电化学(homogeneous electrochemical,HEC)传感器,检出限达到0.02 ng/mL。ZENG等[62]制备出具有极高类OXD活性的Au@MnO2-X纳米酶,并成功用于构建Au@MnO2-X NSs和碱性磷酸酶(alkaline phosphatase,ALP)双酶级联HEC传感平台。当OPs存在时,ALP的活性中心将会被OPs结合,使ALP将L-抗坏血酸-2-磷酸酯水解出的抗坏血酸浓度降低,削弱了抗坏血酸对Au@MnO2-XNSs的酶活性的阻滞作用。该团队通过捕获Au@MnO2-X NSs与ALP级联作用所产生的TMB电信号动态变化,实现了对OPs的灵敏度检测,检测限达到0.039 ng/mL。WANG等[63]将NiCoFeS/rGO纳米酶和乙酰胆碱酯酶(acetylcholinesterase,AChE)组成多功能级联均质传感系统,建立了灵敏的均相电化学检测OPs的方法。AChE的酶活性会因OPs的存在而降低,使AChE水解乙酰硫代胆碱所产生的硫代胆碱(thiocholine,TCh)浓度降低,进而削弱了TCh对NiCoFeS/rGO纳米酶的POD活性抑制作用。在NiCoFeS/rGO纳米酶和AChE的级联作用过程中,NiCoFeS/rGO与H2O2共存时产生的DAP具有强烈的电信号。因此,根据DAP增加的电信号反映OPs的生化行为并定量检测OPs含量,检测限达到9.74 fg/mL。综上所述,通过构建生物酶-纳米酶级联体系,利用农药小分子与生物酶特异性结合,影响生物酶的理化特性,进而将纳米酶在反应过程中产生的电信号放大,建立了高灵敏度检测农药成分的电化学传感平台。
2.3 基于纳米酶的电化学生物传感器检测重金属离子
重金属离子通过工业排放、农药使用和污水灌溉等人类活动排放到环境中,可能导致食品遭受化学污染并沿着食物链进行传播,最后在高级生物体内富集,威胁着公众健康。重金属离子在人体内会与功能蛋白结合引起蛋白质变性,导致人体患有各种严重性疾病。因此对食品中的重金属离子的检测工作至关重要,表3列出了基于纳米酶的电化学生物传感器在检测食品中重金属离子的应用。
表3 不同纳米酶检测食品中重金属离子的应用
Table 3 Application of various nanozymes for the detection of heavy metal ions in foods
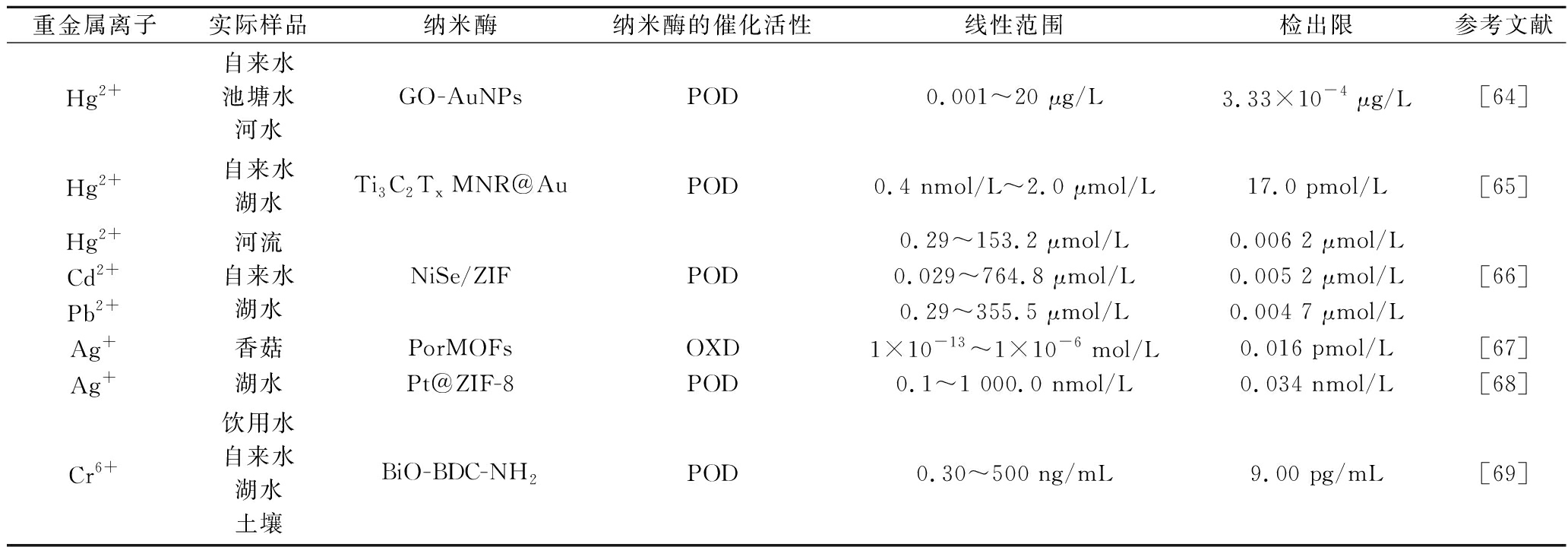
重金属离子实际样品纳米酶纳米酶的催化活性线性范围检出限参考文献Hg2+自来水池塘水河水GO-AuNPsPOD0.001~20 μg/L3.33×10-4 μg/L[64]Hg2+自来水湖水Ti3C2Tx MNR@AuPOD0.4 nmol/L~2.0 μmol/L17.0 pmol/L[65]Hg2+Cd2+Pb2+河流自来水湖水NiSe/ZIFPOD0.29~153.2 μmol/L0.006 2 μmol/L0.029~764.8 μmol/L0.005 2 μmol/L0.29~355.5 μmol/L0.004 7 μmol/L[66]Ag+香菇PorMOFsOXD1×10-13~1×10-6 mol/L0.016 pmol/L[67]Ag+湖水Pt@ZIF-8POD0.1~1 000.0 nmol/L0.034 nmol/L[68]Cr6+饮用水自来水湖水土壤BiO-BDC-NH2POD0.30~500 ng/mL9.00 pg/mL[69]
注:GO-氧化石墨;Por-卟啉。
重金属离子能够对纳米酶表面的电子密度和电子结构产生影响,从而对其类酶活性起到增强或抑制作用,因此电化学技术在痕量/超痕量重金属离子检测中得到了广泛的应用。如LIU等[65]通过自还原法制备出具有极弱POD活性的Ti3C2Tx MNR@Au纳米酶。Hg2+的存在能够激发并显著增强Ti3C2Tx MNR@Au的纳米酶活性,其能有效催化无色TMB、OPD生成有色产物。OPD的氧化产物DAP表现出较强的还原峰,且其峰强度随Hg2+浓度线性增加。利用这一原理,该团队成功研制出基于Ti3C2Tx MNR@Au纳米酶的高灵敏度检测Hg2+的电化学传感器,在有效避免电极位阻效应对纳米材料反应活性损害的同时使Hg2+检测限达到了17.0 pmol/L。ZHANG等[68]通过将Pt负载到ZIF-8上,制备出具有优异的POD活性的纳米酶Pt@ZIF-8并将其用于构建均匀电分析-比色双模检测Ag+平台。Pt@ZIF-8能够催化OPD氧化生成DAP,并通过Ag+对Pt@ZIF-8纳米酶的POD活性所产生的抑制作用,建立起Ag+与DAP的电活性信号之间的线性负相关关系。YANG等[69]以三维球花状氧化甲酸铋为前驱体和模板,构建了具有内在POD活性的金属-有机框架纳米酶BiO-BDC-NH2。Cr6+能够促进该纳米酶的POD活性,增强其催化TMB转化为oxTMB的能力,而Cr3+则起相反作用。因此,该团队将Cr6+转变为低毒性的Cr3+,通过 Cr6+和Cr3+的浓度与响应峰值电流的关系,以更环保的Cr3+形式检测总铬水平,实现对Cr6+的超痕量检测,检测限达到了9.00 pg/mL。综上所述,利用重金属离子对纳米酶活性的调控,影响电活性物质的量,构建重金属离子浓度与电活性物质响应电流之间的线性关系,搭建痕量/超痕量重金属离子检测电化学传感平台。
2.4 基于纳米酶的电化学生物传感器检测食源性致病菌
常见食源性致病菌主要有大肠杆菌、金黄色葡萄球菌、沙门氏菌以及霍乱弧菌等。这些食源性致病菌因其在环境中的高生存能力和迅速传播的特性,能够引发严重的食源性疾病,对人类健康构成重大威胁。因此对食品中的食源性致病菌进行即时、有效、准确地检测,能查出潜在的致病隐患,及时阻断病菌传播。表4列出了基于纳米酶的电化学生物传感器检测食品中食源性致病菌的应用。
表4 不同纳米酶检测食品中食源性致病菌的应用
Table 4 Application of various nanozymes for the detection of foodborne pathogens in foods

食源性致病菌实际样品纳米酶纳米酶的催化活性线性范围/(CFU/mL)检出限/(CFU/mL)参考文献副溶血性弧菌虾CP@MOFPOD10~1085 [70]李斯特菌牛奶莴苣匀浆Pt/HCNsPOD10~1092 [71]金黄色葡萄球菌自来水AuNPs/MOFsPOD10~7.5×107 6 [72]金黄色葡萄球菌牛奶Van@BSA-MnO2POD10~10510 [73]
注:CP-铜纳米点;HCNs-空心碳球;Van-万古霉素;BSA-牛血清白蛋白。
纳米酶的高催化活性能将OPD氧化成DAP,DAP可在电极上被还原而产生还原电流,利用这一性质可构建纳米酶电化学传感器进行检测分析。如WANG等[70]构建了由苯硼酸装饰的CuO2纳米点介导的金属有机有机框架(phenylboronic acid-decorated CuO2 nanodot-mediated metal-organic framework,CP@MOF)纳米酶。在酸性环境下,CP@MOF纳米酶解体,使Cu2+和H2O2同时释放。这会引起Fenton反应,产生·OH,进而氧化TMB,实现对副溶血性弧菌(Vibrio parahaemolyticus)的比色检测;此外,产生的Cu2+还可用于副溶血性弧菌的电化学检测。JIANG等[71]开发了一种基于适配体(aptamer,Apt)调控Pt/HCNs纳米酶活性的简单、高灵敏度的纳米酶电化学传感器。Pt/HCNs纳米酶具有类过氧化物酶活性,能催化氧化OPD生成具有电活性的DAP,产生明显的还原峰电流。当Pt/HCNs纳米酶与Apt结合形成Apt/Pt/HCNs时,其类酶活性就会受到明显抑制,活性位点被覆盖,DAP的还原电流也几乎消失。然而,在李斯特菌存在的情况下,纳米酶的活性可以通过Apt对李斯特菌的特异性识别而恢复,还原峰电流也随之恢复。因此,基于Apt调节的Pt/HCNs纳米酶的电化学传感器对李斯特菌有优异的检测性能。HU等[72]合成了AuNPs/MOFs纳米酶,利用AuNPs的导电性和MOFs的催化活性可增强电化学信号。由于超薄的厚度和丰富的活性位点,二维MOF纳米酶表现出了极佳的过氧化物酶活性,可在H2O2的存在下催化氧化OPD。氧化产物DAP在电极上还原成OPD,从而产生阴极电流,利用其阴极电流可以进行电化学检测。当系统中存在金黄色葡萄球菌时,发现峰电流与金黄色葡萄球菌的浓度呈线性关系。因此,合成的AuNPs/MOFs电化学检测器可用于检测金黄色葡萄球菌。综上所述,当食源性致病菌存在时,其易于纳米酶结合而导致纳米酶的催化活性被抑制,DAP被还原而产生的还原电流随之发生改变,故产生电化学信号,因此可实现对食源性病菌的检测。
2.5 基于纳米酶的电化学生物传感器检测霉菌毒素
霉菌毒素,是指霉菌在其所污染的食品中产生的有毒代谢产物,常见的有赭曲霉毒素A(ochratoxin A,OTA)、黄曲霉毒素B1(aflatoxin B1,AFB1)、伏马菌毒素B1(fumonisin B1,FB1)等。霉菌毒素可通过饲料或食品进入人和动物体内,引起人和动物的急性或慢性中毒,侵害人体健康。因此对食品中的霉菌毒素进行定量、精确、快速的检测具有重要意义。表5列出了基于纳米酶的电化学生物传感器检测食品中霉菌毒素的应用。
表5 不同纳米酶检测食品中霉菌毒素的应用
Table 5 Application of various nanozymes for the detection of mycotoxins in foods
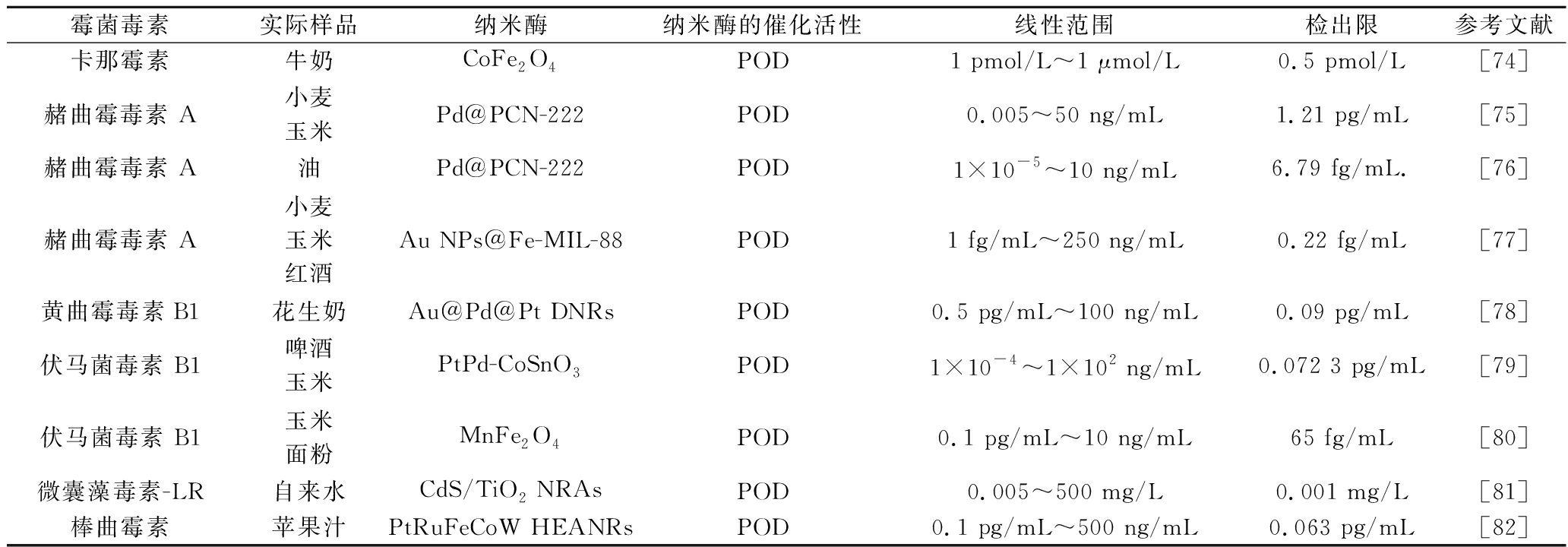
霉菌毒素实际样品纳米酶纳米酶的催化活性线性范围检出限参考文献卡那霉素牛奶CoFe2O4POD1 pmol/L~1 μmol/L0.5 pmol/L[74]赭曲霉毒素 A小麦玉米Pd@PCN-222POD0.005~50 ng/mL1.21 pg/mL[75]赭曲霉毒素 A油Pd@PCN-222POD1×10-5~10 ng/mL6.79 fg/mL.[76]赭曲霉毒素 A小麦玉米红酒Au NPs@Fe-MIL-88POD1 fg/mL~250 ng/mL0.22 fg/mL[77]黄曲霉毒素B1花生奶Au@Pd@Pt DNRsPOD0.5 pg/mL~100 ng/mL0.09 pg/mL[78]伏马菌毒素 B1啤酒玉米PtPd-CoSnO3POD1×10-4~1×102 ng/mL0.072 3 pg/mL[79]伏马菌毒素 B1玉米面粉MnFe2O4POD0.1 pg/mL~10 ng/mL65 fg/mL[80]微囊藻毒素-LR自来水CdS/TiO2 NRAsPOD0.005~500 mg/L0.001 mg/L[81]棒曲霉素苹果汁PtRuFeCoW HEANRsPOD0.1 pg/mL~500 ng/mL0.063 pg/mL[82]
注:PCN-222-金属有机框架;MIL-88-金属有机框架;DNRs-树枝状纳米棒;NRAs-纳米棒阵列;HEANRs-高熵合金纳米棒。
纳米酶的类POD活性能在H2O2存在下催化3,3-二氨基联苯胺(diaminobenzidine,DAB)氧化,产生不溶性沉淀,当沉淀附着在电极上时,电流值会发生改变,因此可将化学信号转化为电信号用于检测分析。如CHEN等[78]构建了基于Au@Pd@Pt DNRs纳米酶的超灵敏新型光电化学传感器。当AFB1存在时,Au@Pd@Pt-aptDNA 能够结合AFB1,从而抑制纳米酶催化DAB的氧化,使形成的沉淀减少,进而增强了光电流,实现了对AFB1的检测。WEI等[79]制备了一种用于定量分析FB1的灵敏光电化学传感器,当FB1被引入传感平台时,PtPd-CoSnO3会与FB1-Apt相结合成FB1-Apt/PtPd-CoSnO3,阻止了PtPd-CoSnO3催化氧化DAB生成沉淀,显著提高了光电流,产生电化学信号。LI等[80]也提出了一种基于半导体MOFs和MnFe2O4纳米酶调控的超灵敏“信号反转”光电化学适体传感器。MnFe2O4表现出优异的类过氧化物酶活性,在H2O2的存在下,DAB被MnFe2O4电催化氧化,产生不溶性沉淀,光电流减弱;而FB1的浓度增加则会抑制DAB的氧化,使沉淀减少,光电流恢复,实现了电化学信号反转。综上所述,基于纳米酶的电化学阻抗型传感器在对霉菌毒素进行分析时,由于霉菌毒素与纳米酶相互结合,影响了纳米酶对DAB的催化反应,导致电流发生改变,从而产生电化学信号,实现对目标分析物的检测。
综上,基于纳米酶的电化学生物传感器应用于食品安全领域展现出了广阔的应用前景,可检测食品中的各种有害物质,如食品添加剂、农药、重金属离子、食源性致病菌、霉菌毒素等。特别地,类POD活性的纳米酶应用相对更加广泛,可能有以下几个原因:类POD的活性底物丰富,包括了TMB、OPD等,并且反应机制简单高效;在传统的食品安全快检的酶联免疫分析中,POD的使用最为广泛,可能也为纳米酶在食品快检领域的实际应用提供了重要参考和经验借鉴;在电化学传感器的研制中,电子的得失能力与传递速度非常重要,类POD为双底物纳米酶,催化氢受体产生大量的氧化自由基,再将第二反应底物氢供体快速氧化,该特性使其具备较高的电子传递效率,提升了传感器的灵敏度和响应能力。
3 总结与展望
本文总结了基于纳米酶的电化学生物传感器用于检测食品中的食品添加剂、农药、重金属离子、食源性致病菌、霉菌毒素等有害物质。基于纳米酶的电化学传感装置具有检测限低、检测线性范围宽、检测识别度高等优点,这可归因于纳米酶的高催化活性。在检测过程中,纳米酶的类酶活性(如类POD活性、类OXD活性、类CAT活性、类SOD活性等)能起到催化作用,促进电流、电压、电阻值的改变,将化学信号放大并转变为电信号,从而实现对目标物质的检测。然而,由于待测物存在形式各异,纳米酶类型多样,电化学检测机制复杂,使其在实际检测分析过程中仍然存在一定限制。如部分纳米酶的稳定性、催化活性易受到环境的影响,在制备过程、催化过程中容易出现纳米酶失活的现象,从而无法保证检测结果准确;食品中的有害物质存在形式庞杂,且多以小分子为主,难以准确识别检测。
针对上述现存的问题,未来可能有如下发展趋势:利用纳米酶的多酶性质,设计级联反应,以此来提高对待测物的检测选择性和灵敏度;通过分子模拟识别,设计新型纳米酶结构,提高纳米酶的稳定性与纳米酶催化的专一性;设计具有靶向性的抗原抗体技术,使待测物能被准确捕捉识别,并结合纳米酶的催化活性,放大信号。统而言之,基于纳米酶的电化学生物传感器在食品安全检测领域具有广阔的研究前景,随着新型技术的开发,科学前沿的不断进步,未来在本领域将会有更进一步的发展。
[1] 邓澄. 提高食品安全检验检测质量的意义与路径[J].中国食品, 2024(2):62-64.DENG C.The significance and path to improve the quality of food safety inspection and testing[J].China Food, 2024(2):62-64.
[2] 王海燕. 食品添加剂应用现状和监管措施研究[J].食品安全导刊, 2024(28):20-22.WANG H Y.Research on application status of food additives and regulatory measures[J].China Food Safety Magazine, 2024(28):20-22.
[3] 朱蕾, 刘静, 徐欢, 等.植物基食品安全风险及应对策略[J].食品科学, 2024, 45(20):376-386.ZHU L, LIU J, XU H, et al.Plant-based foods:Safety risks and countermeasures[J].Food Science, 2024, 45(20):376-386.
[4] SI L X, WU Q, JIN Y L, et al.Research progress in the detection of trace heavy metal ions in food samples[J].Frontiers in Chemistry, 2024, 12:1423666.
[5] 刘婷宇, 董庆利, 李嘉铭, 等.食品中食源性致病菌活菌检测方法研究进展[J/OL].食品工业科技, 2024.DOI:10.13386/j.issn1002-0306.2024070120.LIU T Y, DONG Q L, LI J M, et al.Research progress of detection technology of viable foodborne pathogens[J/OL].Science and Technology of Food Industry, 2024.DOI:10.13386/j.issn1002-0306.2024070120.
[6] 纪文华, 李雪梅, 尹小燕, 等.黄曲霉毒素检测方法研究进展[J].河南工业大学学报(自然科学版), 2022, 43(5):14-21.JI W H, LI X M, YIN X Y, et al.Research progress of aflatoxin detection methods[J].Journal of Henan University of Technology (Natural Science Edition), 2022, 43(5):14-21.
[7] 国家卫健委印发“十四五”食品安全标准与监测评估规划[J].中国食品工业, 2022(16):12.National Health Commission issues ‘14th Five-Year Plan’ for food safety standards and monitoring and evaluation[J].China Food Industry, 2022(16):12.
[8] 胡秀智. 原子吸收光谱法在食品金属检测中的研究进展[J].现代食品, 2021, 27(9):20-22.HU X Z.Research progress of atomic absorption spectrometry in the detection of metals in food[J].Modern Food, 2021, 27(9):20-22.
[9] 黄红滇. 高效液相色谱技术在食品检测中的应用[J].中国食品工业, 2024(21):90-92.HUANG H D.Application of high performance liquid chromatography in food detection[J].China Food Industry, 2024(21):90-92.
[10] 谢希杨, 黄天然, 黄明.基于碳点的荧光适配体传感器在食品安全检测中的应用研究进展[J].食品科学, 2024, 45(22):361-372.XIE X Y, HUANG T R, HUANG M.Research progress in the application of carbon dot-based fluorescent aptamer sensors in food safety detection[J].Food Science, 2024, 45(22):361-372.
[11] 宋菁景, 刘雪, 林小晖.色谱-质谱联用技术在食品检测中的应用[J].食品安全导刊, 2022(17):180-183.SONG J J, LIU X, LIN X H.Application of chromatography-mass spectrometry in food detection[J].China Food Safety Magazine, 2022(17):180-183.
[12] WU J, LIU H, CHEN W W, et al.Device integration of electrochemical biosensors[J].Nature Reviews Bioengineering, 2023, 1(5):346-360
[13] 范克龙, 高利增, 魏辉, 等.纳米酶[J].化学进展, 2023, 35(1):1-87.FAN K L, GAO L Z, WEI H, et al.Nanozymes[J].Progress in Chemistry, 2023, 35(1):1-87.
[14] 李芙蓉, 向发椿, 曹丽萍, 等.纳米酶在食品检测中的应用研究进展[J].食品科学, 2022, 43(1):285-297.LI F R, XIANG F C, CAO L P, et al.Recent advances in applications of nanozymes in food detection[J].Food Science, 2022, 43(1):285-297.
[15] CHEN J Q, LIU X Y, ZHENG G C, et al.Detection of glucose based on noble metal nanozymes:Mechanism, activity regulation, and enantioselective recognition[J].Small, 2023, 19(8):2205924.
[16] ZHANG X J, LIN S J, LIU S W, et al.Advances in organometallic/organic nanozymes and their applications[J].Coordination Chemistry Reviews, 2021, 429:213652.
[17] DAI X H, LIU H, DU W X, et al.Biocompatible carbon nitride quantum dots nanozymes with high nitrogen vacancies enhance peroxidase-like activity for broad-spectrum antibacterial[J].Nano Research, 2023, 16(5):7237-7247.
[18] ZHANG X L, LI G L, WU D, et al.Recent progress in the design fabrication of metal-organic frameworks-based nanozymes and their applications to sensing and cancer therapy[J].Biosensors and Bioelectronics, 2019, 137:178-198.
[19] CHEN H Y, YANG T, LIU F Q, et al.Electrodeposition of gold nanoparticles on Cu-based metal-organic framework for the electrochemical detection of nitrite[J].Sensors and Actuators B:Chemical, 2019, 286:401-407.
[20] LIU L, DU J, LIU W E, et al.Enhanced His@AuNCs oxidase-like activity by reduced graphene oxide and its application for colorimetric and electrochemical detection of nitrite[J].Analytical and Bioanalytical Chemistry, 2019, 411(10):2189-2200.
[21] CHEN Z C, LAI G S, LIU S, et al.Ultrasensitive electrochemical aptasensing of kanamycin antibiotic by enzymatic signal amplification with a horseradish peroxidase-functionalized gold nanoprobe[J].Sensors and Actuators B:Chemical, 2018, 273:1762-1767.
[22] WU J, WANG X Y, WANG Q, et al.Nanomaterials with enzyme-like characteristics (nanozymes):Next-generation artificial enzymes (II)[J].Chemical Society Reviews, 2019, 48(4):1004-1076.
[23] LI S Q, LIU X D, CHAI H X, et al.Recent advances in the construction and analytical applications of metal-organic frameworks-based nanozymes[J].TrAC Trends in Analytical Chemistry, 2018, 105:391-403.
[24] ZHANG L, WANG H, QU X G.Biosystem-inspired engineering of nanozymes for biomedical applications[J].Advanced Materials, 2024, 36(10):2211147.
[25] 张卫丹, 辛嘉英, 贺姣, 等.纳米酶构效关系及其在食品检测中的应用[J].食品安全质量检测学报, 2023, 14(19):78-88.ZHANG W D, XIN J Y, HE J, et al.Structure-activity relationship of nanozymes and its applications in food detection[J].Journal of Food Safety &Quality, 2023, 14(19):78-88.
[26] GONG L, CHEN Y, BAI X P, et al.Peroxidase-mimicking Pt nanodots supported on polymerized ionic liquid wrapped multi-walled carbon nanotubes for colorimetric detection of hydrogen peroxide and glucose[J].Microchemical Journal, 2021, 163:105872.
[27] ZHU H S, CAI Y, QILENG A R, et al.Template-assisted Cu2O@Fe(OH)3 yolk-shell nanocages as biomimetic peroxidase:A multi-colorimetry and ratiometric fluorescence separated-type immunosensor for the detection of ochratoxin A[J].Journal of Hazardous Materials, 2021, 411:125090.
[28] LOU Z P, ZHAO S, WANG Q, et al.N-doped carbon as peroxidase-like nanozymes for total antioxidant capacity assay[J].Analytical Chemistry, 2019, 91(23):15267-15274.
[29] WU G J, DILINAER A, NIE P, et al.Dual-modal bimetallic nanozyme-based sensing platform combining colorimetric and photothermal signal cascade catalytic enhancement for detection of hypoxanthine to judge meat freshness[J].Journal of Agricultural and Food Chemistry, 2023, 71(43):16381-16390.
[30] LI Y C, WANG P, HUANG L J, et al.Schiff-base chemistry-coupled catechol oxidase-like nanozyme reaction as a universal sensing mode for ultrasensitive biosensing[J].Analytical Chemistry, 2023, 95(7):3769-3778.
[31] ZHANG J Y, ZHONG Y J, ZHANG C Y, et al.Mesoporous core-shell Pd@Pt nanospheres as oxidase mimics with superhigh catalytic efficiency at room temperature[J].The Journal of Physical Chemistry Letters, 2022, 13(9):2137-2143.
[32] CHENG H, CHEN Y Y, LIU M J, et al.Theory-guided design of S-doped Fe/Co dual-atom nanozymes for highly efficient oxidase mimics[J].Chemical Science, 2024, 15(36):14816-14828.
[33] GEBICKA L, KRYCH-MADEJ J.The role of catalases in the prevention/promotion of oxidative stress[J].Journal of Inorganic Biochemistry, 2019, 197:110699.
[34] CHEN M T, QIU Q Q, QILENG A R, et al.Efficient nanozyme-triggered pressure sensor for point-of-care immunoassay:Visual sensing and time readout device[J].Analytical Chemistry, 2023, 95(30):11383-11390.
[35] QIAO Q Q, WANG J Y, LONG K, et al.A cascaded enzyme system based on the catalase-like activity of Ti3C2Tx MXene nanosheets for the efficient combination cancer therapy[J].Nano Today, 2024,54:102059.
[36] LI H, XIA X Y, ZANG J C, et al.Construction of manganese-based oyster (Crassostrea gigas) ferritin nanozyme with catalase-like enzyme activity[J].Journal of Agricultural and Food Chemistry, 2024, 72(1):810-818.
[37] SAHOO B M, BANIK B K, BORAH P, et al.Reactive oxygen species (ROS):Key components in cancer therapies[J].Anti-Cancer Agents in Medicinal Chemistry, 2022, 22(2):215-222.
[38] WU H Y, BU T, CAO Y Y, et al.Double-enzyme active vanadium nanospheres-mediated ratiometric multicolor immunosensors for sensitive detection of the T-2 toxin[J].Analytical Chemistry, 2023, 95(12):5275-5284.
[39] ZHANG Y J, GAO W H, MA Y N, et al.Integrating Pt nanoparticles with carbon nanodots to achieve robust cascade superoxide dismutase-catalase nanozyme for antioxidant therapy[J].Nano Today, 2023, 49:101768.
[40] APARNA, GARG M, VISHWAKARMA N, et al.Molecularly imprinted conducting polymer based sensor for Salmonella typhimurium detection[J].Bioelectrochemistry, 2022, 147:108211.
[41] ZHANG J L, WANG J J, ZHANG X Q, et al.Rapid detection of Escherichia coli based on 16S rDNA nanogap network electrochemical biosensor[J].Biosensors and Bioelectronics, 2018, 118:9-15.
[42] ANGELOPOULOU M, KOURTI D, MERTIRI M, et al.A 3D-printed electrochemical immunosensor employing Cd/Se ZnS QDs as labels for the rapid and ultrasensitive detection of Salmonella typhimurium in poultry samples[J].Chemosensors, 2023, 11(9):475.
[43] 张玉, 宋志敏, 杜衍.纳米酶传感器在现场即时检测领域的应用进展[J].分析化学, 2023, 51(5):800-810.ZHANG Y, SONG Z M, DU Y.Recent progress of nanozyme-based sensors in point-of-care testing[J].Chinese Journal of Analytical Chemistry, 2023, 51(5):800-810.
[44] LI C, ZHANG X N, TANG Q Y, et al.Molecularly imprinted electrochemical sensor for ethyl carbamate detection in Baijiu based on “on-off” nanozyme-catalyzing process[J].Food Chemistry, 2024, 453:139626.
[45] GE F G, SUN Y J, WANG K, et al.Colorimetric/electrochemical dual mode detection ascorbic acid based Au@PdNi nanozyme[J].Microchemical Journal, 2024, 201:110745.
[46] SHI X Y, LI J, XIONG Y, et al.Rh single-atom nanozymes for efficient ascorbic acid oxidation and detection[J].Nanoscale, 2023, 15(14):6629-6635.
[47] WANG M Z, ZHAO M H, LIU P, et al.Coupling diazotization with oxidase-mimetic catalysis to realize dual-mode double-ratiometric colorimetric and electrochemical sensing of nitrite[J].Sensors and Actuators B:Chemical, 2022, 355:131308.
[48] GUAN H N, XING K, LIU S P.Green synthesis of Au magnetic nanocomposites using waste chestnut skins and their application as a peroxidase mimic nanozyme electrochemical sensing platform for sodium nitrite[J].Foods, 2023, 12(19):3665.
[49] KONG L Q, HONG F, LUAN P, et al.Novel competitive electrochemical impedance biosensor for the ultrasensitive detection of umami substances based on Pd/Cu-TCPP(Fe)[J].Food Chemistry, 2024, 438:137631.
[50] QILENG A R, LIU W P, LIANG H Z, et al.Tuning the electronic configuration of oxygen atom in engineering non-self-limited nanozyme for portable immunosensor[J].Advanced Functional Materials, 2024, 34(10):2311783.
[51] CHEN M T, QILENG A R, CHEN S Z, et al.Advanced enzyme mimicking engineering:3D biomimetic Pt single-atom nanozymes initiating pressure-driven device[J].Advanced Functional Materials, 2024, 34(38):2402552.
[52] LI Y, ZHANG Y Y, JAVED R, et al.Nonmetal catalyst boosting amplification of both colorimetric and electrochemical signal for multi-mode nitrite sensing[J].Food Chemistry, 2024, 441:138315.
[53] JIANG L Y, HU R, WANG A J, et al.1D/2D SnO2/SnS2 heterojunctions coupling with PtPd/CeO2 heterostructured nanozyme for ultrasensitive PEC apatasensing of lincomycin[J].Sensors and Actuators B:Chemical, 2023, 382:133491.
[54] LI S H, MA X H, PANG C H, et al.Novel chloramphenicol sensor based on aggregation-induced electrochemiluminescence and nanozyme amplification[J].Biosensors and Bioelectronics, 2021, 176:112944.
[55] ZHAO F, GUO D Q, TANG X, et al.Ratiometrically electrochemical and colorimetric dual-mode detection of glyphosate based on 2D Cu-TCPP(Fe) NSs[J].Talanta, 2024, 267:125207.
[56] WEN S H, ZHANG H Y, YU S, et al.Nanozyme coating-gated multifunctional COF composite based dual-ratio enhanced dual-mode sensor for highly sensitive and reliable detection of organophosphorus pesticides in real samples[J].Journal of Hazardous Materials, 2024, 480:135791.
[57] LI S H, PANG C H, MA X H, et al.Microfluidic paper-based chip for parathion-methyl detection based on a double catalytic amplification strategy[J].Mikrochimica Acta, 2021, 188(12):438.
[58] QIU L H, LV P, ZHAO C L, et al.Electrochemical detection of organophosphorus pesticides based on amino acids conjugated nanoenzyme modified electrodes[J].Sensors and Actuators B:Chemical, 2019, 286:386-393.
[59] YU L, CHANG J F, ZHUANG X Y, et al.Two-dimensional cobalt-doped Ti3C2 MXene nanozyme-mediated homogeneous electrochemical strategy for pesticides assay based on in situ generation of electroactive substances[J].Analytical Chemistry, 2022, 94(8):3669-3676.
[60] ZHU X Y, LIN L, WU R M, et al.Portable wireless intelligent sensing of ultra-trace phytoregulator α-naphthalene acetic acid using self-assembled phosphorene/Ti3C2-MXene nanohybrid with high ambient stability on laser induced porous graphene as nanozyme flexible electrode[J].Biosensors and Bioelectronics, 2021, 179:113062.
[61] WANG G X, LIU J, DONG H W, et al.A dual-mode biosensor featuring single-atom Fe nanozyme for multi-pesticide detection in vegetables[J].Food Chemistry, 2024, 437:137882.
[62] ZENG H L, CHEN H L, YANG B, et al.Highly-oxidizing Au@MnO2-X nanozymes mediated homogeneous electrochemical detection of organophosphorus independent of dissolved oxygen[J].Journal of Hazardous Materials, 2023, 459:132116.
[63] WANG R Y, LI B B, LI G P, et al.NiCoFeS/rGO nanozyme-mediated multifunctional homogeneous sensing system for ultrasensitive electrochemical assay of pesticides residues in fruits and vegetables[J].Sensors and Actuators B:Chemical, 2025, 422:136664.
[64] DIAO Q Q, BU Z J, FENG R L, et al.Performance-complementary colorimetric/electrochemical bimodal detection of Hg2+ based on analyte-accelerated peroxidase-mimicking activity of GO-AuNPs[J].Sensors and Actuators B:Chemical, 2025, 422:136598.
[65] LIU T T, ZHOU R Y, WU K C, et al.Colorimetric method transforms into highly sensitive homogeneous voltammetric sensing strategy for mercury ion based on mercury-stimulated Ti3C2Tx MXene nanoribbons@gold nanozyme activity[J].Analytica Chimica Acta, 2023, 1250:340975.
[66] NATARAJ N, DASH P, SAKTHIVEL R, et al.Simultaneous electrochemical and colorimetric detection of tri-heavy metal ions in environmental water samples employing 3D-MOF/nickel selenide as a synergistic catalyst[J].Chemical Engineering Journal, 2024, 485:149965.
[67] HUANG X W, HUANG C Y, ZHOU L L, et al.Allosteric switch for electrochemical aptasensor toward heavy metals pollution of Lentinus edodes sensitized with porphyrinic metal-organic frameworks[J].Analytica Chimica Acta, 2023, 1278:341752.
[68] ZHANG C L, YI Y H, ZHOU Y F, et al.Homogeneous electroanalysis coupled with colorimetry dual-mode sensing of silver ion in water based on target-inhibited peroxidase activity of Pt@ZIF-8 nanozyme[J].Microchemical Journal, 2024, 197:109839.
[69] YANG Q Y, WAN C Q, WANG Y X, et al.Bismuth-based metal-organic framework peroxidase-mimic nanozyme:Preparation and mechanism for colorimetric-converted ultra-trace electrochemical sensing of chromium ion[J].Journal of Hazardous Materials, 2023, 451:131148.
[70] WANG W H, XIAO S, ZENG M L, et al.Dual-mode colorimetric-electrochemical biosensor for Vibrio parahaemolyticus detection based on CuO2 nanodot-encapsulated metal-organic framework nanozymes[J].Sensors and Actuators B:Chemical, 2023, 387:133835.
[71] JIANG X H, LV Z W, RAO C Q, et al.Simple and highly sensitive electrochemical detection of Listeria monocytogenes based on aptamer-regulated Pt nanoparticles/hollow carbon spheres nanozyme activity[J].Sensors and Actuators B:Chemical, 2023, 392:133991.
[72] HU W C, PANG J, BISWAS S, et al.Ultrasensitive detection of bacteria using a 2D MOF nanozyme-amplified electrochemical detector[J].Analytical Chemistry, 2021, 93(24):8544-8552.
[73] MA Y X, LIN X H, XUE B, et al.Ultrasensitive and highly selective detection of Staphylococcus aureus at the single-cell level using bacteria-imprinted polymer and vancomycin-conjugated MnO2 nanozyme[J].Analytical Chemistry, 2024, 96(21):8641-8647.
[74] TIAN L, ZHANG Y, WANG L B, et al.Ratiometric dual signal-enhancing-based electrochemical biosensor for ultrasensitive kanamycin detection[J].ACS Applied Materials &Interfaces, 2020, 12(47):52713-52720.
[75] WU C Y, YUE Y Y, HUANG B C, et al.CRISPR-powered microfluidic biosensor for preamplification-free detection of ochratoxin A[J].Talanta, 2024, 269:125414.
[76] WU C Y, WU X C, HOU F, et al.An ultrasensitive electrochemical aptasensor based on Pd@PCN-222 as a signal probe coupled with exonuclease III-assisted cycling amplification for the detection of ochratoxin A[J].Food Control, 2022, 139:109066.
[77] LI Y L, CHEN Y Y, XIE F T, et al.Smartphone-based dual-mode aptasensor with bifunctional metal-organic frameworks as signal probes for ochratoxin A detection[J].Food Chemistry, 2025, 464:141540.
[78] CHEN D N, WANG G Q, MEI L P, et al.Dual II-scheme nanosheet-like Bi2S3/Bi2O3/Ag2S heterostructures for ultrasensitive PEC aptasensing of aflatoxin B1 coupled with catalytic signal amplification by dendritic nanorod-like Au@Pd@Pt nanozyme[J].Biosensors and Bioelectronics, 2023, 223:115038.
[79] WEI J J, WANG G Q, ZHENG J Y, et al.Z-scheme Cu2MoS4/CdS/In2S3 nanocages heterojunctions-based PEC aptasensor for ultrasensitive assay of fumonisin B1 via signal amplification with hollow PtPd-CoSnO3 nanozyme[J].Biosensors and Bioelectronics, 2023, 230:115293.
[80] LI Z Z, WANG Y F, JI X X, et al.Ultrasensitive “signal-inversion” photoelectrochemical aptasensor based on semiconductive MOF integrated with the manganese ferrite nanozyme-regulation for the selective detection of fumonisin B1[J].Sensors and Actuators B:Chemical, 2024, 420:136473.
[81] WEI J, QILENG A R, YAN Y, et al.A novel visible-light driven photoelectrochemical immunosensor based on multi-amplification strategy for ultrasensitive detection of microcystin-LR[J].Analytica Chimica Acta, 2017, 994:82-91.
[82] MEI L P, XU J J, TANJUNG A P, et al.Integration of high-entropy nanozyme and hollow In2S3 nanotube heterostructures decorated with WO3 for ultrasensitive PEC aptasensing of highly toxic mycotoxin[J].Sensors and Actuators B:Chemical, 2024, 414:135952.