漆酶(EC1.10.3.2)是一种含铜多酚氧化酶[1],自1883年Yoshida在日本紫胶漆树中发现以来[2],便因其独特的催化能力和广泛的底物特异性而备受关注。作为一种高效的酶,漆酶不仅能够氧化酚类及其衍生物和非酚类化合物酚类及其衍生物,如多酚、二酚以及芳香胺等,而且在氧化过程中能够将氧转化为水,全程不产生任何有害副产物,展现了其环保与高效的双重优势。同时漆酶环境友好和高效催化的特性使其在生物合成、木质纤维素生物精炼厂、制浆造纸工业、食品和纺织业、生物修复等领域有着重要的应用价值与潜力[3],成为近年来的研究热点。
漆酶的主要来源于真菌、细菌、植物及昆虫体内[4-5],不同来源的漆酶在结构和催化性能上存在差异,即便是同一来源的菌株,在不同环境条件下也可能产生性质各异的漆酶。在动物中,漆酶多与生殖、免疫等功能相关联,而植物漆酶如漆树漆酶,则在其表皮愈合过程中发挥重要作用。微生物漆酶,特别是真菌漆酶,能够广泛作用于多种底物,表现出极高的催化效率,能在多种环境或条件下发挥作用,展现了极强的适应性和实用性[6]。因此该酶具有高还原潜力和商业应用价值,主要集中在担子菌门和子囊菌门的物种上,成为当前研究的热点。目前,真菌是漆酶的主要产生菌,真菌漆酶是一种糖蛋白,由肽链、糖配基和Cu2+组成,分子质量为60~390 kDa,主要功能有降解木质素、参与自身黑色素合成、降解环境污染物等。
随着全球工业化进程的加速,合成染料在造纸、印刷、纺织及化妆品等行业的广泛应用,带来了严峻的环境污染。大量富含染料的工业废水未经有效处理即被排放至自然环境中,对生态系统的健康构成了巨大威胁[7]。当前,处理这类工业染料废水的方法主要有物理吸附、光化学降解及化学降解等方式,往往成本高并可能产生二次污染,难以全面解决环境污染这一问题。在此背景下,生物修复技术凭借其高效、环保、低成本及广泛适用性等优势,逐渐成为治理环境污染的重要选择。而漆酶在生物修复技术中能够催化氧化多种工业染料并生成无害产物水,这使得漆酶在染料脱色及工业废水净化领域展现出巨大的应用潜力[8]。
本研究以江西省南昌市土壤样本为材料,旨在初步筛选出产漆酶的菌株。通过优化培养条件,提升菌株的漆酶产量;并通过硫酸铵沉淀、透析及离子交换层析获得纯化的漆酶。同时,深入探究该菌株所产漆酶的酶学特性,包括最适温度、pH值、底物特异性及稳定性等,旨在为后续研究提供优质的菌株资源,并为漆酶的工业化应用奠定坚实的理论基础。
1 材料与方法
1.1 材料与设备
1.1.1 菌株
棘孢木霉Tasjk26,南昌师范学院分子遗传实验室分离纯化保藏。
1.1.2 主要试剂
葡萄糖、CuSO4·5H2O(Ⅲ)、蔗糖、K2HPO4、(NH4)2SO4、NH4NO3、KH2PO4、NaCl、氯仿异戊醇,西陇化工股份有限公司;FeSO4·7H2O、NH4Cl、D-果糖、乙酸、乙酸钠、MgSO4·7H2O,上海晶纯生化科技股份有限公司;酵母提取物、胰蛋白胨,上海拜力生物科技有限公司;NH4Cl、可溶性淀粉,国药集团化学试剂有限公司;酪蛋白胨,青岛高科技工业园海博生物技术有限公司;麦芽糖,上海源叶生物科技有限公司;NaNO3、KCl、KOH,天津市大茂化学试剂厂。
1.1.3 主要仪器及设备
MJX-150B霉菌培养箱,上海百典仪器设备有限公司;生物安全柜,青岛海尔特种电器有限公司;TS-1102恒温摇床,上海百典仪器设备有限公司;超净工作台,苏净集团苏州安泰空气技术有限公司;立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;WHL-125B电热恒温干燥箱,天津市泰斯特仪器有限公司;HH-4数显恒温水浴锅,国华电器有限公司;TGL-16 gR高速台式冷冻离心机,上海安亭科学仪器厂;pHS-25 pH计,上海仪电科学仪器股份有限公司;78-1磁力加热搅拌器,杭州仪表电有限公司;JJ224BC型电子天平,长熟市双杰测试仪器厂;UV-1200型紫外可见分光光度计,上海美普达仪器有限公司。
1.2 培养基
TSM培养基(Trichoderma selective medium)(g/L):MgSO4·7H2O 0.2,K2HPO4 0.9,KCl 0.15,NH4NO3 1.0,葡萄糖3.0,玫瑰红0.15,琼脂粉14。
PDA培养基(g/L):去皮土豆200 g切成小块加入适量水在电磁炉上加热至沸腾,维持20 min,4层纱布过滤,称取20 g无水葡萄糖溶于滤液中,定容至1 000 mL,分装到5个锥形瓶,每瓶200 mL,每瓶中加入琼脂粉2.8 g,121 ℃灭菌20 min。
合成低营养琼脂(synthetic nutrient-poor agar,SNA)培养基(g/L):KH2PO4 1.0,KCl 0.5,KNO3 1.0,MgSO4·7H2O 0.5,葡萄糖0.2,蔗糖0.2,琼脂粉14。
漆酶基础发酵培养基(g/L):胰蛋白胨5,葡萄糖10,KH2PO4 1,MgSO4·7H2O 0.5,CuSO4·5H2O 0.2,pH 6.0。
1.3 实验方法
1.3.1 菌株分离鉴定
1.3.1.1 产漆酶木霉菌株的筛选
取10 g土壤投入盛有90 mL无菌水的三角瓶中,充分振荡后梯度稀释至10-3。取上述梯度的稀释液200 μL涂布于含TSM培养基的平板上(含50 μg/mL链霉素),28 ℃倒置培养3~5 d至长出单菌落。将单菌落接种于含0.4%(体积分数)愈创木酚的PDA培养基上,28 ℃倒置培养48 h,观察菌落周围有无红褐色氧化带,记录出现红褐色氧化带的菌落编号,进行下一步复筛。采用摇瓶复筛进一步确定菌株的产酶能力,取直径0.5 mm菌饼3个接种于漆酶发酵培养基的锥形瓶中(250 mL瓶装50 mL培养基),于28 ℃,200 r/min振荡培养5 d,取滤液,用0.22 μm滤器过滤后即为粗酶液,ABTS法测定漆酶活力,选择酶活力最高的菌株进行后续实验。
1.3.1.2 产漆酶木霉菌株形态学鉴定
菌株分别接种至PDA与SNA平板,于28 ℃培养3~5 d,待分生孢子生长后,显微镜下观察分生孢子梗及孢子并拍照。同时,观察并记录菌落生长及形态特征。
1.3.1.3 产漆酶木霉菌株分子生物学鉴定
利用十六烷基三甲基溴化胺(cetyltrimethylammonium bromide,CTAB)法提取目标菌株基因组DNA;设计翻译延长因子1-α(translation elongation factor 1-alpha,tef1)扩增引物:tef1F:CATCGAGAAGTTCGAG AAGG;tef1R:AACTTGCAGGCAATGTGG进行PCR扩增,产物经0.1%(质量分数)琼脂糖凝胶电泳检测并纯化后送至上海生物工程有限公司进行测序,采用MEGA 7软件通过Neighbor-Joining(NJ)法构建系统发育树。
1.3.2 单因素试验
1.3.2.1 碳源对菌株Tasjk26产漆酶能力的影响
将菌株接种于PDA培养基,于28 ℃培养30 h,活化后,用直径0.5 cm打孔器打孔,在基础发酵培养基中设置不同碳源(10 g/L的葡萄糖、淀粉、果糖、麦芽糖、蔗糖),分别测定漆酶酶活力,每瓶培养基接种3个菌饼,每个处理重复3次,于28 ℃、200 r/min下培养5 d,ABTS法测定酶活力。比较不同碳源对产漆酶能力的影响,确定适合产酶的最佳碳源。
1.3.2.2 氮源对菌株Tasjk26产漆酶能力的影响
选择最佳碳源,在此培养条件下探索不同氮源[5 g/L的NaNO3、KNO3、(NH4)2SO4、胰蛋白胨、酵母粉]对产酶的影响,确定适合产酶的最佳氮源。
1.3.2.3 pH值对菌株Tasjk26产漆酶能力的影响
在确定最佳碳源、氮源后,调节发酵培养基的初始pH值(4.0、5.0、6.0、7.0、8.0),比较不同pH值对产漆酶能力的影响,确定适合产酶的最佳pH值。
1.3.2.4 培养时间对菌株Tasjk26产漆酶能力的影响
在确定最佳碳源、氮源及最适pH值的基础上,设置不同的培养时间(48、72、96、120、144 h),测定不同培养时间对菌株Tasjk26产酶能力的影响,确定适合产酶的最佳培养时间。
1.3.3 漆酶活力测定方法
采用ABTS法测定漆酶活力:空白对照管中加入pH为3.0的柠檬酸-Na2HPO4缓冲液2 mL,1 mmol/L 的ABTS溶液1 mL;检测管中加入适当稀释的酶液10 μL,柠檬酸缓冲溶液1.99 mL,加入ABTS溶液1 mL,充分混匀后30 ℃水浴反应3 min,测量420 nm处吸光度的变化,每15 s记录1次,共记录6次数据,计算吸光值差值,取平均值。
反应底物的制备:1 mmol/L ABTS 30 mL:0.016 g ABTS溶于蒸馏水并定容至30 mL。柠檬酸-Na2HPO4缓冲溶液(pH=3.0)200 mL:称取Na2HPO4·12H2O 94 g,柠檬酸3.05 g溶于蒸馏水中定容至200 mL。
酶活力:在特定温度、pH条件下,每分钟内催化1 μmol底物所需要的酶量定义为1个酶活力单位(U)。计算如公式(1)所示:
(1)
式中:ΔA,反应前后吸光度的变化值;V,加入比色皿中的溶液的体积,L;ε420,ABTS消光系数,为36 000 L/(mol·cm);V酶,加入酶液的体积, mL;L,比色皿光径, cm;t,反应时间, min;C=10-6 mol。
1.3.4 菌株Tasjk26粗酶液的纯化
最佳发酵条件下获得的发酵液抽滤除去菌丝,获得粗酶液,经0.22 μm滤器过滤,在4 ℃下缓慢加入(NH4)2SO4(60%,质量分数),静置1 h,待蛋白充分沉淀后4 ℃、4 200 r/min离心15 min,弃上清液,沉淀用粗酶液1/10体积的0.02 mol/L乙酸钠缓冲液(pH 4.8)溶解,将溶解后的溶液装入截留相对分子质量为10 kDa透析袋中,放入0.02 mol/L乙酸-乙酸钠缓冲液(pH 4.8)透析除盐,每隔6 h更换1次透析液并用0.1 mol/L BaCl2溶液检测透析是否完全。将透析完全后的酶液上样至DEAE-纤维柱,用0.02 mol/L乙酸钠缓冲溶液(pH 4.8)平衡10 min后洗涤柱子,然后用含1 mol/L的NaCl溶液洗脱蛋白。以2.5 mL/min的流速收集蛋白液,测定漆酶活力,将有活性的馏分结合浓缩。浓缩后,将纯化的酶液进行SDS-PAGE分析。
1.3.5 菌株Tasjk26纯化的理化性质
1.3.5.1 酶动力学参数
在最适反应温度、pH的基础上,设置不同浓度的ABTS底物,测定反应速度,通过双倒数法绘制米氏方程,计算动力学常数Vmax和Km。
1.3.5.2 温度对酶活力的影响
取纯化后的Tasjk26酶液,设置不同反应温度(10、20、30、40、50、60、70、80 ℃),分别保温30 min后,加入酶液至体系中30 ℃反应10 min后,测定酶活力,比较温度对漆酶活力的影响。
1.3.5.3 pH值对酶活力的影响
在最适反应温度的基础上,设置不同的pH(3.0、4.0、5.0、6.0、7.0),测定pH对漆酶活力的影响。
1.3.5.4 漆酶对染料的影响
染料溶液的配制:用0.02 mol/L的乙酸钠缓冲液(pH=4.8)分别配制质量浓度为50 mg/L的甲基橙、50 mg/L的结晶紫、50 mg/L的孔雀绿、100 mg/L的中性红、1 000 mg/L的刚果红,将上述染料浓度按序稀释到6、4.5、4.5、9、300 mg/L。
反应体系为3 mL,取稀释后染料液(甲基橙、结晶紫、孔雀绿、中性红、刚果红)与纯化后酶液体积2∶1,37 ℃恒温水浴锅中进行降解反应,在染料最大吸光度下反应48 h后测其吸光值,根据同一染料在0.02 mol/L的乙酸钠缓冲液作用下和纯化的漆酶酶液作用下吸光值的差别来计算降解率。
2 结果与分析
2.1 高产漆酶木霉菌株的筛选结果
本研究共分离纯化117株木霉菌株,通过初筛得到5株漆酶活力最高的菌株。图1-a、图1-b为初筛结果,菌落变红色说明具备漆酶活力。复筛结果如图1-c所示,其中菌株Tasjk26的漆酶活力最高,选择该菌株进行后续实验。
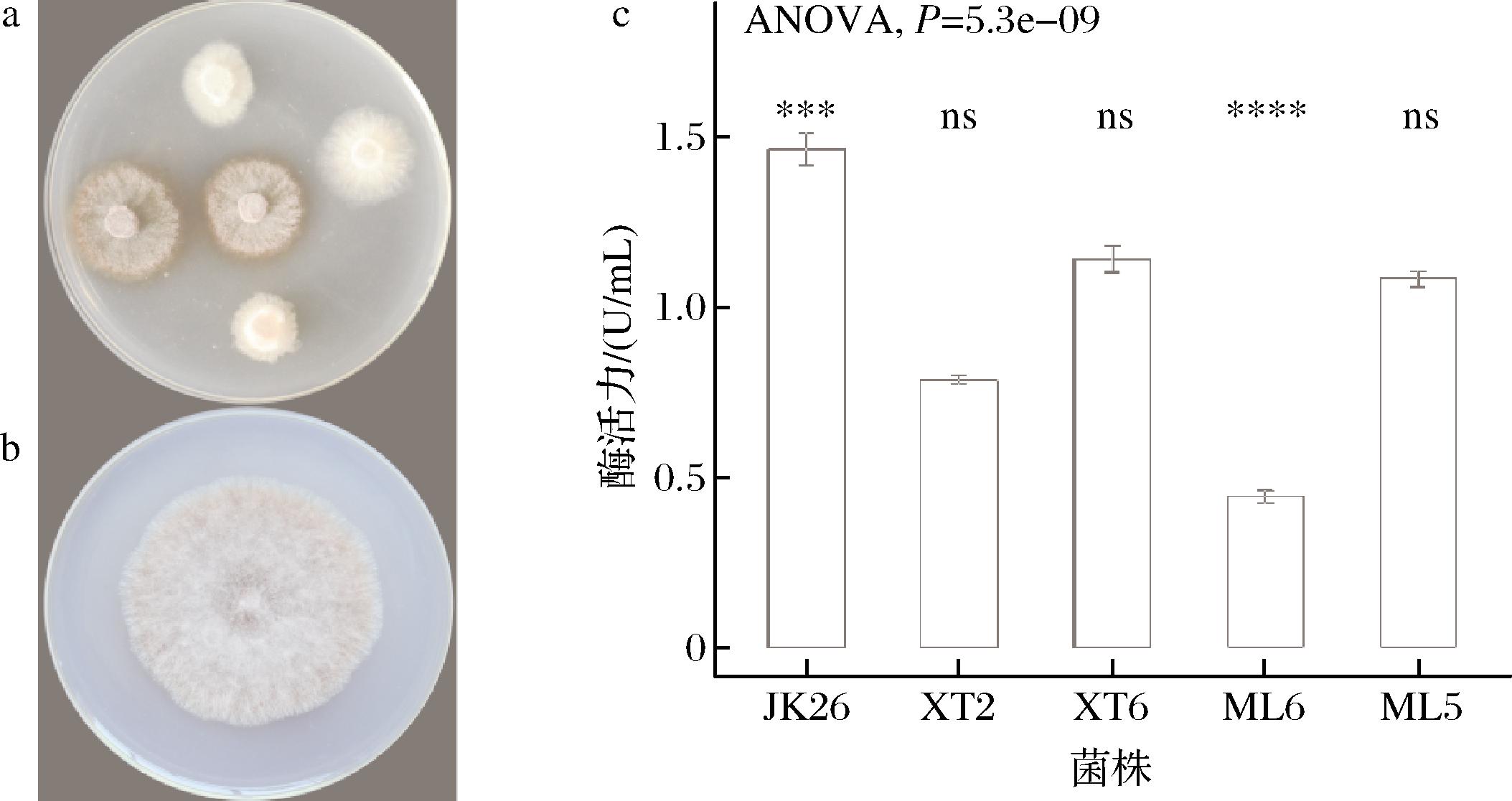
a、b-产漆酶菌株初筛选;c-产漆酶菌株复筛
图1 产漆酶木霉菌株筛选
Fig.1 Screening of Trichoderma strains producing laccase
注:***表示P<0.001,****表示P<0.000 1,ns表示差异不显著(下同)。
2.2 产漆酶木霉菌株鉴定
2.2.1 形态学鉴定
将菌种活化后分别接种于PDA培养基和SNA培养基上,培养3~5 d产孢后,挑取菌丝进行显微观察。如图2-d所示,木霉菌Tasjk26在PDA培养基上初培养时菌落为白色,其气生菌丝茂密,生长迅速,3 d菌落直径达到5.92 cm。如图2-a可看出3 d后产生绿色的分生孢子,随后覆盖整个平板。由图2-c可以看出分生孢子分隔不明显,分枝常对生,分支角度为锐角或接近直角,其上的瓶梗呈现对称分布,分支末端形成类似瓶状的小梗,瓶梗呈安培瓶且中部膨大。根据上述培养性状和形态学特征,初步鉴定该菌株为棘孢木霉菌Trichoderma asperellum。

a-PDA培养下菌落形态;b-SNA培养形态;c-分生孢子梗形态;d-菌株生长速度;e-系统进化树
图2 Tasjk26菌株鉴定
Fig.2 Identification of Tasjk26 strain
2.2.2 分子生物学鉴定
建立系统发育树,比对表明菌株与棘孢木霉T.asperellum(MF049065)序列相似度最高,达到99.8%,如图2-e所示,待测菌株与已知的棘孢木霉在同一个分支中。结合该菌株形态学结果,最终确认此木霉菌株为棘孢木霉,命名为Tasjk26(NCBI登录号为OR046017)。
以翻译延长因子1-α(translation elongation factor 1-alpha,tef1)为引物扩增序列如下:CATCGAGAAGT-TCGAGAAGGTAAGCTAATTTCACTGCTTTTCCCATCA-ATTTTTGGCACAATTATATGCCCGACAATTCTGTTCTC-AGTTTTGTCTTTCTTTTTTCAGCATCACCCCGCTTTGC-CAGCCTACCTACCCCTCCTTTGGCACAGCAAAAATTT-TTCTCGCTGCCTTGTTTGACTTTTAGTGGGGTGTCAAT-TTTGTTTGACGGCAACCCCACTATCGCCACTGTACCT-CTTTCCATCATCCACCACATGCTTTTGTTCAATCGCAT-CGTCTATTTTCAATATCTCTTGTTCATTATGCTGATCAT-GCTTCAATCAATAGGAAGCCGCCGAACTCGGCAAGG-GTTCCTTCAAGTATGCGTGGGTTCTTGACAAGCTCAA-GGCCGAGCGTGAGCGTGGTATCACCATCGACATTGC-CCTCTGGAAGTTCGAGACTCCCAAGTACTATGTCACC-GTCATTGGTATGTTTTGGACACTTCAGTCGACATTGCA-AGATCGTCATTCTAACATACTCTCCCCACAGACGCTCC-CGGTCACCGTGATTTCATCAAGAACATGATCACTGGT-ACCTCCCAGGCTGACTGCGCTATCCTGATTATCGCTG-CCGGTACTGGTGAGTTCGAGGCTGGTATCTCCAAGGA-TGGCCAGACCCGTGAGCACGCTCTGCTCGCCTACACC-CTGGGTGTCAAGCAGCTCATCGTCGCCATCAACAAG-ATGGACACTGCCAACTGGGCTGAGGCTCGTTACCTTG-AGATCATCAAGGAGACCTCCAACTTCATCAAGAAGG-TCGGCTTCAACCCCAAGACCGTTGCCTTCGTCCCCAT-CTCCGGTTTCAACGGTGACAACATGCTGTCCCCCTCC-ACCAACTGCCCCTGGTACAAGGGTTGGGAGAAGGAG-ACCAAGGCTGGCAAGTCCACCGGTAAGACCCTCCTC-GAGGCCATCGACGCCATCGAGCCCCCCAAGCGTCCC-ACAGACAAGCCCCTCCGTCTGCCCCTCCAGGACGTCT-ACAAGATCGGTGGTATCGGAACAGTCCCTGTCGGCC-GTATCGAGACTGGTGTCCTCAAGCCCGGTATGGTCGT-TACCTTCGCTCCTTCCAACGTCACCACTGAAGTCAAG-TCCGTCGAGATGCACCACGAGCAGCTCGCTGAGGGT-GTCCCCGGTGACAACGTTGGTTTCAACGTCAAGAAC-GTCTCTGTCAAGGATATCCGCCGTGGTAACGTTGCCG-GTGACTCCAAGAACGACCCTCCCATGGGTGCCGCTT-CTTTCAACGCCCAGGTCATCGTCATGAACCACCCTGG-CCAGGTCGGTGCCGGTTACGCTCCCGTCCTCGATTGC-CACACTGCCCACATTGCCTGCAAGTT。
2.3 单因素试验结果
2.3.1 培养基的碳源优化
如图3-a所示,Tasjk26菌株的产酶效率在以麦芽糖、果糖或淀粉为碳源的发酵培养基中培养后酶活力较高,其中麦芽糖为碳源时酶活力最高。杨珍福等[9]对2株田头菇属野生菌株进行生物学特性研究中发现:麦芽糖作为碳源时,茶树菇和杨柳田头菇菌丝日均生长速率均最快,与本研究结果一致。因此,选择麦芽糖作为Tasjk26的最适碳源。
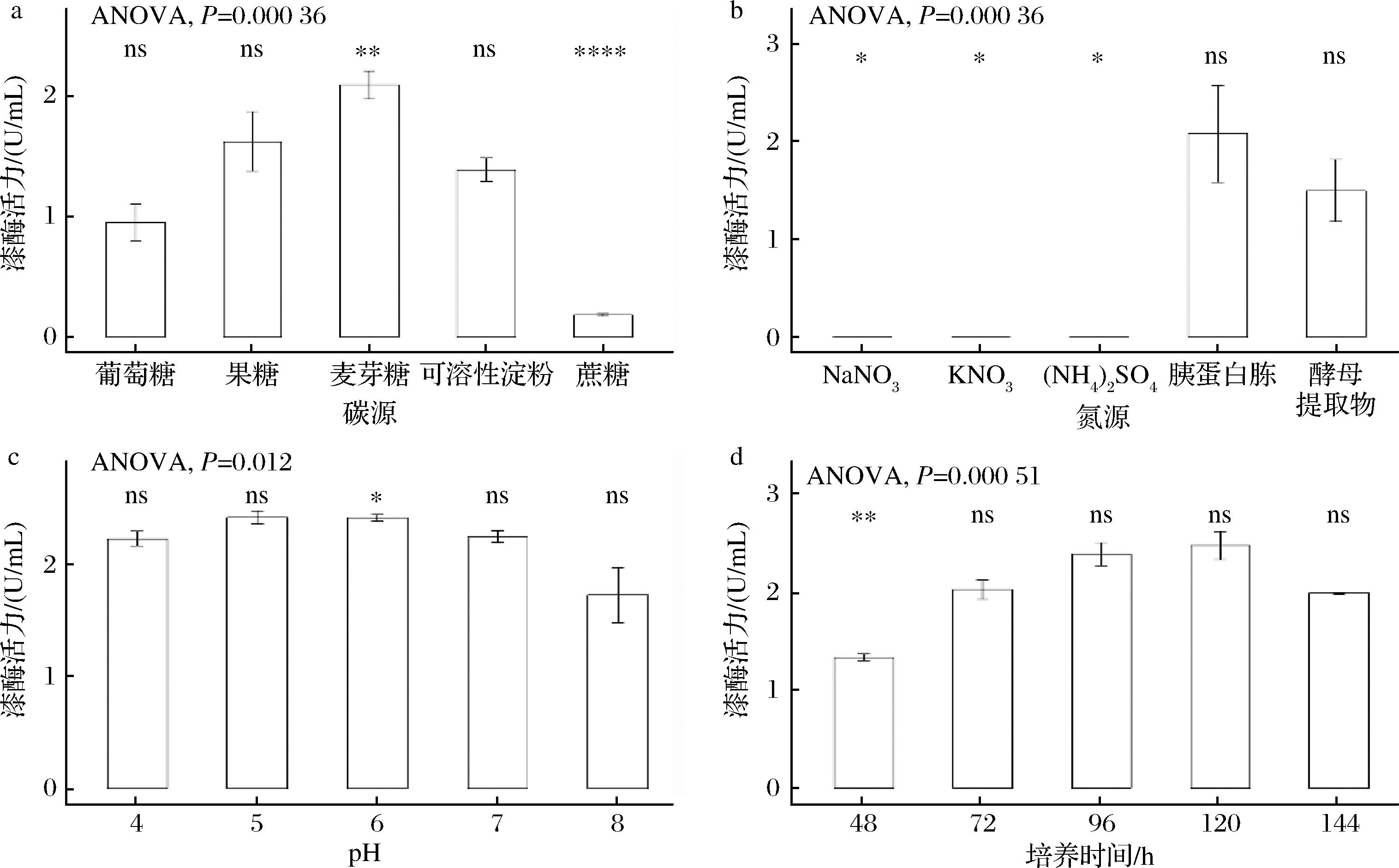
a-碳源优化;b-氮源优化;c-pH值优化;d-培养时间优化
图3 Tasjk26产酶条件优化
Fig.3 Optimization of enzyme production conditions for Tasjk26
注:*表示P<0.05,**表示P<0.01。
2.3.2 培养基的氮源优化
如图3-b所示,Tasjk26菌株只有在以胰蛋白胨、酵母粉作为氮源的基本发酵培养基中时具有漆酶活力,且以胰蛋白胨作为氮源时漆酶活力最高。SHI等[10]在研究时发现胰蛋白胨对BHZ-29的活菌数有显著影响。李润根等[11]在不同氮源处理链格孢菌时,胰蛋白胨处理的菌落直径大且菌落致密,仅次于天然培养基牛肉浸膏。因此,选择胰蛋白胨作为Tasjk26的最适氮源。
2.3.3 培养基的pH值优化
如图3-c所示,过酸或过碱条件下都会影响Tasjk26菌株产酶能力,pH=6.0时产酶能力最好,在发酵液初始pH值处于5.0~6.0产漆酶能力较高,而处于较低和较高pH水平内产酶能力会偏低,pH可以影响酶的结构从而改变与底物的特异性,ABD EL-LATIF等[12]研究发现,漆酶活力在pH值为5~7时保持稳定,且在pH=6.0时活力最高。因此,选择培养基pH=6.0作为Tasjk26的最佳培养pH。
2.3.4 培养时间优化
如图3-d所示,Tasjk26菌株的产酶效果和接种时间存在一定关系。过短和过长的发酵时间都不利于发酵液中菌株产漆酶,培养120 h时,达到最高产酶水平,酶活力最高。当培养时间小于120 h时,产酶能力升高,酶活力升高。而120 h后,产酶能力下降,酶活力下降。彭微等[13]在研究时发现,棘孢木霉生物量在培养时间为1~3 d时增长较缓慢,是因为菌株刚接种到培养基中,处于延滞期,抵御不良环境的能力弱,酶活力较低。随着培养时间的继续延长,酶系活跃,代谢旺盛,菌体开始快速增殖,酶活力旺盛,随着培养时间的持续,培养物质被大量的消耗,菌体也随着营养物质的缺乏和生存空间的减少,部分菌体出现死亡和自溶,酶活力降低。
2.4 漆酶优化
2.4.1 Tasjk26产漆酶分离纯化结果
经过(NH4)2SO4沉淀、DEAE纤维柱纯化后漆酶酶液样品与各步骤酶液的总蛋白、比活力等数据见表1,初始232 mL粗酶液的总活力为593.92 U,总蛋白为11.83 mg,比活力为50 196.08 U/g;在经过(NH4)2SO4沉淀后,26 mL的盐析酶液总活力为319.49 U,总蛋白为2.89 mg,比活力为110 503.6 U/g,纯化倍数为2.2,回收率为53.8%。最后经过DEAE纤维素离子交换柱纯化后漆酶酶液中的总活力降为141.85 U,总蛋白降为0.21 mg,而比活力大幅升高为664 402.81 U/g,纯化倍数升高为13.2,回收率为23.9%,可见在纯化过程中Tasjk26的纯化倍率大幅度提高。相比之下,刘芹等[14]通过(NH4)2SO4沉淀、离子交换层析和凝胶过滤层析来分离纯化漆酶,经过各步纯化后最终漆酶活力总回收率为18.8%,比活力为176.1 U/mg,田嘉慧等[15]通过(NH4)2SO4沉淀、疏水层析、DEAE离子层析和凝胶层析对一色齿毛菌GC.U01漆酶纯化,最终漆酶纯化倍数为21.86倍,回收率为6.57%,比活力为41.31 U/mg,由此可见本研究的纯化法操作简单、酶活力回收率高,这对于漆酶的开发与应用具有重要的意义,同时也为其他酶类的提取提供参考与借鉴。
表1 漆酶纯化
Table 1 Purification of laccase
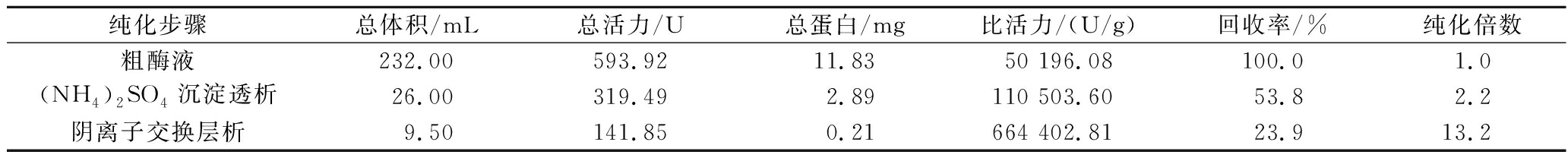
纯化步骤总体积/mL总活力/U总蛋白/mg比活力/(U/g)回收率/%纯化倍数粗酶液232.00593.9211.8350 196.08100.01.0(NH4)2SO4沉淀透析26.00319.492.89110 503.6053.82.2阴离子交换层析9.50141.850.21664 402.8123.913.2
2.4.2 Tasjk26漆酶SDS-PAGE蛋白凝胶结果
Tasjk26发酵液经过0.22 μm滤膜过滤(图4泳道1),(NH4)2SO4沉淀(图4泳道2)再通过DEAE-纤维素离子交换柱纯化(图4泳道3)后,SDS-PAGE电泳检测。结果表明,在70 kDa左右有明显的蛋白主带。而且,经过纯化后,杂蛋白也逐渐减少(图4)。表明该菌株产漆酶的分子质量约为70 kDa,与报道的真菌漆酶大小相符[16]。经过(NH4)2SO4沉淀、阴离子交换层析后,蛋白纯化了13.2倍(表1),纯化后的蛋白将用于后续的酶促动力学分析及染料降解实验。
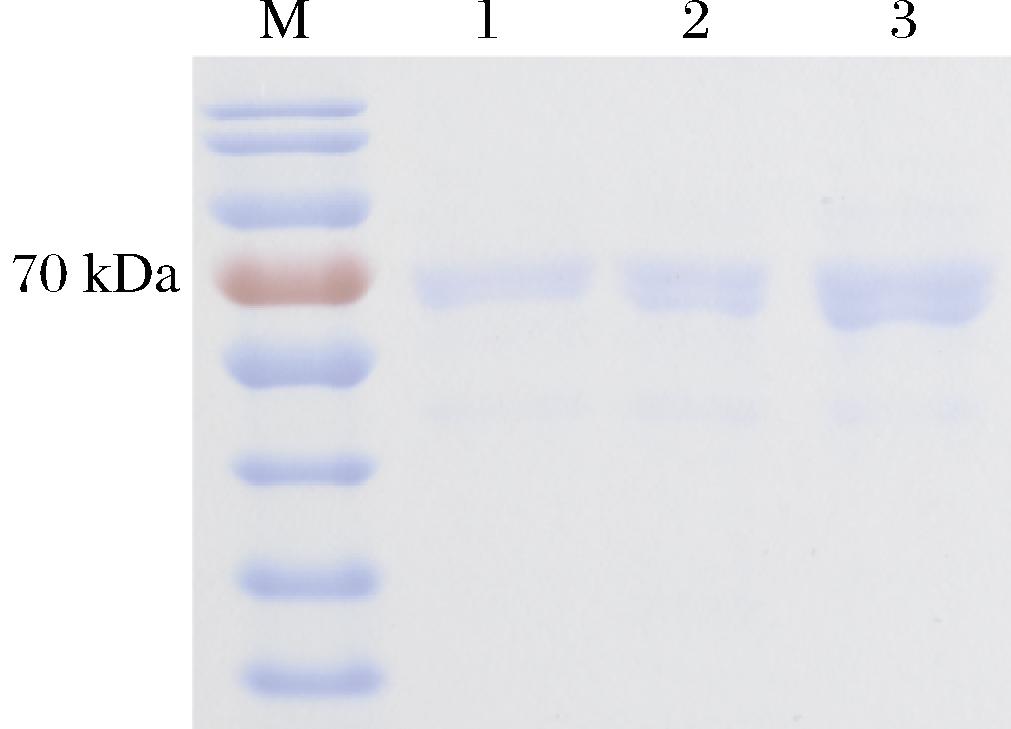
M-蛋白Marker;1-粗酶液;2-(NH4)2SO4沉淀;3-DEAE-纤维素离子交换层析。
图4 漆酶的SDS-PAGE图谱
Fig.4 SDS-PAGE pattern of laccase
2.5 漆酶酶学性质
2.5.1 米氏常数(Km)
Km是酶学性质的一个重要参数,反应了酶与底物的亲和力大小,以不同质量浓度的ABTS作为反应底物,在30 ℃,pH 3.0的条件下测定漆酶蛋白的反应速度,根据双倒数作图法得到其对底物ABTS催化反应的Km值为0.175 mol/L,Vmax值为2 500 U/L(图5)。
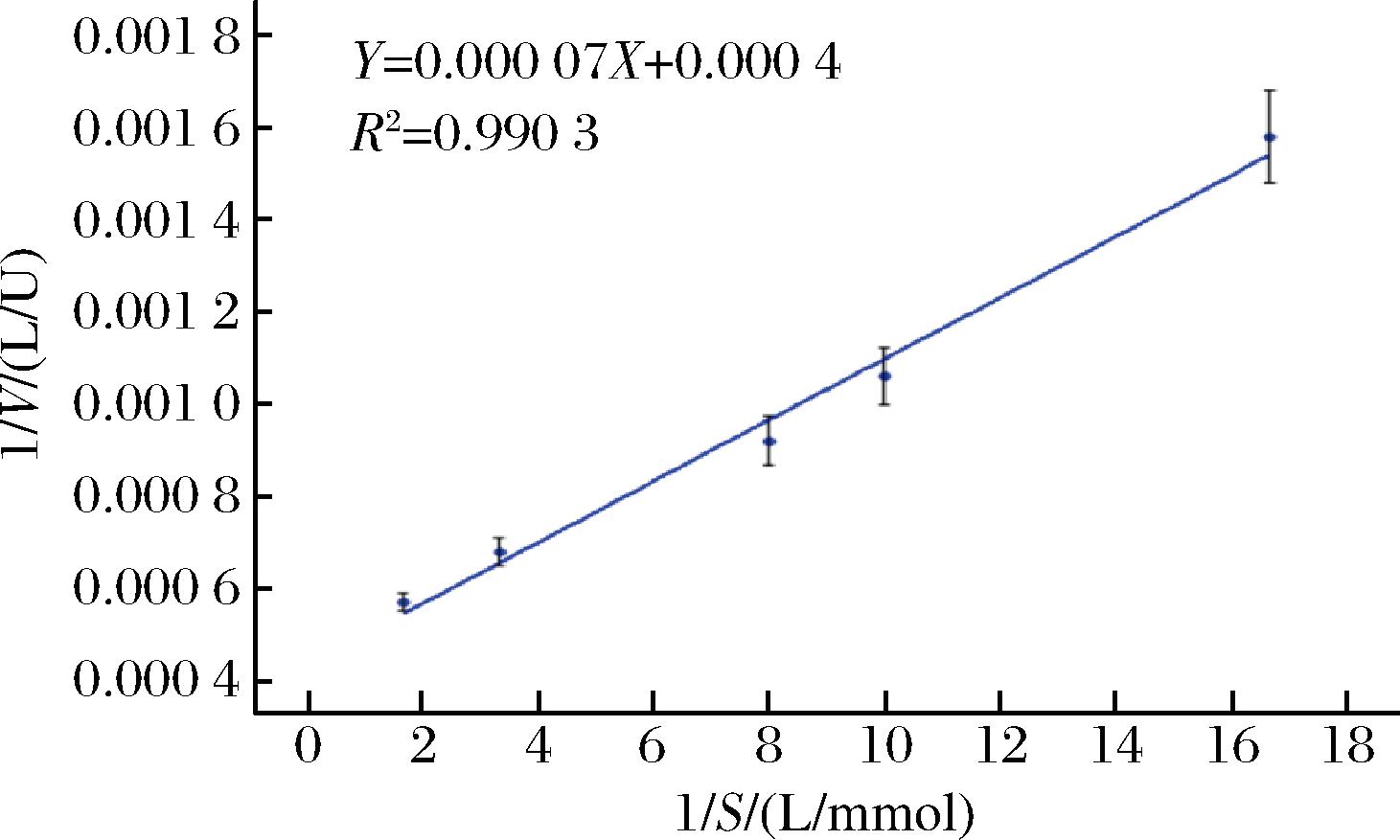
图5 酶促动力学方程
Fig.5 Enzymatic kinetic equation
2.5.2 温度、pH值对漆酶活力的影响
2.5.2.1 反应温度对漆酶活力的影响
测定了5种温度下漆酶的活性,由图6可知,在20~40 ℃的范围内,随温度升高,酶活力逐渐上升,在40 ℃条件下反应10 min时,该菌的漆酶酶活力为最高;50~60 ℃条件下反应10 min仍有较高的酶活力,但是比40 ℃条件下的酶活力低,超过60 ℃后,活力急速下降,因此Tasjk26的最适应反应温度在40 ℃附近,且有较好的耐热性,具有较强的环境适应能力。相似的,黄翠欣等[17]在研究纤维素酶时反应温度为50 ℃,同样具有耐热性。
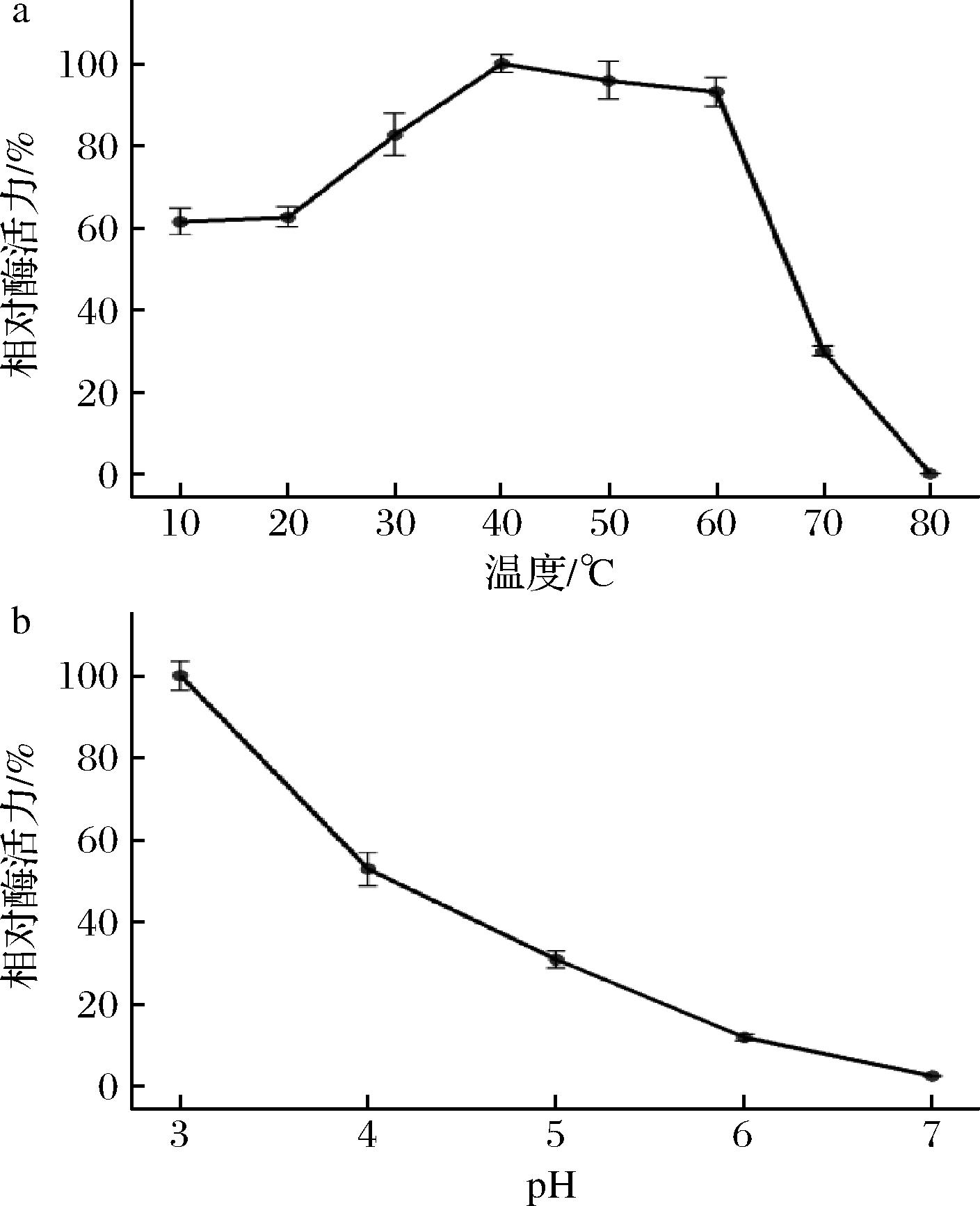
a-温度对酶活力影响;b-pH对酶活力影响
图6 温度、pH对漆酶活力影响
Fig.6 Effect of temperature and pH on laccase activity
2.5.2.2 pH值对漆酶活力的影响
由图6可知,在pH值4.0~7.0,随pH值的升高,酶活力下降明显,在pH 3.0时活性最高,说明Tasjk26产的漆酶最适pH偏酸性。可能过碱的反应条件影响了反应体系中的营养物质离子化程度[18],从而影响了其产酶能力,酶活力降低。
2.6 漆酶染料降解
漆酶对孔雀绿、结晶紫、刚果红等多种染料均有不同程度的降解效果(图7),特别是对于孔雀绿和结晶紫具有较高的降解效果,降解率均超过60%,其中孔雀绿的降解率最高,为69.1%,结晶紫的降解率达60.9%。对于刚果红、中性红和甲基橙也具有降解效果,降解率分别为54.6%、40.1%、22.2%。说明Tasjk26漆酶蛋白样品对上述染料均有降解能力,其对孔雀绿和结晶紫的降解效果最明显,在无介体存在的条件下,48 h对孔雀绿的降解率在60%以上,李丽等[19]利用栓菌4281漆酶对刚果红及结晶紫的降解率在不添加介体条件下分别为4.11%、23.2%,吴丽雅[20]利用漆酶LacMp1在添加介体丁香醛和乙酰丁香酮介体下12 h对铬黑T染料降解效率为60%左右,可见Tasjk26在不添加任何介质的情况下,具有较高的降解效率,说明Tasjk26在纺织染料降解方面具有较大的应用潜力。在实际染料废水的处理中,往往要考虑成本,介体添加量越大成本越高,因此少量的介体成本和高效的降解效率使得菌株具有工业化可行性,后期将继续探究不同外界因素对棘孢木霉Tasjk26染料的降解效率,使其更具有工业化应用的价值。

图7 漆酶对染料的降解
Fig.7 Degradation of dyes by laccase
3 结论
漆酶是由细胞产生的一种单体蛋白,分布于胞外或胞内,本研究从江西省南昌市土壤中分离纯化获得一株高产漆酶的棘孢木霉菌株Tasjk26,通过单因素试验优化其培养条件,该菌株漆酶活力达到2.56 U/mL。通过(NH4)2SO4沉淀、离子交换层析获得蛋白纯品,酶学性质分析表明该菌所产的漆酶分别在pH 3.0和温度40 ℃左右的条件下酶活力较高,具有较广泛的pH值范围,对于生存环境具有较强的适应性,且该酶对5种常见有机染料具有明显降解效果,该菌株为生物修复环境有机污染提供一定的应用价值,后续还将探究不同因素对于该酶对染料的降解效率。
[1] YANG J, LIN Y H, YANG X D, et al.Degradation of tetracycline by immobilized laccase and the proposed transformation pathway[J].Journal of Hazardous Materials, 2017, 322:525-531.
[2] 郭金英, 赵翠敏, 张云龙, 等.血红栓菌液体发酵产漆酶培养条件的研究[J].中国食用菌, 2019, 38(11):52-56.GUO J Y, ZHAO C M, ZHANG Y L, et al.Study on optimization of liquid fermentation cultivation conditions for laccase production by Trametes sanguinea[J].Edible Fungi of China, 2019, 38(11):52-56.
[3] MORENO A D, IBARRA D, EUGENIO M E, et al.Laccases as versatile enzymes:From industrial uses to novel applications[J].Journal of Chemical Technology &Biotechnology, 2020, 95(3):481-494.
[4] 闫莉, 刘海波, 唐德羲, 等.生物催化引发合成高分子化木质素[J].中国造纸学报, 2024, 39(2):35-43.YAN L, LIU H B, TANG D X, et al.Polymerization of lignin by biocatalytic initiation method[J].Transactions of China Pulp and Paper, 2024, 39(2):35-43.
[5] JANUSZ G, PAWLIK A,  WIDERSKA-BUREK U, et al.Laccase properties, physiological functions, and evolution[J].International Journal of Molecular Sciences, 2020, 21(3):966.
WIDERSKA-BUREK U, et al.Laccase properties, physiological functions, and evolution[J].International Journal of Molecular Sciences, 2020, 21(3):966.
[6] VASILIADOU I A, S NCHEZ-V
NCHEZ-V ZQUEZ R, MOLINA R, et al.Biological removal of pharmaceutical compounds using white-rot fungi with concomitant FAME production of the residual biomass[J].Journal of Environmental Management, 2016, 180:228-237.
ZQUEZ R, MOLINA R, et al.Biological removal of pharmaceutical compounds using white-rot fungi with concomitant FAME production of the residual biomass[J].Journal of Environmental Management, 2016, 180:228-237.
[7] 肖旭倩, 胡正龙, 邵广晴.细菌降解三苯甲烷类染料废水的研究进展[J].中国资源综合利用, 2019, 37(7):83-85.XIAO X Q, HU Z L, SHAO G Q.Research progress in degradation of triphenylmethane dye wastewater by bacteria[J].China Resources Comprehensive Utilization, 2019, 37(7):83-85.
[8] ZENG X K, CAI Y J, LIAO X R, et al.Decolorization of synthetic dyes by crude laccase from a newly isolated Trametes trogii strain cultivated on solid agro-industrial residue[J].Journal of Hazardous Materials, 2011, 187(1-3):517-525.
[9] 杨珍福, 陈惠, 郭相, 等.两株田头菇属野生菌株的鉴定及生物学特性[J].北方园艺, 2021(6):116-122.YANG Z F, CHEN H, GUO X, et al.Identification and biological characteristics of two strains from wild Agrocybe[J].Northern Horticulture, 2021(6):116-122.
[10] SHI Y W, NIU X X, YANG H M, et al.Optimization of the fermentation media and growth conditions of Bacillus velezensis BHZ-29 using a Plackett-Burman design experiment combined with response surface methodology[J].Frontiers in Microbiology, 2024, 15:1355369.
[11] 李润根, 于鑫, 孙琴琴, 等.龙牙百合褐斑病病原的鉴定、生物学特性及室内药剂筛选[J].核农学报, 2024, 38(8):1487-1495.LI R G, YU X, SUN Q Q, et al.Identification, characterization the leaf brown spot pathogen in Lilium brownii var.viridulum and screening fungicides against Alternaria arborescens[J].Journal of Nuclear Agricultural Sciences, 2024, 38(8):1487-1495.
[12] ABD EL-LATIF A S, ZOHRI A A, EL-AREF H M, et al.Kinetic studies on optimized extracellular laccase from Trichoderma harzianum PP389612 and its capabilities for azo dye removal[J].Microbial Cell Factories, 2024, 23(1):150.
[13] 彭微, 丁威, 吴宜, 等.基于酿酒废水发酵生产棘孢木霉工艺条件优化及应用研究[J].食品与发酵科技, 2023, 59(4):78-84;91.PENG W, DING W, WU Y, et al.Optimization of fermentation conditions for Trichoderma echinospora production from liquor-making wastewater and its application[J].Food and Fermentation Science &Technology, 2023, 59(4):78-84;91.
[14] 刘芹, 崔筱, 孔维威, 等.白灵侧耳菌渣中漆酶的分离纯化与酶学性质[J].食用菌学报, 2019, 26(4):90-99.LIU Q, CUI X, KONG W W, et al.Purification and characterization of a laccase from Pleurotus tuoliensis cultivation residue[J].Acta Edulis Fungi, 2019, 26(4):90-99.
[15] 田嘉慧, 封佳丽, 卢俊桦, 等.一色齿毛菌漆酶LacT-1的分离纯化与性质研究[J].生物技术通报, 2021, 37(8):186-194.TIAN J H, FENG J L, LU J H, et al.Isolation, purification and characterization of laccase LacT-1 from Cerrena unicolor[J].Biotechnology Bulletin, 2021, 37(8):186-194.
[16] 唐禄鑫, 王雅娴, 彭明意,等.真菌漆酶及其生产、固定化与应用[J].菌物学报, 2023, 42(9):1821-1837.TANG L X, WANG Y X, PENG M Y, et al. Fungal laccase and its production, immobilization, and application:A review[J].Mycosystema, 2023, 42(9):1821-1837.
[17] 黄翠欣, 张桂容, 刘军, 等.一株产纤维素酶菌株的分离纯化及其产酶性质研究[J].食品与发酵工业, 2023, 49(17):37-43.HUANG C X, ZHANG G R, LIU J, et al.Isolation and purification of a cellulose-producing strain and its enzyme-producing properties[J].Food and Fermentation Industries, 2023, 49(17):37-43.
[18] 张亚楠, 王亚勋, 宋立立.枯草芽孢杆菌发酵蟹壳粉产蛋白酶的研究[J].中国饲料, 2024(13):42-47.ZHANG Y N, WANG Y X, SONG L L.Study on protease production from crab shell meal fermented by Bacillus subtilis[J].China Feed, 2024(13):42-47.
[19] 李丽, 张学成, 肖亚中.栓菌4281漆酶催化几种不同结构染料脱色[J].生物学杂志, 2023, 40(2):33-37.LI L, ZHANG X C, XIAO Y Z.Decolorization of several different dyes by Trametes sp.4281 laccase[J].Journal of Biology, 2023, 40(2):33-37.
[20] 吴丽雅. 深海海单胞菌来源漆酶LacMp1在大肠杆菌中的高效表达及其在染料脱色中的应用[D].合肥:合肥学院, 2023.WU L Y.Expression of Marinomonas profundimaris sp-derived laccase LacMp1 in Escherichia coli and its application in dye decolorization[D].Hefei:Hefei university, 2023.