红曲菌(Monascus spp.)是一种嗜酸小型丝状腐生真菌,可产生多种次级代谢产物,研究较多的有红曲色素(Monascus pigments,MPs)和莫纳可林K(monacolin K,MK)。MPs是安全性极高的天然色素,通常被用作食品着色剂、防腐剂,具有抗氧化、抑菌、抗癌等多种生物活性[1]。MK是一类聚酮化合物,为白色针状结晶,通过竞争性抑制胆固醇合成限速酶3-羟基-3甲基戊二酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase, HMGR)的活性能抑制胆固醇合成,能够改善高血压和高胆固醇血症患者的血脂和血糖水平[2],还具有抗炎和抑癌等功效[3]。此外,MK可以通过祛除血瘀和添加胰岛素对抗高水平血糖,还能作为免疫增强剂、肝脏保护剂、健脾药,促进消化、抗心血管疾病[4]。红曲菌在一些东方国家常被用来生产红曲米、红曲醋和红曲豆腐等发酵产品[5]。红曲菌发酵产品具有独特的风味和营养价值,还具有抗氧化[6]、降压和降脂[5]等生物活性,因而备受关注。
大豆分离蛋白(soybean protein isolate,SPI)是一种优质的植物蛋白,不仅含有维持生命活动所需的金属元素,还含有丰富的氨基酸,是在低温环境下将脱脂豆粕经过碱提取、酸沉淀和膜分离等技术得到的高蛋白含量(90%以上)的蛋白粉[7]。大豆或SPI富含蛋白质,可作为优质氮源用于红曲发酵,并且其发酵产品也具有抗氧化、抗菌和抗癌等功效[8-10]。研究表明,红曲发酵大豆的提取物具有较强的抗氧化性及DPPH清除率[8]、红曲发酵黑豆提取物可抑制脂质积累[9-10]及血管紧张素转换酶抑制活性[11]。红曲发酵产品的相关功效与MPs和MK的生物活性关系密切。因此,提高红曲发酵产品中MPs和MK的含量可提升发酵产品的附加值。
大豆及其副产品因其蛋白质含量高被广泛用于红曲发酵。将Monascus spp.接种于大豆可提高或富集大豆红曲中MK及大豆异黄酮糖苷含量[12]。有研究表明,豆粕可促使红色红曲菌在固态培养基中产MK,其最适作用体积分数为3%[13]。本课题组前期研究表明大豆粉能显著提高MK的产量[14],大豆粉中促进红曲菌产MK的核心物质为SPI[15]。
1 材料与方法
1.1 材料
1.1.1 实验材料
丛毛红曲菌(Monascus pilosus)MS-1(CCTCC M 2013295,中国典型培养物保藏中心),由市售红曲米中分离获得;土豆,市售;大豆分离蛋白,上海源叶生物科技有限公司。
1.1.2 仪器与设备
GI54DS高压蒸汽灭菌锅,致微仪器有限公司;UV1900紫外分光光度计,日本岛津公司;PF-16台式高速离心机,长沙平凡仪器仪表有限公司;HZQ-F16振荡培养箱,哈尔滨市东联电子技术开发有限公司;BCM-1300A生物洁净工作台,苏净集团安泰公司;Agilent 1260高效液相色谱仪,安捷伦科技有限公司;pH计,上海精密科学仪器有限公司;TM3030扫描电子显微镜,HITACHI。
1.1.3 试剂及溶液
MK标准品(纯度≥98%),阿拉丁公司;琼脂(生物制剂),北京奥博星生物技术有限责任公司;MgSO4·7H2O、K2HPO4、FeSO4、KCl、蔗糖,均为分析纯,国药集团化学试剂有限公司;谷氨酸钠(分析纯),北京酷来博科技有限公司;葡萄糖(分析纯),天津科密欧化学试剂有限公司。
1.1.4 培养基
PDA培养基[15]:称取削皮的土豆200 g,切成1 cm×1 cm×1 cm的小方块后加入1 000 mL蒸馏水煮沸约20 min。纱布过滤,蒸馏水定容至1 000 mL。加入20 g葡萄糖和20 g琼脂粉,边加热边搅拌至完全溶解,趁热以100 mL/瓶分装于250 mL茄形瓶。pH自然,121 ℃灭菌20 min。
合成培养基(g/L)[16]:谷氨酸钠10、MgSO4·7H2O 0.17、K2HPO4 1、KCl 0.5、FeSO4 0.05、蔗糖60。pH 5.5,121 ℃灭菌20 min。
固体培养基:PDA培养基加2%(体积分数)琼脂,pH自然,合成培养基分别设不添加SPI、1% SPI、3% SPI,各加2%琼脂,pH 5.5,用于红曲菌菌落和菌丝形态观察。
1.2 实验方法
1.2.1 红曲菌液态发酵
红曲菌液态发酵:将孢子悬液以10%(体积分数)的接种量接入合成培养基中,在30 ℃、120 r/min培养2 d后转换温度为25 ℃培养至14 d[15]。
1.2.2 红曲菌发酵液pH和生物量的检测
红曲菌液态发酵结束后过滤得滤液,测定发酵液体积,用pH计检测发酵液pH。过滤后的菌丝用无菌水冲洗至水洗液为无色后置于55 ℃烘箱中烘至恒重,生物量用单位体积培养基菌丝干重表示[15]。
1.2.3 红曲菌发酵产物中MK的检测
红曲菌发酵结束后过滤菌丝,发酵液以8 000 r/min离心10 min,取上清液测定吸光度值(OD值)并计算色价。上清液过0.22 μm滤膜,进行HPLC分析MK。色谱柱为InertsilODS-3(250 mm×4.6 mm,5 μm),流动相:V(乙腈)∶V(水)∶V[0.5%(体积分数)磷酸]=60∶37∶3,流速为1 mL/min,柱温25 ℃,进样量为 20 μL,检测波长238 nm。菌丝置55 ℃烘箱中烘至恒重,称取0.3 g菌丝于50 mL离心管,加入10 mL 75%(体积分数)乙醇溶液,充分振荡混匀并超声波提取1 h后8 000 r/min离心10 min,上清液过0.22 μm滤膜后进行HPLC分析(色谱条件同1.2.3节)[15, 17],MK计算如公式(1)~公式(3)所示:
发酵液![]()
(1)
菌丝体![]()
(2)
总![]()
(3)
1.2.4 SPI影响红曲菌液态发酵产MK添加量的优化
为探究SPI在合成培养基中影响红曲菌产MK的最适添加量,在合成培养基中以0、1%、3%、5%、7%、9%(体积分数,下同)梯度的SPI处理,接种量及培养基条件同1.2.1节,发酵结束后测定发酵液体积、pH、生物量,发酵液和菌丝体处理以及MK的检测同1.2.3节。
1.2.5 1% SPI影响红曲菌产MK初始pH的优化
为探究1% SPI在合成培养基中影响红曲菌产MK的最适初始pH,调整合成培养基起始pH值为2.0、3.0、4.0、5.0、6.0、7.0,红曲菌接种量及培养基条件同1.2.1节,发酵结束后测定红曲菌发酵液体积、pH、生物量,发酵液和菌丝体处理以及MK的检测同1.2.3节。
1.2.6 3% SPI影响红曲菌产MK初始pH的优化
为探究3% SPI添加量在合成培养基中影响红曲菌MK的最适初始pH,调整合成培养基起始pH值为2.0、3.0、4.0、5.0、6.0,接种量及培养基条件同1.2.1节,发酵结束后测红曲菌发酵液体积、pH、生物量,发酵液和菌丝体处理以及MK的检测同1.2.3节。
1.2.7 红曲菌菌落形态观察
活化后的红曲菌用接种针挑取少量菌丝点种于PDA和固态合成培养基中央,置于30 ℃生化培养箱中培养,观察第3、6、9、12、15天生长情况、菌落形态以及正反两面颜色变化。
1.2.8 红曲菌显微形态观察
将红曲菌孢子悬浮液在不同的固体培养基中划线,将灭菌的盖玻片以45°斜插入培养皿中,置于30 ℃生化培养箱中培养,盖玻片置于显微镜下观察第3、6、9、12、15天红曲菌菌丝、分生孢子和闭囊壳的显微形态[18]。
1.2.9 红曲菌菌丝形态观察
分离发酵液和菌丝体。将菌丝体置于2.5%(体积分数)戊二醛溶液中常温避光固定12 h,菌丝体用PBS(0.1 mol/L,pH 7.2)漂洗2次,4 ℃、12 000 r/min离心5 min后除去上清液。将菌丝体分别经30%、50%、70%、80%、90%和100%(体积分数)的分级乙醇脱水后孵育10 min,用V(乙酸异戊酯)∶V(乙醇溶液)=1∶1除去乙醇,孵育10 min。再将菌丝体重新悬浮于六甲基二硅氮烷(hexamethyldisilazane,HMDS)中,并置于60 ℃下干燥至粉末化。最后菌丝体用金-钯包被2 min,用扫描电子显微镜进行观察[19]。
2 结果与分析
2.1 SPI添加量对红曲菌发酵液pH、生物量及产MK的影响
2.1.1 SPI添加量对红曲菌发酵液pH及生物量的影响
在合成培养基中,以SPI为外加氮源,调整其体积分数分别为0、0.5%、1%、3%、5%、7%和9%,考察SPI添加量对丛毛红曲菌MS-1发酵液pH及生物量的影响,结果如图1所示。
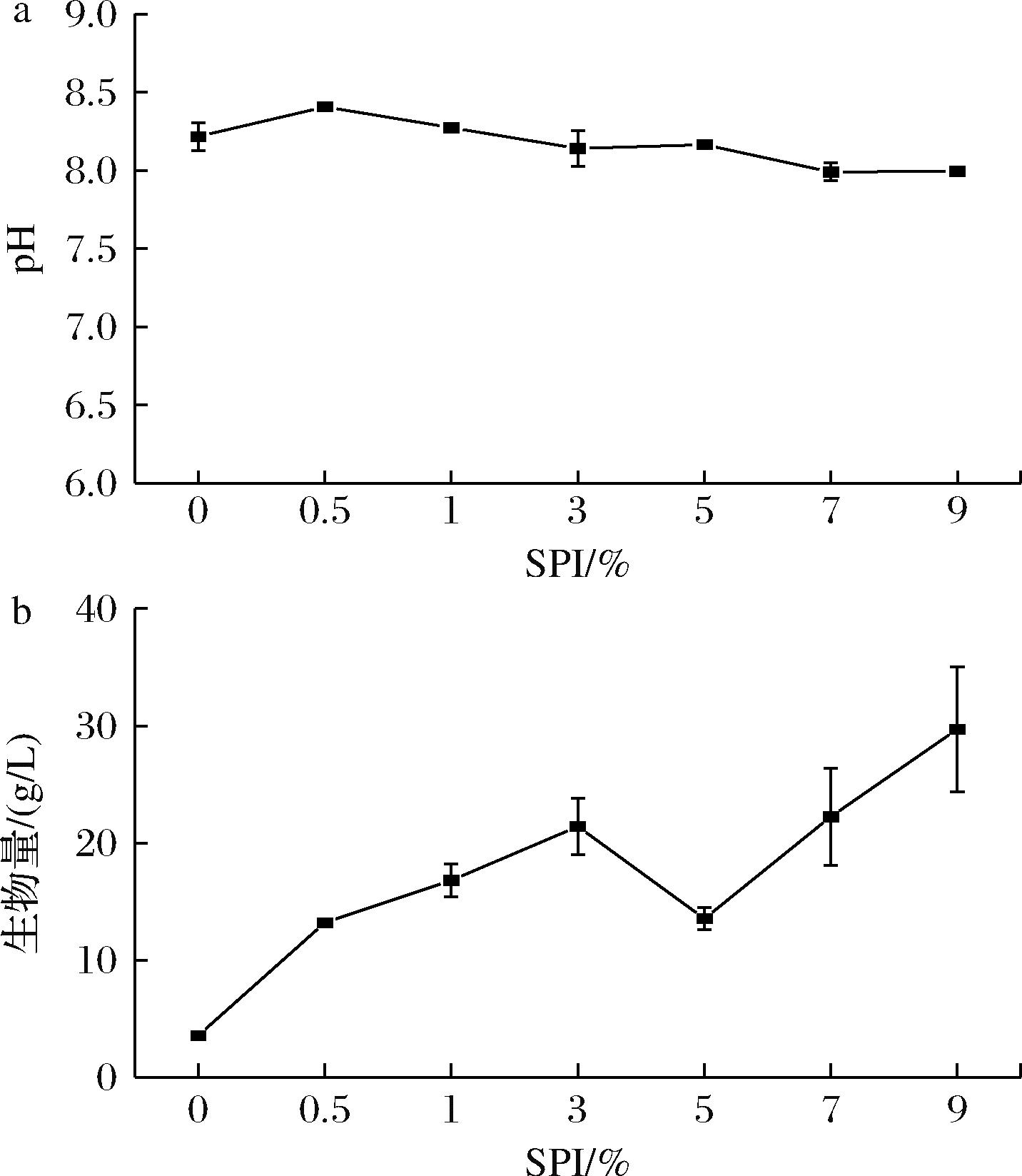
a-发酵液pH;b-生物量
图1 SPI添加量对发酵液pH及生物量的影响
Fig.1 Effects of SPI addition on the pH of fermentation broth and biomass
由图1-a可知,随着SPI添加量的增加红曲菌发酵液pH值为8.0~8.5。发酵液的pH受蛋白水解碱性氨基酸释放以及发酵后期MPs积累和孢子消解影响。由图1-b可知,红曲菌生物量随着SPI的添加量增加呈折线上升趋势,当SPI添加量为9.0%时生物量最高,为29.71 g/L,增加了7.30倍。SPI能显著促进红曲菌生物量的积累(P<0.05),表明SPI作为氮源可促进红曲菌生长,这与已有研究中提出较为复杂的有机氮源被缓慢利用可调节生长代谢相符,表现为代谢产物的分泌期延长及防止菌丝体自溶且更利于孢子的形成[20]。
2.1.2 SPI添加量对红曲菌产MK的影响
在合成培养基中以SPI为外加氮源,分别调整其体积分数为0.5%、1%、3%、5%、7%和9%,考察SPI添加量对红曲菌产MK的影响,结果如图2所示。
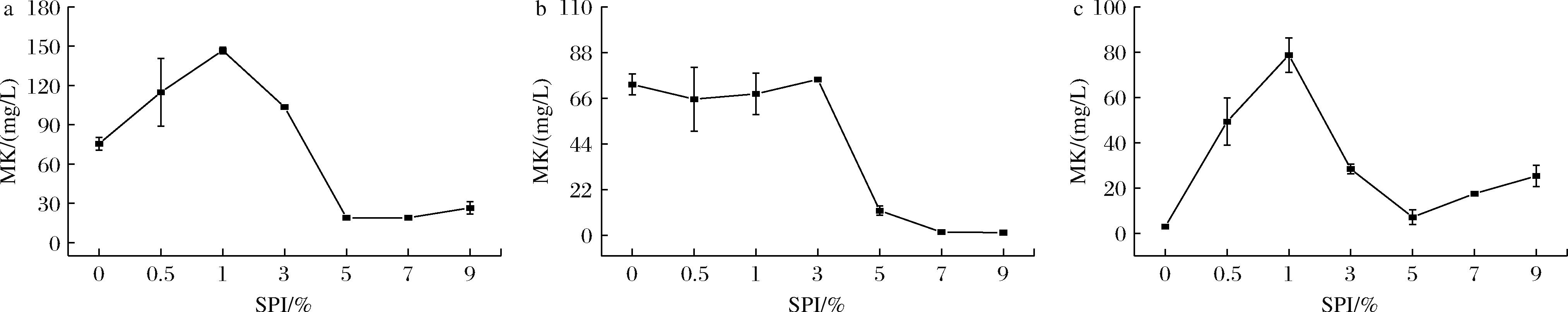
a-总MK;b-胞外MK;c-胞内MK
图2 SPI添加量对红曲菌MS-1产MK的影响
Fig.2 Effects of SPI addition on MK production by Monascus MS-1
由图2可知,随着SPI添加量的增加,MK产量先增加后减少。如图2-a所示,当SPI添加量为1%时总MK产量最高(146.72 mg/L),增加了94%,此时胞内MK高于胞外。SPI添加量为0~3%时可显著促进总MK产生(P<0.05),当SPI添加量大于3%时则显著抑制总MK的产生(P<0.05),可能是SPI中含较高的氮含量可以促进红曲菌生长并迅速进入稳定期合成代谢产物,而过多的氮含量导致碳氮比例失调从而抑制MK的合成,在氮源限制的情况下红曲菌将更多的碳转移到MK的合成中促进MK的合成[21],而氮源含量太高会导致更多的碳源用于菌丝体生长而降低MK的合成。综上,SPI添加量为1%时得到最高的MK含量。
前期研究发现,培养基起始pH对红曲菌发酵影响较大,拟通过调控发酵液初始pH探究其对添加SPI的红曲菌发酵过程的影响,在红曲菌发酵过程中监测pH、生物量及MK产量。
2.2 1% SPI条件下培养基初始pH对红曲菌发酵液pH、生物量和产MK的影响
2.2.1 1% SPI条件下培养基初始pH对红曲菌发酵终点pH及生物量的影响
红曲菌在偏酸性条件下生长更好,在合成培养基中,以1% SPI为外加氮源,调整培养基初始pH值为2.0、3.0、4.0、5.0、6.0、7.0,考察初始pH对红曲菌发酵终点pH及生物量的影响,结果如图3所示。
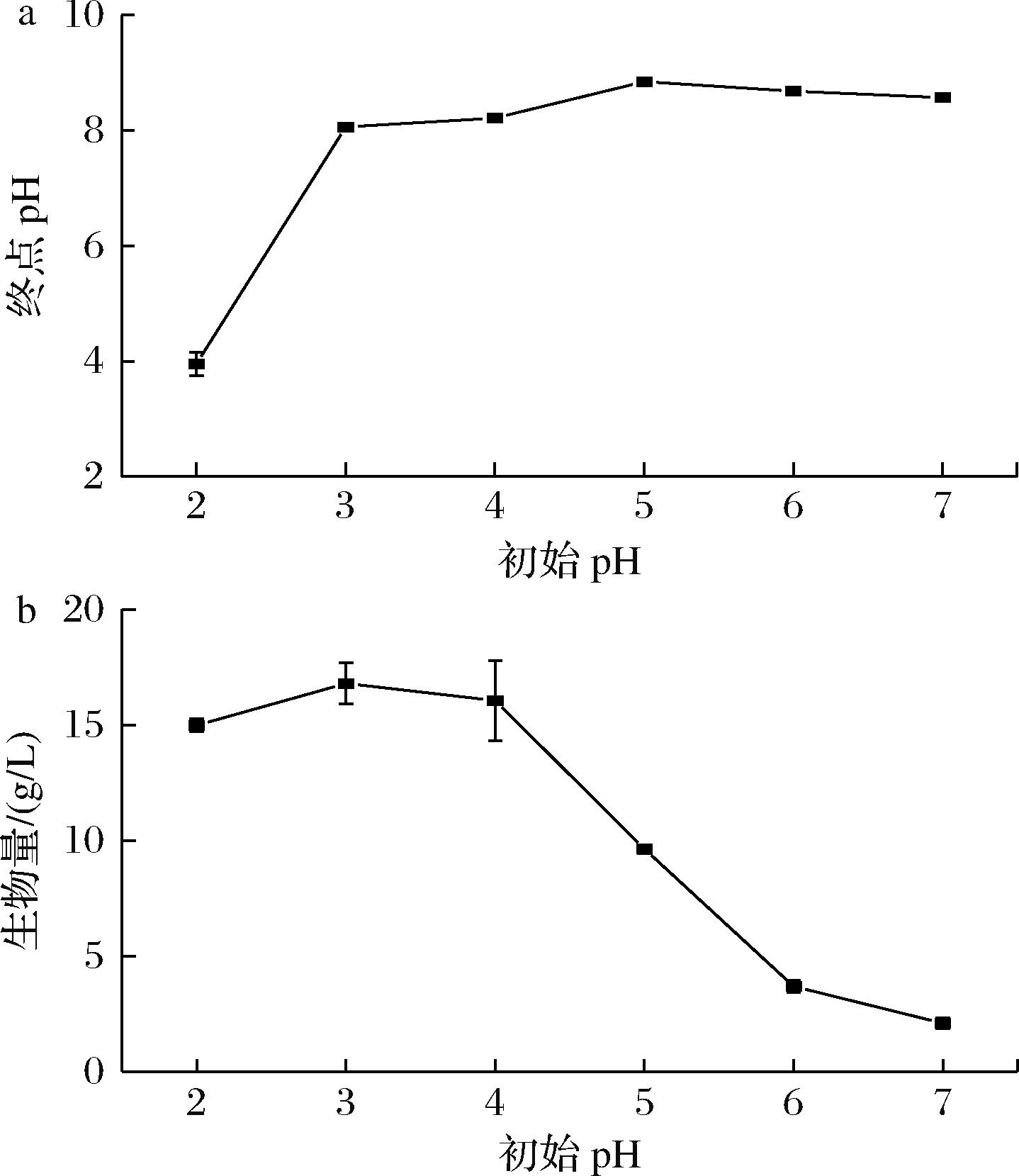
a-发酵终点pH;b-生物量
图3 初始pH对发酵终点pH及生物量的影响
Fig.3 Effect of initial pH on termination pH of fermentation broth and biomass
如图3-a所示,除初始pH值为2.0的处理外,初始pH值在3.0~7.0时发酵终点pH值维持在8.0~9.0。红曲菌生物量随着初始pH值增加呈先增加后降低的趋势,在初始pH值为3.0时生物量达到最大为16.80 g/L。胞外pH调节真菌营养物质的吸收、基因的表达、蛋白质合成、运输、分泌和次级代谢,与真菌的生长和代谢关系密切[22]。如图3-b所示酸性条件下获得的生物量高于接近中性的初始pH条件下,与已有的研究结果相符[23]。此外,与中性及碱性条件相比,酸性条件下孢子萌发速度和萌发率较高[24]。pH可扰乱细胞壁结构,改变质膜的蛋白质构象从而影响质膜功能[4],因此pH与红曲菌的生长关系密切。
2.2.2 1% SPI条件下培养基初始pH对红曲菌产MK的影响
在合成培养基中添加1%SPI,调整培养基初始pH值为2.0、3.0、4.0、5.0、6.0、7.0,分析初始pH对红曲菌生成MK的影响,结果如图4所示。
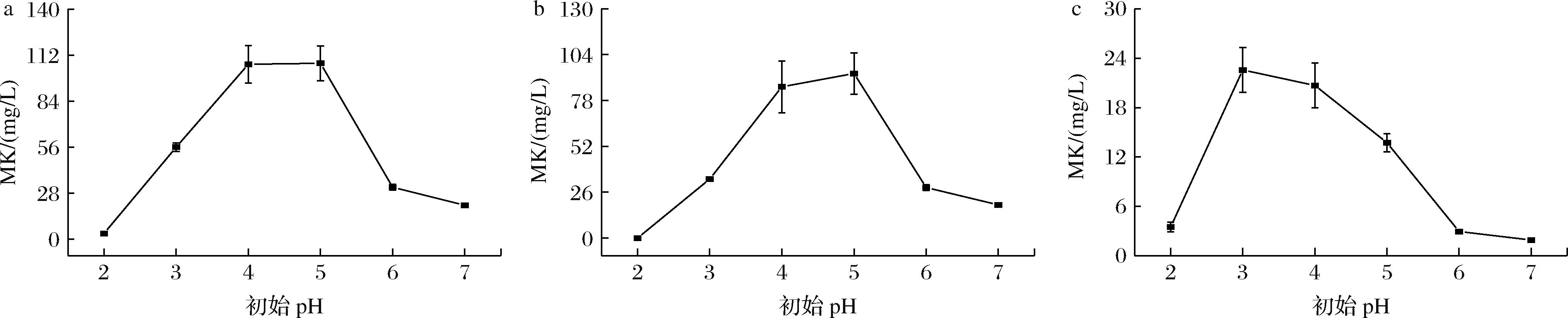
a-总MK;b-胞外MK;c-胞内MK
图4 初始pH对红曲菌产MK的影响
Fig.4 Effect of initial pH on MK production by Monascus spp.
如图4所示,随着初始pH增高,MK含量先增加后减少。图4-a显示,初始pH值为4.0和5.0时总MK产量最高分别为106.48 mg/L和107.04 mg/L,两者差异不显著(P> 0.05),此时胞外MK占主导地位,表明弱酸条件下更适合MK的产生,该结果与已有研究相符[3]。红曲菌菌丝体在酸性pH条件下比在近中性pH条件下生长更好,较高的生物量与较高的MK产量相一致。初始pH接近中性MK产量降低原因之一是生物量降低。初始pH过高或过低都会抑制MK的产生,其原因可能是关键酶的产生受到影响。低pH条件下MK产量低还可能受初级代谢产物的影响[25]。培养基酸碱性不仅影响酶活力,还影响菌丝体的生长、细胞结构状态和细胞膜的电荷状况,以及菌体利用基质的速率,从而影响代谢产物的产生及其稳定性[4, 22, 26]。pH值导致的细胞膜通透性和菌体形态的变化也会影响菌体对代谢产物的分泌以及养分的吸收程度[27]。如图4-b~图4-c所示,随着发酵液初始pH的增加,MK主要在胞外积累,说明SPI添加量为1%时促进MK向胞外分泌。
综上,SPI添加量为1%时,初始pH值为3.0时获得最大生物量,初始pH值为4.0和5.0时MK含量最高(P<0.05)。
为验证初始pH对添加SPI的红曲菌发酵有显著影响,进行了3%添加量的SPI在红曲菌MS-1合成培养基中初始pH的优化,在优化的过程中同样监测终止pH、生物量及MK的产量。
2.3 3% SPI条件下培养基初始pH对红曲菌发酵液pH、生物量和生成MK的影响
2.3.1 3% SPI条件下培养基初始pH对红曲菌发酵终点pH及生物量的影响
在合成培养基中添加3% SPI,调整培养基初始pH值分别为2.0、3.0、4.0、5.0和6.0,考察初始pH对发酵终点pH及生物量的影响,结果如图5所示。
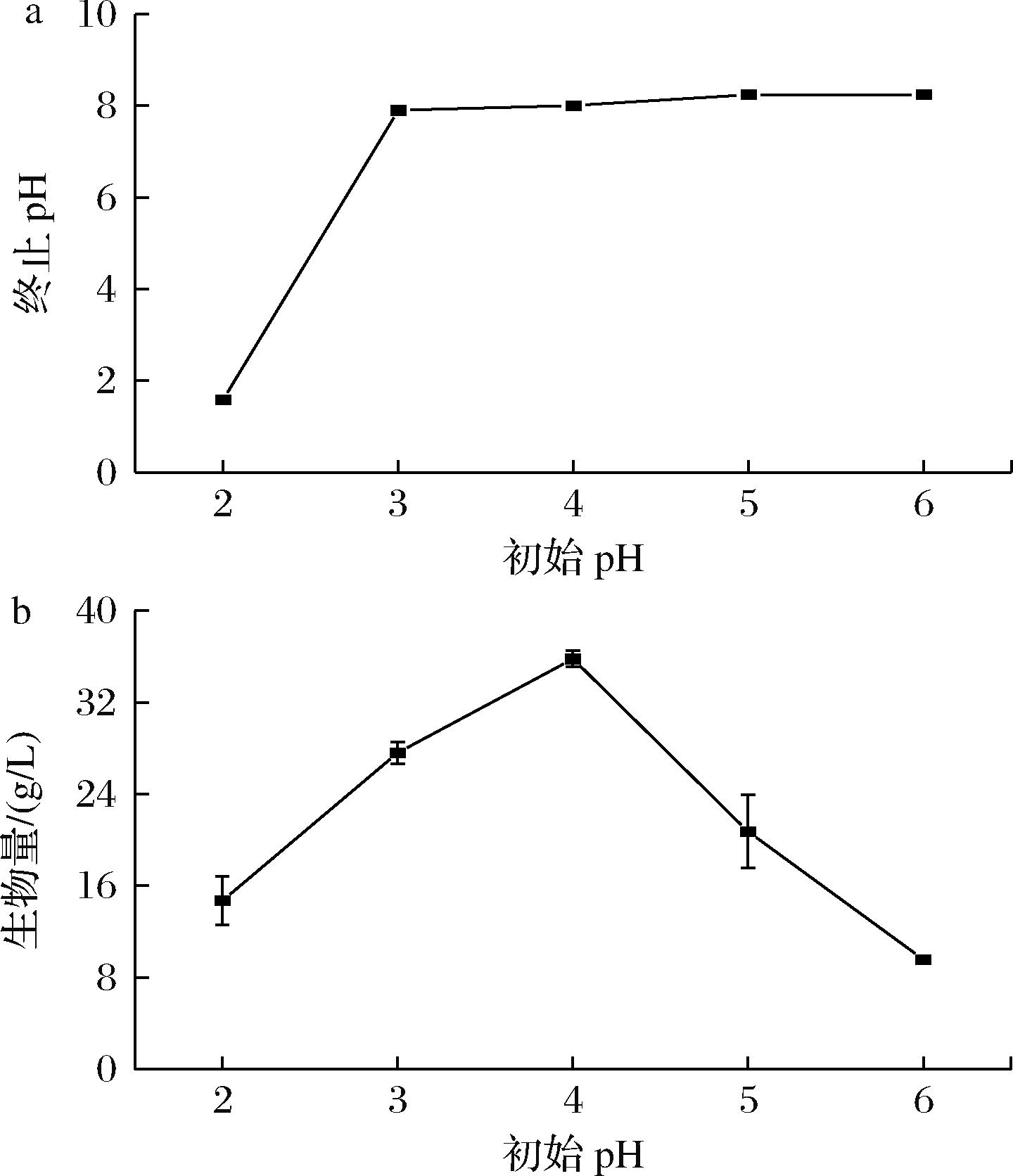
a-发酵液终止pH;b-生物量
图5 初始pH对红曲菌发酵终点pH及生物量的影响
Fig.5 Effect of initial pH on termination pH of fermentation and biomass of Monascus spp.
如图5-a所示,SPI添加量为3%时,除初始pH值为2.0的处理外,发酵终点pH值维持在8.0~9.0。由图5-b可知,随着初始pH的增加,红曲菌MS-1生物量呈先增加后减少的趋势,在初始pH值为4.0时获得最大的生物量35.80 g/L,表明酸性条件下更利于红曲菌生长,与已有的研究结果一致[23]。
2.3.2 3% SPI条件下培养基初始pH对红曲菌产MK的影响
在合成培养基中添加3% SPI,调整培养基初始pH值分别为2.0、3.0、4.0、5.0、6.0,观察初始pH对红曲菌生成MK的影响,实验结果如图6所示。
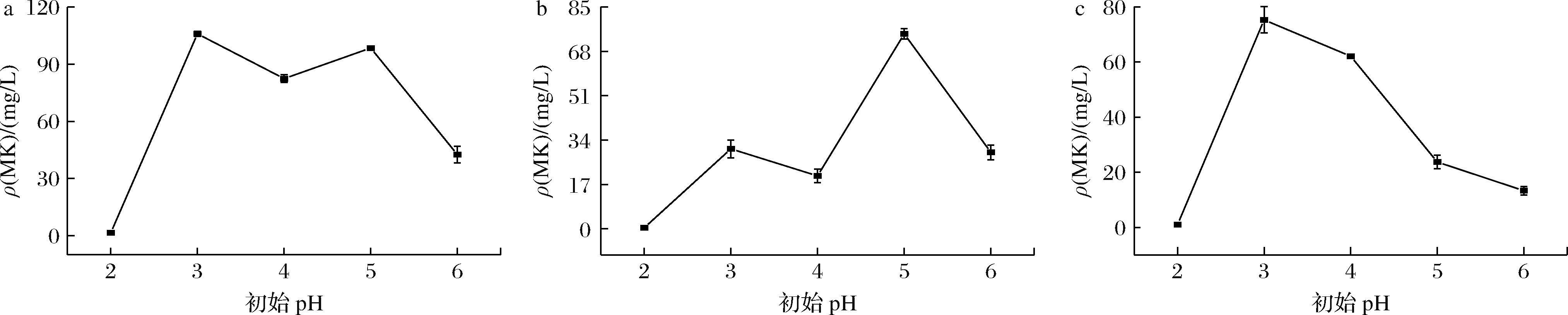
a-总MK;b-胞外MK;c-胞内MK
图6 初始pH对红曲菌产MK的影响
Fig.6 Effect of initial pH on MK production by Monascus spp.
如图6所示,随着初始pH增加,MK含量呈先增加后减少的趋势。如图6-a所示,初始pH值为3.0时获得最高的总MK含量为105.93 mg/L,此时胞内MK占主导地位。当初始pH值为2.0时总MK含量少,初始pH值为5.0时胞外MK含量最高为74.68 mg/L。初始pH值为3.0时,胞内MK含量最高,为75.30 mg/L。由此,SPI添加量为3%时,初始pH值为3.0更适合红曲菌产MK,低初始pH值(2.0)不利于产MK。
初始pH近中性时MK产量减少可能与生物量减少关系密切。如图6-b~图6-c所示,胞内外MK含量随初始pH改变而变化,初始pH值为3.0~4.0时胞内MK占主导,而初始pH 5.0~6.0时胞外MK占主导,表明SPI添加量为3%时初始pH影响胞内外MK的分布。此时最适初始pH比SPI添加量为1%时低,可能是因为SPI溶解灭菌之后其中的碱性物质释放导致培养基pH上升,故应控制较低的培养基初始pH。
综上,SPI添加量为3%时,初始pH值为4.0时获得最大的生物量,初始pH值为3.0时获得最高的总MK含量。
2.4 红曲菌菌落形态观察
将红曲菌接种于4种不同固体培养基中,置于30 ℃培养,观察第3、6、9、12、15天菌落形态和大小以及正反两面颜色变化。结果如图7所示。

图7 SPI对红曲菌菌落形态的影响
Fig.7 Effect of SPI on Monascus spp. colony morphology
由图7可知,PDA培养基中MS-1菌落边缘不规则呈锯齿状,菌丝较长且蓬松,中部隆起,菌落正反面呈橙红色,这与已有的研究相符[18]。合成培养基菌落边缘规则,菌丝中间致密边缘蓬松,正反面菌落呈浅红色。添加1% SPI的合成培养基中,红曲菌菌落边缘规则,菌丝中部致密边缘蓬松,前期菌丝呈红色后期变为白色。当SPI添加量为3%时,菌丝随发酵时间延长而变长,菌落变大且颜色逐渐加深。综上,红曲菌菌落颜色随SPI添加量的增加而加深。由此,SPI能够促进菌丝生长、菌落长大。
由表1可知,在PDA培养基中发酵前9 d菌落增长速度快,发酵后期增长速度减缓,可能是前期营养物质丰富而后期营养消耗后菌丝老化所致。合成培养基菌落直径比PDA小可能归因于营养物质限制。添加SPI后菌落直径明显增加,在发酵前期1% SPI菌丝体生长较3% SPI慢,但培养结束后1% SPI条件下菌落直径较大。说明1% SPI更利于菌丝体生长,SPI添加量继续增加对红曲菌生长的促进作用减弱,过多的氮源可能改变了培养基的碳氮比[28]。
表1 大豆分离蛋白对红曲菌菌落直径的影响
Table 1 Effect of SPI on colony diameter of Monascusspp.
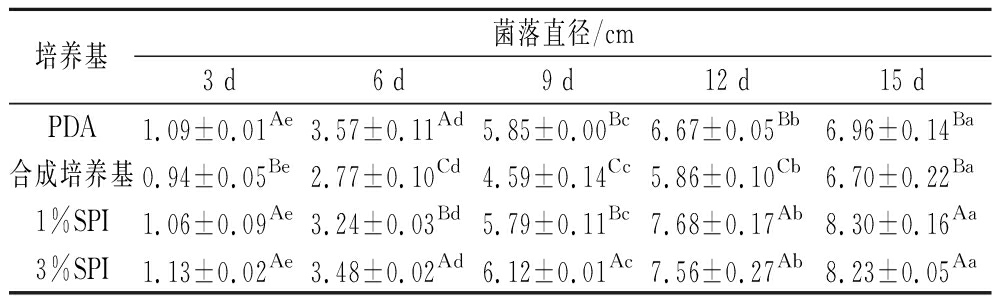
培养基菌落直径/cm3 d6 d9 d12 d15 dPDA1.09±0.01Ae3.57±0.11Ad5.85±0.00Bc6.67±0.05Bb6.96±0.14Ba合成培养基0.94±0.05Be2.77±0.10Cd4.59±0.14Cc5.86±0.10Cb6.70±0.22Ba1%SPI1.06±0.09Ae3.24±0.03Bd5.79±0.11Bc7.68±0.17Ab8.30±0.16Aa3%SPI1.13±0.02Ae3.48±0.02Ad6.12±0.01Ac7.56±0.27Ab8.23±0.05Aa
注:大写字母不同表示培养基间存在显著差异,小写字母不同表示培养时间之间存在显著差异(P<0.05)。
2.5 红曲菌显微形态观察
将红曲菌接种至不同的固体培养基中观察第3、6、9、12、15天红曲菌菌丝、分生孢子和闭囊壳的显微形态。如图8所示,在PDA培养基中菌丝较为粗壮,分生孢子顶生于菌丝上,单生偶有短链状,呈倒卵形至球状,这与已有的研究相符[18]。合成培养基中菌丝较细,分支较多,分生孢子顶生于菌丝上,单生偶有短链状,呈倒卵形至球状。随着发酵时间的延长,在不同培养基中菌丝分支和分生孢子数量都在增加。与对照相比,添加SPI后菌丝分枝和分生孢子数量增加。菌丝分枝和分生孢子数量随着SPI添加量的增加而增加。添加SPI致使闭囊壳出现的时间提前,从对照的第15天提前到1% SPI 6 d,3% SPI则是3 d。

图8 SPI对红曲菌菌丝形态、分生孢子和闭囊壳的影响(×400)
Fig.8 Effect of SPI on the hyphae morphology, conidia and cleistothecia of Monascus spp.(×400)
2.6 菌丝扫描电镜观察
将红曲菌接种至不同的固体培养基中扫描电镜观察第3、6、9、12、15天红曲菌菌丝和分生孢子的形态,结果如图9所示。合成培养基中红曲菌菌丝体完整且有一定程度的收缩和褶皱,在发酵过程中变化不明显。菌丝分枝顶端有单个或多个分生孢子,发酵前期分生孢子较为圆滑,发酵后期分生孢子褶皱和凹陷程度增加。与对照相比,添加SPI后发酵前期菌丝体较为饱满但表面不光滑表现出更多的肿胀、褶皱,在发酵后期菌丝体变为干瘪、弯曲折叠和断裂,分生孢子凹陷程度更加明显,颗粒度增加。由此推测,添加SPI增加了细胞膜的通透性,促进细胞内物质向胞外分泌。该研究结果与ZHANG等[19]添加谷氨酸和精氨酸[29]的研究结果相符,推测SPI分解之后产生的某些特定氨基酸在发挥作用。

图9 SPI对红曲菌形态的影响
Fig.9 Effect of SPI on the morphology Monascus spp.
3 结论与讨论
文章主要通过在合成培养基中优化SPI添加量,研究了SPI对红曲菌生长及产MK的影响。结果表明,SPI添加量为1%且初始pH值为3.0时生物量达到最大,为16.80 g/L;适合红曲菌MS-1产MK的初始pH值为4.0。SPI添加量为3%且初始pH值为4.0时生物量最大,为35.80 g/L;适合红曲菌MS-1产MK的初始pH值为3.0。由此可以得出SPI能促进红曲菌生物量的积累和MK的产生。并且通过对红曲菌菌丝形态的观察,发现SPI能促进菌丝生长、菌落直径增加和分生孢子的产生,使闭囊壳出现的时间提前。由此可以推测SPI促进细胞膜的通透性,促进细胞内物质向胞外分泌。本研究探究了SPI添加量对红曲菌MS-1产MK的影响,证实其对该种属红曲菌生长及MK的产生有显著影响,但在该实验中红曲菌种属较少,后续可将SPI应用到更多的红曲菌种属中探究其对红曲菌生长及产MK的影响。SPI用于红曲发酵能有效增强发酵产品生物活性使其营养价值最大化,有望用于功能性红曲、红曲色素的生产。该研究结果可为利用大豆分离蛋白生产高MK含量的功能性红曲产品提供理论和技术支持,尤其是可考虑采用大豆分离蛋白替代大豆粉应用于功能性红曲的生产中,以此减少因直接使用豆粉造成的红曲产品中脂类的氧化变质等问题。
[1] ZHOU W B, GUO R, GUO W L, et al.Monascus yellow, red and orange pigments from red yeast rice ameliorate lipid metabolic disorders and gut microbiota dysbiosis in Wistar rats fed on a high-fat diet[J].Food &Function, 2019, 10(2):1073-1084.
[2] MAZZA A, SCHIAVON L, RIGATELLI G, et al.The short-term supplementation of monacolin K improves the lipid and metabolic patterns of hypertensive and hypercholesterolemic subjects at low cardiovascular risk[J].Food &Function, 2018, 9(7):3845-3852.
[3] LIU X H, SUN A N, LI Q, et al.A systematic study of the production of Monacolin K by solid state fermentation of Monascus ruber[J].AMB Express, 2022, 12(1):29.
[4] AGBOYIBOR C, KONG W B, ZHANG A M, et al.Nutrition regulation for the production of Monascus red and yellow pigment with submerged fermentation by Monascus purpureus[J].Biocatalysis and Agricultural Biotechnology, 2019, 21:101276.
[5] 王鹏, 许春艳, 续丹丹, 等.高产洛伐他汀红曲菌的选育及其在红腐乳中的应用[J].中国酿造, 2020, 39(11):52-57.WANG P, XU C Y, XU D D, et al.Screening of high-yield lovastatin Monascus sp.strain and its application in red sufu[J].China Brewing, 2020, 39(11):52-57.
[6] 赵文红, 莫依灿, 洪泽淳, 等.红曲对广东客家黄酒抗氧化活性的影响[J].现代食品科技, 2016, 32(1):143-150.ZHAO W H, MO Y C, HONG Z C, et al.Effect of red koji on the antioxidant properties of Guangdong Hakka rice wine[J].Modern Food Science and Technology, 2016, 32(1):143-150.
[7] 张蒙琪. 鸡蛋蛋白与大豆分离蛋白间相互作用及其凝胶特性的研究[D].无锡:江南大学, 2021.Zhang M Q.The research of interaction between hen egg proteins and soybean protein isolate and its gelation properties[D].Wuxi:Jiangnan University, 2021.
[8] LEE Y L, YANG J, MAU J.Antioxidant properties of ethanolic and methanolic extracts from Monascus-fermented soybeans[J].Journal of Food Biochemistry, 2009, 33(5):707-727.
[9] LEE Y S, CHOI B K, LEE H J, et al.Monascus pilosus-fermented black soybean inhibits lipid accumulation in adipocytes and in high-fat diet-induced obese mice[J].Asian Pacific Journal of Tropical Medicine, 2015, 8(4):276-282.
[10] OH H G, KANG Y R, LEE H Y, et al.Ameliorative effects of Monascus pilosus-fermented black soybean (Glycine max L.Merrill) on high-fat diet-induced obesity[J].Journal of Medicinal Food, 2014, 17(9):972-978.
[11] PYO Y H, LEE T C.The potential antioxidant capacity and angiotensin I-converting enzyme inhibitory activity of Monascus-fermented soybean extracts:Evaluation of Monascus-fermented soybean extracts as multifunctional food additives[J].Journal of Food Science, 2007, 72(3):S218-S223.
[12] HONG S H, LEE I, KIM S J, et al.Improved functionality of soft soybean curd containing Monascus fermented soybean ethanol extract[J].Food Science and Biotechnology, 2012, 21(3):701-707.
[13] ZHANG B B, XING H B, JIANG B J, et al.Using millet as substrate for efficient production of monacolin K by solid-state fermentation of Monascus ruber[J].Journal of Bioscience and Bioengineering, 2018, 125(3):333-338.
[14] FENG Y L, SHAO Y C, ZHOU Y X, et al.Monacolin K production by citrinin-free Monascus pilosus MS-1 and fermentation process monitoring[J].Engineering in Life Sciences, 2014, 14(5):538-545.
[15] 石佳, 张红梅, 苏子杰, 等.添加葡萄糖及大豆源基质提高红曲monacolin K产量的研究[J].食品与发酵工业, 2021, 47(2):182-187.SHI J, ZHANG H M, SU Z J, et al.Enhancing monacolin K yield of red yeast rice by adding glucose and substrates from soybean[J].Food and Fermentation Industries, 2021, 47(2):182-187.
[16] 赵薇, 姚钰琪, 王爽, 等.甘油影响红曲菌产色素的碳源选择性探究[J].微生物学杂志, 2019, 39(5):28-34.ZHAO W, YAO Y Q, WANG S, et al.Exploration on carbon source selectivity of glycerol affecting pigments production by Monascus spp.[J].Journal of Microbiology, 2019, 39(5):28-34.
[17] FENG Y L, CHEN W P, CHEN F S.A Monascus pilosus MS-1 strain with high-yield monacolin K but no citrinin[J].Food Science and Biotechnology, 2016, 25(4):1115-1122.
[18] DAI W H, SHAO Y C, CHEN F S.Production of monacolin K in Monascus pilosus:Comparison between industrial strains and analysis of its gene clusters[J].Microorganisms, 2021, 9(4):747.
[19] ZHANG C, CHAI S Y, HAO S, et al.Effects of glutamic acid on the production of monacolin K in four high-yield monacolin K strains in Monascus[J].Applied Microbiology and Biotechnology, 2019, 103(13):5301-5310.
[20] 李芳. 淡紫拟青霉菌(Paecilomyces lilacinus(Thom.)Samson Str.NH-PL-03)生物学特性与次生代谢物质生物效应研究[D].福州:福建农林大学, 2005.LI F.Study on biological characteristics of Paecilomyces lilacinus (Thom.) Samson Str.NH-PL-03 and its biological effects of secondary metabolites[D].Fuzhou:Fujian Agriculture and Forestry University, 2005.
[21] LU L P, ZHANG B B, XU G R.Efficient conversion of high concentration of glycerol to Monacolin K by solid-state fermentation of Monascus purpureus using bagasse as carrier[J].Bioprocess and Biosystems Engineering, 2013, 36(3):293-299.
[22] LI L, CHEN S, GAO M X, et al.Acidic conditions induce the accumulation of orange Monascus pigments during liquid-state fermentation of Monascus ruber M7[J].Applied Microbiology and Biotechnology, 2019, 103(20):8393-8402.
[23] LYU J, ZHANG B B, LIU X D, et al.Enhanced production of natural yellow pigments from Monascus purpureus by liquid culture:The relationship between fermentation conditions and mycelial morphology[J].Journal of Bioscience and Bioengineering, 2017, 124(4):452-458.
[24] 董钰鑫, 陈莎, 高梦祥, 等.pH对红色红曲菌(Monascus ruber)M7生长及产孢的影响[J].中国酿造, 2022, 41(3):76-80.DONG Y X, CHEN S, GAO M X, et al.Effect of pH on the growth and sporulation of Monascus ruber M7[J].China Brewing, 2022, 41(3):76-80.
[25] MOHAN-KUMARI H P, DHALE M A, GOVINDASWAMY V.Optimization of monacolin K production by Monascus purpureus MTTC 410 in submerged fermentation[J].International Journal of Food Engineering, 2012, 8(3):1-12.
[26] 袁国兴. 红曲米中蛋白酶、酯化酶的活性研究[D].济南:山东轻工业学院, 2012.YUAN G X.Study on the activity of esterified enzyme and protease in red rice[D].Jinan:Shandong Polytechnic University, 2012.
[27] 魏巍. 红曲霉发酵合成洛伐他汀的研究[D].武汉:华中科技大学, 2013.Wei W.Study on lovastatin fermentation by Monascus species[D].Wuhan:Huazhong University of Science and Technology, 2013.
[28] 史成. 固态发酵基质影响红曲他汀与色素产量的研究[D].天津:天津科技大学, 2019.SHI C.Study on the effect of solid-state fermentation substrate on Monascus statin and pigments yield[D].Tianjin:Tianjin University of Science and Technology, 2019.
[29] ZHANG C, CHEN M X, ZANG Y M, et al.Effect of arginine supplementation on Monacolin K yield of Monascus purpureus[J].Journal of Food Composition and Analysis, 2022, 106:104252.