真空冷冻干燥是目前益生菌生产中最为常用的干燥技术。然而冻干过程中,因受冷冻和干燥胁迫,引发细胞损伤甚至死亡,进而导致菌体冻干存活率下降。目前关于冻干过程细胞损伤的原因主要为冰晶的形成与升华对肽聚糖[1-3]、脂肪酸[4-5]、蛋白质[6-7]、核酸[1,8]等大分子物质的破坏,以及细胞因失水引起内部溶质浓度过高带来的溶质损伤[9-10]。然而,大部分研究仅关注冻干前后细胞活性的变化,对冻干过程细胞的损伤机制缺乏阐释,如具体哪个冻干阶段对细胞有损伤、损伤的大分子物质种类及大分子物质如何变化等机制尚待研究。
长双歧杆菌长亚种在人类健康中发挥着重要作用,具有防治便秘[11]、抑制肠道致病菌[12]、调节肠道平衡、降低胆固醇[13]、促进营养物质消化吸收、延缓衰老[14]和增强机体免疫活性[15]等生理功能,被广泛应用于多种益生菌产品,市场需求量较大。然而,长双歧杆菌长亚种菌体表面积较大,在冻干过程中易受到损伤,导致存活率和稳定性较差,市场应用挑战较大[16-18]。因此亟待开展真空冷冻干燥过程中长双歧杆菌长亚种细胞损伤的机制研究。
本研究主要通过分析长双歧杆菌长亚种冻干过程中不同阶段的存活率和水分变化,确定细胞损伤发生阶段,明确该阶段细胞损伤的主要原因,探究冻干过程对细胞损伤的机制,靶向性改善关键工艺环节,提高长双歧杆菌长亚种制备效率,为菌株生产提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
长双歧杆菌长亚种(Bifidobacterium longum subsp. longum)BB68S由北京和益源生物技术有限公司提供,专利保藏于中国普通微生物菌种保藏管理中心,保藏编号:CGMCC No.14618。
1.1.2 试剂
酵母蛋白胨、酵母浸粉、牛肉浸粉,安琪酵母股份有限公司;葡萄糖、Na2HPO4、K2HPO4、NaCl、KCl,国药集团化学试剂有限公司;青霉素、溶菌酶、乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒、β-半乳糖苷酶(β-galactosidase,β-GAL)检测试剂盒,北京索莱宝科技有限公司;戊二醛,Wabcan生物科技公司;脱脂奶粉,恒天然商贸(上海)有限公司。
1.1.3 培养基
MRS-L液体培养基(g/L):酵母蛋白胨10、酵母浸粉5、牛肉浸粉5、葡萄糖20、无水乙酸钠5、K2HPO4 2、柠檬酸铵2、MgSO4·7H2O 0.58、MnSO4·H2O 0.19、吐温-80 1 ml/L、半胱氨酸盐酸盐0.5。
1.2 仪器与设备
BLBIO-5GJ-2-H发酵罐,上海百伦生物科技有限公司;CX31光学显微镜,日本奥林巴斯公司;DL-CJ-2 NDI超净工作台,北京东联哈尔仪器制造有限公司;MS-3 basic漩涡振荡器,德国IKA;UV-2802紫外分光光度计,尤尼柯(上海)仪器有限公司;LGJ-50F冻干机,北京松源华兴科技发展有限公司;SU8020扫描电子显微镜,日本日立公司;Nicolet IS10傅里叶红外光谱仪(Fourier transform infrared spectrometer,FTIR),美国尼高力仪器公司。
1.3 实验方法
1.3.1 菌株活化培养与菌体制备
将放于-80 ℃的冻存管取出,待其融化,取0.2 mL菌液接种于10 mL MRS-L液体培养基,37 ℃培养12 h,按2%(体积分数,下同)接种量传至3代,并将活化好的菌种液接种于5 L发酵罐内,待发酵完成,8 000×g离心10 min,去上清液,PBS洗涤菌泥2~3次,将收集的菌泥用等质量PBS重悬备用。
1.3.2 冻干样品制备
采用实验型平板式冻干机进行真空冷冻干燥实验。冻干工艺:预冻温度-30 ℃,时间2 h;升华干燥温度-20 ℃,时间2 h;解析干燥温度25 ℃,时间8 h。分别在0 h(预冻前)、2 h(预冻后/升华干燥前)、3 h(升华干燥中段)、4 h(升华干燥后/解吸干燥前)、8 h(解吸干燥中段)、12 h(解吸干燥后)将冻干样品从冻干机中取出,用无菌纯化水复溶至冻干前质量,低温保存待检。
1.3.3 活菌数检测
冻干样品直接按照GB 4789.35—2023《食品安全国家标准 食品微生物学检验 乳酸菌检验》方法进行活菌数检测。
1.3.4 水分含量检测
冻干样品直接按照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》第一法直接干燥法进行水分含量检测。
1.3.5 菌体形态观察
将冻干样品离心弃上清液,PBS洗涤2次,2.5%(体积分数)戊二醛固定,临界点干燥去除水分,导电胶带固定在载玻片上,10 mA电流下用金溅射2 min,扫描电子显微镜观察菌体形态。
1.3.6 细胞结构检测
将冻干样品离心弃上清液,PBS洗涤2次,无菌纯化水重悬。取30 μL重悬液均匀平铺在ZnSe窗口片,45 ℃干燥1 h,再加入质量50~100倍KBr进行研磨压片,红外灯烘烤2 min。以KBr片为对照,进行FTIR测试,扫描范围4 000~400 cm-1,扫描次数64次,分辨率4 cm-1。由OMINIC 8.0软件进行数据处理,对光谱曲线归一化处理并进行二阶求导,分析各基团特征峰变化,判断细胞结构变化[19]。
1.3.7 细胞壁完整性检测
采用青霉素限定性培养基检测细胞壁完整性[19]。青霉素使用0.22 μm滤膜过滤后添加至无菌培养基中,调整其质量浓度分别为5、10、20、40、80 ng/mL。将活化后的BB68S菌种按照2%接种量分别接种于上述青霉素限定培养基中,37 ℃厌氧培养12 h,检测OD600值,最小抑菌浓度(minimal inhibition concentration,MIC)为能明显抑制BB68S生长的最低浓度。将冻干过程样品分别采用正常MRS固体培养基和青霉素限定培养基(1/2 MIC)进行活菌计数,按照公式(1)计算细胞壁完整度:
(1)
式中:Rw,细胞壁完整度,%;C0,正常MRS固体培养基活菌数,CFU/mL;C1,青霉素限定培养基活菌数,CFU/mL。
1.3.8 细胞膜通透性检测
采用NaCl限定性培养基检测细胞膜通透性[19]。配制质量分数分别为0.375%、0.75%、1.5%、3.0%、6.0%的NaCl限定培养基。将活化后的BB68S菌种按照2%接种量分别接种于上述NaCl限定培养基中,37 ℃厌氧培养12 h,检测OD600值。将冻干过程样品分别用正常MRS固体培养基和NaCl限定培养基(1/2 MIC)进行活菌计数,按公式(2)计算细胞膜通透性:
(2)
式中:Rm,细胞膜通透性,%;C0,正常MRS固体培养基活菌数,CFU/mL;C2,NaCl限定培养基活菌数,CFU/mL。
1.3.9 关键代谢酶活性测定
使用试剂盒测定细胞内外LDH和β-GAL活力。
细胞外酶活力:将冻干样品离心,收集上清液检测酶活力。
细胞内酶活力:将冻干样品离心,收集菌泥,按照每1011CFU/mL添加提取液,超声波破碎(冰浴,功率200 W,超声波处理3 s,间隔10 s,重复30次),4 ℃离心,收集上清液检测酶活力。
1.3.10 数据处理
试验均进行3次重复,使用SPSS 20.0进行统计分析,使用单因素方差分析法检测数据之间的显著差异,P<0.05表明存在统计学显著差异。
2 结果与分析
2.1 冻干过程菌株存活率及水分变化
真空冷冻干燥分为预冻、升华干燥、解吸干燥3个阶段。预冻阶段是在低温条件下将物料冻结;升华干燥阶段是在真空条件下冰晶升华,去除物料中大部分水;解吸干燥是为了去除物料中残留的吸附水,这部分水与物料结合较为紧密,去除难度大[20]。
分别在预冻前后、升华干燥前后、解吸干燥前后取样,检测物料活菌数和水分含量,结果如表1所示。BB68S经预冻后,活菌存活率显著降低了14.1%;经升华干燥后,活菌存活率极显著降低了49.7%;而解吸干燥过程活菌存活率逐渐趋于稳定,仅下降7.1%。结合冻干过程菌体水分含量变化趋势分析,发现BB68S冻干过程存活率和水分含量均先缓慢降低,再快速下降,最后趋于平缓,剧烈变化均发生在升华干燥阶段,存活率较冻干前下降约50%,水分去除95%以上。有研究报道,当细胞含水量降至23.33%~33.33%时,细胞会发生脱水损伤甚至死亡[21],公丕民[19]在进行保加利亚乳杆菌干燥时也发现,当水分含量低于23.52%时,菌体数量开始急剧下降。本研究升华阶段结束后,样品水分含量为15.4%,菌体大量死亡。推测升华干燥阶段水分的剧烈变化可能是导致BB68S细胞损伤的主要原因。
表1 长双歧杆菌长亚种BB68S冻干过程存活率和水分含量变化
Table 1 Changes of survival rate and moisture content of B.longumsubsp. longumBB68S during freeze-drying
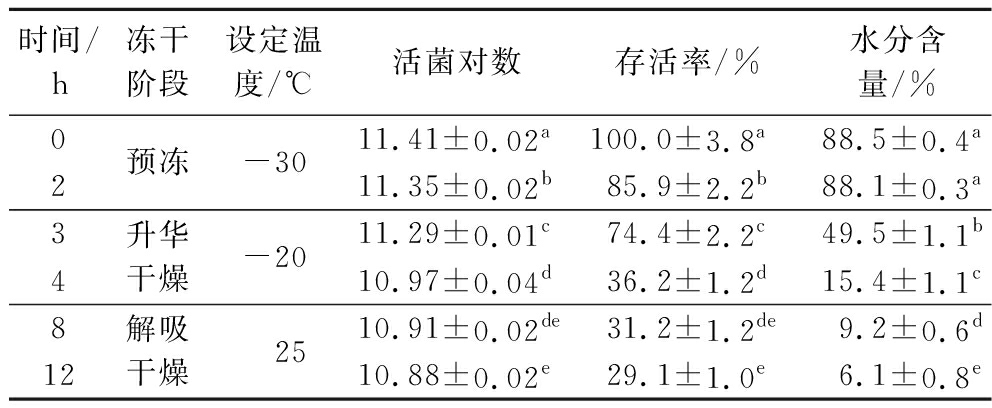
时间/h冻干阶段设定温度/℃活菌对数存活率/%水分含量/%02预冻-3011.41±0.02a100.0±3.8a88.5±0.4a11.35±0.02b85.9±2.2b88.1±0.3a34升华干燥-2011.29±0.01c74.4±2.2c49.5±1.1b10.97±0.04d36.2±1.2d15.4±1.1c812解吸干燥 2510.91±0.02de31.2±1.2de9.2±0.6d10.88±0.02e29.1±1.0e6.1±0.8e
注:不同字母表示两组间差异显著(P<0.05)。
2.2 冻干过程菌体形态变化
如图1所示,预冻前菌体呈长杆状,略弯曲,一端分化特征明显,呈圆帽状,另一端无明显分化特征,菌体长度1~3 μm,菌体表面光滑无褶皱,无鞭毛。预冻后菌体整体形状变化不明显,但有少部分菌体表面出现破损。随着冻干的进行,升华干燥过程菌体表面开始出现明显褶皱,并在解吸干燥过程中褶皱程度逐渐加深。而在冻干过程不同阶段未观察到明显裂解菌体,BB68S菌体完整度保持相对较好。
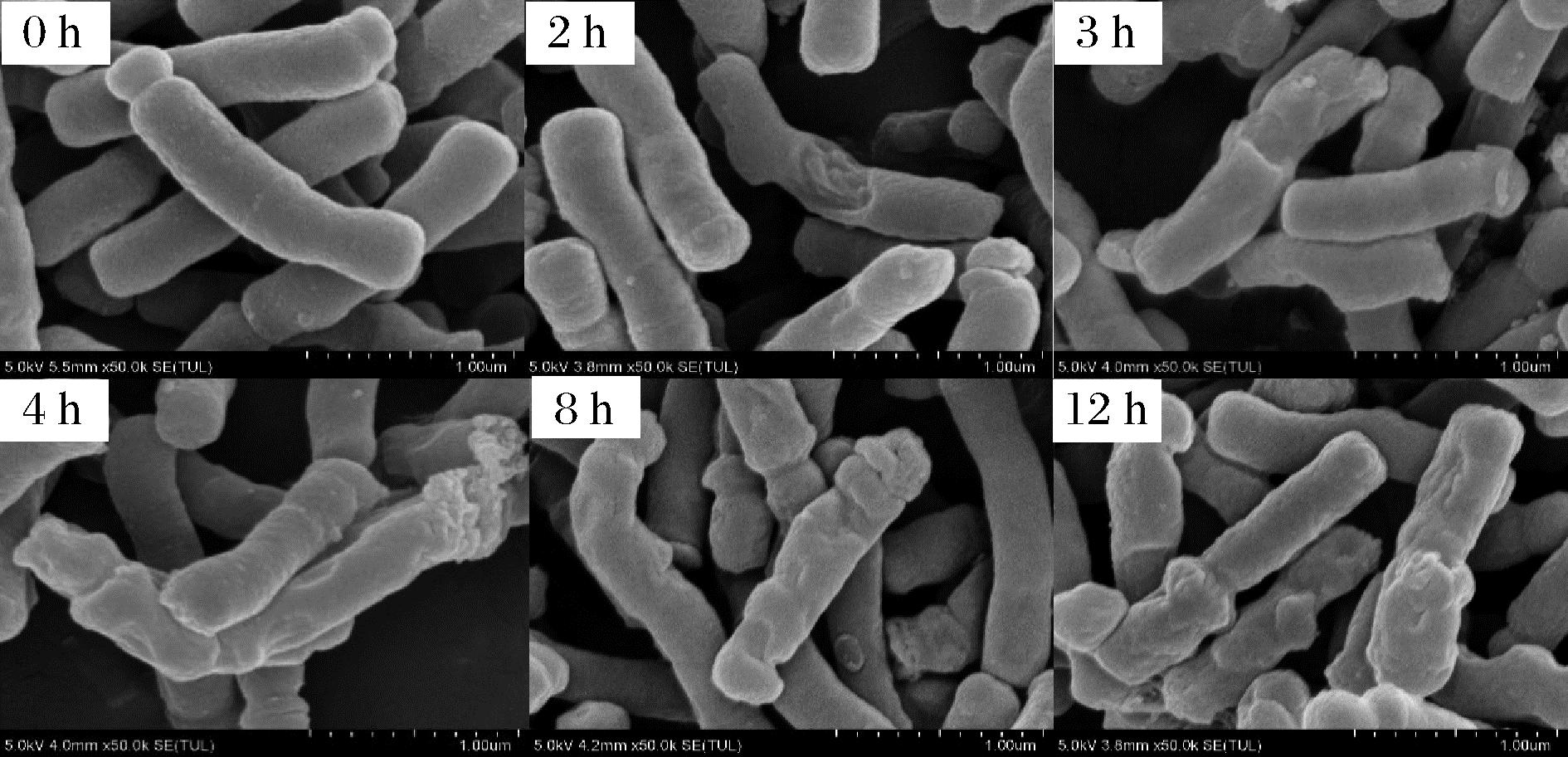
图1 长双歧杆菌长亚种BB68S冻干过程菌体形态变化
Fig.1 Morphological changes of B.longum subsp. longum BB68S during freeze-drying
2.3 冻干过程细胞壁结构变化
长双歧杆菌长亚种BB68S是革兰氏阳性菌,其细胞壁组成为肽聚糖,由N-乙酰葡萄糖胺和N-乙酰胞壁酸交替连接的杂多糖与不同组成的短肽链交叉连接形成的多层网状大分子结构[22]。红外光谱1 200~900 cm-1表征多糖及其异构体的红外吸收范围,包含C—O、C—O—H、C—C、C—O—C等官能团特征吸收峰,可以通过FTIR分析细胞壁结构变化[23]。
对冻干过程不同阶段菌体进行红外扫描,峰图进行基线校正和平滑处理,并进行二阶求导,对二阶导数图谱进行对比分析,结果如图2所示,细胞壁肽聚糖红外吸收峰在预冻前后(0 h和2 h)发生显著性变化,吸收峰数量明显减少,曲线变得光滑,表明肽聚糖结构发生改变,而在升华干燥(3 h和4 h)和解吸干燥(8 h和12 h)过程无明显变化。LUO等[24]研究发现,预冻过程形成的冰晶尺寸主要分布在30~80 μm,而BB68S菌体长度为1~3 μm,冰晶尺寸远大于菌体大小,预冻过程冰晶的形成会对细胞最外层的细胞壁造成挤压,破坏细胞壁结构。因此,BB68S冻干过程细胞壁损伤主要发生在预冻阶段。
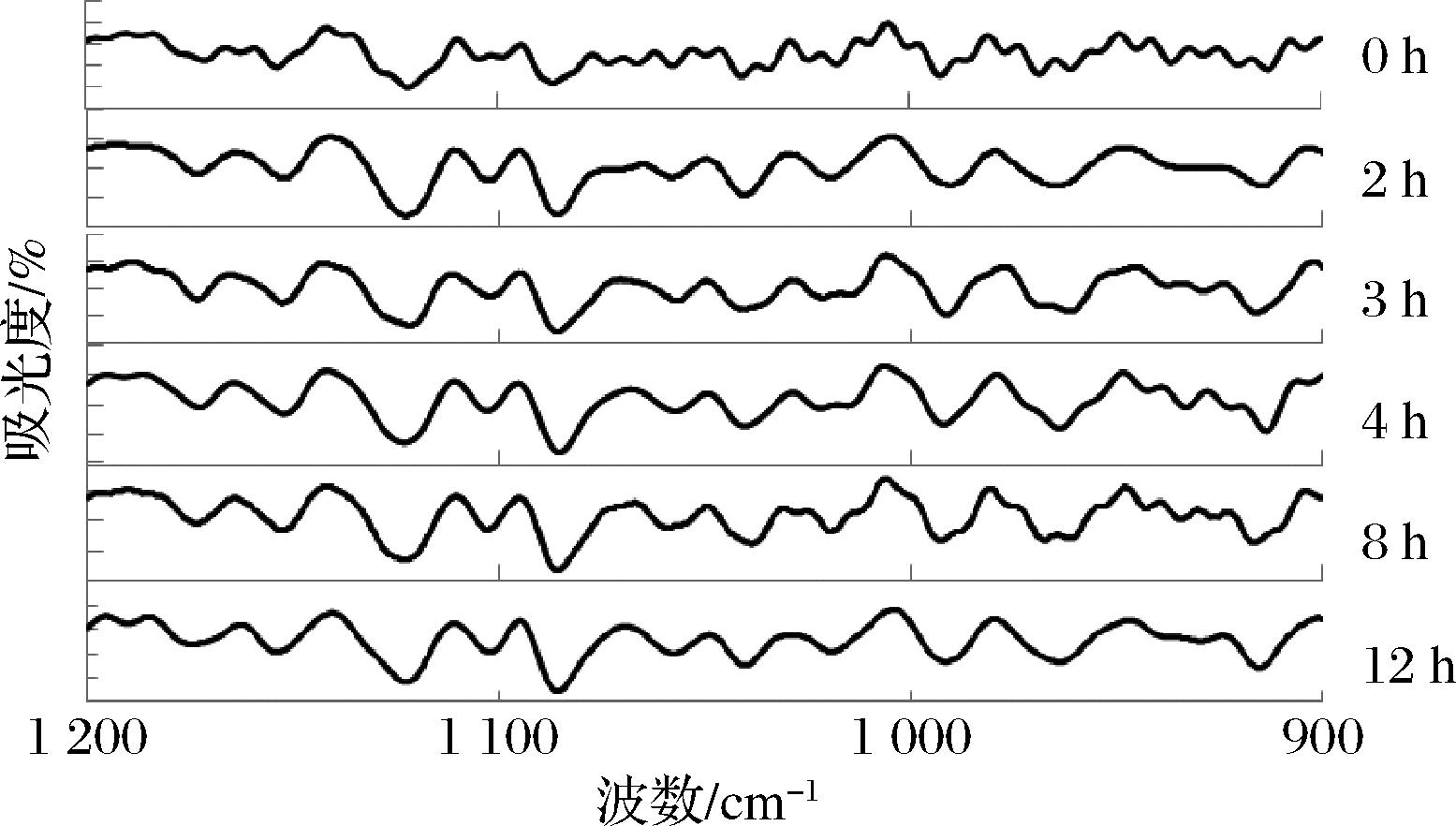
图2 长双歧杆菌长亚种BB68S冻干过程1 200~900 cm-1范围内FTIR二阶导数图谱
Fig.2 Second derivative of FTIR spectra in 1 200-900 cm-1 for B.longum subsp. longum BB68S during freeze-drying
2.4 冻干过程细胞壁完整性变化
青霉素是窄谱型抗生素,能够抑制革兰氏阳性菌细胞壁的合成和修复,且对浓度有较强的依赖性,而细胞壁破损的细胞对青霉素更加敏感[19],本研究先确定正常菌体的青霉素耐受浓度,再根据耐受浓度配制青霉素限定性培养基,冻干样品通过限定性培养基培养能够筛选出细胞壁完整度较高的菌体,最后以正常培养基做对照确定冻干样品菌群的细胞壁完整度。
由图3-a可知,当青霉素质量浓度为40 ng/mL时,BB68S的生长受到显著性抑制,将40 ng/mL作为MIC,并对1/2 MIC(20 ng/mL)进行固体培养基验证,添加20 ng/mL青霉素的限定培养基对正常菌体计数无显著影响,可作为细胞壁完整度检测培养基。
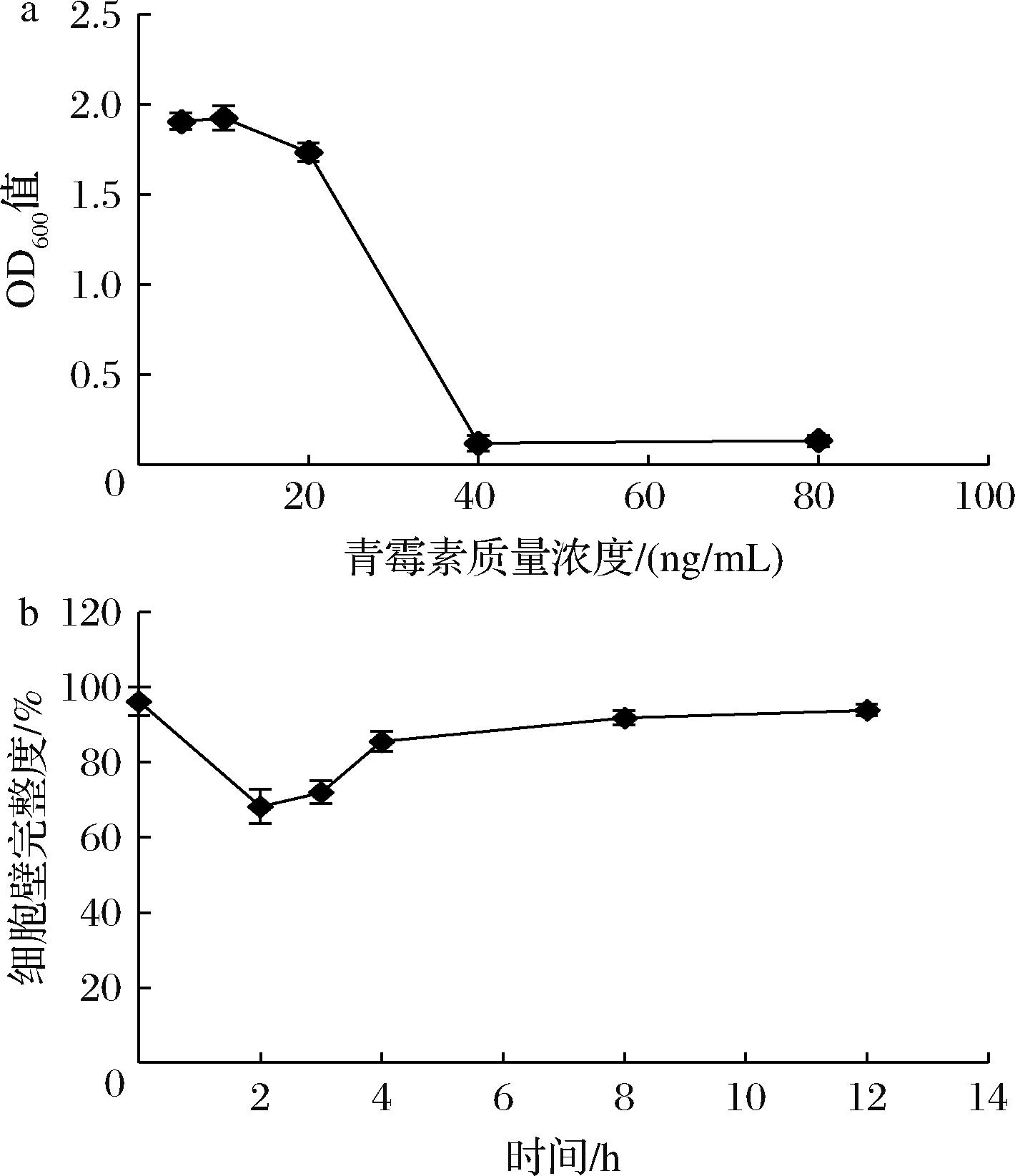
a-BB68S对不同浓度青霉素的耐受结果;b-通过青霉素限定培养基测定的不同冻干阶段BB68S菌群的细胞壁完整度
图3 长双歧杆菌长亚种BB68S冻干过程细胞壁完整度变化
Fig.3 Cell wall integrity changes of B.longum subsp. longum BB68S during freeze-drying
使用青霉素限定培养基对BB68S冻干过程细胞壁完整度进行测定,BB68S细胞壁完整度在冻干过程呈先下降后上升的变化趋势(图3-b)。预冻前细胞壁完整度为96.2%,细胞壁状态完好。预冻后细胞壁完整度大幅度下降至68.2%,表明冰晶的形成破坏了细胞壁结构,导致细胞壁完整度下降。在干燥阶段,细胞壁完整度呈缓慢上升趋势,结合表1数据可看出此阶段活菌存活率大幅度下降,表明存活下来的菌体细胞壁保持较为完整,而细胞壁受损的菌体更易在干燥过程死亡。CHEN等[1] 和E等[2]通过保护细胞壁结构,植物乳植杆菌LIP-1的冻干存活率显著提高,表明细胞壁在冻干过程中的重要性,同时细胞壁受损的细胞更易受到其他因素破坏[19]。
2.5 冻干过程细胞膜结构变化
细胞膜结构主要由磷脂双分子层构成,磷脂分子头部亲水,位于外侧,尾部疏水,位于内侧,两层磷脂分子相对排列,形成内部疏水外部亲水的结构。因其富含大量长碳链,通过观察—CH2—、—CH3对称和反称伸缩振动红外吸收峰位置的变化,可以推断磷脂双分子层的结构变化[25]。
采用FTIR对细胞膜磷脂双分子层结构变化进行检测和分析,结果如图4和表2所示。
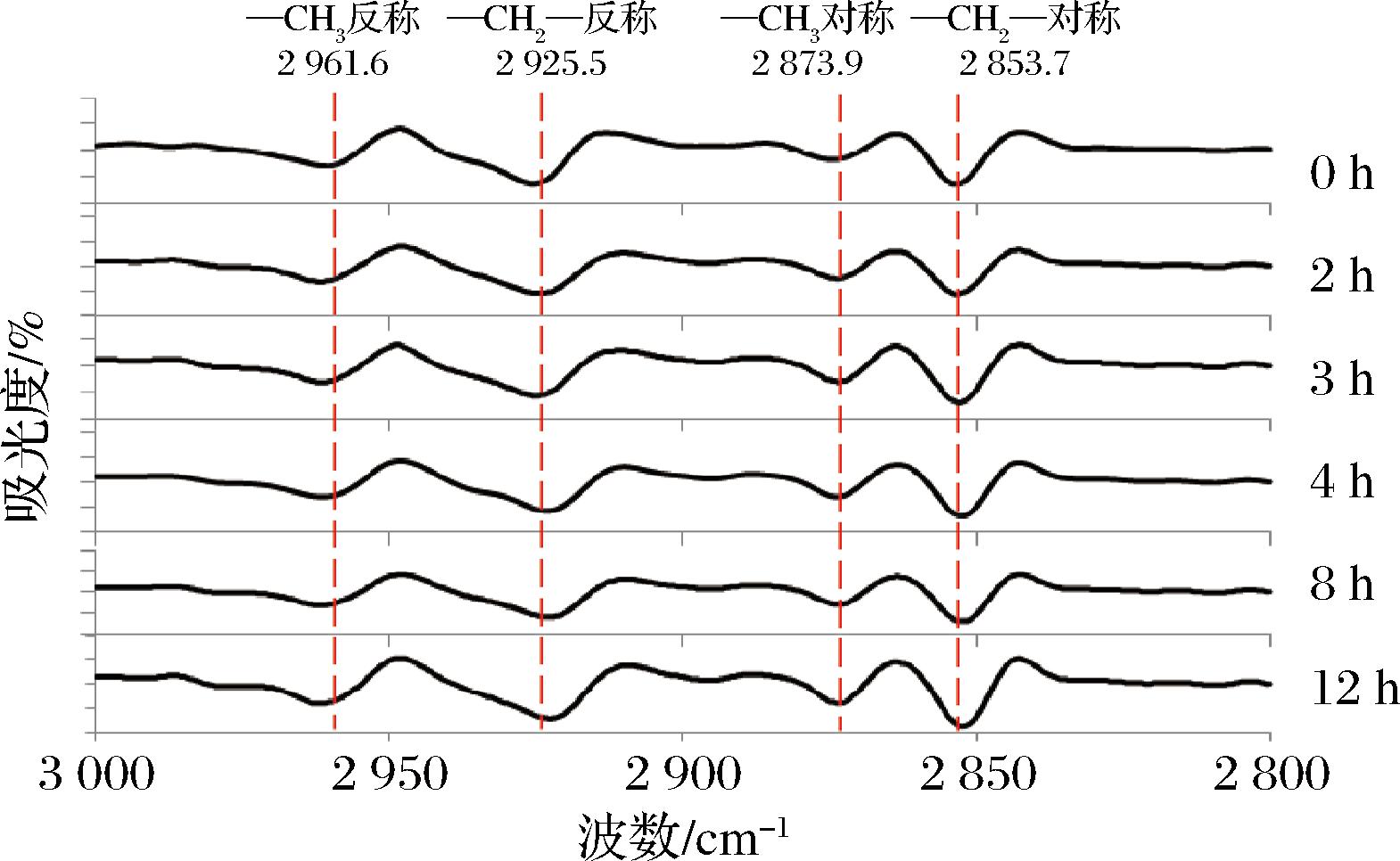
图4 长双歧杆菌长亚种BB68S冻干过程3 000~2 800 cm-1 FTIR二阶导数图谱
Fig.4 Second derivative of FTIR spectra in 3 000-2 800 cm-1 for B.longum subsp. longum BB68S during freeze-drying
表2 长双歧杆菌长亚种BB68S冻干过程细胞膜磷脂红外特征吸收峰 单位:cm-1
Table 2 Infrared characteristic absorption peaks of phospholipid in cell membrane of B.longumsubsp. longum BB68S during freeze-drying
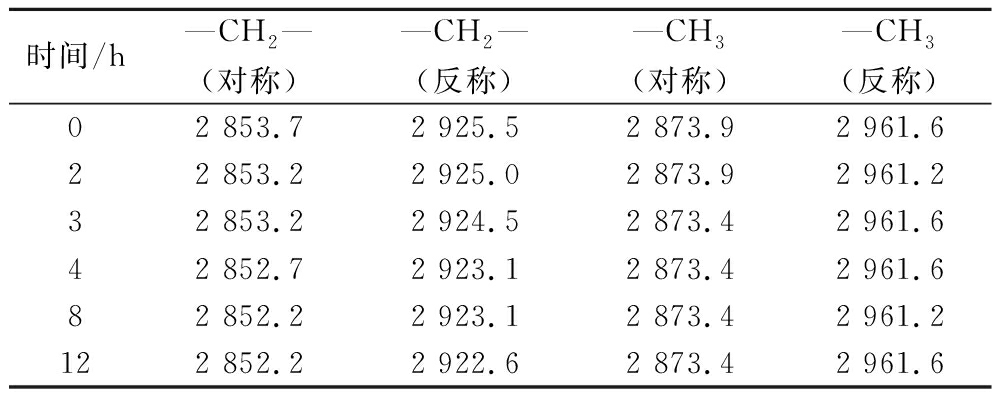
时间/h—CH2—(对称)—CH2—(反称)—CH3(对称)—CH3(反称)02 853.72 925.52 873.92 961.622 853.22 925.02 873.92 961.232 853.22 924.52 873.42 961.642 852.72 923.12 873.42 961.682 852.22 923.12 873.42 961.2122 852.22 922.62 873.42 961.6
BB68S冻干过程磷脂—CH2—反称伸缩振动吸收峰变化显著,吸收峰由冻干前的2 925.5 cm-1逐渐转移至2 922.6 cm-1,特别是在升华干燥阶段变化最明显,同时—CH2—对称伸缩振动吸收峰也发生小幅度变化,表明磷脂分子间疏水作用力和氢键作用力减弱,可能导致细胞膜由液晶态逐渐向凝胶态转变。LOUESDON等[26]研究也表明细胞膜在干燥脱水时,磷脂亲水头部因失水出现空位,酰基强加到空位上,链间范德华力增强,进一步导致细胞膜相变,通透性增加。
2.6 冻干过程细胞膜通透性变化
本实验通过在培养基中添加NaCl配制不同渗透压培养基,观察正常BB68S对NaCl浓度的敏感性。如图5-a所示,当NaCl质量分数为3%时,BB68S的生长受到显著性抑制,将3%作为MIC,并对1/2 MIC(1.5%)进行固体培养基验证,添加1.5%NaCl的限定培养基对正常菌体计数无显著影响,可作为细胞膜通透性检测培养基。
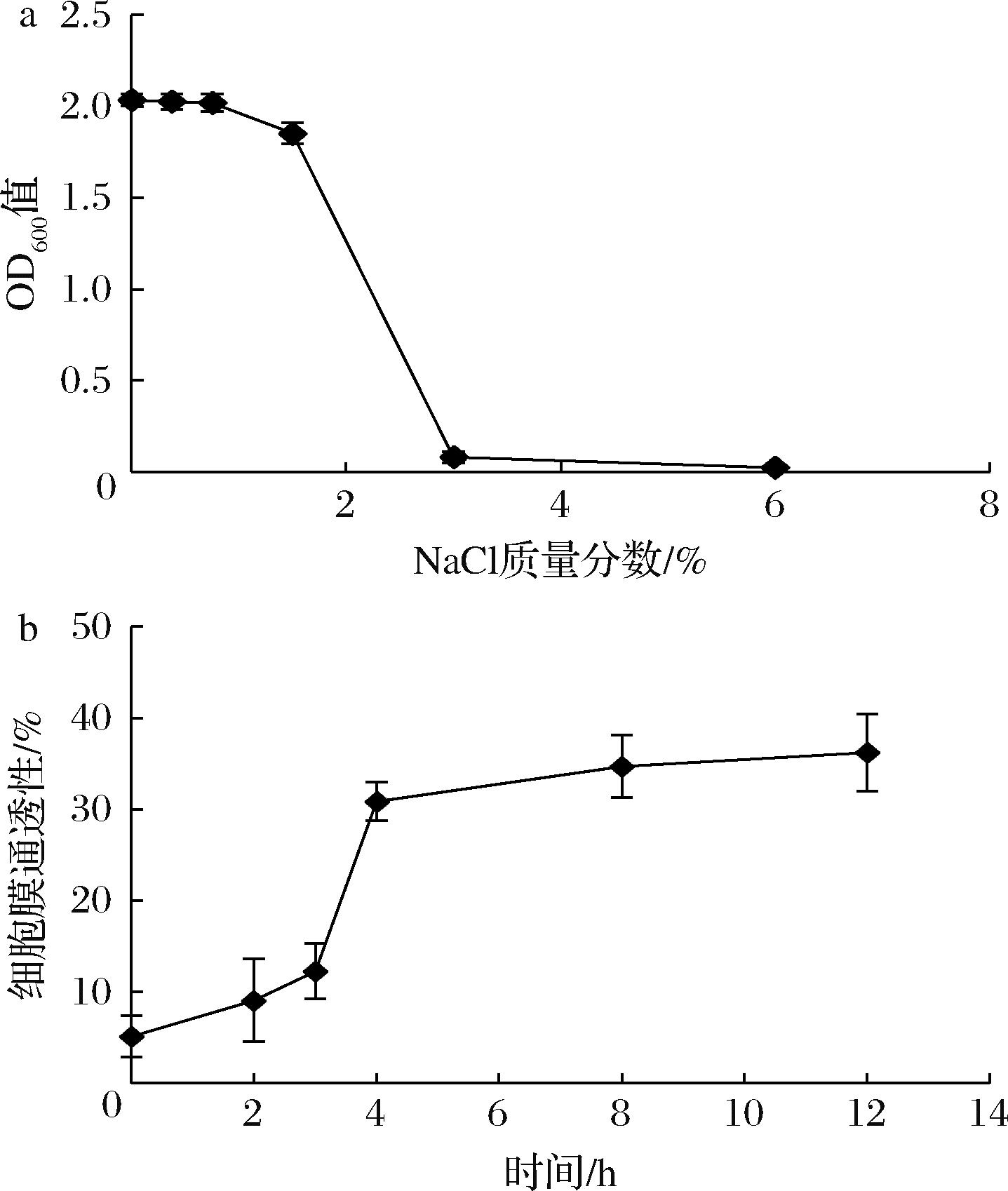
a-BB68S对不同浓度NaCl的耐受结果;b-通过NaCl限定培养基测定的不同冻干阶段BB68S菌群的细胞膜通透性
图5 长双歧杆菌长亚种BB68S冻干过程细胞膜通透性变化
Fig.5 Membrane permeability changes of B.longum subsp. longum BB68S during freeze-drying
使用NaCl限定培养基对BB68S冻干过程细胞膜通透性进行测定,如图5-b所示,冻干过程细胞膜通透性呈S型变化趋势,主要在升华干燥过程变化显著,通透性急剧上升21.8%。细胞膜通透性变化与其结构变化密切相关,升华干燥过程随着水分的降低,维持细胞膜结构的作用力减弱,诱导细胞膜发生凝胶化和反向六方相变化,磷脂分子的聚集进一步导致细胞膜出现空位,使细胞膜通透性增加[27]。细胞膜具有选择性物质转运功能,当外界环境渗透压较高时,其可调节细胞膜内外物质含量维持生理功能,若细胞膜出现破损,通透性增加,渗透调节转运功能失调,此时高渗环境则导致胞内物质外流,甚至死亡[28]。
2.7 关键代谢酶活性变化
如图6-a所示,冻干过程胞内LDH活力逐渐降低,而胞外LDH活力逐渐上升,特别是升华干燥过程,胞内外LDH活力发生显著性变化。图6-b冻干过程胞内外β-GAL活力变化趋势与LDH相似,均是在升华干燥过程变化显著。
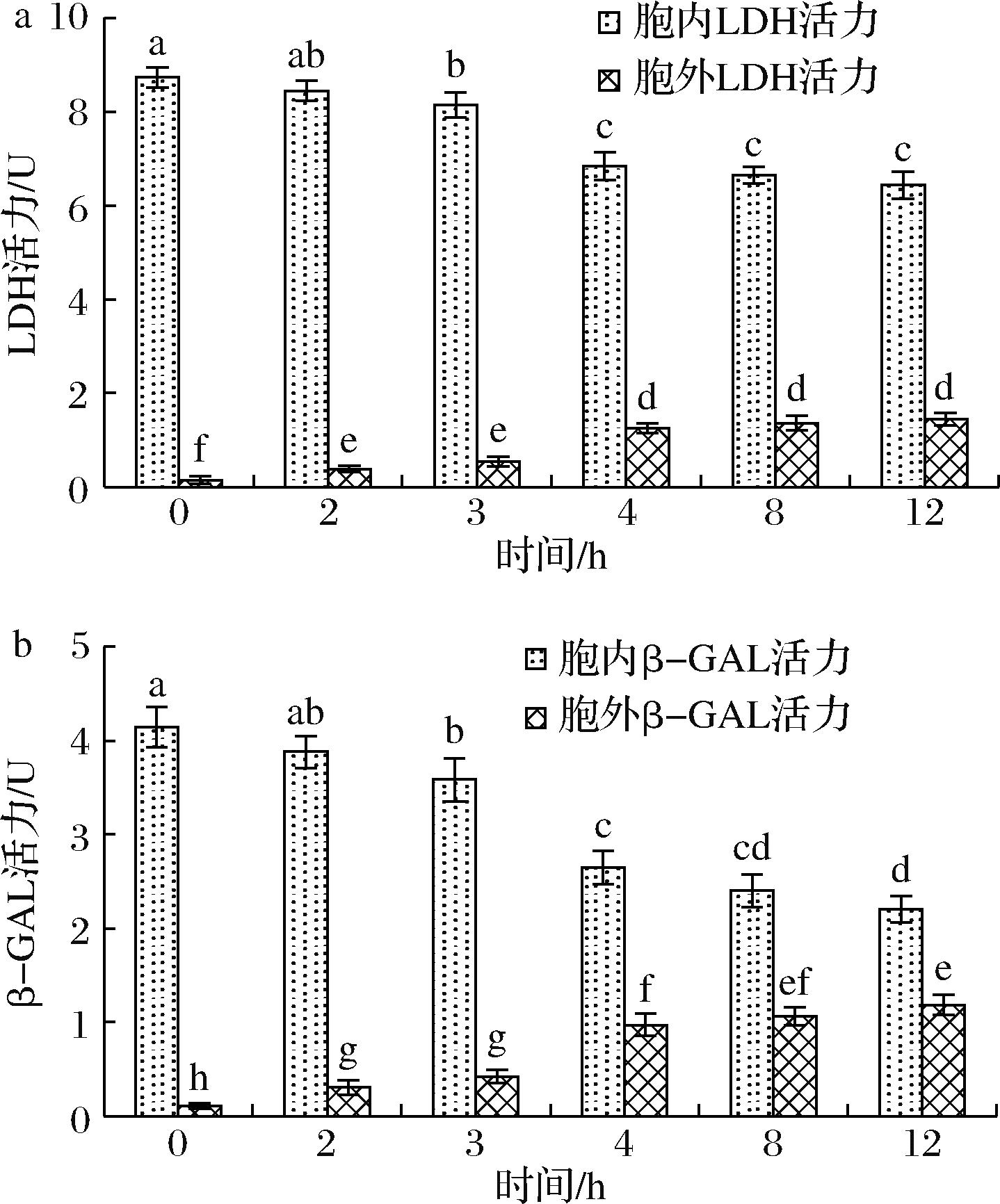
a-LDH;b-β-GAL
图6 长双歧杆菌长亚种BB68S冻干过程细胞内外关键酶活力变化
Fig.6 Changes of key enzyme activity in extracellular and intracellular of B.longum subsp. longum BB68S during freeze-drying
注:不同字母表示两组间差异显著(P<0.05)。
胞内外蛋白质活性在升华干燥阶段发生变化,LDH和β-GAL均是胞内酶,只能在胞内检测到,而在升华干燥过程均在胞外检测到2种酶活力显著性上升,同时胞内酶活力呈下降趋势,表明这2种酶发生泄漏。有研究发现β-GAL活力能反映细胞膜通透性的变化情况,通过测定细胞内外的β-GAL活力可判定细胞膜损伤的情况[9]。也有研究结果表明,冻干过程细胞膜损伤是导致发酵剂活力下降的主要原因[25,29]。由此可知,升华干燥过程细胞膜通透性增加导致胞内酶外漏,蛋白质活性降低。
3 结论
本研究通过考察长双歧杆菌长亚种BB68S在真空冷冻干燥过程中存活率、水分含量、细胞壁结构、细胞膜通透性等特性的变化,确定了冻干过程中菌体细胞损伤的主要阶段为预冻阶段和升华干燥阶段,细胞存活率分别下降14.1%和49.7%,细胞损伤较为严重,同时真空冷冻过程水分变化是导致细胞损伤的主要原因。
预冻阶段主要是细胞壁肽聚糖结构发生显著变化,降低了细胞完整度。升华干燥阶段主要是细胞膜磷脂双分子层结构脱水后发生显著变化,通透性增加,内容物外漏,尤其LDH、β-GAL等胞内代谢关键酶渗漏降低其细胞活性。本研究明确了长双歧杆菌长亚种在真空冷冻干燥过程中细胞损伤的主要原因,为控制真空冷冻干燥工艺提高菌株冻干存活性提供理论依据,对提高菌株生产效率具有实际指导意义。
[1] CHEN Z C, E J J, MA R Z, et al.The effect of aspartic acid on the freeze-drying survival rate of Lactobacillus plantarum LIP-1 and its inherent mechanism[J].LWT, 2022, 155:112929.
[2] E J J, ZHANG J Y, MA R Z, et al.Study of the internal mechanism of L-glutamate for improving the survival rate of Lactiplantibacillus plantarum LIP-1 after freeze-drying[J].Innovative Food Science &Emerging Technologies, 2023, 84:103253.
[3] YANG Y X, WANG R X, CHEN Z C, et al.Effects of exogenous amino acids on the freeze-drying survival rate of Lactiplantibacillus plantarum LIP-1[J].Drying Technology, 2024, 42(4):650-660.
[4] SCHWAB C, VOGEL R, G NZLE M G.Influence of oligosaccharides on the viability and membrane properties of Lactobacillus reuteri TMW1.106 during freeze-drying[J].Cryobiology, 2007, 55(2):108-114.
NZLE M G.Influence of oligosaccharides on the viability and membrane properties of Lactobacillus reuteri TMW1.106 during freeze-drying[J].Cryobiology, 2007, 55(2):108-114.
[5] LIU X T, HOU C L, ZHANG J, et al.Fermentation conditions influence the fatty acid composition of the membranes of Lactobacillus reuteri I5007 and its survival following freeze-drying[J].Letters in Applied Microbiology, 2014, 59(4):398-403.
[6] KANDIL S, EL SODA M.Influence of freezing and freeze drying on intracellular enzymatic activity and autolytic properties of some lactic acid bacterial strains[J].Advances in Microbiology, 2015, 5(6):371-382.
[7] CHEN H, CHEN S W, LI C N, et al.Response surface optimization of lyoprotectant for Lactobacillus bulgaricus during vacuum freeze-drying[J].Preparative Biochemistry &Biotechnology, 2015, 45(5):463-475.
[8] JIANG G, WANG J, ZHAO D D, et al.Molecular mechanism of the cytosine CRISPR base editing process and the roles of translesion DNA polymerases[J].ACS Synthetic Biology, 2021, 10(12):3353-3358.
[9] 李明慧, 尚一娜, 霍麒文, 等.真空冷冻干燥对乳酸菌损伤机制的研究进展[J].食品科学, 2018, 39(19):273-279.LI M H, SHANG Y N, HUO Q W, et al.Recent progress in understanding injury mechanisms of lactic acid bacteria during freeze-drying[J].Food Science, 2018, 39(19):273-279.
[10] 刘开文, 马雯, 金刚.真空冷冻干燥提高乳酸菌存活率及延长贮藏期的研究进展[J].食品科学, 2024, 45(2):325-333.LIU K W, MA W, JIN G.Research progress on improving the survival rate and extending the storage period of lactic acid bacteria through vacuum freeze-drying[J].Food Science, 2024, 45(2):325-333.
[11] 丁圣, 蒋菁莉, 刘松玲, 等.长双歧杆菌BBMN68对便秘模型小鼠的通便作用[J].食品科学, 2011, 32(3):195-198.DING S, JIANG J L, LIU S L, et al.Effect of biofidobactria strain on defecating function in constipation mice[J].Food Science, 2011, 32(3):195-198.
[12] YUN B, SONG M Y, PARK D J, et al.Beneficial effect of Bifidobacterium longum ATCC 15707 on survival rate of Clostridium difficile infection in mice[J].Korean Journal for Food Science of Animal Resources, 2017, 37(3):368-375.
[13] 韦云路, 刘义, 王瑶, 等.3株益生菌体外降胆固醇能力及体内降血脂效果评价[J].食品科学, 2017, 38(23):129-134.WEI Y L, LIU Y, WANG Y, et al.Cholesterol-lowering ability in vitro and hypolipidemic effect in vivo of three probiotic strains[J].Food Science, 2017, 38(23):129-134.
[14] 吕锡斌, 何腊平, 张汝娇, 等.双歧杆菌生理功能研究进展[J].食品工业科技, 2013, 34(16):353-358.LYU X B, HE L P, ZHANG R J, et al.Research progress in physiological functions of Bifidobacterium[J].Science and Technology of Food Industry, 2013, 34(16):353-358.
[15] 杨景, 罗绪刚, 任发政.长双歧杆菌BBMN68诱导的树突状细胞对小鼠牛乳β-乳球蛋白过敏的缓解作用[J].现代食品科技, 2016, 32(7):6-11.YANG J, LUO X G, REN F Z.Reduction of bovine β-lactoglobulin allergenicity via Bifidobacterium longum BBMN68 modulated-dendritic cells in mice[J].Modern Food Science and Technology, 2016, 32(7):6-11.
[16] DUMONT F, MARECHAL P A, GERVAIS P.Cell size and water permeability as determining factors for cell viability after freezing at different cooling rates[J].Applied and Environmental Microbiology, 2004, 70(1):268-272.
[17] SENZ M, VAN LENGERICH B, BADER J, et al.Control of cell morphology of probiotic Lactobacillus acidophilus for enhanced cell stability during industrial processing[J].International Journal of Food Microbiology, 2015, 192:34-42.
[18] BRAVO-FERRADA B M, GONÇALVES S, SEMORILE L, et al.Study of surface damage on cell envelope assessed by AFM and flow cytometry of Lactobacillus plantarum exposed to ethanol and dehydration[J].Journal of Applied Microbiology, 2015, 118(6):1409-1417.
[19] 公丕民. 保加利亚乳杆菌喷雾干燥过程中损伤机制及保护方法研究[D].哈尔滨:哈尔滨工业大学, 2019.GONG P M.Study on damage mechanism and protection method of Lactobacillus bulgaricus during spray drying[D].Harbin:Harbin Institute of Technology, 2019.
[20] SUNDARAMURTHI P, SURYANARAYANAN R.Calorimetry and complementary techniques to characterize frozen and freeze-dried systems[J].Advanced Drug Delivery Reviews, 2012, 64(5):384-395.
[21] SANTIVARANGKNA C, KULOZIK U, FOERST P.Effect of carbohydrates on the survival of Lactobacillus helveticus during vacuum drying[J].Letters in Applied Microbiology, 2006, 42(3):271-276.
[22] INAMURA S, FUKASE K, KUSUMOTO S.Synthetic study of peptidoglycan partial structures.Synthesis of tetrasaccharide and octasaccharide fragments[J].Tetrahedron Letters, 2001, 42(43):7613-7616.
[23] 刘佳, 蔡开聪.β(1→4)糖苷键振动光谱与纤维二糖结构的相关性研究[J].光谱学与光谱分析, 2016, 36(S1):60-61.LIU J, CAI K C.The correlation between the vibrational spectrum of β(1→4)glycosidic linkage and the structure of cellobiose[J].Spectroscopy and Spectral Analysis, 2016, 36(S1):60-61.
[24] LUO C, LIU Z Q, MI S, et al.Quantitative investigation on the effects of ice crystal size on freeze-drying:The primary drying step[J].Drying Technology, 2022, 40(2):446-458.
[25] SANTIVARANGKNA C, WENNING M, FOERST P, et al.Damage of cell envelope of Lactobacillus helveticus during vacuum drying[J].Journal of Applied Microbiology, 2007, 102(3):748-756.
[26] LOUESDON S, CHARLOT-ROUGÉ S, JUILLARD V, et al.Osmotic stress affects the stability of freeze-dried Lactobacillus buchneri R1102 as a result of intracellular betaine accumulation and membrane characteristics[J].Journal of Applied Microbiology, 2014, 117(1):196-207.
[27] SANTIVARANGKNA C, KULOZIK U, FOERST P.Inactivation mechanisms of lactic acid starter cultures preserved by drying processes[J].Journal of Applied Microbiology, 2008, 105(1):1-13.
[28] BASHOLLI-SALIHU M, MUELLER M, SALAR-BEHZADI S, et al.Effect of lyoprotectants on β-glucosidase activity and viability of Bifidobacterium infantis after freeze-drying and storage in milk and low pH juices[J].LWT - Food Science and Technology, 2014, 57(1):276-282.
[29] JOFRÉ A, AYMERICH T, GARRIGA M.Impact of different cryoprotectants on the survival of freeze-dried Lactobacillus rhamnosus and Lactobacillus casei/paracasei during long-term storage[J].Beneficial Microbes, 2015, 6(3):381-386.