胃动力障碍即胃部肌肉收缩蠕动力不足,包括肌肉收缩的力量或频率下降引起的胃肠道运动功能障碍,是功能性消化不良和胃轻瘫的病理机制之一,其症状包括恶心、呕吐、腹胀、腹部不适或疼痛、便秘或腹泻等[1]。胃肠动力障碍由多种病理生理系统疾病引起,包括胃排空加速或减缓、胃容纳性减弱、胃节律紊乱或十二指肠功能失调等[2]。胃运动是一个复杂的过程,涉及到神经、激素和肌肉等多个系统的相互作用,胃动力的神经调节主要由迷走神经和交感神经控制,与胃动力紧密关联的激素主要有胃泌素、胃动素和饥饿素等,胃肌调节主要体现在胃平滑肌收缩、放松和胃酸分泌上[3-4]。在药物治疗中,促胃动力药物是改善胃肠动力障碍的一线疗法。促胃动力药物可放大和协调胃肠肌肉收缩以促进内容物的传输,从而增加胃排空,缓解胃肠动力障碍症状。目前,临床常用的促动力药物包括西沙必利、多潘立酮、红霉素和替加色罗等,但这些药物可能与不良心血管事件有关,导致其使用受限[5]。因此,亟需开发新型安全有效的促胃动力药物。
胃肠蠕动受各种因素的协调调节,包括肠神经系统、免疫系统、肠道激素以及肠道微生物群等[4,6-7]。其中,肠道菌群对胃肠蠕动至关重要,伪无菌和无菌动物实验表明肠道菌群缺失会导致胃肠道蠕动减缓、肠道运输时间延长、收缩力减弱、排便频率降低和肠道神经元丢失等[8]。肠道菌群组成受到多种因素影响,包括一些难消化的碳水化合物、益生元以及益生菌等,摄入益生菌会直接或者间接(通过其肠内代谢)改变肠道菌群的组成。一些研究发现,补充益生菌在体外、动物和人群试验中可改善胃肠道蠕动。体外研究表明丁酸梭菌悬浮液可促进卡哈尔氏间质细胞(interstitial cells of Cajal,ICC)增殖并改善胃肠道运动[9];小鼠灌胃鼠李糖乳酪杆菌GG 1周可显著增加排便频率并减少胃肠道转运时间[10];4种益生菌组合可以改善创伤性脑损伤小鼠的肠蠕动并保护ICC(控制胃肠道平滑肌正常收缩和蠕动活动的主要细胞)[11]。此外,口服罗伊氏粘液乳杆菌DSM 17938或其配方奶粉可减轻婴儿胃胀、加速胃排空并改善反流[12-13]。
前期研究发现,植物乳植杆菌CN2018具有抗幽门螺杆菌感染的能力[14]。幽门螺杆菌感染是功能性消化不良的主要致病因素之一,可能会诱发胃溃疡、胃炎,主要症状有胃部疼痛、恶心、腹胀、打嗝等,而这些也是胃动力障碍的症状。因此,植物乳植杆菌CN2018可能也具有改善胃动力的作用。目前还没有幽门螺杆菌感染与胃动力障碍关联的直接证据,本研究通过腹腔注射L-精氨酸建立大鼠胃动力障碍模型,研究植物乳植杆菌CN2018对胃动力的改善效果。
1 材料与方法
1.1 实验试剂
多潘立酮,西安杨森制药有限公司;异氟烷,深圳市瑞沃德生命科技有限公司;NaCl、左旋精氨酸盐酸盐、多聚甲醛,国药集团化学试剂有限公司;大鼠胃动素(motilin,MTL)、胃泌素(gastrin,GAS)、饥饿素(ghrelin,GHRL)、酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒,上海酶联生物技术有限公司;BCA蛋白浓度测定试剂盒、RIPA(Radio Immunoprecipitation Assay)裂解液,上海碧云天生物技术有限公司;RPMI(Roswell Park Memorial Institute) 1640培养液,美国Thermo Fisher Scientific公司;Trizol裂解液、逆转录试剂盒、PCR检测试剂盒,南京诺唯赞生物技术公司;PCR引物,生工生物工程(上海)股份有限公司。
1.2 实验设备
精密电子天平,梅特勒托利多科技(中国)有限公司;5424R高速离心机,艾本德(上海)国际贸易有限公司;-80 ℃冰箱、Multiscan Go多功能酶标仪,赛默飞世尔科技(中国)有限公司;高通量组织研磨仪,宁波新芝生物科技股份有限公司;Pannoramic MIDI数字切片扫描仪,匈牙利3D-Histech有限公司;MLS 3750高压蒸汽灭菌锅,日本三洋电器股份有限公司;SW-CJ-1 CV型超净工作台,安泰空气技术有限公司;隔水式恒温培养箱,上海跃进医疗器械有限公司。
1.3 实验菌株
本实验使用的菌种为植物乳植杆菌CN2018,来自于江南大学食品微生物菌种保藏中心。
将植物乳植杆菌CN2018在MRS固体培养基上划线纯化2次后,挑取单菌落接种至MRS液体培养基中,37 ℃培养18 h,8 000×g离心15 min,弃去上清液,取沉淀(菌泥)用生理盐水洗涤2~3次。以同样的离心条件获得菌泥并重悬于已灭菌的30%(体积分数)甘油溶液,计数后置于-80 ℃冰箱储存待用。灌胃前将菌液取出,并用无菌生理盐水清洗2~3次,用130 g/L脱脂乳重悬并稀释至活菌数为1×109 CFU/mL。
1.4 动物实验方案
6周龄SPF雄性SD大鼠(180~200 g)购自北京维通利华实验动物技术有限公司。实验动物在江南大学SPF动物房[SYXK(苏)2021-0056]饲养,光照昼夜12 h交替,温度保持在(25±2) ℃,相对湿度为40%~60%,自由摄食及饮水。实验操作按照《江南大学实验动物伦理委员会》相关要求进行(伦理编号:NO20211015S0961120)。
动物经1周适应性饲养后,采用腹腔注射左旋精氨酸诱导法制备大鼠胃动力障碍模型。具体方法为:第1天注射L-亚精胺剂量为5.2 g/kg大鼠体重,第2~5天的剂量为2.6 g/kg大鼠体重,期间空白对照组腹腔注射等量生理盐水。造模后随机取6只测算胃排空率以验证模型建立是否成功。造模成功后,随机分4组(n=6):空白对照组、模型组、阳性对照组和益生菌干预组。阳性对照组每日灌胃多潘立酮溶液(10 mg/kg大鼠体重)、益生菌干预组每日灌胃植物乳植杆菌CN2018(1×109 CFU/100 g大鼠体重)、空白对照组和模型组每日给予等量生理盐水。造模周期为7 d,期间每日记录大鼠体重及摄食量变化。最后一次给药后,大鼠禁食不禁水24 h,后测定胃排空率,30 min后处死大鼠,收集血液,4 ℃放置2 h后离心(3 500×g,10 min),取上清液并立即储存在-80 ℃待测。
1.5 胃排空率测定
采用营养性半固体糊灌胃法测定胃排空率[15]。大鼠禁食不禁水24 h后,按体重灌胃3 mL/kg半固体糊制剂(羧甲基纤维素钠10 g、全脂奶粉16 g、淀粉8 g、蒸馏水200 g)。30 min后处死大鼠,取血后解剖大鼠,解剖取完整胃,洗净胃内容物后称量胃净重并测定胃排空率,胃排空率的计算如公式(1)所示:
胃排空率![]()
(1)
1.6 血清胃肠激素测定
大鼠血清中胃泌素(gastrin,GAS)、胃动素(motilin,MTL)和饥饿素含量的测定,参照ELISA试剂盒说明书步骤进行操作。
1.7 胃液总酸、游离酸和胃蛋白酶测定
参照林飞等[16]方法测定胃液总酸、游离酸和胃蛋白酶活力。每组取3只大鼠在处死前4 h用异氟烷麻醉,打开腹腔,结扎幽门部,再逐层缝合关闭腹腔,处死时结扎贲门后取完整胃,沿胃大弯处剪开,收集胃内容物,离心(3 000×g,10 min)后得到澄清胃液。采用酸碱中和滴定法测定胃液游离酸和总酸度,同时计算游离酸排出速率,总酸/游离酸排出速率的计算如公式(2)所示:
总酸/游离酸排出速率/(mmol/h)![]()
(2)
取毛细玻璃管(10 mm×1 mm)注满蛋清后置于培养皿,85 ℃水浴加热使蛋白凝固以制备蛋白管(合格标准为管中无气泡、管壁光滑无污且置于水中凝固蛋白不分散)。取0.5 mL胃液加入具塞量筒中,加入7.5 mL HCl溶液(0.05 mol/L)摇匀,放入2根自制蛋白管,塞好瓶口于37 ℃孵育48 h后采用游标卡尺测量蛋白管两端透明长度,胃蛋白酶活力的计算如公式(3)所示:
胃蛋白酶活力/(U/mL)=透明长度2×16
(3)
1.8 胃窦组织干细胞因子(stem cell factor, SCF)和c-Kit原癌基因(c-Kit)表达测定
取适量胃窦组织,加入Trizol裂解液,冰上匀浆,提取组织总RNA。参照逆转录试剂盒方法合成cDNA,参照PCR检测试剂盒方法进行荧光定量分析。引物信息如表1所示。
表1 PCR引物信息
Table 1 The primer sequences for qPCR

基因名称引物序列(5’→3’)SCFForward5'-TGAGAAAGGGAAAGCC-3'Reverse5'-ATGGTGGTGAAGACGCCAGT-3'c-KitForward5'-ATCCAGCCCCACACCCTG-3'Reverse5'-TGTAGGCAAGAACCATCACAA-3'GAPDHForward5'-GGCACAGTCAAGGCTGAGAAT-3'Reverse5'-GGCTGGATTTGCTCTTTGCTGT-TAC-3'
1.9 数据统计分析
实验数据用SPSS 22.0进行分析处理,数据均以“平均值±标准误差”形式表示,采用GraphPad Prism 9.0软件进行制图,组间比较采用单因素方差分析(One-way ANOVA)。
2 结果与分析
2.1 植物乳植杆菌CN2018对大鼠体重和摄食量的影响
干预一周后大鼠体重和摄食量变化如图1所示。模型组体重增量和每日摄食量显著低于对照组(P<0.01和P<0.001)。与模型组相比,阳性药物干预显著提高了大鼠体重增量(P<0.05),对每日摄食量无明显影响。与模型组相比,CN2018组大鼠体重变化和每日摄食量无显著影响,表明植物乳植杆菌CN2018干预未能显著提高胃动力障碍大鼠的摄食量,未能恢复胃动力障碍导致的体重增长下降。

a-大鼠体重增量;b-摄食量
图1 植物乳植杆菌CN2018对大鼠体重增量和摄食量的影响
Fig.1 Effects of L.plantarum CN2018 on body weight gain and food intake in rats
注:##、###,表示与空白组相比差异显著(P<0.01、P<0.001);*,表示与模型组相比差异显著(P<0.05)(下同)。
2.2 植物乳植杆菌CN2018对大鼠胃排空率的影响
胃排空延迟是一种胃动力障碍的直观症状。如图2所示,模型组胃排空率显著低于对照组(P<0.001),表明L-精氨酸诱导的胃动力障碍使大鼠胃动力降低、胃排空减慢。与模型组相比,阳性药物组和CN2018组的胃排空率均显著升高(P<0.01和P<0.05)。胃动力障碍是功能性消化不良的发病机制,会造成胃排空延迟及肠蠕动减缓[17-18]。本研究发现,植物乳植杆菌CN2018能显著升高胃动力障碍大鼠的胃排空率,表明其能有效增加胃蠕动,从而改善胃肠动力障碍。
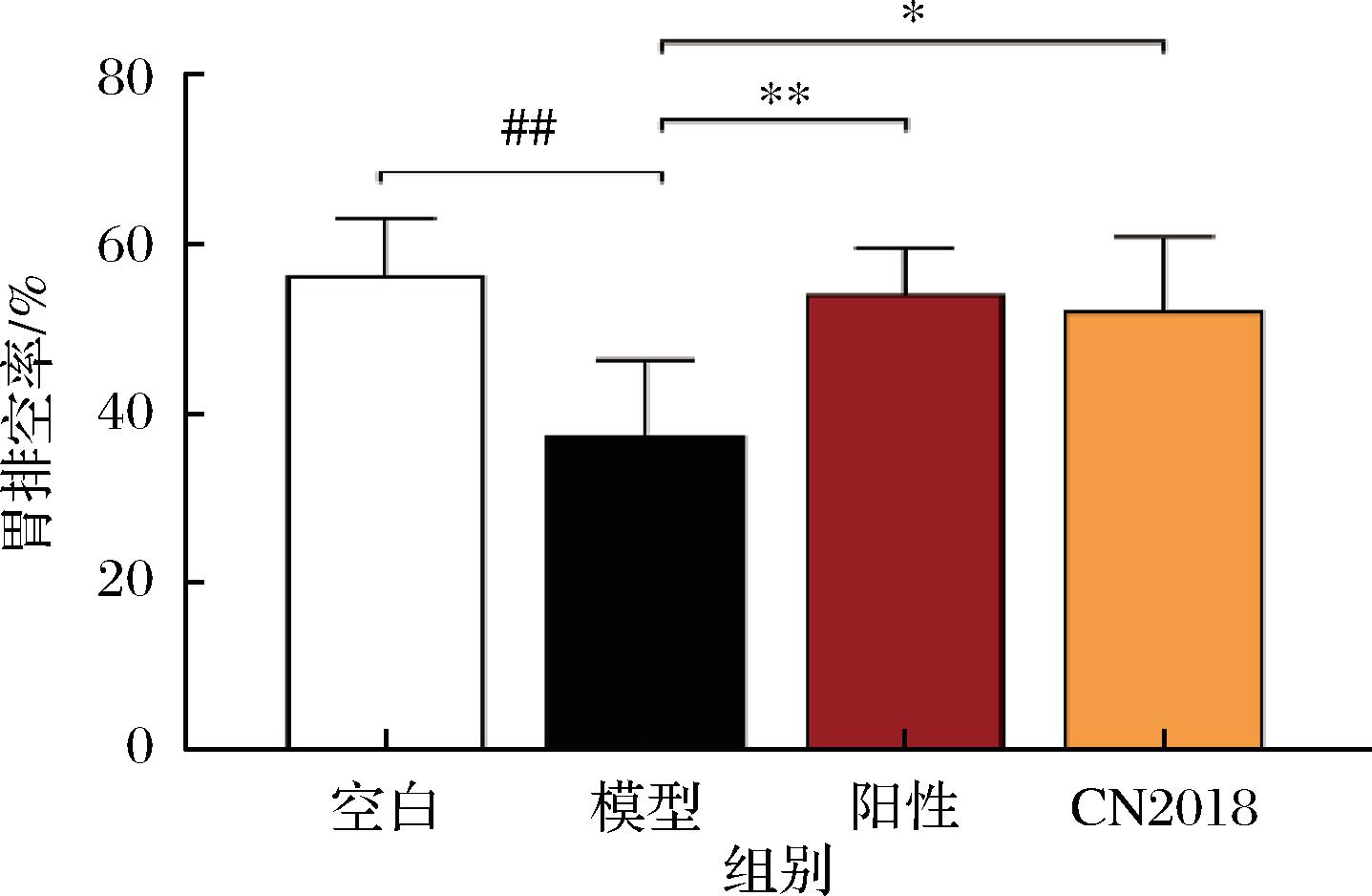
图2 植物乳植杆菌CN2018对大鼠胃排空率的影响
Fig.2 Effects of L.plantarum CN2018 on the gastric emptying rate in rats
注:*、**,表示与模型组相比差异显著(P<0.05,P<0.01)(下同)。
2.3 植物乳植杆菌CN2018对大鼠胃液总酸、游离酸和胃蛋白酶的影响
胃酸和胃蛋白酶是胃液的主要成分,对食物的消化起决定性作用。胃酸主要由胃窦G细胞GAS刺激产生,具有杀菌、促进消化和吸收等功能[19]。但胃酸过度分泌可能引起胃动力不足、延缓胃排空,甚至造成黏液屏障受损、引发消化性溃疡等[20]。与对照组相比,模型组胃液量和游离酸排出速率显著降低(P<0.01和P<0.05),但对总酸浓度、游离酸浓度和总酸排出速率等指标无显著影响(表2)。与模型组相比,阳性药物组胃液量、游离酸排出速率和胃蛋白酶活性有上升趋势,总酸和游离酸浓度及总酸排出速率略微下降。模型组胃蛋白酶活性显著低于对照组(P<0.01),与杨伟金等[18]研究一致。胃蛋白酶是胃中主要消化酶,在低pH时被激活,在pH值为1~6时具有活性,最大活性在1.5~2.5[21]。CN2018组大鼠胃液量、总酸排出速率和游离酸排出速率,以及胃蛋白酶活性略高于模型组,总酸和游离酸浓度略低于模型组,但差异不显著。由2.2节可知,植物乳植杆菌CN2018具有改善大鼠胃动力障碍的作用,但并未显著增加胃液量、胃酸排出速率和胃蛋白酶活性及降低胃酸分泌,说明植物乳植杆菌CN2018改善胃动力障碍并非通过调节胃酸和胃蛋白酶来实现。
表2 植物乳植杆菌CN2018对大鼠胃液量、胃液总酸/游离酸浓度、游离酸排出速率及胃蛋白酶活性的影响
Table 2 Effects of L.plantarumCN2018 on gastric fluid volume, gastric concentration of total acid/free acid, free acid excretion rate, and pepsin activity in rats
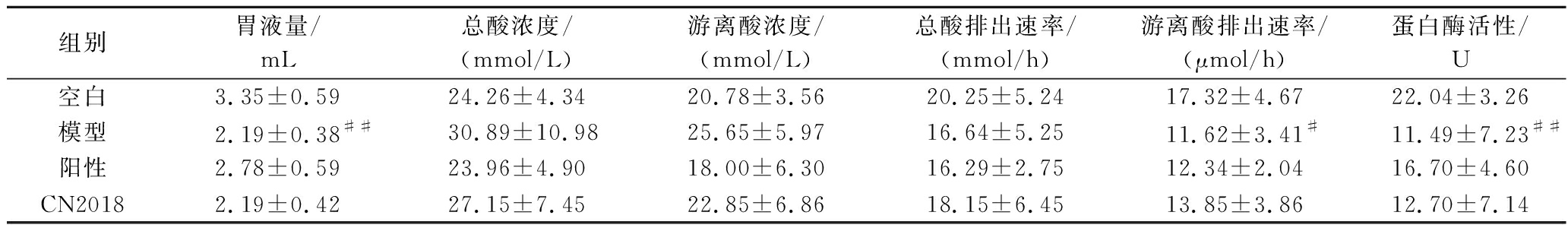
组别胃液量/mL总酸浓度/(mmol/L)游离酸浓度/(mmol/L)总酸排出速率/(mmol/h)游离酸排出速率/(μmol/h)蛋白酶活性/U空白3.35±0.5924.26±4.3420.78±3.5620.25±5.2417.32±4.6722.04±3.26模型2.19±0.38##30.89±10.9825.65±5.9716.64±5.2511.62±3.41#11.49±7.23##阳性2.78±0.5923.96±4.9018.00±6.3016.29±2.7512.34±2.0416.70±4.60CN20182.19±0.4227.15±7.4522.85±6.8618.15±6.4513.85±3.8612.70±7.14
注:#、##分别表示与空白组相比差异显著(P<0.05,P<0.01)。
2.4 植物乳植杆菌CN2018对大鼠胃肠激素的影响
饥饿素、MTL和GAS,是常见的胃肠激素。本研究中大鼠血清胃肠激素含量如图3所示,与对照组相比,模型组大鼠血清饥饿素、MTL和GAS含量均显著下降(P<0.001);与模型组相比,阳性药物和CN2018均显著升高了胃肠激素饥饿素和GAS含量(P<0.05或0.01),然而两者对大鼠血清MTL含量无显著影响。

a-饥饿素;b-MTL;c-GAS
图3 植物乳植杆菌CN2018对大鼠血清胃肠激素的影响
Fig.3 Effects of L.plantarum CN2018 on serum gastrointestinal hormones in rats
本研究中,饥饿素和MTL分泌的降低是导致胃动力障碍大鼠胃排空滞后的主要原因。植物乳植杆菌CN2018显著增加胃肠激素饥饿素,从而增加了胃排空率(图3-a)。本研究中模型组GAS显著低于对照(图3-c)而胃酸浓度却显著增加(表2),可能是因为除胃泌素外,胃酸的分泌还受旁分泌(组胺、生长抑素)和神经(乙酰胆碱)等因素的调节[22]。由此可见,植物乳植杆菌CN2018可以改善大鼠胃动力障碍,与其调节饥饿素和GAS有关。
2.5 植物乳植杆菌CN2018对大鼠胃窦组织c-Kit和SCFmRNA的影响
SCF/c-Kit信号通路是影响胃肠道蠕动的主要因素,是胃动力障碍发病机制。c-Kit是一种由ICC细胞表达的跨膜酪氨酸激酶受体,可调节胃肠道收缩[23]。SCF的表达可以增加ICC的数量并修复这些细胞的结构损伤,从而增强胃肠蠕动[24]。研究表明,胃组织中SCF和c-Kit表达下降会导致ICC超微结构损伤和胃排空延迟[24]。在本研究中,模型组胃组织c-Kit和SCF的表达显著低于对照组(表3,P<0.01和P<0.001),表明胃肠蠕动受阻,胃排空降低。与模型组相比,阳性药物和CN2018干预后,大鼠胃窦组织c-Kit和SCF的表达水平均显著升高(P<0.05)。由2.2节和2.4节可知,植物乳植杆菌CN2018提高了胃排空率,促进饥饿素和GAS的分泌,结合2.5节研究结果,植物乳植杆菌CN2018改善胃动力障碍可能与其激活了SCF/c-Kit信号通路有关。
表3 植物乳植杆菌CN2018对大鼠胃窦组织c-Kit和SCF基因表达的影响
Table 3 Effects of L.plantarumCN2018 on mRNA levels of c-Kitand SCFin gastric sinus of rats

组别c-Kit mRNASCF mRNA空白1.01±0.181.04±0.29模型0.28±0.09##0.19±0.06###阳性0.53±0.10*0.54±0.13*CN20180.60±0.11*0.45±0.07*
注:##、###,分别表示与空白组相比差异显著(P<0.01,P<0.001);*表示与模型组相比差异显著(P<0.05)。
3 结论
本研究使用经典的大鼠胃动力障碍模型,发现植物乳植杆菌CN2018可促进胃排空,并具有增加胃液量、胃酸排出速率和胃蛋白酶活性及降低胃酸分泌的趋势。同时,植物乳植杆菌CN2018可调节大鼠血清饥饿素和胃泌素的水平。进一步分析发现,植物乳植杆菌CN2018可通过激活SCF/c-Kit信号通路来调节胃肠蠕动并促进胃排空。由此可见,植物乳植杆菌CN2018是一株有潜力的促胃动力益生菌。前期研究已经证实植物乳植杆菌CN2018具有抗幽门螺杆菌感染的能力,二者之间可能具有一定的相关性。综合以上研究结果,植物乳植杆菌CN2018在改善胃部健康方面具有广泛的应用前景。然而,本文对改善胃动力机制的研究不够深入,未来也可开展人群试吃试验评估植物乳植杆菌CN2018在改善人群胃动力方面的效果。
[1] WANG X, ZHANG C, ZHENG M Y, et al.Metabolomics analysis of L-arginine induced gastrointestinal motility disorder in rats using UPLC-MS after magnolol treatment[J].Frontiers in Pharmacology, 2019, 10:183.
[2] CAMILLERI M, ATIEH J.New developments in prokinetic therapy for gastric motility disorders[J].Frontiers in Pharmacology, 2021, 12:711500.
[3] COATE K C, KLIEWER S A, MANGELSDORF D J.SnapShot:Hormones of the gastrointestinal tract[J].Cell, 2014, 159(6):1478.
[4] SPENCER N J, HU H Z.Enteric nervous system:Sensory transduction, neural circuits and gastrointestinal motility[J].Nature Reviews.Gastroenterology &Hepatology, 2020, 17(6):338-351.
[5] GIUDICESSI J R, ACKERMAN M J, CAMILLERI M.Cardiovascular safety of prokinetic agents:A focus on drug-induced arrhythmias[J].Neurogastroenterology &Motility, 2018, 30(6):e13302.
[6] MARGOLIS K G, CRYAN J F, MAYER E A.The microbiota-gut-brain axis:From motility to mood[J].Gastroenterology, 2021, 160(5):1486-1501.
[7] WACLAWIKOV B, CODUTTI A, ALIM K, et al.Gut microbiota-motility interregulation:Insights from in vivo, ex vivo and in silico studies[J].Gut Microbes, 2022, 14(1):1997296.
B, CODUTTI A, ALIM K, et al.Gut microbiota-motility interregulation:Insights from in vivo, ex vivo and in silico studies[J].Gut Microbes, 2022, 14(1):1997296.
[8] ZHENG Z P, TANG J Y, HU Y N, et al.Role of gut microbiota-derived signals in the regulation of gastrointestinal motility[J].Frontiers in Medicine, 2022, 9:961703.
[9] SUI S J, TIAN Z B, WANG Q C, et al.Clostridium butyricum promotes intestinal motility by regulation of TLR2 in interstitial cells of Cajal[J].European Review for Medical and Pharmacological Sciences, 2018, 22(14):4730-4738.
[10] CHANDRASEKHARAN B, SAEEDI B J, ALAM A, et al.Interactions between commensal bacteria and enteric neurons, via FPR1 induction of ROS, increase gastrointestinal motility in mice[J].Gastroenterology, 2019, 157(1):179-192.
[11] ZHANG L M, ZENG J, MA Y Y, et al.Effects of Synbiotic2000TM forte on the intestinal motility and interstitial cells of Cajal in TBI mouse model[J].Probiotics and Antimicrobial Proteins, 2017, 9(2):172-181.
[12] INDRIO F, RIEZZO G, RAIMONDI F, et al.Lactobacillus reuteri accelerates gastric emptying and improves regurgitation in infants[J].European Journal of Clinical Investigation, 2011, 41(4):417-422.
[13] INDRIO F, RIEZZO G, GIORDANO P, et al.Effect of a partially hydrolysed whey infant formula supplemented with starch and Lactobacillus reuteri DSM 17938 on regurgitation and gastric motility[J].Nutrients, 2017, 9(11):1181.
[14] 陈卫, 田丰伟, 陈晓华, 等.一种抗幽门螺杆菌感染的植物乳杆菌及其用途:中国, ZL 201110059827.6[P].2011-09-07.CHEN W, TIAN F W, CHEN X H, et al.A strain of Lactobacillus plantarum capable of resisting infection of Helicobacter pylori and its applications:China, ZL 201110059827.6[P].2011-09-07.
[15] DENG Y Z, ZHOU X Y, XIANG X C, et al.Effect of miRNA-19a on gastrointestinal motility in rats with functional dyspepsia[J].Experimental and Therapeutic Medicine, 2018, 15(6):4875-4879.
[16] 林飞, 梁怿, 吕廉, 等.富硒大蒜对实验动物上消化道的刺激作用及对胃液成分的影响[J].癌变·畸变·突变, 2008, 20(4):275-278.LIN F, LIANG Y, LU L, et al.Selenium-enriched garlic on the gastric juice components and upper gastrointestinal tract stimulation in experimental animal[J].Carcinogenesis, Teratogenesis &Mutagenesis, 2008, 20(4):275-278.
[17] XIAO Z L, XU J, TAN J, et al.Zhizhu Kuanzhong, a traditional Chinese medicine, alleviates gastric hypersensitivity and motor dysfunction on a rat model of functional dyspepsia[J].Frontiers in Pharmacology, 2022, 13:1026660.
[18] 杨伟金, 杨明华, 陈婉姬.小儿健脾膏对胃动力障碍大鼠胃肠组织中胃动素m RNA和蛋白表达的影响[J].中国现代应用药学, 2021, 38(21):2654-2658.YANG W J, YANG M H, CHEN W J.Effect of Xiao’er Jianpi plaster on motilin mRNA and protein expression in stomach and intestine of rats with gastric motility disorder[J].Chinese Journal of Modern Applied Pharmacy, 2021, 38(21):2654-2658.
[19] SCHUBERT M L.Physiologic, pathophysiologic, and pharmacologic regulation of gastric acid secretion[J].Current Opinion in Gastroenterology, 2017, 33(6):430-438.
[20] 邓葵, 刘纯伦.胃酸与功能性消化不良[J].胃肠病学和肝病学杂志, 2016, 25(9):1058-1061.DENG K, LIU C L.Gastric acid and functional dyspepsia[J].Chinese Journal of Gastroenterology and Hepatology, 2016, 25(9):1058-1061.
[21] DEL RIO A R, KEPPLER J K, BOOM R M, et al.Protein acidification and hydrolysis by pepsin ensure efficient trypsin-catalyzed hydrolysis[J].Food &Function, 2021, 12(10):4570-4581.
[22] ARIN R M, GOROSTIDI A, NAVARRO-IMAZ H, et al.Adenosine:Direct and indirect actions on gastric acid secretion[J].Frontiers in Physiology, 2017, 8:737.
[23] RICH A, MILLER S M, GIBBONS S J, et al.Local presentation of Steel factor increases expression of c-kit immunoreactive interstitial cells of Cajal in culture[J].American Journal of Physiology.Gastrointestinal and Liver Physiology, 2003, 284(2):G313-G320.
[24] ZHENG X W, ZHANG Y X, TAN Y F, et al.Alpinia officinarum Hance extract ameliorates diabetic gastroparesis by regulating SCF/c-kit signaling pathway and rebalancing gut microbiota[J].Fitoterapia, 2024, 172:105730.