近年来,在“健康中国2030”和“国民营养计划”等国家战略的推动下,人们逐步树立起大健康理念,治未病意识逐渐增强[1]。益生菌作为活的微生物,能够为宿主健康带来许多益处[2]。越来越多的证据表明,肠道微生物群除了维持肠道健康外,还与几种免疫、代谢和精神疾病密切相关[3]。因此,使用益生菌来调节肠道微生物群以及维持机体健康是一个颇具研究价值的领域[4]。目前,随着对益生菌研究的深入,益生菌的更多功能被挖掘,特别是在增强人体免疫力方面拥有广阔的前景[5]。众多研究表明,益生菌具有调节人体免疫的功能,对人体健康发育有着积极影响[6]。益生菌不仅可以调节肠道局部免疫,还可以对其他系统发挥双向免疫调节作用[7]。具有免疫调节作用的常见益生菌有乳杆菌、链球菌和双歧杆菌等[8]。其中乳酸菌对维持人体健康发挥着重要作用,研究发现,乳酸菌能够直接或间接地调节肠道菌群来改善宿主的免疫功能[9]。
植物乳植杆菌(Lactiplantibacillus plantarum)作为一种重要的乳酸杆菌,通常作为发酵剂用于乳制品、肉类和蔬菜的发酵,具有提高机体的抗氧化活性、抑制有害微生物生长的特性[10]。植物乳植杆菌在动物肠道中广泛分布,不仅可以维持肠道微生态平衡,还能产生营养因子促进机体生长发育[11]。此外,由于益生菌对病原体的竞争性抑制,最终会对肠道和整个身体系统产生免疫调节作用[12]。最近有研究表明,新型益生菌嗜黏蛋白阿克曼菌具有免疫调节作用,并有利于促进紧密连接[13];植物乳植杆菌CCFM8661可以通过影响与便秘相关神经递质的传递起到缓解便秘的效果,使便秘小鼠粪便中乙酸含量升高,降低便秘引起的相关炎症[14]。对免疫治疗干预的研究表明,益生菌可增加抗体的产生,最终抵御病原体的侵袭[15];并且益生菌与树突状细胞的直接相互作用、吞噬活性的调节以及细胞因子对结肠炎症的上调也得到了报道[16]。研究还表明,益生菌能够增加黏液分泌,同时抑制病原体与上皮细胞表面的结合,还参与了炎症细胞因子的下调,以维持屏障功能[17]。但是目前,关于植物乳植杆菌CCFM8661改善免疫的研究非常有限。
环磷酰胺(cyclophosphamide,CTX)作为一种抗肿瘤化疗药物,会抑制动物的体液和细胞免疫应答,常用于制备动物免疫抑制模型。本实验通过给小鼠注射CTX建立免疫低下模型,然后给小鼠灌服植物乳植杆菌CCFM8661,通过检测其对小鼠体质量、胸腺及脾脏指数、细胞免疫功能、体液免疫和非特异性免疫的影响,评价植物乳植杆菌CCFM8661的免疫调节功能,为益生菌产品的高效应用以及保健食品的开发提供有价值的理论基础。
1 材料与方法
1.1 材料与仪器
植物乳植杆菌CCFM8661菌粉,微康生物科技有限公司;SPF级雄性BALB/c小鼠,年龄6~8周,体质量18~22 g,辽宁长生生物技术股份有限公司,动物许可证号:SCXK(辽)2020-0001。小鼠饲养环境:室温20~23 ℃,模仿室外12 h明暗交替照明,饲养期间自由饮水、进食。实验过程中所有动物操作均按照黑龙江中医药大学《实验动物管理条例》进行,经黑龙江中医药大学动物伦理委员会批准。
绵羊红细胞(sheep red blood cell,SRBC),玉环市南方试剂有限公司;细胞培养液、胎牛血清,美国Gibco公司;刀豆蛋白A(ConA),美国Sigma公司;小鼠荧光单抗CD3-FITC(100203)、CD4-PE-Cy7(100527)、CD8a-APC(100711)、NK-1.1-PE(108707),安诺论(北京)生物科技有限公司;Hank’s平衡盐溶液(PWL056_A),大连美仑生物技术有限公司;磺基水杨酸(sulfosalicylic acid,SA)缓冲液(IH0065),北京雷根生物技术有限公司;RPMI 1640培养液(C0893-100 mL)、Giemsa染液(C0133-100 mL)、磷酸缓冲盐溶液(ST447-1L)、CCK-8试剂盒(C0037),上海碧云天生物技术股份有限公司。
游标卡尺(精密度0.02 mm),哈尔滨量具刃具集团有限责任公司;MLS-3751L-PC高压蒸汽灭菌器、MDF-382E型-80 ℃冰箱,日本Panasonic公司;SORVALL ST8/8R低温离心机,美国TOMOS公司;SMATBCD Synergy MX全自动酶标仪,美国BIOTEK公司。
1.2 试验方法
1.2.1 动物实验
60只BALB/c小鼠饲养于动物房中,温度22 ℃,湿度10%~60%,每日12 h照明,12 h黑暗,饲料适应性喂养1周,自由饮水。适应性喂养结束后,实验动物将被随机分成5组,每组12只:阴性对照组(normal control,NC)、模型组(model control,MC)、CCFM8661低剂量组(1.5×106 CFU/只)、CCFM8661中剂量组(1.5×107 CFU/只)、CCFM8661高剂量组(1.5×108 CFU/只);在第1~3天,对照组腹腔注射生理盐水,模型组和益生菌干预组小鼠分别腹腔注射100 μL CTX(40 mg/kg),建立免疫功能低下小鼠模型。具体分组可见表1。
表1 小鼠分组及饲养方法
Table 1 Mice grouping and rearing methods
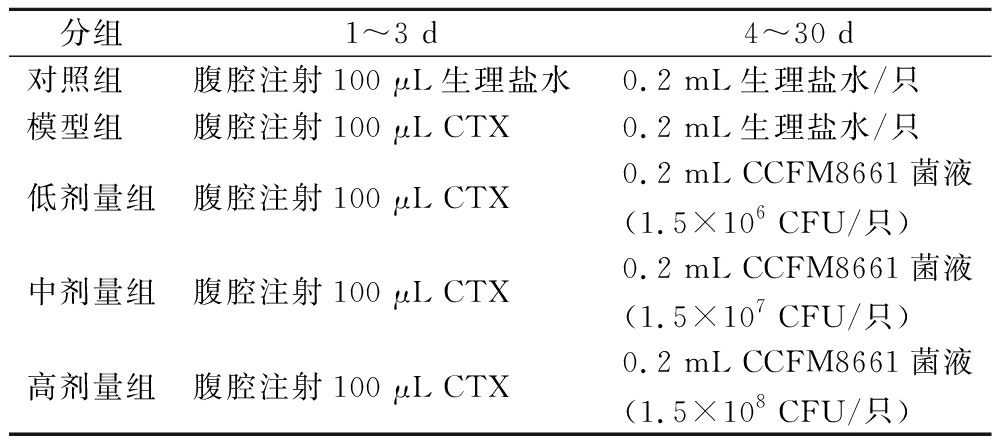
分组1~3 d4~30 d对照组腹腔注射100 μL生理盐水0.2 mL生理盐水/只模型组腹腔注射100 μL CTX0.2 mL生理盐水/只低剂量组腹腔注射100 μL CTX0.2 mL CCFM8661菌液(1.5×106 CFU/只)中剂量组腹腔注射100 μL CTX0.2 mL CCFM8661菌液(1.5×107 CFU/只)高剂量组腹腔注射100 μL CTX0.2 mL CCFM8661菌液(1.5×108 CFU/只)
1.2.2 小鼠体质量、胸腺和脾脏指数的测定
在实验第1天和第30天灌胃结束后称量每组12只小鼠体质量。在实验第30天灌胃给药12 h后,所有小鼠通过颈椎脱臼处死并去除胸腺和脾脏,除去水分后进行称质量,计算胸腺指数和脾脏指数(胸腺或脾脏质量与身体质量的比值)。
1.2.3 小鼠细胞免疫相关指标测定
1.2.3.1 脾淋巴细胞增殖的测定
在实验第30天灌胃给药12 h后,各组(n=12)小鼠处死,无菌取脾置于含有适量细胞培养液的无菌培养皿中,将脾研磨破碎并过滤2次,收集的细胞悬液离心并用红细胞裂解液去除红细胞。将细胞重复2次Hank’s洗液,每次1 000 r/min持续离心10 min。将细胞用1 mL完全培养液重悬并计数,使活细胞占95%以上并将细胞浓度调整至2×106个/mL。
将脾细胞悬液(2×106个/mL)接种在96孔板中,每孔200 μL。接着每孔再加入20 μL ConA,使其终质量浓度为5 μg/mL,并放置在37 ℃、5% CO2的培养箱中培养48 h。然后向每孔中加入20 μL CCK-8溶液,轻轻晃动培养板,继续培养4 h。最后,使用酶标仪测定450 nm处的吸光度,以此表示增殖能力。
1.2.3.2 迟发型变态反应(delayed type hypersensitivity,DTH)
在实验前4 d,每天向小鼠腹腔注射0.2 mL质量分数2%的SRBC以激发其致敏免疫反应。在处死小鼠前1 d使用游标卡尺测量每组小鼠的左后足趾的厚度,然后每只小鼠通过皮下注射20 μL SRBC再次激发小鼠的足趾部位。注射24 h后,用游标卡尺再次测量每只小鼠的左后足趾厚度。
1.2.4 小鼠体液免疫相关指标测定
1.2.4.1 抗体生成细胞检测
提取绵羊静脉血制备SRBC受体;将1 mL的SRBC压积加入到5 mL豚鼠血清中,离心取上清液后用SA缓冲液进行稀释,稀释比例在1∶8~1∶15;取一块干净的玻片并涂上一层琼脂糖后晾干;脱纤维的羊血用生理盐水进行清洗,清洗完2 000 r/min离心10 min,重复3次,然后进行细胞计数;使用5×107~2×108 个SRBC对小鼠进行腹腔注射;在小鼠产生免疫后的4~5 d,将小鼠通过颈椎处死,并取出脾脏放在含有Hank’s液的平皿里进行研磨;将制成的细胞悬液进行过滤,并用Hank’s液洗涤2次;最后使用5 mL 1640培养液将细胞重悬,并进行细胞计数,最终将细胞浓度调整为5×106 个/mL。
将表层培养基加热溶解,并放在45~50 ℃水浴中保温,使用相同体积的Hank’s液进行混合,然后使用EP管分装,向每支小管中加入50 μL体积分数为10%的SRBC和20 μL的脾细胞悬液,将其充分混合后均匀涂抹在已经涂了琼脂糖的玻片上制成平行片。待溶解的培养基凝固后,水平放置在CO2培养箱中孵育1~1.5 h,向玻片架上的凹槽里加入稀释过的SA缓冲液,并放置在CO2培养箱中继续孵育1~1.5 h,计算溶血空斑数。
1.2.4.2 血清溶血素的测定
将SRBC免疫4~5 d后的小鼠,摘除眼球取血,放置于离心管中约1 h,待血清析出后2 000 r/min离心10 min,收集离心后的血清。
设定样品孔和空白对照孔:样品孔中每孔加入50 μL稀释后的血清;空白对照孔中每孔加入50 μL的SA缓冲液,然后加入25 μL体积分数为10%的SRBC和50 μL补体。将样品孔和空白对照孔放置于37 ℃恒温培养箱中孵育30 min,使用冰浴终止反应后,在离心机中以1 500 r/min离心10 min。各取样品孔和空白孔上清液50 μL,加入新的96孔板中,每孔中再加入150 μL都氏试剂。同时,设定一半数量的溶血孔,每孔加入12.5 μL体积分数为10%的SRBC,再加入都氏试剂,使总体积为200 μL。使用振荡器使溶液充分混合,静置10 min后,测定其在540 nm处的光密度值。
溶血素数量用半数溶血值HC50表示,计算如公式(1)所示。本实验中,样品组的HC50只有在显著高于对照组的HC50时,实验结果才可以判定为阳性。
![]() 稀释倍数
稀释倍数
(1)
1.2.5 小鼠非特异免疫相关指标测定
1.2.5.1 小鼠碳廓清实验
在实验第30天,灌胃给药12 h后,根据小鼠的体质量按照10 mL/kg从尾静脉注射稀释过的印度墨汁,注射完成后进行计时。注射墨水后第2、10分钟各从内眦部静脉中抽取20 μL血液,并立即添加至含2 mL 1 g/L Na2CO3的溶液。使用分光光度计,在600 nm的波长下测量光密度,Na2CO3溶液作为空白对照。
取出处死小鼠的肝脏和脾脏,用滤纸吸干其表面血迹,并进行称质量。
按照公式(2)和公式(3)计算吞噬指数α,并表示小鼠的碳廓清能力。该实验结果只有样品组的吞噬指数α显著高于对照组时才判定为阳性。
(2)
(3)
1.2.5.2 小鼠腹腔巨噬细胞吞噬鸡红细胞实验
取鸡血放置于锥形瓶中,并用生理盐水清洗2~3次,2 000 r/min离心10 min,取上清液用生理盐水重悬,制成体积分数为20%的细胞悬液。在实验第30天,灌胃给药12 h后,将制备的鸡红细胞悬液按照每只小鼠1 mL进行腹腔注射。腹腔注射完成1 h后,将小鼠颈椎脱臼处死,将小鼠仰卧位放置,切开腹壁,静脉注射2 mL生理盐水,旋转平板1 min。取1 mL腹腔冲洗液,均匀地置于2块玻片上,置于垫有湿纱布的搪瓷盒子中,转移到37 ℃温箱中孵育30 min。孵育完成后,用生理盐水冲洗,去除不贴附的细胞,晾干后用体积比为1∶1的丙酮-甲醇溶液固定,用4%(体积分数)Giemsa-磷酸缓冲液进行3 min的染色,然后用蒸馏水冲洗干燥。
在油镜下对巨噬细胞进行计数,每张片计数100个,吞噬百分率和吞噬指数按公式(4)、公式(5)计算:
吞噬百分率![]()
(4)
吞噬指数![]()
(5)
1.2.5.3 自然杀伤(natural killer,NK)细胞活性检测
在实验第30天灌胃给药12 h后,按1.2.3.1节方法制备脾淋巴细胞作为效应细胞,YAC-1细胞系作为靶细胞。将效应细胞(1×107 细胞/孔)和靶细胞(1×105 细胞/孔)(孔A)按照每孔100 μL接种于96孔板中。即分别将100 μL/孔效应细胞和靶细胞单独与100 μL/孔细胞培养基共培养(分别记作B、C孔),将96孔板放置在含5% CO2、温度37 ℃的培养箱内孵育24 h,然后每孔加入15 μL CCK-8溶液,轻轻晃动孔板,使其混合均匀,在培养箱中继续孵育2 h,使用酶标仪测定450 nm处的吸光度。NK细胞活性的计算如公式(6)所示:
NK细胞活性![]()
(6)
式中:A、B、C为各孔的吸光度。
1.3 数据统计及分析
使用SPSS统计软件,实验数据结果用“平均数±标准差”表示,采用单因素方差分析进行数据处理,实验组每组和模型组进行比较,模型组与对照组比较,P<0.05具有显著性差异。
2 结果与分析
2.1 CCFM8661对小鼠体质量的影响
如表2所示,模型组终末体质量显著低于对照组(P<0.05),表明CTX免疫抑制模型建造成功;与模型组相比,低、中、高剂量组CCFM8661小鼠体质量增量均显著提高(P<0.05),分别提高了6.36%、9.01%和15.41%。这表明高剂量组CCFM8661对免疫低下小鼠体质量的恢复和增长有最好的效果。
表2 CCFM8661对小鼠体质量的影响
Table 2 Effect of CCFM8661 on body weight of mice
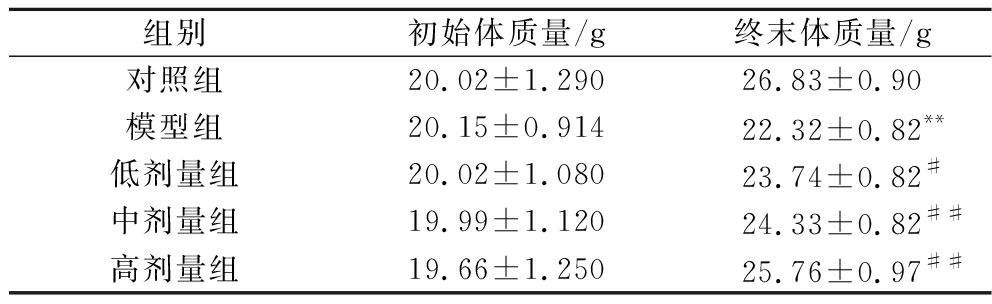
组别初始体质量/g终末体质量/g对照组20.02±1.29026.83±0.90模型组20.15±0.91422.32±0.82**低剂量组20.02±1.08023.74±0.82#中剂量组19.99±1.12024.33±0.82##高剂量组19.66±1.25025.76±0.97##
注:*P<0.05,**P<0.01,与对照组相比;#P<0.05,##P<0.01,与模型组对比。
2.2 CCFM8661对小鼠免疫器官指数的影响
人体的整体免疫水平可以用胸腺指数和脾脏指数来表示[18]。如图1所示,与对照组相比,模型组的胸腺指数和脾脏指数均有降低,具有显著性差异(P<0.01)。与模型组相比,低、中、高剂量组CCFM8661小鼠胸腺指数和脾脏指数均有提升,具有显著性差异。有趣的是,CCFM8661中、高剂量组明显比低剂量组有利于提高胸腺指数;此外,CCFM8661高剂量组的脾脏指数显著高于模型组(P<0.01),与对照组无显著差异。结果表明,灌胃CCFM8661可以促进免疫力低下小鼠免疫器官的恢复和发育,进而改善机体的免疫功能,中、高剂量组效果最佳。
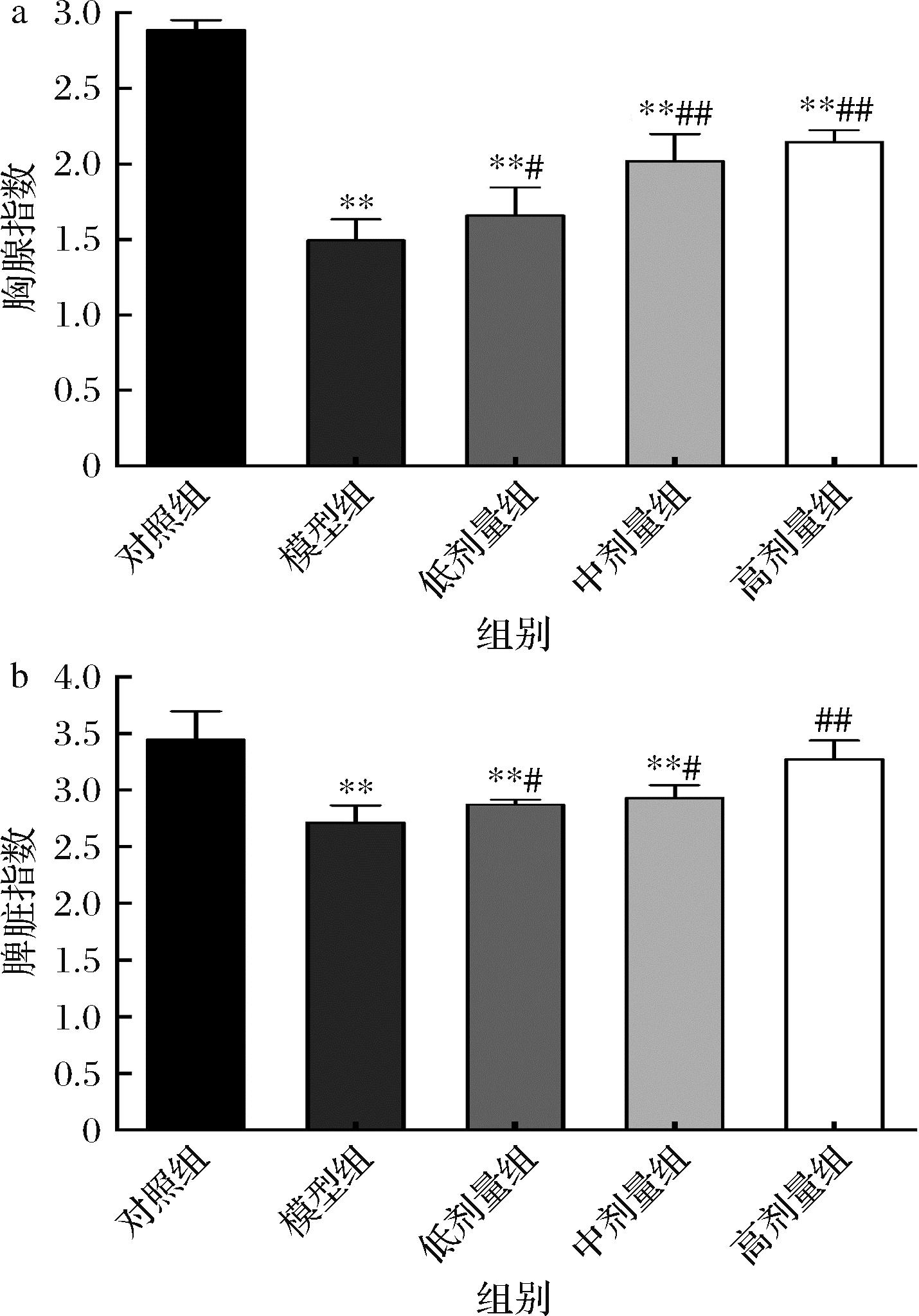
a-胸腺指数;b-脾脏指数
图1 CCFM8661对小鼠胸腺和脾指数的影响
Fig.1 Effect of CCFM8661 on thymus and spleen index in mice
注:*P<0.05,**P<0.01,与对照组相比;#P<0.05,##P<0.01,与模型组相比(下同)。
2.3 CCFM8661对小鼠细胞免疫功能的影响
脾脏是人体最大的免疫器官,含有大量的淋巴细胞[19]。当宿主受到抗原的刺激时,淋巴细胞可以立即被激活,并开始增殖和分化[20]。ConA诱导的小鼠脾淋巴细胞转化实验结果如图2-a所示,与对照组相比,模型组吸光值显著下降(P<0.01),与模型相比,CCFM8661低、中、高剂量组吸光值显著增大(P<0.01)。结果表明灌胃CCFM8661在一定程度上可以提高脾淋巴增殖,低、中、高剂量组效果均较好。
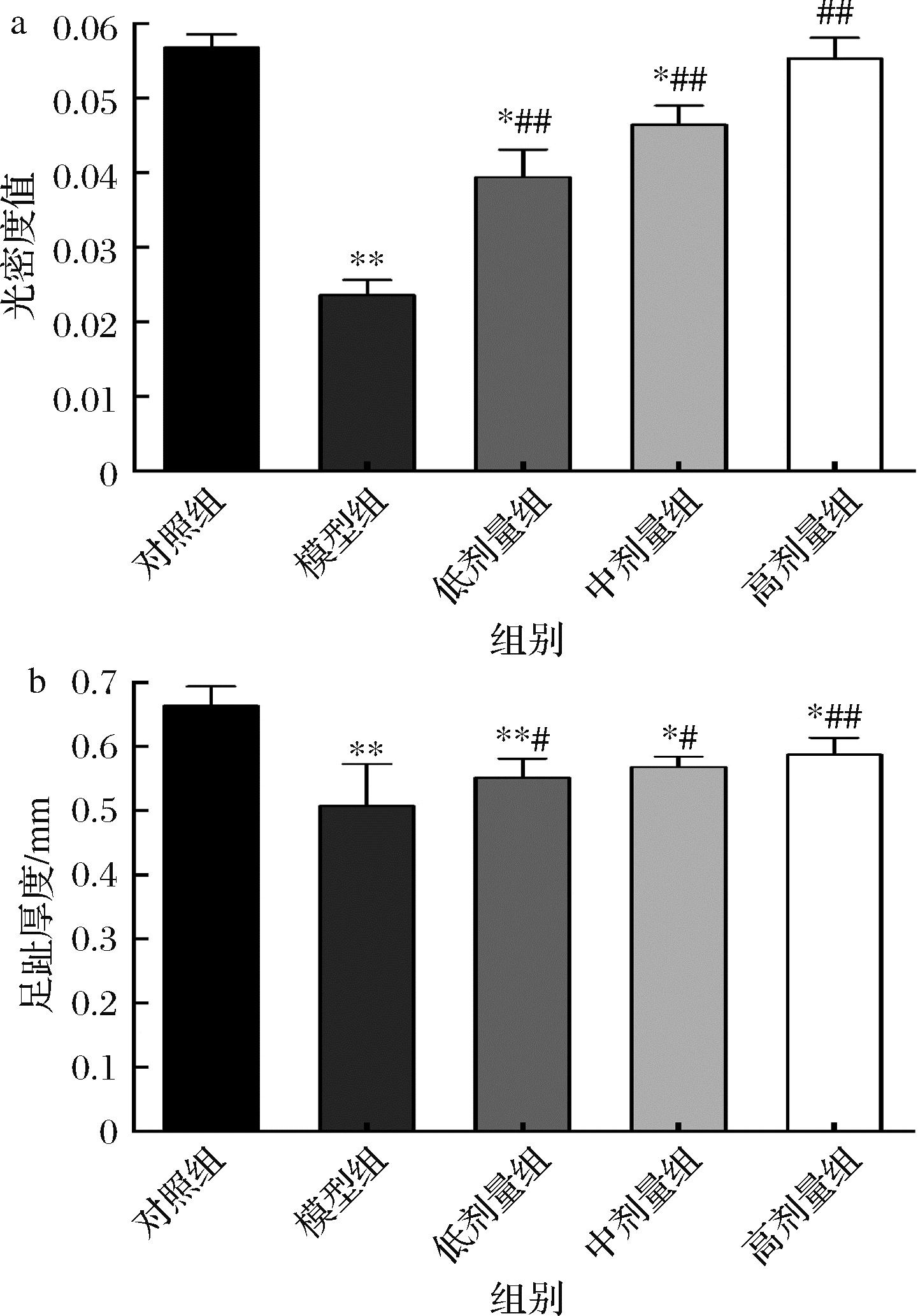
a-光密度值;b-足趾厚度
图2 CCFM8661对小鼠细胞免疫功能的影响
Fig.2 Effect of CCFM8661 on cellular immune function in mice
由图2-b可知,与对照组相比,模型组足趾厚度显著下降(P<0.01),与模型组相比,CCFM8661低、中、高剂量组足跖厚度均显著增大。值得一提的是,高剂量组相较于模型组的足跖厚度增加幅度较多。上述结果表明灌胃CCFM8661在一定程度上可以增强小鼠DTH,高剂量效果最好。
2.4 CCFM8661对小鼠体液免疫功能的影响
血清溶血素抗体积数和溶血空斑数被用来评价体液免疫[21]。抗体生成细胞检测结果表明(图3-a),与对照组相比,模型组溶血空斑数显著下降(P<0.01)。与模型组相比,低、中、高剂量组溶血空斑数显著性增加。由图3-b可知,与对照组相比,模型组抗体积数显著下降(P<0.01)。与模型组相比,CCFM8661低剂量组抗体积数显著增高(P<0.05),CCFM8661中、高剂量组与模型组相比,可以很好地增强抗体积数。因此,CCFM8661在一定程度上可以增强小鼠的体液免疫功能。
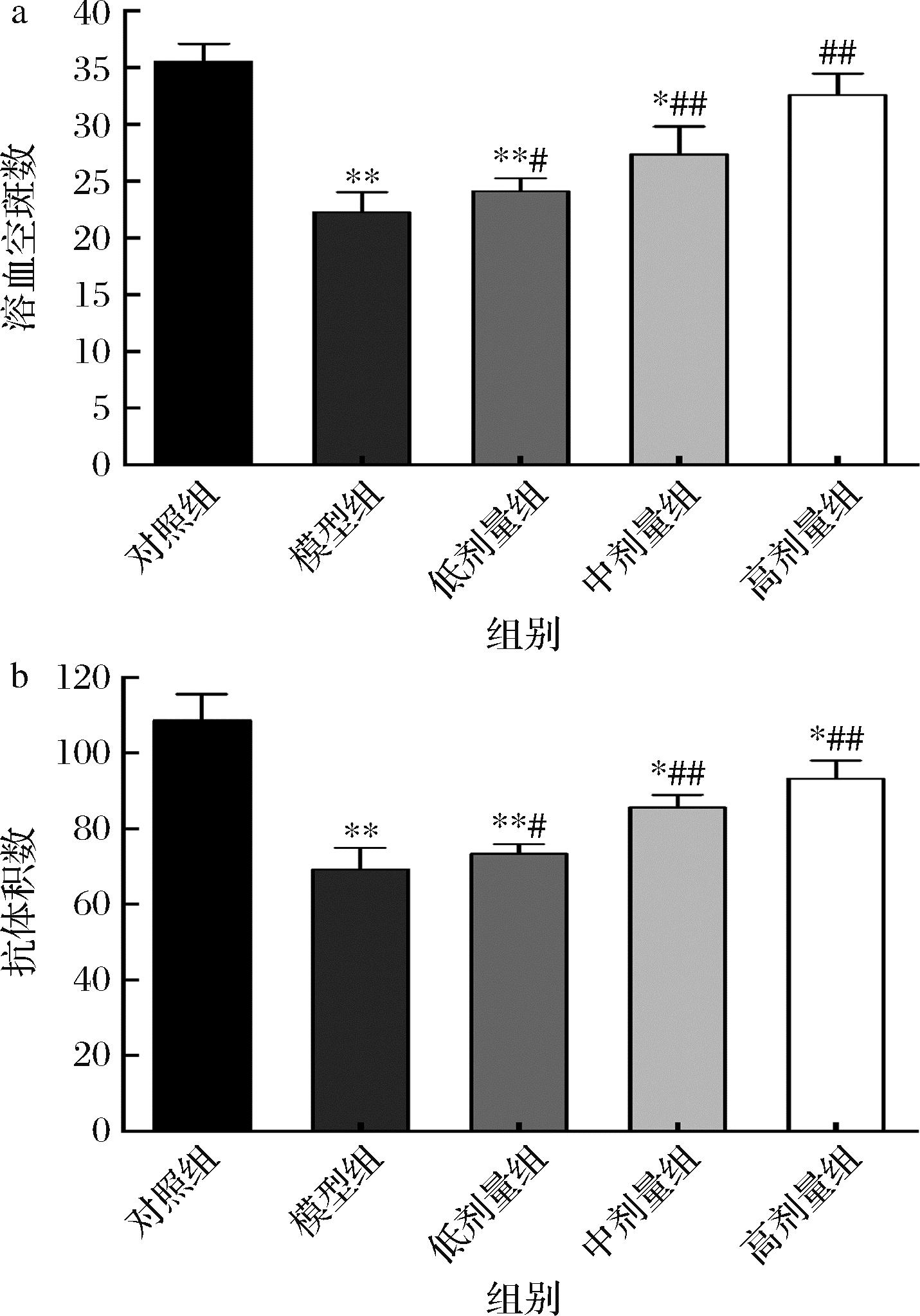
a-溶血空斑数;b-抗体积数
图3 CCFM8661对小鼠体液免疫功能的影响
Fig.3 Effect of CCFM8661 on humoral immune function in mice
2.5 CCFM8661对小鼠非特异性免疫的影响
非特异性免疫系统是抵抗抗原的第一道防线,它包括组织屏障(皮肤、黏膜、血脑、胎盘)、先天免疫细胞和先天免疫分子[22]。肠道微生物组可以通过维持和加强肠道屏障功能来增强宿主的非特异性免疫力[23]。CCFM8661对小鼠非特异性免疫的影响如图4所示。
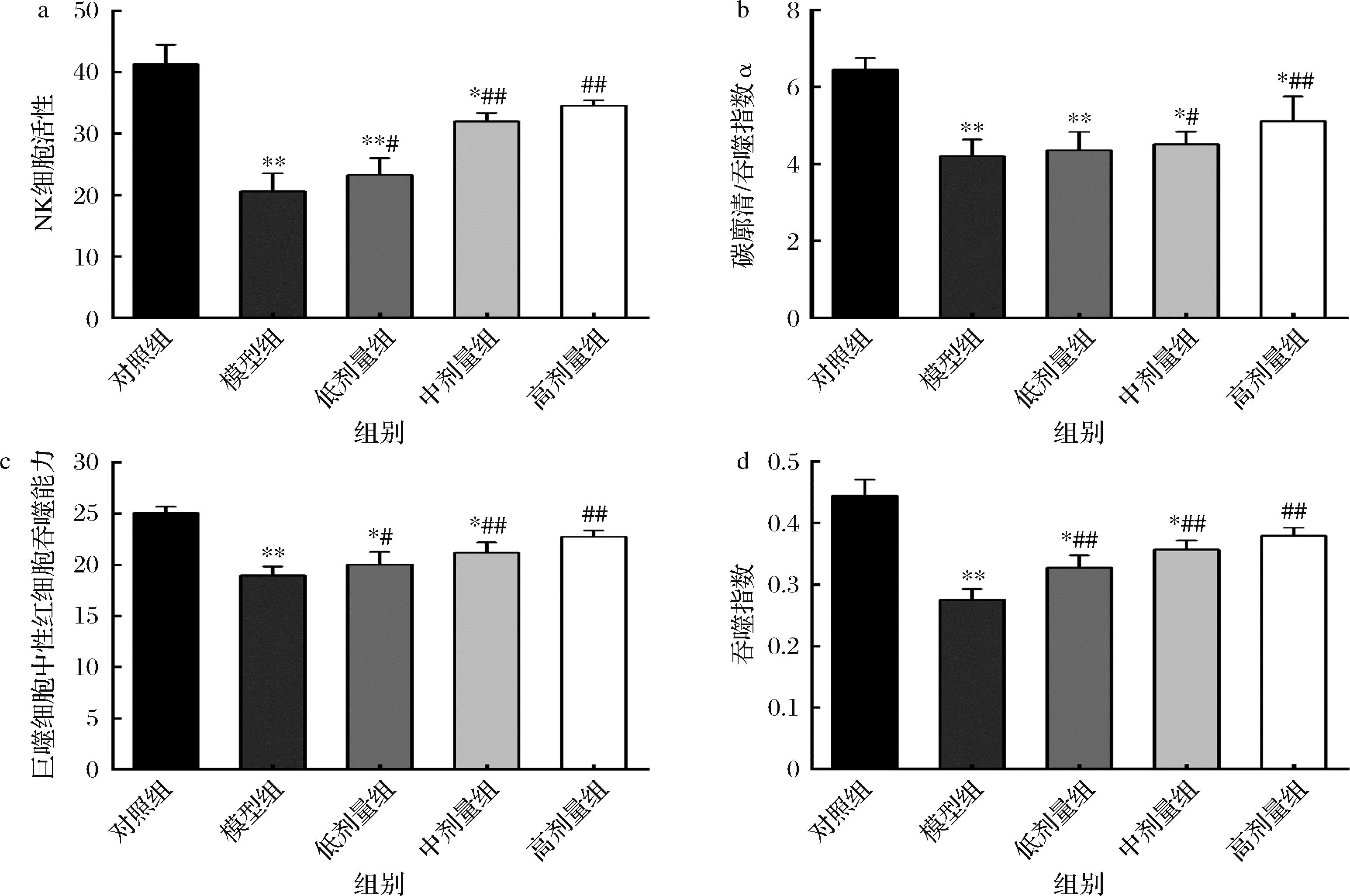
a-NK细胞活性;b-碳廓清/吞噬指数α;c-巨噬细胞中性红细胞吞噬能力;d-吞噬指数
图4 CCFM8661对小鼠非特异性免疫的影响
Fig.4 Effect of CCFM8661on non-specific immunity in mice
由图4-a可知,与对照组相比,模型组NK细胞活性显著降低(P<0.01);与模型组相比,低、中、高剂量组CCFM8661 NK细胞活性均显著增加。由图4-b可知,与对照组相比,模型组小鼠的碳廓清吞噬指数显著降低(P<0.01);与模型组相比,低剂量组小鼠的碳廓清吞噬指数变化不明显,中、高剂量组CCFM8661碳廓清吞噬指数均提高,特别是高剂量组CCFM8661碳廓清吞噬指数显著增加(P<0.01)。由图4-c、图4-d可知,与对照组相比,模型组小鼠的巨噬细胞中性红吞噬能力和吞噬指数均显著降低(P<0.01);与模型组相比,低剂量组小鼠的巨噬细胞中性红吞噬能力显著提高(P<0.05),中、高剂量组小鼠的巨噬细胞中性红吞噬能力增加幅度较大(P<0.01);低、中、高剂量组小鼠的吞噬指数均显著提高(P<0.01)。这说明CCFM8661一定程度上可以提高小鼠的非特异性免疫。
3 讨论
益生菌作为一种活的微生物,具有维持肠道正常功能、促进消化吸收等多种生理功能,其中免疫调节功能备受关注[24]。乳杆菌属中的大多数菌株都有益生作用,尤其是植物乳植杆菌[25]。本研究采用注射CTX这一经典造模方法来建立免疫抑制模型,通过对免疫抑制小鼠灌服不同剂量植物乳植杆菌CCFM8661来评估其对免疫力低下小鼠的免疫调节作用。结果发现,CCFM8661可以增加免疫低下小鼠的体质量。此前也有研究发现动物双歧杆菌乳亚种XLTG11能够改善小鼠的体质量[26]。
胸腺和脾是人体的主要免疫器官,胸腺在免疫功能的建立和免疫丧失后免疫调节功能的恢复中起着重要作用[27]。因此胸腺指数、脾指数的变化是体内免疫的关键指标[28]。研究表明一些乳酸菌能够显著提高免疫器官指数,促进免疫器官发育[29]。本研究结果显示,经CCFM8661喂养的小鼠胸腺和脾指数均显著升高,这表明CCFM8661可以恢复和促进免疫器官发育正常的发育。YIN等[30]也发现益生菌发酵可以提高小鼠的胸腺和脾指数,逆转CTX诱导的免疫器官萎缩。
脾淋巴细胞转化活性和DTH是细胞免疫的2个重要指标。大量研究表明植物乳植杆菌能刺激脾淋巴细胞增殖,增强淋巴细胞活性[31]。本研究结果显示CCFM8661增强了小鼠淋巴细胞增殖能力。DTH是由T细胞介导的免疫应答反应,可反映和评估细胞免疫能力。实验结果表明,CCFM8661可以显著增加足跖厚度,即CCFM8661可以增强健康小鼠的DTH反应,进而调节细胞免疫功能,LI等[32]先前也得出了类似的研究结果。
溶血空斑和血清溶血素分析是检测抗体分泌能力来体现体液免疫的重要指标[33]。溶血斑块的数量反映了脾中产生抗体的细胞数,血清中溶血素的含量用血凝法检测抗体积数计算。在本研究中,喂养CCFM8661小鼠的溶血空斑数和抗体积数显著增加,说明CCFM8661增强小鼠体液免疫功能,这与李玟玟等[34]的研究结果一致。
NK细胞的活性以及细胞吞噬功能通常组合用于评估机体的非特异性免疫。NK细胞是先天性免疫系统的有力效应器,在早期防御病原体和外来复合体方面发挥着关键作用[35]。巨噬细胞作为体内重要的免疫细胞,具有抗感染、抗肿瘤和免疫调节作用,可以反映非特异性免疫反应的强弱[36]。结果表明,CCFM8661提高了小鼠NK细胞活性,碳粒廓清/吞噬指数α、巨噬细胞吞噬能力和吞噬指数,说明CCFM8661可以调节小鼠的非特异性免疫。王增博等[37]也发现动物双歧杆菌乳亚种XLTG11能够提高小鼠的NK细胞活性和腹腔巨噬细胞的吞噬能力,进而调节小鼠的非特异性免疫。
尹红梅等[38]建造与本文相同的免疫抑制模型,通过灌胃植物乳植杆菌NCU137,小鼠免疫器官指数恢复约20%,严婷[39]通过灌胃小鼠植物乳植杆菌BC299(1×109 CFU/mL),小鼠免疫器官指数恢复约22%。本实验中植物乳植杆菌CCFM8661高剂量灌胃小鼠免疫器官指数恢复约25%。此前的研究表明植物乳植杆菌CCFM8661可以调节胆汁酸肝循环增加铅排泄[40]、缓解小鼠急性镉中毒[41]等,但目前没有植物乳植杆菌CCFM8661改善免疫的相关研究。综上,本研究中CCFM8661具有增强免疫力功能。
4 结论
本研究表明,植物乳植杆菌CCFM8661能够显著提高被免疫抑制小鼠的体质量、胸腺指数和脾指数,对小鼠的细胞免疫、体液免疫和非特异性免疫都具有良好的调节作用。综上,植物乳植杆菌CCFM8661具有增强免疫功能的作用,且呈剂量依赖性。这项研究为植物乳植杆菌CCFM8661的进一步开发和利用提供了理论基础和科学依据。
[1] 李楠, 刘振民.益生菌与功能发酵乳开发研究进展[J].乳业科学与技术, 2020, 43(3):31-38.LI N, LIU Z M.Probiotics and development of functional yogurt:A review of recent progress[J].Journal of Dairy Science and Technology, 2020, 43(3):31-38.
[2] REQUE P M, BRANDELLI A.Chapter 1 an introduction to probiotics[J].Probiotics, 2022:1-17.
[3] MILLS S, MURPHY A B, DINAN T G, et al.Chapter 15-Probiotics as Curators of a Healthy Gut Microbiota:Delivering the Solution [M].HYLAND N, STANTON C.The Gut-Brain Axis (Second Edition).Academic Press.2024:361-400.
[4] ASHAOLU T J, FERN NDEZ-TOMÉ S.Gut mucosal and adipose tissues as health targets of the immunomodulatory mechanisms of probiotics[J].Trends in Food Science &Technology, 2021, 112:764-779.
NDEZ-TOMÉ S.Gut mucosal and adipose tissues as health targets of the immunomodulatory mechanisms of probiotics[J].Trends in Food Science &Technology, 2021, 112:764-779.
[5] WANG X Z, ZHANG P, ZHANG X.Probiotics regulate gut microbiota:An effective method to improve immunity[J].Molecules, 2021, 26(19):6076.
[6] MASHEGHATI F, ASGHARZADEH M R, JAFARI A, et al.The role of gut microbiota and probiotics in preventing, treating, and boosting the immune system in colorectal cancer[J].Life Sciences, 2024, 344:122529.
[7] 陈俊飞, 陈健豪, 曹佩江.益生菌补充剂与人体免疫调节功能[J].科技导报, 2023, 41(23):14-19.CHEN J F, CHEN J H, CAO P J.A review of immunomodulatory function of probiotic supplements on human beings[J].Science &Technology Review, 2023, 41(23):14-19.
[8] BLAIS L L, MONTGOMERY T L, AMIEL E, et al.Probiotic and commensal gut microbial therapies in multiple sclerosis and its animal models:A comprehensive review[J].Gut Microbes, 2021, 13(1):1943289.
[9] 赵雯, 刘伟贤, 张海斌, 等.乳双歧杆菌BL-99以及副干酪乳酪杆菌ET-22增强小鼠免疫功能的研究[J].中国乳品工业, 2021, 49(11):13-18.ZHAO W, LIU W X, ZHANG H B, et al.Effects of Bifidobacterium lactis BL-99 and Lactobacillus paracasei(Lacticaseibacillus paracasei)ET-22 on regulating immune function in mice[J].China Dairy Industry, 2021, 49(11):13-18.
[10] LIU Y H, LIU G, FANG J.Progress on the mechanisms of Lactobacillus plantarum to improve intestinal barrier function in ulcerative colitis[J].The Journal of Nutritional Biochemistry, 2024, 124:109505.
[11] 武万强, 王琳琳, 赵建新, 等.植物乳杆菌生理特性及益生功能研究进展[J].食品与发酵工业, 2019, 45(1):1-13.WU W Q, WANG L L, ZHAO J X, et al.Research progress on physiological characteristics and health benefits of Lactobacillus plantarum[J].Food and Fermentation Industries, 2019, 45(1):1-13.
[12] GUIMAR ES J T, BALTHAZAR C F, SILVA R, et al.Impact of probiotics and prebiotics on food texture[J].Current Opinion in Food Science, 2020, 33:38-44.
ES J T, BALTHAZAR C F, SILVA R, et al.Impact of probiotics and prebiotics on food texture[J].Current Opinion in Food Science, 2020, 33:38-44.
[13] CALVO A, PASTOR Y, ROSAS-VAL P, et al.Unveiling the immunomodulatory effect of the novel probiotic Akkermansia muciniphila and its protective effect in vitro[J].Microbiological Research, 2024, 283:127677.
[14] 张晨玥, 马微微, 卢慧敏, 等.植物乳杆菌CCFM 8661调节肠道菌群及缓解便秘研究[J].食品与发酵工业, 2023, 49(18):58-65.ZHANG C Y, MA W W, LU H M, et al.Lactobacillus plantarum CCFM 8661 to regulate intestinal microbiota and relieve constipation[J].Food and Fermentation Industries, 2023, 49(18):58-65.
[15] VITETTA L, SALTZMAN E T, THOMSEN M, et al.Adjuvant probiotics and the intestinal microbiome:Enhancing vaccines and immunotherapy outcomes[J].Vaccines, 2017, 5(4):50.
[16] ROWLAND I, GIBSON G, HEINKEN A, et al.Gut microbiota functions:Metabolism of nutrients and other food components[J].European Journal of Nutrition, 2018, 57(1):1-24.
[17] SANDERS M E, MERENSTEIN D J, REID G, et al.Probiotics and prebiotics in intestinal health and disease:From biology to the clinic[J].Nature Reviews.Gastroenterology &Hepatology, 2019, 16(10):605-616.
[18] WANG Y, QIU F A, ZHENG Q, et al.Preparation, characterization and immune response of chitosan-gold loaded Myricaria germanica polysaccharide[J].International Journal of Biological Macromolecules, 2024, 257:128670.
[19] YANG Y Q, WANG X W, YU W L, et al.Regulating effects of triptriolide on the proliferation and apoptosis of splenic lymphocyte in vivo and in vitro[J].Journal of Holistic Integrative Pharmacy, 2022, 3(2):95-105.
[20] XIE Z X, CHEN J T, ZHENG C, et al.1, 25-dihydroxyvitamin D3-induced dendritic cells suppress experimental autoimmune encephalomyelitis by increasing proportions of the regulatory lymphocytes and reducing T helper type 1 and type 17 cells[J].Immunology, 2017, 152(3):414-424.
[21] 丁倩芸, 徐彩菊, 鹿伟, 等.蔓越莓全果粉和蔓越莓果汁粉对小鼠体液免疫功能的影响[J].卫生研究, 2016, 45(3):462-464.DING Q Y, XU C J, LU W, et al.Effects of cranberry fruit powder and cranberry juice powder on humoral immune function in mice[J].Journal of Hygiene Research, 2016, 45(3):462-464.
[22] XUE J J, AJUWON K M, FANG R J.Mechanistic insight into the gut microbiome and its interaction with host immunity and inflammation[J].Animal Nutrition, 2020, 6(4):421-428.
[23] WRZOSEK L, MIQUEL S, NOORDINE M L, et al.Bacteroides thetaiotaomicron and Faecalibacterium prausnitzii influence the production of mucus glycans and the development of goblet cells in the colonic epithelium of a gnotobiotic model rodent[J].BMC Biology, 2013, 11:61.
[24] MAZZIOTTA C, TOGNON M, MARTINI F, et al.Probiotics mechanism of action on immune cells and beneficial effects on human health[J].Cells, 2023, 12(1):184.
[25] 张群. 新型益生菌发酵乳制品的研究与开发[J].食品与生物技术学报, 2015, 34(6):672.ZHANG Q.Research and development of new probiotic fermented dairy products[J].Journal of Food Science and Biotechnology, 2015, 34(6):672.
[26] 汪小东, 刘铭洋, 翟纯毅, 等.动物双歧杆菌乳亚种XLTG11对小鼠肠道的益生作用[J].现代食品科技, 2024, 40(9):27-36.WANG X D, LIU M Y, ZHAI C Y, et al.Probiotic effect of Bifidobacterium animalis subsp.lactis XLTG11 on the intestinal tract of mice[J].Modern Food Science and Technology, 2024, 40(9):27-36.
[27] CAO N, CAO L, GAO M, et al.Changes in mRNA and protein levels of gonadotropin releasing hormone and receptor in ovine thymus, lymph node, spleen, and liver during early pregnancy[J].Domestic Animal Endocrinology, 2021, 76:106607.
[28] NOBLE B T, BRENNAN F H, POPOVICH P G.The spleen as a neuroimmune interface after spinal cord injury[J].Journal of Neuroimmunology, 2018, 321:1-11.
[29] S AWI
AWI SKA A, SIWEK M, ZYLI
SKA A, SIWEK M, ZYLI SKA J, et al.Influence of synbiotics delivered in ovo on immune organs development and structure[J].Folia Biologica, 2014, 62(3):277-285.
SKA J, et al.Influence of synbiotics delivered in ovo on immune organs development and structure[J].Folia Biologica, 2014, 62(3):277-285.
[30] YIN C M, LI Y H, LI J T, et al.Gastrointestinal digestion, probiotic fermentation behaviors and immunomodulatory effects of polysaccharides from Sanghuangporus vaninii[J].International Journal of Biological Macromolecules, 2022, 223:606-617.
[31] BUJALANCE C, MORENO E, JIMENEZ-VALERA M, et al.A probiotic strain of Lactobacillus plantarum stimulates lymphocyte responses in immunologically intact and immunocompromised mice[J].International Journal of Food Microbiology, 2007, 113(1):28-34.
[32] LI C Y, LIN H C, LAI C H, et al.Immunomodulatory effects of Lactobacillus and Bifidobacterium on both murine and human mitogen-activated T cells[J].International Archives of Allergy and Immunology, 2011, 156(2):128-136.
[33] XU F L, YOU H B, LI X H, et al.Glycine attenuates endotoxin-induced liver injury by downregulating TLR4 signaling in Kupffer cells[J].The American Journal of Surgery, 2008, 196(1):139-148.
[34] 李玟玟, 马微微, 马青, 等.复合益生菌对免疫低下模型小鼠的保护作用[J].中国食品学报, 2023, 23(8):124-131.LI W W, MA W W, MA Q, et al.Protective effect of compound probiotics on immunocompromised mice[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(8):124-131.
[35] KNOOP K A, NEWBERRY R D.Goblet cells:Multifaceted players in immunity at mucosal surfaces[J].Mucosal Immunology, 2018, 11(6):1551-1557.
[36] 刘臻, 刘冬英, 胡志航, 等.铁皮石斛粉对小鼠免疫功能影响的研究[J].中国卫生检验杂志, 2016, 26(21):3041-3044.LIU Z, LIU D Y, HU Z H, et al.Research on the effect of Dendrobium officinale powder on the immune function of mice[J].Chinese Journal of Health Laboratory Technology, 2016, 26(21):3041-3044.
[37] 王增博, 刘铭洋, 刘飞, 等.动物双歧杆菌乳亚种XLTG11对免疫抑制小鼠免疫功能及肠道菌群的影响[J].食品科学, 2024, 45(15):103-111.WANG Z B, LIU M Y, LIU F, et al.Effect of Bifidobacterium animalis subsp.lactis XLTG11 on immune function and intestinal flora in cyclophosphamide-immunosuppressed mice[J].Food Science, 2024, 45(15):103-111.
[38] 尹红梅, 夏圣坤, 钟亚东, 等.植物乳杆菌NCU137发酵薏苡仁调节免疫抑制小鼠免疫和肠道黏膜屏障功能[J].食品科学, 2024, 45(11):136-143.YIN H M, XIA S K, ZHONG Y D, et al.Adlay seeds fermented by Lactobacillus plantarum NCU137 regulates immunity and intestinal mucosal barrier function in immunosuppressed mice[J].Food Science, 2024, 45(11):136-143.
[39] 严婷. 植物乳杆菌BC299对免疫抑制小鼠的免疫调节作用研究[D].天津:天津科技大学, 2021.YAN T.Immune effect of Lactobacillus plantarum BC299 on immunosuppressive mice[D].Tianjin:Tianjin University of Science and Technology, 2021.
[40] 翟齐啸, 朱诗雅, 刘洋, 等.植物乳杆菌CCFM8661调节小鼠胆汁酸肠肝循环并增加铅排泄[C].中国食品科学技术学会.第十四届益生菌与健康国际研讨会摘要集.江南大学食品科学与工程学院, 2019.ZHAI Q X, ZHU S Y, LIU Y, et al.Lactobacillus plantarum CCFM8661 regulates bile acid enterohepatic circulation and increases lead excretion in mice[C].Chinese Institute of Food Science and Technology.Abstracts of the 14th International Symposium on Probiotics and Health.School of Food Science and Engineering, Jiangnan University, 2019.
[41] 翟齐啸, 王刚, 田丰伟, 等.植物乳杆菌CCFM8661对小鼠急性镉中毒的缓解作用[C].中国食品科学技术学会.乳酸菌与生物工程:第八届乳酸菌与健康国际研讨会摘要汇编.江南大学食品学院, 2013.ZHAI Q X, WANG G, TIAN F W, et al.Alleviating effect of Lactobacillus plantarum CCFM8661 on acute cadmium poisoning in mice[C].Chinese Institute of Food Science and Technology.Lactic acid Bacteria and Bioengineering:a compilation of abstracts from the 8th International Symposium on Lactic Acid Bacteria and Health.School of Food Science, Jiangnan University, 2013.