L-苹果酸(L-羟基丁二酸)是一种天然存在的四碳二羧酸,其具有酸度舒适、口感柔和等特点,1967年,苹果酸被美国食品药品监督管理局(Food and Drug Administration,FDA)列为食品安全级产品,被广泛用作食品、饮料行业的酸化剂和增味剂[1-2],并且在纺织、制药和农业等行业中有诸多应用[3]。苹果酸作为一种三羧酸循环的中间体,因其广泛的用途与开发前景,美国能源部将其列为重要的平台化学品之一[4]。目前苹果酸的主要来源,是以石油为原料合成富马酸,以此作为底物通过细胞或酶转化法获得苹果酸[5-6],此方法对环境造成污染的同时因为富马酸非食品来源,其转化产物苹果酸也无法应用于食品领域。因此,微生物发酵法生产苹果酸具有更重要的市场价值和社会意义。
曲霉、根霉和黑穗菌是天然的L-苹果酸生产菌株,经过几十年的研究,通过合理的代谢工程改造大肠杆菌、酵母、谷氨酸棒状杆菌等模式菌株,获得高产L-苹果酸菌株。曲霉属中的黄曲霉被认为是产L-苹果酸最有前途的菌株[7],在20世纪60年代,发现黄曲霉可合成L-苹果酸之初,产量就可达到58.4 g/L,BATTAT等[8]将L-苹果酸发酵产量提高到113 g/L,产率约为0.59 g/(L·h),可黄曲霉会产生有害的致癌物黄曲霉毒素,所生产的L-苹果酸不适合应用在食品工业领域[9]。黑曲霉(Aspergillus niger)是重要的有机酸、酶制剂生产菌株,本研究采用的黑曲霉CGMCC 10142是一株高产柠檬酸菌株,其具有较强的三羧酸循环代谢通量,能耐受低pH条件,且底物利用率高,因此有生产多种有机酸的潜力。
黑曲霉细胞内以葡萄糖生物合成L-苹果酸有3条途径[7],如图1所示。途径一:还原型三羧酸(reductive tricarboxylic acid cycle,rTCA)途径,葡萄糖经糖酵解途径(embden-meyerhof-parnas pathway,EMP)被分解生成丙酮酸,丙酮酸羧化生成草酰乙酸还原生成L-苹果酸,该途径丙酮酸羧化固定CO2生成草酰乙酸,每消耗1 mol 葡萄糖产生2 mol苹果酸,因此该途径的理论转化率最高。途径二:氧化型三羧酸(TCA)循环途径,转化率为1 mol/mol。途径三:乙醛酸循环途径,异柠檬酸在异柠檬酸裂解酶作用下生成乙醛酸和琥珀酸,乙醛酸和乙酰CoA在苹果酸合酶作用下生成 L-苹果酸,理论转化率为1 mol/mol葡萄糖。已有研究表明,在一定条件下rTCA途径可成为曲霉等微生物积累L-苹果酸的主要途径[10]。
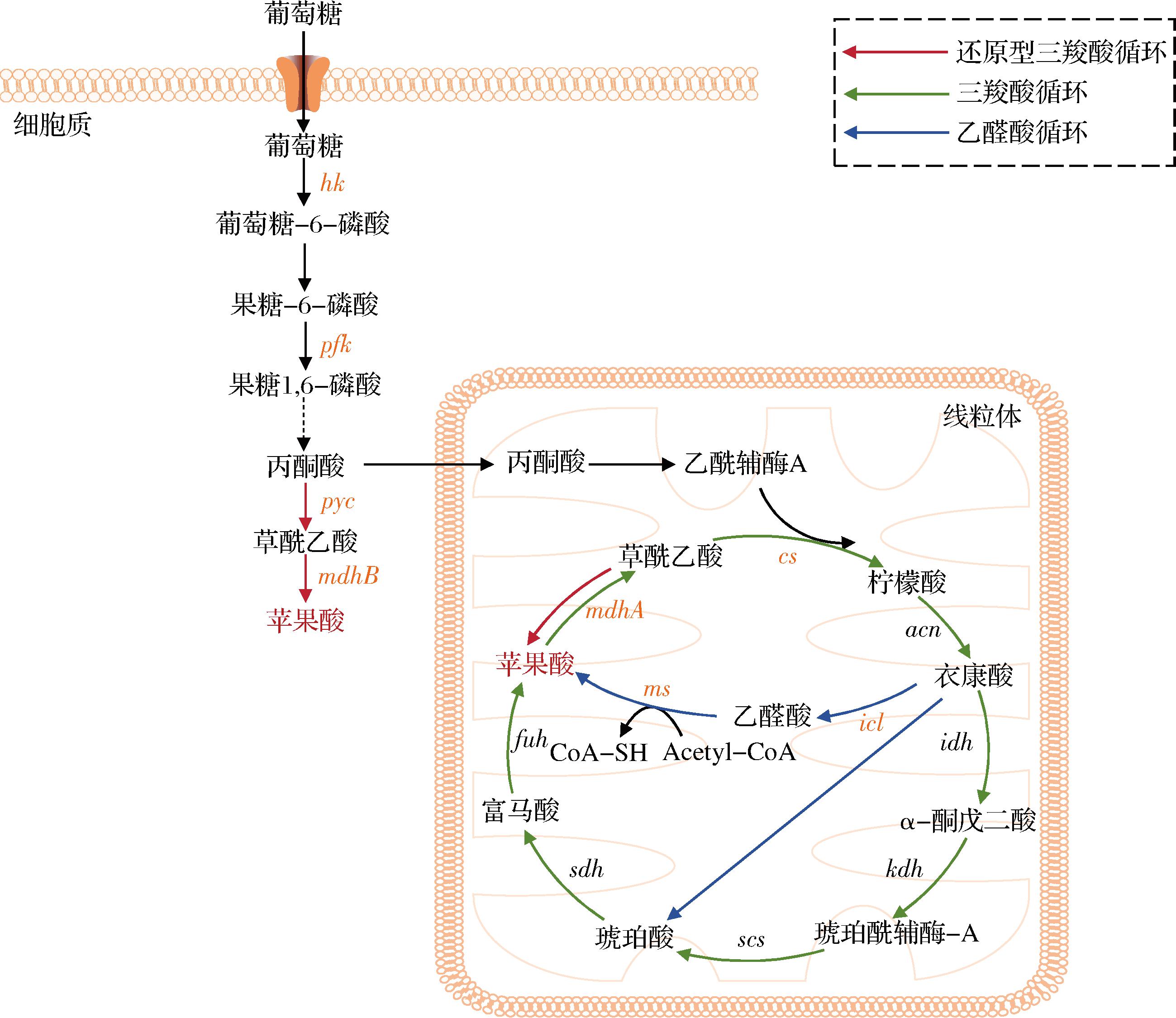
图1 黑曲霉细胞内L-苹果酸的合成途径
Fig.1 The biosynthetic pathways of L-malic acid in A.niger
在代谢工程改造中,增强目标产物的细胞分泌能力十分重要,是提高产物分泌速率、缓解负反馈调节、增加微生物细胞工厂底物利用效率的有效方法[11]。四碳二羧酸与中心代谢密切相关,因此四碳二羧酸的转运蛋白在许多微生物的碳代谢和能量代谢中起着重要作用。目前,酵母[12]、大肠杆菌[13-14]、枯草芽孢杆菌[15]等菌株都有对四碳二羧酸转运的相关报道。LIU等[16],在高产苹果酸的米曲霉WS-M-P-PP菌株中表达来源A.oryzae NRRL 3488菌株的四碳二羧酸转运蛋白C4T318基因和来源S.pombe 972 h-菌株的Mae1基因,苹果酸的产量从58.5 g/L提高到89.5 g/L。本研究在黑曲霉CGMCC 10142菌株中分别同源过表达5种四碳二羧酸转运蛋白基因,分析菌株产L-苹果酸情况,为代谢工程改造柠檬酸黑曲霉发酵生产L-苹果酸奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株
本研究用到的黑曲霉CGMCC 10142菌株;大肠杆DH5α菌株;根癌农杆AGLI菌株均为本实验室保藏菌株。
1.1.2 培养基和主要试剂
LB固体培养基(g/L):NaCl 10,酵母浸出5,蛋白胨10,加入2%琼脂粉(质量分数),121 ℃、20 min高温灭菌。
摇瓶种子培养基(g/L):无水葡萄糖50,酵母粉5,蛋白胨1,(NH4)2SO4 0.3,MgSO4·7H2O 0.25,KH2PO4 0.25,CM微量元素[17] 1 mL,调整pH 5.5。115 ℃,灭菌20 min。
摇瓶发酵培养基(g/L):无水葡萄糖130,酵母粉0.5,玉米浆粉3,(NH4)2SO4 4.86, MgSO4·7H2O 0.1,KH2PO4 0.2,CaCO3 40。115 ℃,灭菌15 min。
质粒提取试剂盒,天根生化科技有限公司;琼脂糖凝胶回收试剂盒,Omega公司;重组克隆试剂盒,南京Vazyme生物科技有限公司;研究所用限制性核酸内切酶,TaKaRa公司;研究所用试剂,天津复科技术有限公司;Fungal RNA Kit试剂盒,OMEGA生物技术公司;HiScripy RT SuperMix for qPCR(+gDNA wiper)试剂、ChamQ Universal SYBR qPCR Master Mix试剂,Vazme公司。
真菌完全培养基(fungal complete medium,CM)、诱导培养基(induction medium,IM)、农杆菌侵染所需培养基及试剂参考文献[17]配制。
1.2 实验方法
1.2.1 质粒构建
以本实验室保存的pdO质粒作为母核,潮霉素hyg抗性作为筛选标记,pgpdA作为启动子启动目的基因,同源重组区为草酰乙酸水解酶基因oah序列。
本研究对pdO质粒使用限制性核酸内切酶KpnI和BamHI进行双酶切,以黑曲霉CGMCC 10142的基因组DNA作为模板,使用表1中的引物,PCR扩增oah基因的上游序列oah-L、pgpdA和dct1~5,通过融合PCR进行连接,使用重组酶将融合片段与线性化pdO质粒连接,得到分别过表达dct1、dct2、dct3、dct4、dct5基因的pDCT1、pDCT2、pDCT3、pDCT4、pDCT5质粒。
表1 实验中用到的引物
Table 1 Primers used in the experiment

引物引物序列引物作用oah-L-FTTCGAGCTCGGTACCCTCCCGCCAGCCAGAACCpDCT2质粒构建引物oah-L-RAGTCCAGTGCCCCTCCACTAGTCGTAGACGCCCGGACAGACpgpdA-FCGGGCGTCTACGACTAGTGGAGGGGCACTGGACTAApgpdA-dct2-RTGCGTATTGGAGACATTGTTTAGATGTGTCTATGTGdct2-FTAGACACATCTAAACAATGTCTCCAATACGCAGGGTTACdct2-RACATTATACGAAGTTATGGATCCTGTACAACCGAAGACGAGAATGGACAGpgpdA-dct1-RCGTTTCAACGTTCATTGTTTAGATGTGTCTATGTGpDCT1质粒构建引物dct1-FTAGACACATCTAAACAATGAACGTTGAAACGAGCCTCdct1-RATTATACGAAGTTATGGATCCTGTACAGGCTGACACAAAGAATGAGCGpgpdA-dct3-RAAGCGATCCGGAGTCATTGTTTAGATGTGTCTATGTGpDCT3质粒构建引物dct3-FTAGACACATCTAAACAATGACTCCGGATCGCTTGTTdct3-RATTATACGAAGTTATGGATCCTGTACACTATTTGGTTCTATGGCGGGGTApgpdA-dct4-RTCATAATTTGGCATTGTTTAGATGTGTCTATGTGpDCT4质粒构建引物dct4-FTAGACACATCTAAACAATGCCAAATTATGAAGCCCAAGACACdct4-RATTATACGAAGTTATGGATCCTGTACAAGTGGTCGTTTACAGATGGTGCpgpdA-dct5-RGATCTTGTCCGCTCATTGTTTAGATGTGTCTATGTGpDCT5质粒构建引物dct5-FTAGACACATCTAAACAATGAGCGGACAAGATCCCAATAGCdct5-RATTATACGAAGTTATGGATCCTGTACATTTTGATGCTTCCTCTGTGACGTTCYZ-pgpdA-FCGGCGTGATGGAGGGGGAGCA阳性转化子验证引物YZ-hyg-RCGGCGAGTACTTCTACACAGCqRT-actin-FAATGGTTCGGGTATGTGC荧光定量PCR引物qRT-actin-RACGCTTGGACTGTGCCTCqRT-dct2-FCGACCACAGAAGGTTCCCAAqRT-dct2-RAATGCGGAGTGCCGTAGTAGqRT-hk-FCTCCAAGCTCAAGCAGATTqRT-hk-RGAACCCAGGTGACGTTCATAqRT-pfk-FGCCAAGAACATGGTCCTCqRT-pfk-RCCAATTCCTTCAACAGACCGqRT-cs-FATCGCTGCCAAGATCTACCGqRT-cs-RAGACGCATGAGCTCAACGAAqRT-pyc-FTTACTCCTCCCTCCCTGACAqRT-pyc-RTGGACAGCCTTGATACCGAqRT-ms-FGACGTCTTCAACCTGGCTCAqRT-ms-RGGTGCTTGCGGAACTTCTTGqRT-mdhA-FATCCAGTTCGGTGGTGACGqRT-mdhA-RGAGAGGGCTCTCAACGAAGGqRT-mdhB-FAATCAACGCCGGTATTGTGCqRT-mdhB-RGAGACGCTTGGGGTCAAAGAqRT-sdhA-FTCCCCACGAGATCTCACACTqRT-sdhA-RCCCTCAAGCTCACGAACACTqRT-sdhB-FCAGCGAGGAGTACCTTGGACqRT-sdhB-RAGTCCGCGAGCAGTTAAGAA
1.2.2 根癌农杆菌介导黑曲霉转化
将通过PCR验证、双酶切验证、测序正确的pDCT1、pDCT2、pDCT3、pDCT4、pDCT5质粒分别化转到大肠杆菌DH5α感受态中进行保存。
从大肠杆菌DH5α中提取质粒,电转到根癌农杆菌感受态中。成功导入质粒的根癌农杆菌与2×107 个/mL浓度的黑曲霉CGMCC 10142菌株孢子悬液共同培养,通过根癌农杆菌侵染的方法介导黑曲霉转化[18]。
1.2.3 黑曲霉转化子筛选
将带有不同dct基因质粒的根癌农杆菌与黑曲霉孢子悬液进行共培养转化,于IM固体诱导培养基生长45 h,洗脱至CM+150 μg/mL潮霉素的初筛培养基,37 ℃培养2 d,挑取单菌落,至CM+200 μg/mL潮霉素的复筛培养基37 ℃培养3 d。复筛板上正常生长的转化子传3代稳定后提取基因组进行PCR验证。
1.2.4 摇瓶发酵
CGMCC 10142、C-pDCT1、C-pDCT2、C-pDCT3、C-pDCT4、C-pDCT5,6株菌在CM斜面培养基上培养6.5 d,使用0.9%(质量分数)的无菌NaCl溶液进行洗脱获得孢子悬液,稀释到2×105 个/mL孢子,接入装有30 mL种子培养基中,37 ℃,250 r/min培养24 h,补加发酵培养基50 mL,37 ℃,220 r/min, 发酵96 h,并分别于36、60、96 h取发酵液进行测定。
1.2.5 发酵液测定
摇瓶发酵36、60、96 h取样,进行发酵液测定。
本研究对于L-苹果酸的定量分析,使用10 mmol/L的硫酸酸化发酵液,12 000 r/min离心15 min,取上清液稀释10倍。稀释后样品经0.22 μm孔径的滤器过滤,进行HPLC检测L-苹果酸的含量。
采用干燥法进行生物量测定,取30 mL均匀发酵液,过200目筛,10 mmol/L稀硫酸冲洗去除过量CaCO3,于60 ℃干燥至恒重,计算得每毫升菌体干重。
利用生物传感器测定发酵液中葡萄糖,取2 mL均匀发酵液,12 000 r/min 离心10 min,吸取上清液,蒸馏水稀释适当倍数,以适配生物传感器的检测范围。
1.2.6 黑曲霉RNA提取和转录分析
取36 h发酵液,经200目筛过滤后收集菌丝球,用无菌水重复洗涤3遍,液氮研磨成白色粉末状,装于1.5 mL无菌EP管中,提取RNA逆转录得到cDNA进行实时荧光定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)。
2 结果与分析
2.1 阳性转化子遗传稳定性验证
本研究设计验证引物YZ-pgpdA-F和YZ-hyg-R验证表达框(pgpdA-dct-hyg),以pDCT1~5质粒作为阳性对照,验证转化子的遗传稳定性(图2-a)。5株菌的验证表达框为,pgpdA-dct1-hyg为3 382 bp,pgpdA-dct2-hyg为3 406 bp,pgpdA-dct3-hyg为3 903 bp,pgpdA-dct4-hyg为3 516 bp,pgpdA-dct5-hyg为3 688 bp,如图2-b所示,PCR验证正确的5株转化子均为随机插入,并可稳定遗传。
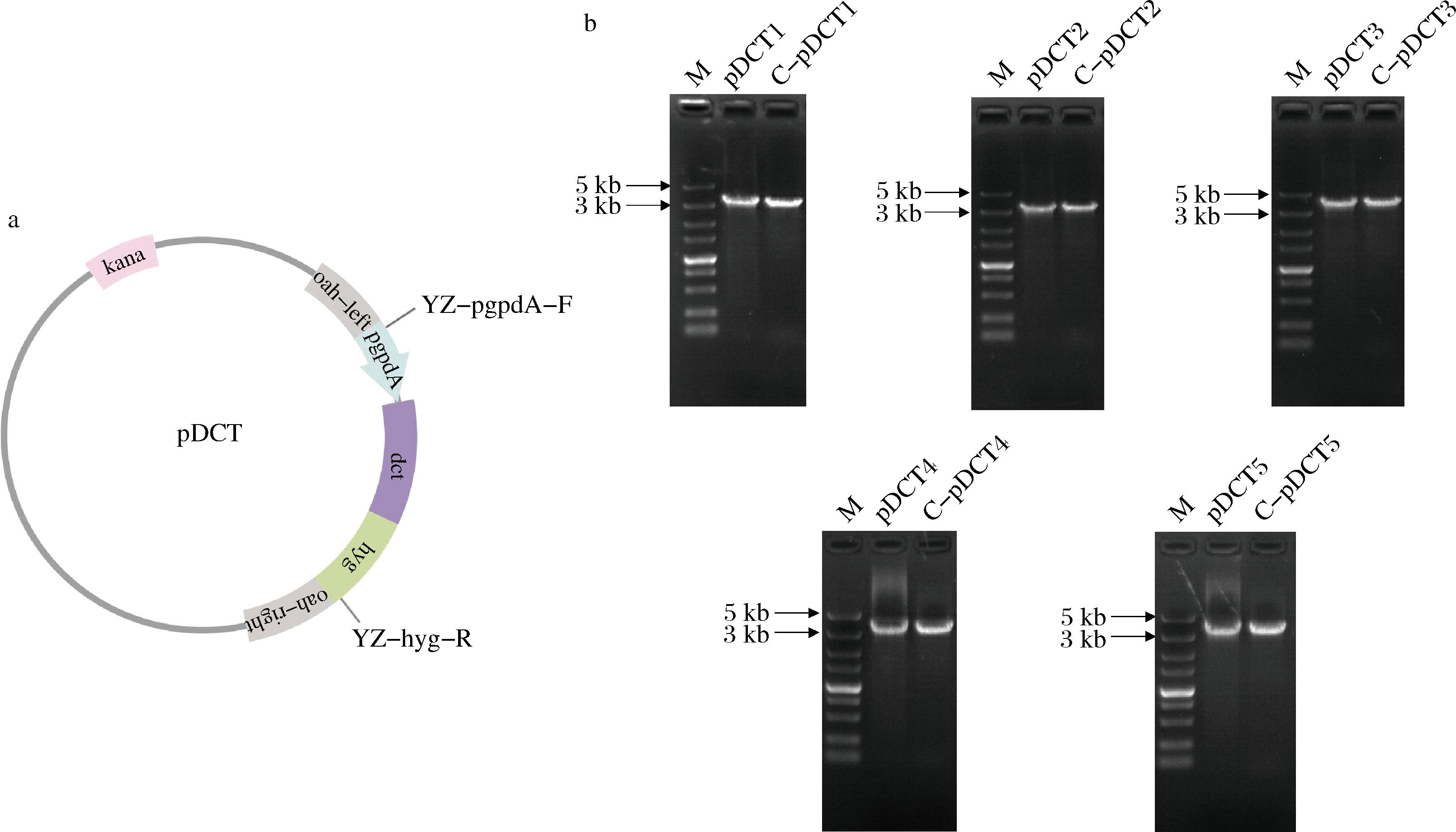
M-DNAmarker。
a-质粒图谱;b-黑曲霉阳性转化子验证
图2 阳性转化子验证
Fig.2 Verification of positive transformants
2.2 摇瓶发酵产L-苹果酸
将黑曲霉CGMCC 10142、C-pDCT1、C-pDCT2、C-pDCT3、C-pDCT4、C-pDCT5 6株菌按照1.2.4节的方法进行摇瓶发酵,分别取36、60、96 h样品进行有机酸产量检测。L-苹果酸发酵结果如图3-a所示,转化子相较出发菌株的L-苹果酸产量均有提高,在60 h达到最高产量,持续发酵L-苹果酸产量有所下降。发酵60 h,C-pDCT2菌株有最大L-苹果酸产量14.48 g/L,相较于出发菌株的11.86 g/L,提高了22.09%,其余C-pDCT1、C-pDCT3、C-pDCT4、C-pDCT5菌株相较出发菌株,L-苹果酸产量分别提高了16.02%、16.69%、11.04%、7.9%。
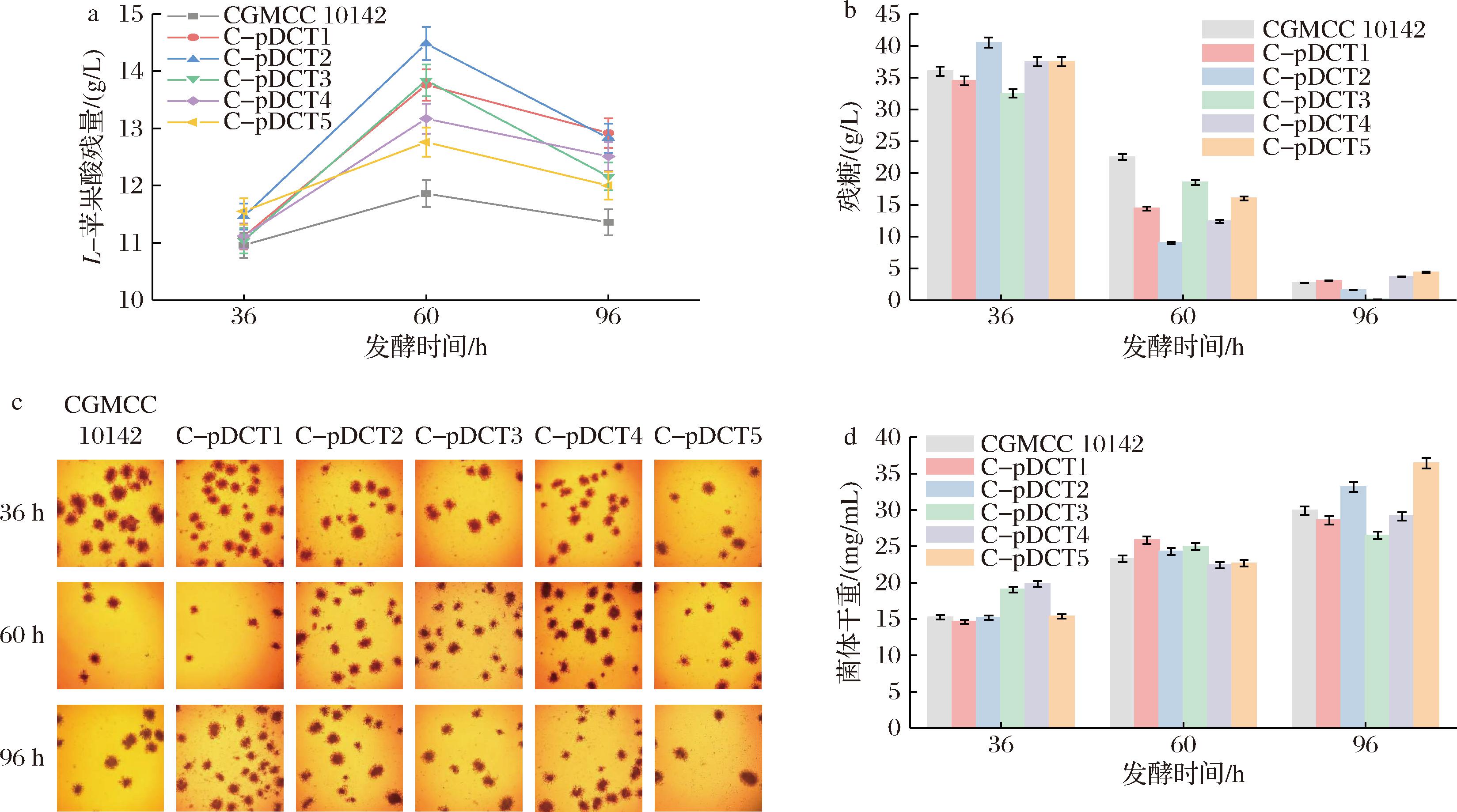
a-L-苹果酸发酵;b-残糖;c-菌球形态;d-菌体干重
图3 CGMCC 10142菌株和C-pDCT1、C-pDCT2、C-pDCT3、C-pDCT4、C-pDCT5转化子摇瓶发酵
Fig.3 Shake flask fermentation of CGMCC 10142 strain and C-pDCT1, C-pDCT2, C-pDCT3, C-pDCT4, and C-pDCT5 transformants
如图3-b所示,C-pDCT2菌株从36 h到60 h消耗了大量的葡萄糖来生产有机酸。发酵过程菌丝球显微观察(图3-c),出发菌株黑曲霉CGMCC 10142有较致密菌丝球,过表达四碳二羧酸转运蛋白后,菌丝球无明显特征变化。发酵36 h菌体生长已经进入稳定期,持续发酵,菌丝球直径无明显变化。发酵96 h,由于培养基中糖分的减少,菌体开始出现退化现象,菌丝球边缘表现出老化特征。值得注意的是,这6株菌之间的菌体干重无明显差异(图3-d),这表明过表达四碳二羧酸转运蛋白基因在提升L-苹果酸产量的同时,并未对菌体的生长产生负面影响。基于发酵的综合分析,推测在60 h后,由于培养基中营养物质的即将耗尽和菌丝的老化,发酵前期积累的L-苹果酸可能重新进入菌体的代谢循环,从而导致L-苹果酸的积累量出现下降。
2.3 qRT-PCR分析
C-pDCT2可作为一株L-苹果酸产量较高菌株与CGMCC 10142菌株进行下一步qRT-PCR,分析代谢途径中关键酶的转录水平。分别收集2株菌摇瓶发酵36 h的菌丝体,按照1.2.6节方法获得cDNA,检测与L-苹果酸生产和转运相关基因的转录水平。
以actin基因作为内参基因,对代谢途径中的关键酶编码基因四碳二羧酸转运蛋白基因(dct2)、己糖激酶(hk)、磷酸果糖激酶(pfk)、丙酮酸羧化酶(pyc)、胞质苹果酸脱氢酶(mdhB)、线粒体苹果酸脱氢酶(mdhA)、柠檬酸合酶(cs)、异柠檬酸裂解酶(icl)、苹果酸合酶(ms)的转录水平进行检测,如图1所示。
qRT-PCR分析结果如图4所示,C-pDCT2菌株的dct2基因转录水平较CGMCC 10142菌株显著增加,是对照菌株的9倍左右,验证出dct2基因被成功过表达,菌体内二羧酸的转运效率显著提高,从而减少L-苹果酸在细胞内的滞留,缓解其对主代谢途径的反馈抑制。qRT-PCR结果可见EMP中关键酶hk和pfk编码基因的转录水平显著增加,分别是对照菌株的4倍和14倍左右,C-pDCT2菌株胞内EMP途径代谢增强,为L-苹果酸的合成提供更多前体物,即丙酮酸。
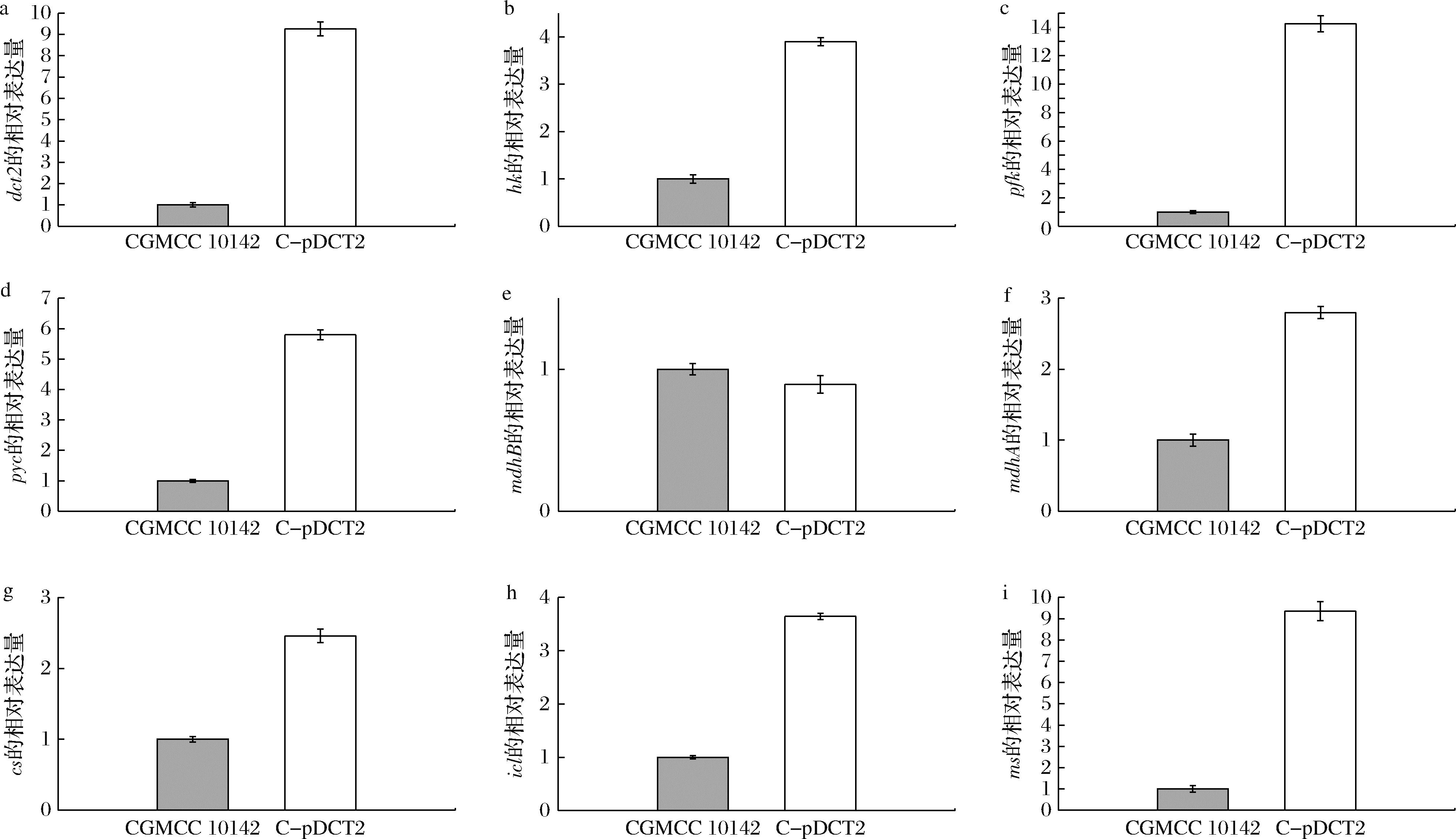
a-dct2;b-hk;c-pfk;d-pyc;e-mdhB;f-mdhA;g-cs;h-icl;i-ms
图4 黑曲霉CGMCC 10142和C-pDCT2菌株dct2、hk、pfk、pyc、mdhB、mdhA、cs、icl、ms相对表达量
Fig.4 Relative expression levels of dct2, hk, pfk, pyc, mdhB, mdhA, cs, icl, and ms in A.niger CGMCC 10142 and C-pDCT2 strains
rTCA途径,通过丙酮酸羧化生成草酰乙酸然后还原为L-苹果酸。C-pDCT2菌株中该途径的关键酶丙酮酸羧化酶(pyc)的编码基因转录水平显著增加,但胞质苹果酸脱氢酶(mdhB)的转录水平变化并不显著。线粒体苹果酸脱氢酶(mdhA)是三羧酸循环中的可逆酶,其转录水平增加2.5倍,L-苹果酸在线粒体内的代谢更加活跃,推测L-苹果酸的合成增加可能主要来自于线粒体。
本研究继续分析发现,线粒体中乙醛酸循环途径合成L-苹果酸的关键酶基因,柠檬酸合酶(cs)、异柠檬酸裂解酶(icl)、苹果酸合酶(ms)编码基因在C-pDCT2菌株中大量表达。柠檬酸合酶(cs)编码基因转录水平显著上调,是对照菌株的2.5倍左右,但发酵液中检测到的柠檬酸质量浓度为5.21 g/L,低于苹果酸14.48 g/L。异柠檬酸裂解酶(icl)和苹果酸合酶(ms)编码基因的转录水平,分别是对照菌株的3.5倍和9倍左右。推测菌体内合成的柠檬酸没有被分泌到细胞外,而是经过活跃的乙醛酸循环途径被继续代谢,L-苹果酸是其代谢产物之一。
对以上关键酶基因转录水平的分析,C-pDCT2菌株在DCT2蛋白大量表达的情况下,乙醛酸循环途径的关键酶基因都有不同程度转录水平的上调,因此乙醛酸循环途径可能为L-苹果酸合成主要途径,是L-苹果酸产量较出发菌株增加的原因,同时也说明在该黑曲霉菌株中应进一步拓展其胞质rTCA途径,以增强其合成L-苹果酸的效率。
2.4 序列分析
本研究采用了生物信息学工具和算法,对黑曲霉CGMCC 10142菌株中的5种四碳二羧酸转运蛋白(DCT1~5)进行了深入的分子层面分析。
如图5-a所示,DCT1~5蛋白的氨基酸序列一致性为34.02%,并识别出多个相对保守位点,DCT2与DCT1、3的一致性分别为24.42%和22.31%,高于与DCT4、5的一致性16.87%、17.68%。分析发酵苹果酸结果发现,过表达DCT1、DCT3菌株L-苹果酸产量高于过表达DCT4、5菌株,由此推测,5种转运蛋白氨基酸序列差异与其L-苹果酸转运效率存在紧密联系。

a-氨基酸序列比对;b-DCT1~5蛋白质三级结构
图5 DCT1-5蛋白氨基酸序列比对和三级结构
Fig.5 Amino acid sequence alignment and tertiary structure prediction of Dct1-5
利用SOPMA在线分析工具对DCT1~5蛋白的二级结构进行预测分析,结果如表2所示,这5种蛋白的二级结构都是以α螺旋和无规则卷曲形式为主,以及较少的β折叠,无β转角。利用AlphaFold建模预测DCT1~5蛋白模型(图5-b),发现这些蛋白的构型具有高度的相似性,均表现为以多个α螺旋组成的跨膜桶状结构,连接α螺旋主要为无规则卷曲和少量β折叠,与二级结构的预测相符合。此外,本研究还应用了TMHMM工具来预测DCT1~5蛋白的跨膜结构区,确认了DCT1~5均为跨膜蛋白,除DCT1有9个跨膜结构区外,其余4个都有10个跨膜结构区。
表2 dct1~5的基本信息
Table 2 Basic information of dct1-5
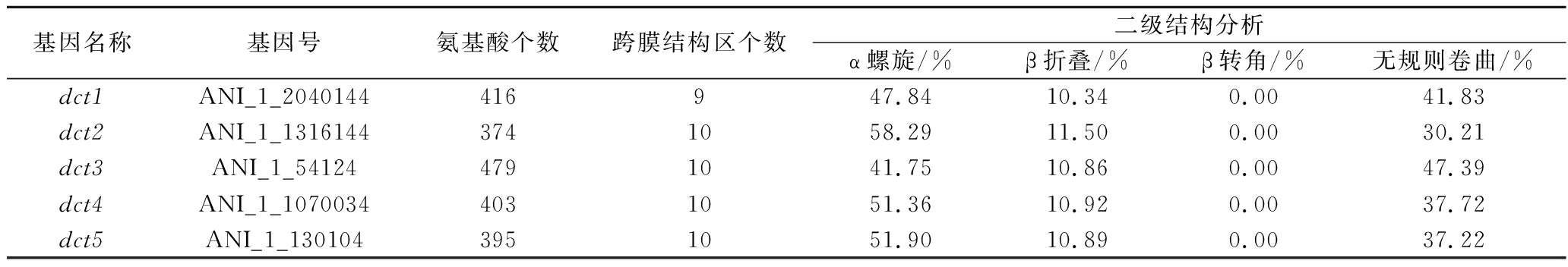
基因名称基因号氨基酸个数跨膜结构区个数二级结构分析α螺旋/%β折叠/%β转角/%无规则卷曲/%dct1ANI_1_2040144416947.8410.340.0041.83dct2ANI_1_13161443741058.2911.500.0030.21dct3ANI_1_541244791041.7510.860.0047.39dct4ANI_1_10700344031051.3610.920.0037.72dct5ANI_1_1301043951051.9010.890.0037.22
综上所述,DCT1~5蛋白在一级序列到高级结构上的相似性,以及发酵结果显示过表达DCT1~5菌株确有增加L-苹果酸的产量,充分说明了它们在黑曲霉中发挥着L-苹果酸的跨膜转运作用。
2.5 分子对接结果
利用AlphaFold进行的分子对接模拟,结果如图6所示,5种四碳二羧酸转运蛋白在一定程度上可以结合L-苹果酸,以L-苹果酸和四碳二羧酸转运蛋白结合能的大小决定结合的程度,结合能低,说明结合构象稳定,如表3所示,其中DCT2与L-苹果酸的结合能最佳,具有强烈的结合活性,这与发酵结果存在一定相关性。
表3 DCT1~5和L-苹果酸分子对接自由能
Table 3 Docking free energy of DCT1-5 and L-malic acid molecular

转运蛋白DCT1DCT2DCT3DCT4DCT5结合氨基酸196-Thr、201-Trp、200-Ser15-Trp、364-Gln368-Trp237-Gln、239-Thr242-Trp98-Leu、102-Ser234-Val、237-Ser、314-Gly结合能/(kcal/mol)-3.45-3.80-3.78-3.33-3.40
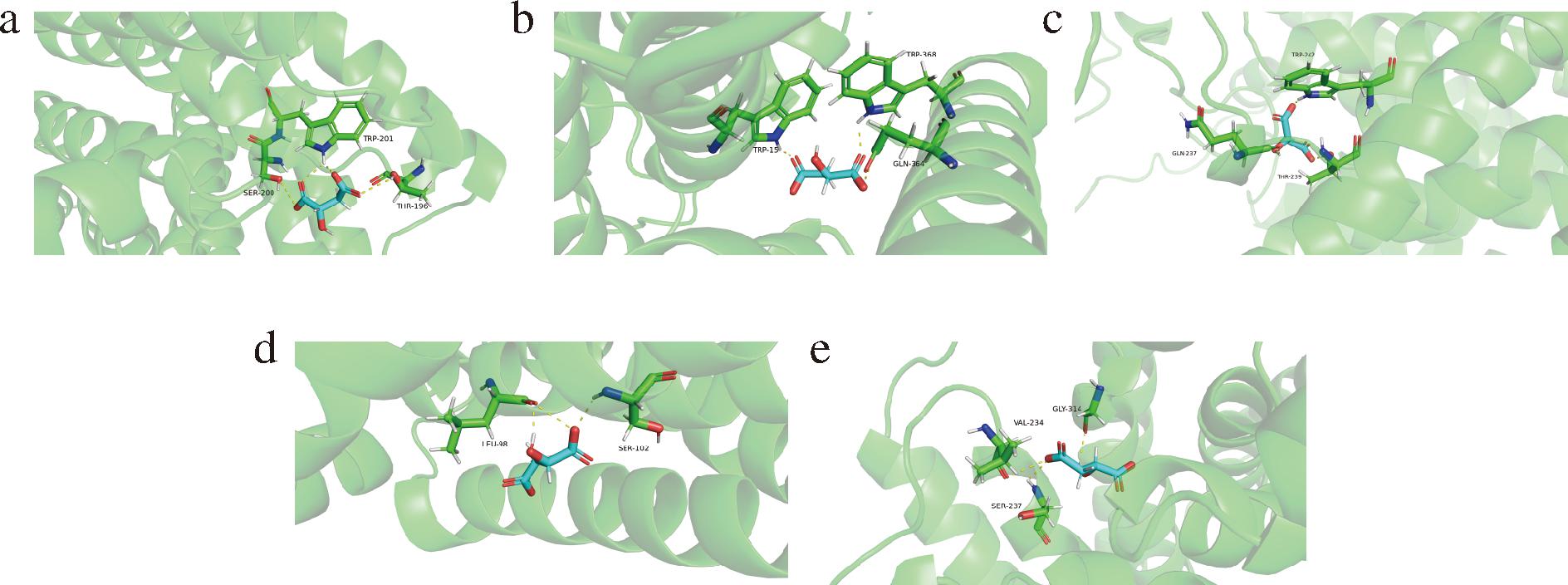
a-DCT1;b-DCT2;c-DCT3;d-DCT4;e-DCT5
图6 DCT1~5和L-苹果酸分子对接结果
Fig.6 Docking results of DCT1-5 and L-malic acid molecule
3 讨论
在微生物发酵过程中,代谢物的积累往往会引起产物反馈抑制,导致代谢产物无法大量积累的同时还会抑制菌体生长,增强目标产物的细胞分泌能力,可促进其胞外积累。本研究应用基因重组技术成功构建了过表达dct1、dct2、dct3、dct4和dct5基因的黑曲霉菌株,通过摇瓶发酵实验,发现这些重组菌株在L-苹果酸产量上相较于出发菌株有显著提高。DCT1~5蛋白的氨基酸序列、二级结构、三级结构展现出高度的相似,分子模拟对接结果显示,L-苹果酸分子能够进入由DCT1~5转运蛋白氨基酸构成的活性口袋,其中DCT2与L-苹果酸的结合能最佳,这与发酵结果存在一定相关性。基于这些发现,推断出DCT1~5蛋白都在不同程度上参与了L-苹果酸的跨膜转运,促进了L-苹果酸在细胞外环境的积累。
发酵60 h,C-pDCT2菌株有最高L-苹果酸产量14.48 g/L,其DCT2蛋白表达的水平增加至9倍,这一变化显著加快了苹果酸的分泌速率,解除了产物对中心代谢途径的反馈抑制,有效拉动菌株的总体代谢流速度,根据C-pDCT2菌体内合成代谢L-苹果酸途径关键酶的转录水平,推测L-苹果酸的累积,是通过线粒体中的乙醛酸循环途径。与之不同的是,PELEG等[19]通过13C示踪法发现,曲霉主要通过草酰乙酸还原积累L-苹果酸,其中关键步骤是丙酮酸的羧化和草酰乙酸的还原[2]。本研究可进一步过表达rTCA途径的关键酶,得到高产L-苹果酸黑曲霉菌株[20-21]。
同时,本研究也存在一些局限性。首先,发酵过程中的参数优化和过程控制也是实现L-苹果酸高效生产的关键因素,温度、pH、微量元素、溶解氧等环境变量都能够对微生物的繁殖、代谢活动造成影响[22],发酵条件对转运蛋白的转运功能也存在不同程度的影响[23]。
综上所述,通过分子生物学和代谢工程手段,对5种四碳二羧酸转运蛋白分泌L-苹果酸的情况进行探究,在本研究的摇瓶发酵条件下,发现DCT2蛋白胞外分泌L-苹果酸的能力更强,菌体内L-苹果酸的合成主要依靠乙醛酸循环途径。本研究为高效和可持续的黑曲霉发酵产L-苹果酸奠定基础。
[1] CHEN X L, WANG Y C, DONG X X, et al.Engineering rTCA pathway and C4-dicarboxylate transporter for L-malic acid production[J].Applied Microbiology and Biotechnology, 2017, 101(10):4041-4052.
[2] 袁恺, 周卫强, 唐堂, 等.微生物制备L-苹果酸的研究进展[J].生物加工过程, 2021, 19(3):227-233.YUAN K, ZHOU W Q, TANG T, et al.Microbial synthesis of L-malic acid:A review[J].Chinese Journal of Bioprocess Engineering, 2021, 19(3):227-233.
[3] CHI Z, WANG Z P, WANG G Y, et al.Microbial biosynthesis and secretion of L-malic acid and its applications[J].Critical Reviews in Biotechnology, 2016, 36(1):99-107.
[4] WEI Z, XU Y X, XU Q, et al.Microbial biosynthesis of L-malic acid and related metabolic engineering strategies:Advances and prospects[J].Frontiers in Bioengineering and Biotechnology, 2021, 9:765685.
[5] 王颖珊, 郭峰, 严伟, 等.四碳有机酸生物合成的代谢工程研究进展[J].生物工程学报, 2021, 37(5):1697-1720.WANG Y S, GUO F, YAN W, et al.Advances in the metabolic engineering for the production of tetracarbon organic acids[J].Chinese Journal of Biotechnology, 2021, 37(5):1697-1720.
[6] IYYAPPAN J, BHARATHIRAJA B, BASKAR G, et al.Process optimization and kinetic analysis of malic acid production from crude glycerol using Aspergillus niger[J].Bioresource Technology, 2019, 281:18-25.
[7] KÖVILEIN A, KUBISCH C, CAI L Y, et al.Malic acid production from renewables:A review[J].Journal of Chemical Technology &Biotechnology, 2020, 95(3):513-526.
[8] BATTAT E, PELEG Y, BERCOVITZ A, et al.Optimization of L-malic acid production by Aspergillus flavus in a stirred fermentor[J].Biotechnology and Bioengineering, 1991, 37(11):1108-1116.
[9] BRINK H G, GEYER-JOHNSON M, SWART R M, et al.Malic acid production by Aspergillus oryzae:The immobilized fungal fermentation route[J].Biofuels, Bioproducts and Biorefining, 2023, 17(2):363-379.
[10] 吴军林, 吴清平, 张菊梅, 等.L-苹果酸生物合成研究进展[J].食品科学, 2014, 35(3):238-242.WU J L, WU Q P, ZHANG J M, et al.Progress in L-malic acid biosynthesis[J].Food Science, 2014, 35(3):238-242.
[11] 金利群, 李晓菡, 赵贝贝, 等.微生物有机酸转运蛋白的研究进展[J].微生物学报, 2023, 63(9):3386-3408.JIN L Q, LI X H, ZHAO B B, et al.Organic acid transporters in microorganisms[J].Acta Microbiologica Sinica, 2023, 63(9):3386-3408.
[12] DARBANI B, STOVICEK V, VAN DER HOEK S A, et al.Engineering energetically efficient transport of dicarboxylic acids in yeast Saccharomyces cerevisiae[J].Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(39):19415-19420.
[13] JANAUSCH I G, ZIENTZ E, TRAN Q H, et al.C4-dicarboxylate carriers and sensors in bacteria[J].Biochimica et Biophysica Acta (BBA) - Bioenergetics, 2002, 1553(1-2):39-56.
[14] 姜巨全, 张正来, 徐桐, 等.大肠杆菌中dctA基因敲除及其苹果酸摄取功能鉴定[J].东北农业大学学报, 2018, 49(5):45-52.JIANG J Q, ZHANG Z L, XU T, et al.Knock-out of dctA gene from Escherichia coli K12 and characterization of its function for malic acid transportation[J].Journal of Northeast Agricultural University, 2018, 49(5):45-52.
[15] ASAI K, BAIK S H, KASAHARA Y, et al.Regulation of the transport system for C4-dicarboxylic acids in Bacillus subtilis[J].Microbiology, 2000, 146 (Pt 2):263-271.
[16] LIU J J, XIE Z P, SHIN H D, et al.Rewiring the reductive tricarboxylic acid pathway and L-malate transport pathway of Aspergillus oryzae for overproduction of L-malate[J].Journal of Biotechnology, 2017, 253:1-9.
[17] MICHIELSE C B, HOOYKAAS P J J, VAN DEN HONDEL C A M J J, et al.Agrobacterium-mediated transformation of the filamentous fungus Aspergillus awamori[J].Nature Protocols, 2008, 3(10):1671-1678.
[18] 曹张磊, 王德培, 张岚.提高根癌农杆菌介导黑曲霉转化效率的研究[J].天津科技大学学报, 2016, 31(2):20-25.CAO Z L, WANG D P, ZHANG L.Improvement of transformation efficiency of Aspergillus niger mediated by Agrobacterium tumefaciens[J].Journal of Tianjin University of Science &Technology, 2016, 31(2):20-25.
[19] PELEG Y, STIEGLITZ B, GOLDBERG I.Malic acid accumulation by Aspergillus flavus[J].Applied Microbiology and Biotechnology, 1988, 28(1):69-75.
[20] KANG N K, LEE J W, ORT D R, et al.L-malic acid production from xylose by engineered Saccharomyces cerevisiae[J].Biotechnology Journal, 2022, 17(3):2000431.
[21] JIANG Y M, ZHENG T W, YE X H, et al.Metabolic engineering of Escherichia coli for L-malate production anaerobically[J].Microbial Cell Factories, 2020, 19(1):165.
[22] 张文芝, 郭坚华.微生物发酵工艺优化研究进展[J].广东农业科学, 2013, 40(6):114-117.ZHANG W Z, GUO J H.Research advances in microbial fermentation process optimization[J].Guangdong Agricultural Sciences, 2013, 40(6):114-117.
[23] ZHOU S H, DING N N, HAN R H, et al.Metabolic engineering and fermentation optimization strategies for producing organic acids of the tricarboxylic acid cycle by microbial cell factories[J].Bioresource Technology, 2023, 379:128986.