随着人们对外表美观的重视,脱发问题越来越受到关注。脱发不仅影响个人形象,还可能导致心理困扰和自尊心下降。现有的脱发治疗方法,如米诺地尔和非那雄胺,尽管在一定程度上有效,但其副作用较强。例如,在临床治疗中使用米诺地尔,常见的不良反应是多毛症,部分患者会出现面部或其他部位长出过多的毛发、体位性低和血心动过速等不良反应[1]。因此,寻找新的、安全的治疗手段成为迫切需求。
头发生长周期包括3个阶段:生长期、退行期和休止期。毛发生长障碍主要原因是毛囊循环的改变,即生长期缩短和休止期延长。因此,调控毛囊的生长周期在改善脱发和促进毛发再生中至关重要。Wnt/β-catenin信号通路是调节毛囊生长发育和诱导毛囊再生的重要通路之一[2],该通路通过影响细胞内β-catenin的表达,促进下游靶基因LEF1等的表达,刺激细胞增殖,从而改善因脱发引起的毛囊萎缩和数量减少,许多研究表明激活Wnt/β-catenin信号通路可促进毛发再生[3]。除Wnt/β-catenin信号通路外,生长因子在毛发形态发生和生长周期中也起着关键作用。血管内皮生长因子(vascular endothelial growth factor,VEGF)、胰岛素生长因子-1(insulin-like growth factor 1,IGF-1)和转化生长因子β1(transforming growth factor β1,TGF-β1)等可以调控毛发周期的各个阶段,对毛发生长起到重要作用。
侧柏叶是柏科植物侧柏的枝与叶片,常被用于治疗脱发,研究表明侧柏叶及其复方制剂在防脱生发方面有着显著效果。刘青等[4]将侧柏叶、姜根、红车轴草叶和艾叶等提取物混合用于临床试验,发现坚持涂抹4周即可有效缓解脱发现象;马世宏等[5]以侧柏叶、何首乌为原料制备混合物,可明显改善小鼠雄激素源性脱发。近年来,益生菌及其代谢产物在调节毛发健康方面的潜力逐渐被发掘[6-7]。TSAI等[8]发现热灭活副干酪乳酪杆菌GMNL-653对头皮健康具有有益影响;CHAE等[9]发现植物乳植杆菌能够平衡皮肤微生物群,维持健康、正常的皮肤功能。由此可见,植物乳植杆菌在改善皮肤健康方面具有较好的潜力。
本文以植物乳植杆菌CCFM1351为研究对象,采用细胞和动物模型,通过定量检测生长因子VEGF、IGF-1、TGF-β1,以及Wnt/β-catenin信号通路和凋亡信号通路中关键分子的mRNA和蛋白表达水平,探讨其对侧柏叶防脱护发功能的影响,为利用益生菌和植物提取物开发新的脱发治疗策略提供科学依据。
1 材料与方法
1.1 实验材料
1.1.1 实验试剂
侧柏叶提取物,山西盛恒生物科技有限公司;qPCR相关引物,生工生物工程(上海)有限公司;反转录试剂盒、qPCR荧光定量试剂盒、CCK8试剂盒,南京诺唯赞生物公司;VEGF、TGF-β1、TGF-β2、Dickkopf相关蛋白1(Dickkopf-related protein 1,DKK1)、IGF-1、β-catenin、Ki67试剂盒,南京森贝伽生物科技有限公司;米诺地尔,北京索莱宝科技有限公司;非那雄胺,上海麦克林生化有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)及其他化学用品,国药集团化学试剂有限公司。
植物乳植杆菌CCFM1351,江南大学食品微生物菌种保藏中心;人毛囊真皮乳头细胞(human dermal papilla cells,HDPCs),由江南大学化学与材料工程学院馈赠;雄性C57BL/6J小鼠,北京维通利华实验动物技术有限公司。
1.1.2 仪器与设备
Countess 3细胞计数仪、Multiskan GO酶标仪,赛默飞世尔科技公司;HWS-150隔水式恒温培养箱,上海森信实验仪器有限公司;CFX Opus 96实时定量PCR仪器、CFX Opus 384实时定量PCR仪器、C1000实时定量基因扩增仪,美国Bio-Rad公司;5424R高速冷冻离心机,Eppendorf公司;SCIENTZ-10N/A冷冻干燥机,宁波新芝生物科技股份有限公司。
1.2 侧柏叶的发酵
将植物乳植杆菌CCFM1351以2%接种量接种于发酵培养基(侧柏叶提取物50 g/L,酵母粉10 g/L,调节pH至6.0~6.2,115 ℃高压灭菌20 min),37 ℃培养18 h。调节pH值至7.0,离心(8 000×g、4 ℃、15 min),收集的上清液用0.22 μm微孔滤膜过滤。冻干后得到发酵侧柏叶冻干粉。
1.3 植物乳植杆菌CCFM1351对HDPCs增殖的影响
1.3.1 HDPCs复苏与培养
添加一定量细胞完全培养基复苏HPDCs后,将细胞放置条件为37 ℃、5% CO2的细胞培养箱中培养过夜,待细胞贴壁生长至汇合度>80%时,用含2.5 g/L EDTA的胰蛋白酶对细胞进行消化处理后进行传代。
1.3.2 细胞增殖实验
细胞培养如1.3.1节,传代时对HDPCs计数,将细胞数调至1×105 个/mL。96孔培养板中每孔加入100 μL细胞悬液,于细胞培养箱中过夜。设置凋零组、对照组和样品组。样品组加入不同质量浓度的侧柏叶提取物和植物乳植杆菌发酵侧柏叶代谢产物。每组设置3个复孔,于细胞培养箱中培养24 h。检测时,去除上清液,加入新鲜配制的MTT溶液,37 ℃避光培养4 h后去除上清液,加入100 mL DMSO后振荡摇匀,酶标仪设置为490 nm读取OD值并计算细胞增殖率。
1.3.3 细胞RNA提取与基因相对表达量分析
细胞培养如1.3.1节,细胞数调至1.5×105 个/mL,6孔培养板中每孔加入2 mL细胞悬液,于细胞培养箱中过夜。样品组加入5 mg/mL侧柏叶提取物和植物乳植杆菌发酵侧柏叶代谢产物,0.1 μmol/L米诺地尔作为阳性对照。孵育24 h后去除上清液,使用预冷PBS洗涤细胞,重复2次。加入1 mL Trizol,反复抽吸吹打后转移至1.5 mL无酶离心管中。加入200 μL三氯甲烷,摇匀后静置10 min。4 ℃下12 000×g离心15 min,收集上清液至新的无酶离心管。加入等体积的异丙醇,摇匀后静置10 min,4 ℃下12 000×g离心10 min,弃上清液。使用体积分数75%乙醇洗涤底部的白色沉淀,重复2次后收集白色沉淀,即为样品RNA。通过逆转录试剂盒合成cDNA后按照SYBR Green荧光染料说明书步骤进行实时定量聚合链反应(real-time quantitative polymerization chain reaction,RT-qPCR),通过2-ΔΔCt计算方法分析相关基因mRNA的相对表达水平,引物序列见表1。
表1 细胞实验中引物序列
Table 1 Primer sequences used in cell experiments

引物名称引物序列(5'-3')GAPDHF:TCCATGACAACTTTGGTATCR:TGTAGCCAAATTCGTTGTCAβ-cateninF:AAAGCGGCTGTTAGTCACTGGR:CGAGTCATTGCATACTGTCCATCyclin DF:CGTGGCCTCTAAGATGAAGGR:TGCGGATGATCTGTTTGTTCTGF-β2F:CAGCACACTCGATATGGACCAR:CCTCGGGCTCAGGATAGTCTIGF-1F:GCTCTTCAGTTCGTGTGTGGAR:GCCTCCTTAGATCACAGCTCCBAXF:CCCGAGAGGTCTTTTTCCGAGR:CCAGCCCATGATGGTTCTGAT
1.3.4 细胞上清液生化指标测定
细胞培养如1.3.1节。根据ELISA试剂盒的说明书测定培养上清液中的VEGF、TGF-β1和DKK-1质量浓度,每组重复3次。
1.4 侧柏叶协同植物乳植杆菌CCFM1351对毛发生长的影响
1.4.1 动物实验造模及分组
56只6周龄雄性C57BL/6J小鼠(体重约为20 g),随机分成7组,每组8只,具体分组见表2。小鼠适应一周后正式进行试验。使用动物脱毛器去除小鼠部的毛发,涂抹脱毛膏后清洗,小鼠背部裸露皮肤呈粉红色,标志着C57BL/6J小鼠毛发生长处于休止期,即建立C57BL/6J小鼠脱发模型[10]。所有小鼠每天给予药物0.2 mL,连续21 d。在干预后第7、14、21天分别拍照记录小鼠背部皮肤并通过Image J软件计算毛发覆盖率。动物实验方案获得江南大学实验动物实验伦理委员会批准(伦理编号为:JN.No20230615c1600815)。
表2 动物实验方案
Table 2 Animal experimental design
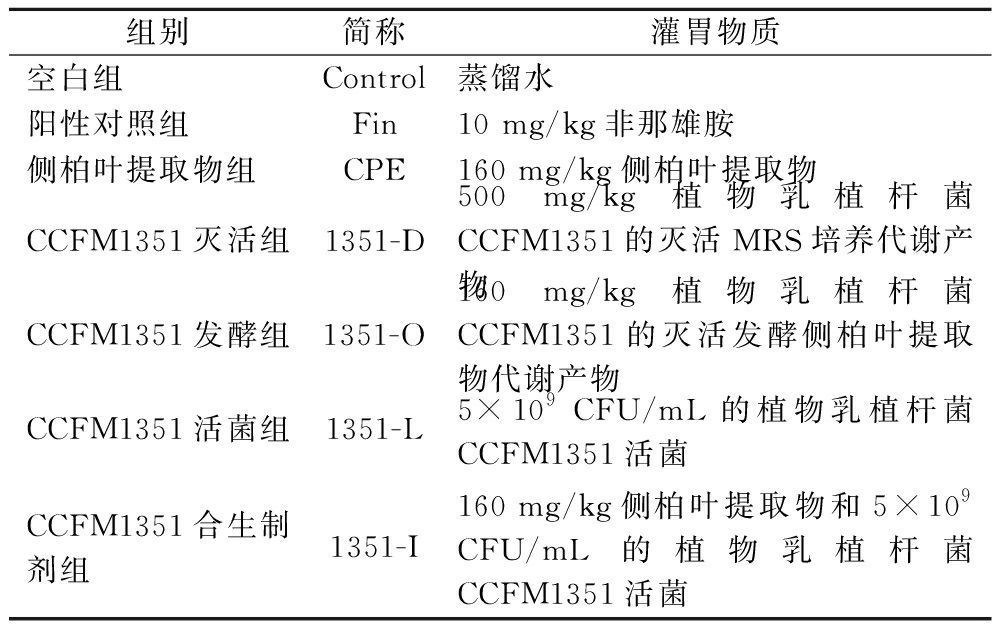
组别简称灌胃物质空白组Control蒸馏水阳性对照组Fin10 mg/kg非那雄胺侧柏叶提取物组CPE160 mg/kg侧柏叶提取物CCFM1351灭活组1351-D500 mg/kg植物乳植杆菌CCFM1351的灭活MRS培养代谢产物CCFM1351发酵组1351-O160 mg/kg植物乳植杆菌CCFM1351的灭活发酵侧柏叶提取物代谢产物CCFM1351活菌组1351-L5×109 CFU/mL的植物乳植杆菌CCFM1351活菌CCFM1351合生制剂组1351-I160 mg/kg侧柏叶提取物和5×109 CFU/mL的植物乳植杆菌CCFM1351活菌
1.4.2 皮肤RNA提取与基因相对表达量分析
小鼠背部皮肤的RNA提取采用Trizol法,具体操作如1.3.3节,使用引物如表3所示。
表3 动物实验中的引物序列
Table 3 Primer sequences used in mice experiments

引物名称引物序列(5'-3')GAPDHF:AGGTCGGTGTGAACGGATTTGR:TGTAGACCATGTAGTTGAGGTCAWnt5αF:CAACTGGCAGGACTTTCTCAAR:CCTTCTCCAATGTACTGCATGTGWnt10bF:GCGGGTCTCCTGTTCTTGGR:CCGGGAAGTTTAAGGCCCAGTGF-β2F:CTTCGACGTGACAGACGCTR:GCAGGGGCAGTGTAAACTTATTLEF1F:TGTTTATCCCATCACGGGTGGR:CATGGAAGTGTCGCCTGACAGBcl2F:GTCGCTACCGTCGTGACTTCR:CAGACATGCACCTACCCAGCBAXF:TGAAGACAGGGGCCTTTTTGR:AATTCGCCGGAGACACTCG
1.4.3 皮肤组织生化指标测定
实验结束后处死小鼠,剪取小鼠背部皮肤组织30 mg,加入270 μL PBS制备匀浆,3 000×g离心20 min后收集上清液,根据ELISA试剂盒的说明书测定小鼠背部皮肤的β-catenin、VEGF、IGF-1、TGF-β1和Ki67质量浓度,每组重复3次。
1.5 数据统计与分析
使用SPSS 16.0统计软件来对显著性差异进行统计学分析。组间比较使用单因素方差分析(One-Way ANOVA),P<0.05表示差异显著。
2 结果与讨论
2.1 植物乳植杆菌CCFM1351发酵侧柏叶代谢产物对HDPCs的影响
毛乳头细胞(dermal papilla cells,DPC)是位于毛囊基部的特殊间充质细胞,能够分泌多种物质来促进和维持毛囊的生长发育。许多研究用DPC来评估物质对毛发生长的影响[11]。人毛囊真皮乳头细胞(human dermal papilla cells,HDPCs)是从真皮结缔组织细胞分化而来的细胞,其数量随着毛囊生长而增加。沈胡驰等[12]发现茶麸黄酮可以显著促进HDPCs增殖,具有潜在的促进头发增长能力。通过研究植物乳植杆菌CCFM1351发酵侧柏叶代谢产物对HDPCs增殖的影响,确定其是否具有协同侧柏叶增强防脱护发功效的潜力。
2.1.1 植物乳植杆菌CCFM1351发酵侧柏叶代谢产物对HDPCs细胞活力的影响
为探究不同浓度的植物乳植杆菌CCFM1351发酵侧柏叶代谢产物对HDPCs增殖的影响,通过MTT法检测了不同发酵侧柏叶代谢产物对HDPCs的细胞活力的影响,结果如表4所示。当侧柏叶代谢产物质量浓度为5 mg/mL时,HDPCs的细胞活力显著提高,细胞活力为124.41%,故选用5 mg/mL作为后续实验质量浓度。
表4 发酵侧柏叶代谢产物对HDPCs活力的影响 单位:%
Table 4 Effects of metabolites from fermented Cacumenplatycladion activity of HDPCs
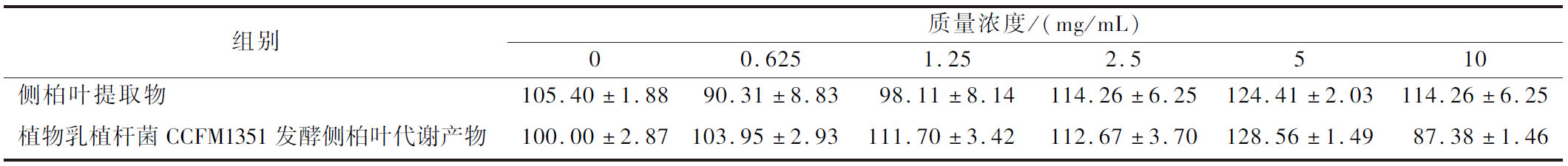
组别质量浓度/(mg/mL)00.6251.252.5510侧柏叶提取物105.40±1.8890.31±8.8398.11±8.14114.26±6.25124.41±2.03114.26±6.25植物乳植杆菌CCFM1351发酵侧柏叶代谢产物100.00±2.87103.95±2.93111.70±3.42112.67±3.70128.56±1.4987.38±1.46
2.1.2 植物乳植杆菌CCFM1351发酵侧柏叶代谢产物对HDPCs Wnt/β-catenin信号通路的影响
Wnt/β-catenin信号通路在毛囊的增殖分化以及生长周期的调控中起着关键作用。β-catenin是Wnt/β-catenin信号通路的关键蛋白,Cyclin D是Wnt/β-catenin信号通路的下游靶基因之一。为了探究菌株发酵侧柏叶代谢产物对HDPCs Wnt/β-catenin信号通路的影响,通过实时荧光定量法检测了发酵侧柏叶代谢产物与HDPCs共培养后HDPCs中β-catenin和Cyclin D的mRNA表达,结果如图1-a、图1-b。与Control组相比,阳性对照组米诺地尔显著提高了β-catenin和Cyclin D的mRNA的转录水平,侧柏叶提取物干预后未提高β-catenin和Cyclin D的mRNA的转录水平,而植物乳植杆菌CCFM1351发酵侧柏叶代谢产物干预后仅显著提高Cyclin D mRNA的转录水平(P<0.05)。
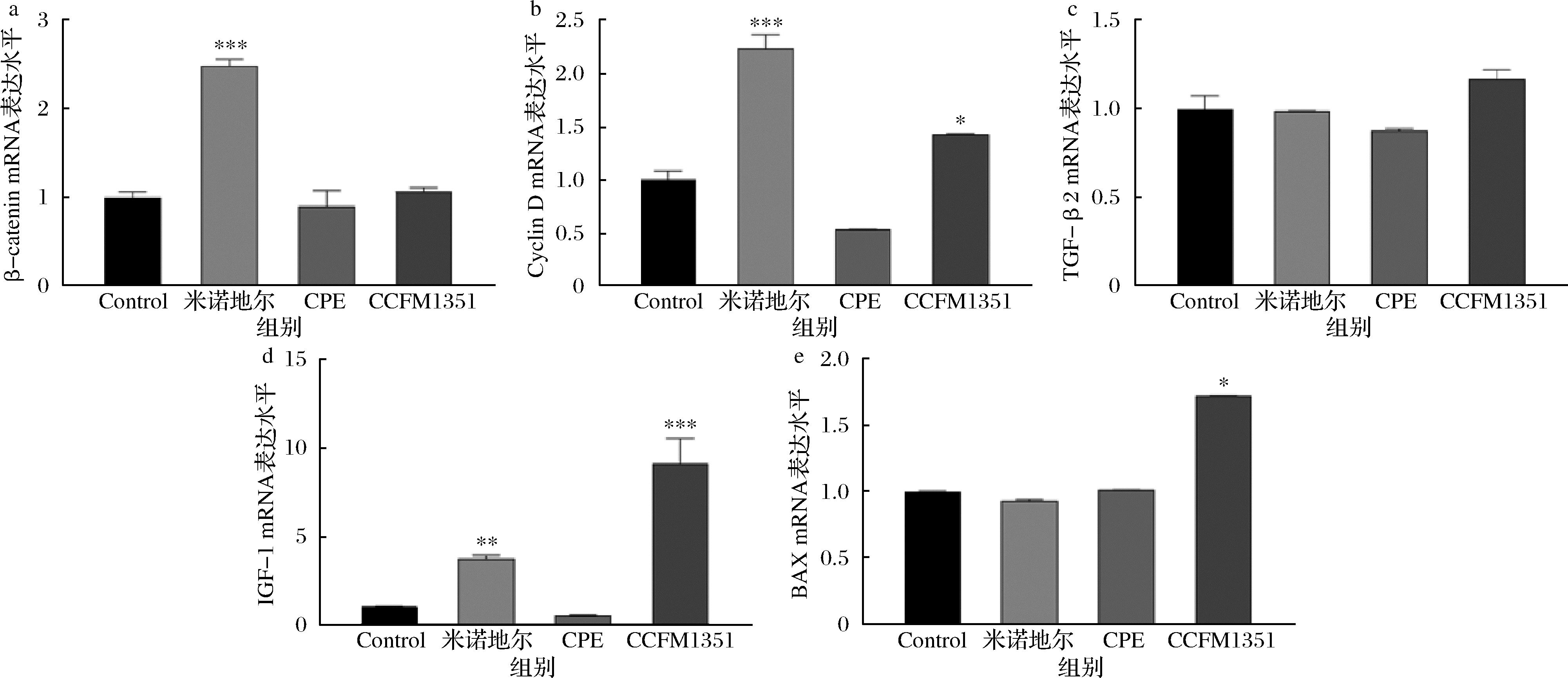
a-β-catenin;b-Cyclin D;c-TGF-β2;d-IGF-1;e-BAX
图1 植物乳植杆菌CCFM1351发酵侧柏叶代谢物对HDPCs Wnt/β-catenin通路、生长因子、凋亡通路的影响
Fig.1 Effects of Lactiplantibacillus plantarum CCFM1351 fermentation of C. platycladi metabolites on Wnt/β-catenin pathway, growth factors, and apoptotic pathway in HDPCs
注:CPE为侧柏叶提取物组,CCFM1351为植物乳植杆菌CCFM1351发酵侧柏叶代谢产物组,*表示与Control组相比具有显著性差异,*P<0.05,**P<0.01,***P<0.001(下同)。
2.1.3 植物乳植杆菌CCFM1351发酵侧柏叶代谢产物对HDPCs相关生长因子表达的影响
毛囊的生长发育过程受多种生长因子的调控,TGF-β2通过诱导细胞凋亡促进毛囊向退行期转变,对毛囊的生长和周期性循环起负性调节作用,IGF-1是一种结构性胰岛素同源物,可以促进毛囊细胞增殖[13-14]。为了探究发酵侧柏叶代谢产物对HDPCs相关生长因子表达的影响,通过实时荧光定量法检测了发酵侧柏叶代谢产物与HDPCs共培养后HDPCs中TGF-β2和IGF-1的mRNA表达,结果如图1-c、图1-d。与Control组对照,米诺地尔阳性对照组只对IGF-1的mRNA转录水平有上调能力,植物乳植杆菌CCFM1351发酵侧柏叶代谢产物干预后显著上调了IGF-1 mRNA的转录水平,且效果优于米诺地尔阳性对照组。
2.1.4 植物乳植杆菌CCFM1351发酵侧柏叶代谢产物对HDPCs细胞凋亡信号通路的影响
细胞凋亡与毛囊生长的过早终止是脱发的关键因素之一。在存在凋亡刺激的情况下,促凋亡蛋白BAX表达增加。为了探究发酵侧柏叶对HDPCs中BAX mRNA表达的影响,通过实时荧光定量法检测了发酵侧柏叶与HDPCs共培养后HDPCs中BAX mRNA的转录水平,结果如图1-e所示。与Control组对比,米诺地尔阳性对照组、侧柏叶提取物干预后均对HDPCs中BAX mRNA表达没有显著的下调作用,而植物乳植杆菌CCFM1351发酵侧柏叶代谢产物提高了BAX的mRNA的转录水平。
2.1.5 植物乳植杆菌CCFM1351发酵侧柏叶代谢产物对HDPCs生化指标的影响
以调控毛囊生长发育相关调控通路的关键靶点为切入口,接着对HDPCs相关生化指标进行了分析。VEGF在毛囊新生细胞中高表达,促进毛囊周围的血管生成并诱导毛囊进入生长期[15];TGF-β1高表达抑制毛囊发育,可导致上皮细胞凋亡和毛囊周期由生长期向退行期转变[16];DKK-1是一种分泌蛋白,具有拮抗Wnt/β-catenin信号通路的能力[17]。为了探究发酵侧柏叶代谢产物对HDPCs中这些生化指标的影响,通过ELISA法检测了发酵侧柏叶代谢产物与HDPCs共培养后HDPCs上清液中VEGF、TGF-β1、DKK-1的含量,结果如图2。与Control组相比,米诺地尔阳性对照组和侧柏叶提取物组干预后可以促进HDPCs分泌VEGF,未抑制HDPCs中的TGF-β1的分泌,显著抑制HDPCs中DKK-1的分泌(P<0.001),植物乳植杆菌CCFM1351发酵侧柏叶代谢产物能够显著抑制DKK-1的分泌(P<0.001),对VEGF和TGF-β1的分泌无显著作用。
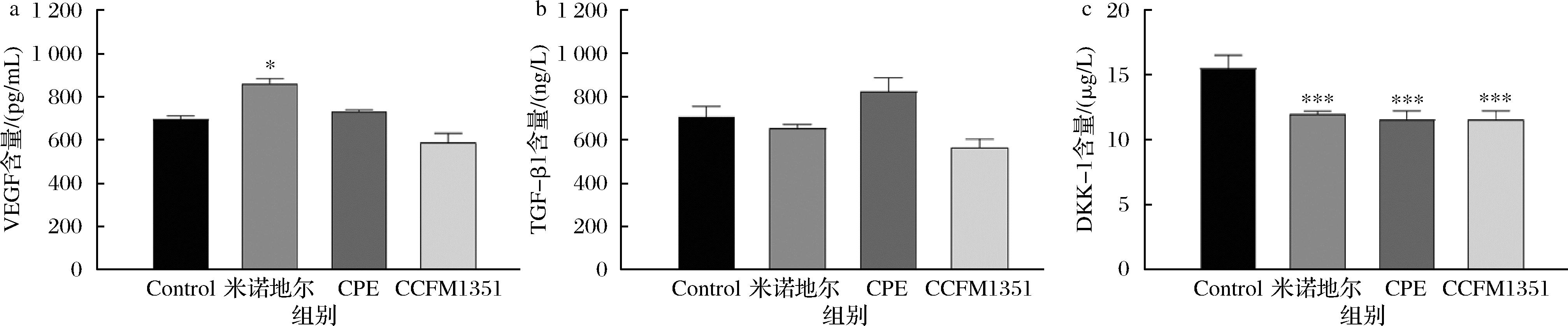
a-VEGF;b-TGF-β1;c-DKK-1
图2 发酵侧柏叶代谢物产物对HDPCs分泌VEGF、TGF-β1、DKK-1的影响
Fig.2 Effect of metabolite products of fermented C. platycladi on secretion of VEGF, TGF-β1, and DKK-1 by HDPCs
2.2 植物乳植杆菌CCFM1351对侧柏叶体内防脱生发作用的影响研究
基于2.1节的研究结果,与侧柏叶提取物比较,植物乳植杆菌CCFM1351发酵侧柏叶代谢产物可以显著调控毛囊生长发育相关通路的多个靶点。建立C57BL/6J小鼠脱发模型,设立不同的组别,通过观察小鼠背部皮肤颜色变化、毛发生长状态、毛囊生长发育相关基因表达和皮肤生化指标进一步研究植物乳植杆菌CCFM1351对侧柏叶防脱护发功能的影响。
2.2.1 侧柏叶协同植物乳植杆菌CCFM1351可促进毛发生长
选择6周龄C57BL/6J小鼠并对背部进行脱毛处理,观察给药干预后第7、14和21天时各组小鼠背部的皮肤颜色变化。植物乳植杆菌CCFM1351相关组别小鼠毛发生长情况见图3-a。与空白对照组相比,CCFM1351灭活组、发酵组、活菌组及合生制剂组均能促进小鼠的毛发生长。其中,CCFM1351发酵组和活菌组效果相近,但都明显优于其灭活组、侧柏叶提取物组和阳性对照组;CCFM1351合生制剂组明显优于侧柏叶提取物组和阳性对照组,但低于发酵组和活菌组。
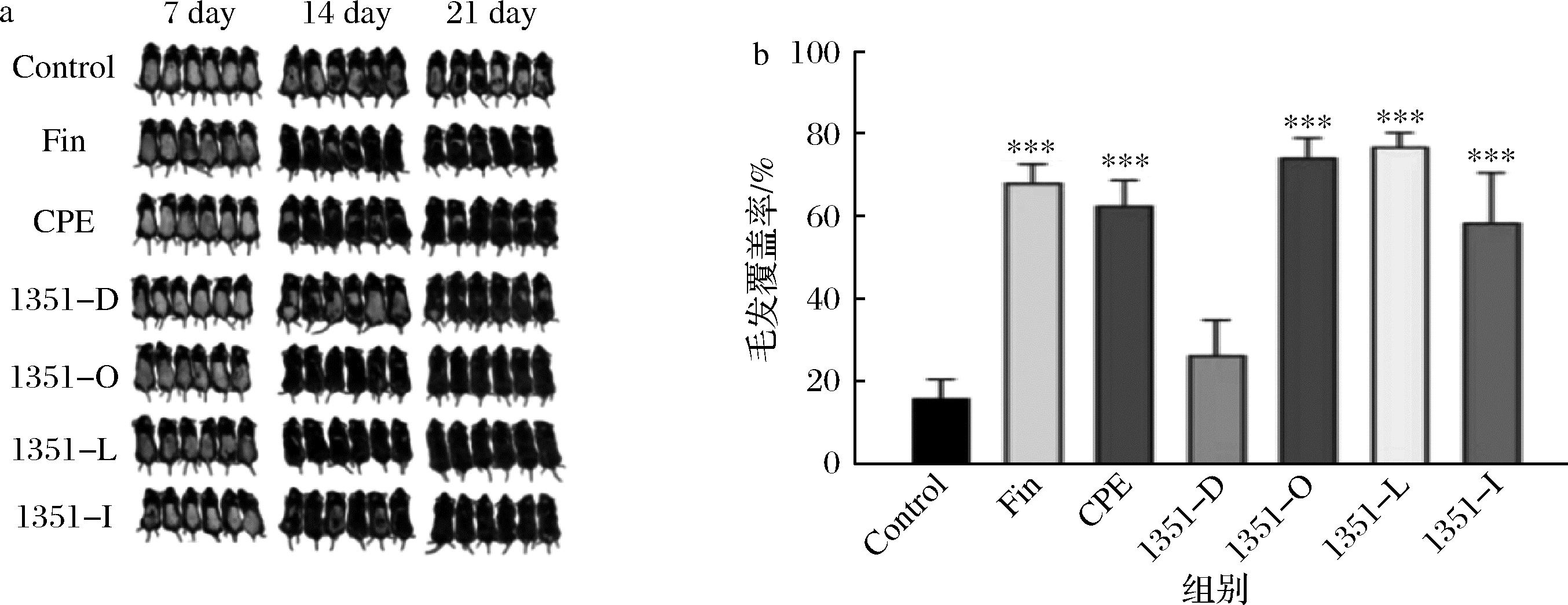
a-小鼠背部皮肤颜色变化;b-小鼠背部毛发覆盖率
图3 CCFM1351干预对小鼠背部毛发生长的影响
Fig.3 Effect of CCFM1351 intervention on dorsal hair growth in mice
为了更直观地评估各组对小鼠毛发生长的促进作用,本研究选择干预14 d时测量小鼠皮肤表面的毛发覆盖程度对其进行量化。如图3-b所示,与Control组相比,CCFM1351活菌组(1351-L)毛发覆盖率更高,与合生制剂组(1351-I)相比亦是如此,表明植物乳植杆菌CCFM1351自身代谢物能够较好促进毛发生长,其效果略低于植物乳植杆菌CCFM1351发酵组(1351-O)。CCFM1351发酵组背部毛发覆盖率提高了3.68%,高于其灭活组(1351-D)和侧柏叶提取物组(CPE)。综合来看,植物乳植杆菌CCFM1351发酵组具有最佳的促进毛发生长的能力,表明其有协同发酵侧柏叶、促进毛发生长的能力。
2.2.2 侧柏叶协同植物乳植杆菌CCFM1351对小鼠皮肤中Wnt/β-catenin信号通路的影响
Wnt/β-catenin信号通路是调节毛囊生长的最重要信号之一,可以促进HDPCs增殖和诱导毛囊再生。Wnt5a和Wnt10b是Wnt家族重要成员,可以调控毛囊的生长发育。LEF1是Wnt/β-catenin信号通路下游的效应转录因子[18-19]。为了探讨影响机体毛发生长的调控机制,进一步检测了干预后小鼠背部皮肤中Wnt5a、Wnt10b和LEF1的mRNA表达情况,结果如图4-a~图4-c。与Control组相比:侧柏叶提取物组显著上调了Wnt10b mRNA的转录水平(P<0.001),对Wnt5a和LEF1的mRNA的转录水平无显著上调作用;CCFM1351各组对Wnt5a和LEF1 mRNA的转录水平无显著上调作用,CCFM1351活菌组及合生制剂组的Wnt10b mRNA表达分别提高了3.47倍和3.79倍(P<0.05)。这一结果与PERKINS等[20]的发现相一致,Wnt10b在毛囊再生中的作用至关重要,能够通过激活β-catenin途径促进毛发生长,植物乳植杆菌CCFM1351本身具有促进毛发生长的能力,也能协同侧柏叶发酵,进一步增强防脱护发。
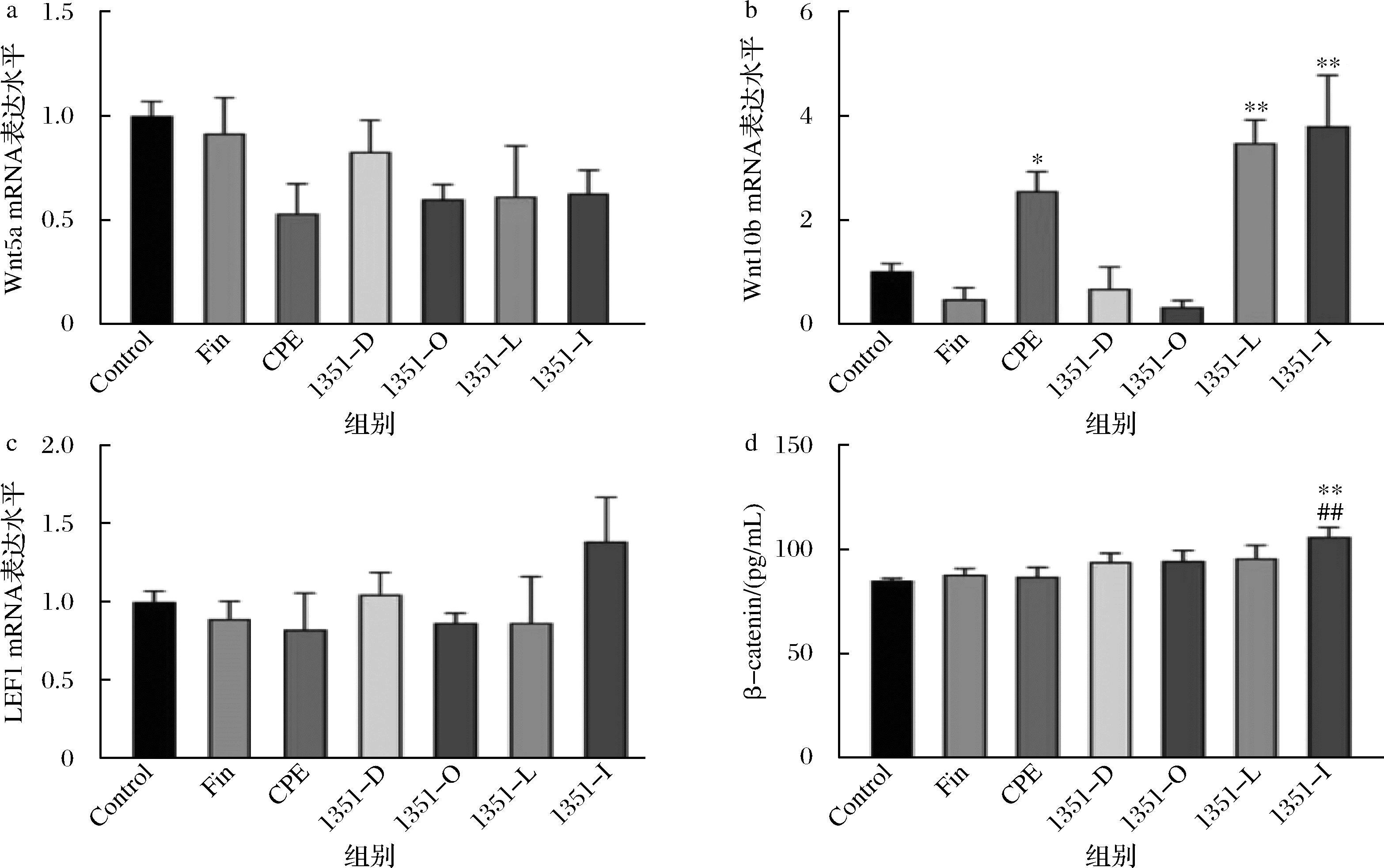
a-Wnt5a的mRNA转录水平;b-Wnt10b的mRNA转录水平;c-LEF1的mRNA转录水平;d-β-catenin的含量
图4 CCFM1351各组别对小鼠皮肤中Wnt/β-catenin信号通路的影响
Fig.4 Effect of CCFM 1351 on the Wnt/β-catenin signalling pathway in mouse skin by group
注:#表示与侧柏叶提取物组相比具有显著性差异,##P<0.01(下同)。
采用ELISA法检测小鼠背侧皮肤中β-catenin的含量,结果如图4-d。与Control组对比,侧柏叶提取物干预后的小鼠皮肤中β-catenin含量有提升,CCFM1351合生制剂组小鼠皮肤中β-catenin含量有显著性提升(P<0.01),优于侧柏叶提取物组。以上结果表明,植物乳植杆菌CCFM1351在侧柏叶提取物的存在下,能够较好地增加小鼠的毛发生长。与前文CHAE等[9]关于植物乳植杆菌抗菌活性的发现不同,本研究首次揭示了植物乳植杆菌CCFM1351在发酵侧柏叶后对Wnt/β-catenin信号通路的协同增强效应。这一发现进一步表明,通过微生物发酵可以显著增强天然提取物的生物活性,从而提高其在毛发生长中的潜力。
2.2.3 侧柏叶协同植物乳植杆菌CCFM1351对小鼠皮肤中相关生长因子的影响
为了探讨侧柏叶协同乳杆菌是否通过调控相关生长因子影响机体毛发生长,进一步检测了干预后小鼠背部皮肤中负调节作用的TGF-β2的表达情况,结果见图5-a。与Control组相比:侧柏叶提取物可下调TGF-β2 mRNA的表达,降低了35.10%;CCFM1351合生制剂组可下调TGF-β2 mRNA的表达,降低了36.63%;其余组别无明显抑制现象。由此可以看出,植物乳植杆菌CCFM1351具有协同增强侧柏叶提取物防脱发护发作用的能力。

a-TGF-β2;b-VEGF;c-IGF-1;d-TGF-β1
图5 CCFM1351对小鼠皮肤中相关生长因子的影响
Fig.5 Effect of CCFM1351 on related growth factors in mouse skin
采用ELISA法检测小鼠背侧皮肤中VEGF、IGF-1、TGF-β1的含量,结果见图5-b~图5-d。与Control组相比:侧柏叶提取物干预后对小鼠背部皮肤中VEGF、IGF-1含量有提高作用,对小鼠背部皮肤TGF-β1的含量有降低作用;CCFM1351合生制剂组小鼠皮肤中VEGF含量有显著性提升(P<0.05),CCFM1351灭活组和活菌组小鼠皮肤中IGF-1含量有显著性提升(P<0.05),分别提高了19.76%和17.67%。
2.2.4 侧柏叶协同植物乳植杆菌CCFM1351对小鼠皮肤中细胞凋亡信号通路的影响
为了探究侧柏叶协同乳杆菌的促生发作用是否与细胞凋亡有关,我们检测了细胞凋亡调控蛋白Bcl2 mRNA[21]和负调控蛋白BAX mRNA的表达,结果如图6-a、图6-b。与Control组相比:侧柏叶提取物组对Bcl2 mRNA的转录水平无显著上调作用,可以下调BAX mRNA的转录水平;CCFM1351灭活组Bcl2 mRNA的转录显著上调了2.15倍(P<0.01);CCFM1351灭活组、发酵组、活菌组和合生制剂组BAX mRNA的转录显著下调了51.57%、33.20%、34.95%和51.46%(P<0.05)。以上结果与沈胡驰等[12]对DPC增殖与生长因子相关的结果形成对比,表明植物乳植杆菌CCFM1351本身能够抑制小鼠皮肤中细胞的凋亡,也具有协同侧柏叶来抑制小鼠皮肤细胞凋亡的能力,护发作用是生长因子与凋亡通路共同作用的结果。
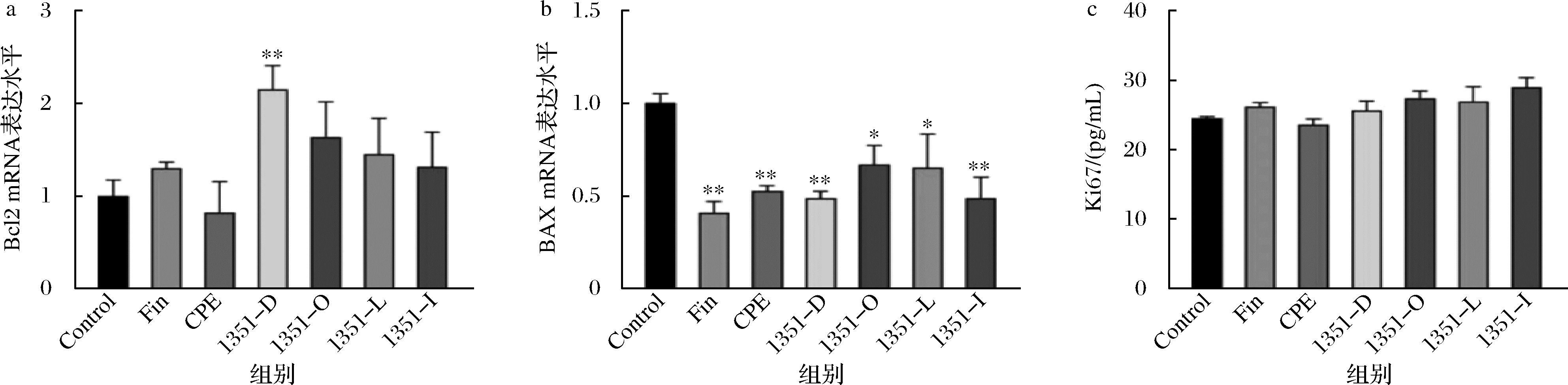
a-Bcl2的mRNA转录水平;b-BAX的mRNA转录水平;c-Ki67的含量
图6 CCFM1351对小鼠皮肤中细胞凋亡信号通路的影响
Fig.6 Effect of CCFM 1351 on apoptosis signaling pathway in mouse skin
Ki67蛋白是细胞周期相关的一种核蛋白,是检测细胞增殖的重要标志物[22]。采用ELISA法检测小鼠背侧皮肤中Ki67的含量结果如图6-c。与Control组相比,各组未见显著上调作用。
3 结论
本研究系统地评估了植物乳植杆菌CCFM1351对侧柏叶防脱护发功能的影响,发现其具有显著的促进作用。通过细胞实验,发现植物乳植杆菌CCFM1351发酵侧柏叶代谢产物在5 mg/mL质量浓度下显著提高了HDPCs细胞活力,显著上调了HDPCs中IGF-1和Cyclin D的mRNA的转录水平。在脱毛小鼠模型中,CCFM1351合生制剂组显著促进了小鼠背部毛发的再生,其毛发覆盖率在第21天达到最高值;进一步分析发现,CCFM1351合生制剂组上调了Wnt/β-catenin信号通路的关键蛋白β-catenin的mRNA转录水平,并显著提高了小鼠皮肤中VEGF和IGF-1的含量,同时下调了TGF-β2和BAX的表达,从而促进毛发生长并抑制毛囊细胞凋亡;CCFM1351发酵侧柏叶提取物促进了小鼠背部毛发再生,下调了皮肤中BAX的mRNA的转录水平(与细胞实验结果存在差异,有待进一步研究)。以上结果表明,发酵或者直接与侧柏叶提取物复合,植物乳植杆菌CCFM1351对侧柏叶提取物发挥防脱护发功能具有协同促进作用。尽管具体机制尚未阐述清楚,本研究为开发新型脱发治疗手段提供了新的思路和方向,具有较好的应用前景。
[1] 刘起彬, 高建, 谢林海.雄激素性脱发的治疗现状[J].中国美容整形外科杂志, 2023, 34(9):576-579.LIU Q B, GAO J, XIE L H.Current status of treatment of androgenetic alopecia [J].Chinese Journal of Aesthetic and Plastic Surgery, 2023, 34(9):576-579.
[2] CHOI Y S, ZHANG Y H, XU M G, et al.Distinct functions for Wnt/β-catenin in hair follicle stem cell proliferation and survival and interfollicular epidermal homeostasis[J].Cell Stem Cell, 2013, 13(6):720-733.
[3] CHOI B Y.Targeting Wnt/β-catenin pathway for developing therapies for hair loss[J].International Journal of Molecular Sciences, 2020, 21(14):4915.
[4] 刘青, 黄芳.侧柏、姜、红车轴草、艾复合提取物的防脱发功效[J].广东化工, 2022, 49(22):76-78.LIU Q, HUANG F.Anti-hair loss effect of a mixture comprising extracts of arborvitae, ginger, clover and mugwort[J].Guangdong Chemical Industry, 2022, 49(22):76-78.
[5] 马世宏, 单承莺, 聂韡, 等.侧柏叶、何首乌复合提取物防脱发功效研究[J].中国野生植物资源, 2021, 40(5):43-47.MA S H, SHAN C Y, NIE W, et al.Study on the anti-hair loss effects of the compound extract of Platycladus orientalis and Polygonum multiflorum[J].Chinese Wild Plant Resources, 2021, 40(5):43-47.
[6] YIN C S, MINH NGUYEN T T, YI E J, et al.Efficacy of probiotics in hair growth and dandruff control:A systematic review and meta-analysis[J].Heliyon, 2024, 10(9):e29539.
[7] LAM S, ZHANG J W, YANG K L, et al.Modulation of gut microbiota impacts diet-induced and drug-induced alopecia in mice[J].Gut, 2022, 71(11):2366-2369.
[8] TSAI W H, FANG Y T, HUANG T Y, et al.Heat-killed Lacticaseibacillus paracasei GMNL-653 ameliorates human scalp health by regulating scalp microbiome[J].BMC Microbiology, 2023, 23(1):121.
[9] CHAE M, KIM B J, NA J, et al.Antimicrobial activity of Lactiplantibacillus plantarum APsulloc 331261 and APsulloc 331266 against pathogenic skin microbiota[J].Frontiers in Bioscience, 2021, 13(2):237-248.
[10] LEE Y I, HAM S, LEE S G, et al.An exploratory in vivo study on the effect of annurca apple extract on hair growth in mice[J].Current Issues in Molecular Biology, 2022, 44(12):6280-6289.
[11] 苏胤杰, 杨劲, 张艺, 等.毛乳头细胞的研究现状[J].医学综述, 2014, 20(1):12-14.SU Y J, YANG J, ZHANG Y, et al.The cell of dermal papilla at a glance[J].Medical Recapitulate, 2014, 20(1):12-14.
[12] 沈胡驰, 陈殿松, 杨井国, 等.茶麸黄酮促进毛乳头细胞增殖和VEGF分泌的研究[J].日用化学工业, 2022, 52(1):44-49.SHEN H C, CHEN D S, YANG J G, et al.Study on the promotion of proliferation of dermal papilla cells and VEGF secretion by flavonoids from camellia seed cake[J].China Surfactant Detergent &Cosmetics, 2022, 52(1):44-49.
[13] WEGER N, SCHLAKE T.IGF-I signalling controls the hair growth cycle and the differentiation of hair shafts[J].Journal of Investigative Dermatology, 2005, 125(5):873-882.
[14] TRÜEB R M.Further clinical evidence for the effect of IGF-1 on hair growth and alopecia[J].Skin Appendage Disorders, 2018, 4(2):90-95.
[15] KIM J, SHIN J Y, CHOI Y H, et al.Hair growth promoting effect of hottuynia cordata extract in cultured human hair follicle dermal papilla cells[J].Biological &Pharmaceutical Bulletin, 2019, 42(10):1665-1673.
[16] DANILENKO D M, RING B D, PIERCE G F.Growth factors and cytokines in hair follicle development and cycling:Recent insights from animal models and the potentials for clinical therapy[J].Molecular Medicine Today, 1996, 2(11):460-467.
[17] INUI S, ITAMI S.Molecular basis of androgenetic alopecia:From androgen to paracrine mediators through dermal papilla[J].Journal of Dermatological Science, 2011, 61(1):1-6.
[18] MACDONALD B T, TAMAI K, HE X.Wnt/β-catenin signaling:Components, mechanisms, and diseases[J].Developmental Cell, 2009, 17(1):9-26.
[19] SOMA T, FUJIWARA S, SHIRAKATA Y, et al.Hair-inducing ability of human dermal papilla cells cultured under Wnt/β-catenin signalling activation[J].Experimental Dermatology, 2012, 21(4):307-309.
[20] PERKINS R S, SINGH R, ABELL A N, et al.The role of WNT10B in physiology and disease:A 10-year update[J].Frontiers in Cell and Developmental Biology, 2023, 11:1120365.
[21] VOGLER M, DINSDALE D, DYER M S, et al.Bcl-2 inhibitors:Small molecules with a big impact on cancer therapy[J].Cell Death and Differentiation, 2009, 16(3):360-367.
[22] WEI L Y, LI Y M, HAO Z N, et al.Fermentation improves antioxidant capacity and γ-aminobutyric acid content of Ganmai Dazao Decoction by lactic acid bacteria[J].Frontiers in Microbiology, 2023, 14:1274353.