长期过量的饮酒会导致肝脏损伤,引起酒精性肝病(alcoholic liver disease,ALD),ALD是肝脏类疾病死亡的主要原因之一[1]。据报道,氧化应激和炎症反应在ALD的发展中发挥着重要作用,具有抗氧化或抗炎活性的化合物能够显著改善ALD[2]。如玉米胚芽粉白蛋白肽[3]、黑豆衍生肽[4]、豆粕肽[5]、薏苡仁蛋白水解物[6]、槲皮素多酚[7]、姜黄多酚[8]、山萘酚[9]、莲藕多酚[10]等。此外,在体内酒精代谢过程中会产生活性氧(reactive oxygen species,ROS),ROS会对蛋白质、脂质和核酸等生物大分子物质造成损伤,破坏其正常的结构和功能。ROS还可能引起脂质过氧化并促进肝脏氧化应激,促发细胞凋亡与炎症,最终导致肝损伤[11]。目前,ALD的治疗主要包括药物干预和手术治疗。然而,化学药物的长期摄入可能会增加消化系统和肝脏的负担,且手术治疗一般仅用于重症肝病患者[12]。因此,开发天然产物或者食品衍生化合物作为功能性食品或营养保健品以预防ALD的研究迫在眉睫。
青稞酒糟(highland barley distiller’s grains,HBDG)是青稞酒生产过程中产生的一种有价值的副产品,含有丰富的蛋白质、黄酮类物质、纤维素以及脂肪[13]等。蛋白及其水解物作为HBDG主要成分之一,表现出多种生物学功能。例如碱溶酸沉加碱性蛋白酶酶解制备的HBDG多肽,在质量浓度为10 mg/mL时,对乙醇脱氢酶的激活程度最高,具有良好的醒酒效果。当HBDG多肽质量浓度为21 μg/L时,对DPPH自由基、羟自由基和超氧阴离子自由基的清除率较高,具有良好的抗氧化活性[14]。研究表明,膳食多酚可作为自由基清除剂或金属螯合剂,中断脂质自氧化链反应的传播阶段[15]。因此,多酚作为膳食补充剂可以缓解急性或慢性饮酒引起的氧化应激,改善脂质积累[16]。除此之外,WANG等[17]提取的多酚化合物通过抑制核因子-κB的活化来改善炎症,达到缓解酒精肝损伤的目的。相关体外研究发现,HBDG活性提取物能够有效清除DPPH自由基和ABTS阳离子自由基,表明其具有一定的抗氧化作用,在一定程度上能够改善氧化应激[18]。因此,HBDG活性提取物可能具有一定的解酒活性。然而,目前鲜有研究探讨HBDG多肽和HBDG多酚对酒精性肝损伤(alcoholic liver injury,ALI)小鼠的保护作用。在此基础上,本文通过行为学测试、生化指标检测和非靶向代谢组学分析评估HBDG多肽和HBDG多酚对酒精诱导的ALI小鼠的保肝作用,以期为HBDG活性提取物预防ALI提供理论依据,为HBDG的进一步开发利用奠定基础。
1 材料与方法
1.1 材料和仪器
52 ℃白酒、HBDG粉(过80目筛),天佑德青稞酒股份有限公司(中国青海);碱性蛋白酶(200 U/mg),索莱宝科技有限公司(中国北京);超氧化物歧化酶(superoxide dismutase,SOD)测试盒、乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)测试盒、甘油三酯(triglyceride,TG)测试盒、谷草转氨酶(aspartate aminotransferase,AST)测试盒、还原型谷胱甘肽(glutathione,GSH)测试盒、丙二醛(malondialdehyde,MDA)试剂盒,塞维尔生物科技有限公司(中国武汉);0.22 μm聚四氟乙烯滤膜,津腾实验设备有限公司(中国天津);15只雄性SPF级C57BL/6J小鼠购自中国农业科学院兰州兽医研究所实验动物中心[许可证号:SCXK(甘)2020-0002]实验方案经青海大学动物伦理委员会的批准(批准号SL-2021019)。
XU-10N-60A/B真空冷冻干燥机,上海析牛莱伯仪器有限公司;J-15/15R系列高速离心机,贝克曼库尔特国际贸易(上海)有限公司;DF-101S磁力搅拌器,上海鹰迪仪器设备有限公司;SHB-IIG型台式循环水式多用真空泵,郑州长城科工贸有限公司;KZ-III-F高速组织研磨仪,武汉赛维尔生物科技有限公司;5305真空浓缩仪,德国Eppendorf公司;BE-2600混匀仪,海门市其林贝尔仪器制造有限公司;Vanquish液相色谱仪、Q Exactive Focus质谱仪,美国Thermo公司。
1.2 实验方法
1.2.1 HBDG多肽粗提物的制备
利用碱溶酸沉法[14]提取HBDG中的蛋白,取适量HBDG粉于醇(95%乙醇)碱(0.5 mol/L NaOH)混合液(1∶2,体积比)中,固液比1∶40(g∶mL),磁力搅拌390 min后离心取上清液。调节上清液pH=4.7,静置2 h后取沉淀,水洗使蛋白pH为中性后冷冻干燥,得到粗蛋白粉末。将HBDG蛋白溶于蒸馏水中(1∶30,g∶mL),调节pH为10,加入碱性蛋白酶(1∶25,g∶mL),水解240 min,放置90 ℃水浴锅中15 min,离心15 min(4 000 r/min,4 ℃),取上清液,冻干备用。
1.2.2 HBDG多酚粗提物制备
称取HBDG粉少许,将其添加到体积分数60%的乙醇水溶液中,料液比为1∶30(g∶mL),在55 ℃下超声波萃取50 min[19]。所得溶液使用循环水式多用真空泵对其进行抽滤,通过60 ℃旋转蒸发浓缩,使溶液体积减少1/3,所得溶液冻干备用。
1.2.3 实验动物分组与给药
15只雄性SPF级C57BL/6J小鼠(25~30 g,中国农业科学院兰州兽医研究所实验动物中心),适应性喂养1周后[温度保持在(22±1) ℃,湿度(50±5)%,并接受12 h的光/暗循环],将15只SPF小鼠随机分为5组(n=3),空白对照组(Control)、模型组(M)、海王金樽阳性组(Y,187.5 mg/mL)、HBDG多肽组(DT,100 mg/mL)、HBDG多酚组(DF,100 mg/mL)。各给药组小鼠根据体重按(10 mL/kg bw)灌胃受试药物,Control、M组灌胃超纯水,除Control组外的其他组小鼠在灌胃给药30 min后给予10 mL/kg bw白酒(52°天佑德白酒),Control给予等剂量的超纯水,连续14 d,期间观察小鼠的活动状态。参考赵婷婷等[20]的造模方法并稍加修改,建立小鼠ALI模型。
1.2.4 小鼠行为学测定
以小鼠“翻正反射”消失与恢复判断小鼠醉酒与醒酒状态。小鼠灌酒后,背向下放在笼上,若背向下的姿势连续30 s以上则认为翻正反射消失,即为醉酒,否则为醒酒。记录各组小鼠醉酒时间(灌完酒到翻正反射消失时间)、醒酒时间(翻正反射消失到恢复翻正反射时间)。
1.2.5 小鼠血清及肝组织采集和制备
在末次灌胃后禁食不禁水12 h,麻醉后摘眼球取血,在室温下静置1~2 h后[21],将血清在低温离心机中以3 000 r/min分离15 min,并将血清样品冷冻于-80 ℃。取肝组织后用生理盐水漂洗肝脏表面血渍,擦干称质量,以备后用。
1.2.6 组织病理学分析
将肝脏组织固定在4%(体积分数)多聚甲醛,经脱水、包埋、切片和苏木素-伊红(Hematoxylin-eosin,HE)染色处理,光学显微镜下观察肝组织的组织病理学变化。
1.2.7 生化参数的测定
使用塞维尔生物科技有限公司(中国武汉)提供的试剂盒测量血清AST和TG水平以及肝脏组织ALDH、SOD活力、MDA含量和GSH含量。
1.2.8 肝脏的非靶向代谢组学分析
参考WANT等[22]的方法,在离心管中放入样品,组织提取液为体积分数75%的甲醇氯仿(甲醇∶氯仿=9∶1,体积比)混合水溶液,加入后于50 Hz研磨60 s,重复2次。超声波处理30 min后将其放置冰上30 min,4℃、12 000 r/min低温离心10 min取上清液,冷冻干燥。取200 μL 体积分数50%的乙腈配置2-氯-L-苯丙氨酸(4 mg/L),将样品溶解于配置好的溶液中。过滤液加入到检测瓶中,用于LC-MS检测。
色谱条件:使用ACQUITY UPLC® HSS T3(2.1×100 mm, 1.8 μm)色谱柱,流速0.3 mL/min,柱温40 ℃,进样量2 μL。流动相为0.1%甲酸乙腈(B2)和0.1%甲酸水(A2),以0~1 min,8%B2;1~8 min,8%~98%B2;8~10 min,98%B2;10~10.1 min,98%~8%B2;10.1~12 min,8%B2为正离子模式下梯度洗脱程序。流动相为乙腈(B3)和5 mmol/L甲酸铵水(A3),0~1 min,8%B3;1~8 min,8%~98%B3;8~10 min,98%B3;10~10.1 min,98%~8%B3;10.1~12 min,8%B3为负离子模式下梯度洗脱程序。质谱参数:电喷雾离子源(electrospray ionization,ESI),正负离子模式(ESI+、ESI-)分别采集数据。正、负离子喷雾电压分别为3.50 kV和-2.50 kV,鞘气40 Arb,辅助气10 Arb。毛细管温度325 ℃,分辨率70 000进行一级全扫描,一级离子扫描范围 100~1 000 m/z,并采用HCD进行二级裂解,碰撞能量30 eV,二级分辨率17 500。采用R XCMS软件包进行峰检测、峰过滤、峰对齐处理[23],参数设置有bw=2,ppm=15,peakwidth=c(5,30),mzwid=0.015,mzdiff=0.01,method=“centWave”,得到物质定量列表。代谢产物的多元统计分析、差异代谢产物分析及生物信息分析参照常规代谢组学数据分析方法[24]。
1.3 数据处理
利用SPSS 22.0分析数据,数据结果均表示为“平均值±标准差”。采用单因素方差分析进行统计分析,P<0.05认为显著。不同的字母表示不同组间显著差异。设定阈值变量投影重要性(variable importance in projection, VIP)>1.0且P<0.05,筛选出差异代谢物。
2 结果与分析
2.1 行为学测定
评价醉酒状态常见方法之一是翻正反射,观察记录醉酒小鼠的翻正反射恢复时间和翻正反射消失时间。研究表明,解酒口服液可以通过延长小鼠的醉酒时间,缩短醒酒时间的方法验证解酒效果[25]。由表1可知,M组小鼠摄入酒精后(24±1.53) min内翻正消失且醉酒率为100%。与Y组相比,DT组和DF组翻正消失时长较短,但是与M组相比,摄入HBDG多肽显著减少翻正恢复时长,从(190±12.34) min降低到(150±20.31) min(P<0.05)。除此之外,摄入HBDG多酚可显著增加小鼠的翻正消失时长,从(24±1.53) min提高到(35±2.52) min(P<0.05),并减少翻正恢复时长,从(190±12.34) min降低到(159±15.89) min。结果表明,HBDG活性提取物具有一定的醒酒效果。
表1 HBDG提取物对ALI小鼠行为指标的影响
Table 1 Effect of HBDG on behavioral indices of ALI mice

组别醉酒率/%翻正消失时长/min翻正恢复时长/minM10024±1.53190±12.34Y10040±4.04*144±14.33*DT66.733±4.00150±20.31*DF10035±2.52*159±15.89
注:*P<0.05,和M组比较。
2.2 肝脏组织的病理变化分析
各组小鼠肝组织病理切片如图1所示,M组中肝细胞与Control组相比胞质疏松淡染,出现点状的肝细胞坏死现象(黑色箭头),核溶解,伴有点状的淋巴细胞与粒细胞浸润(红色箭头);DF组中有炎性细胞浸润现象,但是相比较M组肝索排列较整齐,说明HBDG在一定程度上可以改善ALI小鼠酒精肝损伤,但是效果不显著。与M相比,DT组的肝细胞排列相对整齐,炎性细胞浸润和脂肪空泡化等情况均有显著改善;这表明HBDG多肽可以改善由于饮酒造成的肝损伤。
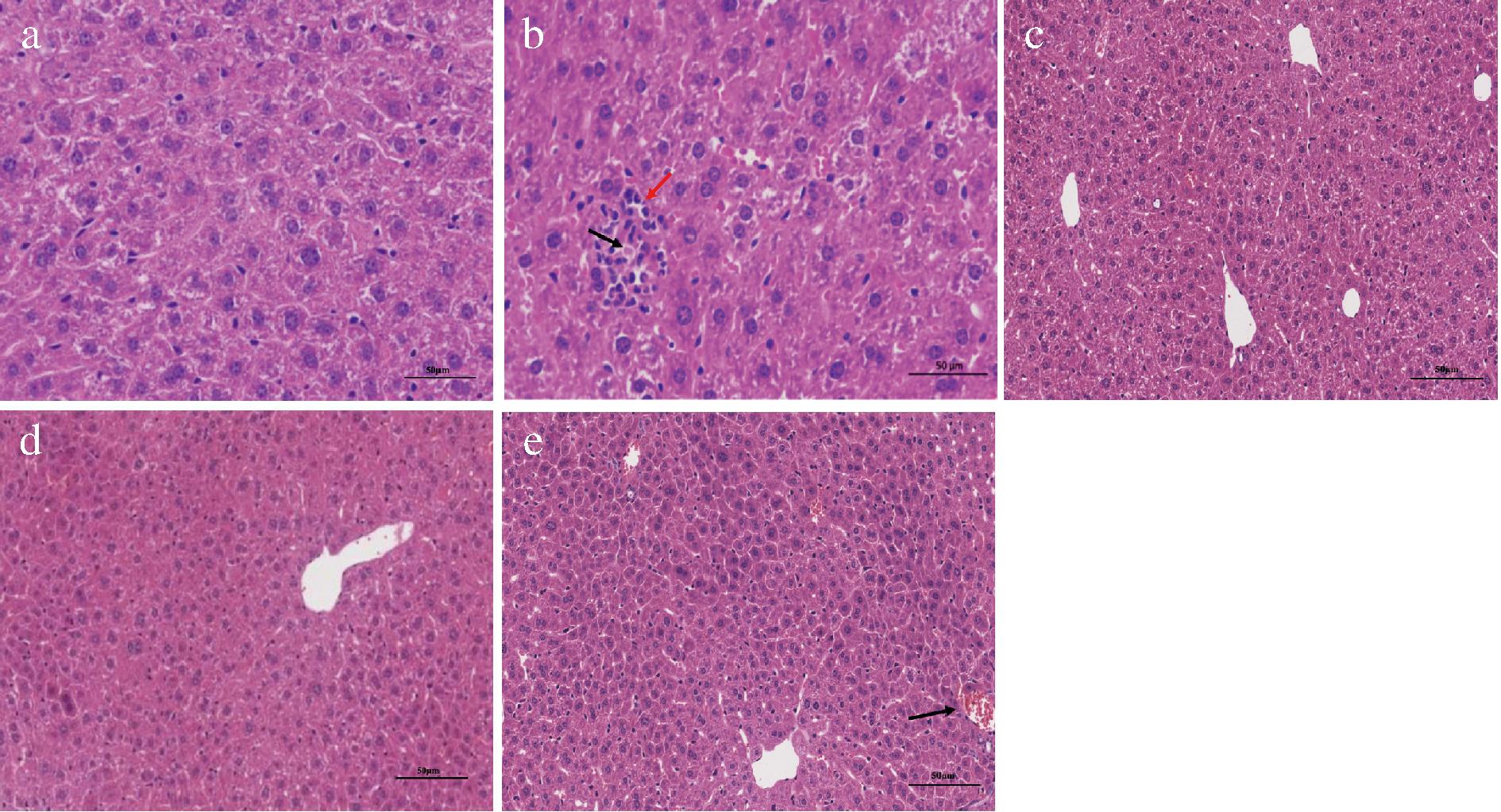
a-Control;b-M;c-Y;d-DT;e-DF
图1 肝组织病理学表现(HE染色, 400×)
Fig.1 The liver histopathological sections (HE staining, 400×)
2.3 血清及肝脏组织的生化指标分析
AST和TG是最常见的肝损伤标志物,当过量饮酒引起肝细胞损伤时细胞膜的通透性增加,使得血清AST和TG水平升高[26]。如图2-a、图2-b所示,M组中的AST含量和TG含量与Control组相比均显著上升(P<0.05),这与漆正方等[27]的结果趋势一致,表示造模成功。相反,与M组相比,HBDG多肽和HBDG多酚处理组小鼠AST和TG含量显著降低(P<0.05)。其中DT组中AST、TG含量分别降低了30.83%、44.35%。DF组中AST、TG含量分别降低了29.08%、33.87%。本次实验研究与冯杨梦晓等[28]的结果趋势一致,说明HBDG多肽和HBDG多酚可以改善肝细胞损伤。
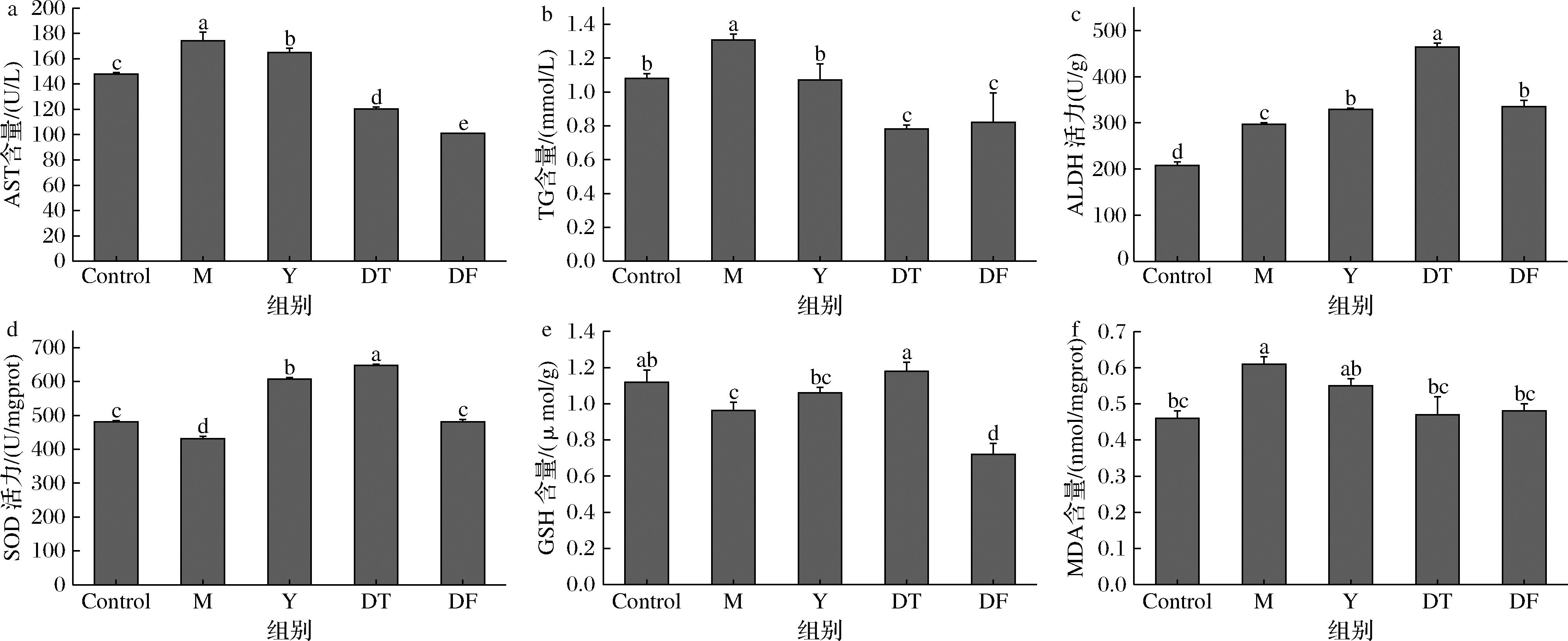
a-血清AST;b-血清TG;c-肝脏ALDH;d-肝脏SOD;e-肝脏GSH;f-肝脏MDA
图2 HBDG提取物对小鼠肝脏及血清相关指标的影响
Fig.2 Effects of HBDG extract on liver and serum related indexes in mice
注:同一列中不同的小写字母代表具有显著性差异(P<0.05)。
肝脏酶含量变化如图2-c~图2-f所示,与Control组相比,M组中SOD活力显著下降(P<0.05),表明ALI小鼠肝脏中的氧化应激水平显著升高,进一步证明了模型建立成功。相反,与模型组相比,多肽组和多酚组中SOD活力和GSH含量显著上升,表明HBDG多肽和HBDG多酚处理都能够显著提高机体的抗氧化能力(P<0.05)。ALDH氧化系统是肝脏中主要的酒精代谢途径,超过90%的饮酒通过乙醇脱氢酶和ALDH介导的氧化途径代谢。在这种主要的氧化途径中,乙醇首先被乙醇脱氢酶氧化成醛,然后是ALDH介导的醛代谢为乙酸盐[29]。与Control组相比,M组中肝脏ALDH活力的显著升高(P<0.05),是小鼠摄入酒精后对酒精刺激的适应性反应。而HBDG多肽和HBDG多酚处理组的ALDH活性升高程度显著高于模型组(P<0.01)。主要原因是HBDG提取物处理后ALI小鼠ALDH活力进一步增强。说明HBDG多肽和HBDG多酚处理使ALI小鼠酒精代谢能力增强,从而达到缓解肝损伤的目的,且DT组对ALDH活性的提高显著高于DF组(P<0.05)。与此同时,MDA含量与肝脏细胞膜的脂质过氧化程度密切相关,是反映机体潜在抗氧化能力的重要参数[1]。M组中肝脏MDA含量相比Control组显著上升(P<0.05),说明摄入酒精使M组的脂质过氧化程度加重。DT组和DF组中肝脏MDA含量相比M组显著下降(P<0.05),意味着HBDG多肽和HBDG多酚有很强的抗氧化能力,能够有效清除肝脏中的ROS,减少氧化应激,维持因酒精暴露而破坏的氧化还原平衡,改善脂质过氧化现象。
2.4 小鼠肝脏非靶代谢组学分析
肝脏是体内生物合成和生物转化的关键器官[30],为了研究HBDG多肽和HBDG多酚对ALI小鼠肝脏代谢产物的影响,使用非靶向代谢组学分析小鼠肝脏的代谢产物。基于ESI+或ESI-模式下的PLS-DA评分图结果发现(图3),不同组别样本明显分离且距离较远,说明不同分组肝脏代谢存在显著差异。M组与Control组肝脏代谢物存在明显分离,表明过量饮酒明显影响肝脏代谢。M组与DT组和DF组之间存在明显的分离,表明M与DT组和DF组肝脏代谢差异较大。
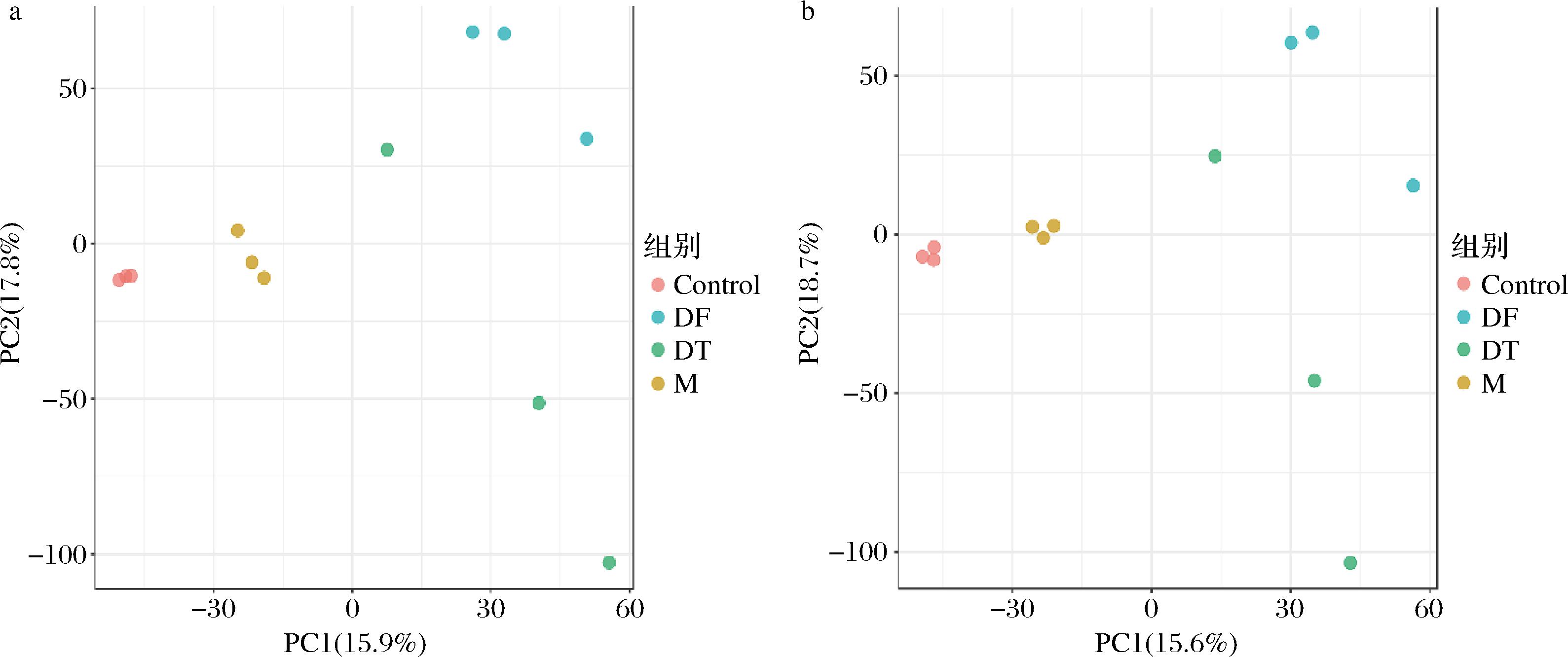
a-ESI+;b-ESI-
图3 基于ESI+或ESI-模式下的PLS-DA评分图
Fig.3 PLS-DA score plot in the positive model (ESI+) and in the negative model (ESI-)
2.4.1 HBDG多肽对ALI小鼠肝脏代谢组学分析
脂质代谢功能障碍和脂肪积累是ALI的初期的典型症状[31]。为了研究HBDG肽干预对ALD小鼠肝脏代谢的影响,通过比较DT处理组和M组之间的肝脏差异代谢产物,在正离子和负离子模式下,成功鉴定了20种潜在的差异代谢物(表2)(VIP>1,P<0.05),其中18种肝脏代谢产物(包括前列腺素F2α、石胆酸、S-乳酰谷胱甘肽和二十二碳五烯酸等)在DT干预下显著上调,2种代谢物[包括(R)-(-)-3-羟基丁酸和α-酮异戊酸]显著下调(图4-a)。据报道,二十二碳五烯酸是一种长链的n-3多不饱和脂肪酸具有抗血小板聚集、抗炎和改善血脂增生的作用[32]。
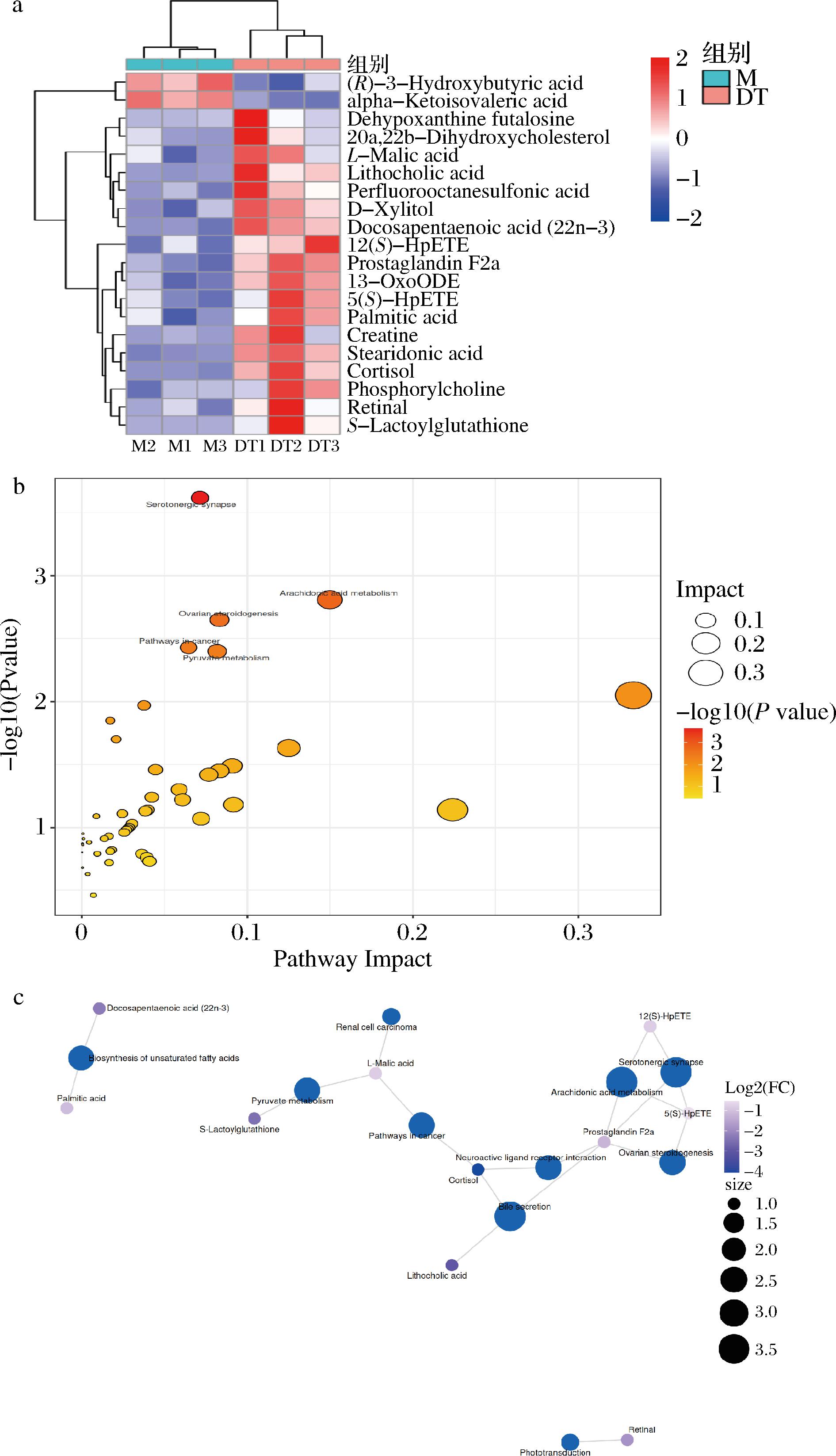
a-M组和DT组间显著差异代谢物的相对丰度热图;b-基于KEGG库中M组和DT组的代谢途径预测;c-KEGG通路与差异代谢物网络图
图4 HBDG多肽对ALI小鼠肝脏代谢组学分析
Fig.4 Metabolomic analysis of HBDG peptide on the liver of mice with ALI
表2 与M组相比,DT组的差异性代谢物信息表
Table 2 Differential metabolite information table for group DT compared to M group

保留时间/minm/z代谢物名称(英文)代谢物名称(中文)差异倍数P值VIP值调控52.1132.077 0Creatine肌酸0.20.011 1 2.01 上调599.4153.076 6D-XylitolD-木糖醇0.560.005 5 2.09 上调495.4184.072 1Phosphorylcholine磷酸胆碱0.630.035 3 1.83 上调571.6259.206 4Stearidonic acid十八碳四烯酸0.150.000 0 2.26 上调453.1285.221 3Retinal视黄醛0.270.033 2 1.84 上调49.2296.065 7Dehypoxanthine futalosine-0.040.018 3 1.92 上调389.5319.226 612(S)-HpETE12(S)-氢过氧二十碳四烯酸0.570.046 6 1.78 上调400.6319.227 75(S)-HpETE5(S)-羟基过氧化二十碳四烯酸0.690.019 2 2.00 上调347.9337.238 1Prostaglandin F2a前列腺素F2α0.430.025 1 1.87 上调333.2363.217 0Cortisol皮质醇0.060.0014 2.20 上调489.3376.313 1Lithocholic acid石胆酸0.130.007 3 1.99 上调66.0380.111 7S-LactoylglutathioneS-乳酰谷胱甘肽0.180.040 4 1.77 上调521.9401.341 120a,22b-Dihydroxycholesterol20a,22b-二羟基胆固醇0.250.034 3 1.83 上调33.4103.039 4(R)-3-Hydroxybutyric acid(R)-3-羟基丁酸1.270.004 1 2.12 下调65.4115.039 0alpha-Ketoisovaleric acidα-酮异戊酸2.610.000 1 2.22 下调43.7132.972 7L-Malic acidL-苹果酸0.570.033 5 1.88 上调657.6256.235 8Palmitic acid棕榈酸0.470.041 0 1.80 上调472.6294.216 113-OxoODE-0.190.038 5 1.82 上调574.3330.251 4Docosapentaenoic acid (22n-3)二十二碳五烯酸0.210.016 9 1.91 上调400.6498.929 1Perfluorooctanesulfonic acid全氟辛基磺酸0.420.033 4 1.78 上调
注:“-”表示未查询到,表4同。
为了全面了解DT干预诱导的肝脏代谢组变化,进行了基于KEGG分析的代谢途径富集(图4-b)。在HBDG肽干预下筛选到的关键代谢途径有花生四烯酸代谢、卵巢类固醇生成和丙酮酸代谢。推测HBDG肽改善小鼠酒精肝损伤的代谢途径可能是通过干预花生四烯酸代谢途径上调前列腺素F2α等(表3)。研究表明,前列腺素F2α参与花生四烯酸的代谢,具有调节宿主免疫应答、调节血管张力、降低肾脏炎症[33]的作用。而在HBDG多肽的干预下前列腺素F2α上调,使得机体在降低肾脏炎症方面的作用增强。
表3 M组和DT组中参与关键KEGG代谢通路的差异代谢物
Table 3 Differential metabolites involved in key KEGG metabolic pathways for the M and DT groups

KEGG ID关键通路名称代谢物P值ko00590花生四烯酸代谢通路前列腺素F2α;5(S)-羟基过氧化二十碳四烯酸;12(S)-氢过氧二十碳四烯酸0.001 6 ko04913卵巢类固醇生成代谢通路前列腺素F2α;5(S)-羟基过氧化二十碳四烯酸0.002 2 ko00620丙酮酸代谢通路L-苹果酸; S-乳酰谷胱甘肽0.004 0
此外,还确定了代谢物和富集的KEGG途径之间的相关性网络(图4-c)。花生四烯酸代谢、神经配体-受体相互作用信号通路和丙酮酸代谢途径通过共享代谢产物连接。
2.4.2 HBDG多酚对ALI小鼠肝脏代谢组学分析
模型组和多酚组小鼠肝脏代谢物水平如表4(VIP>1,P<0.05),鉴定出了25种潜在的差异代谢物,其中23种肝脏代谢产物(磷酸吡哆醛、脱硫生物素、芥酸、七叶苷、芒柄花素和硫胺素等)在DF处理下显著上调,2种肝脏代谢物(己二酸半醛和α-酮异戊酸)显著下调(图5)。
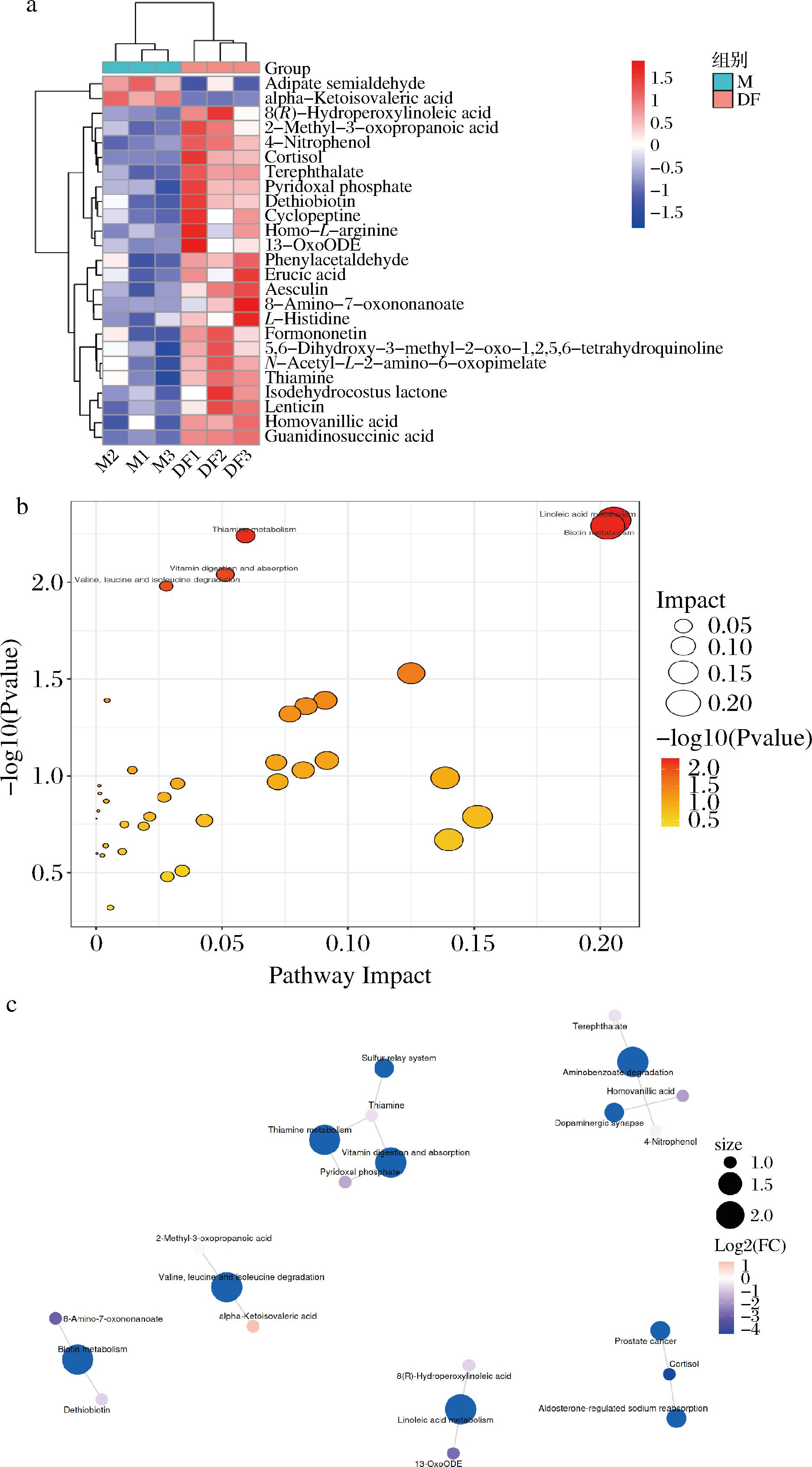
a-M组和DF组间显著差异代谢物的相对丰度热图;b-基于KEGG库中M组和DF组的代谢途径预测;c-KEGG通路与差异代谢物网络图
图5 HBDG多酚对ALI小鼠肝脏代谢组学分析
Fig.5 Metabolomic analysis of HBDG polyphenols on the liver of mice with ALI
表4 与M组相比,DF组的差异性代谢物信息表
Table 4 Differential metabolite information table for group DF compared to M group

保留时间/minm/z代谢物名称(英文)代谢物名称(中文)差异倍数P值VIP值调控361.7102.034 12-Methyl-3-oxopropanoic acid2-甲基-3-氧代丙酸0.910.006 3 2.02 上调101.1121.065 1Phenylacetaldehyde苯乙醛0.560.018 0 1.92 上调178.0130.065 5Adipate semialdehyde己二酸半醛1.950.044 0 1.74 下调77.4140.034 44-Nitrophenol4-硝基苯酚0.870.000 3 2.17 上调526.4170.117 98-Amino-7-oxononanoate8-氨基-7-氧代壬酸酯0.120.006 3 2.03 上调611.0182.985 5Homovanillic acid高香草酸0.290.024 8 1.89 上调55.3193.068 45,6-Dihydroxy-3-methyl-2-oxo-1,2,5,6-tetrahydroquinoline5,6-二羟基-3-甲基-2-氧代-1,2,5,6-六氢吲哚0.630.036 1 1.78 上调689.4213.983 2Dethiobiotin去硫生物素0.590.043 0 1.74 上调326.8231.141 6Isodehydrocostus lactone异去氢木香内酯0.410.030 4 1.80 上调59.1231.098 3N-Acetyl-L-2-amino-6-oxopime-lateN-Acetyl-L-2-amino-6-oxopime-late0.660.032 5 1.81 上调208.1247.144 7Lenticin-0.490.003 7 2.06 上调49.4265.111 6Thiamine硫胺素0.70.036 7 1.79 上调90.7281.113 6Cyclopeptine-0.510.012 7 1.97 上调616.4338.341 9Erucic acid13-二十二碳烯酸0.720.021 7 1.89 上调333.2363.217 0Cortisol皮质醇0.050.000 9 2.15 上调65.4115.039 0alpha-Ketoisovaleric acidα-酮异戊酸2.490.000 0 2.11 下调52.6154.061 4L-HistidineL-组氨酸0.830.023 3 1.78 上调32.5165.018 0Terephthalate对苯二甲酸盐0.690.006 6 1.93 上调32.5174.955 1Guanidinosuccinic acid胍基琥珀酸0.090.013 5 1.90 上调231.1187.050 8Homo-L-arginine高-L-精氨酸0.650.025 5 1.74 上调493.4247.170 0Pyridoxal phosphate磷酸吡哆醛0.330.026 7 1.75 上调432.7267.197 0Formononetin芒柄花素0.770.020 2 1.82 上调472.6294.216 113-OxoODE-0.140.031 4 1.74 上调378.3312.226 58(R)-Hydroperoxylinoleic acid8(R)-过氧羟基亚油酸0.590.011 8 1.84 上调566.3339.068 3Aesculin七叶素0.620.017 6 1.82 上调
对DF处理下的KEGG的代谢途径富集分析可知(图5-b),HBDG多酚干预改变了亚油酸代谢、生物素代谢、缬氨酸、亮氨酸和异亮氨酸降解以及维生素的消化和吸收等代谢途径。检测到与亚油酸代谢相关的代谢产物有13-OxoODE和8(R)-Hydroperoxylinoleic acid(表5)。相对于模型组,在HBDG多酚组中13-OxoODE和8(R)-Hydroperoxylinoleic acid上调,说明HBDG多酚治疗可能通过影响脂质代谢相关的途径来改善ALI,与YUN等[34]研究一致。除此之外,硫胺素参与硫胺素代谢通路(表5),而硫胺素的硫醇形式能够与ROS相互作用[35],这表明HBDG多酚干预提高了机体的抗氧化能力,减轻了肝脏氧化应激。总的来说,这些结果证实了HBDG多酚对可以通过影响脂质代谢和氧化应激来缓解ALI。代谢物和富集的KEGG途径之间的相关性网络见图5-c。硫胺素代谢和维生素的消化和吸收途径通过共享代谢产物连接。共有两种代谢产物富集在生物素代谢过程中,分别是8-氨基-7-氧代壬酸酯和脱硫生物素。
表5 M组和DF组中参与关键KEGG代谢通路的差异代谢物
Table 5 Differential metabolites involved in key KEGG metabolic pathways for the M and DF groups
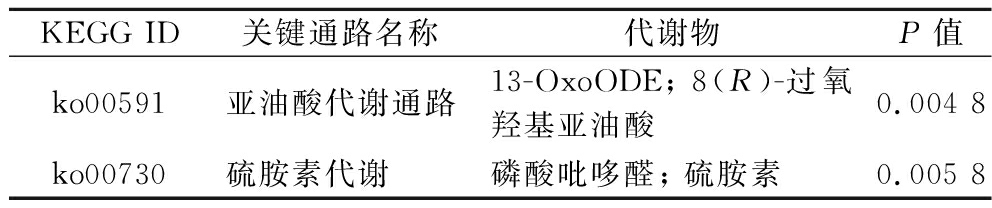
KEGG ID关键通路名称代谢物P值ko00591亚油酸代谢通路13-OxoODE; 8(R)-过氧羟基亚油酸0.004 8 ko00730硫胺素代谢磷酸吡哆醛; 硫胺素0.005 8
3 结论
综上所述,本研究初步表明,HBDG肽和HBDG多酚可以通过加速酒精代谢、提高抗氧化能力有效改善ALI现象。除此之外,通过肝脏代谢组学探索了HBDG活性提取物干预ALI过程中可能的保护机制,发现HBDG提取物可以通过调节代谢产物缓解ALI。但是,研究还存在一定的局限性,尽管通过实验证明HBDG提取物对酒精引起的肝损伤具有保护作用,但它是一种复杂的混合物,其功能成分仍需进一步确认,还需要进一步的研究来验证HBDG活性提取物对肝脏保护的确切机制。
[1] LI X X, JIANG Z H, ZHOU B, et al.Hepatoprotective effect of gastrodin against alcohol-induced liver injury in mice[J].Journal of Physiology and Biochemistry, 2019, 75(1):29-37.
[2] WANG X, DONG K, MA Y J, et al.Hepatoprotective effects of chamazulene against alcohol-induced liver damage by alleviation of oxidative stress in rat models[J].Open Life Sciences, 2020, 15(1):251-258.
[3] YU Y L, GUAN S Y, FENG M M, et al.Hepatoprotective effect of albumin peptide fractions from corn germ meal against alcohol-induced acute liver injury in mice[J].Foods, 2023, 12(6):1183.
[4] REN J, LI S J, SONG C L, et al.Black soybean-derived peptides exerted protective effect against alcohol-induced liver injury in mice[J].Journal of Functional Foods, 2021, 87:104828.
[5] PAN F G, CAI Z Z, GE H F, et al.Transcriptome analysis reveals the hepatoprotective mechanism of soybean meal peptides against alcohol-induced acute liver injury mice[J].Food and Chemical Toxicology, 2021, 154:112353.
[6] CHEN L C, ZHANG S Y, ZI Y, et al.Functional coix seed protein hydrolysates as a novel agent with potential hepatoprotective effect[J].Food &Function, 2020, 11(11):9495-9502.
[7] MACHADO I F, MIRANDA R G, DORTA D J, et al.Targeting oxidative stress with polyphenols to fight liver diseases[J].Antioxidants, 2023, 12(6):1212.
[8] KIMURA Y, SUMIYOSHI M, TAMAKI T.Effects of the extracts and an active compound curcumenone isolated from Curcuma zedoaria rhizomes on alcohol-induced drunkenness in mice[J].Fitoterapia, 2013, 84:163-169.
[9] CHEN J, XUAN Y H, LUO M X, et al.Kaempferol alleviates acute alcoholic liver injury in mice by regulating intestinal tight junction proteins and butyrate receptors and transporters[J].Toxicology, 2020, 429:152338.
[10] YANG Z H, GAO Y, WU W J, et al.The mitigative effect of Lotus root (Nelumbo nucifera Gaertn) extract on acute alcoholism through activation of alcohol catabolic enzyme, reduction of oxidative stress, and protection of liver function[J].Frontiers in Nutrition, 2023, 9:1111283.
[11] YANG Y, ZHOU Z L, LIU Y F, et al.Non-alcoholic components in Huangjiu as potential factors regulating the intestinal barrier and gut microbiota in mouse model of alcoholic liver injury[J].Foods, 2022, 11(11):1537.
[12] TANG Z, ZHAN L, HE R R, et al.Hepatoprotective effect of tea composite solid beverage on alcohol-caused rat liver injury[J].Foods, 2023, 12(22):4126.
[13] 丁良. 酒糟及添加剂对提高西藏发酵全混合日粮品质的影响[D].南京:南京农业大学, 2018.DING L.Effects of distiller’s grains and additives on improving the quality of fermented total mixed diets in Tibet[D].Nanjing:Nanjing Agricultural University, 2018.
[14] 杨婷婷, 孙万成, 罗毅皓, 等.青稞酒糟多肽的制备及其活性研究[J].食品与发酵工业, 2022, 48(20):217-224.YANG T T, SUN W C, LUO Y H, et al.Preparation and activity of highland barley fermentation spent polypeptide[J].Food and Fermentation Industries, 2022, 48(20):217-224.
[15] LI S, TAN H Y, WANG N, et al.The potential and action mechanism of polyphenols in the treatment of liver diseases[J].Oxidative Medicine and Cellular Longevity, 2018, 2018(1):8394818.
[16] WANG W, XU C, WANG Q Y, et al.Protective effect of polyphenols, protein, peptides, and polysaccharides on alcoholic liver disease:A review of research status and molecular mechanisms[J].Journal of Agricultural and Food Chemistry, 2023.
[17] WANG Y P, FAN Z F, YANG M L, et al.Protective effects of E Se tea extracts against alcoholic fatty liver disease induced by high fat/alcohol diet:In vivo biological evaluation and molecular docking study[J].Phytomedicine, 2022, 101:154113.
[18] 陈少华. 青稞酒糟蛋白生物活性肽的制备及其功能性质研究[D].上海:上海应用技术大学, 2023.CHEN S H.Study on the preparation and functional properties of bioactive peptides from highland barley distiller’s grains protein[D].Shanghai:Shanghai Institute of Technology, 2023.
[19] 杨婷婷, 罗毅皓, 张艺炜, 等.青稞酒糟多酚提取工艺优化及其抗氧化性[J].食品研究与开发, 2023, 44(19):140-146.YANG T T, LUO Y H, ZHANG Y W, et al.Optimization of the extraction process and antioxidant properties of polyphenols from highland barley fermentation spent[J].Food Research and Development, 2023, 44(19):140-146.
[20] 赵婷婷, 戴映笛, 舒昉, 等.灵芝菌丝体多糖提取工艺优化及其对慢性酒精肝损伤的保护作用[J].食品工业科技, 2023, 44(5):388-396.ZHAO T T, DAI Y D, SHU F, et al.Optimization of extraction technology of polysaccharides from Ganoderma Lingzhi Mycelium and its protective effect on alcoholic liver injury[J].Science and Technology of Food Industry, 2023, 44(5):388-396.
[21] TAN T, LUO Y H, SUN W C, et al.Effects of branched-chain fatty acids derived from yak ghee on lipid metabolism and the gut microbiota in normal-fat diet-fed mice[J].Molecules, 2023, 28(20):7222.
[22] WANT E J, MASSON P, MICHOPOULOS F, et al.Global metabolic profiling of animal and human tissues via UPLC-MS[J].Nature Protocols, 2013, 8(1):17-32.
[23] NAVARRO-REIG M, JAUMOT J, GARC A-REIRIZ A, et al.Evaluation of changes induced in rice metabolome by Cd and Cu exposure using LC-MS with XCMS and MCR-ALS data analysis strategies[J].Analytical and Bioanalytical Chemistry, 2015, 407(29):8835-8847.
A-REIRIZ A, et al.Evaluation of changes induced in rice metabolome by Cd and Cu exposure using LC-MS with XCMS and MCR-ALS data analysis strategies[J].Analytical and Bioanalytical Chemistry, 2015, 407(29):8835-8847.
[24] RASMUSSEN J A, VILLUMSEN K R, ERNST M, et al.A multi-omics approach unravels metagenomic and metabolic alterations of a probiotic and synbiotic additive in rainbow trout (Oncorhynchus mykiss)[J].Microbiome, 2022, 10(1):21.
[25] 于纯淼, 付佳琪, 张良, 等.食源复方解酒口服液对小鼠酒精性肝损伤的保护作用[J].食品工业科技, 2021, 42(5):300-304;310.YU C M, FU J Q, ZHANG L, et al.Protective effect of homology of medicine and food compound alleviate a hangover oral liquid on alcoholic liver injury in mice[J].Science and Technology of Food Industry, 2021, 42(5):300-304;310.
[26] KIM J H, WOO D, NAM Y, et al.Probiotic cheese improves alcohol metabolism and alleviates alcohol-induced liver injury via the SIRT1/AMPK signaling pathway[J].Journal of Functional Foods, 2023, 108:105736.
[27] 漆正方, 李东海, 孙宜春, 等.刺梨复合植物饮料对小鼠急性酒精性肝损伤的保护作用[J].食品工业科技,2025,46(3):361-367.QI Z F, LI D H, SUN Y C, et al.Protective effect of rosa roxburghii compound plant beverage on acute alcohol-induced liver injury in mice[J].Science and Technology of Food Industry, 2025,46(3):361-367.
[28] 冯杨梦晓, 任青兮, 刘双平, 等.海洋蛋白源解酒护肝水解物的筛选制备及功效评价[J].食品与发酵工业,2025,51(3):1-11.FENG Y M X, REN Q X, LIU S P, et al.Screening, preparation, and efficacy evaluation of hydrolysates from marine protein sources for sobering up and liver protection[J].Food and Fermentation Industries, 2025,51(3):1-11
[29] LI H, TOTH E, CHERRINGTON N J.Alcohol metabolism in the progression of human nonalcoholic steatohepatitis[J].Toxicological Sciences, 2018, 164(2):428-438.
[30] CAO Y J, HUANG Z R, YOU S Z, et al.The protective effects of ganoderic acids from Ganoderma lucidum fruiting body on alcoholic liver injury and intestinal microflora disturbance in mice with excessive alcohol intake[J].Foods, 2022, 11(7):949.
[31] XIAO C Q, JIA R B, LI X G, et al.Musculus senhousei peptides alleviated alcoholic liver injury via the gut-liver axis[J].Food &Function, 2024, 15(13):7124-7135.
[32] KAUR G, GUO X F, SINCLAIR A J.Short update on docosapentaenoic acid:A bioactive long-chain n-3 fatty acid[J].Current Opinion in Clinical Nutrition and Metabolic Care, 2016, 19(2):88-91.
[33] SONNWEBER T, PIZZINI A, NAIRZ M, et al.Arachidonic acid metabolites in cardiovascular and metabolic diseases[J].International Journal of Molecular Sciences, 2018, 19(11):3285.
[34] YUN H X, DUAN X L, XIONG W D, et al.Exploration of the hepatoprotective effect and mechanism of Swertia mussotii Franch in an acute liver injury rat model[J].Combinatorial Chemistry &High Throughput Screening, 2019, 22(9):649-656.
[35] PAVLOVA O, STEPANENKO S, CHEHIVSKA L, et al.Thiamine deficiency in rats affects thiamine metabolism possibly through the formation of oxidized thiamine pyrophosphate[J].Biochimica et Biophysica Acta (BBA) - General Subjects, 2021, 1865(11):129980.