基于肠神经胶质细胞的缓解泻剂结肠的益生菌筛选及其效果验证
朱胜男,薛伊凡,黄尹,李嘉臻,刘文续,王琳琳,陈卫*
(江南大学 食品学院,江苏 无锡,214122)
摘 要 泻剂结肠的显著特征为肠神经系统(enteric nervous system,ENS)严重损伤。益生菌已被证实能够修复ENS,改善肠道动力。但现有益生菌筛选方法多依赖于动物实验或临床实验,效率低且成本高。该研究旨在建立一种快速高效的体外筛选方法,以筛选缓解泻剂结肠的益生菌。将益生菌的裂解液、死菌和发酵上清液分别与肠神经胶质细胞(enteric glial cells,EGCs)体外共培养,检测神经营养因子Bdnf、Gdnf和S100β表达水平,通过主成分分析筛选出体外评分高、中、低的3株益生菌,在体内进一步验证。结果显示,这3株益生菌在体内缓解泻剂结肠的效果趋势与体外评分基本一致。特别是两歧双歧杆菌BB5,其在体外可提高上述神经营养因子的表达,展现肠神经调节潜力;在体内能够提高粪便含水率、增加粪便粒数、缩短肠道转运时间,缓解泻剂结肠。该研究开发的基于EGCs的体外筛选方法高效、经济且可靠,为益生菌的筛选和功能评价提供了新的科学路径,并为泻剂结肠的治疗提供了潜在的益生菌干预策略。此方法为益生菌的筛选和临床应用提供了重要的理论依据,具有广泛的应用前景。
关键词 体外筛菌;泻剂结肠;两歧双歧杆菌;肠神经系统;肠神经胶质细胞
DOI:10.13995/j.cnki.11-1802/ts.042193
引用格式:朱胜男,薛伊凡,黄尹,等.基于肠神经胶质细胞的缓解泻剂结肠的益生菌筛选及其效果验证[J].食品与发酵工业,2025,51(14):1-8.
ZHU Shengnan,XUE Yifan,HUANG Yin, et al.Screening and validation of probiotics to relieve cathartic colon based on enteric glial cells[J].Food and Fermentation Industries,2025,51(14):1-8.
第一作者:硕士研究生(陈卫教授为通信作者,E-mail:chenwei66@jiangnan.edu.cn)
基金项目:国家自然科学基金项目(32472348)
收稿日期:2024-01-22,改回日期:2025-03-18
泻剂结肠是一种因长期滥用刺激性泻药(如番泻叶、酚酞、比沙可啶等)导致结肠结构或功能异常的慢传输型便秘[1]。患者往往会出现自主排便困难、排便频率降低、腹痛、胀气等症状。研究表明,泻剂结肠的主要特征是肠神经系统(enteric nervous system,ENS)异常[2],这是因为刺激性泻药可损伤ENS并引起一些肠道神经递质的变化,从而影响肠道动力[3]。
ENS被认为是周围神经系统中最大最复杂的组成部分,它是由肠神经元和肠神经胶质组成的综合神经网络系统,存在于整个胃肠道的肌肉层之间[4]。其中,肠神经胶质细胞(enteric glial cells,EGCs)是肠道内重要的稳态细胞,其在维持胃肠道组织完整性和调节神经元活性方面起着非常重要的作用[5],参与控制包括黏膜感觉和分泌、胃肠运动和免疫应答等多项ENS功能[6-9]。S100钙调蛋白β(S100 calcium-binding protein β,S100β)为肠胶质细胞标志物,反映肠神经胶质细胞数量[10]。HANSEBOUT等[5]证实,EGCs在体内和体外环境均能够向环境中释放分泌脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)等。这些分子在神经元的发育、成熟以及ENS的功能和疾病中扮演着关键角色[11]。
肠道微生物群支配着ENS[12]。研究发现,益生菌能够通过调节肠道微生物群[13]、影响肠脑轴[14]、刺激胶质细胞增殖等方式修复肠神经系统。其中特别是两歧双歧杆菌对于肠道健康的影响被广泛认可[15]。例如,有研究显示,两歧双歧杆菌在动物模型中表现出显著的便秘缓解效果,这为其在临床应用中的潜力提供了基础。此外,实验室前期筛选出了一株能够缓解泻剂结肠的两歧双歧杆菌CCFM1163,指出该菌株主要通过修复肠神经及肠屏障来发挥作用[16]。
然而,目前对缓解便秘(尤其是泻剂结肠)的益生菌菌株筛选主要依赖于动物实验或临床实验,这些方法虽然直接,但往往耗时费力且价格昂贵。为解决上述问题,本研究开发了一种基于EGCs的快速体外筛选方法,通过检测Bdnf、Gdnf和S100β的表达水平,筛选具有肠神经调节潜力的益生菌,并进一步通过动物实验验证筛选方法的有效性。该研究为益生菌的高效筛选和评价提供了新方法,同时探索了益生菌缓解泻剂结肠的潜在机制。
1 材料与方法
1.1 材料与试剂
1.1.1 细胞
大鼠肠神经胶质细胞CRL-2690由陆军军医大学肖卫东教授赠与。
1.1.2 菌株
本文中所使用的4株两歧双歧杆菌从健康人的粪便中分离得到,保存于江南大学菌种保藏库。具体信息如表1所示。
表1 菌株信息
Table 1 Strain information
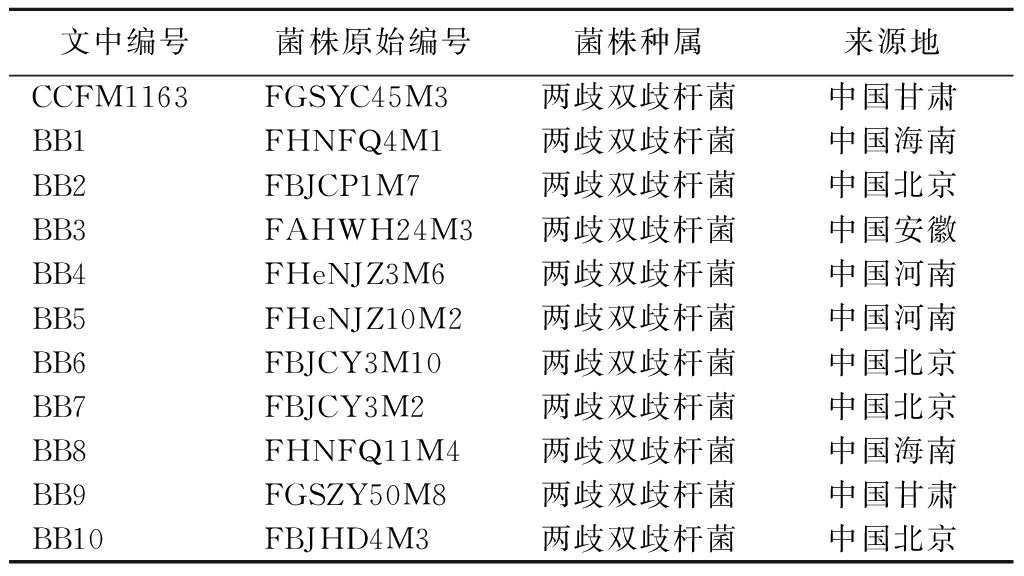
文中编号菌株原始编号菌株种属来源地CCFM1163FGSYC45M3两歧双歧杆菌中国甘肃BB1FHNFQ4M1两歧双歧杆菌中国海南BB2FBJCP1M7两歧双歧杆菌中国北京BB3FAHWH24M3两歧双歧杆菌中国安徽BB4FHeNJZ3M6两歧双歧杆菌中国河南BB5FHeNJZ10M2两歧双歧杆菌中国河南BB6FBJCY3M10两歧双歧杆菌中国北京BB7FBJCY3M2两歧双歧杆菌中国北京BB8FHNFQ11M4两歧双歧杆菌中国海南BB9FGSZY50M8两歧双歧杆菌中国甘肃BB10FBJHD4M3两歧双歧杆菌中国北京
1.1.3 动物
实验动物为5周龄的雄性C57BL/6 J小鼠(北京维通利华实验动物技术有限公司),适应性饲养1周后开始操作[SPF级屏障环境,温度(23±3) ℃,湿度(55±15)%,提供标准饲料,并且自由饮水]。该动物实验得到了江南大学实验动物伦理委员会的批准(伦理编号为JN.No 20240630c1201012 [359])。
1.1.4 试剂
番泻叶提取物(有效成分番泻苷A+B,占20%质量分数),西安旭煌生物技术有限公司;伊文思蓝,美国Sigma-Aldrich公司;PCR 扩增引物及合成,上海生工生物工程股份有限公司;细胞总RNA提取试剂盒、反转录试剂盒,南京诺唯赞生物科技有限公司;DMEM培养液、胎牛血清、胰酶,赛默飞世尔科技公司;细胞冻存液,苏州新赛美生物科技有限公司。
1.2 仪器与设备
RC BIOS 10落地式离心机,美国赛默飞世尔科技公司;GPR-9160恒温培养箱、DK-S12电热恒温水浴锅,上海森信实验仪器有限公司;C1000 Touch PCR扩增仪、CFX384 qPCR 仪器,Bio-Rad公司;MLS-3750高压灭菌锅,日本Sanyo公司;SJ-CW-1FD超净工作台,苏州安泰空气技术有限公司。
1.3 实验方法
1.3.1 菌株处理
1.3.1.1 菌株活化
使用接种环蘸取原始菌液,在含半胱氨酸的MRS培养基上进行划线纯化。置于37 ℃条件下进行厌氧培养48 h。随后挑取单个菌落接种至液体培养基中,继续37 ℃条件下厌氧培养20 h。将培养物以25 g/L的接种量进行传代活化并扩大培养,经16 h后进行计数。剩余菌悬液于4 ℃,6 000 r/min的条件下离心15 min,收集菌泥,用无菌生理盐水清洗2次后,用100 g/L脱脂乳重悬至菌浓度为5×109 CFU/mL,最终贮存于-80 ℃冰箱备用。
1.3.1.2 菌株发酵上清液
纯化后的菌株液接传2代,培养16 h,根据前期计数结果,用双蒸水调整发酵液,使得菌株浓度为109 CFU/mL。随后在4 ℃条件下以10 000 r/min离心15 min,收集上清液,并用0.22 μm微孔滤膜过滤,滤液即为发酵上清液。使用时以20%(体积分数)加入完全高糖DMEM培养基中干预细胞。
1.3.1.3 死菌悬液
纯化后的菌株液接传2代,培养16 h后,在65 ℃下水浴30 min后,在10 000 r/min下离心15 min,弃去上清液。用PBS充分洗涤菌体后再次离心,重复3次,弃上清液。根据前期计数结果,用完全高糖DMEM培养基重悬菌体,使菌株浓度为109 CFU/mL。取悬液涂布计数,于37 ℃下培养48 h,若无菌生长,则证明死菌悬液制备成功。
1.3.1.4 菌株裂解液
纯化后的菌株液接传2代,培养16 h后,在4 ℃,10 000 r/min下离心15 min,弃上清液。用PBS充分洗涤菌体后再次离心,重复3次,弃上清液。根据前期计数结果,用完全高糖DMEM培养基重悬菌体,使菌株浓度为109 CFU/mL。在冰浴中超声裂解(40 kHz,15 min),显微镜下观察无完整菌体形态。裂解液在4 ℃条件下以10 000 r/min离心15 min,收集上清液。
1.3.2 细胞培养
向DMEM中添加10%(体积分数)的FBS和1%(体积分数)的双抗,配置成完全培养基。将完全培养基和PBS均于水浴37 ℃预热,同时将超净台及实验耗材紫外照射30 min。将冻存于-80 ℃的细胞快速在37 ℃水浴锅中融化,将细胞移至离心管中,加入完全培养基用以稀释冻存液。于1 000 r/min 条件下离心5 min,弃去冻存液,加入1 mL完全培养基后均匀铺在加有10 mL培养基的10 cm2培养皿中,摇晃均匀后,置于细胞孵箱中培养(37 ℃,5%体积分数CO2)。待细胞生长密度为80%时进行细胞传代。细胞传代3代后,移至6孔板中培养,待细胞贴壁生长占皿底80%时,进行干预。
1.3.3 细胞总RNA的提取及基因表达测定
细胞与样品共培养12 h后,用PBS清洗细胞后加入裂解液,利用RNA提取试剂盒提取细胞总RNA,随即将其逆转录为cDNA,最后采用实时荧光定量聚合酶链反应测定Bdnf、Gdnf及S100β的基因相对表达量。涉及引物序列如表2所示。
表2 引物序列
Table 2 Primer sequences
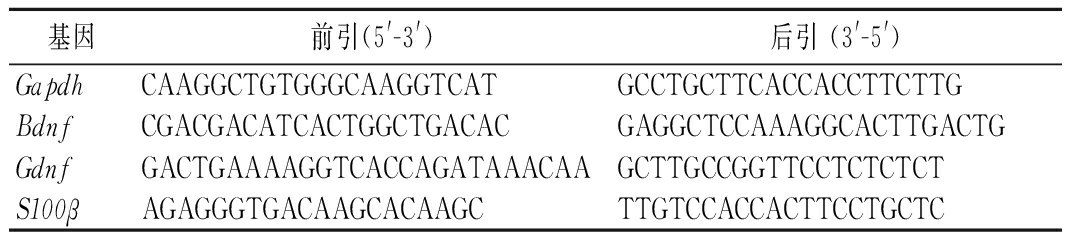
基因前引(5'-3')后引 (3'-5')GapdhCAAGGCTGTGGGCAAGGTCATGCCTGCTTCACCACCTTCTTGBdnfCGACGACATCACTGGCTGACACGAGGCTCCAAAGGCACTTGACTGGdnfGACTGAAAAGGTCACCAGATAAACAAGCTTGCCGGTTCCTCTCTCTS100βAGAGGGTGACAAGCACAAGCTTGTCCACCACTTCCTGCTC
1.3.4 动物实验设计
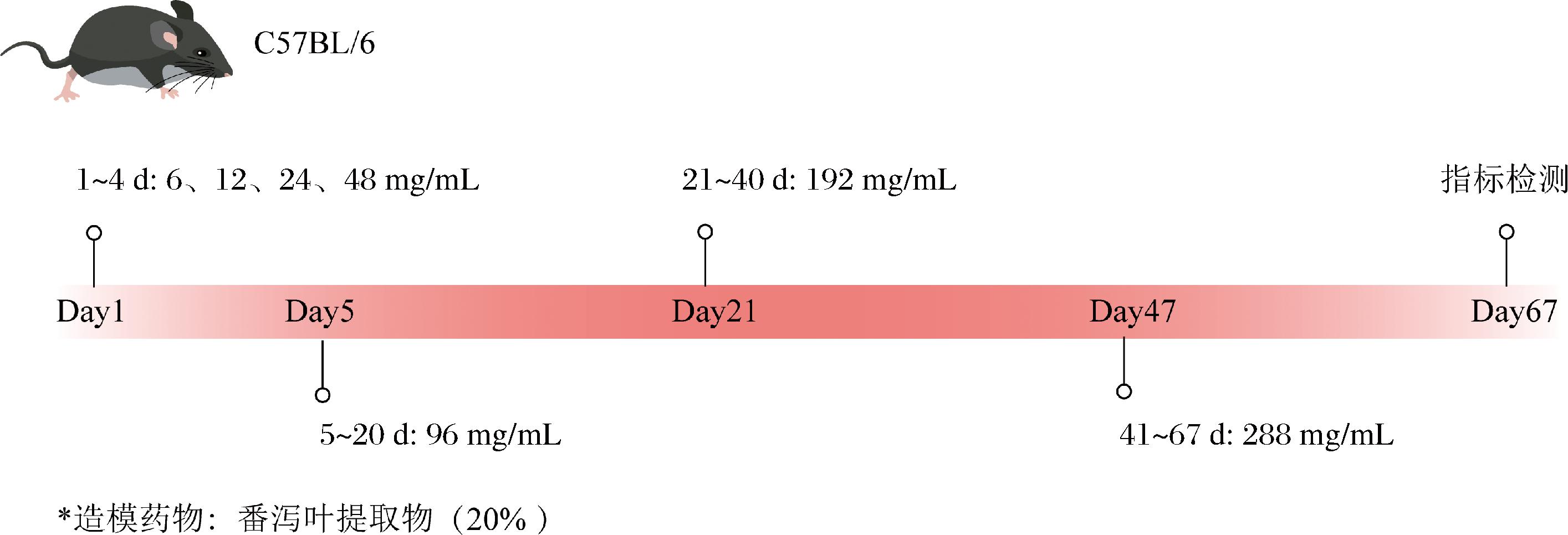
本实验共6组,包括:空白组、模型组、益生菌干预组(共4组)。空白组每天灌胃0.2 mL生理盐水;模型组利用番泻叶提取物(有效成分为番泻苷A+B,含量占总提取物的20%质量分数)溶于生理盐水进行造模,在起始剂量基础上,逐渐递增,标准如下:当半数动物出现稀便时,维持当前剂量,直至80%动物稀便消失,提高剂量,进入下一个剂量循环。实际操作剂量和周期如下(图1):1~4 d分别灌胃6、12、24、48 mg/mL的质量浓度,5~20 d持续灌胃96 mg/mL质量浓度,21~40 d灌胃192 mg/mL质量浓度,41~67 d灌胃288 mg/mL的质量浓度。造模结束一周后测定粪便含水率、肠道转运时间和5 h粪便粒数来判断造模是否成功;益生菌组:小鼠干预期灌胃生理盐水重悬的0.2 mL的菌悬液1×109 CFU/mL,维持2周。
1.3.5 便秘表观指标测定
1.3.5.1 粪便含水率
参考GE等[17]的方法,使用分析天平测得离心管加粪便的总质量,减去离心管质量即得到粪便湿重,之后打开管盖放入真空冷冻干燥机中冻干,冻干完成后取出并称得冻干后质量,减去管重即得粪便干重。粪便含水率计算如公式(1)所示:
(1)
式中:W,粪便含水率,%; R,粪便湿重, g; D,粪便干重,g。
1.3.5.2 肠道转运时间
参考STORR等[18] 的方法,每只小鼠灌胃0.2 mL的伊文思蓝混合物,将灌胃开始时间到小鼠排出第一颗蓝色粪便的时间计为肠道总转运时间。
1.3.5.3 5 h内粪便粒数
将小鼠从笼盒中取出,置于一干净笼盒中,计数其5 h内的粪便粒数。
1.4 数据分析
本实验使用GraphPad Prism 9.0.0统计学软件对数据进行统计分析。统计方法为“平均值±标准差”或“中位数±四分位数”。组间差异的参数分析采用单因素方差分析(one-way ANOVA)与Dunnett事后检验。P<0.05为差异有统计学意义,*P<0.05;**P<0.01;***P<0.001。
2 结果与分析
2.1 细胞实验筛菌
实验思路是以CCFM1163为阳性对照菌株,益生菌的裂解液、死菌和发酵上清液分别与EGCs共培养,检测EGCs标志物:Bdnf、Gdnf、S100β,采用主成分分析筛选得分较高、中、低3株菌。
2.1.1 双歧杆菌裂解液对EGCs的影响
2.1.1.1 肠神经系统相关指标的检测
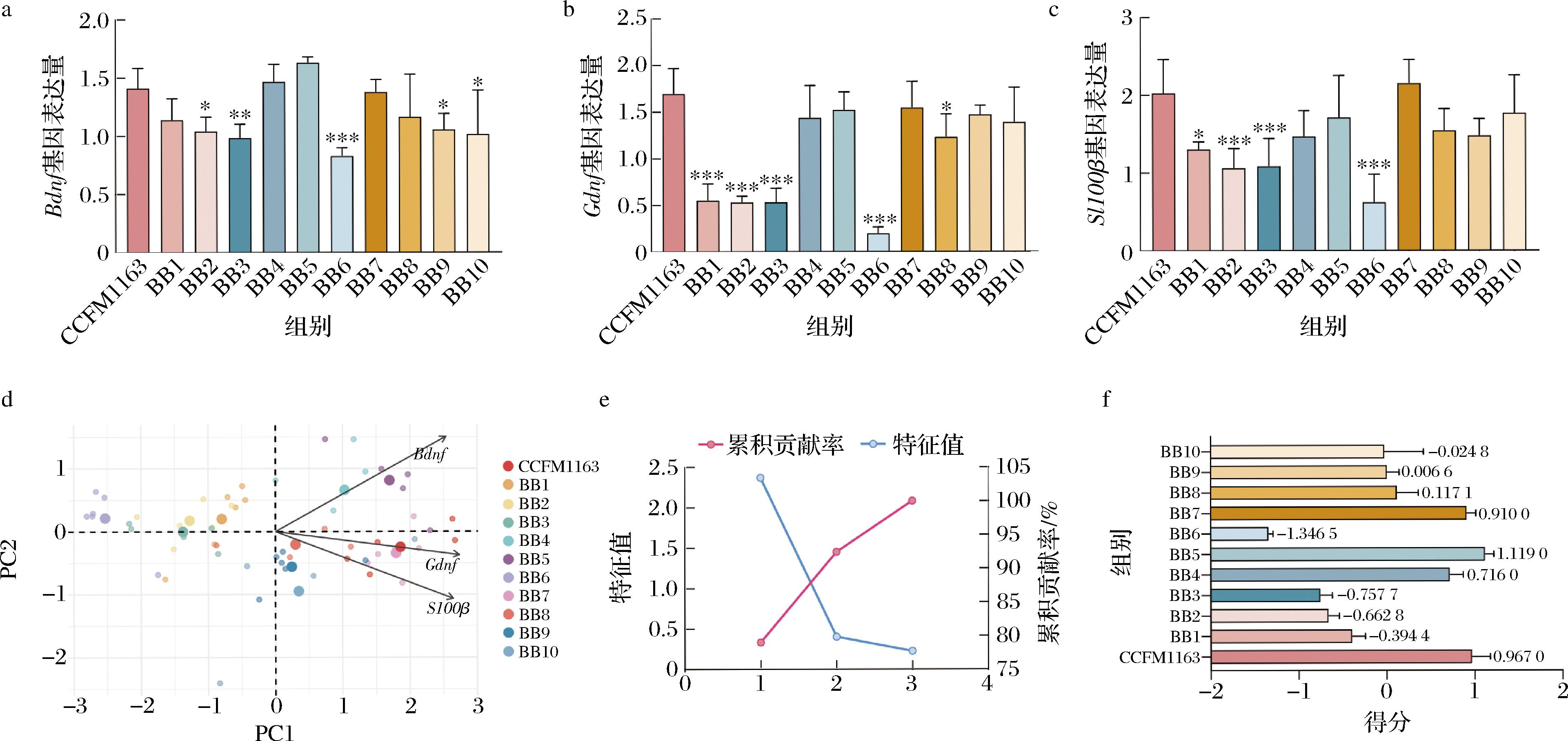
本研究通过将11株两歧双歧杆菌裂解液与EGCs共培养12 h,测定了Bdnf、Gdnf及S100β的基因表达情况,以评估不同益生菌株裂解液成分在调节肠神经系统功能方面的潜力(图2)。
Bdnf基因表达显示(图2-a),与阳性对照组CCFM1163相比,大部分两歧双歧杆菌组对Bdnf 的表达提升较小,其中BB2、BB3、BB6、BB9、BB10组的表达显著低于CCFM1163(P<0.05)。然而,BB5和BB7组的Bdnf表达水平较高,接近甚至略高于CCFM1163组(BB5)。这些结果表明,BB5和BB7可能具有调节Bdnf基因表达的潜力。
Gdnf基因表达显示(图2-b),CCFM1163组的Gdnf表达高于大多数两歧双歧杆菌组,但BB5和BB7组的Gdnf表达与CCFM1163组接近。BB6组在Gdnf表达中表现最低(P<0.001),表明其在肠神经调节中的作用可能较弱。
S100β基因表达显示(图2-c),CCFM1163组的S100β表达依旧保持较高水平,BB5和BB7组的表达也相对较高,接近阳性对照组。此外,BB1、BB2、BB3、BB6组的S100β表达显著低于CCFM1163(P<0.05),提示这些菌株在S100β相关功能的调节中效果较弱。
总体来看,BB5和BB7菌株在Bdnf、Gdnf和S100β的基因表达中均表现出较高的水平,显示出较好的肠神经功能调节潜力。
2.1.1.2 主成分分析(principal components analysis,PCA)
PCA结果(图2-d)进一步揭示了各菌株在综合调节Bdnf、Gdnf和S100β表达中的表现。CCFM1163组作为阳性对照,在PC1和PC2维度上均具有较高的得分,反映其在3种神经因子表达中的综合调节作用最优。BB5和BB7组在PCA中接近CCFM1163,表现出显著优势。
碎石图分析(图2-e)表明,前2个主成分解释了数据中大部分的变异,总贡献率达到约90%。这一结果表明,PCA是筛选有效益生菌株的可靠工具。
根据PCA评分结果(图2-f),BB5得分最高(1.119 0),其次是CCFM1163组(0.967 0),BB7组得分次之(0.910 0)。相比之下,BB6组得分最低(-1.346 5),在神经因子表达的调节作用中表现较差。
2.1.2 双歧杆菌死菌菌体对EGCs的影响
2.1.2.1 肠神经系统相关指标的检测
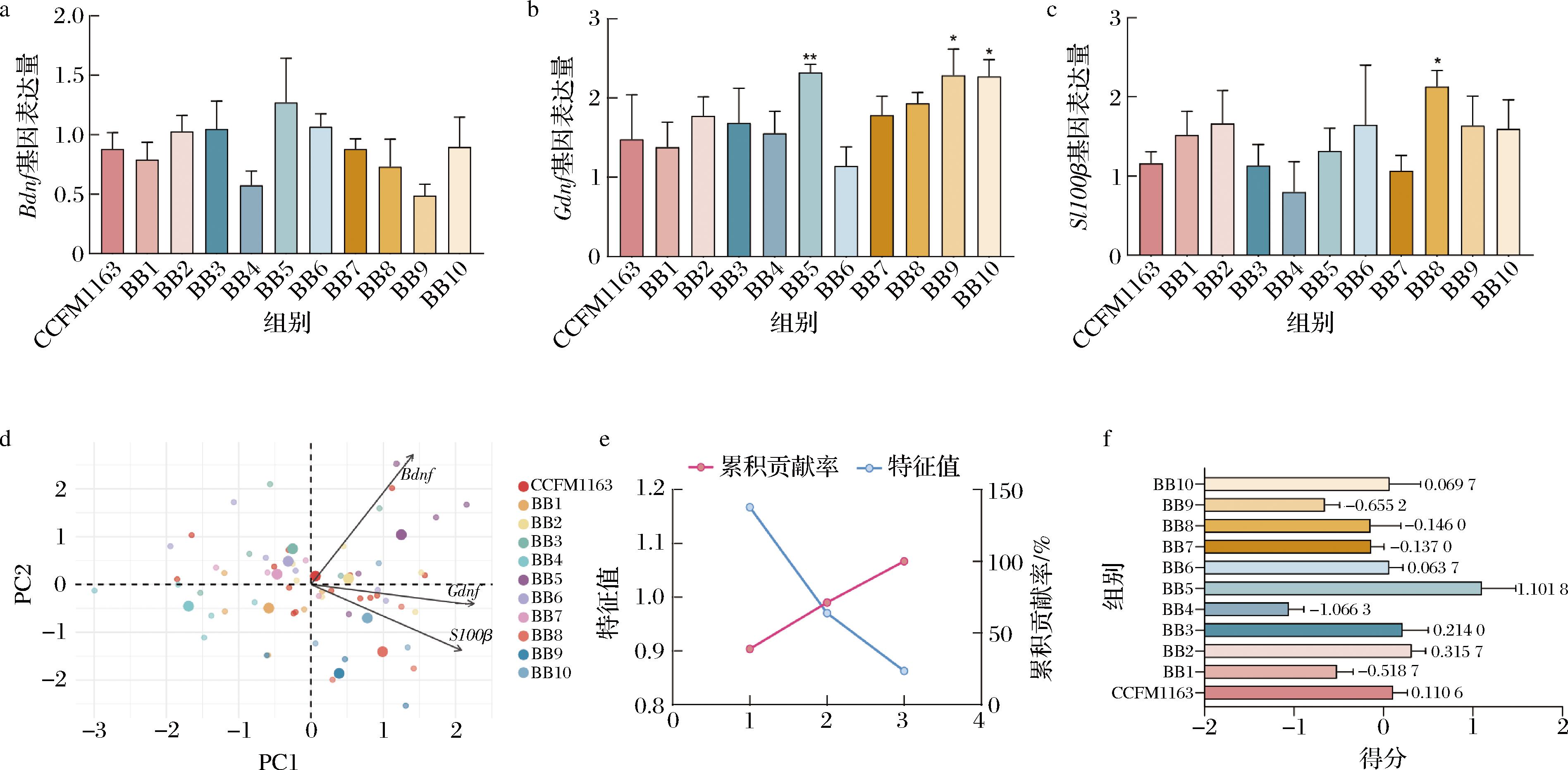
在本研究中,通过将11株两歧双歧杆菌死菌成分与EGCs共培养12 h,测定Bdnf、Gdnf及S100β的基因表达水平,评估不同益生菌株的死菌成分在调节肠神经功能方面的潜力(图3)。
Bdnf基因表达结果显示(图3-a),与阳性对照CCFM1163相比,大部分两歧双歧杆菌组的Bdnf表达水平变化不显著。其中,BB5组表现出最高的Bdnf表达水平,甚至略高于CCFM1163组。而BB4和BB9组的Bdnf表达相对较低。这表明,部分死菌成分可能保留了调节Bdnf表达的活性,特别是在BB5组。
Gdnf基因表达结果显示(图3-b),与CCFM1163组相比,BB5、BB9和BB10组的Gdnf表达显著提高(P<0.05或P<0.01)。相较而言,BB6组在Gdnf表达中表现最差。
S100β基因表达结果显示(图3-c),BB8显著提高S100β的表达 (P<0.05),这与BB5和CCFM1163趋势相反。
总体来看,BB5菌株在Bdnf、Gdnf和S100β的基因表达中表现较好,显示出较好的肠神经功能调节潜力。
2.1.2.2 PCA
PCA综合了Bdnf、Gdnf及S100β的表达数据,评估了不同菌株的死菌成分的整体调节能力(图3-d)。结果显示,CCFM1163组位于PC1和PC2的正方向高位,表现出最优的综合调节能力。BB5组紧随其后,显示出较强的综合作用。相反,BB6组在2个主成分中的得分均较低,表明其死菌成分的调节能力较弱。
碎石图分析(图3-e)显示,前2个主成分解释了数据中约85%的变异,进一步验证了PCA方法的可靠性。
根据综合评分结果(图3-f),BB5组的得分最高(1.101 8),甚至高于CCFM1163组(0.110 6),表现出BB5死菌成分对神经因子调节的显著作用。而BB4和BB1组得分最低(分别为-1.066 3和-0.518 7),提示其对肠神经功能的整体调节效果有限。
2.1.3 双歧杆菌发酵上清液对EGCs的影响
2.1.3.1 肠神经系统相关指标的检测
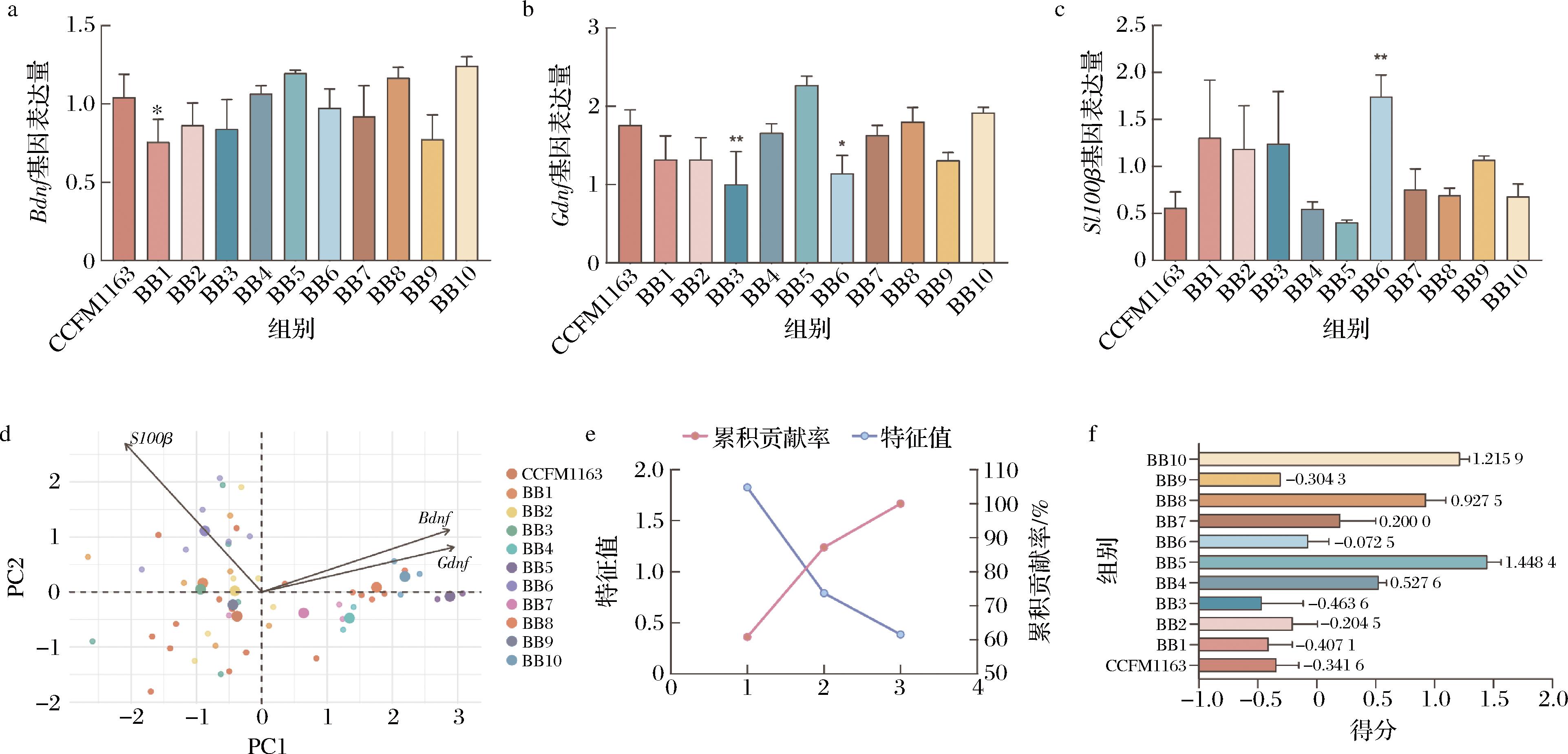
本研究通过将11株两歧双歧杆菌发酵上清液与EGCs共培养12 h,测定了神经因子Bdnf、Gdnf及S100β的基因表达情况,以评估不同益生菌发酵产物对肠神经功能的潜在调节作用(图4)。
Bdnf基因表达结果(图4-a)显示,阳性对照组CCFM1163在Bdnf表达水平上表现较高,作为基线标准。与之相比, BB4、BB5、BB8和BB10组的Bdnf表达水平接近或高于CCFM1163,而BB1组则显著较低(P<0.05)。特别是BB5和BB10组的表现突出,说明其发酵产物对Bdnf基因的表达具有较好的促进作用。
Gdnf基因表达结果(图4-b)结果表明, BB5组的Gdnf表达水平高于其他组,显示其发酵上清液对Gdnf的表达具有显著的促进作用。此外,与CCFM1163相比,BB3和BB6显著降低其基因表达(P<0.05),提示其发酵上清液对该神经因子的调节作用较弱。
S100β基因表达结果(图4-c)显示,BB6显著提高其表达(P<0.01),这与CCFM1163趋势相反。而BB4和BB5均出现与CCFM1163相同趋势。
2.1.3.2 PCA
PCA结合了Bdnf、Gdnf和S100β基因的表达数据,综合评估了不同发酵上清液对肠神经功能的调节能力(图4-d)。CCFM1163组在PC1和PC2轴上均表现优异,作为阳性对照的基准。而BB5组也表现出了卓越的综合调节能力。相较之下,BB1和BB3组数据发生偏离,表明其对肠神经相关指标的调节作用有限。
碎石图(图4-e)分析表明,前2个主成分解释了数据中约85%的变异,验证了PCA作为筛选方法的可靠性。
综合评分结果(图4-f)显示,BB5组以最高得分(1.448 4)位居首位,表明其发酵产物对Bdnf、Gdnf及S100β的表达具有显著的综合促进作用。BB1和BB3组得分最低(分别为-0.407 1和-0.463 6),提示其发酵上清液在神经因子调节中的作用相对较弱。
2.1.4 综合分析
本研究通过益生菌裂解液、死菌成分及发酵上清液3种形式与EGCs共培养,系统评估了不同益生菌株在调节神经因子Bdnf、Gdnf和S100β基因表达中的作用,并利用PCA筛选出得分高、中、低的菌株。
结果表明,不同菌株及处理形式对神经因子表达的影响存在显著差异。其中,BB5得分最高,其在3种处理形式下均表现出最佳的调节效果。相比于其他菌株,BB5的裂解液、死菌和发酵上清液组的成分均对Bdnf和Gdnf的表达有一定的提升,接近或超过CCFM1163,且S100β的表达与CCFM1163一致,最终BB5在PCA综合得分中位居首位,表明BB5具有显著的肠神经调节潜力。此外,BB8、BB9菌株表现稳定,其裂解液、死菌和发酵上清液在Bdnf、Gdnf及S100β的调节中均处于中等水平。相比之下,BB6菌株得分最低,其在所有处理条件下的表现均较差,Bdnf、Gdnf和S100β基因的表达水平均显著低于其他菌株,其PCA得分也接近最低,提示BB6菌株的肠神经调节作用较为有限。
通过细胞实验的比较和筛选,确定BB5、BB9、BB6进行动物实验验证。
2.2 动物验证
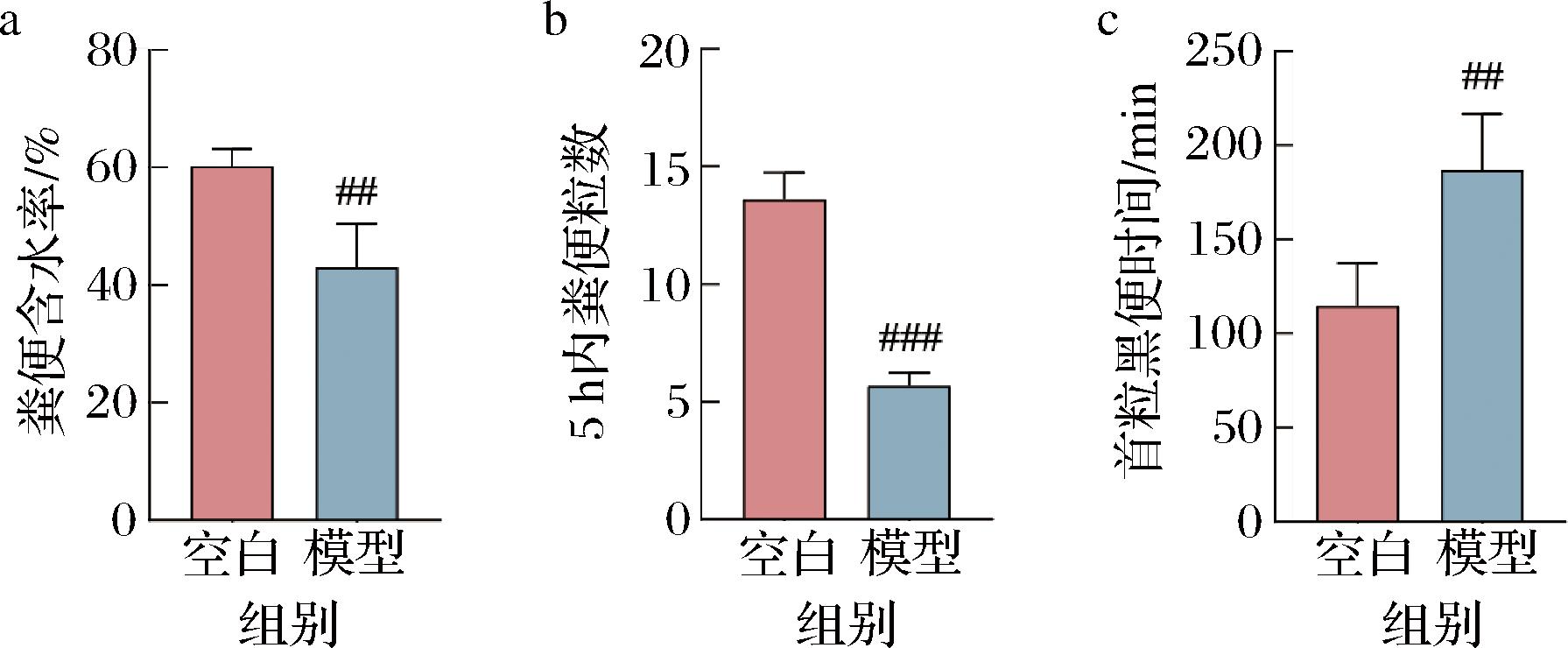
2.2.1 番泻叶提取物引起小鼠便秘
如图5所示,番泻叶造模后小鼠5 h内的粪便粒数与空白组相比显著降低(P<0.001)、首粒黑便时间显著延长(P<0.01)、粪便含水率显著降低(P<0.01),小鼠出现便秘症状。
番泻叶提取物的主要成分是蒽醌类化合物,其中,番泻苷A和番泻苷B被认为是主要的泻药成分[19]。番泻苷在结肠中通过肠道微生物的作用被代谢为活性物质大黄酸蒽醌,其通过改变结肠黏膜的电解质运输、增加腔内液体,并作为黏膜刺激物作用,从而增强结肠的蠕动。然而,长期使用番泻叶则有可能导致泻剂结肠的发生[20]。本文通过67 d对小鼠灌胃番泻叶提取物溶液,造模结束后检测便秘表观指标(5 h内的粪便粒数、首粒黑便时间、粪便含水率),确定便秘后进入干预期。
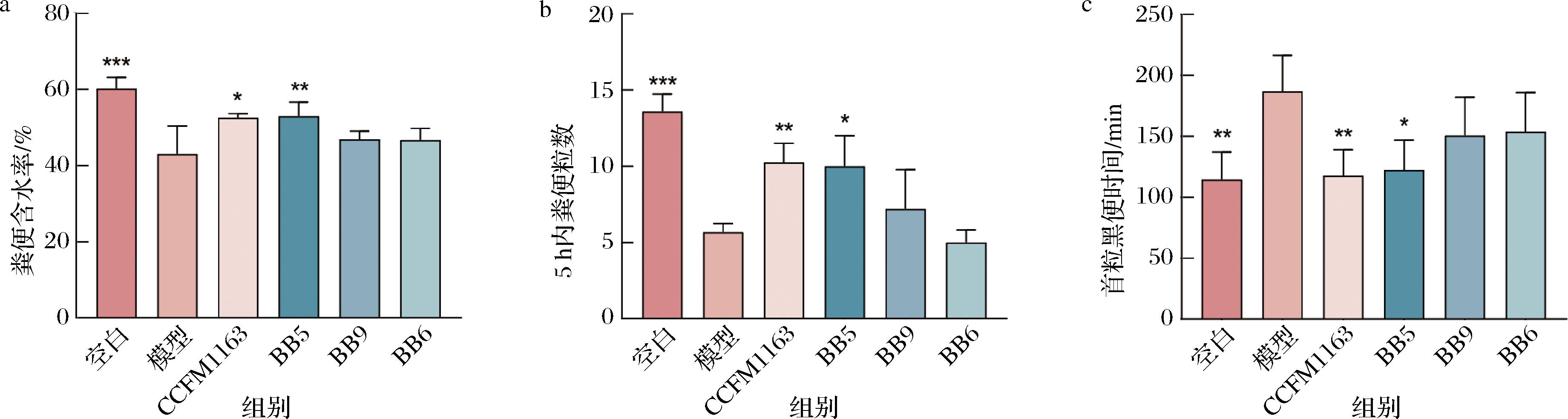
2.2.2 三株益生菌体内缓解泻剂结肠效果比较
通过对便秘小鼠连续2周灌胃两歧双歧杆菌CCFM1163、BB5、BB9、BB6四株两歧双歧杆菌以验证细胞实验筛选结果。由图6可知,CCFM1163和BB5能够显著缓解泻剂结肠[5 h内粪便粒数显著增多(P<0.05)、首粒黑便时间显著缩短(P<0.05)、粪便含水率显著提高(P<0.05)],而BB9和BB6在3个指标上虽然具有一定的改善作用,但与模型组相比,均不具有显著性。
2.2.3 综合分析
通过比较动物实验和细胞实验的结果不难发现,经细胞实验筛选出的3株益生菌在动物实验上效果与体外结果几乎一致:通过PCA整合多指标数据筛选出具有显著调节能力的菌株BB5,其在泻剂结肠模型小鼠模型中能够显著提高粪便含水率、增加5 h内的粪便粒数,缩短肠道转运时间,缓解泻剂结肠,这进一步验证了体外筛选结果的准确性。BB9仅有趋势但无显著性。BB6在动物实验中效果较差,这与细胞实验中BB6评分最低一致。
3 结论与讨论
BDNF、GDNF和S100β对肠神经系统的功能至关重要,影响着神经元的生存、生长、分化和功能维护,参与调节肠道的运动、分泌、免疫,维持肠道稳态[21]。两歧双歧杆菌BB5在体外能够提高三者的基因表达,进一步研究发现,其在体内能够缓解泻剂结肠。猜测BB5可能是通过调节肠神经生长因子的水平来修复肠神经系统,继而影响肠道动力的。多项研究均表明,肠道微生物可能会通过代谢物(例如,短链脂肪酸)来影响BDNF水平,继而影响肠道神经健康[22-23]。在另一项研究当中,研究人员发现双歧杆菌能够刺激EGCs释放更多的GDNF,改善肠神经元发育不良小鼠结肠运动[24]。基于此,本文猜测,基于肠神经胶质细胞,应用不同的“物质”(益生菌的裂解液、死菌和发酵上清液)分别与肠神经胶质细胞(EGCs)体外共培养,通过检测神经营养因子Bdnf、Gdnf和S100β表达水平,可实现体外快速筛选调节肠动力的益生菌。
综上所述,本研究开发了一种基于肠神经胶质细胞的体外筛选模型,用于快速筛选能够缓解泻剂结肠的益生菌。通过细胞实验和动物实验结合对比,证实了该方法的可行性。并且利用该方法筛选出了一株两歧双歧杆菌BB5,推测BB5能够通过调节肠神经生长因子来修复肠神经系统,继而缓解泻剂结肠。该研究为益生菌的筛选和评价提供了一种科学有效的方法,并为泻剂结肠的益生菌干预开辟了新的研究方向。未来研究可进一步探讨BB5的作用机制及其在临床中的实际应用潜力。
参考文献
[1] MENG Y Y, LI Q D, FENG Y, et al. Animal models of cathartic colon[J]. World Journal of Clinical Cases, 2021, 9(6):1251-1258.
[2] LI H Y, YAN X, XUE Q L, et al. Effects of nociceptin/orphanin FQ on rats with cathartic colon[J]. World Journal of Gastroenterology, 2007, 13(1):141-145.
[3] LIU B H, MO P, ZHANG S B. Effects of mu and kappa opioid receptor agonists and antagonists on contraction of isolated colon strips of rats with cathartic colon[J]. World Journal of Gastroenterology, 2004, 10(11):1672-1674.
[4] SEGUELLA L, GULBRANSEN B D. Enteric glial biology, intercellular signalling and roles in gastrointestinal disease[J]. Nature Reviews. Gastroenterology &Hepatology, 2021, 18(8):571-587.
[5] HANSEBOUT C R, SU C X, REDDY K, et al. Enteric glia mediate neuronal outgrowth through release of neurotrophic factors[J]. Neural Regeneration Research, 2012, 7(28):2165-2175.
[6] BOESMANS W, HAO M M, FUNG C, et al. Structurally defined signaling in neuro-glia units in the enteric nervous system[J]. Glia, 2019, 67(6):1167-1178.
[7] BOH RQUEZ D V, LIDDLE R A. The gut connectome: Making sense of what you eat[J]. The Journal of Clinical Investigation, 2015, 125(3):888-890.
RQUEZ D V, LIDDLE R A. The gut connectome: Making sense of what you eat[J]. The Journal of Clinical Investigation, 2015, 125(3):888-890.
[8] CHOW A K, GULBRANSEN B D. Potential roles of enteric glia in bridging neuroimmune communication in the gut[J]. American Journal of Physiology. Gastrointestinal and Liver Physiology, 2017, 312(2): G145-G152.
[9] NEUNLIST M, ROLLI-DERKINDEREN M, LATORRE R, et al. Enteric glial cells: Recent developments and future directions[J]. Gastroenterology, 2014, 147(6):1230-1237.
[10] SHARKEY K A. Emerging roles for enteric glia in gastrointestinal disorders[J]. The Journal of Clinical Investigation, 2015, 125(3):918-925.
[11] POPOVA N K, ILCHIBAEVA T V, NAUMENKO V S. Neurotrophic factors (BDNF and GDNF) and the serotonergic system of the brain[J]. Biochemistry. Biokhimiia, 2017, 82(3):308-317.
[12] OBATA Y, CASTA O
O  , BOEING S, et al. Neuronal programming by microbiota regulates intestinal physiology[J]. Nature, 2020, 578(7794):284-289.
, BOEING S, et al. Neuronal programming by microbiota regulates intestinal physiology[J]. Nature, 2020, 578(7794):284-289.
[13] VICENTINI F A, KEENAN C M, WALLACE L E, et al. Intestinal microbiota shapes gut physiology and regulates enteric neurons and glia[J]. Microbiome, 2021, 9(1):210.
[14] WANG H Y, LEE I S, BRAUN C, et al. Effect of probiotics on central nervous system functions in animals and humans: A systematic review[J]. Journal of Neurogastroenterology and Motility, 2016, 22(4):589-605.
[15] FUYUKI A, HIGURASHI T, KESSOKU T, et al. Efficacy of Bifidobacterium bifidum G9-1 in improving quality of life in patients with chronic constipation: A prospective intervention study[J]. Bioscience of Microbiota, Food and Health, 2021, 40(2):105-114.
[16] TANG N, YU Q Q, MEI C X, et al. Bifidobacterium bifidum CCFM1163 alleviated cathartic colon by regulating the intestinal barrier and restoring enteric nerves[J]. Nutrients, 2023, 15(5):1146.
[17] GE X L, DING C, ZHAO W, et al. Antibiotics-induced depletion of mice microbiota induces changes in host serotonin biosynthesis and intestinal motility[J]. Journal of Translational Medicine, 2017, 15(1):13.
[18] STORR M A, BASHASHATI M, HIROTA C, et al. Differential effects of CB(1) neutral antagonists and inverse agonists on gastrointestinal motility in mice[J]. Neurogastroenterology and Motility, 2010, 22(7):787-796; e223.
[19] KOBAYASHI M, YAMAGUCHI T, ODAKA T, et al. Regionally differential effects of sennoside A on spontaneous contractions of colon in mice[J]. Basic &Clinical Pharmacology &Toxicology, 2007, 101(2):121-126.
[20] IZZY M, MALIECKAL A, LITTLE E, et al. Review of efficacy and safety of laxatives use in geriatrics[J]. World Journal of Gastrointestinal Pharmacology and Therapeutics, 2016, 7(2):334-342.
[21] SINGH A. Brain-derived neurotrophic factor-a key player in the gastrointestinal system[J]. Przeglad Gastroenterologiczny, 2023, 18(4):380-392.
[22] SUDA K, MATSUDA K. How microbes affect depression: Underlying mechanisms via the gut-brain axis and the modulating role of probiotics[J]. International Journal of Molecular Sciences, 2022, 23(3):1172.
[23] MOLSKA M, MRUCZYK K,  A, et al. The influence of intestinal microbiota on BDNF levels[J]. Nutrients, 2024, 16(17):2891.
A, et al. The influence of intestinal microbiota on BDNF levels[J]. Nutrients, 2024, 16(17):2891.
[24] LIU W, ZHOU T T, TIAN J Q, et al. Role of GDNF, GFRα1 and GFAP in a Bifidobacterium-intervention induced mouse model of intestinal neuronal dysplasia[J]. Frontiers in Pediatrics, 2022, 9:795678.
Screening and validation of probiotics to relieve cathartic colon based on enteric glial cells
ZHU Shengnan, XUE Yifan, HUANG Yin, LI Jiazhen, LIU Wenxu, WANG Linlin, CHEN Wei*
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
ABSTRACT Cathartic colon is primarily characterized by substantial damage to the enteric nervous system (ENS).Probiotics have demonstrated the ability to repair the ENS and enhance gut motility.However, existing probiotic screening methods predominantly rely on animal models or clinical trials, both of which are inefficient and costly.This study aimed to develop a rapid and efficient in vitro screening method to identify probiotics capable of alleviating the cathartic colon.Probiotic lysates, dead bacterial components, and fermentation supernatants were co-cultured with enteric glial cells (EGCs) in vitro, and the expression levels of neurotrophic factors Bdnf, Gdnf, and S100β were measured.Principal component analysis (PCA) was employed to identify three probiotic strains with high, medium, and low in vitro scores, which were subsequently validated in vivo.Results showed that the trends in the in vivo efficacy of the three strains were consistent with their in vitro scores.Notably, Bifidobacterium bifidum BB5 significantly upregulated the expression of neurotrophic factors in vitro, indicating its potential for modulating the ENS.In vivo, Bifidobacterium bifidum BB5 increased stool water content, enhanced fecal pellet count, and reduced intestinal transit time, thereby alleviating the cathartic colon.The in vitro screening method developed based on EGCs was efficient, cost-effective, and reliable.It provided a novel scientific approach for probiotic screening and functional evaluation, offering promising probiotic intervention strategies for the treatment of the cathartic colon.This method establishe an important theoretical foundation for the screening and clinical application of probiotics and holds considerable potential for broad application.
Key words in vitro probiotic screening; cathartic colon; Bifidobacterium bifidum; enteric nervous system; enteric glial cells


 RQUEZ D V, LIDDLE R A. The gut connectome: Making sense of what you eat[J]. The Journal of Clinical Investigation, 2015, 125(3):888-890.
RQUEZ D V, LIDDLE R A. The gut connectome: Making sense of what you eat[J]. The Journal of Clinical Investigation, 2015, 125(3):888-890. O
O  , BOEING S, et al. Neuronal programming by microbiota regulates intestinal physiology[J]. Nature, 2020, 578(7794):284-289.
, BOEING S, et al. Neuronal programming by microbiota regulates intestinal physiology[J]. Nature, 2020, 578(7794):284-289.