传统牦牛发酵乳中产细菌素菌株的筛选鉴定及细菌素特性
刘丰铭1,2,陶生俭3,梁琪1,2*,范萍3,陈湑慧1,2,赵保堂1,2
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)2(甘肃省功能乳品实验室,甘肃 兰州,730070)3(兰州庄园乳业有限公司,甘肃 兰州,730020)
摘 要 为了筛选具有广谱细菌素合成能力的菌株,该研究以大肠杆菌和金黄色葡萄球菌为指示菌,通过琼脂平板扩散法从甘肃甘南传统牦牛发酵乳中分离得到一株产细菌素植物乳植杆菌(Lactiplantibacillus plantarum)EL2。经qPCR鉴定发现该菌株具有多种细菌素合成基因,其合成的细菌素粗提物不仅具备常见细菌素对革兰氏阳性菌的抑制活性,还能抑制革兰氏阴性菌和部分真菌。通过测定大肠杆菌胞内物质泄露、结合扫描电镜观察,发现该细菌素通过破坏菌株细胞膜完整性造成菌体死亡,抑菌效率呈浓度依赖性。EL2产细菌素对温度和酸碱性耐受能力较好,在生产应用中具有稳定的活性和广泛的使用范围,其对消化蛋白酶敏感且不具有溶血活性,在中低浓度时对Caco-2无明显细胞毒性,具有良好的生物安全性。因此,该菌株的发现及其细菌素的初步探究为开发天然防腐剂提供了新的资源和理论基础,具有广阔的应用前景与深入挖掘的研究价值。
关键词 细菌素;广谱抑菌;分离筛选;植物乳植杆菌;基因鉴定;抑菌机制;安全性评价
DOI:10.13995/j.cnki.11-1802/ts.042516
引用格式:刘丰铭,陶生俭,梁琪,等.传统牦牛发酵乳中产细菌素菌株的筛选鉴定及细菌素特性[J].食品与发酵工业,2025,51(14):122-130.
LIU Fengming,TAO Shengjian,LIANG Qi, et al.Screening and identification of bacteriocin-producing strains from traditional yak fermented milk and characterization of bacteriocins[J].Food and Fermentation Industries,2025,51(14):122-130.
第一作者:硕士研究生(梁琪教授为通信作者,E-mail:liangqi@gsau.edu.cn)
基金项目:中央引导地方科技发展资金专项(25ZYJA038)
收稿日期:2025-02-25,改回日期:2025-03-20
微生物污染是造成食品腐败的主要原因,其中金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、沙门氏菌等细菌污染引起的食品腐败对人体健康有严重危害[1]。食品防腐剂可以抑制腐败菌的生长繁殖,从而延长食品保质期,而长期摄入过量防腐剂对人体的危害极大[2]。研究表明,天然防腐剂在人体内的代谢适应性较强,毒性风险极低,且同样具有良好的抑菌保鲜能力,因此开发绿色安全的天然防腐剂已成为国内外研究的热点[3]。
乳酸菌在发酵过程中可代谢分泌多种天然抑菌物质,例如乳酸、过氧化氢、细菌素等[4-5]。其中细菌素是由乳酸菌核糖体合成的小分子多肽或蛋白类物质,可被人体消化酶分解吸收,具有安全高效的特性,被称为“天然食品防腐剂”,拥有广阔的应用前景[6]。其中由乳酸链球菌产生的细菌素Nisin,被美国食品药品管理局(Food and Drug Administration,FDA)批准为“公认安全”(Generally Recognized as Safe,GRAS)的食品防腐剂[7]。研究表明,常见的细菌素抑菌机制为破坏微生物的细胞膜平衡,进而影响靶细胞的能量代谢、物质交换、信息传递[8]。部分种类细菌素亦可通过抑制微生物遗传物质的表达合成、抑制其发育繁殖,从而控制微生物污染[9]。了解细菌素的特异性抑菌能力和机制有利于针对性地高效利用细菌素、实现添加浓度的降低,可以在节约生产成本的同时提高食用安全性。然而乳酸菌细菌素通常对近缘微生物和革兰氏阳性菌的抑制效果更显著,对革兰氏阴性菌和真菌的抑制能力较弱,使其使用范围受到限制[10]。因此,筛选具有广谱抑菌能力的产细菌素菌株成为挖掘天然防腐剂的首要任务。
甘南藏区传统牦牛酸奶在制作过程中不添加任何商业发酵剂,经长期天然发酵中的自然驯化留存了大量优势菌种,形成了稳定的微生物种群平衡,使其在贮存过程中不易被腐败菌侵害,因而可能富含可抑制腐败菌生长的优势乳酸菌[11-12]。据此本研究分别以革兰氏阳性的S.aureus和革兰氏阴性的E.coli为指示菌,从传统牦牛酸奶中筛选具有广谱抑菌能力的乳酸菌,通过qPCR技术鉴定细菌素合成的关键基因,并以革兰氏阴性的E.coli探究其抑菌机理,为开发安全高效的天然防腐剂提供科学依据。
1 材料与方法
1.1 材料与试剂
藏区传统牦牛发酵乳采自甘肃省甘南藏族自治州合作市博拉乡扎沙村,样品经无菌采集后保存在4 ℃冰盒中,密封运送至甘肃省功能乳品实验室,于-80 ℃冰箱中保存。
E.coli CGMCC44102、S.aureus CGMCC26003,中国普通微生物菌种保藏管理中心;MRS培养基、LB培养基、TritonX-100,北京酷来搏科技有限公司;DNA快速抽提试剂盒,美国Sigma公司;过氧化氢酶、胃蛋白酶、胰蛋白酶、木瓜蛋白酶、PBS缓冲液,上海源叶生物科技有限公司;5 kDa透析袋、ATP含量测定试剂盒,北京索莱宝科技有限公司;生理盐水、硫酸铵、氢氧化钠,中国医药集团有限公司;50 g/L羊血胰蛋白酶黄豆琼脂(tryptore soy agar,TSA)平板,广东环凯微生物科技有限公司。
1.2 仪器与设备
HG303-4电热恒温培养箱、HWS-26恒温水浴锅,上海一恒科学仪器有限公司;SW-GJH-2FD超净工作台,苏州净化设备有限公司;TGL-20台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;pHS-3C pH计,上海精密仪器有限公司;NanoDrop Lite分光光度计,美国Thermo Scientific公司;ZSB-1200IIA2生物安全柜,南京博尔迪生物科技有限公司;扫描电子显微镜,赛默飞世尔科技公司。
1.3 实验方法
1.3.1 产细菌素菌株的筛选
1.3.1.1 乳酸菌的初筛
称取10 g牦牛发酵乳,溶解于100 mL的8.5 g/L无菌生理盐水中,振荡混匀并梯度稀释。取0.1 mL适宜浓度(104、105、106)的稀释液涂布于含10 g/L CaCO3的MRS琼脂培养基中,37 ℃培养48 h,连续平板划线提高纯度[13]。
1.3.1.2 具有抑菌能力菌株的筛选
将分离纯化得到的乳酸菌活化二代后接种至MRS液体培养基,培养24 h后,于4 ℃、10 000 r/min下离心10 min,并使用0.22 μm的滤膜过滤除菌,得到无细胞发酵上清液(cell-free supernatant,CFS)。采用双层琼脂平板扩散法,用游标卡尺测量受试乳酸菌产生的CFS对指示菌(S.aureus和E.coli)的抑菌圈直径,读数精确至0.01 mm。
1.3.1.3 具有产细菌素能力菌株的筛选
使用1 mol/L的NaOH溶液将1.3.1.2节中具有抑菌活性的CFS的pH调至7,并加入H2O2酶。采用双层琼脂平板扩散法[4],用游标卡尺测量处理后的CFS对指示菌的抑菌圈直径,读数精确至0.01 mm。
1.3.2 产细菌素菌株的鉴定
1.3.2.1 菌株16S rDNA 鉴定
参照DNA快速抽提试剂盒的说明提取菌株EL2的基因组DNA,并进行PCR扩增,扩增产物送至武汉擎科生物有限公司测序,根据测序结果利用Mega 9.0构建系统进化树。
1.3.2.2 细菌素合成关键基因的qPCR鉴定
参照DNA快速抽提试剂盒说明书提取菌株EL2的DNA,通过NCBI网站确定植物乳植杆菌(Lactiplantibacillus plantarum)中合成细菌素的关键基因,使用Primer Premier 5.0设计引物,引物序列见表1。参照张开屏等[14]的方法设计PCR反应体系和反应程序,PCR产物采用10 g/L的琼脂糖凝胶电泳20 min,使用凝胶成像系统观察扩增结果。
表1 引物序列信息
Table 1 Primer sequence information

基因名称方向核苷酸序列(5'-3')产物大小/bpplnAFTGAAAATTCAAATTAAAGGTATGA108RTAATTGCAGTTGCCCCCATCplnBFATGCCATTGAGCAAGCCC200RCTGATCAACAAGATCCCGCACplnCFAGTTGGTGGTGGCGACAG111RACCCGGCCTGAGTTTGTTCplnDFGCAATGGAGCTTAGGGTTGC119RAGTCCAGCCTGTTTGTCCTCplnEFGAAGTTACAATATTCCAGGTTGCC133RACGAATGCCTGCAACTGAACCplnFFGTTTTGCGTGACCGTGAATTAA106RAATCGGCAGGCCCAACAGplnJFATTTGGATGTAGTAGATGCATTTGC141RAACGACGGATTGCTCTGCCplnKFTGAATTTGAAGAATTAACTGCTGAC134RCCCTTGAACCACCAAGCACplnNFTGCCGGGTTAGGTATCGAAAT118RTCCCTCTGCTACCTTTCCCA
1.3.3 EL2产细菌素的抑菌能力
1.3.3.1 细菌素粗提物的制取
采用硫酸铵沉淀法[15],用NaOH将EL2的CFS调节至pH值为7,缓慢加入硫酸铵粉末至最终饱和度为70%。振荡析出细菌素蛋白沉淀经离心10 min后复溶于0.2 mol/L的PBS中,并使用5 kDa的透析袋脱盐浓缩后冻干48 h,即得到细菌素粗提物。
1.3.3.2 抑菌谱
称取1 mg的细菌素冻干粉末,溶解于1 mL浓度为0.2 mol/L的PBS中,振荡均匀得到1 mg/mL的细菌素溶液,采用双层琼脂平板扩散法,测量细菌素粗提液对指示菌的抑菌圈直径,读数精确至0.01 mm。
1.3.3.3 最小抑菌浓度(minimal inhibit concentration,MIC)
调节对数期大肠杆菌浓度为106 CFU/mL,采用二倍稀释法将1.024 mg/mL的细菌素用PBS梯度稀释备用。在96孔板中各加入100 μL菌液与不同浓度的细菌素,37 ℃培养16 h后检测OD600nm值,其中完全抑制大肠杆菌生长的细菌素浓度记为MIC。将100 μL细菌素溶液和100 μL的无菌LB培养基混合作为阴性对照,以200 μL的菌液作为阳性对照。
1.3.3.4 抑菌动力学曲线
将浓度为1/2×MIC、1×MIC以及2×MIC的细菌素加入菌浓度为106 CFU/mL的对数期E.coli菌液,以不加细菌素的菌液作为对照,37 ℃培养24 h,每隔2 h测量OD600nm值,并绘制时间-抑菌曲线。
1.3.4 EL2产细菌素在不同处理下的抑菌活性稳定性
1.3.4.1 EL2产细菌素对热处理的敏感性
将1 mg/mL的细菌素粗提液分别在35、50、65、80、95 ℃水浴30 min,同时在121 ℃加热15 min,迅速冷却至室温,测定抑菌活性。
1.3.4.2 EL2产细菌素的酸碱耐受性
将1 mg/mL的细菌素粗提液的pH值分别调至2.0、4.0、6.0、8.0、10.0、12.0,室温放置3 h,再回调到pH 6.0,测定抑菌活性。
1.3.4.3 EL2产细菌素对蛋白酶的敏感性
将1 mg/mL的细菌素粗提液分别用木瓜蛋白酶、胰蛋白酶、蛋白酶K和胃蛋白酶在37 ℃下水浴3 h,冷却至室温,将pH值调节到6.0,测定抑菌活性。
1.3.5 EL2产细菌素的抑菌机制
1.3.5.1 胞内ATP的泄漏
将浓度为1×MIC和2×MIC的细菌素加入菌浓度为106 CFU/mL的对数期E.coli菌液,以不加细菌素的菌液作为对照,37 ℃培养60 min,每10 min取样离心,将菌体超声破碎后按照ATP含量测定试剂盒说明书进行胞内ATP含量测定。
1.3.5.2 紫外吸收物质的泄露
采用1.3.5.1节方法处理指示菌,37 ℃培养5 h,每隔1 h取样一次制取CFS。使用紫外分光光度计分别测定OD280nm(蛋白质)和OD260nm(核酸)下CFS的吸光度。
1.3.5.3 细胞形态的观察
参考ZHU[8]的方法,将指示菌E.coli培养至对数生长期中期,添加1×MIC的细菌素,37 ℃分别处理2 h和6 h后离心取菌泥。使用PBS洗涤菌体后离心,加入5 mL的25 g/L戊二醛冷藏固定过夜,次日在扫描电镜下观察细胞结构损伤情况。
1.3.6 EL2产细菌素的安全性评价
1.3.6.1 溶血性试验
参考胡伟中等[5]的方法进行溶血性实验,将EL2产细菌素稀释得到1×MIC、2×MIC、4×MIC、8×MIC、16×MIC、32×MIC的溶液,以生理盐水作为阴性对照,并将TritonX-100稀释5次作为阳性对照,在50 g/L羊血TSA平板的孔中各添加50 μL,37 ℃下孵育24 h,观察溶血圈。
1.3.6.2 细胞毒理试验
参考SOLTANI等[16]的方法培养人结肠腺癌细胞(Caco-2)细胞并进行细胞毒理实验。将稀释浓度为1×MIC、2×MIC、4×MIC、8×MIC、16×MIC、32×MIC、64×MIC、128×MIC的EL2产细菌素溶液加入细胞培养液,并设置2个不添加细菌素的对照组,向其中一个对照组中按1∶1的体积比加入裂解液(Promega)处理5 min以诱导乳酸脱氢酶(lactate dehydrogenase,LDH)最大程度释放。将CytoTox-ONETM试剂加入待测细胞培养液,在室温下孵育10 min后加入终止液,测量其在OD560nm处的吸光度,即LDH的释放量。每个处理组的值均以对照组的值作为空白对照进行校正,细胞毒性以最大LDH释放量(经裂解液处理的细胞)的百分比来表示,通过公式(1)进行计算:
细胞毒性(LDH相对释放量)
(1)
1.4 数据处理
所有实验均为3次重复,结果以“平均数±标准差”表示;采用Excel进行数据整理;采用IBM SPSS Statistics 27.0软件进行数据显著性分析;采用Origin 2019b软件对数据处理结果进行绘图。
2 结果与分析
2.1 产细菌素菌株的筛选
从传统牦牛酸奶样品中分离得到36株乳酸菌,其中21株乳酸菌的CFS对2种指示菌均有抑制作用。研究表明,革兰氏阴性菌具有含脂多糖、磷脂、脂蛋白等保护物质的细胞外膜,因此很多抑菌物质对革兰氏阳性菌的抑制效果比革兰氏阴性菌强[10,17]。本研究中所有受试乳酸菌的CFS对S.aureus的抑菌圈直径均高于E.coli,且CFS经除酸除H2O2处理后,有6株菌仅对S.aureus有抑制作用,而只有3株菌仅对E.coli有抑制作用,表明可产生抑制革兰氏阳性菌细菌素的乳酸菌更为常见。所有受试菌株中仅有2株菌对2种指示菌均有抑制作用,显示出细菌素合成与作用的高度特异性。其中EL2对S.aureus的抑菌圈直径为18.43 mm,对E.coli的抑菌圈直径为17.18 mm,均高于其他菌株,因此选择EL2作为后续研究的供试菌株。
2.2 产细菌素菌株的鉴定
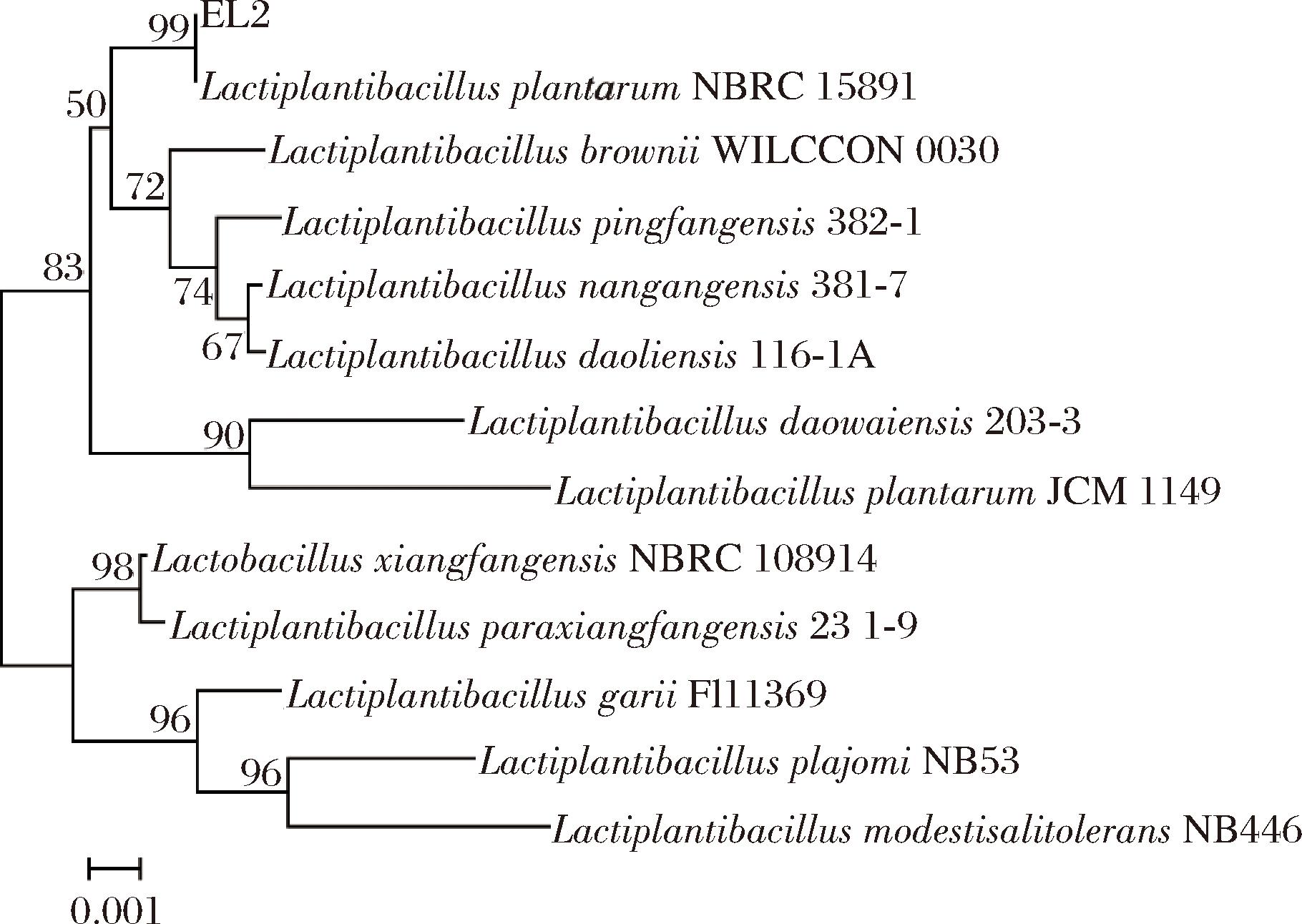
如图2所示,基于16S rDNA基因序列构建菌株系统发育树,结果表明菌株EL2与L.plantarum NBRC 15891亲缘关系最近,相似度达到99%,结合形态学特征,鉴定菌株EL2为L.plantarum。研究表明,L.plantarum细菌素的合成受群体感应(quorum sensing,QS)系统的调控,其中包括编码信号分子AIP的plnA、编码“信号接收器”组氨酸激酶(histidine kinase,HK)的plnB和编码反应调节蛋白(response regulator,RR)的plnC和plnD[18]。QS系统通过完整的信号传导过程精准调控编码细菌素前体肽PlnJK、PlnEF、PlnN等序列的启动子转录并生成相关细菌素蛋白[19]。
将EL2中细菌素合成相关基因的特异性引物进行PCR扩增并通过凝胶电泳观察,如图3所示,9个受试基因的PCR产物均扩增出相应长度的电泳条带,表明EL2含有调控细菌素合成中信息传导的关键基因plnA、plnB、plnC、plnD;且至少含有5种表达潜在细菌素蛋白的编码基因plnE、plnF、plnJ、plnK、plnN。研究发现,plnE和plnF可编码Ⅱb类双肽细菌素PlnEF,而plnJ和plnK可编码PlnJK,这2种双肽细菌素分别具有不同的抑菌谱[20-21]。本研究中EL2同时含有plnE、plnF、plnJ和plnK基因,表明EL2同时具备合成PlnEF和PlnJK的潜力,且EL2中可能还含有其他未经报道的细菌素合成基因,因此EL2合成的细菌素粗提物具备拥有高效广谱抑菌能力的潜质。
2.3 EL2产细菌素的抑菌能力
采用双层琼脂平板扩散法检测EL2产细菌素对不同微生物的拮抗能力差异,如表2所示,所有可致食品腐败的革兰氏阳性菌和革兰氏阴性菌均对其表现出高度敏感性,真菌黑曲霉也对其具有敏感性,表明EL2产细菌素的抑菌谱较广,这可能与其含有多种产细菌素基因相关。研究表明在酸奶贮运过程中,乳酸菌会利用残存乳糖继续发酵产生过度酸味,称为酸奶后酸化现象,严重影响酸奶品质,可通过添加细菌素的方式抑制酸奶后酸化[22]。本研究中EL2产细菌素对德氏乳杆菌保加利亚亚种等乳酸菌均有一定抑制作用,表明EL2产细菌素具有控制酸奶后酸化的潜在应用价值。另外,EL2筛选自甘南牦牛发酵乳,本身具有较好的发酵适应性;且其作为L.plantarum,通常具有一定的益生性。因此EL2具有作为酸奶发酵剂中功能乳酸菌的应用潜质,后期可通过发酵菌株的复配优化实验,实现EL2在发酵乳生产中的有效添加。
表2 EL2产细菌素的抑菌谱
Table 2 The antibacterial spectrum of bacteriocin produced by EL2
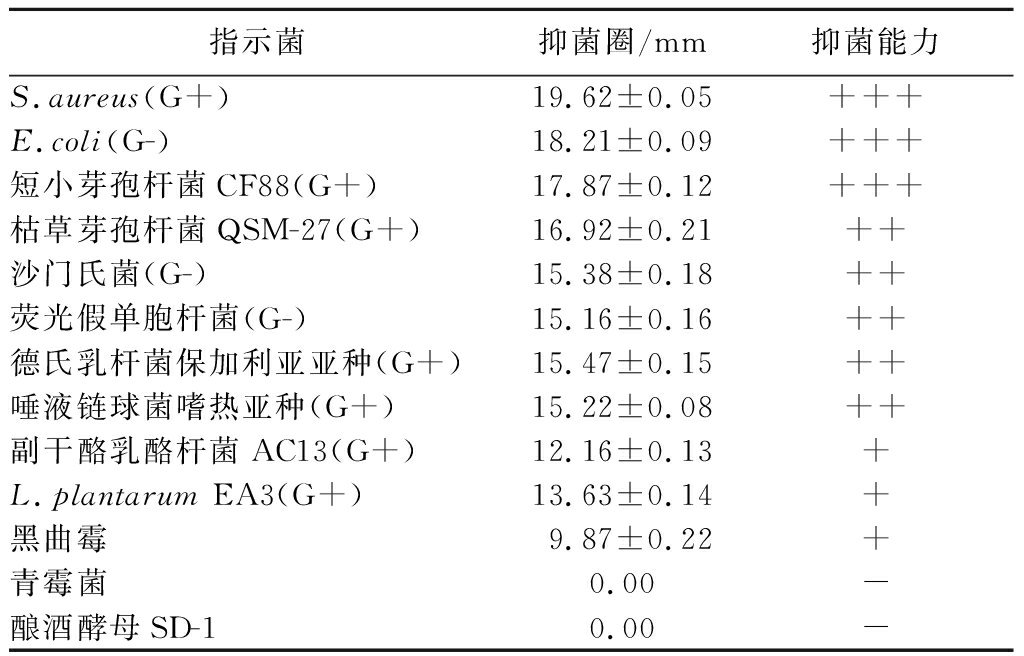
指示菌抑菌圈/mm抑菌能力S.aureus(G+)19.62±0.05+++E.coli(G-)18.21±0.09+++短小芽孢杆菌CF88(G+)17.87±0.12+++枯草芽孢杆菌QSM-27(G+)16.92±0.21++沙门氏菌(G-)15.38±0.18++荧光假单胞杆菌(G-)15.16±0.16++德氏乳杆菌保加利亚亚种(G+)15.47±0.15++唾液链球菌嗜热亚种(G+)15.22±0.08++副干酪乳酪杆菌AC13(G+)12.16±0.13+L.plantarum EA3(G+)13.63±0.14+黑曲霉9.87±0.22+青霉菌0.00-酿酒酵母SD-10.00-
注:+++代表抑菌能力较强;++代表抑菌能力中等;+表示抑菌能力一般;-代表无抑菌能力。
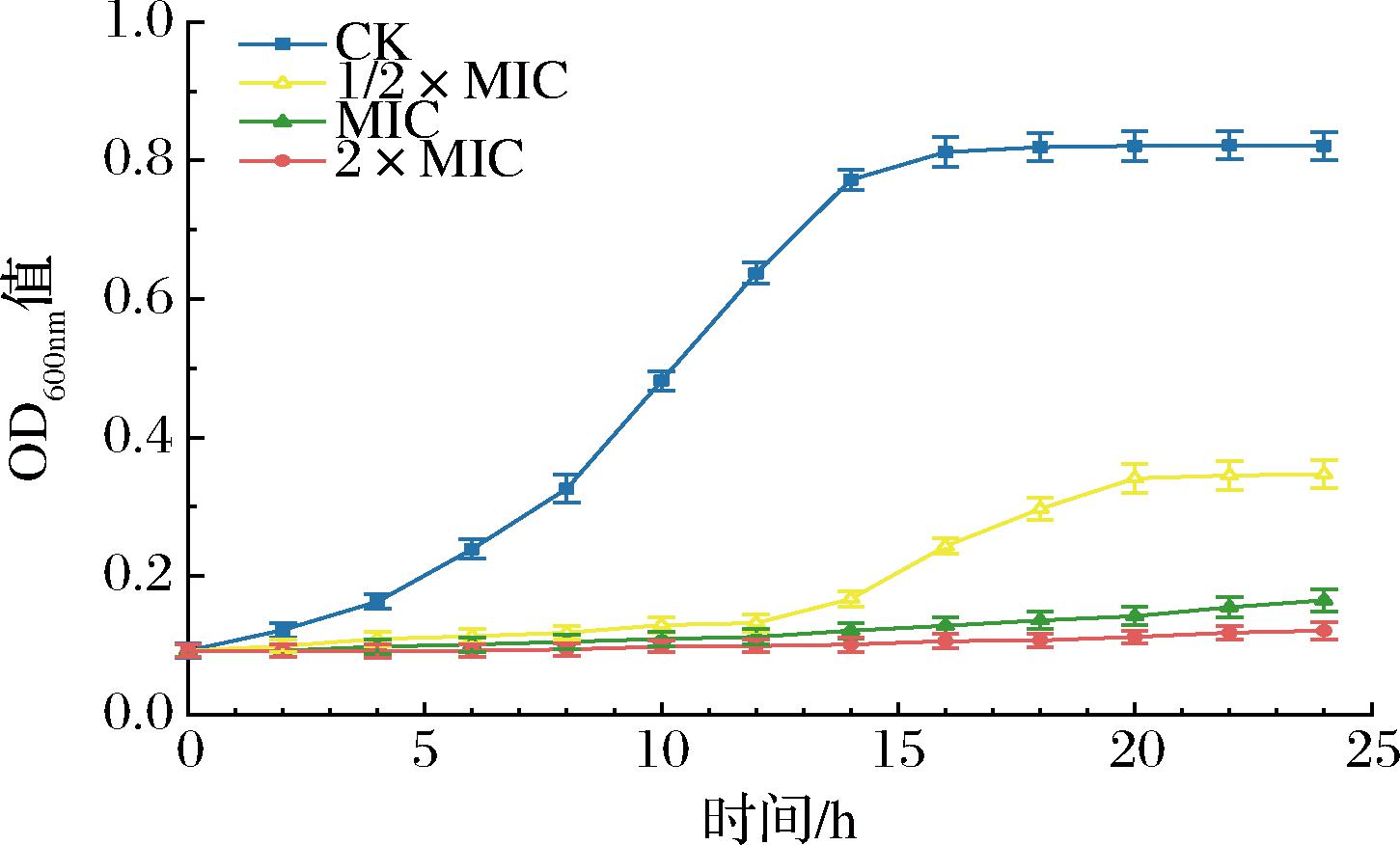
如表3所示,大肠杆菌的OD600nm值随细菌素浓度升高而降低,抑菌效果与细菌素浓度呈正相关。当细菌素质量浓度为32 μg/mL时,E.coli的OD600nm值出现骤降且与阴性对照组无显著差异(P>0.05),表明E.coli的生长被完全抑制。研究发现,细菌素BMP11和细菌素A32对E.coli的MIC分别为0.6 mg/mL和1.25 mg/mL[23-24]。本研究中EL2产细菌素对E.coli的MIC为32 μg/mL,与上述细菌素相比EL2产细菌素具有更高效的抗菌活性,其抑菌能力在未纯化的细菌素中属于较高水平,具备深入拓展与转化应用的广阔前景。由图4可知,细菌素浓度为1/2×MIC时E.coli的生长受到一定抑制,当细菌素浓度增加到1×MIC或2×MIC时,E.coli的生长被完全抑制。结果表明,EL2产细菌素的作用效果高度依赖于浓度,CAO等[25]的研究结果与此类似。
表3 EL2产细菌素的最小抑菌浓度
Table 3 The minimum inhibitory concentration of bacteriocin produced by EL2
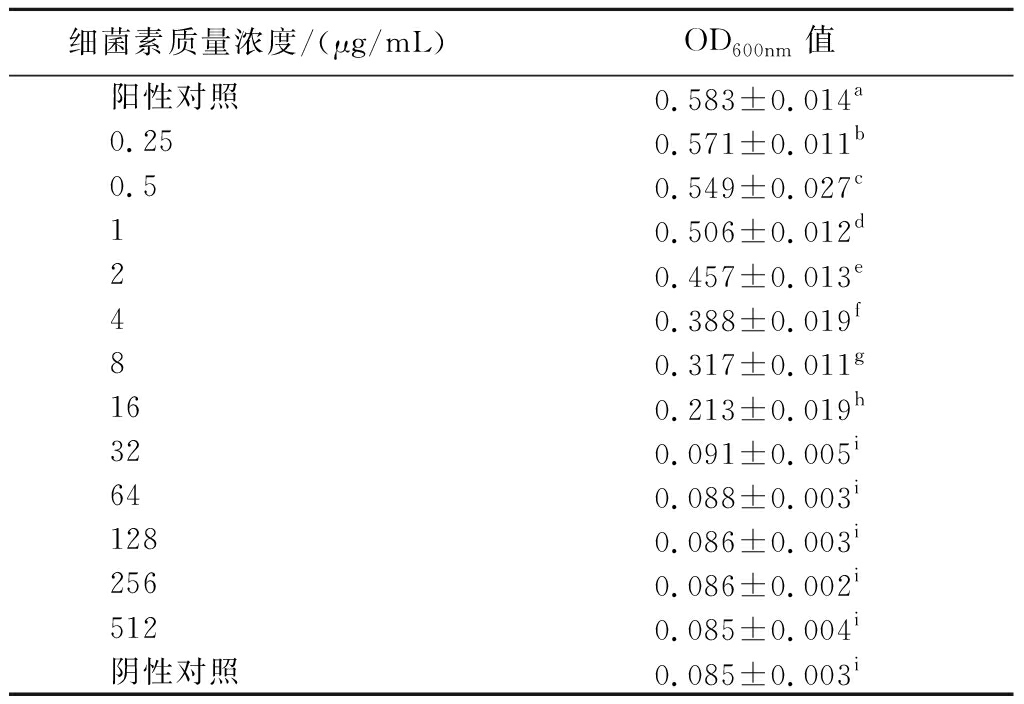
细菌素质量浓度/(μg/mL)OD600nm值阳性对照0.583±0.014a0.250.571±0.011b0.50.549±0.027c10.506±0.012d20.457±0.013e40.388±0.019f80.317±0.011g160.213±0.019h320.091±0.005i640.088±0.003i1280.086±0.003i2560.086±0.002i5120.085±0.004i阴性对照0.085±0.003i
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.4 EL2产细菌素的理化稳定性
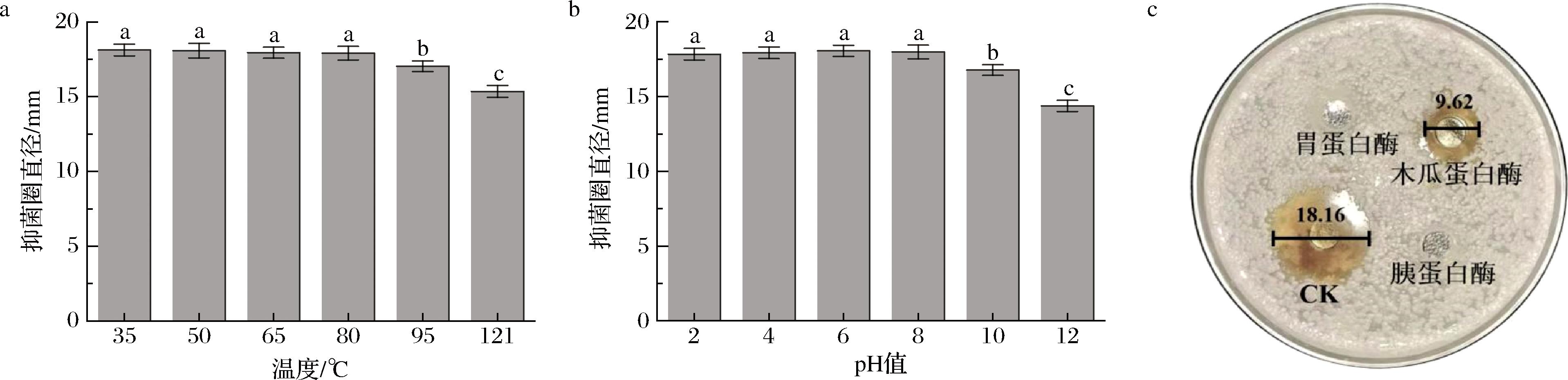
EL2产细菌素在35~95 ℃下处理30 min后抑菌圈直径稳定在18.12~17.03 mm,抑菌活性降幅低于6.11%;经121 ℃处理15 min后,抑菌圈直径为15.35 mm,抑菌活性仍保持84.71%(图5-a),结果表明该抗菌物质具有良好的热稳定性,适宜作为热加工食品中的天然防腐剂。
由图5-b可知,EL2产细菌素在pH<10的条件下抑菌效果无显著性变化(P>0.05),且当pH值为10时抑菌活性仍保持了92.35%。随着pH值增大至12,抑菌圈直径减小为14.37 mm,抑菌活性降低至79.61%,表明该细菌素在酸性、中性、弱碱性环境下均具有高效抑菌活性,且对碱性pH的耐受范围大于10,高于Nisin对碱性环境的耐受程度[7]。因此,EL2产细菌素的抑菌活性稳定性较强,在实际生产中可具有广泛的适用范围,拥有较高的开发应用价值。
与CK组相比,EL2产细菌素经胃蛋白酶和胰蛋白酶处理后抑菌活性完全丧失(图5-c),表明其对人体内含有的蛋白质消化酶高度敏感,可被人体消化系统分解代谢,进一步证实了其在食品领域应用的安全性。同时EL2产细菌素在木瓜蛋白酶处理下尚存52.97%的抑菌活性,可能由于该细菌素对木瓜蛋白酶具有一定耐受性或酶作用不够充分,王嘉悦等[26]发现的细菌素WJY-6也有相同表现。
2.5 EL2产细菌素的抑菌机制
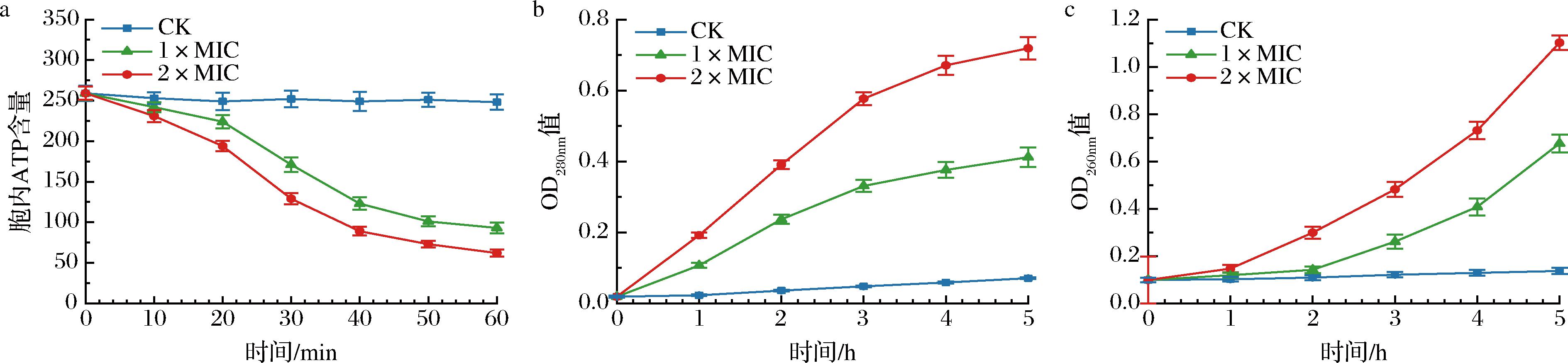
细胞膜作为细胞的关键构成部分,维持着细胞形态和胞内外的物质平衡,当细胞膜发生损伤时,贮存于胞内的ATP、蛋白质、核酸等物质会泄露至胞外,因此胞内物质的泄露量可作为评估细胞膜受损程度的重要依据。如图6-a所示,对照组ATP含量几乎保持不变,而细菌素处理后的E.coli胞内ATP含量不断下降,表明EL2产细菌素使细胞膜的通透性增加并导致ATP泄露。在细菌素作用的10~40 min内,胞内ATP含量的降幅较大,表明细菌素处理可在短时间内显著影响E.coli细胞膜通透性;作用40 min后ATP泄露速率减小并逐渐趋于稳定,表明胞内ATP已被逐渐耗竭,细胞能量供应体系严重受损。
如图6-b与6-c所示,经EL2产细菌素处理后5 h内,E.coli CFS的OD280nm值(蛋白质)和OD260nm值(核酸)持续上升,表明E.coli表面出现了可使蛋白质、核酸等生物大分子泄露的细胞膜孔洞。通过对比图6-b与图6-c中胞外蛋白质和核酸浓度变化的曲线,发现蛋白质的泄露速率在0~3 h内较大,3 h后逐渐降低,而核酸的泄露速率在0~3 h内较为平缓,在3 h后增长。结果表明蛋白质大量泄露的时间早于核酸,这可能由于核酸分子质量极大且结构致密,而蛋白质分子质量相对较小且溶解性较好,更容易发生泄露。
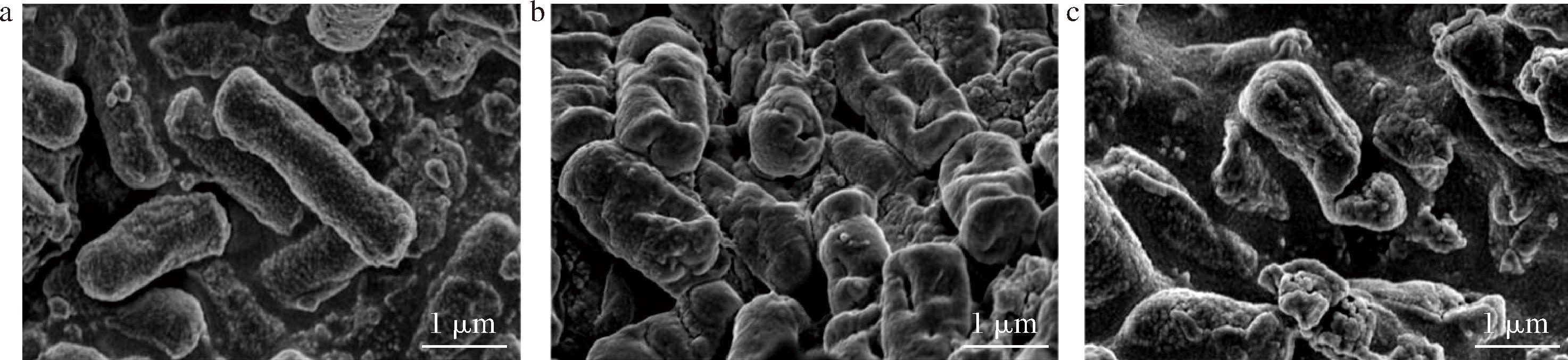
通过扫描电镜观察,E.coli经1×MIC的细菌素分别处理2 h和6 h后的形态结构变化。如图7所示,对照组E.coli细胞呈完整且独立的杆状,外膜结构均匀细腻,细胞体饱满圆润。经细菌素处理2 h后,E.coli细胞呈现扭曲凹陷的状态,表明细胞膜通透性受损,细胞内外渗透压严重失衡;部分菌体出现不同程度的细胞膜孔洞,细胞内容物发生泄露。经细菌素处理6 h后,E.coli菌体出现横断裂解,细胞形态严重受损,胞内物质大量析出现象。以上结果表明,细菌素处理初期细胞膜通透性受损,分子质量较小的蛋白质从细胞膜上的微小破损或孔洞泄露;延长细菌素处理时间至6 h后菌体破裂,核酸等分子质量更大的物质从细胞中逸散,与大部分Ⅱ类细菌素类似[6,8]。但目前对EL2产细菌素破坏细胞膜形成孔洞的具体机制尚不明确,需要在细菌素纯化后进行深入探究。
2.6 EL2产细菌素的安全性评价
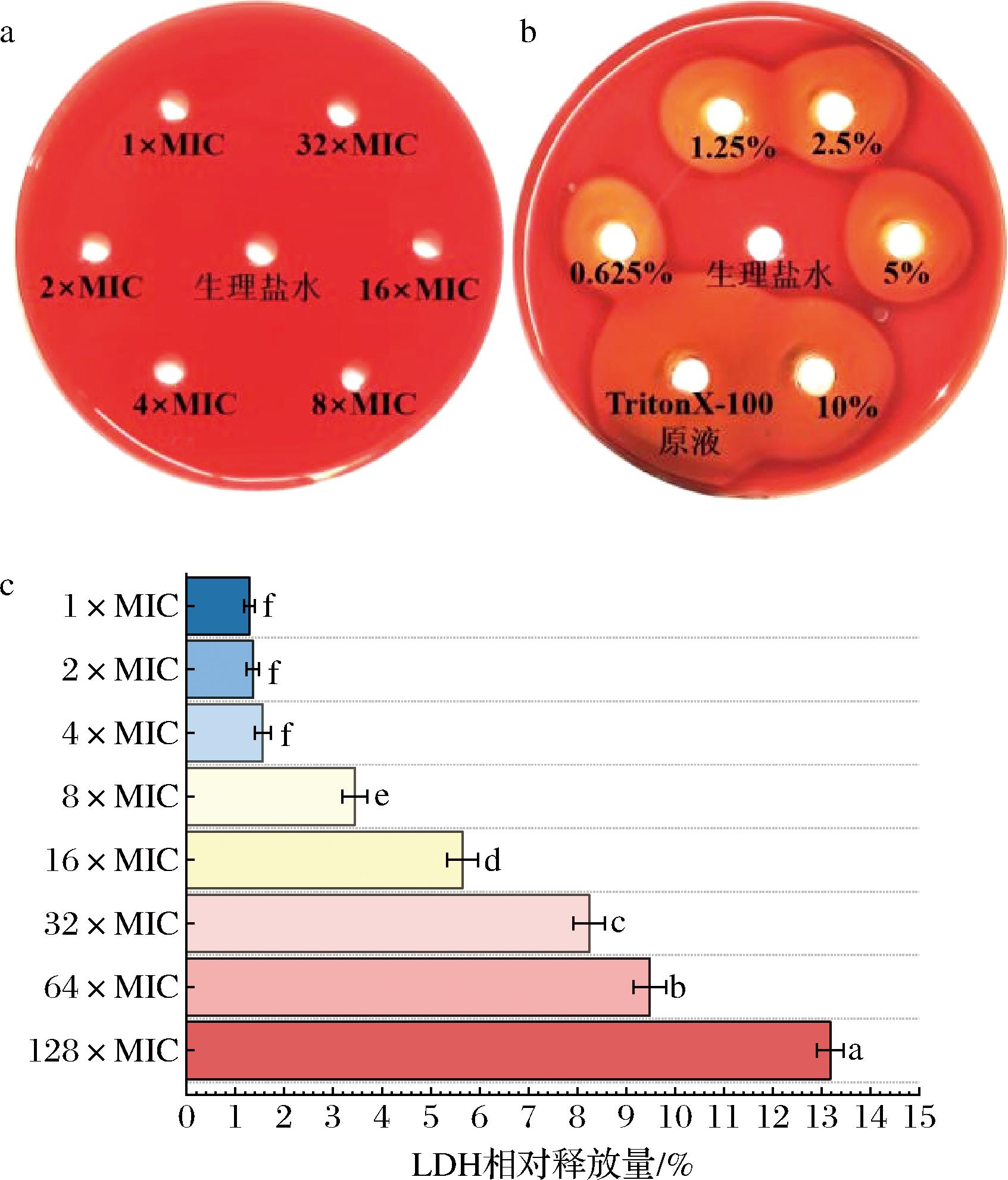
具有溶血性的物质通常具有较强的致病性或毒性,本研究通过在羊血TSA平板上打孔灌注不同浓度的细菌素,测试EL2产细菌素的溶血活性[27]。如图8-a和图8-b所示,阴性对照组生理盐水未出现溶血圈,阳性对照组TritonX-100稀释5次后仍出现明亮溶血圈,而EL2产细菌素在32×MIC(1.024 mg/mL)时仍未出现溶血圈,表明EL2产细菌素具有一定生物安全性。
Caco-2细胞模型与人小肠上皮细胞同源性好,广泛用于口服药的吸收、转运和毒理研究,通过测定EL2产细菌素对Caco-2细胞LDH释放率的影响,评估EL2产细菌素的安全性[16]。研究表明,大部分细菌素在低浓度时没有显著毒性作用,在高浓度时表现出低毒作用[6]。如图8-c所示,EL2产细菌素在低于8×MIC(256 μg/mL)时对LDH相对释放量的影响始终低于2%,表明该细菌素在低浓度对Caco-2细胞膜通透性的影响可忽略不计。细菌素作用浓度提高后,LDH相对释放量显著提高(P<0.05),然而当细菌素质量浓度提高至64×MIC(2.048 mg/mL)时,LDH相对释放量仍低于10%,即Caco-2细胞活性仍高于90%,而细菌素CH3在低剂量下就可使细胞活性下降至80%左右[28]。因此,EL2产细菌素在低和中浓度时具有较高的生物安全性,后续可通过大鼠实验验证其在高浓度的毒性作用。
3 结论
本研究从传统牦牛发酵乳中筛选获得一株可合成广谱细菌素的植物乳植杆菌EL2,此菌株具有多种细菌素合成基因,其合成的细菌素具有高效的广谱抑菌能力,且具有控制酸奶后酸化的应用潜质。EL2产细菌素通过破坏大肠杆菌细胞膜完整性使细胞内容物泄漏,造成菌体死亡。该细菌素对消化蛋白酶敏感,其溶血性实验结果为阴性且在中低浓度时对Caco-2 细胞没有显著毒性作用,表明其具有良好的生物安全性;其稳定性较好,对高温环境和极端pH的耐受能力较强,在实际生产中具有广泛的适用范围。因此,EL2产细菌素具备作为高效天然防腐剂来防控食源性致病菌污染的应用价值。本研究丰富了合成广谱细菌素的乳酸菌资源,也为后续菌株EL2的益生和发酵特性研究,以及EL2产细菌素纯化表征、结构鉴定和开发应用等深入探索提供了理论基础。
参考文献
[1] ODEYEMI O A, ALEGBELEYE O O, STRATEVA M, et al. Understanding spoilage microbial community and spoilage mechanisms in foods of animal origin[J]. Comprehensive Reviews in Food Science and Food Safety, 2020, 19(2):311-331.
[2] ABD-ELHAKIM Y M, BEHAIRY A, HASHEM M M M, et al. Toll-like receptors and nuclear factor kappa B signaling pathway involvement in hepatorenal oxidative damage induced by some food preservatives in rats[J]. Scientific Reports, 2023, 13(1):5938.
[3] DONG H Y, XU Y, ZHANG Q Q, et al. Activity and safety evaluation of natural preservatives[J]. Food Research International, 2024, 190:114548.
[4] 叶庆磊, 张颖, 刘子豪, 等. 一株拮抗单增李斯特菌的蒙氏肠球菌A9-1A的筛选及其细菌素抗菌活性分析[J]. 微生物学通报, 2024, 51(12):5177-5192.YE Q L, ZHANG Y, LIU Z H, et al. Enterococcus mundtii A9-1A with antagonistic effect on Listeria monocytogenes:Screening and characterization of antimicrobial activity of its bacteriocin[J]. Microbiology China, 2024, 51(12):5177-5192.
[5] 胡伟中, 李慧颖 ,史早,等. 抑制单增李斯特菌的益生乳酸菌筛选及原位抑制效果研究[J]. 食品与发酵工业, 2025, 51(10):23-32.HU W Z, LI H Y, SHI Z, et al. Screening of probiotic lactic acid bacteria for inhibiting Listeria monocytogenes and study on their in situ inhibitory effects[J]. Food and Fermentation Industries, 2025, 51(10):23-32.
[6] 高雅茹, 张灏, 黄晓宇, 等. 屎肠球菌ID4产生的细菌素及作用机制研究[J]. 食品与发酵工业, 2025, 51(2):16-24.GAO Y R, ZHANG H, HUANG X Y, et al. Studies on antibacterial activity and mechanism of Enterococcus faecium ID4 bacteriocin[J]. Food and Fermentation Industries, 2025, 51(2):16-24.
[7] WU J J, ZANG M W, WANG S W, et al. Nisin: From a structural and meat preservation perspective[J]. Food Microbiology, 2023, 111:104207.
[8] ZHU R F, LI B Y, HAN S W, et al. Purification, characterization, and antimicrobial mechanism of a novel broad-spectrum bacteriocin produced by Lactiplantibacillus plantarum SCA12 from Traditional Chinese Fermented Mustard greens[J]. LWT, 2024, 211:116933.
[9] LUO L L, YI L H, CHEN J X, et al. Antibacterial mechanisms of bacteriocin BM1157 against Escherichia coli and Cronobacter sakazakii[J]. Food Control, 2021, 123:107730.
[10] TODOROV S D, DE MELO FRANCO B G, TAGG J R. Bacteriocins of Gram-positive bacteria having activity spectra extending beyond closely-related species[J]. Beneficial Microbes, 2019, 10(3):315-328.
[11] 朱潇, 梁琪, 王湘竹, 等. 基于Illumina MiSeq高通量技术比较甘肃藏区传统牦牛发酵乳制品细菌菌群多样性[J]. 中国食品学报, 2021, 21(4): 336-344.ZHU X, LIANG Q, WANG X Z, et al. Comparison of bacterial community diversity in traditional Tibetan yak fermented dairy products from Gansu based on Illumina MiSeq high-throughput technology [J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(4): 336-344.
[12] 郑雪, 梁琪, 宋雪梅, 等. 1株牦牛乳源产细菌素融合魏斯氏菌ZW21全基因组测序及序列分析[J]. 食品科学, 2023, 44(20): 119-126.ZHENG X, LIANG Q, SONG X M, et al. Whole genome sequencing and sequence analysis of a bacteriocin-producing Weissella confusa strain ZW21 from yak milk [J]. Food Science, 2023, 44(20): 119-126.
[13] TANG J T, YI L H, ZENG K F. Isolation of antagonistic lactic acid bacteria from traditional fermented foods of China and biocontrol mode of Leuconostoc mesenteroides SNP037 against green pepper soft rot caused by Pectobacterium carotovorum[J]. Postharvest Biology and Technology, 2024, 212:112872.
[14] 张开屏, 赵艳红, 李权威, 等. 乳酸菌抗氧化特性及其katA基因分析[J]. 中国食品学报, 2021, 21(7):37-43.ZHANG K P, ZHAO Y H, LI Q W, et al. Antioxidant properties of Lactobacillus and its KatA gene analysis[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(7):37-43.
[15] MERAL-AKTA H. Bacteriocin characterization of Enterococcus faecium isolates and evaluation of their in situ anti-Listerial activity in Beyaz cheese[J]. Food Bioscience, 2024, 61:104741.
H. Bacteriocin characterization of Enterococcus faecium isolates and evaluation of their in situ anti-Listerial activity in Beyaz cheese[J]. Food Bioscience, 2024, 61:104741.
[16] SOLTANI S, ZIRAH S, REBUFFAT S, et al. Gastrointestinal stability and cytotoxicity of bacteriocins from gram-positive and gram-negative bacteria: A comparative in vitro study[J]. Frontiers in Microbiology, 2022, 12:780355.
[17] ROJAS E R, BILLINGS G, ODERMATT P D, et al. The outer membrane is an essential load-bearing element in Gram-negative bacteria[J]. Nature, 2018, 559(7715):617-621.
[18] WU S B, LIU J H, LIU C J, et al. Quorum sensing for population-level control of bacteria and potential therapeutic applications[J]. Cellular and Molecular Life Sciences, 2020, 77(7):1319-1343.
[19] KAREB O, AÏDER M. Quorum sensing circuits in the communicating mechanisms of bacteria and its implication in the biosynthesis of bacteriocins by lactic acid bacteria: A review[J]. Probiotics and Antimicrobial Proteins, 2020, 12(1):5-17.
[20] 刘国荣, 刘洋硕, 聂蓉. 微生物共培养促进植物乳杆菌RX-8高效合成细菌素的调控机制[J]. 中国食品学报, 2023, 23(9):32-43.LIU G R, LIU Y S, NIE R. Mechanism of microbial co-culture promoting efficient bacteriocin production by Lactobacillus plantarum RX-8 [J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(9): 32-43.
[21] XU Y L, YANG L L, LI P, et al. Heterologous expression of class IIb bacteriocin plantaricin JK in Lactococcus lactis[J]. Protein Expression and Purification, 2019, 159:10-16.
[22] 杨慧, 步雨珊, 刘奥, 等. 产细菌素植物乳杆菌Q7对酸奶后酸化及品质的影响[J]. 食品与发酵工业, 2020, 46(3):30-35.YANG H, BU Y S, LIU A, et al. The effect of bacteriocin-producing Lactobacillus plantarum Q7 on post-acidification and quality of yogurt[J]. Food and Fermentation Industries, 2020, 46(3):30-35.
[23] YI L H, LI X, LUO L L, et al. A novel bacteriocin BMP11 and its antibacterial mechanism on cell envelope of Listeria monocytogenes and Cronobacter sakazakii[J]. Food Control, 2018, 91:160-169.
[24] 高娟娟, 贾丽艳, 畅盼盼, 等. 枯草芽孢杆菌细菌素A32的抑菌机理研究[J]. 中国食品学报, 2021, 21(10):56-64.GAO J J, JIA L Y, CHANG P P, et al. Studies on the inhibition mechanism of bacteriocin A32 producing by Bacillus subtilis[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(10):56-64.
[25] CAO S, DU R P, ZHAO F K, et al. The mode of action of bacteriocin CHQS, a high antibacterial activity bacteriocin produced by Enterococcus faecalis TG2[J]. Food Control, 2019, 96:470-478.
[26] 王嘉悦, 潘果, 钟忻桐, 等. 肠膜明串珠菌细菌素抗金黄色葡萄球菌的生物学特性分析[J]. 微生物学通报, 2024, 51(9):3562-3571.WANG J Y, PAN G, ZHONG X T, et al. Biological characterization of a bacteriocin produced by Leuconostoc mesenteroides inhibiting Staphylococcus aureus[J]. Microbiology China, 2024, 51(9):3562-3571.
[27] AYYASH M, ABUSHELAIBI A, AL-MAHADIN S, et al. In-vitro investigation into probiotic characterisation of Streptococcus and Enterococcus isolated from camel milk[J]. Lwt, 2018, 87:478-487.
[28] KRISHNAMOORTHI R, SRINIVASH M, MAHALINGAM P U, et al. Antimicrobial, anti-biofilm, antioxidant and cytotoxic effects of bacteriocin by Lactococcus lactis strain CH3 isolated from fermented dairy products-An in vitro and in silico approach[J]. International Journal of Biological Macromolecules, 2022, 220:291-306.
Screening and identification of bacteriocin-producing strains from traditional yak fermented milk and characterization of bacteriocins
LIU Fengming1,2, TAO Shengjian3, LIANG Qi1,2*, FAN Ping3, CHEN Xuhui1,2, ZHAO Baotang1,2
1(College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)2(Functional Dairy Product Engineering Laboratory of Gansu, Lanzhou 730070, China)3(Lanzhou Zhuangyuan Dairy Co.Ltd., Lanzhou 730020, China)
ABSTRACT To screen for strains with broad-spectrum bacteriocin synthesis capabilities, Escherichia coli and Staphylococcus aureus were used as indicator bacteria.A bacteriocin-producing strain, Lactiplantibacillus plantarum EL2, was isolated from traditional yak fermented milk in Gannan, Gansu, using the agar well diffusion method.The qPCR analysis revealed that EL2 harbors multiple bacteriocin synthesis genes.The crude extract of the bacteriocin synthesized by this strain not only exhibited the inhibitory activity against Gram-positive bacteria, which was common for bacteriocins, but also could inhibit Gram-negative bacteria and some fungi.Measurements of intracellular material leakage in E.coli and scanning electron microscopy observations indicated that the bacteriocin disrupts cell membrane integrity, leading to bacterial death.The inhibition efficiency was concentration-dependent.The bacteriocin showed good tolerance to temperature and pH variations, suggesting stable activity and broad application potential.It was sensitive to digestive proteases, lacked hemolytic activity, and exhibited no significant cytotoxicity to Caco-2 cells at low to medium concentrations, indicating good biosafety.The discovery of EL2 and its bacteriocin provides new resources and a theoretical basis for developing natural preservatives, highlighting its potential for further research and application.
Key words bacteriocin; broad-spectrum antimicrobial activity; isolation and screening; Lactiplantibacillus plantarum; gene identification; antimicrobial mechanism; safety evaluation




 H. Bacteriocin characterization of
H. Bacteriocin characterization of