LIU Junjie,CHEN Ningning,XU Yujuan, et al.Effects of different storage temperatures on stability of freeze-dried powder of Bacillus coagulans BC30[J].Food and Fermentation Industries,2025,51(14):131-138.
益生菌源自希腊语“forlife”,即“益生菌”、“益生素”或“微生态调节剂”,是能够改善宿主肠道微生态平衡和健康状况的微生物[1]。已有研究表明,益生菌具有增强免疫力、降低血清胆固醇和提高营养物质利用率等功能特性[2]。最近,由于消费者对食品健康的关注度日益增加,开始选择添加有益生菌的食品。但大多数商业益生菌对热敏感,有人提出可以通过使用产孢子的益生菌来克服这一问题。凝结芽孢杆菌(Bacillus coagulans)作为一种产芽孢的益生菌[3],最早从腐败牛奶中分离出来,其最适的生长温度和pH分别为35~50 ℃和5.5~6.5[4]。与其他益生菌相比,凝结芽孢杆菌因其孢子具有高抗逆性,能够耐受高温、高酸和胆汁盐,能在较差的环境中生长繁殖,具有明显的优势。据报道,凝结芽孢杆菌已用于食品、药品、饲料等方面。
在食品方面,凝结芽孢杆菌作为一种益生食品补充剂,已经用于多种食品中,如发酵饮料、酸奶、冰淇淋和即食谷物等[3]。儿童定期食用含有凝结芽孢杆菌的益生菌制剂可预防腹泻等胃肠道疾病,也可用于治疗与肠易激综合征相关的症状[5]。除了作为食品补充剂,不同种类的凝结芽孢杆菌还可以生产各种食品级的淀粉酶、蛋白酶、果胶酶和纤维素酶[6]。在药品方面,凝结芽孢杆菌因其代谢产物对人体具有调节作用,能够增强免疫力、平衡肠道菌群,所以已有改善人体肠道环境的益生菌片。在饲料方面,凝结芽孢杆菌作为饲料添加剂使用时,能降低畜禽感染大肠杆菌和葡萄球菌的几率,并通过提高畜禽的消化率以改善动物的生长[7]。一般来说,市面上的益生菌产品主要以液态或固态形式存在,但益生菌对环境条件极为敏感,为了提高它们在胃肠道中的存活率,食品工业通常采用冷冻干燥或喷雾干燥的技术来制备益生菌。这些方法有助于保持益生菌的活性,从而确保它们能够充分发挥预期的健康功效。然而,益生菌粉在贮藏过程中易出现活力大幅下降的现象,这严重影响益生菌粉的货架期和最终产品的功效。目前,有许多研究致力于探讨益生菌粉在贮存期间的稳定性,水分活度、含水量、贮存温度以及玻璃化转变温度(glass transition temperature,Tg)是决定益生菌粉贮存稳定性的关键因素,其中贮存温度对益生菌粉活性的影响尤为显著。ADRIANA等[8]评估了魏斯氏菌冻干粉分别在5、15、25 ℃条件下的贮藏稳定性,结果发现只有在5 ℃贮藏时菌粉能够保持较高存活率。此外,有研究表明贮藏过程中益生菌粉存活率的下降是因为贮藏温度接近于其Tg,细胞无法维持稳定的玻璃化基质,导致细胞膜出现损伤,菌株活力下降[9]。
目前,针对凝结芽孢杆菌BC30的研究主要集中于其益生活性,而对其冻干菌粉贮藏稳定性的研究甚少,阻碍凝结芽孢杆菌BC30的广泛应用。因此,本研究将从BC30活菌数、存活率、生长活力、酶活性、外观品质这5个方面揭示贮藏温度对凝结芽孢杆菌BC30冻干菌粉稳定性的作用机制,为凝结芽孢杆菌BC30冻干菌粉货架期的延长提供依据。
凝结芽孢杆菌BC30由广东省农业科学院蚕业与农产品加工所实验室保藏并提供;安家新西兰脱脂乳粉,恒天然商贸(上海)有限公司;低聚果糖、谷氨酸钠,上海源叶生物科技有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒、Na+-K+-ATP酶试剂盒、β-半乳糖苷酶(β-galactosidase,β-GAL)试剂盒,苏州格锐思生物科技有限公司;氯化钠,福晨(天津)化学试剂有限公司。
LB培养基(g/L):蛋白胨10,酵母粉5,葡萄糖20,NaCl 10,pH至6.5,若制作固体培养基,在此基础上加入20 g/L琼脂粉即可。
凝结芽孢杆菌生长培养基(g/L):葡萄糖20,蛋白胨20,磷酸氢二钾3,pH 7.0。
ZQZY-88BV恒温培养振荡培养箱,上海知楚仪器有限公司;D3024R台式高速冷冻离心机,美国赛洛捷克SCILOGEX公司;SW-CJ-2FD洁净工作台,苏净集团·苏州安泰空气技术有限公司;PB-10 pH计,德国Sartorius公司;MJX-250Z生化培养箱,海博讯事业有限公司医疗设备厂;YXQ-LS-50SⅡ立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;ME20万分之一电子分析天平,梅特勒-托利多仪器上海有限公司;DRC-1100冷冻干燥机,南京恒惠科技有限公司;XM-650T超声破碎仪,小美超声仪器(昆山)有限公司;UV1800紫外分光光度计,日本岛津仪器有限公司。
1.3.1 菌种的活化
将保存在甘油管中的凝结芽孢杆菌解冻并恢复至室温,采用平板划线法分离单菌落,选择单菌落接种到凝结芽孢杆菌液体培养基中。在37 ℃和180 r/min的条件下培养20 h进行二次激活,获得种子液。
1.3.2 凝结芽孢杆菌培养
将活化到第二代的种子液以2%的接种量接种到发酵培养基中培养,于42 ℃、220 r/min的条件下培养20 h进行后续的冷冻干燥。
1.3.3 冻干菌粉的制备
本研究采用96 g/L脱脂乳粉、109 g/L低聚果糖、51 g/L谷氨酸钠复合保护剂溶于水中,其中脱脂乳粉在108 ℃下灭菌10 min,低聚果糖、谷氨酸钠均在115 ℃下灭菌15 min。
将培养了20 h的凝结芽孢杆菌BC30使用高速离心机于4 ℃下以8 000 r/min离心10 min后,收集处于稳定期的活性细胞,为去除培养基,用0.85%生理盐水洗涤细胞2次,然后再次离心收集5 g湿菌体,用10 mL生理盐水重悬,然后取1 mL的细菌悬浮液与等体积的冷冻保护剂充分混合,取其中2 mL分装在10 mL的西林瓶中,盖上无菌的二叉胶塞,放入-20 ℃冰箱预冻12 h,将预冻好的菌体放入冷冻干燥机中冷冻干燥36 h。
1.3.4 冻干菌粉凝结芽孢杆菌BC30存活率的测定
将10 g添加有最佳复合保护剂的冻干菌粉装入带有干燥剂的铝箔袋中,分别在-20、4、25 ℃下贮藏45 d。以分析不同贮藏温度下冻干菌粉中凝结芽孢杆菌BC30存活率的变化。分别于第4、8、12、16、36、45天准确称取各组菌粉0.1 g,加入1 mL 0.9%生理盐水中,然后采用平板菌落计数法测定凝结芽孢杆菌BC30活菌数。取1 mL稀释液加入到无菌培养皿中,然后倒入LB琼脂培养基20 mL,混合均匀,待培养基冷却凝固后置于37 ℃培养箱中培养24 h进行计数。不同贮藏阶段存活率的计算如公式(1)所示:
存活率![]()
(1)
式中:Na表示不同贮藏阶段的冻干菌粉中的活菌数,CFU/mL;Nb表示未经贮藏的冻干菌粉中的活菌数,CFU/mL。
1.3.5 Na+-K+-ATP酶活性的测定
分别取0.1 g第0、6、12、32、45天不同温度下贮藏的冻干菌粉用生理盐水复水至2 mL,取1 mL菌悬液12 000 r/min离心10 min收集菌泥,菌泥用0.85%生理盐水溶液清洗2次后,加入1 mL酶提取液(Na+-K+-ATP酶试剂盒、LDH试剂盒和β-GAL试剂盒的酶提取液分别为Tris-HCl缓冲液、PBS缓冲液和柠檬酸缓冲液);在超声细胞破碎仪中进行破碎(冰浴,每次超声3 s,间隔10 s,重复30次,功率200 W),最后于4 ℃、12 000 r/min离心10 min,取上清液置于冰上保存。
紫外分光光度计预热30 min以上,波长设定为700 nm,蒸馏水调零。所有试剂解冻至室温25 ℃,根据试剂盒的方法,在EP管中依次加入试剂,随后37 ℃孵育20 min,混匀。离心机转速12 000 r/min,4 ℃离心5 min。取上清液,与显色试剂混匀,室温静置3 min进行显色反应,700 nm下读取吸光值。重复3次,酶活性的单位用U/g干粉表示。
1.3.6 LDH酶活性的测定
无细胞提取液的制备方法同上。紫外分光光度计预热30 min以上,调整波长至450 nm,蒸馏水调零。所有试剂解冻至室温(25 ℃)。根据试剂盒的方法在1 mL玻璃比色皿中依次加入试剂,随后混匀,在室温(25 ℃)下,立即于450 nm处读取吸光值。重复3次,酶活性的单位用U/g干粉表示。
1.3.7 β-GAL活性的测定
无细胞提取液的制备中离心转速为15 000 r/min,其余方法同上。紫外分光光度计预热30 min以上,温度设定37 ℃,波长设定为405 nm,蒸馏水调零。根据试剂盒的方法在EP管中依次加入试剂,迅速混匀,37 ℃保温30 min。添加显色试剂,混匀,全部液体转移到1 mL玻璃比色皿中,405 nm处测定吸光值。重复3次,酶活性的单位用U/g干粉表示。
1.3.8 冻干菌粉外观的测定
分别将-20、4、25 ℃下贮藏45 d的冻干菌粉置于称量皿中,以未经贮藏的冻干菌粉作为对照,在小型LED摄影灯箱中进行拍照,观察不同温度下贮藏的冻干菌粉外观和颜色上的变化。
1.3.9 冻干菌粉生长能力的测定
冻干菌粉生长能力的测定参考李辉玉[10]的方法并稍加修改。将0.1 g凝结芽孢杆菌BC30粉末按照10 g/L的接种量接种到10 mL LB液体培养基中,然后在37 ℃的条件下培养6 h,取1 mL菌悬液进行梯度稀释检测培养基中凝结芽孢杆菌BC30活菌数,并检测培养基的pH值。
所有实验平行测定3次,数据结果以“平均值±标准差”表示;采用SPSS 19.0软件通过多极差检验分析不同数据组间的统计显著性,显著性阈值设定为0.05;绘图采用软件Origin 2021。
益生菌对温度较为敏感,在较低温度下,菌体处于休眠状态,较为稳定,高温则会导致菌体内蛋白等物质变性,功能丧失[11]。图1显示了3种不同贮藏温度对冻干菌粉凝结芽孢杆菌BC30存活率的影响,随着贮藏时间的延长,-20、4、25 ℃贮藏温度下冻干菌粉的凝结芽孢杆菌BC30存活率均呈现出下降的趋势。而贮藏于-20 ℃的冻干菌粉凝结芽孢杆菌BC30存活率高于其他2组。贮藏45 d后,-20 ℃贮藏的冻干菌粉中凝结芽孢杆菌BC30的活菌数达到11.09 lg CFU/mL,存活率为82.43%。而在4 ℃和25 ℃ 贮藏的冻干菌粉凝结芽孢杆菌BC30存活率分别为54.73%和33.11%,远低于-20 ℃贮藏组。以上结果表明凝结芽孢杆菌BC30冻干菌粉适宜于贮藏在较低的温度下。这可能是过高的贮藏温度会使凝结芽孢杆菌BC30的代谢处于较高水平,导致其活力快速下降。此外,过高的贮藏温度会加快氧化速率,使凝结芽孢杆菌BC30的磷脂与贮藏环境中的氧气发生氧化反应,造成凝结芽孢杆菌BC30的死亡。还有研究称,贮藏温度越接近Tg,益生菌的稳定性越差。当冻干菌粉处于玻璃化基质贮藏时,由于基质的高黏度,可以通过延缓分子流动性和减慢反应速率来提高益生菌的贮藏稳定性,这也解释了为什么-20 ℃贮藏温度菌粉的存活率最高。FRITZEN-FREIRE等[12]在双歧杆菌菌粉贮藏稳定性的研究中也发现了相同的结果,-18 ℃贮存条件下双歧杆菌菌粉的活菌数显著高于4 ℃度贮藏时。
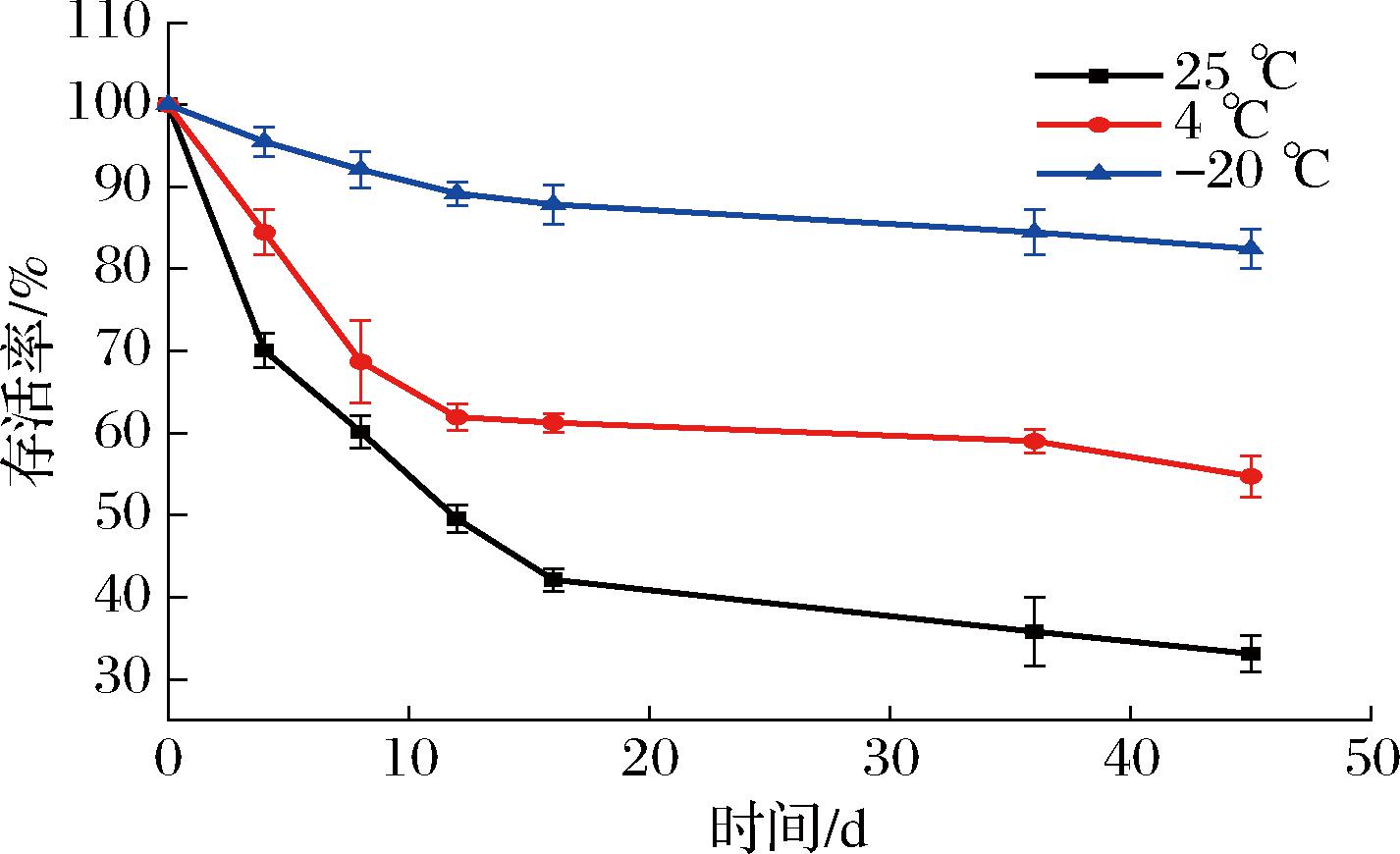
图1 凝结芽孢杆菌BC30冻干菌粉贮藏期间的存活率
Fig.1 Changes in survival rate of freeze-dried B.coagulans BC30 during storage
2.2.1 Na+-K+-ATP酶活性的变化
为了解析贮藏温度影响冻干菌粉凝结芽孢杆菌BC30存活率的原因,分析了贮藏过程中凝结芽孢杆菌BC30关键酶活性的变化。Na+-K+-ATP酶是细胞膜上的一种重要蛋白,它通过消耗ATP来维持细胞内外的离子浓度差,对细胞膜电位和离子运输等基本功能起到关键作用[13]。同时,ATP酶的活性下降可以间接反映微生物细胞膜的破裂。因此,首先分析了在不同贮藏温度下凝结芽孢杆菌BC30的Na+-K+-ATP酶活性的变化。从图2中可知,随着贮藏时间的延长,凝结芽孢杆菌BC30的Na+-K+-ATP的活性不同贮藏温度下均呈下降趋势。有研究表明,Na+-K+-ATP酶活性的下降会影响细胞正常的生理代谢功能,导致细胞活力下降或者丢失,这也解释了不同贮藏温度下冻干菌粉凝结芽孢杆菌BC30存活率下降的现象[14]。经过6 d的贮藏,-20和4 ℃下贮藏的冻干菌粉Na+-K+-ATP酶活性下降幅度接近,而25 ℃贮藏下的冻干菌粉Na+-K+-ATP酶活性从19.02 U/g干粉显著下降至13.91 U/g干粉。这说明25 ℃不适合凝结芽孢杆菌BC30冻干菌粉的贮藏。在经过45 d的贮藏后,-20、4、25 ℃处理组的菌株Na+-K+-ATP酶活性分别从19.02 U/g干粉下降至11.48、9.27、8.12 U/g干粉。可见,置于-20 ℃贮藏的菌粉凝结芽孢杆菌BC30的Na+-K+-ATP酶活性保持的最好,保留率为60.36%。而置于25 ℃贮藏的菌粉凝结芽孢杆菌BC30的Na+-K+-ATP酶活性保持的最差,仅为初始的42.69%。马雁等[15]在研究不同贮藏温度对发酵乳杆菌grx07冻干菌粉稳定性影响的过程中也发现了相同的现象,-20 ℃的贮藏温度能够使菌粉中的发酵乳杆菌grx07 Na+-K+-ATP酶的活性保持在50%以上。
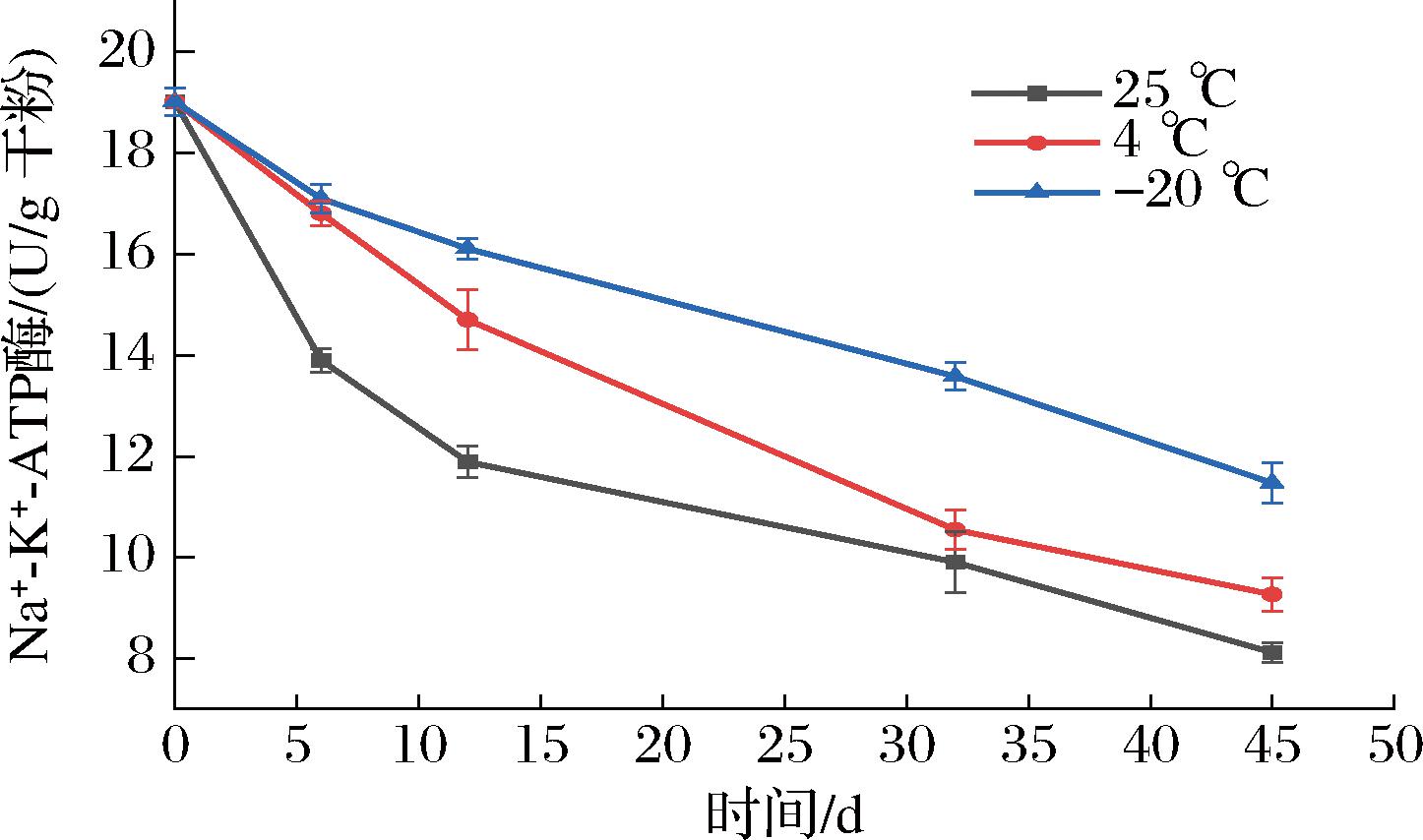
图2 不同贮藏温度对凝结芽孢杆菌BC30 Na+-K+-ATP酶活性的影响
Fig.2 Effects of different storage temperatures on the Na+-K+-ATPase activity of B.coagulans BC30
2.2.2 LDH活性的变化
LDH是糖酵解途径的关键酶,能够将丙酮酸还原为乳酸,其可直接影响菌株的代谢能力,从而影响菌株的存活,并且能间接反映细胞膜通透性的变化。已有研究表明,该酶的失活是冻干菌粉存活率降低的主要原因[16-17]。图3显示了不同贮藏温度对凝结芽孢杆菌BC30 LDH活性的影响。相较于-20 ℃和4 ℃ 贮藏的菌粉,贮藏于25 ℃菌粉的LDH活性下降幅度较大,其LDH活性从初始的9.52 U/g干粉下降到1.56 U/g干粉。而贮藏于-20 ℃和4 ℃菌粉的LDH活性分别下降至6.06、4.83 U/g干粉。贮藏45 d后,仅有-20 ℃贮藏的菌粉LDH活性保留率在60%以上,表明较低的贮藏温度才能使菌粉凝结芽孢杆菌BC30的LDH活性维持在较高水平。此外,有研究称LDH通过将NADH还原成NAD+,保持了细胞内氧化还原状态的平衡,LDH活性的保持有利于维持细胞代谢途径的其他反应。这也进一步证实LDH活性的下降是冻干菌粉中凝结芽孢杆菌BC30存活率下降的原因之一。
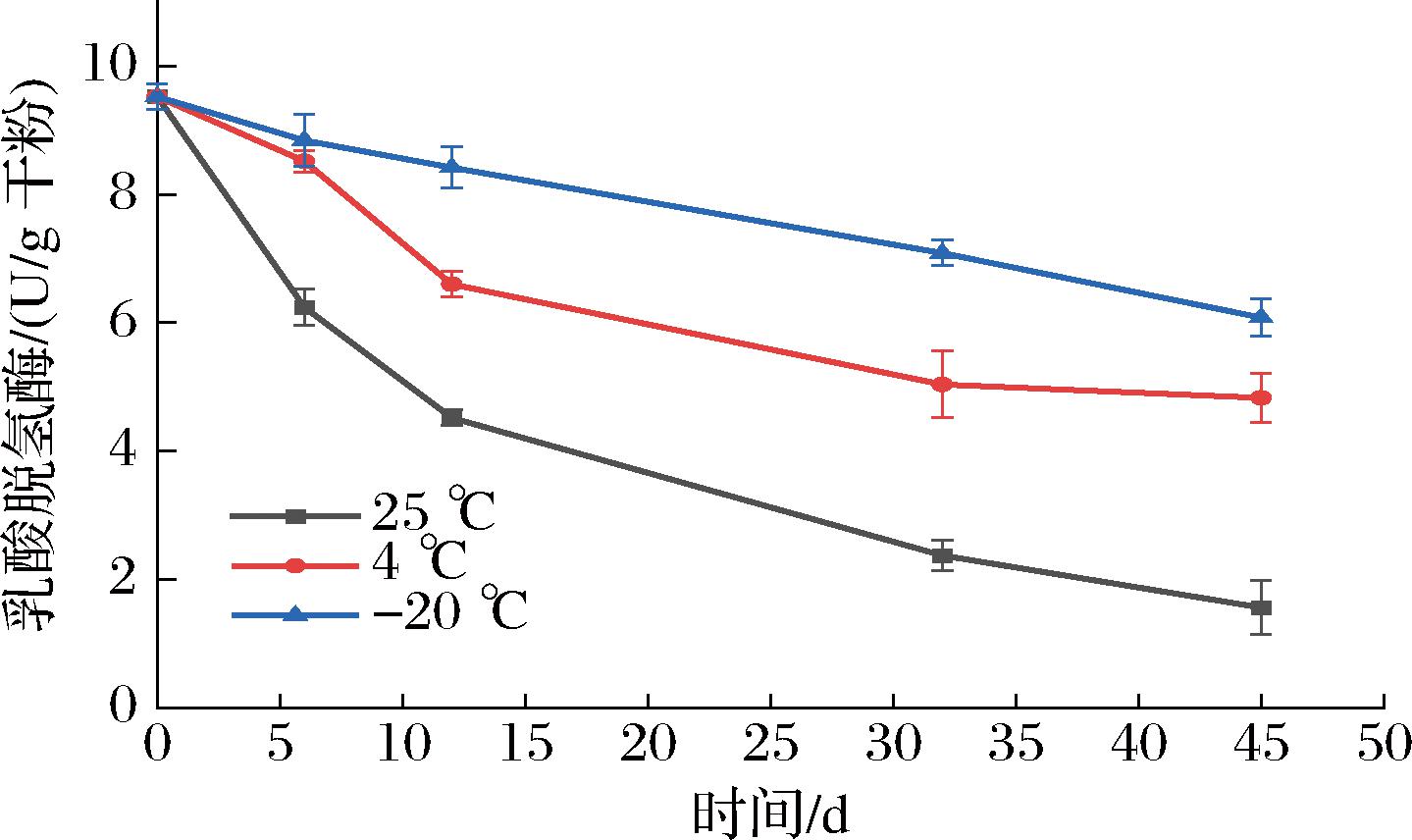
图3 不同贮藏温度对凝结芽孢杆菌BC30的LDH活性的影响
Fig.3 Effect of different storage temperatures on LDH activity of B.coagulans BC30
2.2.3 β-GAL活性的变化
β-GAL又称乳糖酶,广泛存在于各种动物、植物和微生物中,它是降解乳糖所必须的酶。它的活力不仅可反映菌株的发酵性能,而且可表征菌株细胞膜通透性的变化[18]。JOFRÉ等[19]提出β-GAL作为一种胞内大分子内源性酶,可以通过测定细胞外β-GAL的活性来判断微生物细胞膜的损伤程度。由图4可知,菌粉在贮藏过程中,其凝结芽孢杆菌BC30的胞外β-GAL活性呈上升趋势,并且随着贮存温度的升高其上升趋势越显著(P<0.05),这表明菌粉贮藏过程中凝结芽孢杆菌BC30细胞膜的通透性发生了改变。贮藏45 d后,贮藏于-20、4、25 ℃的菌粉凝结芽孢杆菌BC30的胞外β-GAL活性分别从0.20 U/g干粉增加至1.38、2.00、2.44 U/g干粉。贮藏于25 ℃的菌粉凝结芽孢杆菌BC30的胞外β-GAL活性显著高于其他2组,表明随着贮藏时间的延长,贮藏于25 ℃的菌粉凝结芽孢杆菌BC30的细胞膜损伤最严重,而-20 ℃的贮藏温度能够较好的保护菌粉凝结芽孢杆菌BC30细胞膜的完整性,防止β-GAL的外泄。
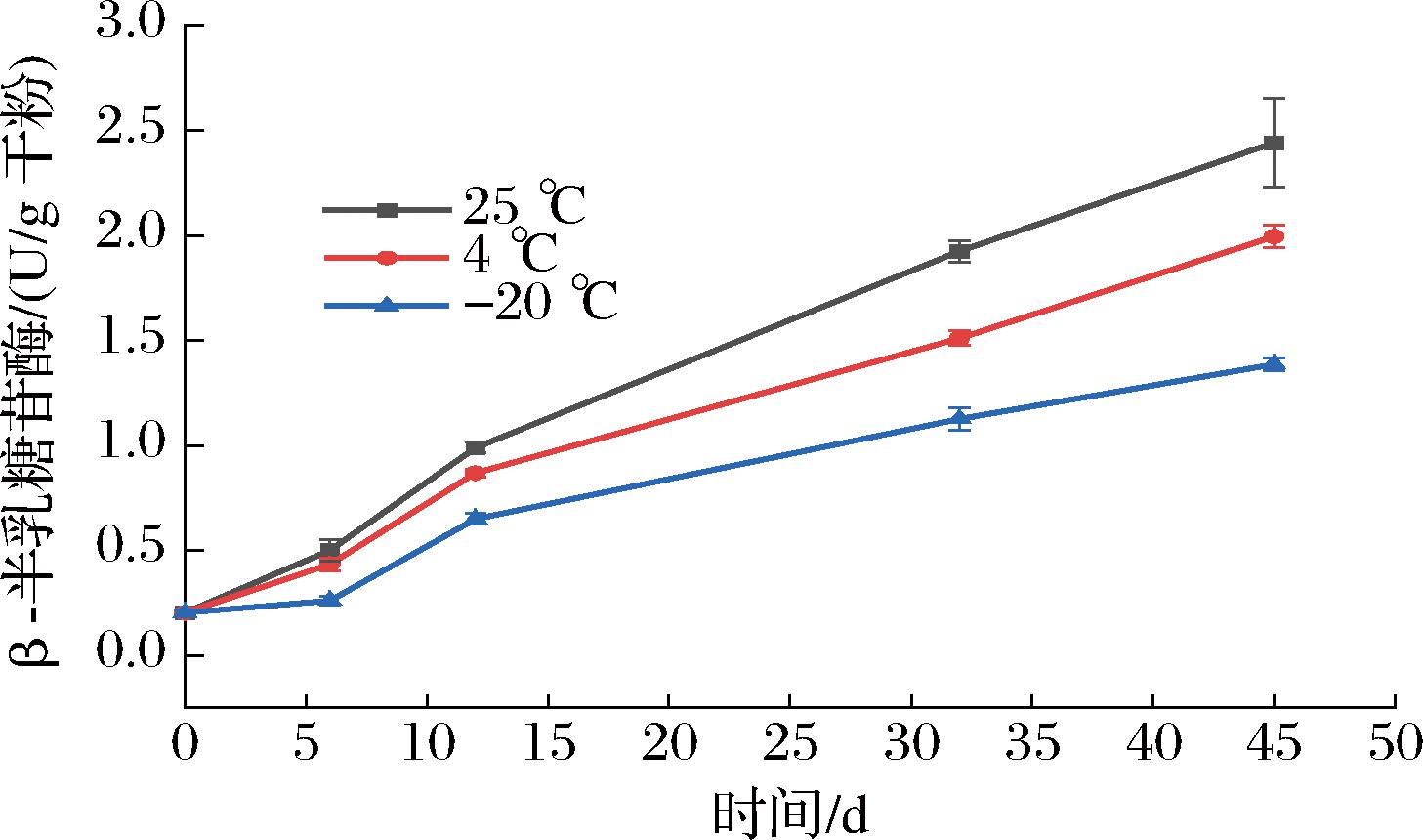
图4 不同贮藏温度对凝结芽孢杆菌BC30的β-GAL活性的影响
Fig.4 Effect of different storage temperatures on β-GAL activity of B.coagulans BC30
为了进一步分析贮藏温度对冻干菌粉稳定性的影响,还评价了不同贮藏温度下冻干菌粉的外观品质。从图5可以看出,不同温度下贮藏45 d的菌粉外观具有一定的差异性。未经贮藏的凝结芽孢杆菌BC30冻干菌粉颜色呈乳白色,并且无明显的结块现象。相比于未经贮藏的冻干菌粉,贮藏于-20 ℃冻干菌粉的颜色与其最为接近。此外,贮藏于-20 ℃的冻干菌粉粉体细腻且无明显的结块现象,而贮藏于4 ℃的冻干菌粉颜色发黄,并出现结块现象。HOLKEM等[20]在双歧杆菌冻干菌粉的贮藏稳定性研究中也观察到类似的现象,双歧杆菌菌粉在-18 ℃贮藏120 d后其外观没有明显变化,而4 ℃贮藏的双歧杆菌菌粉却会发黄。贮藏于25 ℃的凝结芽孢杆菌BC30冻干菌粉的外观变化最大,菌粉呈土黄色,有明显的结块现象。出现这一现象的原因可能是因为菌粉中的糖与蛋白质在氧气和温度较高的条件下发生美拉德反应,产生褐变,进而改变菌粉的外观品质;另一方面可能是因为菌粉贮藏在25 ℃的环境中,由于贮藏温度接近于菌株玻璃化转变温度的起始温度,从而引发了其从玻璃态向橡胶态的转变[21]。通过此实验可以得出,低温有利于保持菌粉的外观品质,同时还可以考虑对菌粉进行无氧贮藏,防止高温加速氧化反应速率,引起菌体死亡。
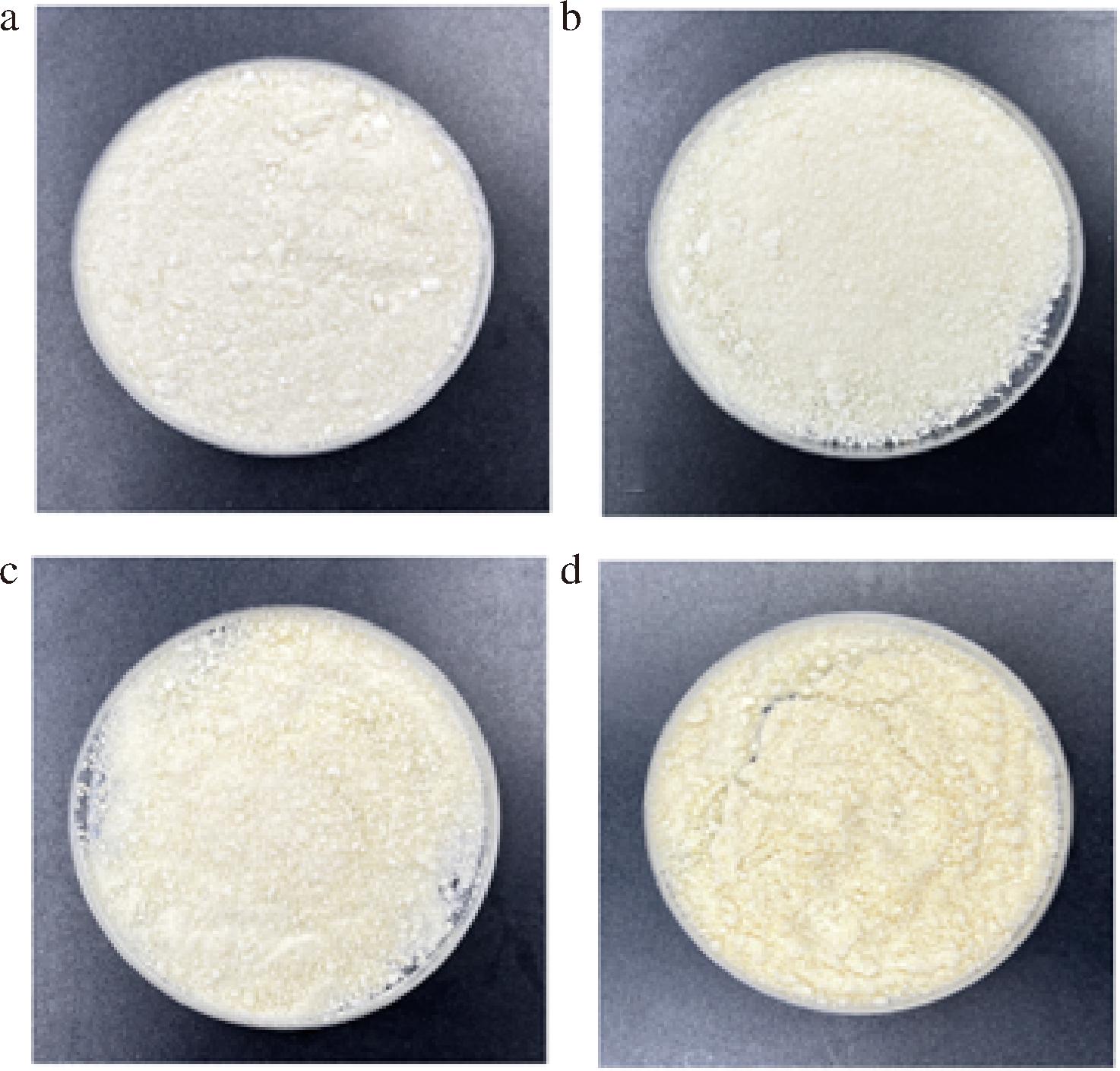
a-未经贮藏的凝结芽孢杆菌BC30冻干粉;b-贮藏于-20 ℃环境中贮藏45 d的凝结芽孢杆菌BC30冻干粉;c-贮藏于4 ℃环境中贮藏45 d的凝结芽孢杆菌BC30冻干粉;d-贮藏于25 ℃环境中贮藏45 d的凝结芽孢杆菌BC30冻干粉
图5 不同贮藏温度下贮藏45 d后对凝结芽孢杆菌BC30菌粉外观品质的影响
Fig.5 Effect on the appearance quality of B.coagulans BC30 powder after 45 d of storage at different storage temperatures
为了评价贮藏温度对冻干菌粉生长能力的影响,将-20、4、25 ℃条件下贮藏45 d的冻干菌粉分别接种于LB培养基中,培养6 h后,接种-20、4、25 ℃贮藏的冻干菌粉培养基中的凝结芽孢杆菌BC30活菌数分别为5.54×109、5.15×109、4.33×109 CFU/mL,与之对应的培养基pH值分别为5.25、5.86和6.19。这是因为凝结芽孢杆菌BC30消耗发酵培养基中的碳源产生了酸,从而使发酵培养基的pH下降。由图6可知,-20 ℃贮藏的菌粉生长能力最强,与4、25 ℃分别相差7.57%、27.66%,说明贮藏温度对冻干菌粉的生长能力有显著影响(P<0.05),这也跟其菌粉凝结芽孢杆菌BC30存活率最高有关。MIAO等[22]研究表明菌粉在低温下贮藏才能有效保持其活力,从而提高产品的货架期。此外,-20 ℃贮藏的菌粉中凝结芽孢杆菌BC30的LDH活性也较高,LDH是乳酸合成的关键酶,其活力是影响菌株产酸能力的关键因素之一[15]。这也是接种-20 ℃贮藏冻干菌粉的培养基pH低于其他2组的关键原因之一。
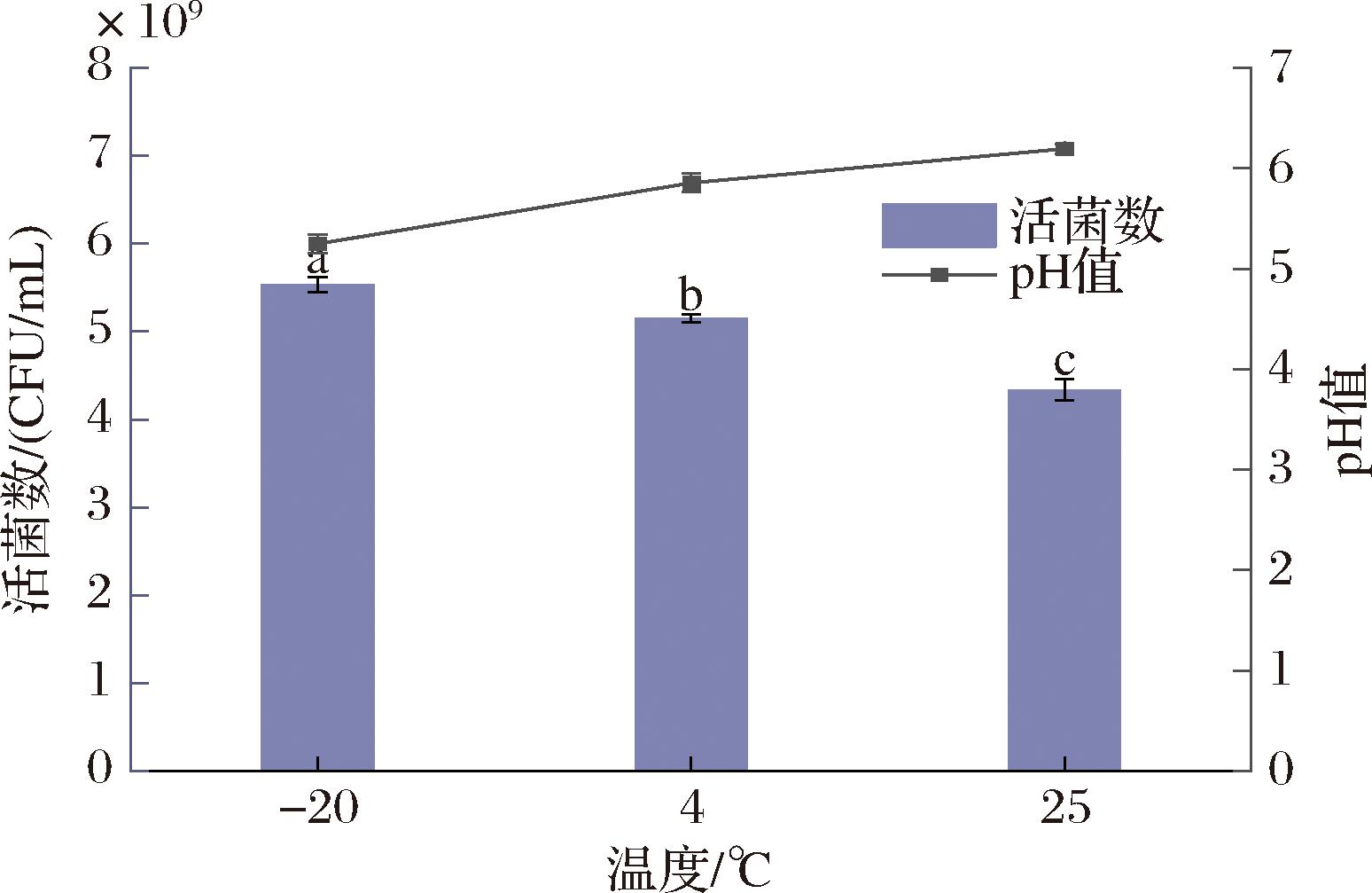
图6 不同贮藏温度对冻干凝结芽孢杆菌BC30生长活力的影响
Fig.6 Effect of different storage temperatures on the growth viability of freeze-dried B.coagulans BC30
注:图中不同小写字母代表差异显著(P<0.05)。
为了更好地揭示贮藏温度与凝结芽孢杆菌BC30冻干菌粉存活率、酶活性、pH和生长能力的相关性,对各处理的存活率、酶活性、pH和生长能力进行了主成分分析(图7-a)与聚类分析(图7-b)。由图7-a可知,PC1和PC2的累积贡献率高达98.2%,大于可信值60%,因此可以反映出不同处理组之间的差异。主成分分析得分图中,贮藏温度25 ℃组和贮藏温度-20 ℃组距离较远,因此两组的差异性较大。25 ℃处理组与PC1呈负相关,而-20 ℃处理组与PC1呈正相关。随后,通过聚类分析进一步解析不同处理组与存活率、酶活性、pH和生长能力的相关性,-20和25 ℃贮藏的菌粉与其存活率、酶活性、pH和生长能力呈现显著的相关性(图7-b)。-20 ℃处理组与胞外β-GAL活性和pH呈负相关,而与其他4个指标呈正相关。25 ℃处理与存活率、酶活性、pH和生长能力的相关性则与-20 ℃处理组完全相反。这与前面的研究结果一致,贮藏温度越低,菌粉中凝结芽孢杆菌BC30的LDH和Na+-K+-ATP酶活性就越大,冻干粉菌株的存活率和生长活力也就越强。
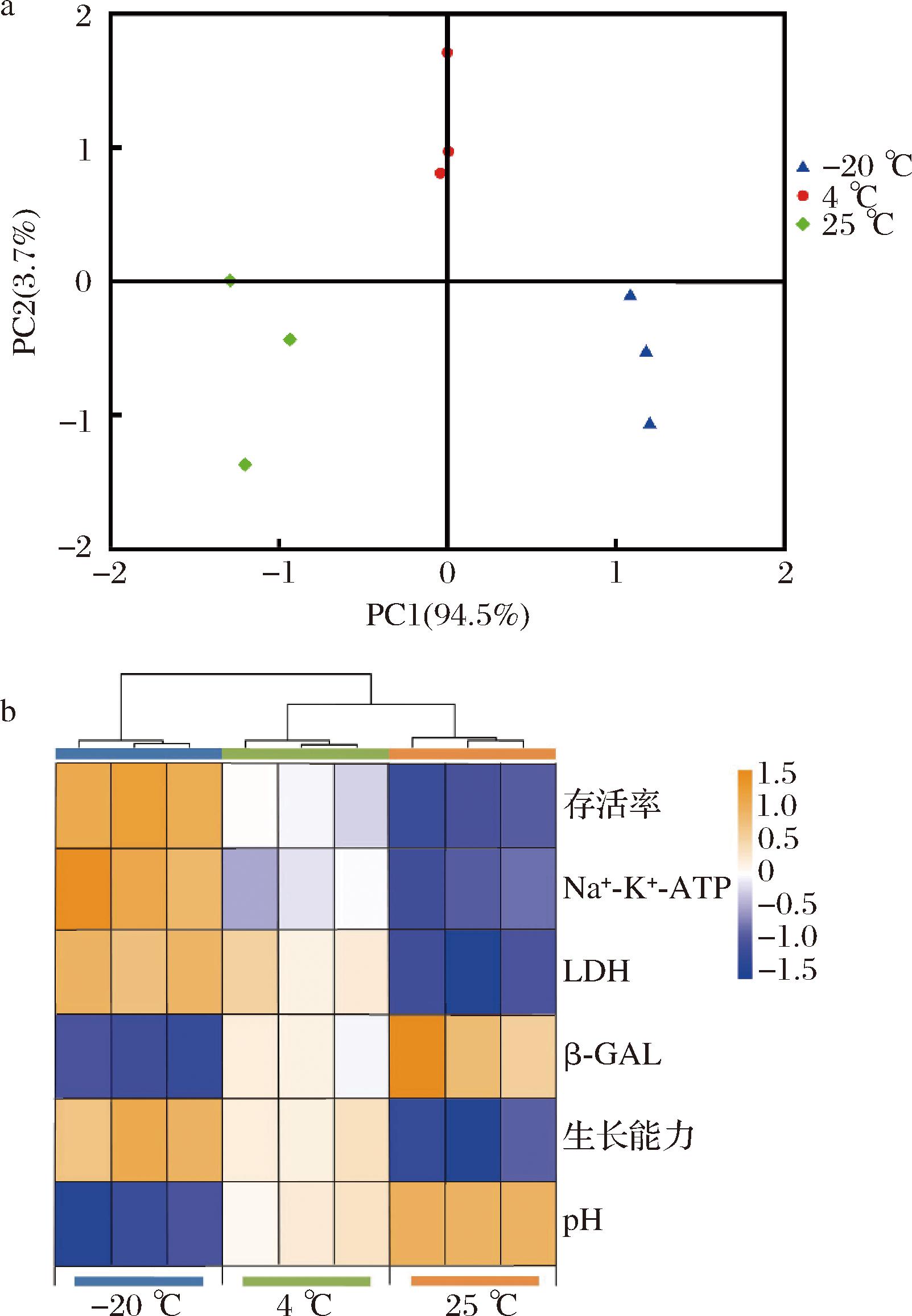
a-主要成分分析;b-聚类热图
图7 不同贮藏温度下贮藏45 d后冻干菌粉的酶活及菌株活性指标的聚类热图和主要成分分析
Fig.7 Cluster heat map and principal component analysis of enzyme activity and strain activity indices of freeze-dried powder after storage at different storage temperatures for 45 days
注:不同贮藏温度与凝结芽孢杆菌BC30冻干粉各指标之间的正负性分别用橙色和蓝色表示。
本文研究了不同贮藏温度对凝结芽孢杆菌BC30冻干菌粉稳定性的影响。当贮藏温度为-20 ℃时,冻干菌粉中凝结芽孢杆菌BC30的存活率最高(82.43%),而随着贮藏温度的升高其存活率呈下降趋势,25 ℃贮藏冻干菌粉中凝结芽孢杆菌BC30存活率仅为33.11%。此外,为了解析冻干菌粉中凝结芽孢杆菌BC30存活率下降的原因,还对贮藏过程中冻干菌粉中凝结芽孢杆菌BC30的Na+-K+-ATP、LDH和胞外β-GAL活性的变化规律进行了分析,冻干菌粉中凝结芽孢杆菌BC30的Na+-K+-ATP和LDH活性随着贮藏温度的升高而降低,而其胞外β-GAL活性随着贮藏温度的升高而升高,表明低温贮藏能够较好的保护冻干菌粉中凝结芽孢杆菌的细胞膜和活性,初步揭示了低温贮藏对冻干菌粉中凝结芽孢杆菌的保护机制。贮藏45 d后,贮藏于25 ℃的冻干菌粉出现明显的结块现象,而贮藏于-20 ℃的冻干菌粉粉体细腻且无明显的结块现象,这可能是由于菌粉中的糖与空气中的氧气在温度较高的情况发生了美拉德反应,证实了贮藏温度过高会影响冻干菌粉的外观质地,后续还可以考虑对冻干菌粉进行隔氧贮藏的相关研究。通过对45 d的菌粉进行生长能力的测定,25 ℃的生长能力最低,这与贮藏于-20 ℃的冻干菌粉完全相反,且pH与生长能力呈负相关性,说明凝结芽孢杆菌BC30适合在酸性条件下生长,维持产酸酶的活性是保持菌体稳定性的关键。相关性分析进一步证实贮藏温度对凝结芽孢杆菌BC30冻干菌粉的稳定性有重要影响,表明凝结芽孢杆菌BC30冻干菌粉适合低温贮藏。然而,由于温度越低,贮藏成本越高的原因,后续的研究还需要进一步对贮藏温度进行单因素和响应面优化,使冻干菌粉的贮藏成本和存活率达到一个平衡点。
此外,已有研究表明使用一些包装材料和包装技术可提高冻干菌粉的贮藏温度,从而降低冻干菌粉的贮藏成本。例如桑跃等[23]通过利用充氮包装降低高温对益生菌粉稳定性的影响,提高了益生菌粉的4 ℃下的贮藏稳定性,有效地降低了菌粉贮藏的成本。CAMELO-SILVA等[24]也提到,采用乳化法结合冷冻干燥技术制备益生菌微胶囊,是一种提高益生菌在加工和贮存过程中抵抗不良环境挑战的有效方法,益生菌粉可以在4 ℃的贮藏温度下表现出良好的贮藏稳定性,满足贮藏需求,可有效节省贮藏成本,同时保持菌粉的活性。因此,后续会进行低温贮藏结合其他方法来优化冻干菌粉的贮藏温度,以此降低冻干菌粉的贮藏成本。
[1] SALMINEN S, COLLADO M C, ENDO A, et al.The International Scientific Association of Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of postbiotics[J].Nature Reviews.Gastroenterology &Hepatology, 2021, 18(9):649-667.
[2] YAN F, POLK D B.Probiotics and probiotic-derived functional factors-mechanistic insights into applications for intestinal homeostasis[J].Frontiers in Immunology, 2020, 11:1428.
[3] CUTTING S M.Bacillus probiotics[J].Food Microbiology, 2011, 28(2):214-220.
[4] KONURAY G, ERGINKAYA Z.Potential use of Bacillus coagulans in the food industry[J].Foods, 2018, 7(6):92.
[5] FIJAN S.Microorganisms with claimed probiotic properties:An overview of recent literature[J].International Journal of Environmental Research and Public Health, 2014, 11(5):4 745-4 767.
[6] GHANI M, ANSARI A, AMAN A, et al.Isolation and characterization of different strains of Bacillus licheniformis for the production of commercially significant enzymes[J].Pakistan Journal of Pharmaceutical Sciences, 2013, 26(4):691-697.
[7] LIANG J, LI C H, CHEN Z Q, et al.Progress of research and application of Heyndrickxia coagulans (Bacillus coagulans) as probiotic bacteria[J].Frontiers in Cellular and Infection Microbiology, 2024, 14:1415790.
[8] ADRIANA M C, MISAEL C R, LILIANA S C.Evaluation of viability, physicochemical properties, and digestibility of freeze-dried Weissella cibaria microcapsules during storage[J].Food Packaging and Shelf Life, 2023, 40:101164.
[9] SAVEDBOWORN W, TEAWSOMBOONKIT K, SURICHAY S, et al.Impact of protectants on the storage stability of freeze-dried probiotic Lactobacillus plantarum[J].Food Science and Biotechnology, 2018, 28(3):795-805.
[10] 李辉玉. 明胶-低聚木糖美拉德反应产物的制备及其微囊化益生菌的研究[D].南昌:南昌大学, 2023.LI H Y.Preparation of gelatin-xylooligosaccharides Maillard reactionproducts and study on microencapsulated probiotics[D].Nanchang:Nanchang University, 2023.
[11] CORCORAN B M, ROSS R P, FITZGERALD G F, et al.Comparative survival of probiotic lactobacilli spray-dried in the presence of prebiotic substances[J].Journal of Applied Microbiology, 2004, 96(5):1024-1039.
[12] FRITZEN-FREIRE C B, PRUD NCIO E S, AMBONI R D M C, et al.Microencapsulation of bifidobacteria by spray drying in the presence of prebiotics[J].Food Research International, 2012, 45(1):306-312.
NCIO E S, AMBONI R D M C, et al.Microencapsulation of bifidobacteria by spray drying in the presence of prebiotics[J].Food Research International, 2012, 45(1):306-312.
[13] NORDAHL L, WENNMALM S, JÖNSSON J, et al.Direct observation of Na, K-ATPase oligomers in the plasma membrane of living cells by FRET-FCS[J].The FASEB Journal, 2022, 36(S1):4657.
[14] 王琳. 干酪乳杆菌冷冻干燥保护剂筛选及作用机理研究[D].天津:天津科技大学, 2012.WANG L.Research on cryoprotectant selection and protective mechanism for Lactobacillus casei [D].Tianjin:Tianjin University of Science &Technology, 2012.
[15] 马雁, 沈桂奇, 陶志强, 等.贮藏温度对真空冻干发酵剂发酵乳杆菌grx07活性的影响[J].食品工业科技, 2020, 41(2):84-88;94.MA Y, SHEN G Q, TAO Z Q, et al.Effects of storage temperature on the viability of Lactobacillus fermentum grx07 under vacuum freeze-dried start[J].Science and Technology of Food Industry, 2020, 41(2):84-88;94.
[16] IZUTSU K I, YOSHIOKA S, TERAO T.Stabilizing effect of amphiphilic excipients on the freeze-thawing and freeze-drying of lactate dehydrogenase[J].Biotechnology and Bioengineering, 1994, 43(11):1102-1107.
[17] TAMIYA T, OKAHASHI N, SAKUMA R, et al.Freeze denaturation of enzymes and its prevention with additives[J].Cryobiology, 1985, 22(5):446-456.
[18] 张英华, 霍贵成, 郭鸰.冷冻干燥造成乳酸菌损伤的研究[J].食品与发酵工业, 2007, 33(1):142-146.ZHANG Y H, HUO G C, GUO L.Study on the damage of lactic acid bacteria following freeze drying[J].Food and Fermentation Industries, 2007, 33(1):142-146.
[19] JOFRÉ A, AYMERICH T, GARRIGA M.Impact of different cryoprotectants on the survival of freeze-dried Lactobacillus rhamnosus and Lactobacillus casei/paracasei during long-term storage[J].Beneficial Microbes, 2015, 6(3):381-386.
[20] HOLKEM A T, RADDATZ G C, NUNES G L, et al.Development and characterization of alginate microcapsules containing Bifidobacterium BB-12 produced by emulsification/internal gelation followed by freeze drying[J].LWT-Food Science and Technology, 2016, 71:302-308.
[21] 王淑敏, 桑跃, 侯彩云, 等.冷冻干燥乳双歧杆菌A04菌粉的贮藏活性研究[J].中国食品学报, 2021, 21(9):192-202.WANG S M, SANG Y, HOU C Y, et al.Studies on survival of freeze-dried Bifidobacterium lactis A04 powder during storage[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(9):192-202.
[22] MIAO S, MILLS S, STANTON C, et al.Effect of disaccharides on survival during storage of freeze dried probiotics[J].Dairy Science &Technology, 2008, 88(1):19-30.
[23] 桑跃, 冯海红, 蒙璐, 等.充氮包装和储藏温度对益生菌粉储藏稳定性的影响[J].食品与发酵工业, 2020, 46(19):143-147.SANG Y, FENG H H, MENG L, et al.Effects of nitrogen-filled packaging and storage temperature on storage stability of probiotics powder[J].Food and Fermentation Industries, 2020, 46(19):143-147.
[24] CAMELO-SILVA C, VERRUCK S, AMBROSI A, et al.Innovation and trends in probiotic microencapsulation by emulsification techniques[J].Food Engineering Reviews, 2022, 14(3):462-490.