WANG Yaning,XUE Jie,ZHONG Heng, et al.High-throughput screening of bioactive peptides based on autophagy and application in Lujiu products[J].Food and Fermentation Industries,2025,51(14):139-149.
酒精性肝病(alcoholic liver disease, ALD)是长期过量饮酒引起的肝脏疾病。通常初期症状为酒精性脂肪肝,后期转变为酒精性肝炎、肝硬化等[1],严重时发展为细胞坏死和肝癌[2]。ALD的发病机制复杂且尚未明确,已有研究表明其中乙醇的代谢物如乙醛和活性氧在酒精性肝病中起着重要作用,乙醇氧化代谢影响细胞内信号通路,扰乱多个基因的转录控制,导致脂肪堆积以及先天性和适应性免疫激活,此外乙醛对肝脏有害,可改变脂质稳态[3]。ALD严重损害人体身心健康,是我国第二大肝脏疾病。
目前越来越多研究致力于使用天然活性成分治疗ALD,其中生物活性肽具有促进酒精代谢和缓解肝损伤的能力[4]。WANG等[5]研究发现玉米肽通过加速酒精代谢、减少肝脏脂肪沉积、抗氧化和抗炎反应,对酒精诱导的急性肝损伤有显著保护作用。于亚莉等[6]研究发现玉米肽通过提高脂质代谢等作用,保护细胞免受酒精性损伤。刘效森等[7]研究发现大豆低聚肽可诱导肝癌细胞凋亡,且2种肽(RQRK、HCGAPA)联合使用细胞凋亡率更高。WANG等[8]研究发现牡蛎肽通过对抗氧化应激和炎症反应,从而保护肝脏免受酒精损害。曾瑜等[9]研究发现小麦低聚肽对小鼠体内乙醇和乙醛水平有降低作用,同时增强肝组织中乙醇脱氢酶含量,具有一定解酒功能。
自噬是细胞受各应激源诱导后经溶酶体依赖性降解途径,选择性降解并清除内部老化受损的细胞器及蛋白聚集体,继而实现更新代谢且保持自身稳定的一种生物学过程。研究表明,自噬在调节炎症和免疫、维持基础代谢等方面具有重要作用,在ALD早期通过调节自噬对其进行干预,以阻断病情进展。王妍凌[10]研究发现橙皮苷一定程度上能降低肝脏系数、控制肝脏脂质水平,提升机体抗氧化、炎症能力,促进细胞自噬,从而缓解ALD。高立敏[11]研究发现金线莲苷通过促进酒精代谢、减轻氧化应激和内质网应激、激活腺苷酸活化蛋白激酶依赖的自噬,缓解肝纤维化小鼠的肝功能,可作为治疗酒精性肝病的潜在药物,但有关玉米肽、小麦肽通过促进细胞自噬治疗酒精性肝病的研究较少。流式细胞术(flow cytometry, FCM)是一种先进的技术,其工作原理是特定荧光探针标记的细胞通过激光束时发生光散射和荧光发射,通过检测荧光信号对细胞依次分析,它能够以高速、相对定量和多参数的方式在单细胞水平上分析细胞群[12]。FCM既可以实现细胞计数以及种类、粒径和表面积的测量[13],也能够表征细胞的氧化应激、细胞凋亡、蛋白质和DNA等多种指标多光谱成像[14],也可收集细胞图像,并以灵敏、稳健和高通量的方式评估细胞自噬[15]。
近年来,将生物活性肽加入酒中制备露酒丰富了多肽的利用途径,如木瓜肽酒[16]、大鲵肽酒[17]等。本研究首先通过倒置显微镜观察不同种类生物活性肽在不同浓度处理下,对红绿双荧光蛋白-LO2细胞存活的影响,并采用流式细胞仪检测红绿双荧光蛋白的变化情况,以探讨生物活性肽对细胞自噬通量的作用,随后以生物活性肽和白酒为原料制备露酒,并通过小鼠实验观察添加肽的露酒对肝组织病理形态学改变,研究结果为生产优质健康露酒产品提供理论基础。
LO2人源肝细胞,中国科学院上海细胞生物学研究所;RPMI-1640培养基,美国Gibco公司;红绿双荧光蛋白-LO2细胞(LO2-GFP-RFP荧光细胞,GFP:绿色荧光蛋白,RFP:红色荧光蛋白)、小麦肽-1、小麦肽-6、玉米肽-1、玉米肽-3、浓香型、酱香型、清香型基酒,中国食品发酵工业研究院有限公司;胎牛血清、胰蛋白酶、链霉素、青霉素,美国Hyclone公司;实验动物由斯贝福生物技术有限公司提供,为49~56日龄雄性C57BL/6 J小鼠,体重18~22 g,动物的饲养温度为(23±2) ℃,相对湿度为(50±5)%,光照时间12 h/d,实验动物的相关处理均严格遵守实验动物福利伦理与保护相关规定,并随时接受实验动物伦理委员会的监督与检查。
CKX41型倒置光学显微镜,日本奥林巴斯株式会社;YXQ-50G立式灭菌锅,上海博迅生物仪器股份有限公司安;DLAB DM0506临床低速离心机,大龙兴创实验仪器股份公司;安捷伦流式细胞仪NovoCyte 2000R,安捷伦科技有限公司;UV-1780紫外可见分光光度计,日本SHIMADZU公司。
1.3.1 细胞培养
将冻存的LO2-GFP-RFP荧光细胞从-80 ℃冰箱取出,放入37 ℃水浴锅中解冻,融化后1 000 r/min离心5 min以收集细胞,转入RPMI-1640培养基中(含10%胎牛血清),为防细胞污染加入100 U/mL青霉素和100 μg/mL链霉素。将细胞置于37 ℃、5% CO2的培养箱中培养。待细胞融合度达到70%~80%时,使用0.25%的胰蛋白酶消化传代,每2~3 d进行1次传代。
1.3.2 倒置显微镜观察不同浓度肽对细胞存活的影响
取5个6孔板,每个孔接种LO2细胞1.2×105个。为了比较实验结果,还需单独接种LO2细胞作为阴性对照组。当细胞在培养板上贴壁生长24 h后,将向每个6孔板中加入不同浓度的活性物质,包括小麦肽-1、小麦肽-6、玉米肽-1、玉米肽-3。根据细胞的存活情况确定短肽作用的浓度范围。
1.3.3 流式细胞仪检测不同肽对细胞自噬活性的影响
自噬受相关基因(ATG)编码蛋白质的严格调控,其中LC3B是哺乳动物中自噬关键蛋白ATG8的同源物,对其研究最为广泛。罗蕊琪等[18]构建了红绿荧光蛋白细胞株,在自噬过程中,由于自噬溶酶体环境呈现酸性导致绿色荧光GFP-LC3B淬灭,而红色荧光RFP-LC3B稳定保留在细胞内,因此可通过流式细胞仪通过检测转染细胞中的GFP和RFP的信号,计算GFP/RFP,估计细胞自噬通量。经前述低浓度生物活性肽处理细胞24 h后,用PBS收集样本,上流式细胞仪。
1.3.4 生物活性肽在露酒新产品开发中的应用
以白酒为基酒,添加生物活性肽后静置3 d,使用滤纸过滤制得露酒。通过单因素和响应面试验并结合不同生物活性肽对细胞自噬活性的影响确定露酒制备的最佳工艺。
1.3.4.1 单因素试验
通过单因素试验,探讨不同酒精度(30%vol、38%vol、42%vol、46%vol、52%vol)、基酒香型(浓香型、酱香型、清香型)、基酒温度(15、20、25、30 ℃)、生物活性肽类型(小麦肽-1、小麦肽-6、玉米肽-1、玉米肽-3)、肽添加量(5.00、10.00、15.00、20.00、25.00 mg/mL)这5个因子对露酒中肽保留率的影响。参照GB/T 22729—2008《海洋鱼低聚肽粉》检测露酒的肽含量。保留率的计算如公式(1)所示:
保留率![]()
(1)
1.3.4.2 响应面试验
根据响应面BBD设计原理,以保留率(Y)为响应值,选取单因素试验中对保留率影响较大的酒精度(A)、生物活性肽类型(B)和肽添加量(C)为自变量,对露酒制备工艺进行优化。响应面试验因素水平见表1。后续参照GB/T 10345—2022《白酒分析方法》进行感官品评。
表1 响应面试验因素水平表
Table 1 Factors and levels of response surface test
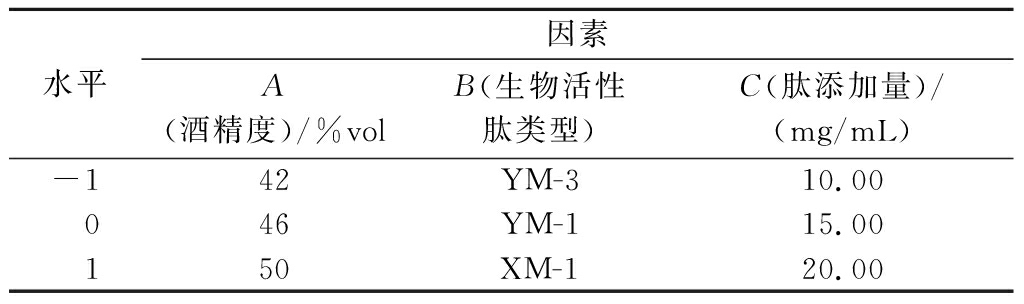
水平因素A(酒精度)/%volB(生物活性肽类型)C(肽添加量)/(mg/mL)-142YM-310.00046YM-115.00150XM-120.00
1.3.5 实验动物造模及肝脏组织病理学检查
实验小鼠适应性喂养一周后,将20只小鼠随机分成4组,分别为空白对照、食用酒精组、基酒组、肽酒组。其中食用酒精组、基酒组、肽酒组分别灌胃200 μL 48%vol食用酒精、48%vol清香型白酒、48%vol添加肽露酒,空白组灌胃等剂量生理盐水,连续灌胃21 d,最后一次禁食不禁水,8 h后颈椎脱臼处死小鼠,取肝脏组织进行后续实验,其中,将右半部肝脏组织通过10%中性多聚甲醛固定制备石蜡切片,肝脏组织病理学变化采用苏木精-伊红染色法染色后观察分析。
首先添加不同浓度生物活性肽观察其对LO2细胞存活的影响,设立0~5.00 mg/mL的梯度(分别为0、0.63、1.25、2.50、5.00 mg/mL),对LO2细胞分别进行了24 h处理,通过倒置显微镜下观察不同种类生物活性肽在不同浓度处理下,对LO2细胞存活率的影响。如图1所示,5.00 mg/mL时,经过24 h的处理,小麦肽-1、小麦肽-6和玉米肽-3处理后的细胞贴壁性能变差,细胞呈半贴半漂状态,经玉米肽-1处理后的细胞形态良好,但细胞密度降低,综合考虑最终选取质量浓度5.00 mg/mL作为检测细胞自噬活性实验的最高作用浓度。

A-阴性对照;B-小麦肽-1;C-小麦肽-6;D-玉米肽-1;E-玉米肽-3
图1 不同生物活性肽对肝细胞存活率影响的倒置显微镜图观察分析(×40)
Fig.1 Inverted microscopic view of the effect of different bioactive peptides on the survival rate of human hepatocytes(×40)
注:阴性对照组未添加任何活性物质。
为进一步观察不同类型生物活性肽对细胞自噬活性的影响作用,将生物活性肽与LO2-GFP-RFP荧光细胞共同培养24 h后,用PBS收集样本并在流式细胞仪上进行检测。
2.2.1 小麦肽-1对细胞自噬活性的影响
通过流式细胞仪检测结果观察小麦肽-1处理组的GFP和RFP荧光强度(图2),可以发现,随着小麦肽-1浓度的增加,GFP荧光强度先呈现下降趋势后急速上升到较高值,这可能表明小麦肽-1在一定浓度范围内能够抑制细胞自噬,可能是通过影响某些涉及自噬过程的关键蛋白或信号途径来实现的。然后比较GFP/RFP的荧光比值。随着小麦肽-1浓度的增加,该比值呈现先下降后上升的趋势,这可能进一步说明,小麦肽-1确实可以影响细胞自噬的程度。在自噬过程中,GFP和RFP的表达水平可以反映自噬体的数量,因此这个比值的变化表明,小麦肽-1在0.63~2.50 mg/mL随质量浓度增加,促进细胞自噬作用增强,在2.50 mg/mL时促进作用开始下降,当质量浓度达到5.00 mg/mL时抑制细胞自噬。

A-GFP荧光强度;B-RFP荧光强度;C-GFP/RFP荧光比值
图2 小麦肽-1对细胞自噬活性的影响
Fig.2 Effect of wheat peptide-1 on autophagy activity of cells
注:GFP-小麦肽-1绿荧光强度;RFP-小麦肽-1红荧光强度;图中不同小写字母代表差异显著(下同)。
2.2.2 小麦肽-6对细胞自噬活性的影响
通过流式细胞仪检测结果观察小麦肽-6处理组的GFP和RFP荧光强度(图3),可以发现,随着小麦肽-6浓度的增加,GFP荧光强度先呈现下降趋势后上升到较高值,RFP荧光强度基本保持不变。这可能表明小麦肽-6在一定浓度范围内能够抑制细胞自噬,可能是通过影响某些涉及自噬过程的关键蛋白或信号途径来实现的。然后,比较GFP/RFP的荧光比值(图3)。随着小麦肽-6浓度的增加,该比值呈现先下降,后上升的趋势。这可能进一步说明,小麦肽-6确实可以影响细胞自噬的程度。在自噬过程中,GFP和RFP的表达水平可以反映自噬体的数量,因此这个比值的变化表明,小麦肽-6在0.63~2.50 mg/mL能够促进自噬体的形成,而在2.50 mg/mL时促进作用开始下降,当质量浓度达到5.00 mg/mL时抑制细胞自噬。
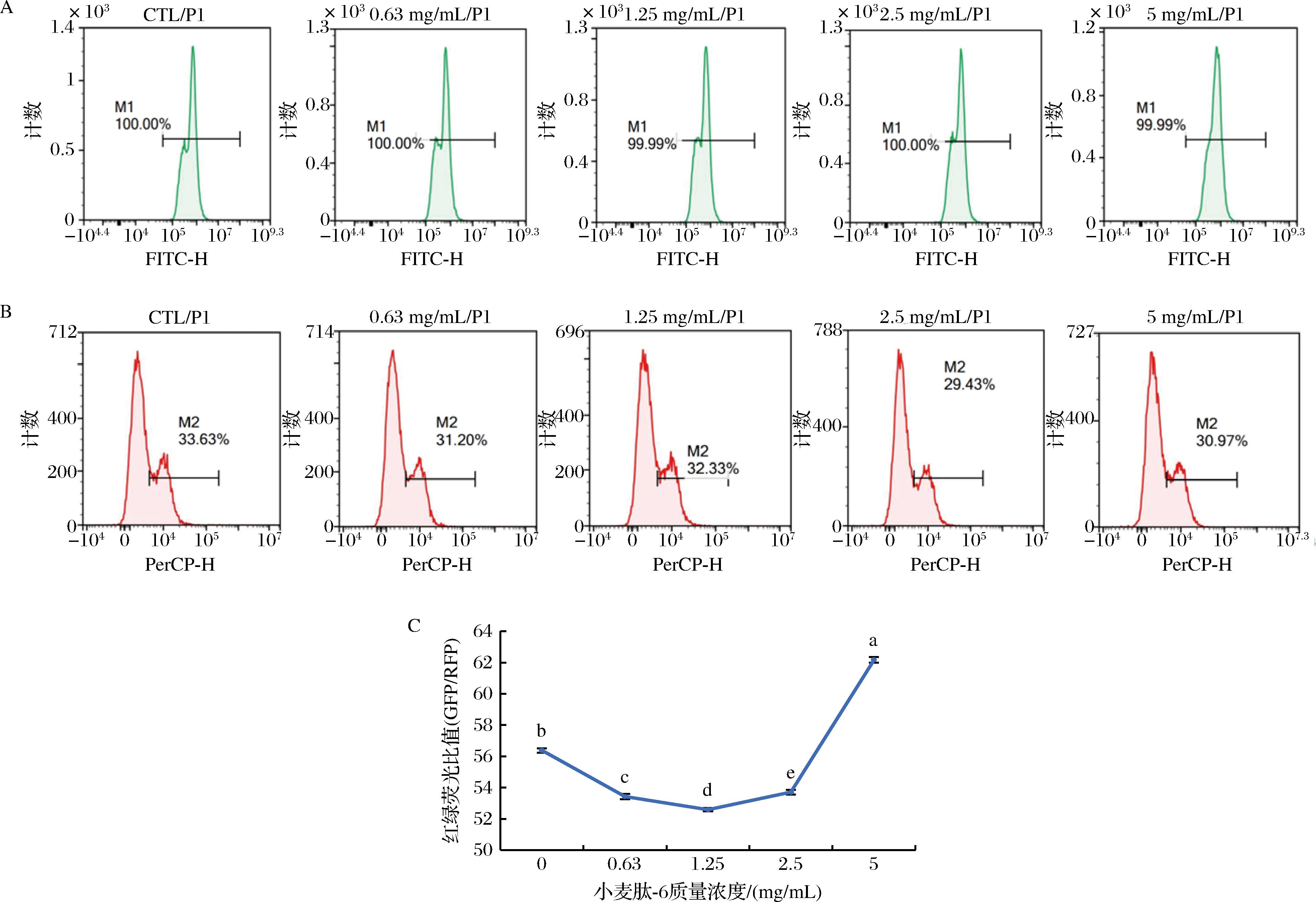
图3 小麦肽-6对细胞自噬活性的影响
Fig.3 Effect of wheat peptide-6 on autophagy activity of cells
注:GFP-小麦肽-6绿荧光强度,RFP-小麦肽-6红荧光强度。
2.2.3 玉米肽-1对细胞自噬活性的影响
通过流式细胞仪检测结果观察玉米肽-1处理组的GFP和RFP荧光强度(图4),可以发现,随着玉米肽-1浓度的增加,GFP荧光强度先呈现下降趋势后缓慢上升,RFP荧光强度基本保持不变。这可能表明玉米肽-1在一定浓度范围内能够抑制细胞自噬,可能是通过影响某些涉及自噬过程的关键蛋白或信号途径来实现的。然后,比较GFP/RFP的荧光比值(图4)。随着玉米肽-1浓度的增加,该比值呈现先下降,后缓慢上升的趋势。这可能进一步说明,玉米肽-1确实可以影响细胞自噬的程度。在自噬过程中,GFP和RFP的表达水平可以反映自噬体的数量,因此这个比值的变化表明,玉米肽-1在0.63~5.00 mg/mL是能够促进自噬体的形成,即使在高质量浓度5.00 mg/mL的情况下,促进作用下降也不明显。
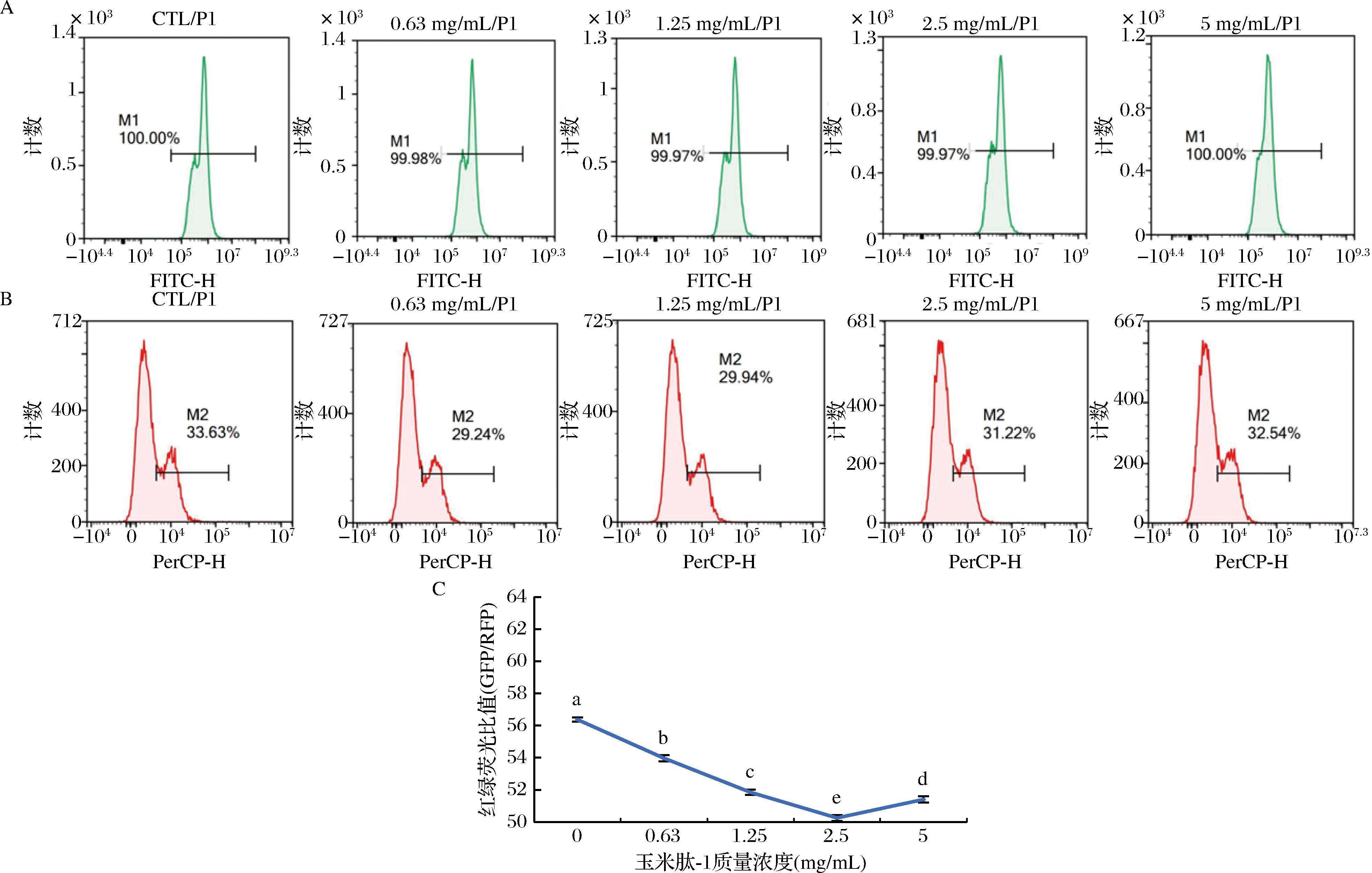
图4 玉米肽-1对细胞自噬活性的影响
Fig.4 Effect of corn peptide-1 on autophagy activity of cells
注:GFP-玉米肽-1绿荧光强度,RFP-玉米肽-1红荧光强度。
2.2.4 玉米肽-3对细胞自噬活性的影响
通过流式细胞仪检测结果观察玉米肽-3处理组的GFP和RFP荧光强度(图5),可以发现,随着玉米肽-3浓度的增加,GFP荧光强度先呈现下降趋势后急速上升到正常值,RFP荧光强度基本保持不变。这可能表明玉米肽-3在一定浓度范围内能够抑制细胞自噬,可能是通过影响某些涉及自噬过程的关键蛋白或信号途径来实现的。然后,比较GFP/RFP的荧光比值(图5)。随着玉米肽-3浓度的增加,该比值呈现先下降,后上升的趋势。这可能进一步说明,玉米肽-3确实可以影响细胞自噬的程度。在自噬过程中,GFP和RFP的表达水平可以反映自噬体的数量,因此这个比值的变化表明,玉米肽-3在0.63~5.00 mg/mL是能够促进自噬体的形成。
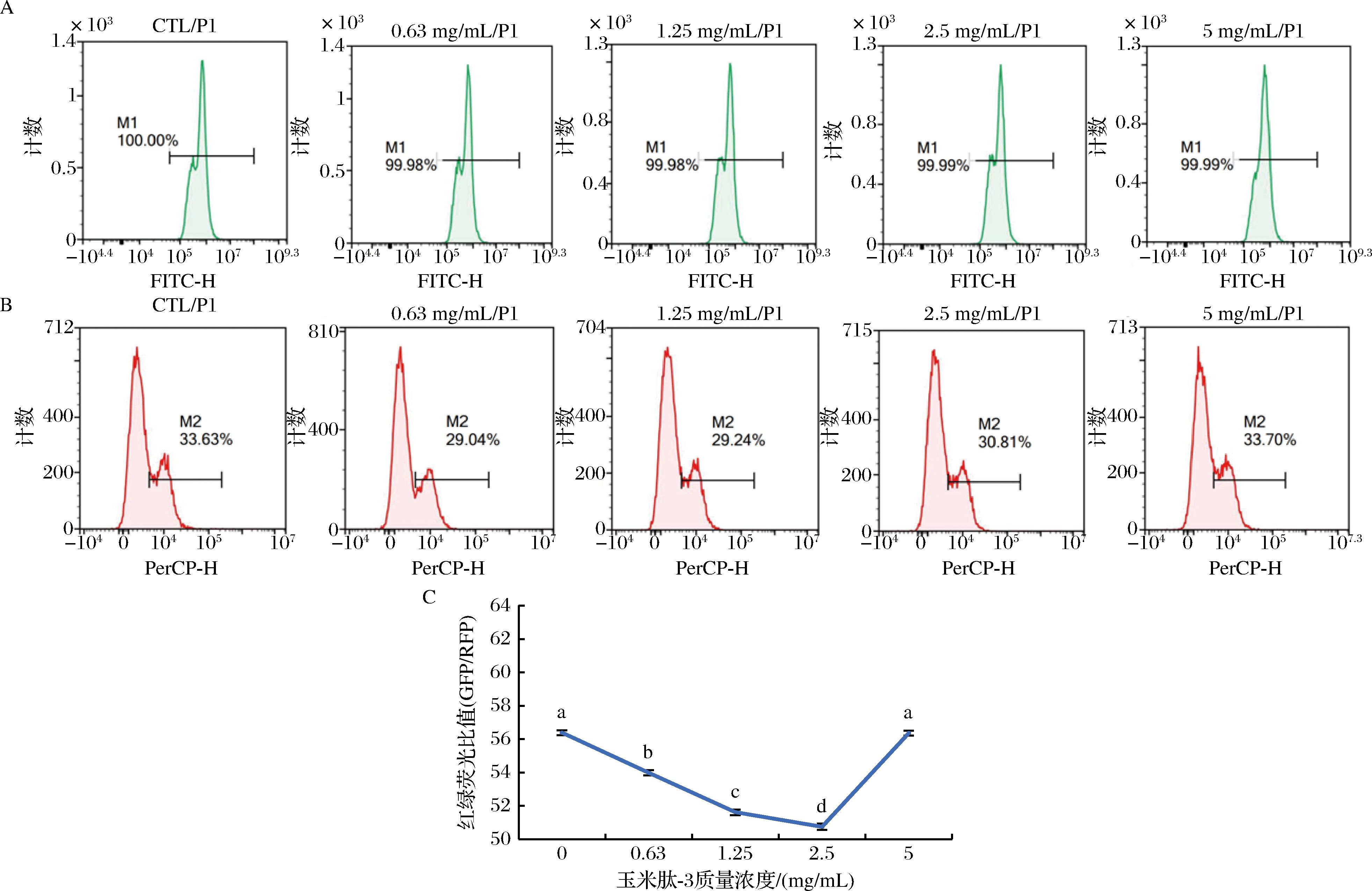
图5 玉米肽-3对细胞自噬活性的影响
Fig.5 Effect of corn peptide-3 on autophagy activity of cells
注:GFP-小玉米-3绿荧光强度,RFP-玉米肽-3红荧光强度。
2.2.5 不同生物活性肽功能评价
综上所述,不同生物活性肽在一定的浓度范围内对红绿双荧光蛋白细胞均有促进细胞自噬的作用。玉米肽-1、玉米肽-3在0.63~5.00 mg/mL有促进作用,小麦肽-1、小麦肽-6在0.63~2.50 mg/mL质量浓度范围内有促进作用,在5.00 mg/mL时有明显的抑制作用;其中,玉米肽-1在2.50~5.00 mg/mL质量浓度范围内的促进作用下降趋势最平缓,说明此玉米肽-1对细胞自噬的促进效果最为明显。
通过流式细胞仪检测不同类型的肽对细胞自噬活性的影响,发现玉米肽-1对细胞自噬的促进效果最为明显,但不同类型肽在白酒基酒中的保留率存在很大差异,本研究比较了不同类型肽的保留率的差异,并以玉米肽-1为研究对象,分析了基酒度数、基酒香型、基酒温度、肽添加量对保留率的影响,其中保留率越高,代表肽在酒中溶解度越高,露酒的营养价值相应也较高。
2.3.1 生物活性肽类型对肽保留率的影响
一般而言,肽的分子质量越小其溶解度通常越高,实验所用的玉米肽-1、玉米肽-3和小麦肽-1分子质量在1 000 Da以下,小麦肽-6分子质量为2 000~3 000 Da。此外,有些肽序列具有包含疏水侧链的氨基酸,例如β-分支氨基酸,因此不同类型的肽因其氨基酸组成在酒中溶解度也有差异[19]。由图6可知,肽的类型对其保留率的影响显著。添加玉米肽-1的肽保留率最高,小麦肽-1次之,添加小麦肽-6的肽保留率最低,原因可能为玉米肽-1分子质量低,或其氨基酸序列有利于肽的溶解,小麦肽-6分子质量高,肽溶解率低。考虑到玉米肽-1对细胞自噬的促进效果最为明显,因此选择玉米肽-1作为露酒制备工艺响应面试验的中心水平。
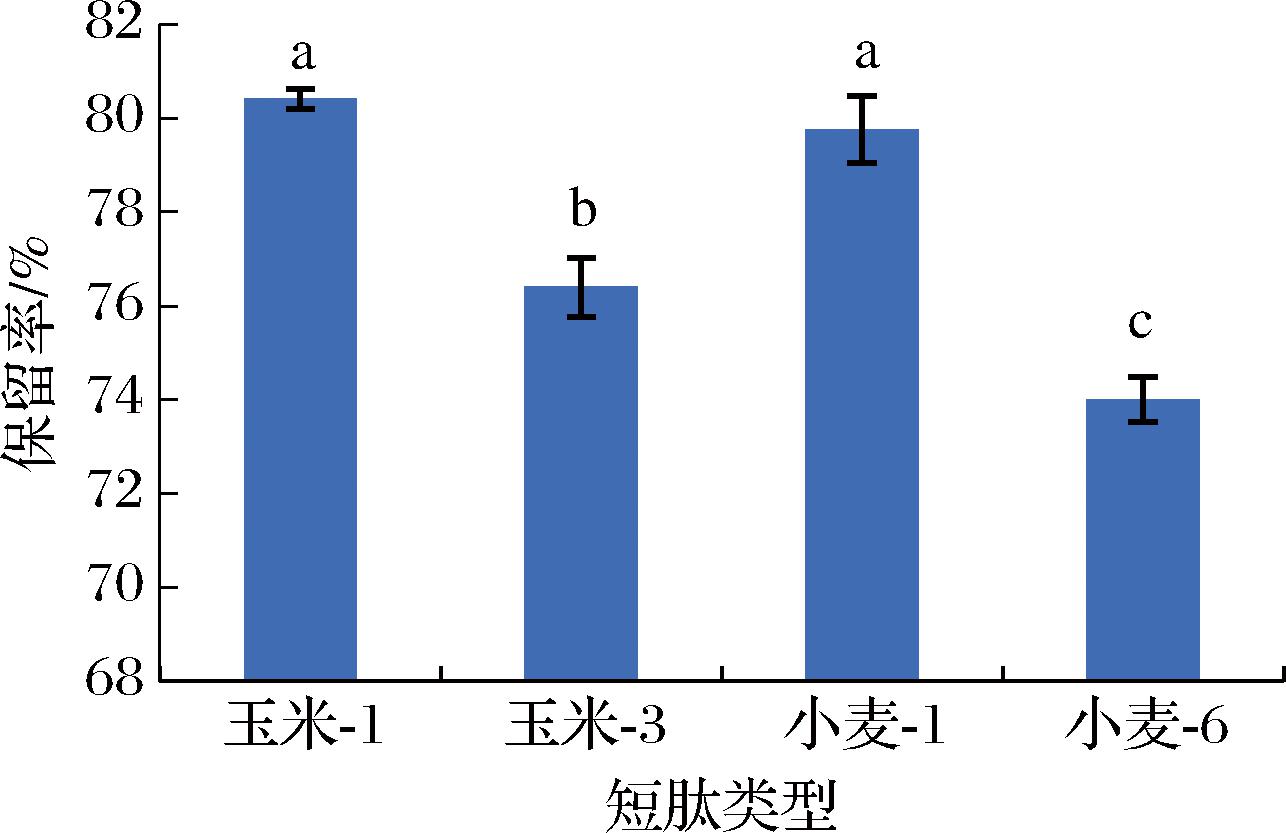
图6 肽类型对肽保留率的影响
Fig.6 Effect of peptide type on peptide retention rate
2.3.2 基酒度数对肽保留率的影响
由图7可知,基酒度数对肽保留率影响显著。随着基酒度数的增加,露酒的保留率呈先上升后趋于平缓的走向。当基酒度数为46%vol,肽的保留率基本保持稳定,说明酒精含量的增加有利于肽的溶解,这可能由于醇溶蛋白分子内部富含疏水性氨基酸,同时缺乏带电荷的氨基酸,其分子与水表面之间存在界面张力,上述因素决定了醇溶蛋白的特殊溶解性,难溶于水,可溶于一定浓度的乙醇水溶液中[20],以此制备的肽仍保留了醇溶蛋白中的氨基酸构成,并且分子质量更小,具有较好的醇溶性和水溶性。考虑到露酒度数偏低,因此选择46%vol作为露酒制备工艺响应面试验的中心水平。
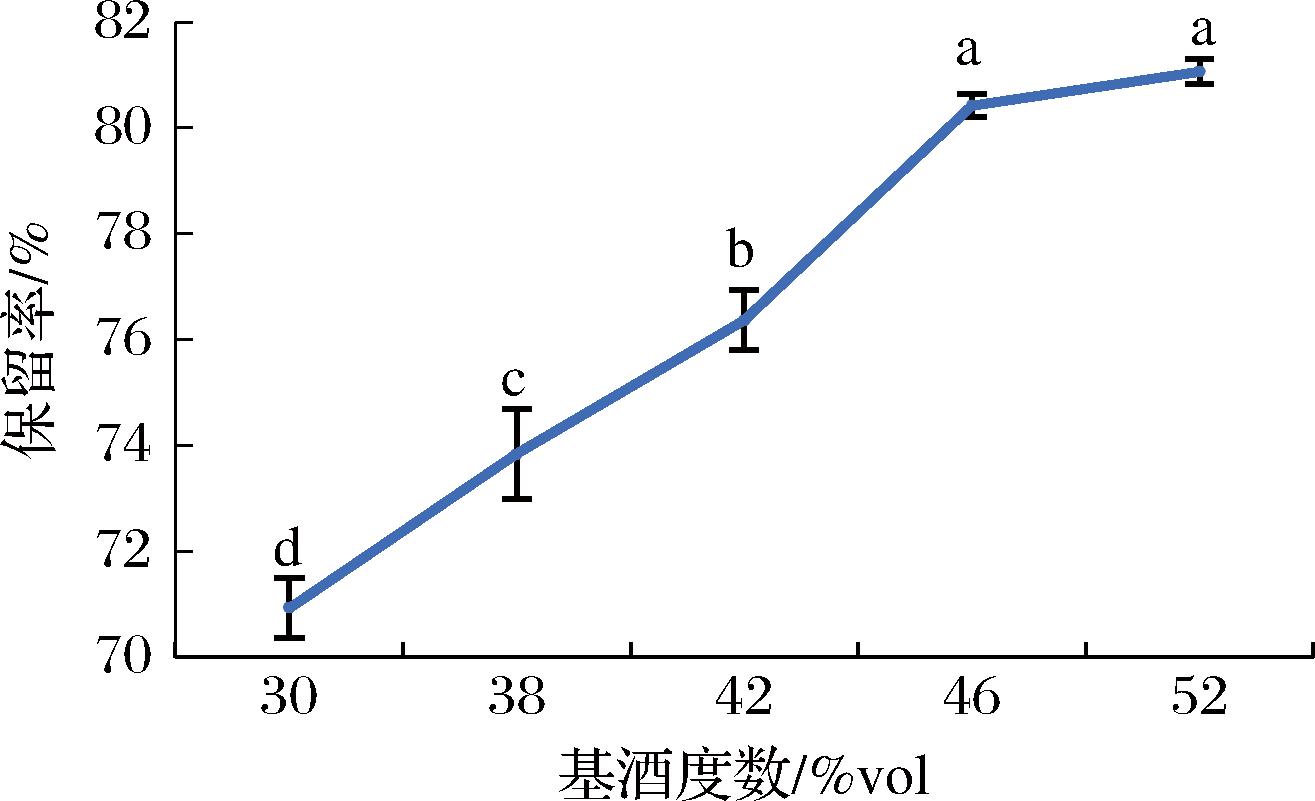
图7 基酒度数对肽保留率的影响
Fig.7 Effect of base liquor degree on peptide retention rate
2.3.3 基酒香型对肽保留率的影响
不同香型基酒由于其总酸、pH以及金属元素含量存在差异,如Al、Ca、Cu、酯类、醛类、有机酸等[21],这些物质可能与肽发生相互作用,从而影响肽在酒中的保留率。但由图8可知,不同香型基酒制备的露酒其肽保留率无显著差异,说明不同香型基酒的成分对肽在酒中的溶解度影响较小。以清香型白酒制备的露酒中肽保留率最高,此外考虑到清香型白酒风味特征为清澈醇甜、甘润爽口、淡雅协调、尾净香长,更容易被消费者接受,因此选择清香型白酒作为基酒制备露酒较为合适。
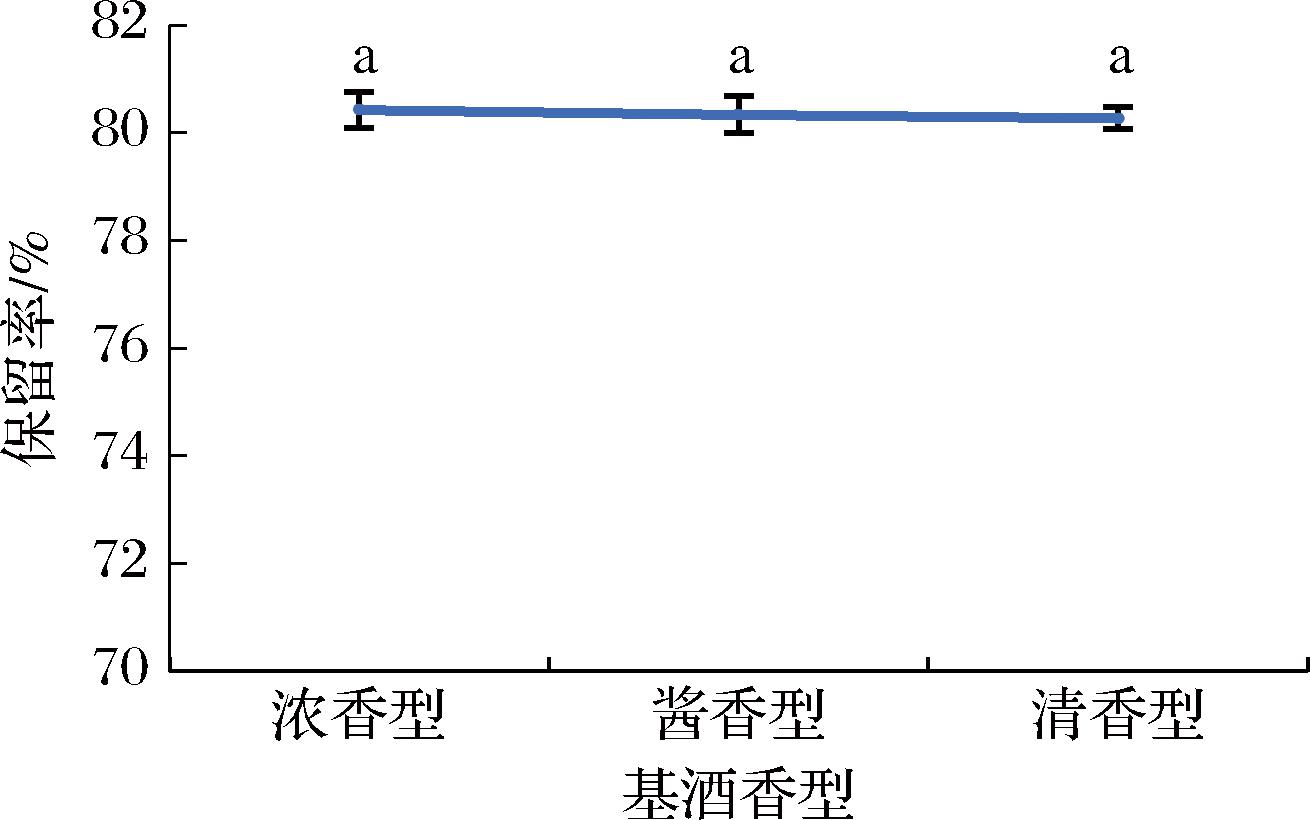
图8 基酒香型对肽保留率的影响
Fig.8 Effect of base liquor flavor type on peptide retention rate
2.3.4 基酒温度对肽保留率的影响
一般而言,对于固体溶质,溶剂温度越高,其溶解度越大,这是因为分子的平均动能越大,溶质分子更易扩散到溶剂分子中,但温度提高也可能会导致分子内的疏水基团暴露,从而增强表面疏水作用,诱导肽发生聚集,使肽的溶解度下降[22]。由图9可知,基酒温度越高,肽的保留率越高,说明在此温度范围内提高温度有利于肽在酒中的溶解,但对其影响并不显著。考虑到酒精易挥发,提高基酒温度可能会导致酒精度下降,并且在室温下更易操作,因此基酒温度选择室温较为合适。
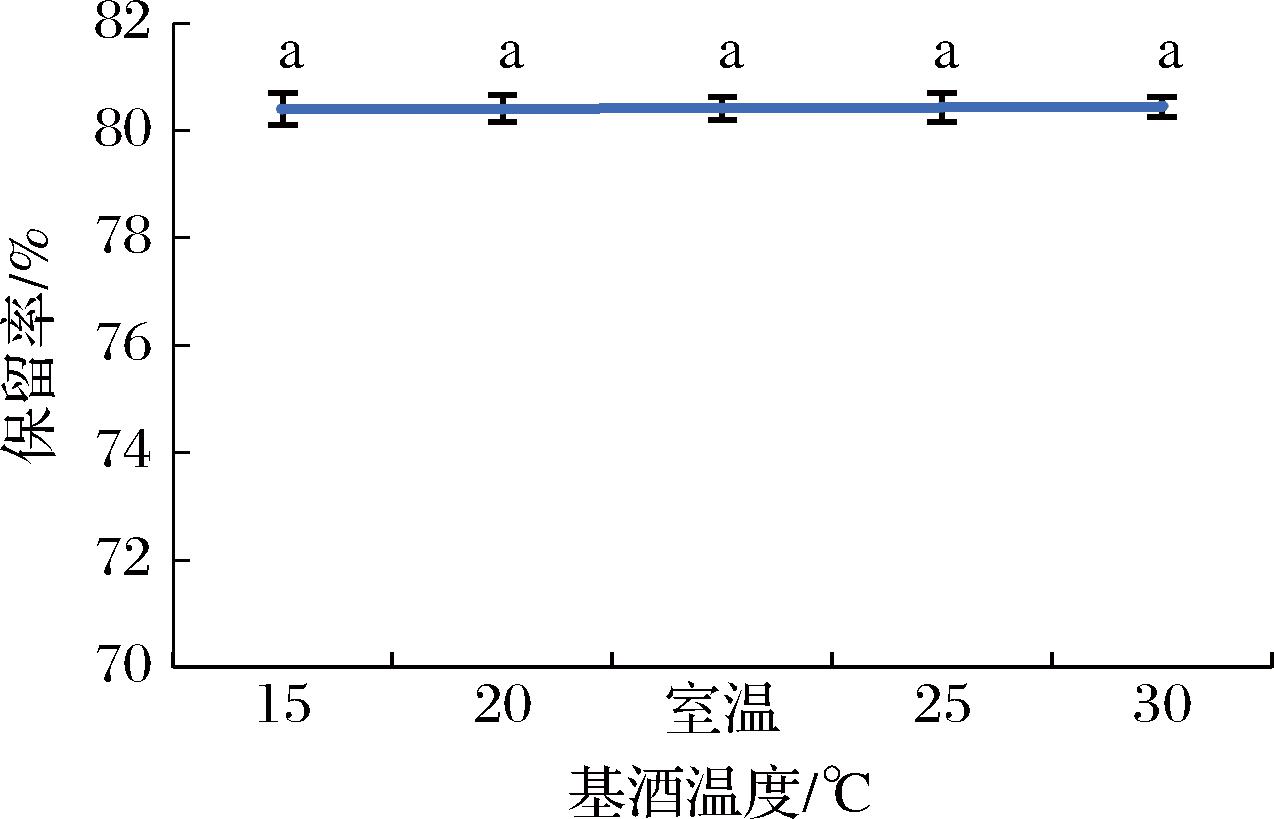
图9 基酒温度对肽保留率的影响
Fig.9 Effect of base liquor temperature on peptide retention rate
2.3.5 肽添加量对肽保留率的影响
通常肽添加量越高,其溶解度越低。在不同生物活性肽功能评价实验中可知,玉米肽-1质量浓度为2.50 mg/mL时促进细胞自噬的作用最大,但酒进入人体后会被稀释,因此本次实验酒中肽添加量参考路联等[23]方法,设置为5.00~25.00 mg/mL。由图10可知,肽添加量对保留率的影响显著。随着添加量的增加,肽的保留率呈先平缓后下降的趋势,当肽的添加量在5.00~15.00 mg/mL时,肽的保留率较高,超过15.00 mg/mL时,保留率开始降低,说明肽的溶解度开始下降,因此选择15.00 mg/mL作为露酒制备工艺响应面试验的中心水平。
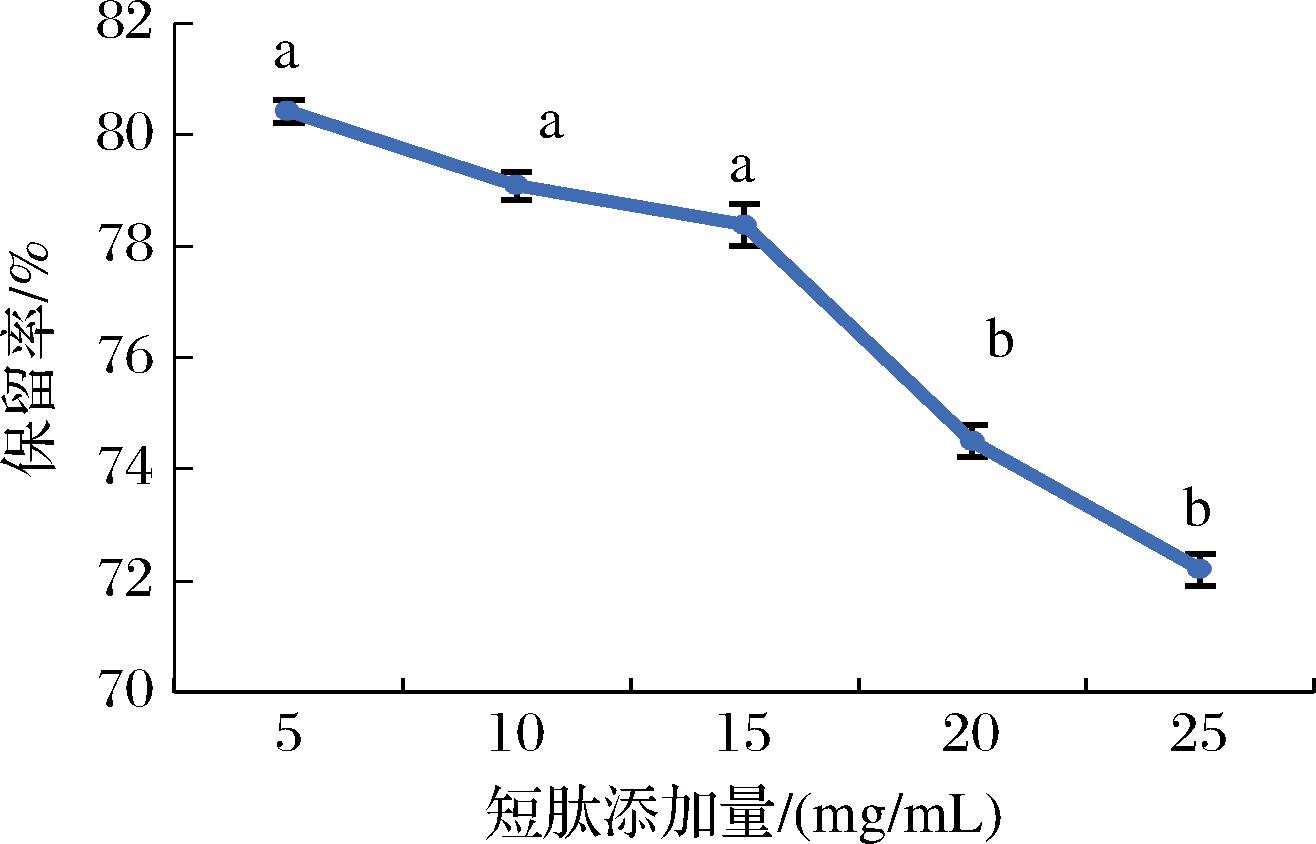
图10 肽添加量对肽保留率的影响
Fig.10 Effect of peptide addition on peptide retention rate
2.4.1 响应面试验结果分析
在单因素试验基础上选择基酒度数(A)、生物活性肽类型(B)和肽添加量(C)三因素做Box-Behnken设计,将肽保留率作为其响应值,对结果进行分析,进而确定最佳的工艺参数,结果如表2所列。
表2 响应面试验设计及结果
Table 2 Design and results of response surface experiment
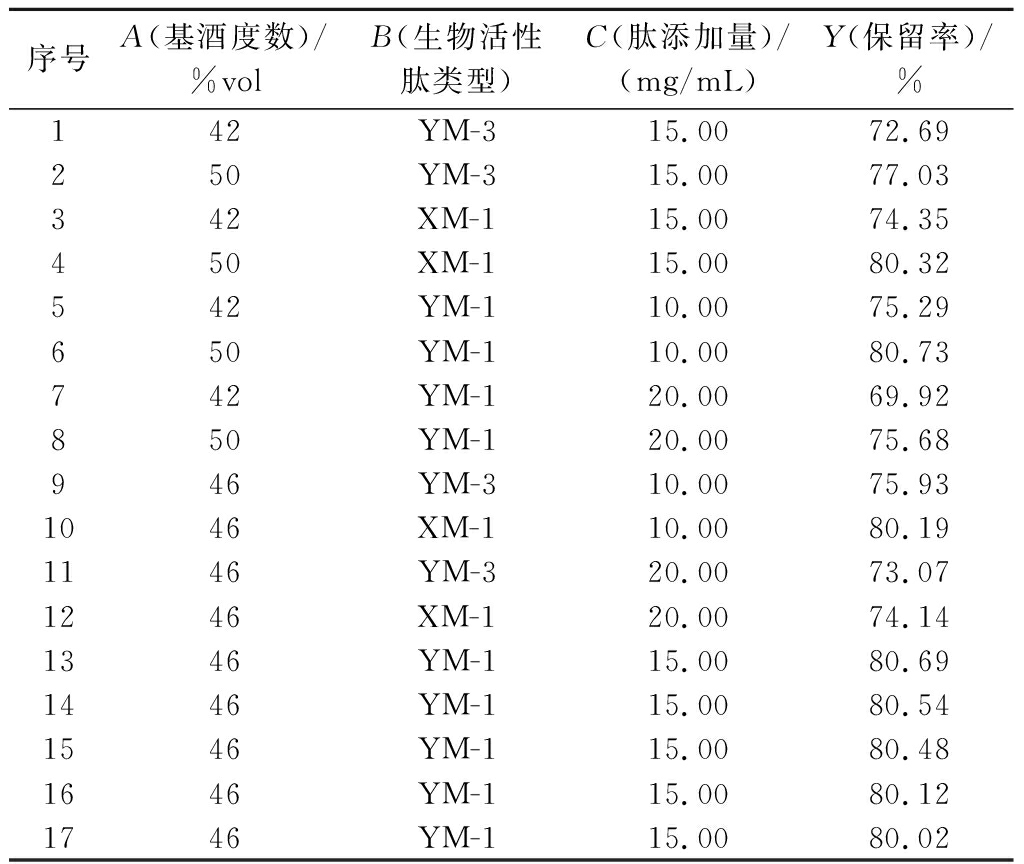
序号A(基酒度数)/%volB(生物活性肽类型)C(肽添加量)/(mg/mL)Y(保留率)/%142YM-315.0072.69 250YM-315.0077.03 342XM-115.0074.35 450XM-115.0080.32 542YM-110.0075.29 650YM-110.0080.73 742YM-120.0069.92 850YM-120.0075.68 946YM-310.0075.93 1046XM-110.0080.19 1146YM-320.0073.07 1246XM-120.0074.14 1346YM-115.0080.69 1446YM-115.0080.54 1546YM-115.0080.48 1646YM-115.0080.12 1746YM-115.0080.02
以BBD中心复合设计原理为基础,构建出回归公式预测模型,对响应面试验的结果进行多重回归和二项拟合分析,得到保留率(Y)关于各因素的回归方程:Y=80.37+2.69A+1.28B-2.42C+0.41AB+0.08AC-0.80BC-2.35A2-1.92B2-2.62C2。
2.4.2 模型方差分析
运用响应面分析软件对各因子进行建模,得出各因子对响应值的影响程度,影响肽保留率的各种因素进行了分析,![]() 方差分析结果如表3所列。
方差分析结果如表3所列。
由表3可以看出,所构建的回归模型中P<0.000 1,结果表明该模型在95%置信水平下具有高度统计显著性。当非拟合部分P达到0.316 2>0.05时说明回归方程是可信的。回归系数R2为99.63%,表明该公式的拟合程度高,可以用该公式替代实验来反应各变量与实验结果之间的关系。修正因子R2为0.991 5,表明该模式能够解释肽保留率中99.15%,的改变。表3中的数据说明本实验的设计可靠,适合实际情况,可以用来对优化肽保留率的结果进行分析和预测。
表3 拟合二次回归模型的方差分析
Table 3 Analysis of variance of the fitted quadraticregression model
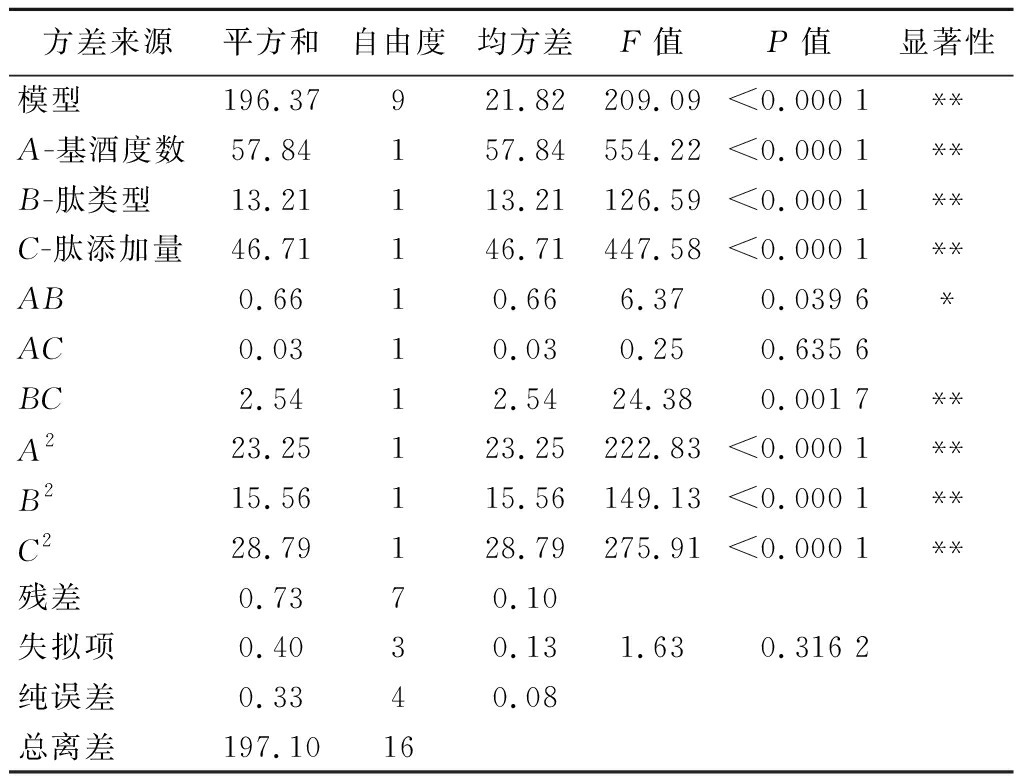
方差来源平方和自由度均方差F值P值显著性模型196.37 9 21.82 209.09 <0.000 1**A-基酒度数57.84 1 57.84 554.22 <0.000 1**B-肽类型13.21 1 13.21 126.59 <0.000 1**C-肽添加量46.71 1 46.71 447.58 <0.000 1**AB0.66 1 0.66 6.37 0.039 6*AC0.03 1 0.03 0.25 0.635 6BC2.54 1 2.54 24.38 0.001 7**A223.25 1 23.25 222.83 <0.000 1**B215.56 1 15.56 149.13 <0.000 1**C228.79 1 28.79 275.91 <0.000 1**残差0.73 7 0.10失拟项0.40 3 0.13 1.63 0.316 2纯误差0.33 4 0.08 总离差197.10 16
注:“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01)。
由表3中的P值可以看出,一次项中酒精度(A)、肽类型(B)和肽添加量(C)对肽保留率的影响都极显著;并且在所有的交互效应中,AB、BC对露酒的保留率有显著影响,而AC对露酒的保留率没有显著影响;二次项中的A2、B2、C2极大地影响着保留率的变化。参照表3中F值,可以得到以下3种因素保留率的影响程度:基酒度数(A)>肽添加量(C)>肽类型(B)。
2.4.3 响应面各因素交互作用结果与分析
根据各变量和其对应的响应值,可以绘制出空间曲面和等高线图,直观展示出各因素对实验结果的影响。基酒度数、肽类型和肽添加量3个因素之间的交互影响情况如图11所示。由图11可知,基酒度数和肽类型、肽类型和肽添加量的曲线陡峭,等高线近似椭圆,说明其因素之间的交互效应对响应值影响显著,肽类型和肽添加量的曲线平缓,等高线近似圆形,说明其因素之间的交互效应对响应值影响不显著。

A-基酒度数和肽类型的交互作用;B-基酒度数和肽添加量;C-肽类型和肽添加量的交互作用
图11 酒精度、肽类型和肽添加量之间的交互作用对肽保留率影响的响应面及等高线图
Fig.11 Response surface and contour map of the interaction between alcohol content, peptide type, and addition on retention rate
2.4.4 验证实验
通过响应面试验得到最佳露酒制备工艺:酒精度为47.91%vol,肽类型为玉米肽-1,肽添加量为15.09 mg/mL,基于此条件,试验预测值为81.07%。为方便试验操作、减少误差、提高实际操作可行性,将其调整为酒精度为48%vol,肽类型为玉米肽-1,肽添加量为15.09 mg/mL,试验重复3次,结果取平均值,肽保留率为80.72%,接近预测值,按照GB/T 10345—2022《白酒分析方法》进行感官品评,得分为93。
小鼠肝脏HE染色结果如图12所示,空白对照组小鼠肝组织基本无明显病理变化,肝组织排列紧密,肝细胞正常生长,无变性情况,食用酒精组和基酒组小鼠肝细胞排列紊乱,细胞肿胀,胞浆疏松淡染,有水样变性趋势,食用酒精组还出现小叶偶见炎性细胞小灶性浸润(黑色箭头),说明过量饮酒可加重肝脏负担,使肝细胞受损变性,导致酒精性肝病,肽酒组肝组织呈正常清晰的肝小叶结构,肝细胞围绕中央静脉呈放射状排列,肝板排列规则、整齐,肝窦无明显扩张或挤压,肝细胞基本无变性,未见明显的炎性细胞浸润,说明露酒中的玉米肽对酒精造成的肝损伤起到一定保护作用,能够减少酒精带来的肝损伤危害。
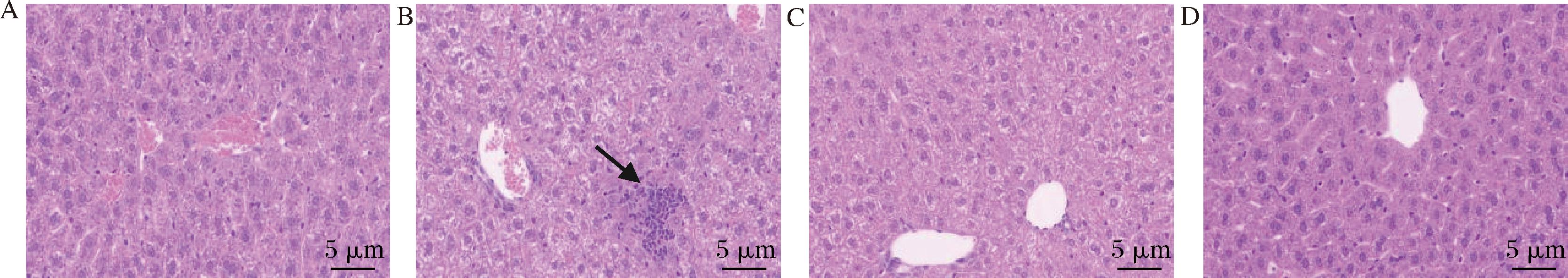
A-空白组;B-食用酒精组;C-基酒组;D-肽酒组
图12 不同处理组小鼠肝组织病理形态图(×20)
Fig.12 Pathomorphologic maps of liver tissues in mice in different treatment groups(×20)
本文首先通过倒置显微镜观察不同浓度的生物活性肽对LO2细胞存活的影响,最终选取质量浓度5.00 mg/mL作为检测细胞自噬活性实验的最高作用浓度。IKARI等[24]发现荞麦的乙醇提取物可促进细胞自噬,缓解酒精性肝炎,本实验中所用的肽从醇溶蛋白制得,预测其具有一定细胞自噬活性,因此通过流式细胞仪观察不同生物活性肽对细胞自噬活性的影响,结果发现不同生物活性肽在一定的浓度范围内对红绿双荧光蛋白细胞均有促进细胞自噬的作用:玉米肽-1、玉米肽-3均在0.63~5.00 mg/mL有促进作用,小麦肽-1、小麦肽-6在0.63~2.50 mg/mL有促进作用,在5.00 mg/mL时有明显的抑制作用;其中,玉米肽-1在2.50~5.00 mg/mL的促进作用下降趋势最平缓,说明玉米肽-1对细胞自噬的促进效果最为明显,随后以生物活性肽和白酒为原料制备露酒,以保留率为指标,通过单因素试验和响应面试验得到露酒制备的最佳工艺条件:基酒度数为48%vol,基酒类型为清香型,基酒温度为室温,生物活性肽类型为玉米肽-1,生物活性肽添加量为15.09 mg/mL,此条件下露酒的肽保留率为80.72%,口感佳,感官评分93分。通过小鼠实验观察露酒对肝组织病理形态学改变,与食用酒精组和基酒组相比,露酒组小鼠肝细胞变性程度要优于前两组,表明加肽的露酒在一定程度上减少酒精性肝损伤的产生。
[1] THEODORESON M D, AITHAL G P, ALLISON M, et al.Extra-hepatic morbidity and mortality in alcohol-related liver disease:Systematic review and meta-analysis[J].Liver International, 2023, 43(4):763-772.
[2] CHOWDHURY A B, MEHTA K J.Liver biopsy for assessment of chronic liver diseases:A synopsis[J].Clinical and Experimental Medicine, 2023, 23(2):273-285.
[3] OSNA N A, RASINENI K, GANESAN M, et al.Pathogenesis of alcohol-associated liver disease[J].Journal of Clinical and Experimental Hepatology, 2022, 12(6):1492-1513.
[4] GONG X X, AN Q, LE L Q, et al.Prospects of cereal protein-derived bioactive peptides:Sources, bioactivities diversity, and production[J].Critical Reviews in Food Science and Nutrition, 2022, 62(11):2855-2871.
[5] WANG X J, LIU X L, ZHENG X Q, et al.Antagonistic effect of the glycopeptide from zein on acute alcohol-induced liver injury in mice[J].Journal of Functional Foods, 2022, 92:105062.
[6] 于亚莉, 宋雪梅, 关玉, 等.玉米肽Tyr-Phe-Cys-Leu-Thr对酒精性HepG2细胞的保护作用[J].中国食品学报, 2020, 20(5):43-52.YU Y L, SONG X M, GUAN Y, et al.Protective effect of corn peptide Tyr-Phe-Cys-Leu-Thr on alcoholic HepG2 cells[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(5):43-52.
[7] 刘效森, 王琳, 蔡转章, 等.大豆低聚肽对HepG2细胞增殖抑制作用的研究[J].营养学报, 2019, 41(3):287-292.LIU X S, WANG L, CAI Z Z, et al.Inhibition of soybean oligopeptides on proliferation HepG2 cells[J].Acta Nutrimenta Sinica, 2019, 41(3):287-292.
[8] WANG X Q, YU H H, XING R E, et al.Hepatoprotective effect of oyster peptide on alcohol-induced liver disease in mice[J].International Journal of Molecular Sciences, 2022, 23(15):8081-8096.
[9] 曾瑜, 潘兴昌, 张立实, 等.小麦低聚肽对小鼠解酒功能的评价[J].现代预防医学, 2019, 46(7):1255-1259.ZENG Y, PAN X C, ZHANG L S, et al.Evaluation of wheat oligopeptide on hangover function in mice[J].Modern Preventive Medicine, 2019,46(7):1255-1259.
[10] 王妍凌. 基于细胞自噬的葡萄酒及其酚类物质对肝脏保护的影响研究[D].乌鲁木齐:新疆农业大学, 2023.WANG Y L.Effects of wine and its phenolic compounds on liver protection based on cellular autophagy[D].Urumqi:Xinjiang Agricultural University, 2023.
[11] 高立敏. 金线莲苷对酒精性脂肪肝和肝纤维化的保护作用及机制探索[D].武汉:华中科技大学, 2022.GAO L M,.Protective effect and mechanism of kinsenoside on alcoholic fatty liver and liver fibrosis[D].Wuhan:Huazhong University of Science and Technology, 2022.
[12] MANOHAR S M, SHAH P, NAIR A.Flow cytometry:Principles, applications and recent advances[J].Bioanalysis, 2021, 13(3):181-198.
[13] WELSH J A, JONES J C, TANG V A.Fluorescence and light scatter calibration allow comparisons of small particle data in standard units across different flow cytometry platforms and detector settings[J].Cytometry Part A, 2020, 97(6):592-601.
[14] MANOHAR S M, SHAH P, NAIR A.Flow cytometry:Principles, applications and recent advances[J].Bioanalysis, 2021, 13(3):181-198.
[15] REN H, BAKAS N A, VAMOS M, et al.Design, synthesis, and characterization of an orally active dual-specific ULK1/2 autophagy inhibitor that synergizes with the PARP inhibitor olaparib for the treatment of triple-negative breast cancer[J].Journal of Medicinal Chemistry, 2020, 63(23):14609-14625.
[16] 陈国华. 一种风味极佳的木瓜肽酒及其制备方法:中国, CN114106961A[P].2022-03-01.CHEN G H.A method for preparing papaya peptide wine with excellent flavor:China, CN114106961A[P].2022-03-01.
[17] 曾允灏, 苏文, 郑小莉, 等.大鲵肝肽酒制备及其对小鼠酒后肝脏保护作用研究[J].中国酿造, 2023, 42(2):120-125.ZENG R H, SU W, ZHENG X L, et al.Preparation of Andrias davidianus liver peptide wine and its protective effect on mouse liver after drinking[J].China Brewing, 2023, 42(2):120-125.
[18] 罗蕊琪, 钟恒, 韩兴林, 等.一种酒体微量成分对细胞自噬通量影响的检测方法:中国, CN116987756A[P].2023-11-03.LUO R Q, ZHONG H, HAN X L, et al.A method for detecting the effect of trace components of wine body on autophagy flux:China, CN116987756A[P].2023-11-03.
[19] MUELLER L K, BAUMRUCK A C, ZHDANOVA H, et al.Challenges and perspectives in chemical synthesis of highly hydrophobic peptides[J].Frontiers in Bioengineering and Biotechnology, 2020, 8:162.
[20] QAZANFARZADEH Z, KADIVAR M, SHEKARCHIZADEH H, et al.Rye secalin characterisation and use to improve zein-based film performance[J].International Journal of Food Science &Technology, 2021, 56(2):742-752.
[21] 卓俊纳. 三种香型白酒的ICP-OES和GC-QTOF MS分析及判别研究[D].自贡:四川轻化工大学, 2022.ZHUO J N.Analysis and discrimination research by ICP-OES and GC-QTOF MS of three kinds of flavor Baijiu[D].Zigong:Sichuan University of Science and Engineering, 2022.
[22] JIANG W, CHANG K F, MA S N, et al.Effects of heat treatment on structural and functional properties of velvet antler polypeptides[J].Journal of Food Processing and Preservation, 2021, 45(6):e15490.
[23] 路联, 李海忠.一种养生保健酒的制备方法:中国, CN115433655A[P].2022-12-06.LU L, LI H Z.The preparation method of healthy wine:China, CN115433655A[P].2022-12-06.
[24] IKARI S, YANG Q, LU S L, et al.Quercetin in tartary buckwheat induces autophagy against protein aggregations[J].Antioxidants, 2021, 10(8):1217.