WEI Lei,LI Ningjie,JIN Rao, et al.Structural characterization and antioxidant activity of acidic polysaccharides from Stropharia rugosoannulata[J].Food and Fermentation Industries,2025,51(14):167-174.
赤松茸(Stropharia rugosoannulata)是一种药食兼用的食用蘑菇,具有清爽、酥脆的质地,伴有微甜的味道[1],因其碳水化合物、蛋白质、维生素、矿物质、膳食纤维含量高和脂质含量低而被认为是健康食品。随着食用菌相关研究的深入,学者们发现赤松茸存在多种与其生物活性相关的功能成分[2],特别是多糖,具有诸多药理活性,包括调节免疫、降血糖、抗肿瘤、抗病毒、调节肠道菌群和抗氧化[3]等。目前对赤松茸的研究主要集中在种植优化[4]和养分组成[5]。然而,赤松茸多糖的结构特征以及其具体的抗氧化活性机制仍不清晰;特别是,经过分离纯化得到的赤松茸多糖的活性机制尚不明确。在先前的研究中发现博爱县所产的赤松茸,因独特的竹林栽培方式而使得其部分功能成分含量高于其他栽培模式下的赤松茸,其中多糖含量的升高尤为显著[6-7]。因此,为进一步探究博爱赤松茸多糖的潜在益处,有必要揭示其多糖纯化后的化学结构和生物活性。
多糖是由多种单糖组成的聚合碳水化合物。绝大多数人类健康系统中的病症,均已被证实与氧化应激的过度发生有关。多糖类物质作为一种天然的生物活性成分,在调节并减轻这种应激状态方面,展现出了其显著的抗氧化活性[8]。众多科学研究已揭示,多糖的抗氧化效能并非孤立存在,而是紧密依附于其精细复杂的结构特性。具体而言,单糖的构成种类和比例、分子质量范围与分布形态、糖苷键的特定类型以及糖醛酸成分的含量等因素,均在不同程度上影响多糖的抗氧化能力[9]。WANG等[10]发现当归多糖对DPPH自由基的清除活性略弱,主要是由于分子质量过大,说明DPPH自由基的清除活性与分子质量的高低有关。YI等[11]用蒸汽爆炸预处理牛膝,发现多糖组分中阿拉伯糖、半乳糖和半乳糖醛酸的比例增加,同时增强了牛膝多糖对ABTS阳离子自由基、DPPH自由基、羟自由基和超氧阴离子自由基的体外清除活性。FENG等[12]从慈菇中提取多糖,其中鼠李糖和甘露糖含量较高的多糖组分具有较高的ABTS阳离子自由基清除活性,并且表明了羟自由基清除能力与半乳糖含量显著相关。因此,多糖的抗氧化活性不仅受单糖组成和比例的影响,还与自由基的种类有关[13]。因此,为较好的评价赤松茸多糖的体外抗氧化活性,需测定多种自由基清除活性。
本研究采用热水萃取和乙醇沉淀法,结合DEAE-52和Sepharose CL-6B色谱柱,从赤松茸中分离出酸性糖(Stropharia rugosoannulata acidic polysaccharides, SRAP),并对多糖的结构进行表征,测定其纯度、分子质量、单糖组成等,结合高碘酸氧化和Smith降解,以及刚果红实验,确定多糖的基本结构。同时从DPPH自由基、ABTS阳离子自由基和羟自由基清除能力3个方面评价了SRAP的抗氧化活性。研究旨在能够进一步解释赤松茸多糖的生物活性与其结构之间的关联,为博爱赤松茸多糖的开发提供科学依据,推动赤松茸多糖在功能性食品和潜在药物领域的开发与应用。
赤松茸,购自博爱县祥竹种植专业合作社赤松茸种植基地,采收于2023年6月。
葡聚糖(T-3、T-10、T-50、T-70和T-110),上海源叶生物科技有限公司;半乳糖、甘露醇、阿拉伯糖、鼠李糖、木糖、葡萄糖,葡萄糖醛酸、半乳糖醛酸,北京索莱宝科技有限公司;氢氧化钠、氯化钠、过硫酸钾、正丁醇,天津市大茂化学试剂厂;苯酚、四硼酸钠、三氟乙酸、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP),上海阿拉丁生化科技股份有限公司;DEAE-52纤维素,北京瑞达恒辉科技发展有限公司;高碘酸钠、琼脂糖凝胶CL-6B、乙二醇,上海麦克林生化科技股份有限公司;95%乙醇、冰醋酸、硫酸、三氯甲烷均为国产分析纯。
TU-1810紫外分光光度计,北京普析通用仪器有限责任公司;安捷伦1260高效液相色谱仪,安捷伦科技有限公司;LC-20AT高效液相色谱仪、QP2010 Ultra气相色谱-质谱联用仪,岛津企业管理(中国)有限公司;Nicolet iS20傅里叶红外光谱,美国赛默飞世尔科技公司。
1.3.1 粗多糖的提取
赤松茸粉末用乙醇提前浸泡2 h脱去脂质杂质,精密称取赤松茸粉末1 g,加入20 mL蒸馏水,放入水浴锅中2 h,温度设置为85 ℃。水浴完成后进行离心,4 000 r/min离心10 min。收集滤液,加入4倍体积95%乙醇(体积分数),4 ℃醇沉过夜,离心。沉淀复溶,浓缩至无醇味,冷冻干燥得到粗多糖。
1.3.2 粗多糖除蛋白
配制1 mg/mL粗多糖溶液,随后按体积比1∶5(Sevage:多糖溶液)加入Sevage试剂(体积比,三氯甲烷∶正丁醇=4∶1)。充分剧烈振荡该混合物20 min,以有效去除其中的变性蛋白质及伴随的有机溶剂层。随后,仔细收集澄清的上清液作为进一步处理的原料。此去杂步骤需重复进行,以确保多糖溶液的纯度与质量。测定上清液中的多糖含量及蛋白质含量,并绘制蛋白脱除曲线以确定最佳脱除次数。
1.3.2.1 多糖含量的测定
采用苯酚硫酸法测多糖含量。配制不同浓度的葡萄糖溶液,依次加入5%(质量分数)苯酚1.0 mL和浓硫酸5.0 mL,在室温下静置25 min后测其处的吸光度,绘制标准曲线。
1.3.2.2 可溶性蛋白质含量的测定
采用考马斯亮蓝法对蛋白含量进行测定。实验过程中配制一系列浓度梯度的牛血清白蛋白标准溶液,随后向各溶液中分别加入5 mL的考马斯亮蓝G-250染色剂,确保充分混合后静置5 min,以促进颜色反应的完成。利用分光光度计在595 nm下精确测量各溶液的吸光度值,依据所得数据绘制出标准曲线。
1.3.3 多糖的纯化
1.3.3.1 DEAE-52纤维柱纯化
选取1.6 cm×30 cm的层析柱,装入DEAE-52纤维素,通过梯度洗脱分离纯化粗多糖。NaCl梯度洗脱浓度分别设定为0、0.1、0.2、0.4、0.6 mol/L。洗脱流速1 mL/min,每管5 mL,每个梯度洗脱24管,多糖含量采用硫酸苯酚法检测。收集组分,用蒸馏水透析(截留分子质量为3 500 Da)多糖溶液,然后冷冻干燥。
1.3.3.2 Sepharose CL-6B凝胶柱纯化
经DEAE-52纤维柱纯化得到的组分进一步用Sepharose CL-6B凝胶柱进行洗脱,各组分分别溶于少量蒸馏水中,装样,柱规格为1.6 cm×30 cm,洗脱液为蒸馏水,洗脱速度为1 mL/min,收集洗脱液用苯酚硫酸法测定多糖含量。
1.3.4 分子质量
分子质量使用高效凝胶渗透色谱法进行测定分析[14]。该测定在配备TSK-gel G4000PWXL色谱柱和示差检测器(refractive index detector,RID)的安捷伦1260系统上进行。待测多糖样品配成1 mg/mL的溶液,过膜后进行测定。色谱条件:流动相为超纯水,流速为0.5 mL/min,柱温为35 ℃,进样体积20 μL,RID温度为40 ℃,洗脱时间为30 min。根据使用标准葡聚糖T系列(T-3、T-10、T-40、T-70和T-110)建立的校准曲线测定多糖的分子质量。
1.3.5 单糖组成
单糖组成参照文献方法稍作修改[15]。5 mg多糖样品置于1 mL 2 mol/L的三氟乙酸溶液中,120 ℃的条件下反应6 h。待水解反应完成后,将上述产物与500 μL 0.3 mol/L NaOH和500 μL PMP溶液(871.0 mg PMP溶解在10.0 mL甲醇中)混合,在黑暗中70 ℃水浴加热1 h,随后用0.3 mol/L的HCl进行中和处理。最后使用等量的氯仿对中和后的混合物进行3次萃取操作。样品过膜后,通过高效液相色谱进行分析测定。色谱条件:采用Agilent Eclipse XDB-C18柱(4.6 mm×250 mm×5 μm),流动相组成为0.1 mol/L乙酸钠溶液与乙腈(82∶18,体积比),流速设定为1.0 mL/min,柱温控制在30 ℃。
1.3.6 紫外光谱分析
配制1 mg/mL多糖溶液,并使用紫外分光光度计在200~400 nm区间内扫描,细致观察并记录所得吸收曲线的变化趋势。
1.3.7 傅里叶变换红外光谱分析
准确称取1 mg的干燥样品,随后将其与100 mg的溴化钾粉末充分混合,以确保两者均匀分散。之后,利用适当的压片机将混合物压制成透明、均一的薄片,在4 000~400 cm-1范围内在光谱仪上进行傅立叶变换红外光谱分析。
1.3.8 高碘酸氧化和Smith降解
1.3.8.1 高碘酸氧化
高碘酸氧化反应参照文献的方法稍作修改[16]。配制浓度为30 mmol/L的高碘酸钠,稀释成不同浓度,测定223 nm下的吸光度,绘制高碘酸洗脱曲线。取10 mg多糖样品溶解在30 mmol/L高碘酸钠溶液中,配制成20 mL,并在4 ℃的黑暗中培养,每隔12 h测定吸光度。当吸光度保持不变时,说明反应稳定,加入2 mL乙二醇混合以终止反应。所得甲酸用0.01 mol/L氢氧化钠溶液进行3次滴定。计算消耗高碘酸的量和甲酸生成量。残留溶液用蒸馏水透析48 h,以进行Smith降解。
1.3.8.2 Smith降解
Smith降解参考文献[16]的方法稍作修改。简言之,取高碘酸氧化多糖溶液,加入30 mg NaBH4,于4 ℃暗处反应12 h。反应后,用冰醋酸调至pH 5.5。冻干处理,随后用三氟乙酸在120 ℃下水解6 h。经浓缩干燥,多次甲醇洗涤去酸后,将产物、赤藓醇及甘油进行糖醇衍生化,最后进行色谱分析。
1.3.9 刚果红实验
多糖的构象结构是参照文献[17]方法稍作修改。将2 mL的0.5 mg/mL多糖溶液与等体积的200 μmol/L刚果红溶液混合,充分搅拌后,逐步加入1 mol/L氢氧化钠溶液,以调整至不同的最终氢氧化钠浓度。测定了不同氢氧化钠浓度下多糖+刚果红和刚果红的最大吸收波长(λmax),来确定多糖是否有三螺旋结构。
1.3.10 碘-碘化钾实验
取SRAP溶液(质量浓度1 mg/mL)2 mL,与碘试剂(由0.02% I2溶于0.2% KI中配制,均为质量分数)1.2 mL混合均匀。随后,在300~800 nm区间内,对该混合溶液进行光谱扫描分析。
1.3.11 抗氧化能力测定
1.3.11.1 DPPH自由基清除率的测定
用无水乙醇配制0.1 mmol/L的DPPH溶液,避光保存。取不同浓度的多糖溶液100 μL,加入100 μL DPPH乙醇溶液,避光反应30 min,测定515 nm下的吸光度得A1。无水乙醇替代DPPH乙醇溶液测吸光度得A2,蒸馏水替代多糖溶液得A0。其计算如公式(1)所示:
清除率![]()
(1)
1.3.11.2 ABTS阳离子自由基清除率的测定
将7 mmol/L的ABTS溶液和5 mmol/L的过硫酸钾溶液等体积混合,避光保存12~16 h,得ABTS自由基储存液。使用前稀释使其在734 nm下吸光度为0.70±0.02,取不同浓度的多糖溶液0.2 mL,加入3.8 mL ABTS阳离子自由基稀释液,摇晃后反应6 min,测定734 nm下的吸光度得A1。蒸馏水替代ABTS测吸光度得A2,蒸馏水替代多糖溶液得A0。其计算如公式(2)所示:
清除率![]()
(2)
1.3.11.3 羟自由基清除率的测定
参照羟自由基试剂盒说明书的方法测定多糖样品对羟自由基清除活性[18]。
使用IBM SPSS Statistics 24软件对数据进行统计学分析,并用Origin 2018软件绘图。
2.1.1 蛋白脱除曲线
赤松茸通过水提醇沉初步得到赤松茸粗多糖,然后采用Sevage法脱除蛋白,赤松茸多糖除蛋白脱除曲线如图1所示。由图1可知,为了最大程度地脱除蛋白,且多糖损失率最小,赤松茸多糖的最佳脱除次数为4次。赤松茸粗多糖经4次脱除蛋白后进行旋蒸浓缩、冻干,放入干燥器中以备后续实验。
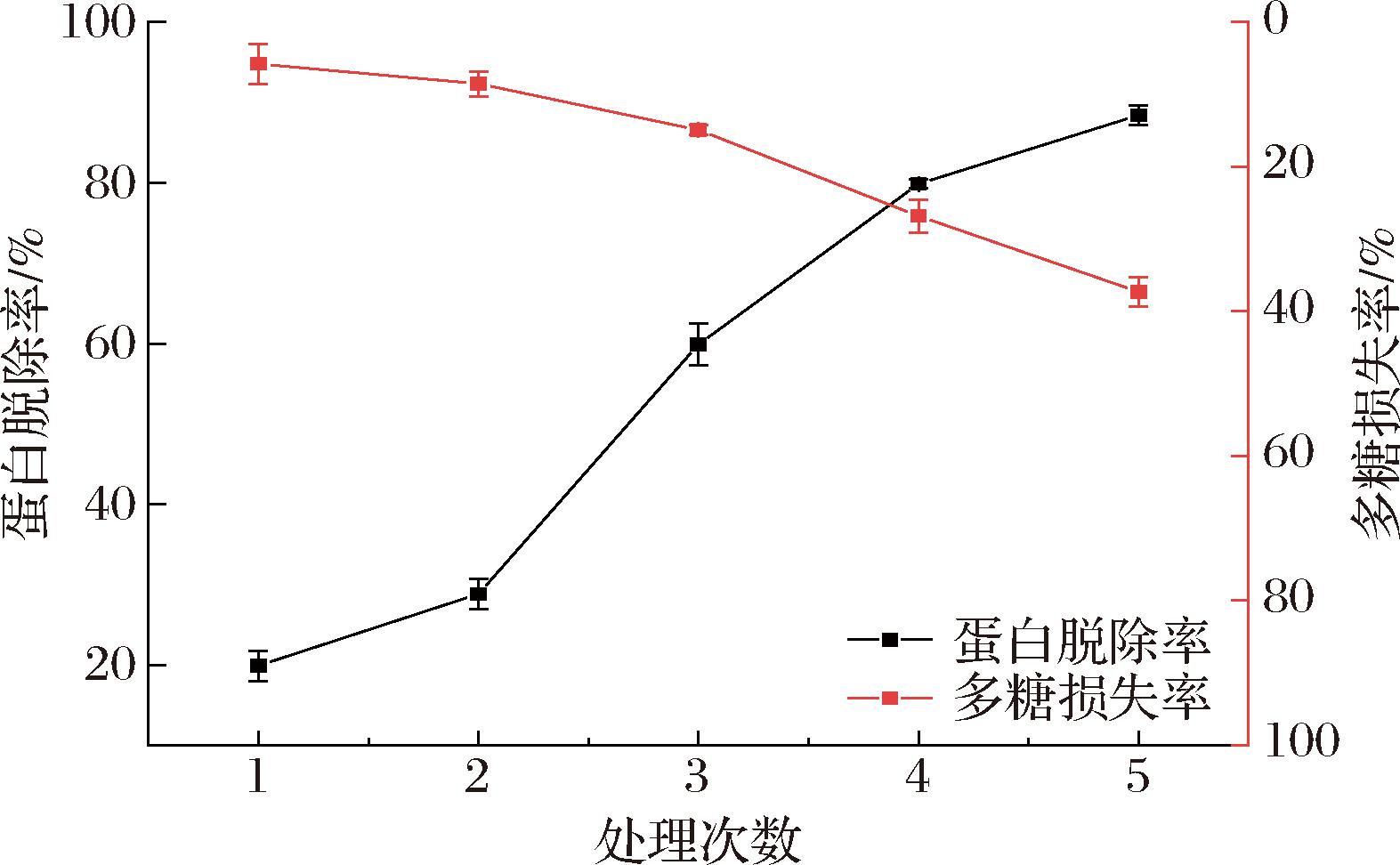
图1 赤松茸粗多糖的蛋白脱除效果
Fig.1 Removal effect of crude polysaccharide protein from Stropharia rugosoannulata
2.1.2 洗脱曲线
赤松茸粗多糖经过除蛋白后,利用DEAE-52纤维素离子层析柱进行洗脱分离,结果如图2-A所示。赤松茸粗多糖在DEAE-52纤维素柱上主要出现2个洗脱峰,收集适合的洗脱峰得到2个组分,分别为水洗脱出的中性糖(SRP-1)和0.1 mol/L NaCl洗脱出的酸性糖[19](SRP-2)。目前发现对赤松茸中性糖的研究较多且较为全面,而对酸性糖的研究偏少,因此我们对赤松茸酸性糖(SRP-2)进行进一步的纯化和研究。通过Sepharose CL-6B柱对酸性糖SRP-2进行洗脱,结果如图2-B所示。SRP-2经洗脱后得到赤松茸酸性糖SRAP。
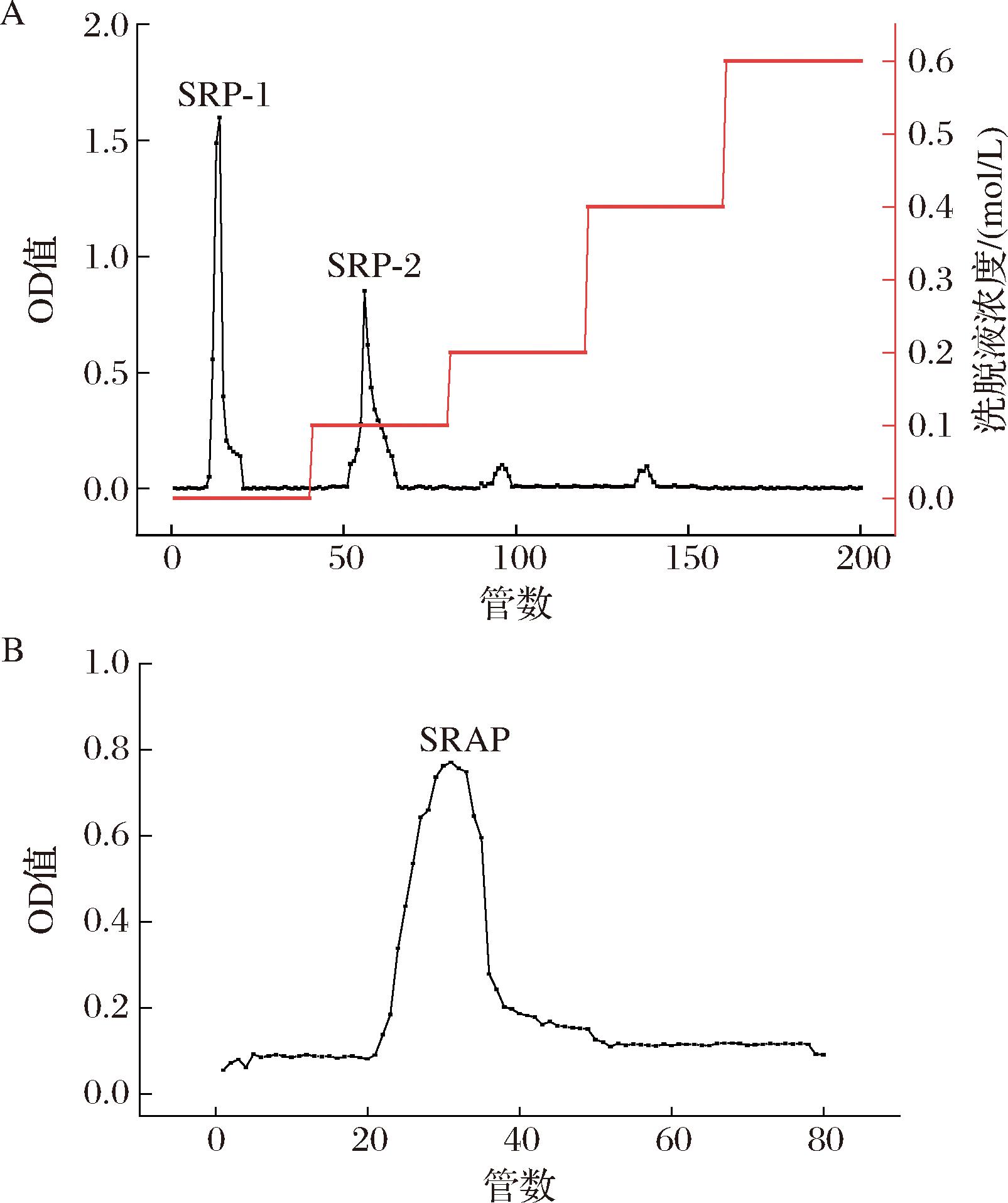
A-DEAE-52纤维素柱洗脱曲线;B-Sepharose CL-6B柱洗脱曲线
图2 赤松茸多糖的洗脱曲线
Fig.2 Elution curve of polysaccharides from Stropharia rugosoannulata
SRAP的分子质量谱图如图3所示,显示一个单一且对称的的峰,表明SRAP为分子质量均一的多糖。通过测定和计算得出,葡聚糖的标准曲线为log Mw=-0.516 8x+13.656(R2=0.999 2),将出峰时间17.891 min带入标曲,得出SRAP的分子质量为2.57×104 Da。耿敏等[20]分离纯化出了食用菌姬松茸酸性糖,其分子质量为3.6×105 Da。其远大于SRAP的分子质量,这说明SRAP为分子质量较低的食用菌酸性糖。
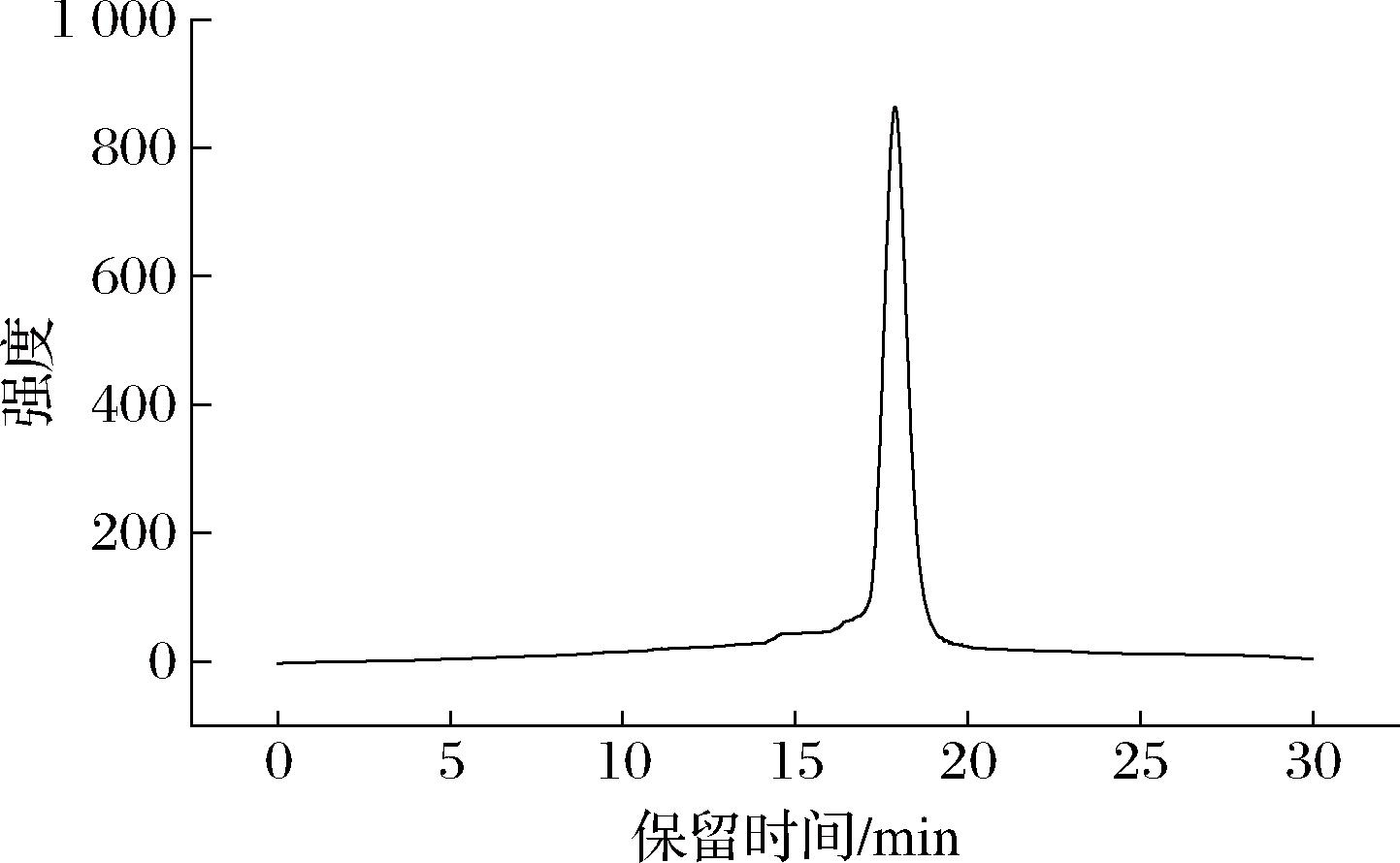
图3 SRAP的分子质量谱图
Fig.3 Molecular weight profile of SRAP
SRAP的化学组成和单糖组成如表1所示。由表1可知,SRAP的总糖含量为(88.47±0.74)%,总糖含量高于85%,表明SRAP为纯度较高的多糖。SRAP的蛋白质含量为(0.61±0.11)%,说明除蛋白的效果较好。单糖组成的结果表明,SRAP由甘露糖、葡萄糖醛酸、葡萄糖和半乳糖组成,其中半乳糖的含量最高(69.38%),其次为葡萄糖(17.88%)和甘露糖(12.25%),还含有微量的葡萄糖醛酸(0.49%)。商佳琦等[21]发现5种食用菌多糖均含有葡萄糖、半乳糖和甘露糖,SRAP的单糖组成结果与此一致。SRAP含有葡萄糖醛酸这一酸性糖特征性组成成分,所以初步确定为酸性糖,这与SRAP是在DEAE柱材料下NaCl溶液洗脱出来的结果一致。
表1 SRAP的化学组成和单糖组成
Table 1 Chemical composition and monosaccharide composition of SRAP

指标单糖名称含量/%总糖 88.47±0.74蛋白质0.61±0.11甘露糖 12.25单糖 葡萄糖醛酸0.49葡萄糖 17.88半乳糖 69.38
核酸在紫外光谱中,其最大吸收峰常位于260 nm处;而蛋白质则通常在280 nm处展现其紫外吸收的最大值;至于多肽,其紫外吸收特性则表现为在420 nm附近达到吸收高峰。为了评价SRAP中是否含有蛋白质、核酸和多肽,对SRAP进行了全波长扫描(200~600 nm)。SRAP的紫外光谱图如图4所示,在紫外光谱波长为260、280、420 nm时,SRAP不具有紫外吸收峰,这说明SRAP中不含有核酸、蛋白质以及多肽,这一结果说明Savage法除蛋白效果较好,与蛋白质含量的测定结果也一致。
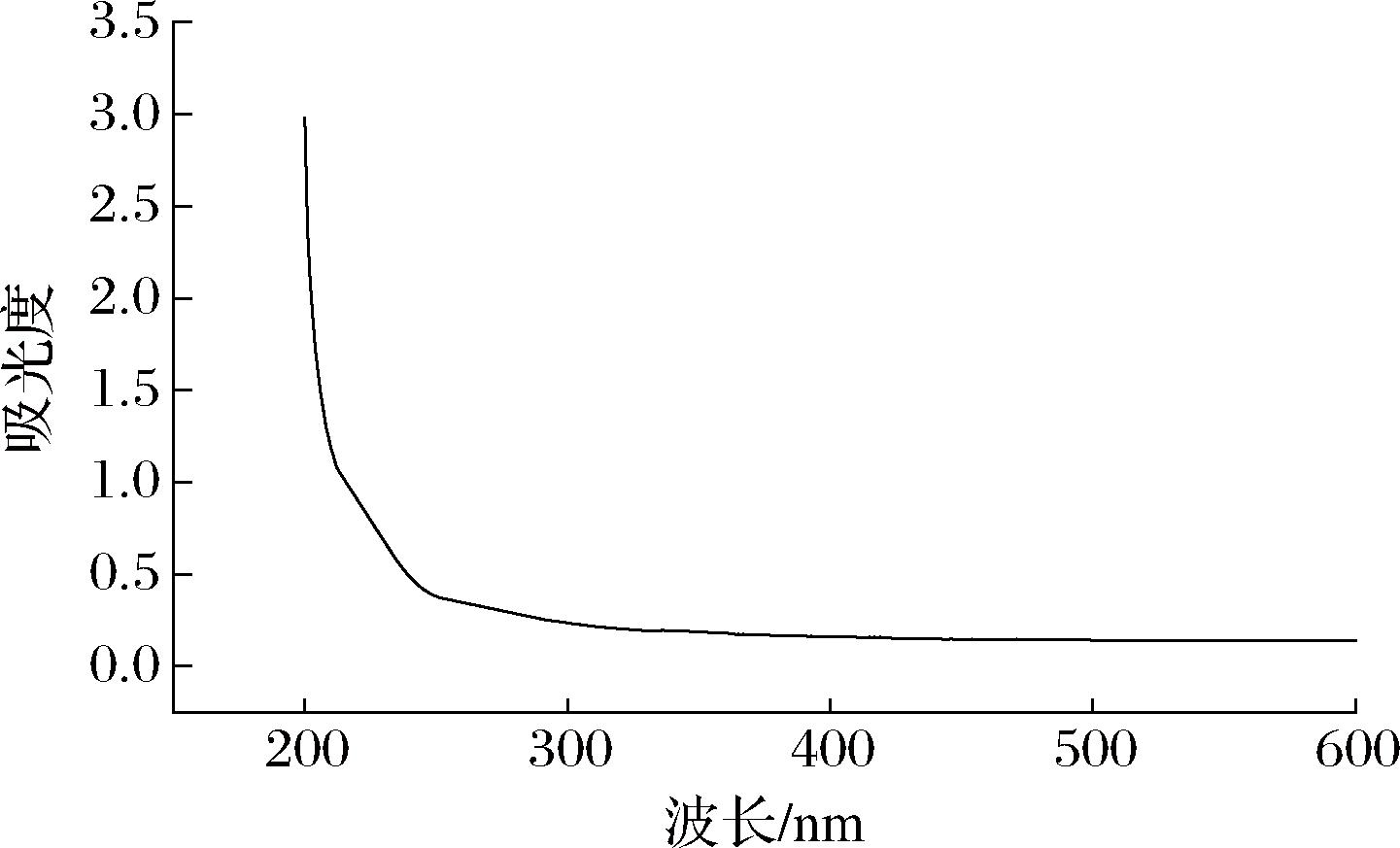
图4 SRAP的紫外光谱图
Fig.4 Ultraviolet spectra of SRAP
图5展示了SRAP在红外光谱范围内(4 000~400 cm-1)的特征图谱。其中,3 420 cm-1处的强吸收峰是O—H键伸缩振动的典型表现,而2 930 cm-1的吸收峰则反映了多糖特有的C—H键伸缩振动。此外,1 725 cm-1处的吸收峰揭示了酯羧基的存在[22],进一步确认了SRAP中糖醛酸的成分,这与单糖组成有葡糖糖醛酸的结果一致。红外光谱图中,1 648 cm-1的吸收峰归属于结合水(H—O—H)的伸缩振动,而1 395 cm-1处的峰则体现了多糖C—H键的弯曲振动特性。另外,1 146 cm-1和1 078 cm-1的吸收峰可能源于葡萄糖苷键的C—O—C拉伸振动或侧链C—O—H的弯曲振动,这些特征证明了SRAP中存在吡喃糖结构[23]。值得注意的是,890 cm-1和925 cm-1区域内未观察到明显的吸收峰,但吡喃糖的典型吸收峰明显出现在623 cm-1左右[24],这进一步证实了SRAP由吡喃糖组成而不是呋喃糖。
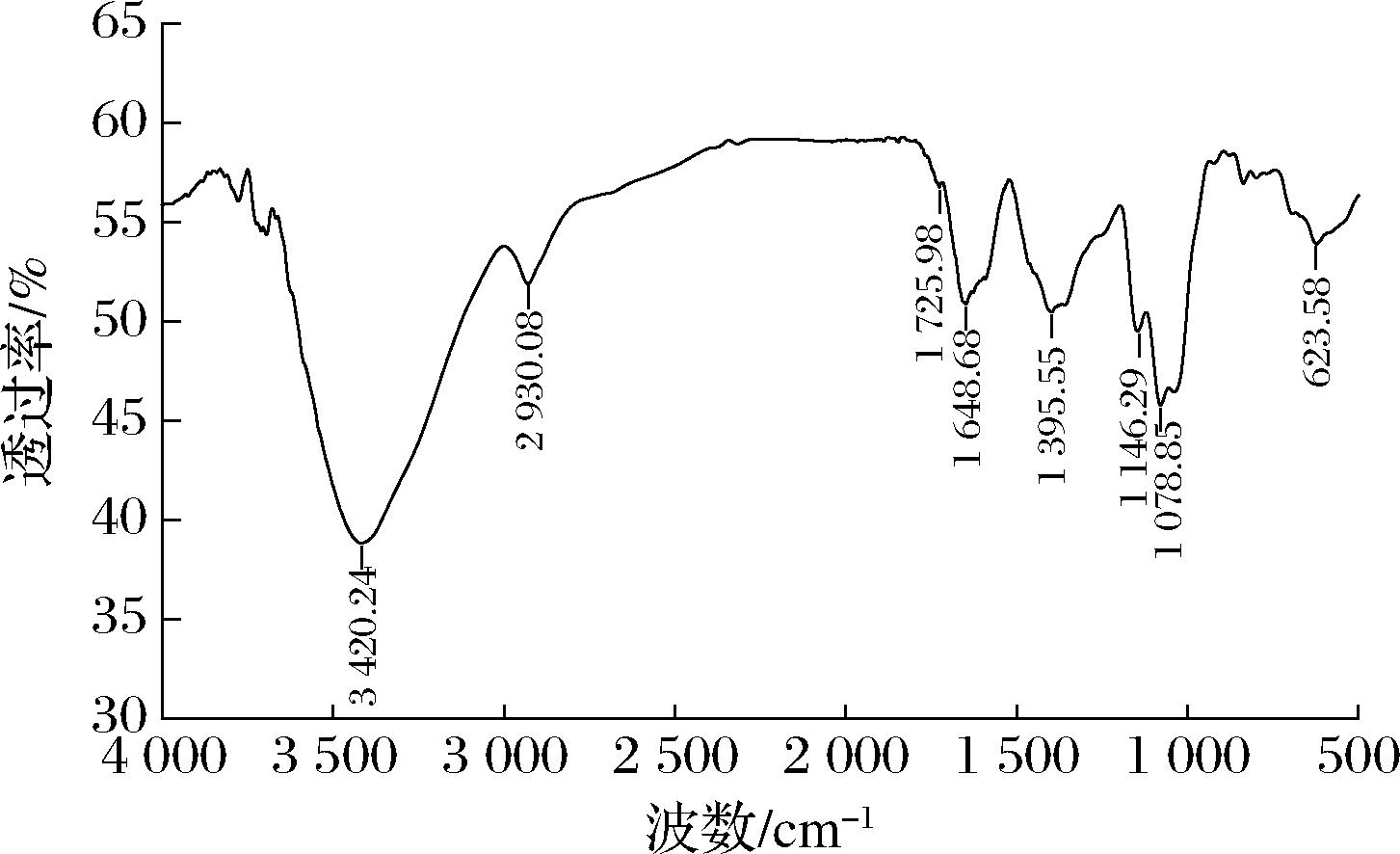
图5 SRAP的红外光谱图
Fig.5 Infrared spectra of SRAP
通过高碘酸氧化实验,得到高碘酸钠消耗量的标准曲线:y=8.981 4x+0.208 4(R2=0.999 4)。SRAP被高碘酸氧化,96 h时,吸光度趋于平稳(图6)。SRAP经高碘酸氧化和滴定实验得出,每消耗0.08 mmol高碘酸钠产生0.01 mmol甲酸。在SRAP的反应过程中,高碘酸钠的消耗伴随甲酸的产生,这是1→或1→6糖苷键存在的标志[25]。若高碘酸钠的消耗量明显超出甲酸生成量的2倍,则可能意味着反应中涉及了特殊类型的糖苷键,如1→2或1→2,6或1→4或1→4,6连接,这些糖苷键在反应中仅消耗高碘酸钠而不产生甲酸[26]。SRAP经Smith降解后的色谱图如图7所示。甘油的存在说明存在1→2或1→6连接的糖苷键。甘露糖和葡萄糖的存在,说明存在不能被高碘酸氧化的1→3或1→3,6或1→2,3或1→2,4或1→3,4或1→2,3,4连接的糖苷键[27]。高碘酸氧化和Smith降解的结果表明SRAP可能含有(1→或1→6)、(1→2或1→2,6或1→4或1→4,6)以及(1→3或1→3,6或1→2,3或1→2,4或1→3,4或1→2,3,4)连接的糖苷键。
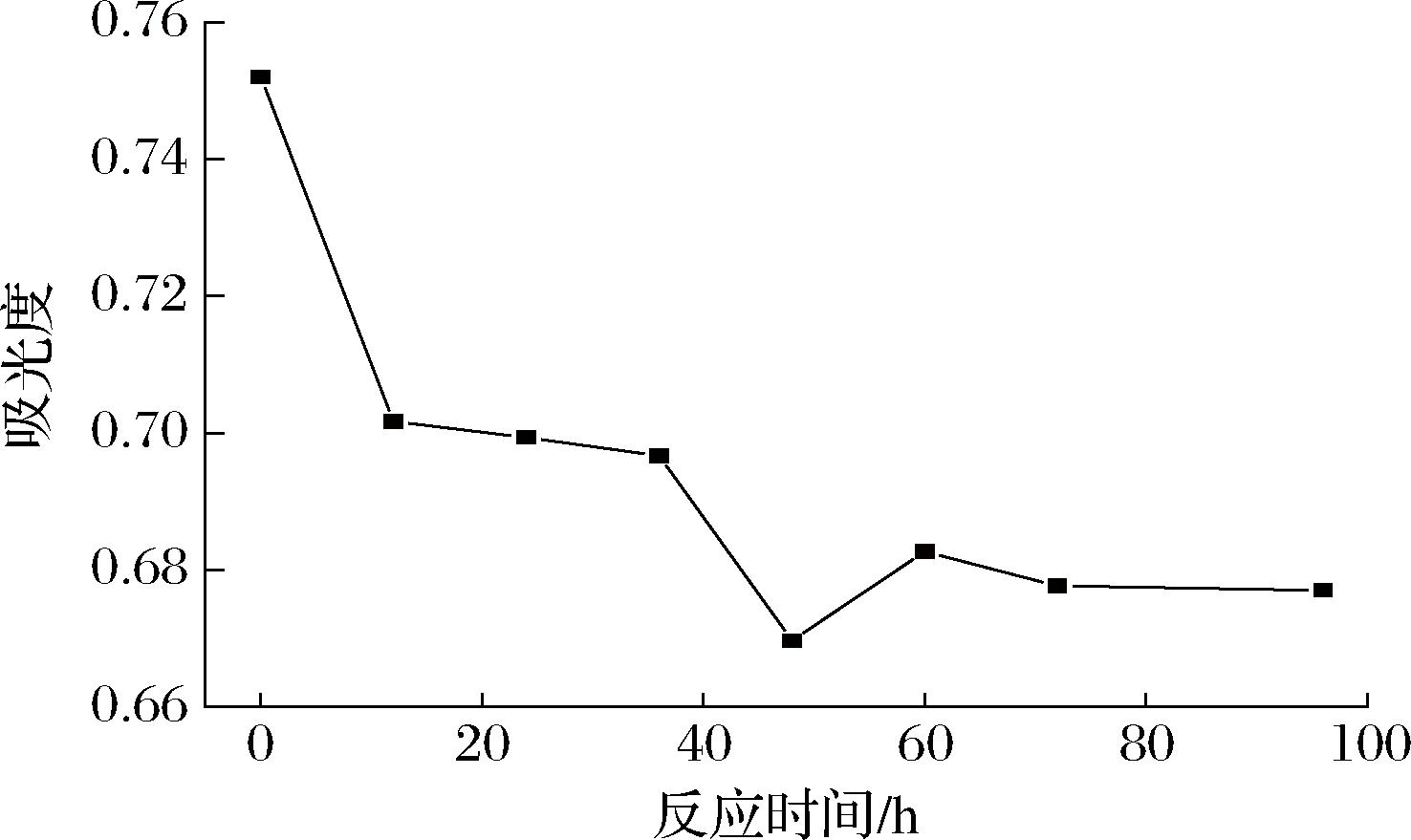
图6 SRAP的高碘酸氧化反应曲线
Fig.6 Curve of periodic acid in oxidation of SRAP
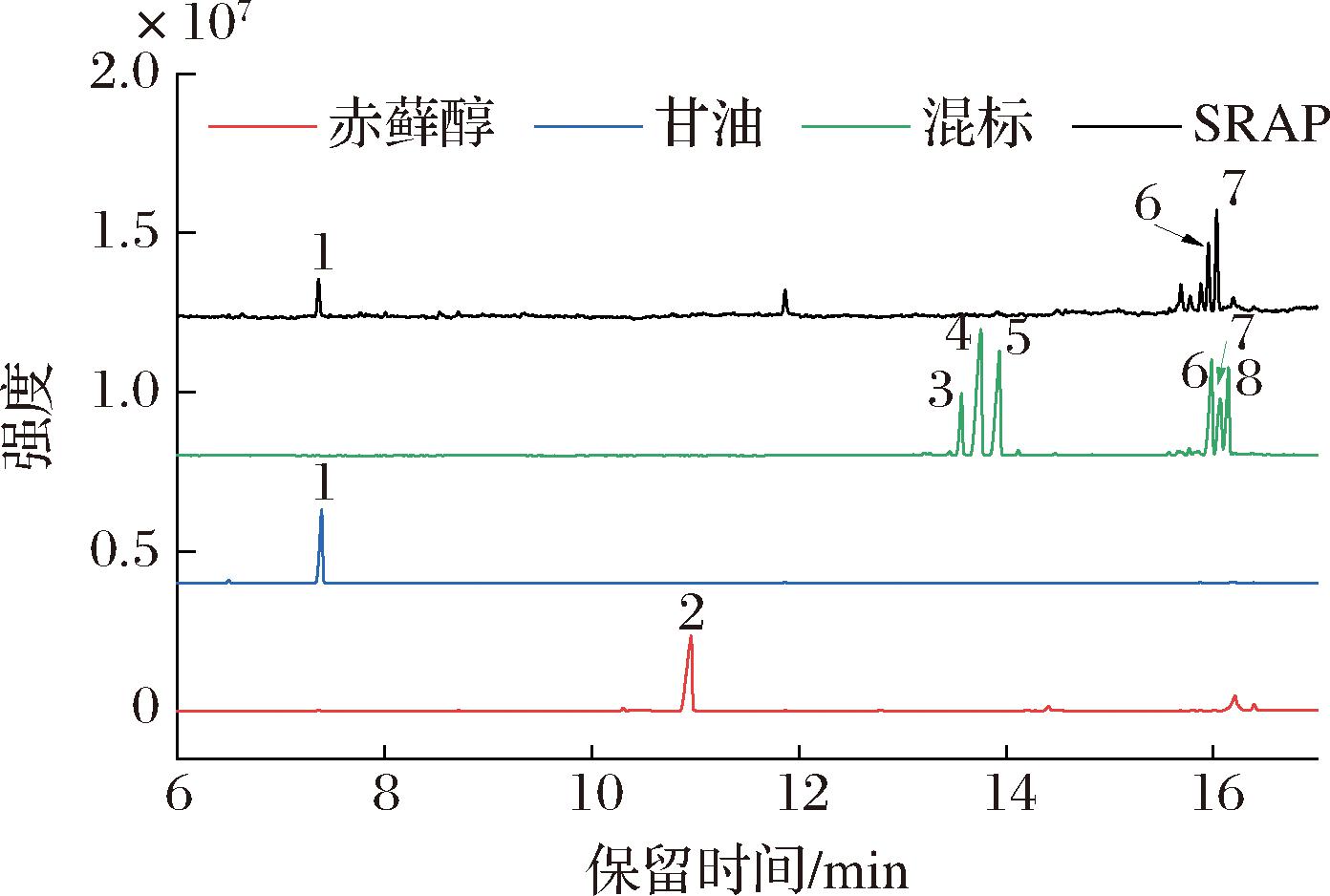
图7 赤藓醇、甘油、单糖混标及SRAP样品的色谱图
Fig.7 Chromatogram of erythritol, glycerol, monosaccharide mixed standard and SRAP sample
注:1-甘油,2-赤藓醇,3-鼠李糖,4-阿拉伯糖,5-木糖,6-甘露糖,7-葡萄糖,8-半乳糖。
刚果红是一种典型的酸性染料,能够展现出独特的三螺旋结构识别能力。在特定的弱碱性环境中,含有三螺旋结构的多糖样品能够与刚果红发生络合反应,形成稳定的复合物。这一反应的结果是,与单独的刚果红染料相比,形成的络合物在光谱分析中表现出最大吸收波长的红移现象,即吸收峰向长波长方向移动。在强碱性溶液中,三螺旋结构被破坏,这可能会削弱红移效应。SRAP与刚果红的相互作用如图8所示,在0~0.5 mol/L时,刚果红+SRAP络合物的最大吸收波长呈先下降后平衡趋势,并没有发生红移,说明SRAP没有三螺旋结构。三螺旋和立体构象对于多糖的生物活性并非必不可少的,如WU等[28]的研究表明没有三螺旋结构的多糖也具有较强的生物活性。
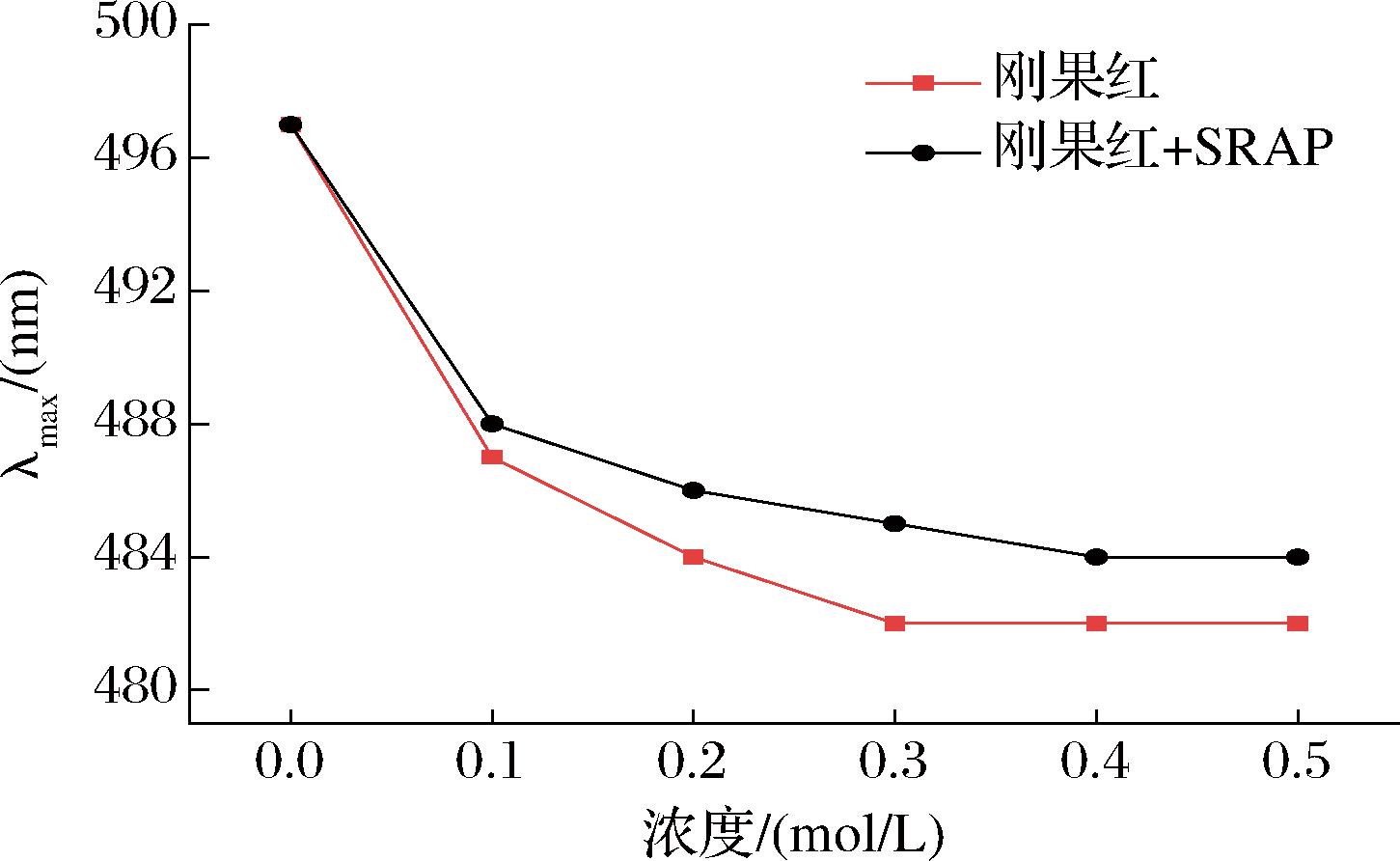
图8 刚果红与SRAP复合物在不同浓度氢氧化钠溶液下的最大吸收波长
Fig.8 The maximum absorption wavelength of Congo red and SRAP complex at various concentrations of NaOH solution
SRAP与碘试剂混匀后紫外吸收光谱如图9所示,SRAP与碘试剂的反应物最大吸收峰在350 nm,而565 nm并没有最大吸收,说明SRAP可能具有高度分支结构,而短侧链较少[29]。这与高碘酸氧化和Smith降解实验表明SRAP有较多的糖苷键连接方式的结果一致。
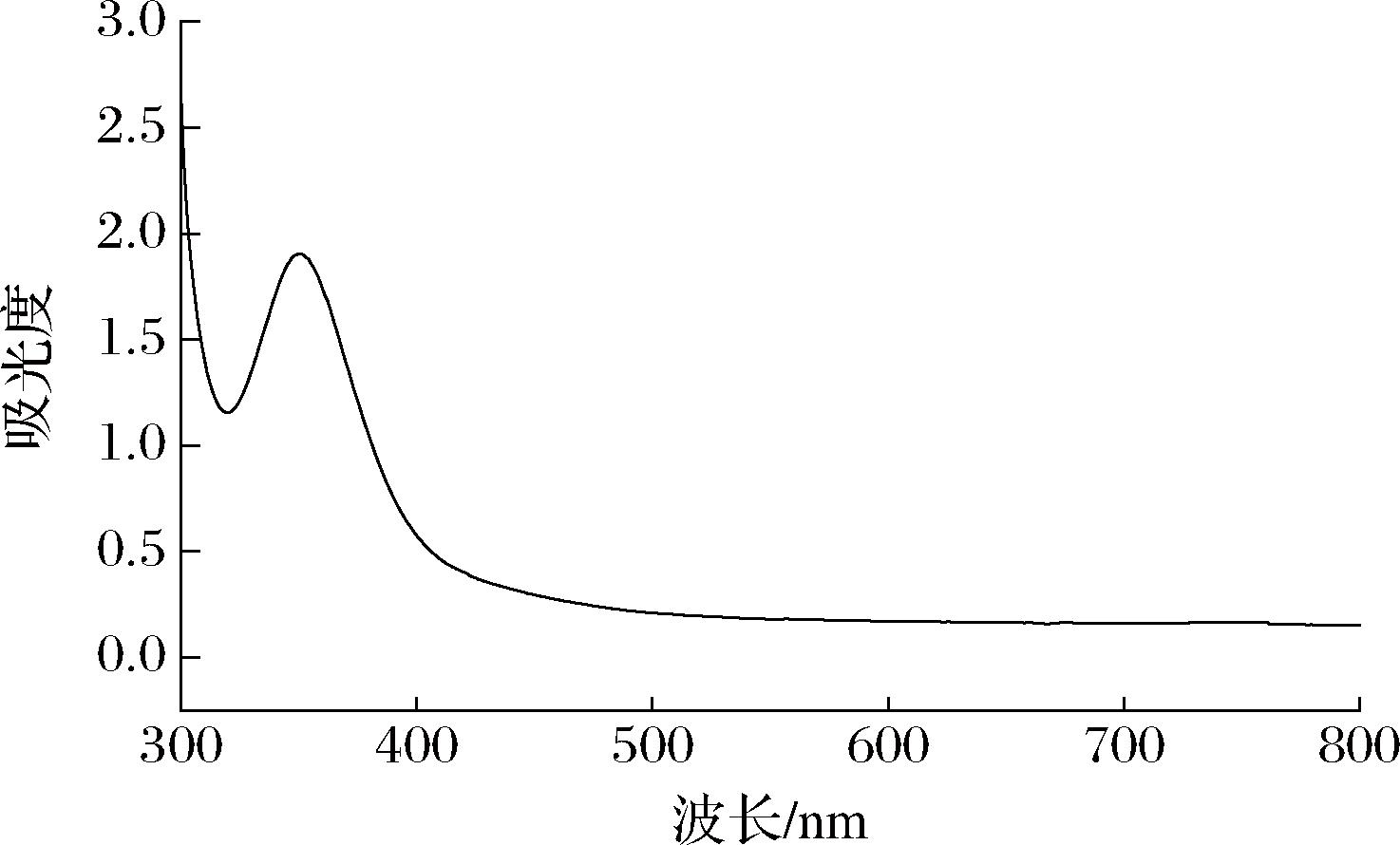
图9 SRAP与碘-碘化钾反应的紫外吸收光谱
Fig.9 UV absorption spectrum of SRAP after reaction with KI-I2
SRAP的抗氧化活性如图10所示。如图所示,随着质量浓度提升至2.5 mg/mL,DPPH自由基、ABTS阳离子自由基和羟自由基的清除率均展现出显著的上升趋势,分别达到特定的高效水平(91.13±1.08)%、(76.75±0.97)%和(73.19±2.05)%,说明SRAP的DPPH自由基、ABTS阳离子自由基和羟自由基清除能力较好。但在实验剂量范围内,SRAP对DPPH自由基、ABTS阳离子自由基和羟自由基清除率均低于抗坏血酸。计算得到SRAP对DPPH自由基、ABTS阳离子和羟自由基清除率的IC50值分别为0.34、0.79、1.18 mg/mL。一般来说,含有一定量的糖醛酸的酸性多糖是一种有效的抗氧化剂。这与SRAP含有葡萄糖醛酸,且抗氧化效果较好的结果一致。WANG等[30]发现,低分子质量多糖比高分子质量多糖具有更高的抗氧化活性。CHEN等[8]的综述说明可能富含半乳糖的多糖具有更好的抗氧化活性。因此SRAP的抗氧化能力较好可能是由于其分子质量较低和含有较高比例的半乳糖。研究表明,多糖的分子质量、单糖组成、糖苷连接、分支程度和高级构象与其抗氧化活性密切相关[9,31]。其中1→4、1→6和1→3糖苷键是抗氧化多糖结构中常见的糖苷键连接方式[8],SRAP较强的自由基清除能力可能由于含有上述的糖苷键,此外还可能与α和β糖苷键的连接方式有关。因此SRAP的抗氧化能力还需结合更详细的结构特征来解释问题。
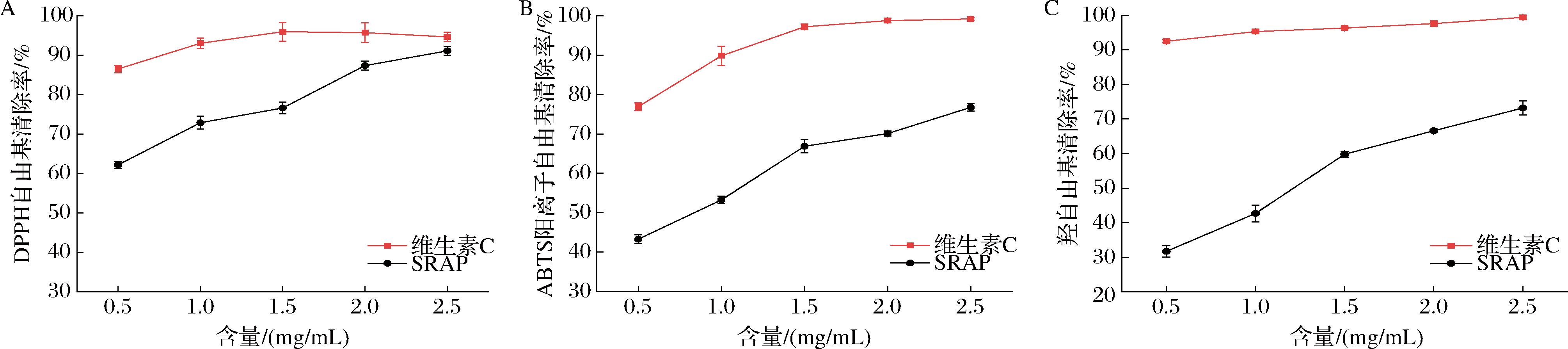
A-SRAP对DPPH自由基的清除率;B-SRAP对ABTS阳离子自由基的清除率;C-SRAP对羟自由基的清除率
图10 SRAP的抗氧化活性
Fig.10 Antioxidant activities of SRAP
经水提醇沉、除蛋白以及DEAE-52层析和Sepharose CL-6B层析得到均一组分SRAP,分子质量为2.57×104 Da,总糖含量为(88.47±0.74)%,紫外光谱扫描结果表明不含蛋白质、核酸和多肽。红外和单糖组成都表明了SRAP为酸性糖,由甘露糖、葡萄糖醛酸、葡萄糖和半乳糖组成。刚果红和碘-碘化钾反应表明SRAP不具有三螺旋结构,可能含有较多的侧链和分支。高碘酸氧化和Smith降解的结果表明SRAP可能含有(1→或1→6)、(1→2或1→2,6或1→4或1→4,6)以及(1→3或1→3,6或1→2,3或1→2,4或1→3,4或1→2,3,4)连接的糖苷键。体外抗氧化的结果表明SRAP具有较强的DPPH自由基、ABTS阳离子自由基和羟自由基清除能力,这可能是由于其分子质量较低和含有较高比例的半乳糖。SRAP具体的糖苷键连接方式还需要结合甲基化和核磁共振进一步解析验证。本研究进一步揭示了博爱赤松茸多糖的抗氧化活性与其结构之间的关联,为开发赤松茸多糖的应用潜力提供了一定的理论依据。
[1] HAO H, CUI C, XING Y Q, et al.Sulfation of the extracellular polysaccharide from the edible fungus Stropharia rugosoannulata with its antioxidant activity[J].Journal of Future Foods, 2023, 3(1):37-42.
[2] LIU Y, HU C F, FENG X, et al.Isolation, characterization and antioxidant of polysaccharides from Stropharia rugosoannulata[J].International Journal of Biological Macromolecules, 2020, 155:883-889.
[3] WANG Q, ZHAO Y L, FENG X, et al.Effects of drying on the structural characteristics and antioxidant activities of polysaccharides from Stropharia rugosoannulata[J].Journal of Food Science and Technology, 2021, 58(9):3622-3631.
[4] 陈逸湘, 徐贻宜, 李钦艳, 等.赤松茸人工栽培技术及栽培基质用量研究[J].农业与技术, 2024, 44(5):78-81.CHEN Y X, XU Y Y, LI Q Y, et al.Research on the artificial cultivation techniques and cultivation medium dosage of Stropharia rugosoannulata[J].Agriculture and Technology, 2024, 44(5):78-81.
[5] HU S, FENG X, HUANG W, et al.Effects of drying methods on non-volatile taste components of Stropharia rugosoannulata mushrooms[J].LWT, 2020, 127:109428.
[6] WEI L, JING B N, LI X, et al.Evaluation of nutritional ingredients, biologically active materials, and pharmacological activities of Stropharia rugosoannulata grown under the bamboo forest and in the greenhouse[J].Journal of Food Quality, 2021, 2021(1):5478227.
[7] 魏磊, 王伟, 谢晓阳, 等.响应面优化博爱赤松茸多糖提取工艺及其抑菌和抗氧化活性研究[J].食品工业科技, 2023, 44(15):213-220.WEI L, WANG W, XIE X Y, et al.Optimization of extraction process of polysaccharides from Stropharia rugosoannulata in Bo’ai county by response surface method and evalation of their antibacterial and antioxidant activity[J].Science and Technology of Food Industry, 2023, 44(15):213-220.
[8] CHEN N, JIANG T Y, XU J X, et al.The relationship between polysaccharide structure and its antioxidant activity needs to be systematically elucidated[J].International Journal of Biological Macromolecules, 2024, 270:132391.
[9] TIAN J F, ZHANG Z, SHANG Y H, et al.Extraction, structure and antioxidant activity of the polysaccharides from morels (Morchella spp.):A review[J].International Journal of Biological Macromolecules, 2024, 264(Pt 2):130656.
[10] WANG Y, LI X, ZHAO P, et al.Physicochemical characterizations of polysaccharides from Angelica Sinensis Radix under different drying methods for various applications[J].International Journal of Biological Macromolecules, 2019, 121:381-389.
[11] YI J P, LI X, WANG S, et al.Steam explosion pretreatment of Achyranthis bidentatae radix:Modified polysaccharide and its antioxidant activities[J].Food Chemistry, 2022, 375:131746.
[12] FENG Y Q, JULIET I C, WEN C T, et al.Effects of multi-mode divergent ultrasound pretreatment on the physicochemical and functional properties of polysaccharides from Sagittaria sagittifolia L.[J].Food Bioscience, 2021, 42:101145.
[13] WANG Z C, ZHENG Y, LAI Z R, et al.Effect of monosaccharide composition and proportion on the bioactivity of polysaccharides:A review[J].International Journal of Biological Macromolecules, 2024, 254(Pt 2):127955.
[14] TIAN W L, SONG X L, WANG F S, et al.Study on the preparation and biological activities of low molecular weight squid ink polysaccharide from Sepiella maindroni[J].International Journal of Biological Macromolecules, 2023, 237:124040.
[15] FAN H T, SUN M, LI J, et al.Structure characterization and immunomodulatory activity of a polysaccharide from Saposhnikoviae Radix[J].International Journal of Biological Macromolecules, 2023, 233:123502.
[16] 李瑶, 熊彩明, 张佳乐, 等.磷酸化裙带菜多糖的制备及结构表征和生物活性分析[J].食品科学, 2024, 45(7):35-42.LI Y, XIONG C M, ZHANG J L, et al.Preparation, structural characterization and biological activity of phosphorylated polysaccharide from Undaria pinnatifida suringar[J].Food Science, 2024, 45(7):35-42.
[17] 任国瑞, 刘瑾, 赵紫玉, 等.库尔勒香梨中性多糖结构及其抗氧化抗过敏性哮喘活性研究[J].中国食品添加剂, 2024, 35(5):123-133.REN G R, LIU J, ZHAO Z Y, et al.Structure analysis of neutral polysaccharide from Pyrus sinkiangensis Yu.and its antioxidant and anti-allergic asthma activities[J].China Food Additives, 2024, 35(5):123-133.
[18] 杨敏, 周蕊, 奚军伟.青海藜麦总黄酮及多酚共提工艺及其抗氧化活性[J].中南农业科技, 2023, 44(8):62-67.YANG M, ZHOU R, XI J L.The co extraction process of total flavonoids and polyphenols from Chenopodium quinoa Willd.in Qinghai and its antioxidant activity[J].South-Central Agricultural Science and Technology, 2023, 44(8):62-67.
[19] 陈梦丝. 素花党参药用部位和非药用部位酸性多糖的提取纯化、抗氧化活性评价及结构解析[D].成都:四川农业大学, 2022.CHEN M S.Extraction and purification, structural feature and antioxidant activities of polysaccharides from different parts of Codonopsis pilosula var.modesta (Nannf.) L.T.Shen[D].Chengdu:Sichuan Agricultural University, 2022.
[20] 耿敏, 李晓婧, 王嘉怿, 等.食用菌姬松茸多糖的分离纯化及结构分析[J].东北师大学报(自然科学版), 2024, 56(1):115-124.GENG M, LI X J, WANG J Y, et al.Isolation, purification, and structural analysis of Agadcus blazei Murill polysaccharides from edible fungi[J].Journal of Northeast Normal University (Natural Science Edition), 2024, 56(1):115-124.
[21] 商佳琦, 邹丹阳, 滕翔宇, 等.5种食用菌多糖的结构特征及抗氧化活性对比[J].食品工业科技, 2020, 41(15):77-83;89.SHANG J Q, ZOU D Y, TENG X Y, et al.Structural characterization and antioxidant activity of five kinds of edible fungus polysaccharides[J].Science and Technology of Food Industry, 2020, 41(15):77-83;89.
[22] ZENG F K, CHEN W B, HE P, et al.Structural characterization of polysaccharides with potential antioxidant and immunomodulatory activities from Chinese water chestnut peels[J].Carbohydrate Polymers, 2020, 246:116551.
[23] ZHANG Y, LIU Y H, NI G Y, et al.Sulfated modification, basic characterization, antioxidant and anticoagulant potentials of polysaccharide from Sagittaria trifolia[J].Arabian Journal of Chemistry, 2023, 16(7):104812.
[24] SONG J X, WU Y, JIANG G Q, et al.Sulfated polysaccharides from Rhodiola sachalinensis reduce D-gal-induced oxidative stress in NIH 3T3 cells[J].International Journal of Biological Macromolecules, 2019, 140:288-293.
[25] 顾嘉楠, 刘桂馨, 李帅, 等.茯苓多糖佐剂PCP-Ⅰ及其水解寡糖的化学结构研究[J].中国中药杂志, 2023, 48(16):4429-4437.GU J N, LIU G X, LI S, et al.Structural characterization of PCP-Ⅰ from Poria as vaccine adjuvant and its hydrolytic oligosaccharide[J].China Journal of Chinese Materia Medica, 2023, 48(16):4429-4437.
[26] 王武静, 杨燕妮, 丁子禾, 等.枳壳均一多糖CALB-2结构表征及生物活性[J].中国实验方剂学杂志, 2020, 26(16):154-160.WANG W J, YANG Y N, DING Z H, et al.Structures characteristics and bioactivity of polysaccharide CALB-2 from aurantii fructus[J].Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(16):154-160.
[27] 刘艳秋, 王亚茹, 毛迪锐, 等.轮叶党参多糖的分离纯化及结构研究[J].食品与机械, 2023, 39(9):162-168;240.LIU Y Q, WANG Y R, MAO D R, et al.Isolation, purification and structure analysis of polysaccharide from lance asiabell root[J].Food &Machinery, 2023, 39(9):162-168;240.
[28] WU J Y, ZHENG W Y, LUO P, et al.Structural characterization of a water-soluble acidic polysaccharide CSP-IV with potential anticoagulant activity from fruit pulp of Clausena lansium (Lour.) Skeels Guifei[J].International Journal of Biological Macromolecules, 2024, 254:128029.
[29] GONG Y F, MA Y X, CHEUNG P C, et al.Structural characteristics and anti-inflammatory activity of UV/H2O2-treated algal sulfated polysaccharide from Gracilaria lemaneiformis[J].Food and Chemical Toxicology, 2021, 152:112157.
[30] WANG J Q, HU S Z, NIE S P, et al.Reviews on mechanisms of in vitro antioxidant activity of polysaccharides[J].Oxidative Medicine and Cellular Longevity, 2016, 2016(1):5692852.
[31] 冀晓龙, 郭建行, 田静源, 等.植物多糖降解方法及降解产物特性研究进展[J].轻工学报, 2023,38(3):55-62.JI X L, GUO J H, TIAN J Y, et al.Research progress on degradation methods and product properties of plant polysaccharides[J].Journal of Light Industry, 2023, 38(3):55-62.