基于饮食-肠道菌群-疾病相互作用数据库的膳食推荐对葡聚糖硫酸钠诱导的小鼠溃疡性结肠炎的缓解作用
胡博1,2,张惠琴2,裴彰明2,陈雪梅1,2,唐晓姝1,2,陆文伟1,2*
1(江南大学国家功能食品工程技术研究中心,江苏 无锡,214122)2(江南大学 食品学院,江苏 无锡,214122)
摘 要 膳食-肠道菌群-健康之间存在密切关联,开发肠道菌群靶向性食品以缓解疾病是一种切实可行的手段。该团队前期研究开发了一个饮食-肠道菌群-疾病相互作用(food-gut microbiota-disease interaction,FGMDI)数据库,其能根据疾病类型推荐膳食干预方案。该文以葡聚糖硫酸钠盐诱导的溃疡性结肠炎小鼠为实验对象,评估FGMDI数据库推荐的5种膳食干预方案对结肠炎的缓解作用。结果显示,模型对溃疡性结肠炎预测的27种肠道菌群靶点中有12种可在模型组与空白组的差异肠道菌群中发现,且其LDA score与推荐分数的方向和大小一致。以疾病活动性评分、结肠组织炎症及病理学、肠道屏障等作为评估指标,发现FGMDI推荐分数较高的MDCF、MSPrebiotic®和绿色地中海干预3种膳食方案可以调控模型预测的肠道菌群靶点中的拟杆菌属、阿克曼氏菌属、大肠埃希氏菌、肠球菌属、罗氏菌属等肠道菌群。综上,该研究验证了FGMDI膳食推荐方案的有效性,为相关菌群靶向性食品开发提供了新思路。
关键词 肠道菌群;菌群靶向性食品;膳食推荐;溃疡性结肠炎
DOI:10.13995/j.cnki.11-1802/ts.041734
引用格式:胡博,张惠琴,裴彰明,等.基于饮食-肠道菌群-疾病相互作用数据库的膳食推荐对葡聚糖硫酸钠诱导的小鼠溃疡性结肠炎的缓解作用[J].食品与发酵工业,2025,51(14):17-27;34.
HU Bo,ZHANG Huiqin,PEI Zhangming, et al.Alleviating effect of dietary recommendations based on food-gut microbiota-disease interaction database on dextran sodium sulphate-induced ulcerative colitis in mice[J].Food and Fermentation Industries,2025,51(14):17-27;34.
第一作者:硕士,实验师(陆文伟研究员为通信作者,E-mail:luwenwei@jiangnan.edu.cn)
基金项目:国家自然科学基金面上项目(32172216);“十四五”国家重点研发子课题项目(2022YFF1100203)
收稿日期:2024-11-29,改回日期:2025-03-04
肠道菌群稳态在人类宿主的代谢健康中至关重要,肠道菌群紊乱会促进疾病的发生,包括肥胖[1-2]、非酒精性脂肪肝[3]、克罗恩病[4]、胆管炎[5]、溃疡性结肠炎[6]、癫痫病[7]、细菌性阴道病[8]和银屑病[9]等,危害人体健康。其中,溃疡性结肠炎是一种病因尚不十分明确的结肠和直肠慢性非特异性疾病。其病变部位局限于大肠黏膜及黏膜下层,临床主要表现为腹泻、腹痛及黏液脓血便,对患者的健康和生活质量造成严重影响。
大量研究表明,膳食营养是影响肠道菌群结构和功能的主要因素[10],肠道菌群可以通过对宿主摄入营养物质的吸收利用,产生代谢物供宿主和共生菌群利用,影响宿主的代谢状况[11]。膳食可以在24 h内显著改变肠道菌群的组成结构,而长期的膳食干预导致的肠道菌群变化更为稳定且难以恢复,甚至无法逆转[12]。通过饮食对肠道菌群进行干预有见效快、成本低、无副作用、可持续干预等优点,可作为辅助治疗、长期调控的有效手段,基于日常膳食补充而实现肠道菌群的靶向调控是未来健康饮食产业发展的趋势[13-15]。
本团队在先前研究中通过整合现有开源数据库和已发表的相关文献,构建了一个更全面的饮食-肠道菌群-疾病相互作用(food-gut microbiota-disease interaction,FGMDI)数据库[16]。该数据库是一种极具竞争力的新型食物微生物和疾病微生物关联预测方法,有助于发现复杂疾病的目标微生物,为肠道菌群不平衡设计合适的膳食配方。溃疡性结肠炎的动物模型研究比较成熟,且膳食推荐结果中未得到验证的大多是饮食而非益生菌组,是验证膳食推荐模型良好的研究对象[17-18]。因此,本研究基于膳食推荐模型对溃疡性结肠炎的预测结果,选取其中无报道的5种饮食推荐方案进行动物实验验证,以阐明膳食推荐下葡聚糖硫酸钠盐(dextran sulfate sodium,DSS)诱导的小鼠溃疡性结肠炎得到缓解的实质原因,为疾病人群的膳食建议提供新的思路。
1 材料与方法
1.1 材料与试剂
无水乙醇、甲醇等试剂,国药集团化学试剂有限公司;小鼠定制饲料,江苏协同医药生物工程有限公司;4%(体积分数)多聚甲醛固定液,武汉赛维尔生物科技有限公司;粪便基因组DNA提取试剂盒,美国MP Biomedials有限公司;胶回收试剂盒,浙江倍沃医学科技有限公司;16S rRNA V3-V4扩增引物341F和806R引物,上海生工生物工程有限公司;便隐血试剂盒,珠海贝索生物技术有限公司;RNA保存液、RNA提取试剂盒、转录试剂盒和2×Taq master mix预混液,南京诺唯赞生物科技股份有限公司;RIPA裂解液(强,无抑制剂)、蛋白酶磷酸酶抑制剂(哺乳动物用,50×),上海碧云天生物技术有限公司;小鼠IL-10和IL-1β等酶联免疫试剂盒,美国R&D公司。
1.2 仪器与设备
ME3002E电子天平,梅特勒-托利多国际贸易(上海)有限公司;IKA振荡器,德国IKA集团;SX-300型高压蒸汽灭菌锅,日本Tomy公司;thermo-994型超低温冰箱(-80 ℃),美国赛默飞有限公司;高通量组织研磨器(SCIENTZ-48),宁波新芝生物科技股份有限公司;SW-CJ-1FD型超净工作台,苏州安泰空气技术有限公司;5424R型台式高速离心机,德国艾本德股份公司;DGG-9123A型电热恒温鼓风干燥箱、GRP-9080隔水式恒温培养箱,上海森信实验仪器有限公司;PANNORMIC MIDI型数字切片扫描仪,匈牙利3DHistech有限公司;Multiscan GO型酶标仪,美国赛默飞有限公司;Trace 1300气相色谱质谱联用仪,美国ThermoFisher Sciecntific公司。
1.3 实验方法
1.3.1 膳食干预动物饲料设计
在溃疡性结肠炎的前20种膳食推荐模型中,有8种推荐未有相关文献报道,排除益生菌后还有5种膳食,分别是MDCF(microbiome-directed complementary food)饮食、MSPrebiotic®、绿色地中海饮食、精制低直链淀粉小麦和白面包。其中MDCF饮食是国外开发的一种针对肠道菌群靶点调控的膳食,可改善儿童营养不良情况[19],绿色地中海饮食是在地中海饮食的基础上额外摄入绿茶和微藻Mankai的膳食[20]。
表1 小鼠定制饲料组分剂量换算情况
Table 1 Dose conversion of customized diet components in mice
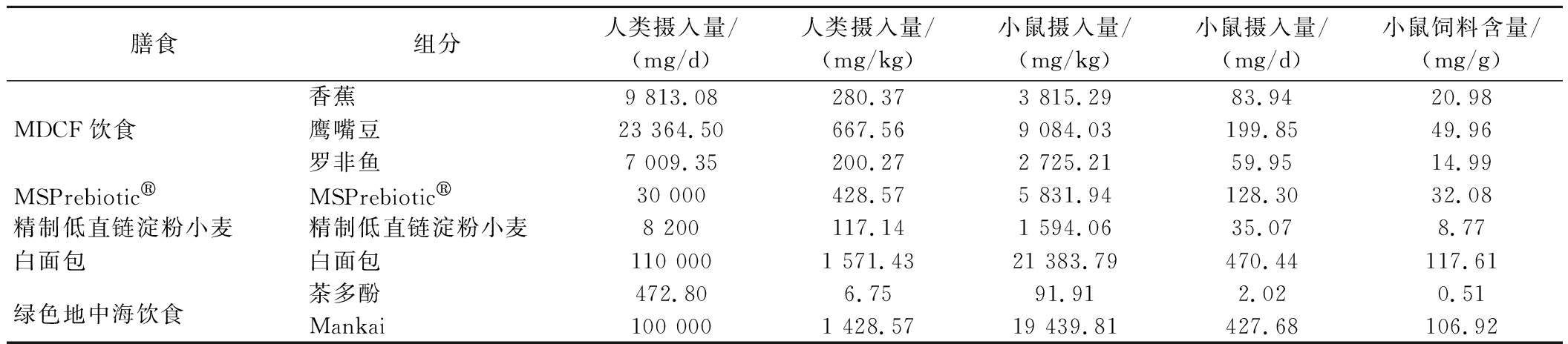
膳食组分人类摄入量/(mg/d)人类摄入量/(mg/kg)小鼠摄入量/(mg/kg)小鼠摄入量/(mg/d)小鼠饲料含量/(mg/g)香蕉9 813.08280.373 815.2983.9420.98MDCF饮食鹰嘴豆23 364.50667.569 084.03199.8549.96罗非鱼7 009.35200.272 725.2159.9514.99MSPrebioticMSPrebiotic30 000428.575 831.94128.3032.08精制低直链淀粉小麦精制低直链淀粉小麦8 200117.141 594.0635.078.77白面包白面包110 0001 571.4321 383.79470.44117.61绿色地中海饮食茶多酚472.806.7591.912.020.51Mankai100 0001 428.5719 439.81427.68106.92
通过查找FGMDI数据库中这5种膳食的原始文献,得到相应的膳食配方、营养成分表及用量,根据人与小鼠之间的药物剂量转换原理将其转换为小鼠的适用剂量。相关小鼠饲料(同时根据空白组饲料进行等能配比)的定制来自江苏协同医药生物工程有限公司,相关膳食组分及剂量换算如表1所示,主要营养素及能量密度如表2所示。
表2 小鼠定制饲料主要营养素及能量密度
Table 2 Main nutrients and energy density of mouse customized diet
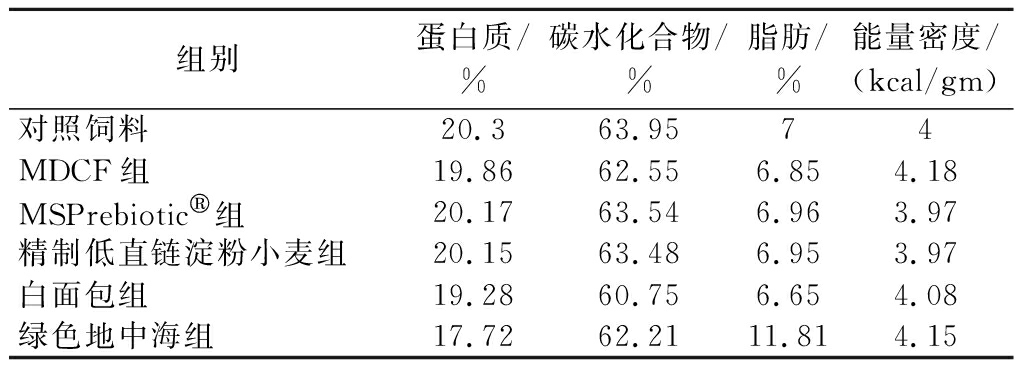
组别蛋白质/%碳水化合物/%脂肪/%能量密度/(kcal/gm)对照饲料20.363.9574MDCF组19.8662.556.854.18MSPrebiotic组20.1763.546.963.97精制低直链淀粉小麦组20.1563.486.953.97白面包组19.2860.756.654.08绿色地中海组17.7262.2111.814.15
1.3.2 动物实验设计
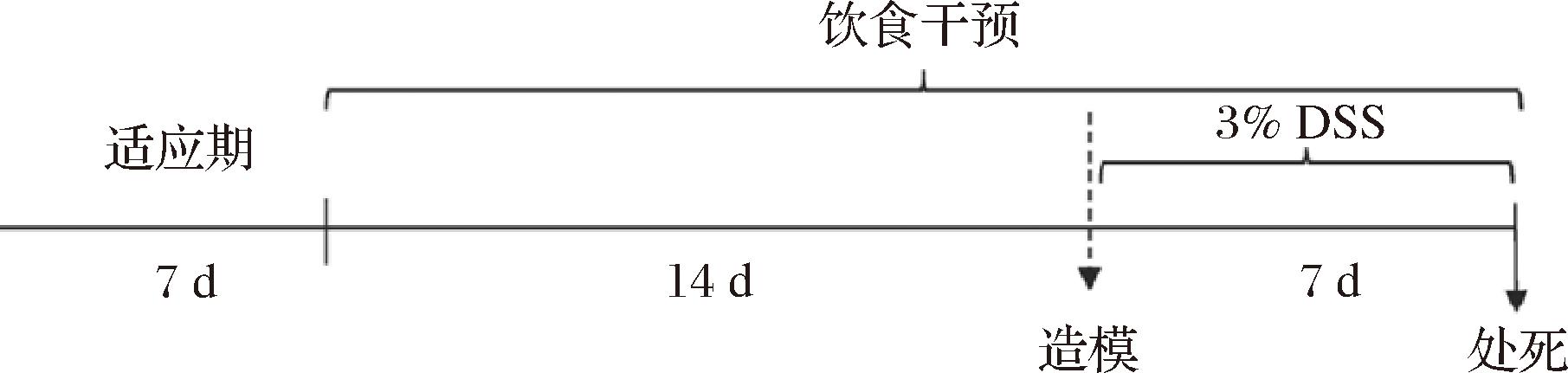
将6周龄雄性C57BL/6 J小鼠(SPF级别)随机分为7组,包括空白组、模型组、MDCF组、MSPrebiotic®组(MS)、绿色地中海组、精制低直链淀粉小麦组和白面包组,每组8只。实验前适应新环境一周,之后为干预组小鼠提供定制饲料,为空白组和模型组提供对照饲料,共干预3周时间。在干预最后一周对模型组和干预组连续7 d每天给予30 g/L DSS饮用水进行造模[21-22],空白组正常给予饮用水(图1)。在膳食干预过程中,每2 d进行一次体重和饲料摄入量测定,造模开始后每天进行体重、饲料摄入量及饮水量的测定。
本实验伦理号为:JN.No20231007c0701116[454],上述实验经江南大学动物保护和使用委员会批准。
1.3.3 疾病活动性评分测定
DSS造模后每天检查小鼠结肠炎的严重程度和症状,使用便隐血检测试剂盒并按照其步骤检测粪便潜血,通过记录体重、大便稠度、腹泻、血便、直肠出血等情况,根据Cooper HS计量表计算疾病活动性评分[23],标准如表3所示。
表3 疾病活动性评分测定标准
Table 3 Composition and content of mouse custom diets

得分/分体重下降/%粪便性状粪便隐血0无正常 正常 10~5半松散隐血阳性 25~10松散 隐血阳性 310~20稀便 肉眼血便 4>20水样便肉眼直肠出血
注:松散粪便为不黏附于肛门的糊状、半成形粪便;稀便为可黏附于肛门的稀状粪便;水样便为粪便无固型物,呈水状。
1.3.4 结肠长度和脾脏指数测定
处死动物后,切除结肠和盲肠组织,用镊子将其以镰刀状置于干净白纸上,使用直尺测定结肠长度并进行拍照,取2段无内容物的结肠组织用于切片和RNA提取后,分离剩余结肠和内容物,分装后贮存于-80 ℃冰箱用作后续分析。取小鼠的脾脏,用生理盐水洗净并吸干水分,称量小鼠脾脏质量,脾脏指数(%)为脾脏质量占小鼠体重的百分比。
1.3.5 结肠组织切片和苏木精-伊红染色
在近盲端取1 cm无内容物的结肠组织,在室温下固定在4%(体积分数)多聚甲醛中24 h。然后委托武汉赛维尔生物科技有限公司进行结肠组织石蜡切片和苏木精-伊红(chematoxylin-eosin,HE)染色,之后,使用数字切片扫描仪对组织切片进行扫片并拍照,观察结肠组织病理情况。
1.3.6 结肠组织炎症因子测定
称取70 mg结肠组织,在700 μL RIPA裂解液中匀浆(70 Hz,30 s,重复5次),并在4 ℃下以14 000 r/min离心10 min,收集上清液并贮存在-80 ℃下进行后续炎症因子分析。
1.3.7 肠道屏障蛋白基因表达分析
称取50 mg结肠组织,通过RNA提取试剂盒进行RNA提取,利用Nano phtometer超微量分光光度计测定所提RNA产物的浓度及纯度。DEPC水稀释确保逆转录体系中含有1 μg RNA模板,通过逆转录试剂盒对RNA进行逆转录,将得到的cDNA产物保存于-80 ℃冰箱。以cDNA为模板,β-actin基因为内参,通过qPCR检测结肠组织中肠道屏障蛋白基因Claudin-1、Zonula occludin-1(ZO-1)的表达水平,所用引物序列如表4[24]所示,引物委托上海生工实验室合成。对每个样品做3次平行,下机数据以空白组为参照,计算得到各组目的基因相对内参基因的表达量。
表4 qPCR引物信息
Table 4 The information of primers sequences used for qPCR

基因退火温度/℃引物序列(5'→3')Claudin-152正向:TTGTTTGCAGAGACCCCATCA反向:GGAGTAAATCTTCCACTGGGGZO-152正向:ATCCCAAATAAGAACAGAGC反向:GGCGTTACATCTAATAAAGC
1.3.8 肠道菌群宏基因组测定
收集小鼠结肠内容物进行宏基因组测序,委托北京诺禾致源科技股份有限公司完成,测序平台为Illumina MiSeq,得到宏基因组原始数据,而后通过Qiime2平台对下机数据进行分析。首先进行序列质控,使用bwa、samtools去除宿主序列信息,而后对序列进行排序合并,使用Trimmomatic去除低质量、双端不合格序列。通过物种注释得到分类操作单元(operational taxonomic unit,OTU)数据,相似度>97%的序列被分配到相同的OTU中。通过物种观测数、Chao1指数、辛普森多样性指数和香农指数来评估肠道菌群α多样性。通过主坐标分析(principal co-ordinates analysis,PCoA)进行β多样性分析,使用R语言vegan、ade4包。通过R语言upsetR、ggplot2包绘制集合图(upset)和物种丰度堆叠柱状图,以评估不同组间肠道菌群的共现性和差异性。随后进行线性判别分析(linear discriminant analysis effect size,LEfSe),以确定不同组间中有显著差异的肠道菌群。
1.4 数据处理
通过GraphPad Prism(v 8.0.1)分析小鼠生理指标、炎症因子和肠道屏障蛋白基因表达情况,所有实验数据表示为“平均值±标准差”。通过单因素方差分析比较各组之间的差异水平,当数据不符合正态分布时使用Brown-Forsythe and Welch ANOVA tests函数进行秩和检验,当P<0.05时,认为具有统计学意义。
2 结果与分析
2.1 膳食干预对小鼠表观生理指标的影响
2.1.1 饲料摄入量、饮水量、体重和疾病活动性评分分析
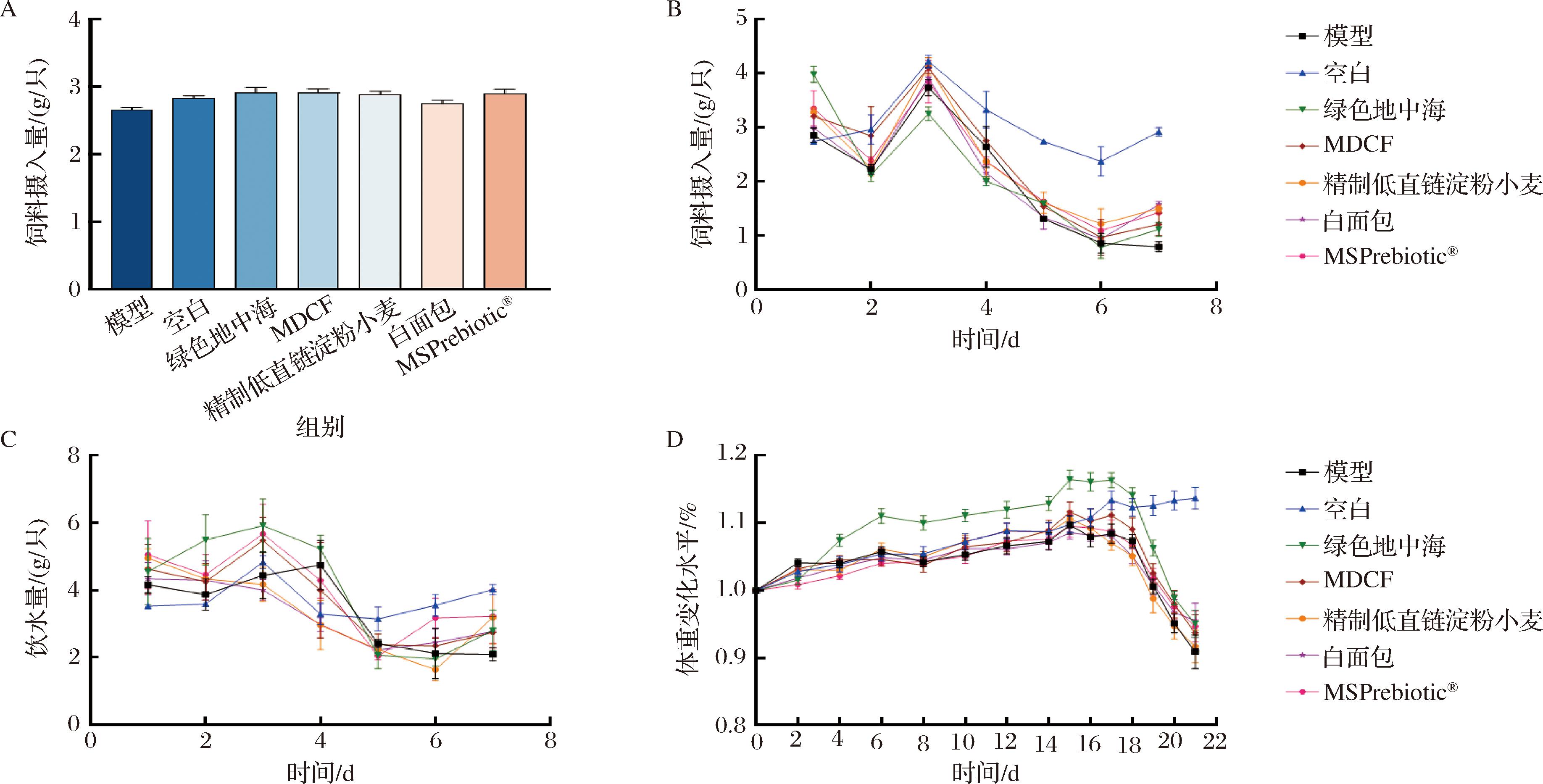
图2-A表示在DSS造模前,不同膳食干预组的定制饲料对小鼠饲料摄入量无影响。在DSS造模后,相较于图2-B中空白组的饲料摄入量,其他组小鼠的饲料摄入量逐渐下降。
同时,相较于空白组,DSS造模导致的严重腹泻和直肠出血显著降低了小鼠体重,而膳食干预对小鼠体重降低有缓解作用,但与模型组相比无显著性差异。
在溃疡性结肠炎造模过程中,小鼠出现不同程度的腹泻、便血和体重降低。在造模第5天即可见小鼠直肠出血,体重严重下降,粪便变为松散或水样,说明DSS造模成功。
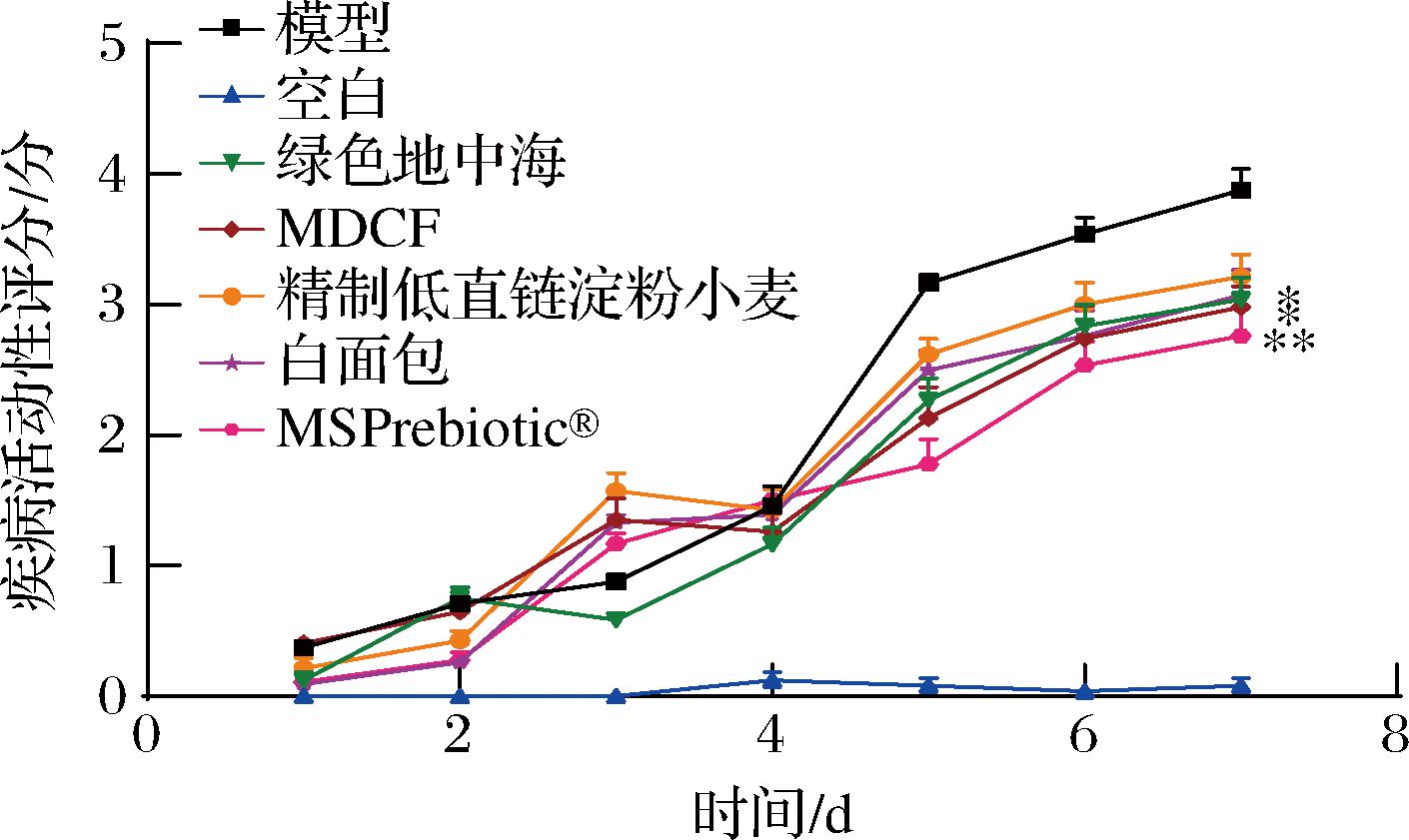
如图3所示,膳食干预可以缓解小鼠结肠炎症状,其中,绿色地中海、MDCF和MSPrebiotic®可以显著改善DSS诱导的结肠炎,结合表5中对溃疡性结肠炎膳食推荐的预测结果,绿色地中海、MDCF和MSPrebiotic®3种饮食的得分分别为0.002 8、0.004 8、0.002 9分,排名均在前20种以内,具有一定的参考依据。
表5 对溃疡性结肠炎前20种推荐饮食的预测结果
Table 5 Prediction results for the top 20 recommended diets for ulcerative colitis

排序得分/分饮食证明资料10.023 6菊粉PMID:3039577620.020 4双歧杆菌PMID:3390033030.014 4类胡萝卜素PMID:3048872440.013 6富含多酚的饮食PMID:2922172550.013 2亚麻种子PMID:3348204560.012 5manjisthaPMID:3608233070.008 3燕麦和大米的特定碳水化合物饮食PMID:2965137080.006 5植物乳植杆菌Dad-13无90.004 8MDCF饮食无100.004 3低聚半乳糖PMID:35703137110.004 0布拉氏酵母菌PMID:34367460120.002 9MSPrebiotic无130.002 8TriphalaAmeliorative effects of Triphala on mucosal damage in rat model of ulcerative colitis[25]140.002 8绿色地中海饮食无150.002 7油酰乙醇酰胺PMID:32922296160.002 4鱼油、动物双歧杆菌乳亚种420和鼠李糖乳酪杆菌HN001无170.002 2植物乳植杆菌CCFM8610PMID:31984399180.002 1动物双歧杆菌乳亚种GCL2505无190.001 8精制低直链淀粉小麦无200.001 8白面包无
2.1.2 结肠长度及脾脏指数分析
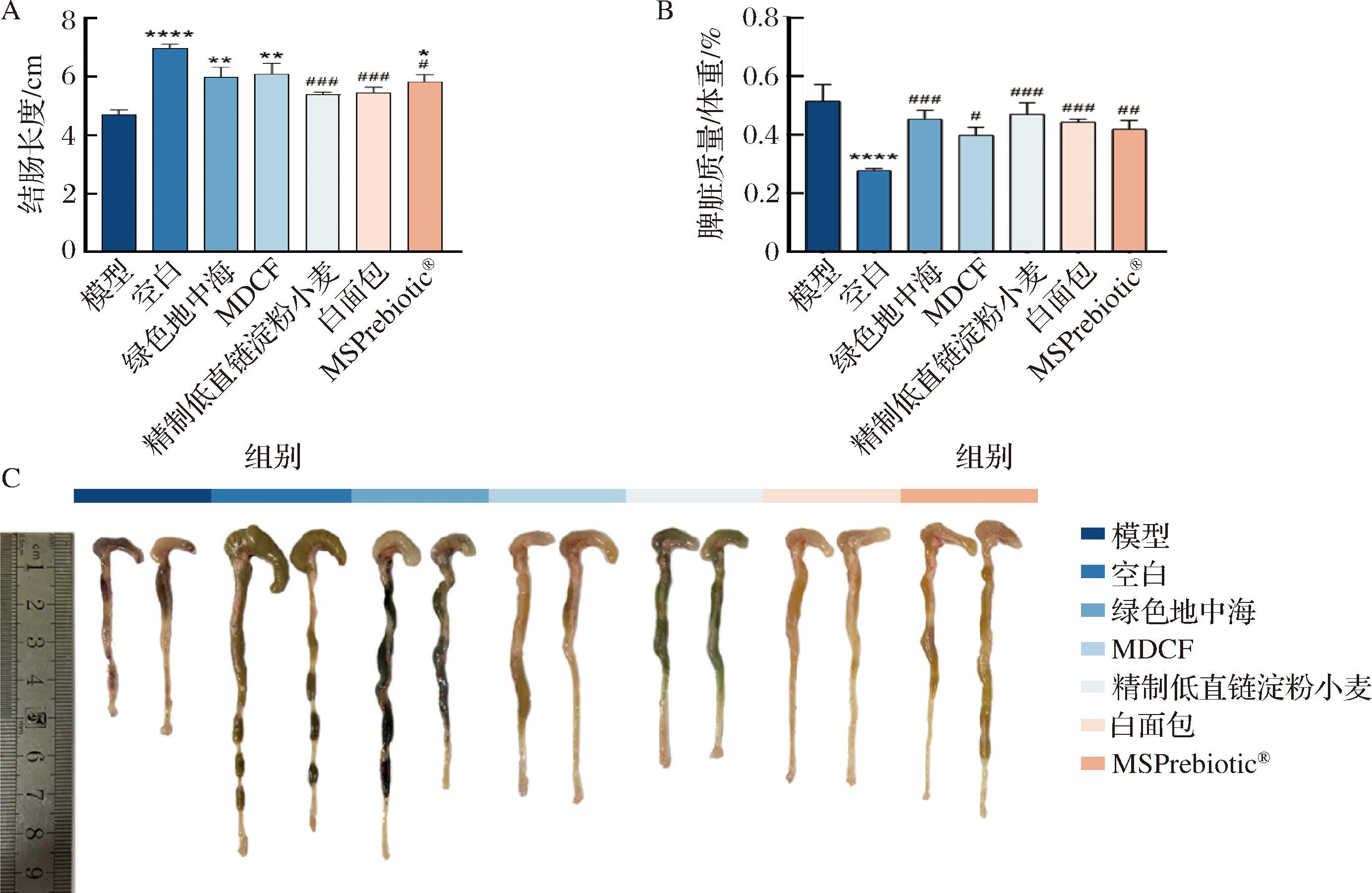
如图4所示,与空白组相比,模型组小鼠的结肠长度显著降低。而绿色地中海、MDCF和MSPrebiotic®组可以显著缓解DSS造模导致的结肠长度降低,精制低直链淀粉小麦和白面包组虽然有效但没有显著性差异。脾脏是主要的免疫器官之一,其质量会随着急性炎症强度的增加而增加[26],相较于空白组,DSS造模成功导致小鼠脾脏指数增加,干预组可缓解脾脏指数增加。
2.2 膳食干预对小鼠结肠组织炎症因子的影响
图5中模型组小鼠结肠组织中IL-17、IL-1β、TNF-α、IL-6的水平显著高于空白组,IL-10的水平显著降低。饮食干预可显著改善肠道炎症因子水平,对溃疡性结肠炎有一定缓解作用,MDCF和MSPrebiotic®干预效果最好。相较于模型组,MSPrebiotic®组对所有炎症因子水平都有显著性差异, MDCF组在降低IL-1β、IL-6和TNF-α的表达水平方面表现最突出,这也符合膳食推荐预测结果。
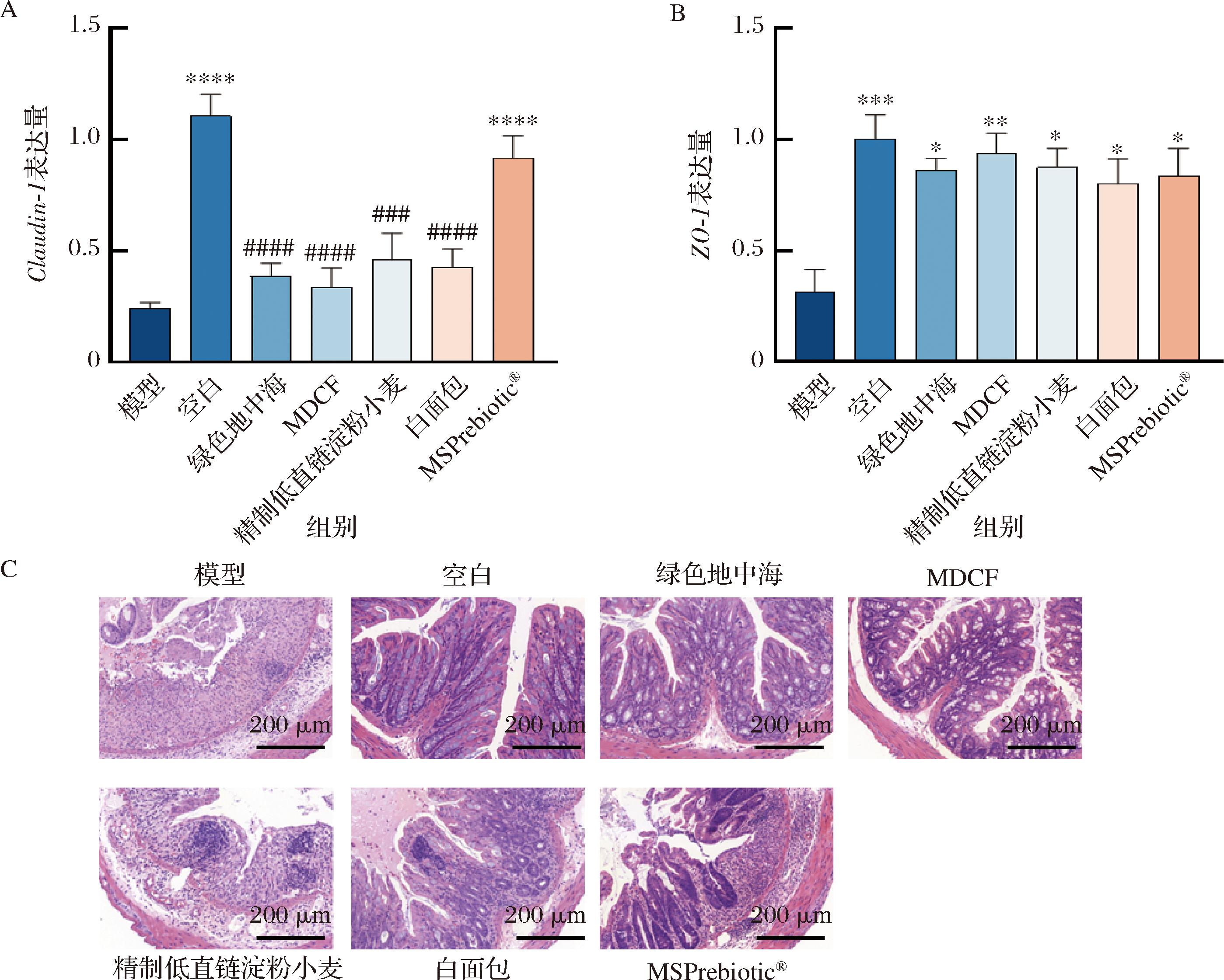
2.3 膳食干预对小鼠肠道屏障的影响
通过结肠组织切片HE染色和qPCR分析小鼠肠道屏障功能,结果如图6所示。空白组结构规则清晰、黏膜层和端部黏膜下层之间有明显的分离、隐窝结构完整、腺体排列紧密、基本无炎性细胞浸润。相比之下,模型组表现出严重的组织学损伤,内有大量炎症细胞浸润,主要包括中性粒细胞、淋巴细胞和杯状细胞丢失,隐窝和腺体严重畸形。除了精制低直链淀粉小麦组,其他4种饮食成功缓解了DSS造模导致的结肠的组织学损伤并减轻了炎症症状,减少炎症细胞浸润、杯状细胞丢失,降低肠黏膜刺激损伤。
紧密连接蛋白Claudin-1和ZO-1是肠道屏障重要的组成部分[27],模型组对比空白组的Claudin-1和ZO-1表达水平显著下降。MSPrebiotic®干预可显著缓解Claudin-1和ZO-1表达水平下降情况。相较于模型组,其他4种饮食干预对改善Claudin-1表达水平无统计学意义,但可显著性改善ZO-1表达水平。
2.4 膳食干预对小鼠肠道菌群组成结构的影响
肠道菌群紊乱会刺激促炎细胞因子的产生,通过改善肠道菌群稳态可以缓解肠道免疫系统的失衡抑制炎症反应[28-29]。通过对不同组小鼠结肠内容物进行宏基因组测序,可以验证FGMDI预测溃疡性结肠炎靶点、膳食干预对小鼠相关肠道菌群靶点的作用情况。
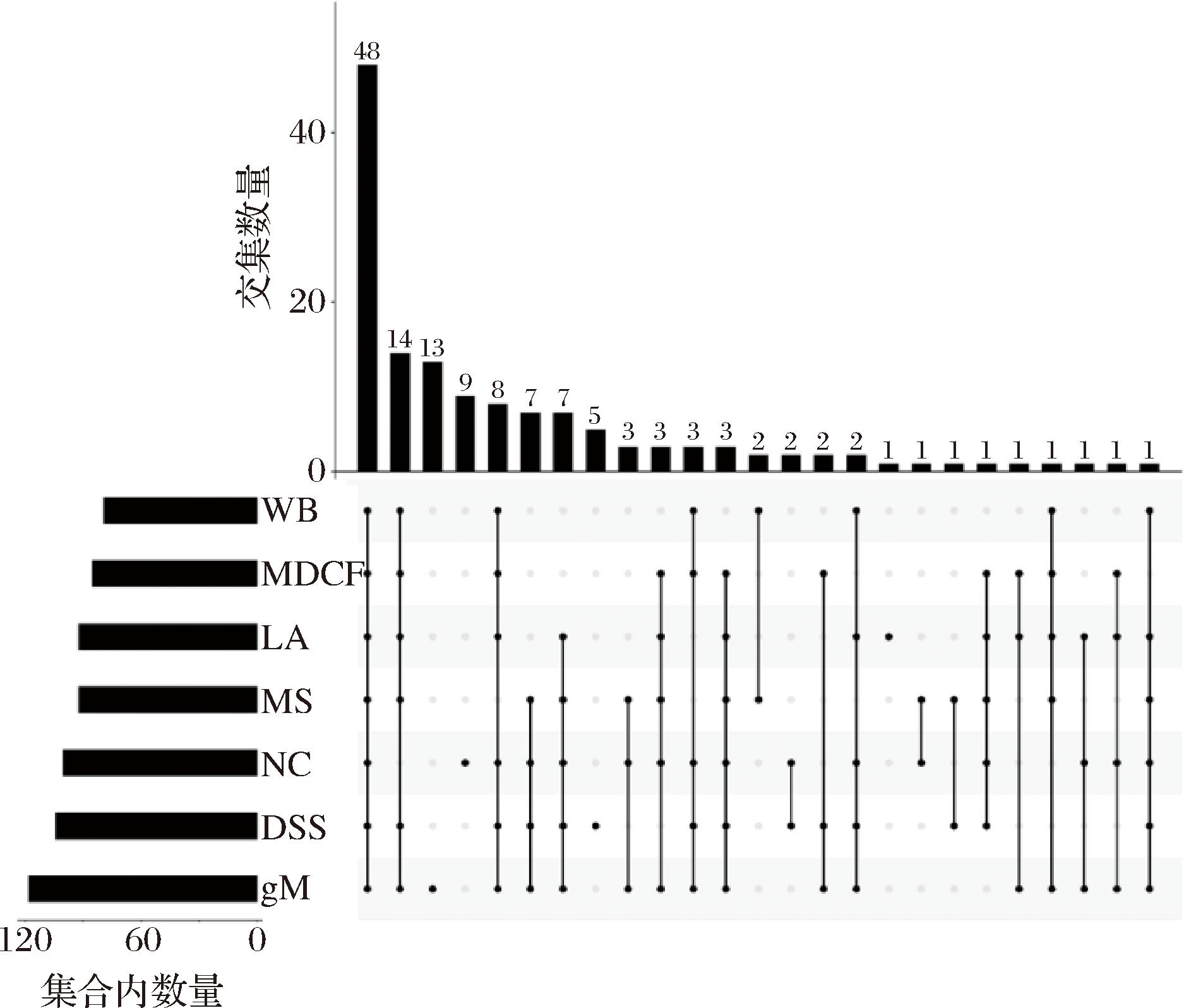
通过R语言构建不同组小鼠肠道菌群OTU的upset图,可以展示不同组之间共有和特有OTU的数量。设样本比例为0.5,即每组内一半以上样本含有该OTU,则认为该组含有该OTU。如图7所示,可以直观地看到绿色地中海组小鼠结肠内容物的OTU最丰富,且其独有的OTU数量为13种。绿色地中海饮食中的多酚含量丰富,研究表明多酚及其代谢产物可以调节微生物种群,增加双歧杆菌、乳酸杆菌、阿克曼氏菌和粪杆菌的丰度[30]。
所有组小鼠共有的肠道菌群OTU数量为48,而相较于空白组,经过DSS造模的模型组和干预组有14种独有的OTU,推测这14种OTU可能是导致溃疡性结肠炎的特异性菌种。然而,独有的OTU相对丰度通常较低,后续研究需要对这些菌种在溃疡性结肠炎的发生发展中的作用进一步确认。
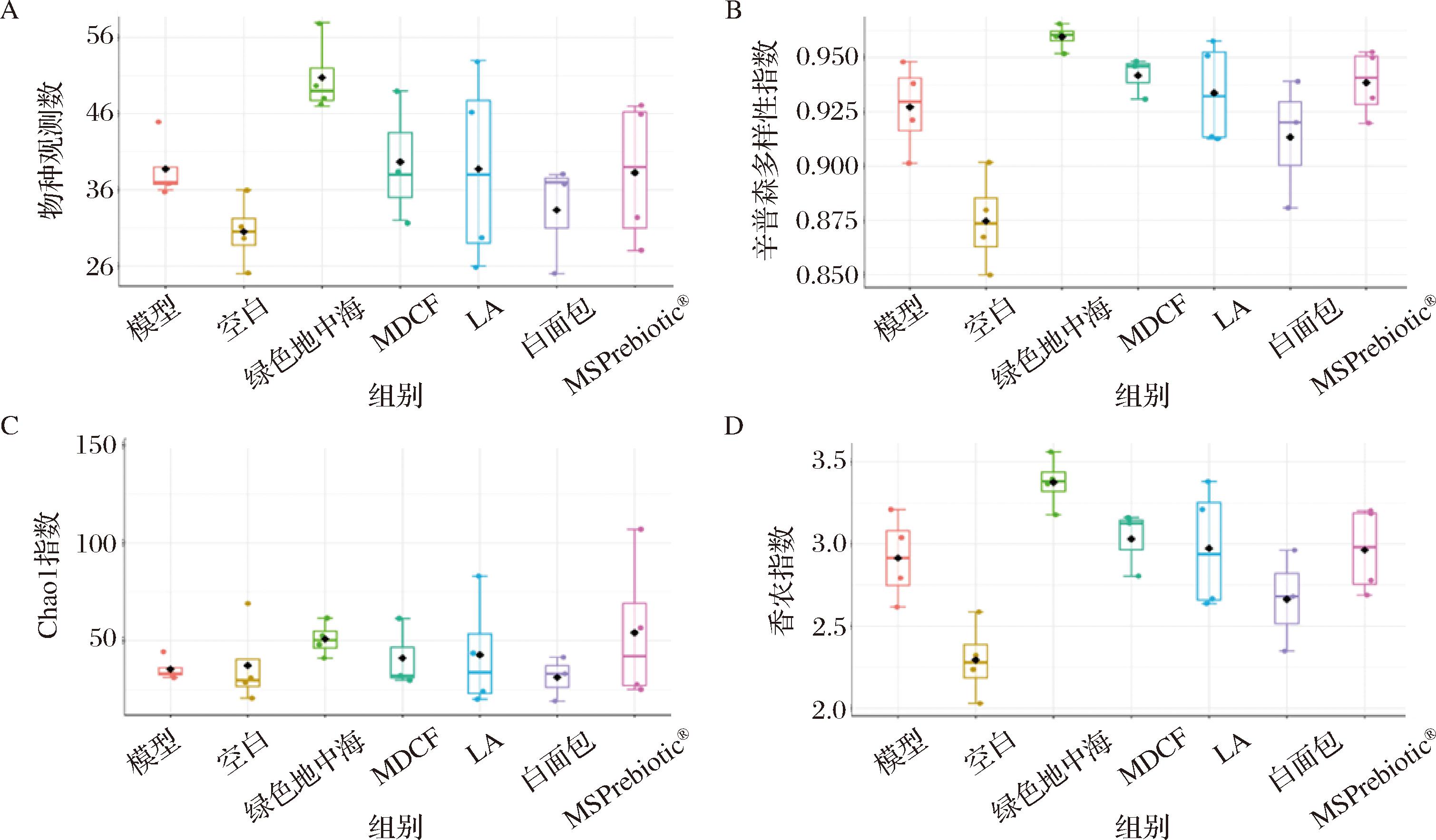
小鼠肠道菌群α多样性的分析可以观测肠道菌群物种多样性的变化,利用T检验/方差分析得到物种观测数、辛普森多样性指数、Chao1指数和香农指数结果如图8所示。其中,模型组与干预组的小鼠肠道菌群α多样性无显著性差异。
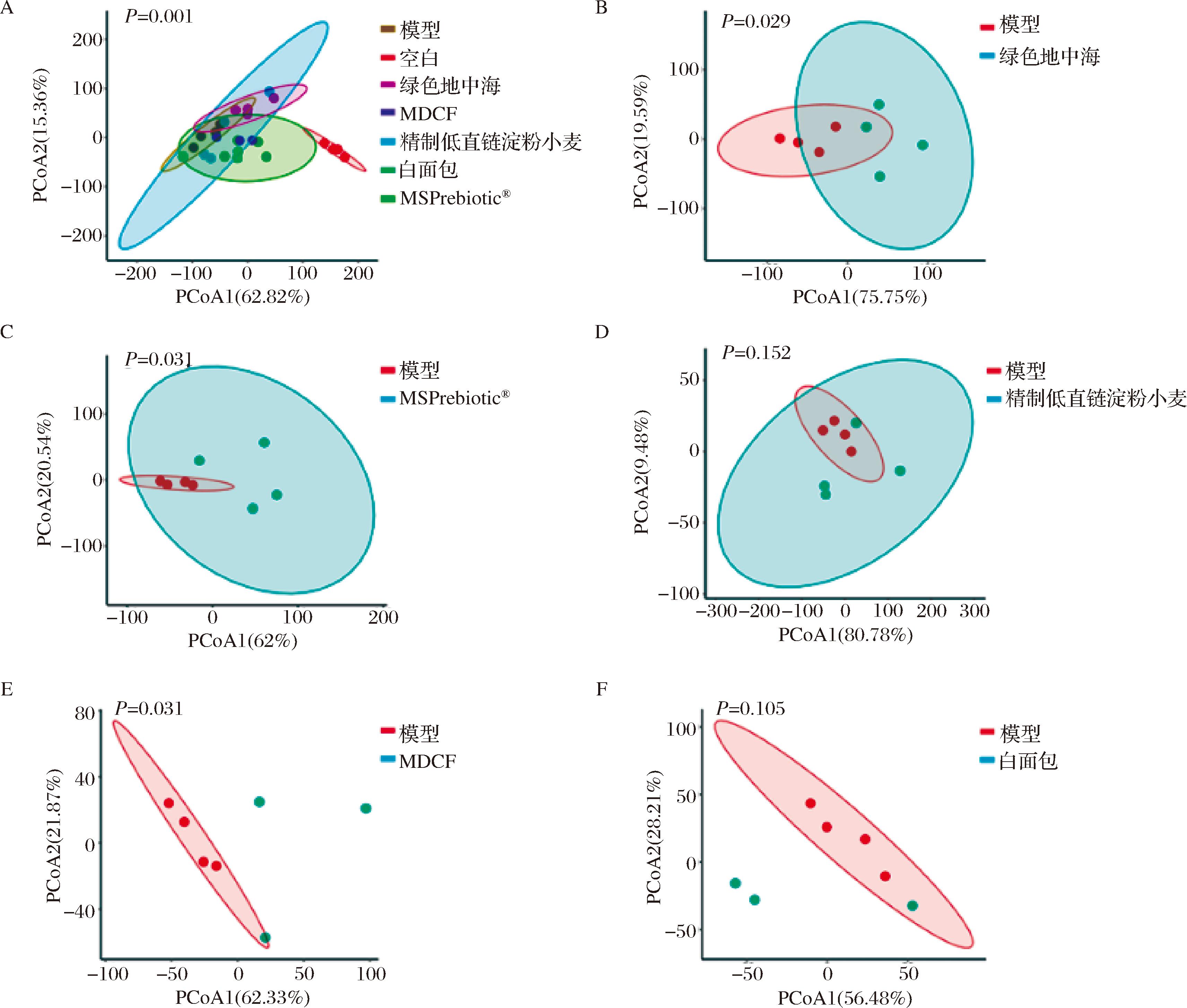
PCoA计算β多样性可以用来评估膳食干预对小鼠肠道菌群结构的影响。如图9所示,由于MDCF和白面包组小鼠粪便的送测质量问题,可通过P值进行分析。基于OTU水平,模型组和空白组的肠道菌群组成存在显著分离,而膳食干预中的绿色地中海、MDCF和MSPrebiotic®组可以显著逆转DSS诱导的结肠炎小鼠的肠道菌群结构失调,且MDCF组与MSPrebiotic®组肠道菌群结构相似。
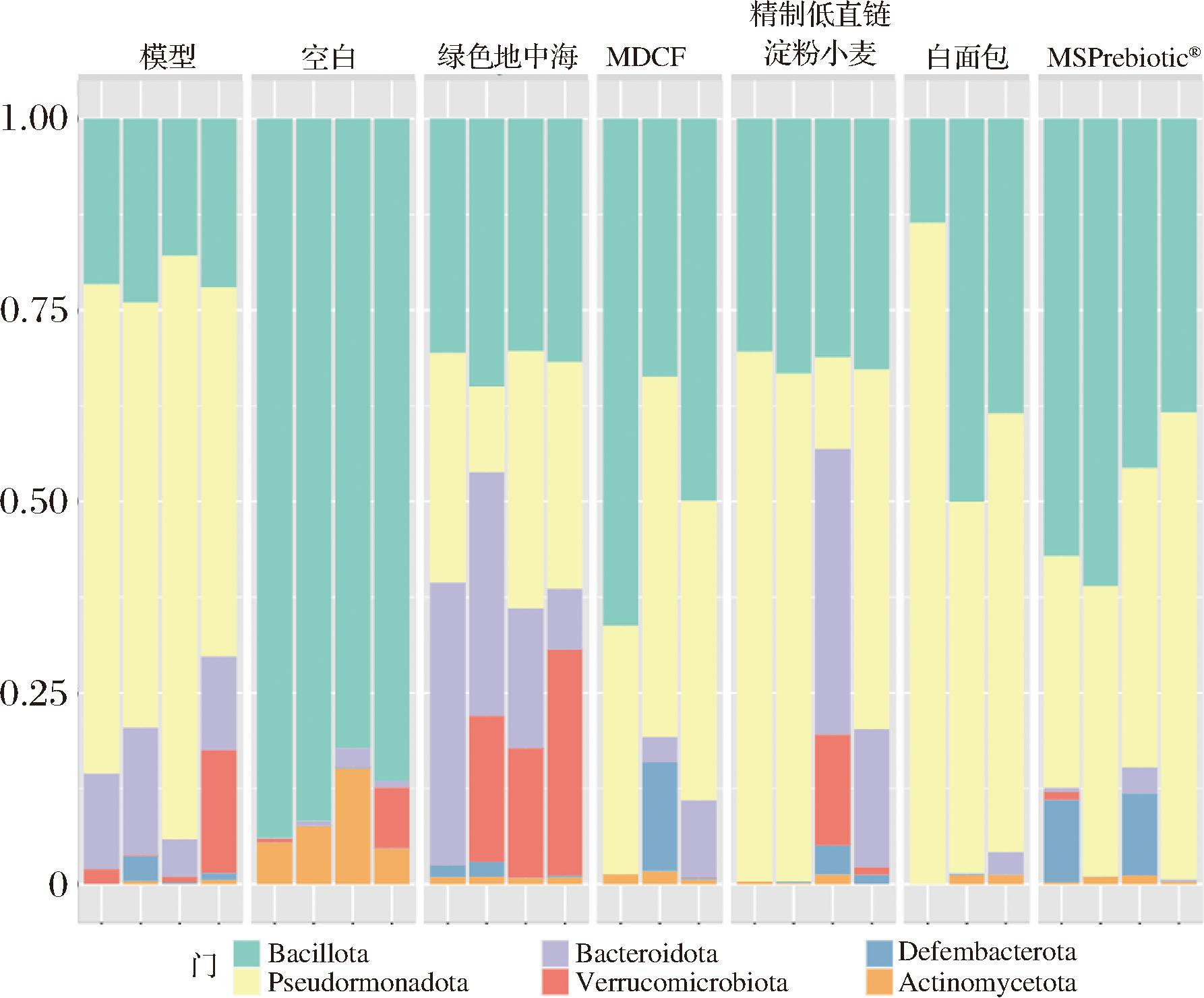
为进一步探究DSS诱导的结肠炎小鼠在膳食干预下肠道菌群分类组成的变化,通过分类学分析门水平肠道菌群丰度的差异并进行鉴定。结果如图10所示,DSS处理对厚壁菌门(Bacillota)、拟杆菌门(Bacteroidota)、变形菌门(Pseudomonadota)和放线菌门(Actinomycetota)的相对丰度和比例有显著影响,降低厚壁菌门和放线菌门相对丰度,增加拟杆菌门和变形菌门相对丰度。与模型组相比,MDCF和MSPrebiotic®干预可缓解DSS处理导致的肠道菌群丰度变化,而绿色地中海干预则增加了拟杆菌门,降低了变形菌门水平,这3种膳食干预可以降低结肠肠道菌群中厚壁菌门与拟杆菌门的比例,而研究表明低F/B比值有助于宿主健康[31]。
除此之外,绿色地中海干预对疣微菌门(Verrucomicrobiota)相对丰度有独特的促进作用,图10中绿色地中海饮食丰富的肠道菌群种类是疣微菌门,而疣微菌门可以在肠道黏膜内层分解各种多酚和纤维类物质并产生短链脂肪酸,与肠道健康和免疫系统有关[32]。
2.5 膳食干预对模型预测的溃疡性结肠炎肠道菌群靶点的影响
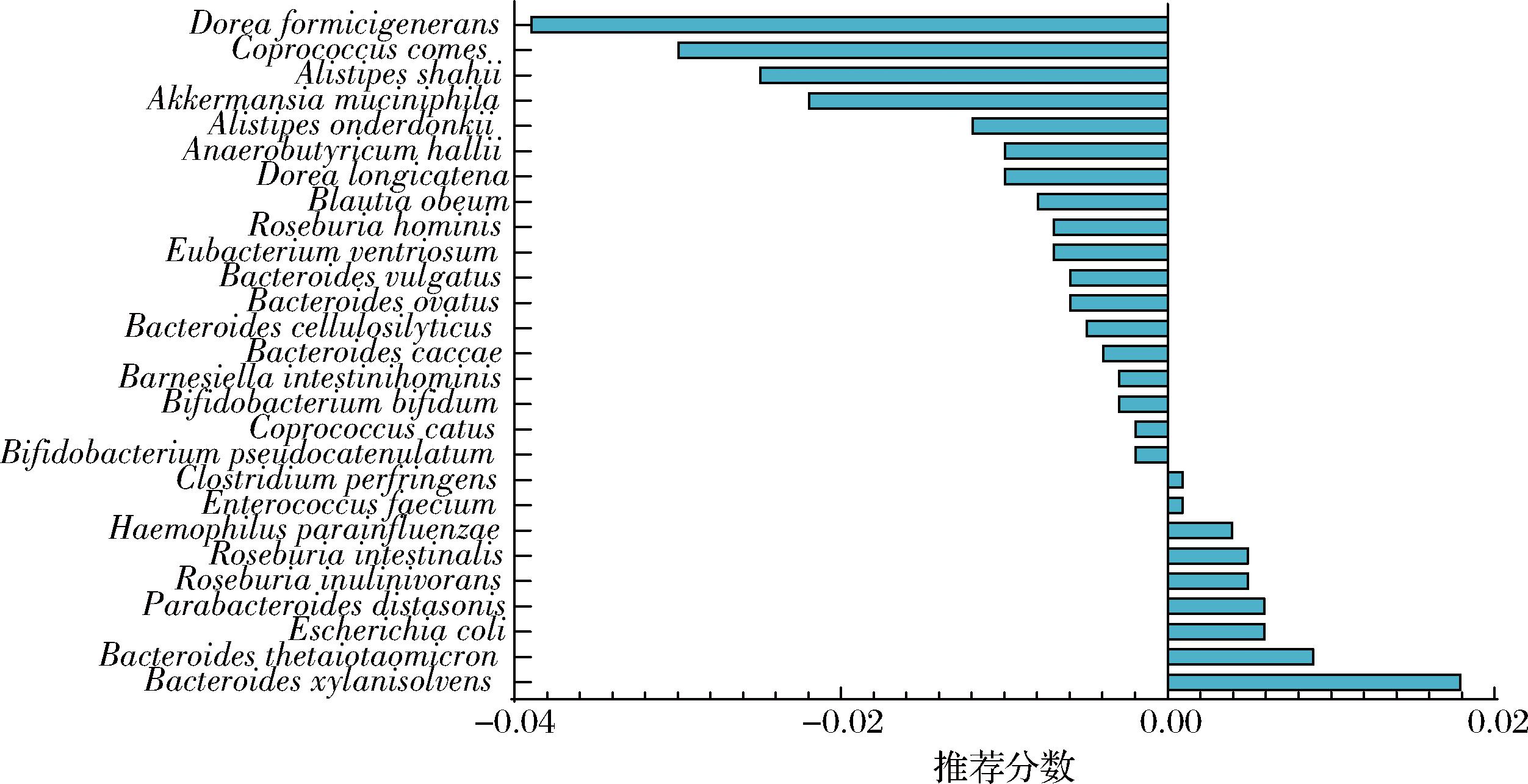
通过对DSS诱导的结肠炎小鼠生理表观指标、炎症因子、肠道屏障、结肠病理和肠道菌群分析,发现预测的5种饮食中推荐分数靠前的MDCF、MSPrebiotic®和绿色地中海干预可以成功缓解小鼠结肠炎症状,恢复小鼠肠道菌群结构。经过肠道菌群-疾病图注意力网络和基于宏基因组数据的分类器对靶点进行二次筛选,27种溃疡性结肠炎的肠道菌群靶点及其推荐得分如图11所示。推荐得分>0说明该肠道菌群可能是针对溃疡性结肠炎的有益菌,应该促进其增殖,推荐分数<0说明其可能是有害菌。调研发现这27种肠道菌群靶点都能够在FGMDI数据库中找到相关文献证实其与溃疡性结肠炎相关性。其中,普通拟杆菌(Phocaeicola vulgatus)能产生大量与溃疡性结肠炎相关的蛋白酶,可以促进隐窝增生,显著降低肠道屏障完整性[33]。
利用LEfSe和系统发育树分析膳食干预对DSS诱导的结肠炎小鼠肠道菌群的影响,可以探究其中有显著差异的肠道菌群。该过程使用Kruskal-Wallis检验和Wilcoxon检验进行校正,P<0.05,将LDA score过滤阈值设为3。
比较模型组和空白组的差异肠道菌群与预测的肠道菌群靶点,由于测序深度不足以及人体及小鼠的肠道菌群差异,所测得小鼠种和属水平的肠道菌群种类数量不足以同模型预测的肠道菌群靶点相对应,而差异肠道菌群中的肠球菌属(Enterococcus)、双歧杆菌属(Bifido bacterium)、真杆菌属(Eubacterium)、副拟杆菌属(Parabacteroides)、埃希氏菌属(Escherichia)和拟杆菌门都符合模型预测结果。模型预测的27种肠道菌群有12种属于DSS造模组与空白组的差异肠道菌群,且LDA score与推荐分数的方向和大小一致。
在DSS诱导的结肠炎小鼠中,回肠杆菌属(Lleibacterium)、双歧杆菌属、真杆菌属和嗜胆菌属(Enterorhabdus)等菌属显著减少,而柠檬酸杆菌属(Citrobacter)、副拟杆菌属、肠球菌属和埃希氏菌属等菌属显著增加。这些肠道菌群与炎症性疾病密切相关,如肠球菌属可以通过产生金属蛋白酶明胶酶GelE,损害肠黏膜屏障[34];粪肠球菌的丰度增加已被研究证实与IBD中临床活动性克罗恩病密切相关[35];大肠埃希氏菌(Escherichia coli)已被多次报道在溃疡性结肠炎患者中丰度增加[36];腐蚀柠檬酸杆菌作为致病菌可导致克罗恩病、溃疡性结肠炎和结肠肿瘤发生[37]等;双歧杆菌是婴儿最早定植的肠道菌群之一,作为有益微生物,它可以促进抗肿瘤免疫并防止溃疡性结肠炎复发;短双歧杆菌可以通过细胞外多糖和MyD88通路减少上皮细胞凋亡脱落等[38]。
图12中Bacilli-Lactobacillales-Enterococcaceae-Enterococcus的分支在DSS造模的结肠炎小鼠中显著增加,而饮食干预可以将小鼠中这些有害病原体的相对丰度降低,这进一步表明饮食干预在一定程度上可以有效逆转DSS诱导的肠道菌群失调。
利用LEfSe分析MDCF、MSPrebiotic®和绿色地中海组和模型组的肠道菌群差异,探究不同饮食对肠道菌群靶点调控情况。将图13的差异肠道菌群与图11进行比较,发现饮食干预可成功对靶点肠道菌群进行调控。其中,MDCF组与模型组差异肠道菌群中的拟杆菌属、阿克曼氏菌(Akkermansia)、Escherichia coli、肠球菌属能够含括模型预测结果中9种肠道菌群;MSPrebiotic®组与模型组差异肠道菌群中的肠球菌属、副拟杆菌属、拟杆菌门、罗氏菌属(Roseburia)、经黏液真杆菌属(Blautia)能够含括模型预测结果中12种肠道菌群;绿色地中海组与模型组差异肠道菌群中的拟杆菌属、罗氏菌属、E.coli能够含括模型预测结果中10种肠道菌群。说明模型预测的肠道菌群靶点能够成功被推荐的膳食调控,从而有助于缓解DSS诱导的结肠炎小鼠肠道菌群失衡。
3 结论
根据FGMDI数据库的膳食推荐模型,本研究选取5种暂未报道过的膳食建议方案评估其对DSS诱导的结肠炎小鼠病症的缓解作用。结果显示, FGMDI推荐分数较高的MDCF、MSPrebiotic®和绿色地中海干预3种膳食方案可以有效缓解DSS诱导的小鼠结肠炎症状,并且可以调控模型预测的肠道菌群靶点。综上,本文验证了FGMDI数据库膳食推荐模型的有效性,通过确定不同疾病的潜在肠道菌群靶点,提出能够改善患者肠道环境从而缓解溃疡性结肠炎的膳食建议。然而,改善肠道菌群只是治疗结直肠炎的一条路径,本研究中虽然发现饮食干预能影响到菌群结构,部分菌种可能与结直肠炎改善有关,但是这些菌种与疾病的因果关联仍需进一步确认。
参考文献
[1] CUNNINGHAM A L, STEPHENS J W, HARRIS D A. A review on gut microbiota: A central factor in the pathophysiology of obesity[J]. Lipids in Health and Disease, 2021, 20(1):65.
[2] FAN Y, PEDERSEN O. Gut microbiota in human metabolic health and disease[J]. Nature Reviews Microbiology, 2020, 19(1):55-71.
[3] 朱春胜, 施亚敏, 付智慧.基于肠道菌群和代谢组学研究化滞柔肝颗粒治疗非酒精性脂肪肝的作用机制[J].中草药, 2023, 54(4):1190-1200.ZHU C S, SHI Y M, FU Z H, et al. Mechanism of Huazhi Rougan Granule in treatment of non-alcoholic fatty liver disease based on intestinal flora and metabolomics [J]. Chinese Traditional and Herbal Drugs, 2023, 54(4): 1190-1200.
[4] PINTO S, BENINC E, GALAZZO G, et al. Heterogeneous associations of gut microbiota with Crohn’s disease activity[J]. Gut Microbes, 2024, 16(1):2292239.
E, GALAZZO G, et al. Heterogeneous associations of gut microbiota with Crohn’s disease activity[J]. Gut Microbes, 2024, 16(1):2292239.
[5] HOLE M J, JØRGENSEN K K, HOLM K, et al. A shared mucosal gut microbiota signature in primary sclerosing cholangitis before and after liver transplantation[J]. Hepatology, 2023, 77(3):715-728.
[6] BARBERIO B, FACCHIN S, PATUZZI I, et al. A specific microbiota signature is associated to various degrees of ulcerative colitis as assessed by a machine learning approach[J]. Gut Microbes, 2022, 14(1):2028366.
[7] ARULSAMY A, TAN Q Y, BALASUBRAMANIAM V, et al. Gut microbiota and epilepsy: A systematic review on their relationship and possible therapeutics[J]. ACS Chemical Neuroscience, 2020, 11(21):3488-3498.
[8] LI Y X, ZHU W, JIANG Y, et al. Synthetic bacterial consortia transplantation for the treatment of Gardnerella vaginalis-induced bacterial vaginosis in mice[J]. Microbiome, 2023, 11(1):54.
[9] ZHAO Q X, YU J D, ZHOU H, et al. Intestinal dysbiosis exacerbates the pathogenesis of psoriasis-like phenotype through changes in fatty acid metabolism[J]. Signal Transduction and Targeted Therapy, 2023, 8:40.
[10] LAI H, LI Y F, HE Y F, et al. Effects of dietary fibers or probiotics on functional constipation symptoms and roles of gut microbiota: A double-blinded randomized placebo trial[J]. Gut Microbes, 2023, 15(1):2197837.
[11] ZENG X F, XING X, GUPTA M, et al. Gut bacterial nutrient preferences quantified in vivo[J]. Cell, 2022, 185(18):3441-3456.e19.
[12] LEEMING E R, JOHNSON A J, SPECTOR T D, et al. Effect of diet on the gut microbiota: Rethinking intervention duration[J]. Nutrients, 2019, 11(12):2862.
[13] PIAZZON M C, CALDUCH-GINER J A, FOUZ B, et al. Under control: How a dietary additive can restore the gut microbiome and proteomic profile, and improve disease resilience in a marine teleostean fish fed vegetable diets[J]. Microbiome, 2017, 5(1):164.
[14] ROY S, DHANESHWAR S. Role of prebiotics, probiotics, and synbiotics in management of inflammatory bowel disease: Current perspectives[J]. World Journal of Gastroenterology, 2023, 29(14):2078-2100.
[15] PELED S, LIVNEY Y D. The role of dietary proteins and carbohydrates in gut microbiome composition and activity: A review[J]. Food Hydrocolloids, 2021, 120:106911.
[16] ZHANG H Q, ZHANG J, ZHAO L, et al. Comprehensive database for food-gut microbiota-disease interactions (FGMDI) analysis and dietary recommendation applications[J]. Food Bioscience, 2024, 60:104091.
[17] GU W C, ZHANG L K, HAN T, et al. Dynamic changes in gut microbiome of ulcerative colitis: Initial study from animal model[J]. Journal of Inflammation Research, 2022, 15:2631-2647.
[18] WANG F, CHEN Y R, ITAGAKI K, et al. Wheat germ-derived peptide alleviates dextran sulfate sodium-induced colitis in mice[J]. Journal of Agricultural and Food Chemistry, 2023, 71(42):15593-15603.
[19] GEHRIG J L, VENKATESH S, CHANG H W, et al. Effects of microbiota-directed foods in gnotobiotic animals and undernourished children[J]. Science, 2019, 365(6449): eaau4732.
[20] KAPLAN A, ZELICHA H, MEIR A Y, et al. The effect of a high-polyphenol Mediterranean diet (Green-MED) combined with physical activity on age-related brain atrophy: The Dietary Intervention Randomized Controlled Trial Polyphenols Unprocessed Study (DIRECT PLUS)[J]. The American Journal of Clinical Nutrition, 2022, 115(5):1270-1281.
[21] QIN W, LUO H, YANG L, et al. Rubia cordifolia L. ameliorates DSS-induced ulcerative colitis in mice through dual inhibition of NLRP3 inflammasome and IL-6/JAK2/STAT3 pathways[J]. Heliyon, 2022, 8(8): e10314.
[22] 刘慧敏, 侯慧, 李丹萍. 高摄入红肉通过改变肠道菌群加重小鼠溃疡性结肠炎[J]. 中国微生态学杂志, 2023, 35(4):396-402.LIU H M, HOU H, LI D P. High red meat intake exacerbates ulcerative colitis in mice by altering gut microbiota[J]. Chinese Journal of Microecology, 2023, 35(4):396-402.
[23] HUANG X L, XU J, ZHANG X H, et al. PI3K/Akt signaling pathway is involved in the pathogenesis of ulcerative colitis[J]. Inflammation Research, 2011, 60(8):727-734.
[24] WANG C H, PAN Z H, JIN Y X. F-53B induces hepatotoxic effects and slows self-healing in ulcerative colitis in mice[J]. Environmental Pollution, 2023, 317:120819.
[25] NARIYA M, NARIYA PANKAJ, RAVISHANKAR B, et al. Ameliorative effects of Triphala on mucosal damage in rat model of ulcerative colitis[J]. Indian Journal of Traditional Knowledge, 2021, 20(4): 951-955.
[26] OZ H S, ZHONG J, DE VILLIERS W J S. Osteopontin ablation attenuates progression of colitis in TNBS model[J]. Digestive Diseases and Sciences, 2012, 57(6):1554-1561.
[27] MARINO M, RENDINE M, VENTURI S, et al. Red raspberry (Rubus idaeus) preserves intestinal barrier integrity and reduces oxidative stress in Caco-2 cells exposed to a proinflammatory stimulus[J]. Food &Function, 2024, 15(13):6943-6954.
[28] TONG L J, ZHANG X Y, HAO H N, et al. Lactobacillus rhamnosus GG derived extracellular vesicles modulate gut microbiota and attenuate inflammatory in DSS-induced colitis mice[J]. Nutrients, 2021, 13(10):3319.
[29] LI W Y, ZHANG Y, CHEN M Y, et al. The antioxidant strain Lactiplantibacillus plantarum AS21 and Clostridium butyricum ameliorate DSS-induced colitis in mice by remodeling the assembly of intestinal microbiota and improving gut functions[J]. Food &Function, 2024, 15(4):2022-2037.
[30] CHATTERJEE A, KUMAR S, ROY SARKAR S, et al. Dietary polyphenols represent a phytotherapeutic alternative for gut dysbiosis associated neurodegeneration: A systematic review[J]. The Journal of Nutritional Biochemistry, 2024, 129:109622.
[31] MARIAT D, FIRMESSE O, LEVENEZ F, et al. The Firmicutes/Bacteroidetes ratio of the human microbiota changes with age[J]. BMC Microbiology, 2009, 9:123.
[32] YANG J P, KURNIA P, HENNING S M, et al. Effect of standardized grape powder consumption on the gut microbiome of healthy subjects: A pilot study[J]. Nutrients, 2021, 13(11):3965.
[33] MILLS R H, DULAI P S, V ZQUEZ-BAEZA Y, et al. Multi-omics analyses of the ulcerative colitis gut microbiome link Bacteroides vulgatus proteases with disease severity[J]. Nature Microbiology, 2022, 7(2):262-276.
ZQUEZ-BAEZA Y, et al. Multi-omics analyses of the ulcerative colitis gut microbiome link Bacteroides vulgatus proteases with disease severity[J]. Nature Microbiology, 2022, 7(2):262-276.
[34] STINEMETZ E K, GAO P, PINKSTON K L, et al. Processing of the major autolysin of E. faecalis, AtlA, by the zinc-metalloprotease, GelE, impacts AtlA septal localization and cell separation[J]. PLoS One, 2017, 12(10): e0186706.
[35] ICHIMIYA T, KAZAMA T, ISHIGAMI K, et al. Application of plasma alternative to serum for measuring leucine-rich α2-glycoprotein as a biomarker of inflammatory bowel disease[J]. PLoS One, 2023, 18(6): e0286415.
[36]  M, STASIEWICZ M. Carcinogenic microbiota and its role in colorectal cancer development[J]. Seminars in Cancer Biology, 2022, 86:420-430.
M, STASIEWICZ M. Carcinogenic microbiota and its role in colorectal cancer development[J]. Seminars in Cancer Biology, 2022, 86:420-430.
[37] ZHOU Z, YANG W J, YU T M, et al. GPR120 promotes neutrophil control of intestinal bacterial infection[J]. Gut Microbes, 2023, 15(1):2190311.
[38] GU Z P, XU S Q, ZHENG Y X, et al. In vitro faecal fermentation metabolites of 2’-fucosyllactose protect against intestinal epithelial injury: Infant enterotype effects[J]. International Dairy Journal, 2024, 150:105860.
Alleviating effect of dietary recommendations based on food-gut microbiota-disease interaction database on dextran sodium sulphate-induced ulcerative colitis in mice
HU Bo1,2, ZHANG Huiqin2, PEI Zhangming2, CHEN Xuemei1,2, TANG Xiaoshu1,2, LU Wenwei1,2*
1(National Engineering Research Center for Functional Food, Jiangnan University, Wuxi 214122, China)2(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
ABSTRACT There is a close correlation among diet, gut microbiota, and health.Developing gut microbiota-targeted foods to alleviate diseases is a practical approach.This team previously developed a food-gut microbiota-disease interaction (FGMDI) database, which could recommend dietary intervention plans according to different disease types.In this study, mice with dextran sulfate sodium-induced ulcerative colitis were used as experimental subjects to evaluate the alleviating effects of five dietary intervention plans recommended by the FGMDI database on colitis.Results showed that 12 out of the 27 gut microbiota targets predicted for ulcerative colitis by the model could be found among the differential gut microbiota between the model group and the blank group, and the direction and magnitude of their LDA scores were consistent with the recommended scores.Using disease activity scores, colon tissue inflammation, pathology, and intestinal barrier as evaluation indicators, it was found that three dietary plans, namely MDCF, MSPrebiotic®, and the Green Mediterranean intervention, with higher recommended scores in FGMDI, could regulate gut microbiota such as Bacteroides, Akkermansia, Escherichia coli, Enterococcus, and Roseburia, which were the gut microbiota targets predicted by the model.In conclusion, this study verified the effectiveness of the dietary recommendation plans of FGMDI and provided new ideas for the development of related microbiota-targeted foods.
Key words gut microbiota; microbial targeted food; dietary recommendation; ulcerative colitis








 E, GALAZZO G, et al. Heterogeneous associations of gut microbiota with Crohn’s disease activity[J]. Gut Microbes, 2024, 16(1):2292239.
E, GALAZZO G, et al. Heterogeneous associations of gut microbiota with Crohn’s disease activity[J]. Gut Microbes, 2024, 16(1):2292239. ZQUEZ-BAEZA Y, et al. Multi-omics analyses of the ulcerative colitis gut microbiome link
ZQUEZ-BAEZA Y, et al. Multi-omics analyses of the ulcerative colitis gut microbiome link