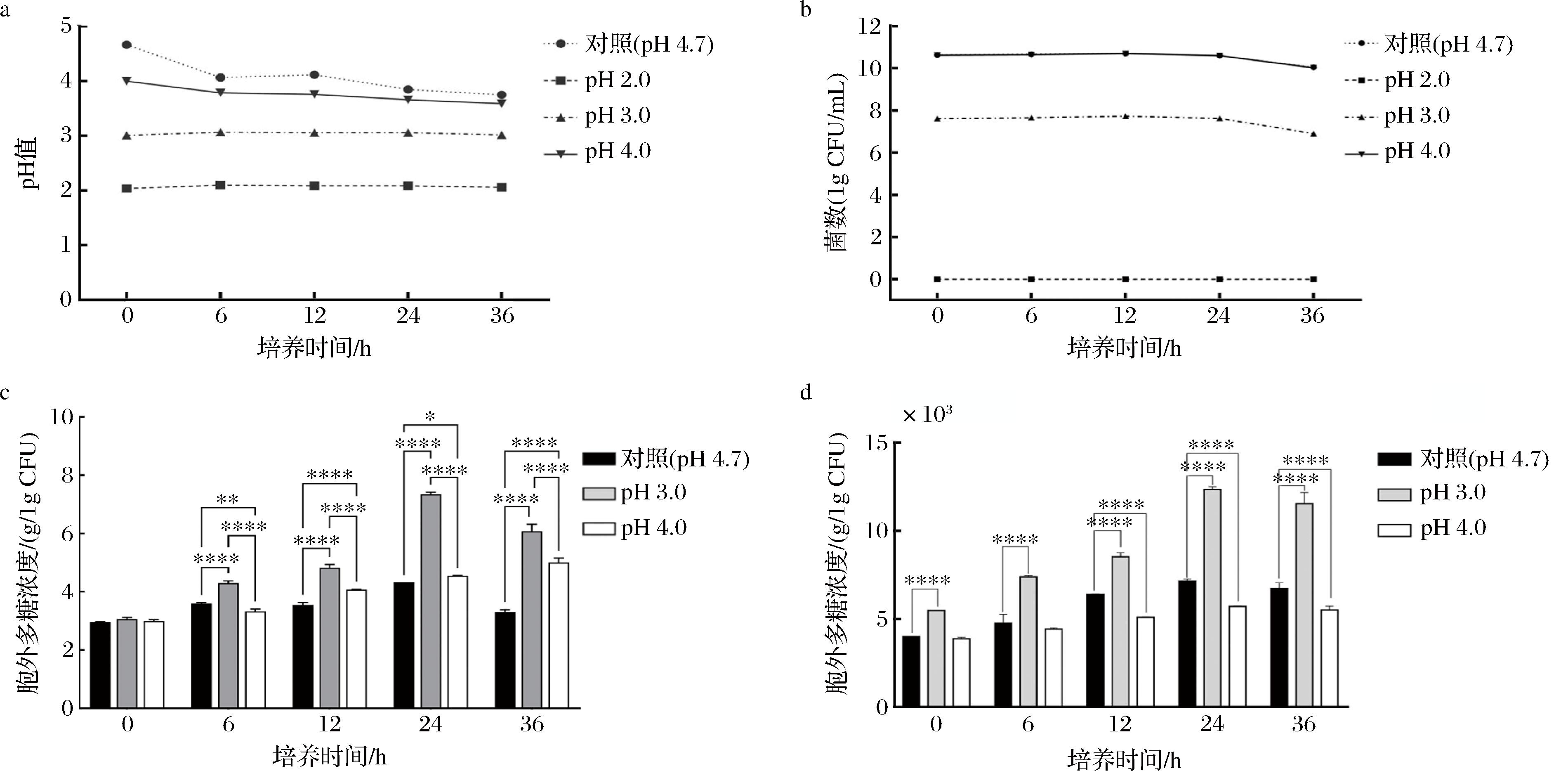
a-L-ZS9在酸胁迫下pH的变化;b-酸胁迫下L-ZS9菌落数;c-酸胁迫对L-ZS9产EPS浓度的影响;d-酸胁迫下L-ZS9单个菌落产EPS的能力
图1 酸胁迫对L-ZS9菌株产EPS的影响
Fig.1 Effect of acid stress on EPS production by the L-ZS9 strain
注:样品通过双向方差(ANOVA)分析;*代表P<0.05;**代表P<0.01;***代表P<0.001;****代表P<0.000 1(下同)。
YUAN Lu,SONG Yunlong,LIU Lei, et al.Effect of environmental stress on ability of Lactiplantibacillus paraplantarum L-ZS9 to synthesize exopolysaccharides[J].Food and Fermentation Industries,2025,51(14):195-201.
乳酸菌(lactic acid bacteria,LAB)是指能利用可发酵碳水化合物并产生乳酸的一类革兰氏阳性、无芽孢细菌的统称[1],是人和动物胃肠道内重要的益生菌,是世界公认安全(generally recognized as safe,GRAS)的食品级益生菌[2]。乳酸菌作为益生菌,具备多种对人体健康有益的生理功能,比如调节肠道菌群、抑制有害菌的生长、促进肠道蠕动、提高机体免疫能力、降低胆固醇、缓解乳糖不耐症等[3-4],在食品、医学、农业等领域均有着重要的应用价值。
乳酸菌胞外多糖(exopolysaccharides,EPS)是乳酸菌分泌的一种次级代谢副产物[5],是乳酸菌通过非共价相互作用产生与细胞松散结合或释放到周围环境中的由碳水化合物(糖残基)组成的高分子质量化合物[6]。其具有抗氧化[7]、抗肿瘤[8]、免疫调节等生物活性[9-10]。另外有研究证明[11-13],EPS能通过多种途径,如肠机械屏障、微生物屏障及免疫屏障等,调控肠道屏障功能、维护肠道健康。除此之外,EPS还是一种天然的增稠剂[14],能显著提高发酵乳的持水力[15],还具有抗病毒[16]、保护肠道内有益菌体免受毒害[17]等功能特性。
乳酸菌胞外多糖与环境胁迫有着密不可分的联系,乳酸菌在生产及发挥益生功能时要受到多种不利环境条件的影响,如通过胃肠道时经历的低pH和胆盐等,在工业生产过程中所经历的环境胁迫(包括低温与高温、高压、氧化以及其他因素等)[18]。而乳酸菌过量合成胞外多糖就是其在抵御外界不良环境时重要的应激手段,通过过量分泌胞外多糖来提高其抗逆性[19-20]。人类胃酸pH值较低且根据个人身体状况和饮食结构的不同存在较大波动,正常人胃液的pH值为2.0左右,进食后胃液被稀释,pH值上升至3.5。胆盐是胆汁酸与钠盐或钾盐结合形成的盐类,其可以促进脂肪的消化和吸收[21]。人体内正常的胆盐含量为0.3%~0.5%,当食物中的乳酸菌通过胃的消化进入小肠后将会面临高胆盐的生存环境。吴清清[22]采用多株植物乳杆菌,从宏观角度出发,揭示了植物乳杆菌胞外多糖的合成可能与酸环境有关。胆盐诱导EPS的合成,胆盐环境对胞外多糖的合成具有积极作用[23]。乳酸菌在运输、贮藏及制剂过程中一般处于低温环境[24],有研究表明,中产胞外多糖组中的植物乳杆菌存活率显著高于低产胞外多糖组,具有优越的抗冷冻能力[22],但未见有明确指出低温胁迫能够显著提高乳酸菌胞外多糖产量的相关报道。在工业生产的超高压条件下,乳酸菌可能会调整其胞外多糖的合成量和类型,以应对外界的压力变化。有报道指出[25],压力可导致微生物细胞脂质成分的变化,可能会影响细胞膜的流动性和渗透力。除了产量变化之外,在受到外界胁迫时乳酸菌合成胞外多糖的结构与生物学活性也会发生相应的变化[26]。
目前的研究发现乳酸菌在各种胁迫环境下具有自我调控能力,并通过各种生理反应来适应不利环境[27],但应用于医学、药学及生物材料等方面的细菌胞外多糖的相关研究以及环境胁迫对EPS产量的促进作用的研究很少,并且EPS的合成效率偏低,生产成本较高,极大限制了EPS的规模化生产和工业应用。研究乳酸菌在逆境下的产胞外多糖能力对提高EPS产量具有重大意义[28-29],为乳酸菌的高密度培养及其工业化应用提供理论依据。本试验在前期工作中筛选获得了类植物乳植杆菌L-ZS9(Lactiplantibacillus paraplantarum L-ZS9),该菌株在生长过程中能够产生胞外多糖以提高环境适应性。
类植物乳植杆菌L-ZS9(Lactiplantibacillus paraplantarum L-ZS9),保存在中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC),保藏编号为CICC No.6262,GenBank登录号为CP013130。
MRS培养基(g/L):蛋白胨10.0、牛肉膏10.0、酵母膏5.0、Tween-80 1.0、磷酸氢二钾2.0、无水乙酸钠5.0、柠檬酸氢二胺2.0、硫酸镁0.58、硫酸锰0.25、葡萄糖20.0,加蒸馏水至1 L,121 ℃下灭菌15 min。固体培养基中加入20 g/L琼脂。
mMRS培养基(g/L):蛋白胨10.0、牛肉膏10.0、酵母膏5.0、Tween-80 1.0、磷酸氢二钾2.0、无水乙酸钠5.0、柠檬酸钠5.0、硫酸镁0.2、硫酸锰0.05、蔗糖50.0,加蒸馏水至1 L,121 ℃下灭菌15 min。固体培养基中加入20 g/L琼脂。
浓硫酸、盐酸、苯酚、蔗糖、无水乙酸钠,成都市科隆化学品有限公司;无水磷酸氢二钾,广东光华科技股份有限公司;柠檬酸钠(二水),上海源叶生物科技有限公司;硫酸锰、硫酸镁,天津市致远化学试剂有限公司;Tween-80,上海索莱宝生物科技有限公司;胆盐三号、琼脂粉,北京奥博生物技术有限责任公司;PBS,四川川奕科技有限公司;所用化学试剂均为分析纯。
5424小型高速离心机,德国艾本德;Infinite F200荧光化学发光分析仪,瑞士TECAN;GI54DWS全自动灭菌锅,致微(厦门)仪器有限公司;PHS-320酸度计、BPX-82精密恒温培养箱,成都世纪方舟科技有限公司;HPP600Mpa/3-5L超高压食品处理实验设备,包头科发高压科技有限责任公司。
1.3.1 类植物乳植杆菌L-ZS9的活化
在超净工作台中从L-ZS9平板中挑取单菌落,在MRS平板上划线,置37 ℃恒温培养箱培养24 h。挑取单菌落于mMRS液体培养基,在条件为37 ℃,150 r/min的摇床中振荡培养过夜。按5%(体积分数)接种于新的mMRS液体培养基,培养过夜,重复该操作,使L-ZS9活化3代。
1.3.2 菌落计数
菌落计数采用稀释涂布平板法,用移液枪吸取50 μL稀释后的菌液,用涂布棒快速且均匀涂布,待菌液晾干后,倒置于37 ℃培养箱中约培养36 h,准确数出菌落数,根据公式(1)换算为CFU值。
B=A×20×10n
(1)
式中:A,稀释涂布平板上的菌落总数;B,CFU值,CFU/mL;n,稀释倍数。
1.3.3 胞外多糖浓度测定
胞外多糖浓度测定采用苯酚-硫酸法,取1 mL发酵菌液8 000 r/min下离心15 min,取上清液100 μL,用蒸馏水稀释103倍,取稀释后的液体400 μL,加入浓硫酸1 mL(本步骤需在冰水中进行),再加入200 μL 6%苯酚。将样品涡旋3~5 s,沸水浴20 min,进行显色操作。立即放入冰水中冷却,取显色的样品200 μL于96孔板,每个样品做3个平行,用荧光化学发光分析仪测定显色后的样品在490 nm处的吸光值。
1.3.4 胁迫环境的模拟
将活化后的L-ZS9菌液按5%(体积分数)接种比接入到mMRS培养基中,37 ℃下培养过夜,待L-ZS9菌液生长至OD590nm值为1.0后分装。
a)胃液胁迫环境模拟:用体积分数为30%的稀盐酸分别调至pH 2.0,pH 3.0,pH 4.0,空白对照组的pH不做调整。再将100 mL不同酸处理过的菌液平均分装于3个50 mL锥形瓶中,置37 ℃恒温培养箱培养36 h。
b)胆盐胁迫环境模拟:准确称取0.1、0.3、0.5 g胆盐三号分别溶于5 mL无菌mMRS液体培养基中配制成不同浓度的胆盐母液,高压蒸汽灭菌后,加入95 mL mMRS菌液配制成胆盐质量浓度分别1、3、5 g/L 的菌液,对照组除不加胆盐外,其他操作同实验组。再将100 mL不同胆盐浓度处理过的菌液平均分装于3个50 mL锥形瓶中,置37 ℃恒温培养箱培养36 h。
c)低温胁迫环境模拟:将分装好的L-ZS9菌悬液分别置于不同温度下培养36 h,37 ℃为对照组,0 ℃(冰水混合物)、4 ℃(冰箱)为试验组。
d)超高压胁迫环境模拟:用超高压食品处理设备分别在100、200、300 Mpa处理10 min,对照组不做处理。将处理后密封袋中的菌液转入灭菌过的50 mL 锥形瓶内,置37 ℃恒温养箱培养36 h。
在培养0、6、12、24、36 h时分别进行菌落计数(按照1.3.2节的步骤进行),另取2 mL发酵菌液用酸度计测定不同条件培养时间的pH,并测定EPS浓度(按照1.3.3节的步骤进行)。
结果以“平均值±标准差”表示。使用GraphPad Prism软件(V9.0)进行方差分析(analysis of variance,ANOVA),显著性水平设定为P<0.05。
在pH 2.0、pH 3.0以及pH 4.0的稀盐酸胁迫下,L-ZS9培养环境中的pH变化幅度均较小,而对照组在0~6 h时间内变化幅度较大,6~36 h变化减小(图1-a)。这是因为终产物乳酸的积累会抑制乳酸菌生长并导致乳酸产量下降,该情况随发酵液中H+浓度的升高(即pH的降低)而增强,即pH越低,乳酸产量会下降,pH变化越小。显然,对照组酸度最低,因此变化最大,且后期随着pH降低,这种变化也开始变小。当pH为2.0时,由于L-ZS9的耐酸能力有限,pH 2.0条件下的酸度过高,引起细胞膜电荷的变化,从而影响微生物对营养物质的吸收,影响代谢过程中酶的活性,改变营养物质的可给性和有害物质的毒性,从而导致菌株死亡(图1-b)。总的来说,在pH为3.0条件下,无论是单个菌落还是整体菌群,类植物乳植杆菌L-ZS9产EPS的能力都显著高于对照组,特别是培养24 h后,L-ZS9的产胞外多糖能力达到最佳(图1-c、图1-d),表明一定pH的酸胁迫环境有利于类植物乳植杆菌L-ZS9胞外多糖的合成。

a-L-ZS9在酸胁迫下pH的变化;b-酸胁迫下L-ZS9菌落数;c-酸胁迫对L-ZS9产EPS浓度的影响;d-酸胁迫下L-ZS9单个菌落产EPS的能力
图1 酸胁迫对L-ZS9菌株产EPS的影响
Fig.1 Effect of acid stress on EPS production by the L-ZS9 strain
注:样品通过双向方差(ANOVA)分析;*代表P<0.05;**代表P<0.01;***代表P<0.001;****代表P<0.000 1(下同)。
当胆盐质量浓度为5 g/L时,胆盐浓度太高,直接溶解细胞膜中的脂质,使细胞质等内容物从胞内流出[30],直接导致菌体死亡(图2-a)。当培养时间为12 h时,胆盐胁迫条件均对L-ZS9产EPS能力无显著影响。总体来说,胆盐质量浓度为1、3 g/L的胁迫条件均能提高L-ZS9菌群和单个菌落产EPS的能力,尤其在胆盐质量浓度为1 g/L的胁迫条件下,L-ZS9单个菌落产EPS的能力显著高于对照组(图2-b、图2-c)。说明类植物乳植杆菌L-ZS9在一定浓度的胆盐胁迫下,能提高其产EPS的能力。
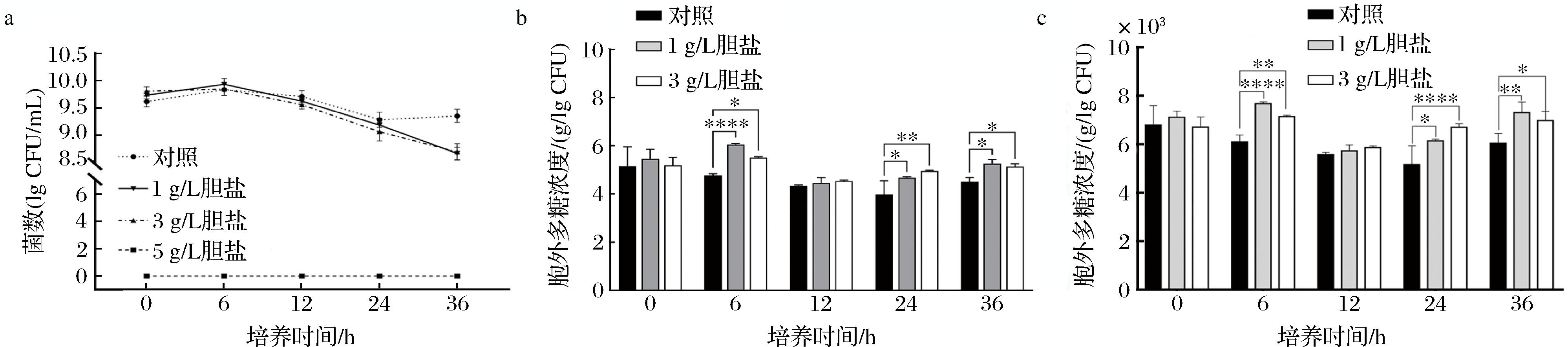
a-胆盐胁迫下L-ZS9的菌落数;b-胆盐胁迫对L-ZS9产EPS的影响;c-胆盐胁迫下L-ZS9单个菌落产EPS的能力
图2 胆盐胁迫对L-ZS9菌株产EPS 的影响
Fig.2 Effect of bile salt stress on EPS production by the L-ZS9 strain
在0、4 ℃的低温胁迫环境下,L-ZS9的菌落数变化趋势和波动范围不大(图3-a),表明在0、4 ℃低温胁迫环境下对L-ZS9的菌落数并无太大影响。在低温胁迫下L-ZS9产EPS的能力并未得到显著提升,但在4 ℃低温胁迫条件下培养36 h后,与对照组相比,L-ZS9产EPS的能力显著上升(图3-b、图3-c)。因此,在此条件下,类植物乳植杆菌L-ZS9产EPS能力可以得到一定程度上的提升。总体而言,低温胁迫对L-ZS9产EPS的能力几乎没有促进作用,甚至还有抑制作用。
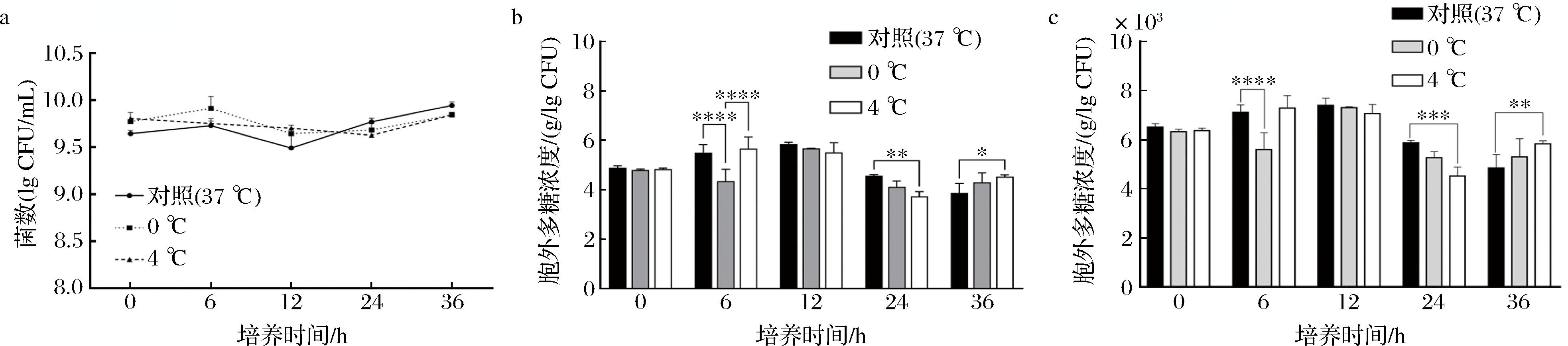
a-低温胁迫下L-ZS9的菌落数;b-低温胁迫对L-ZS9 产EPS的影响;c-低温胁迫下L-ZS9单个菌落产EPS的能力
图3 低温胁迫对L-ZS9菌株产EPS的影响
Fig.3 Effect of low-temperature stress on EPS production by the L-ZS9 strain
类植物乳植杆菌L-ZS9经300 MPa超高压处理后,菌落总数较对照组偏低(图4-a),这可能是由于部分菌在超高压处理过程中死亡。随着培养时间延长,类植物乳植杆菌L-ZS9胞外多糖产量总体呈升高趋势(图4-b)。在300 MPa超高压胁迫条件下,类植物乳植杆菌L-ZS9单个菌落产EPS的能力显著高于对照组(图4-c)。结果表明,在300 MPa超高压胁迫条件能显著提高类植物乳植杆菌L-ZS9产EPS的能力。
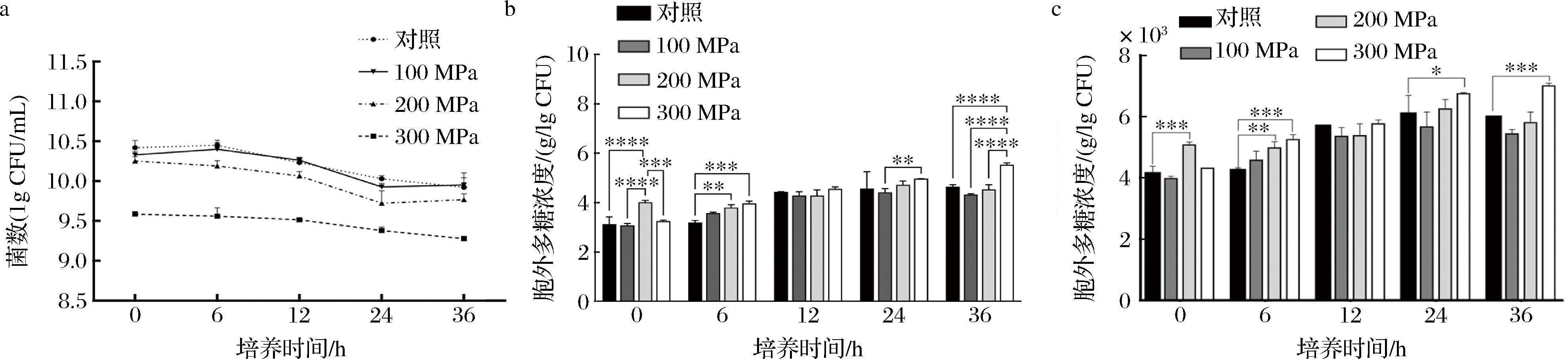
a-不同超高压下L-ZS9的菌落数;b-超高压胁迫对L-ZS9产EPS的影响;c-超高压胁迫下L-ZS9单个菌落产EPS的能力
图4 超高压胁迫对L-ZS9菌株产EPS 的影响
Fig.4 Effect of ultra-high pressure stress on EPS production by the L-ZS9 strain
乳酸菌胞外多糖在工业应用和人体胃肠道系统中都会面临多种环境胁迫,包括酸、盐、冷冻胁迫等[31]。并且目前的乳酸菌胞外多糖EPS生物合成的生产效率偏低,生产成本较高,从而影响了乳酸菌EPS的生物活性以及在各个领域的应用,包括食品工业、医学、药学、环境工业等。本文探究了环境胁迫(酸胁迫、低温胁迫、胆盐胁迫和超高压胁迫)对类植物乳植杆菌L-ZS9产EPS能力的影响,结果表明,酸、胆盐、超高压胁迫条件均对类植物乳植杆菌L-ZS9的EPS合成具有积极影响。
在酸胁迫下,随着pH的降低,L-ZS9产EPS能力升高,在pH为3.0的酸胁迫下,L-ZS9产EPS能力最强,但pH 2.0条件下活菌数为零,说明过酸会导致菌株死亡;在胆盐胁迫下,L-ZS9产EPS的能力均得到提高,0.1%胆盐胁迫下,单个菌落产EPS能力最强,但过高的胆盐浓度也会导致菌株的死亡;总之,在一定浓度的酸和胆盐胁迫下,L-ZS9产EPS能力较对照组显著提高,说明酸和胆盐在一定条件下可以促进L-ZS9产EPS。有研究表明,在酸、胆盐等极端环境下,乳酸菌产生的EPS对菌株具有保护作用,胆盐和酸能够诱导/影响特定菌株胞外多糖(bifidobacterial exopolysaccharides,B-EPS)的产量,从而影响菌株的肠道耐受性[32]。植物乳杆菌VAL6在pH为3.0的胁迫下暴露3 h可产生最高的胞外多糖产量(50.44 g/L),比非胁迫高6.4倍[33]。WANG等[34]的研究结果表明,随着酸碱胁迫水平的增加,球形赖氨酸芽孢杆菌Ya6的对数生长期短暂延长,但胁迫条件下的后期生长速率和EPS产量均高于对照。
在低温胁迫下,0 ℃和4 ℃条件下,L-ZS9单个菌落产EPS能力无明显差异,L-ZS9产EPS能力并未得到显著提升,甚至在一定程度上抑制其产生EPS。ZHAO等[35]调查了低培养温度对Rhodotorula glutinis ZHK胞外多糖产生的影响。结果表明,与对照(25 ℃)相比,5 d后低温(16 ℃)显着增加了粗胞外多糖的产量。ZHANG等[36]也表明,低温(20 ℃)显著提高了嗜盐四联球菌胞外多糖的产量。但从本文的研究结果来看,在低温胁迫下,L-ZS9产EPS的能力并未得到显著提升,甚至在一定程度上抑制其产生EPS,研究结果并不一致。以此可以推测,低温胁迫环境对乳酸菌胞外多糖合成的影响可能因菌株不同而有较大差异。超高压胁迫条件下,乳酸菌胞外多糖合成能力影响的相关研究较少,本文经研究发现,在超高压胁迫下,随着压力的增大,L-ZS9产EPS能力提高,其中培养36 h时,300 MPa条件下单个菌落产EPS能力最强,显著高于对照组和其他试验组。综上,环境胁迫有利于提高乳酸菌产胞外多糖的能力。
乳酸菌可以产生多种不同化学组成和结构的EPS,以应对胃肠道环境和工业应用中不良环境的影响,因此,乳酸菌胞外多糖的合成可能受各种胁迫环境的调控,这将有利于人为通过控制胁迫环境来控制EPS的产生,从而可以广泛地应用到食品工业、医学、药学、生物材料等各个领域。本文为胁迫环境下乳酸菌胞外多糖的合成及其扩大应用提供了一种思路。
[1] 纪亚楠. 环境胁迫对乳酸菌产生物膜、信号分子AI-2及胞外多糖的影响[D].呼和浩特:内蒙古农业大学, 2020.JI Y N.The effects of environmental stress on the production of biofilm, signal molecule AI-2 and EPS in lactic acid bacteria[D].Huhehaote:Inner Mongolia Agricultural University, 2020.
[2] 李金泽, 李丘轲, 单安山.乳酸菌胞外多糖生物学功能及其在畜牧生产中的应用前景[J].动物营养学报, 2021, 33(4):1901-1912.LI J Z, LI Q K, SHAN A S.Biological activities of exopolysaccharides produced by lactic acid bacteria and its application prospect in livestock production[J].Chinese Journal of Animal Nutrition, 2021, 33(4):1901-1912.
[3] 高云云, 李宝坤, 卢士玲, 等.新疆传统乳品中产胞外多糖乳酸菌的筛选及益生特性的研究[J].中国酿造, 2020, 39(5):28-34.GAO Y Y, LI B K, LU S L, et al.Screening and probiotic characteristics of extracellular polysaccharide-producing lactic acid bacteria from traditional dairy products in Xinjiang[J].China Brewing, 2020, 39(5):28-34.
[4] 王辑. 产胞外多糖植物乳杆菌的分离筛选、分子表征及其应用研究[D].长春:吉林大学, 2015.WANG J.Separation, screening, molecular characterization and application of exopolysaccharide-producing Lactobacillus plantarum strains[D].Changchun:Jilin University, 2015.
[5] BEHERA S S, PANDA S K.Ethnic and industrial probiotic foods and beverages:Efficacy and acceptance[J].Current Opinion in Food Science, 2020, 32:29-36.
[6] CIRRINCIONE S, BREUER Y, MANGIAPANE E, et al.‘Ropy’ phenotype, exopolysaccharides and metabolism:Study on food isolated potential probiotics LAB[J].Microbiological Research, 2018, 214:137-145.
[7] PATTEN D A, LEIVERS S, CHADHA M J, et al.The structure and immunomodulatory activity on intestinal epithelial cells of the EPSs isolated from Lactobacillus helveticus sp.rosyjski and Lactobacillus acidophilus sp.5e2[J].Carbohydrate Research, 2014, 384:119-127.
[8] 汪清美, 赵丽平.乳酸菌胞外多糖的结构及益生功能研究进展[J].天津农业科学, 2015, 21(5):19-22.WANG Q M, ZHAO L P.Research progress on structure and function of exopolysaccharides from lactic acid bacteria[J].Tianjin Agricultural Sciences, 2015, 21(5):19-22.
[9] 孟凡岭, 万姝含, 胡风庆.乳酸菌胞外多糖生物活性研究进展[J].辽宁大学学报(自然科学版), 2018, 45(4):379-384.MENG F L, WAN S H, HU F Q.Progress in biological activity of exopolysaccharide of lactic acid bacteria[J].Journal of Liaoning University (Natural Sciences Edition), 2018, 45(4):379-384.
[10] LIANG S N, WANG X Y, LI C, et al.Biological activity of lactic acid bacteria exopolysaccharides and their applications in the food and pharmaceutical industries[J].Foods, 2024, 13(11):1621.
[11] 王琪, 肖融, 王敬, 等.乳酸菌胞外多糖对动物肠道屏障功能的调控作用及机制[J].动物营养学报, 2021, 33(7):3657-3664.WANG Q, XIAO R, WANG J, et al.Regulation and mechanism of lactic acid bacteria exopolysaccharide on intestinal barrier function of animals[J].Chinese Journal of Animal Nutrition, 2021, 33(7):3657-3664.
[12] VINDEROLA G, PERIG N G, DUARTE J, et al.Effects of the oral administration of the exopolysaccharide produced by Lactobacillus kefiranofaciens on the gut mucosal immunity[J].Cytokine, 2006, 36(5-6):254-260.
N G, DUARTE J, et al.Effects of the oral administration of the exopolysaccharide produced by Lactobacillus kefiranofaciens on the gut mucosal immunity[J].Cytokine, 2006, 36(5-6):254-260.
[13] POLAK-BERECKA M, ![]() A, KUBIK-KOMAR A.Optimization of culture conditions for exopolysaccharide production by a probiotic strain of Lactobacillus rhamnosus E/N[J].Polish Journal of Microbiology, 2014, 63(2):253-257.
A, KUBIK-KOMAR A.Optimization of culture conditions for exopolysaccharide production by a probiotic strain of Lactobacillus rhamnosus E/N[J].Polish Journal of Microbiology, 2014, 63(2):253-257.
[14] 关成冉, 赵瑞峰, 马雁, 等.产胞外多糖乳酸菌的筛选及其芒果风味发酵乳的制备[J].中国乳品工业, 2020, 48(4):17-22.GUAN C R, ZHAO R F, MA Y, et al.Screening of lactic acid bacteria for extracellular polysaccharide and preparation of mango fermented milk[J].China Dairy Industry, 2020, 48(4):17-22.
[15] 袁世龙. 豆豉中高产胞外多糖乳酸菌及其在发酵乳中发酵特性的研究[D].南宁:广西大学, 2015.YUAN S L.Study on lactic acid bacteria strains from “douchi” with high yield of exopolysaccharides, and its fermentation charateristics of fermented milk[D].Nanning:Guangxi University, 2015.
[16] 白丽娟. 马奶酒中产胞外多糖瑞士乳杆菌的筛选及多糖的结构和抗氧化活性研究[D].沈阳:沈阳农业大学, 2017.BAI L J.Screening exopolysaccharide-producing L.helveticus and structure, antioxidant activities of exopolysaccharides[D].Shenyang:Shenyang Agricultural University, 2017.
[17] LIU Z Q, ZHANG Z H, QIU L, et al.Characterization and bioactivities of the exopolysaccharide from a probiotic strain of Lactobacillus plantarum WLPL04[J].Journal of Dairy Science, 2017, 100(9):6895-6905.
[18] 张筠, 孟祥晨.乳酸菌的胁迫应答及其对碳水化合物代谢的影响[J].中国食品学报, 2017, 17(6):145-151.ZHANG Y, MENG X C.Stress responses and impact of carbonhydrate metabolism in lactic acid bacteria[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(6):145-151.
[19] LIN H J, ZHANG M J, WANG F Y, et al.A critical review of extracellular polymeric substances (EPSs) in membrane bioreactors:Characteristics, roles in membrane fouling and control strategies[J].Journal of Membrane Science, 2014, 460:110-125.
[20] 李敏, 罗晟, 鄢祖旋, 等.镉胁迫对屎肠球菌CX2-6生理代谢及胞外多糖合成的影响[J].环境科学学报, 2024, 44(2):441-452.LI M, LUO S, YAN Z X, et al.Effect of Cd stress on physiological metabolism and exopolysaccharide synthesis of Enterococcus faecalis CX2-6[J].Acta Scientiae Circumstantiae, 2024, 44(2):441-452.
[21] 赵小茜, 魏旭丹, 陈戴玲, 等.乳酸菌耐酸耐胆盐机制研究进展[J].乳业科学与技术, 2017, 40(3):33-36.ZHAO X X, WEI X D, CHEN D L, et al.A review on the mechanism of acid and bile salt resistance of lactic acid bacteria[J].Journal of Dairy Science and Technology, 2017, 40(3):33-36.
[22] 吴清清. 植物乳杆菌胞外多糖产量与其环境胁迫耐受的相关性研究[D].扬州:扬州大学, 2021.WU Q Q.Study on the relationship between the exopolysaccharides production and environmental stress tolerance of Lactobacillus plantarum[D].Yangzhou:Yangzhou University, 2021.
[23] RUAS-MADIEDO P, GUEIMONDE M, ARIGONI F, et al.Bile affects the synthesis of exopolysaccharides by Bifidobacterium animalis.[J].Applied and Environmental Microbiology, 2009, 75 (4):1204-1207.
[24] 骞宇, 陈孝勇, 易若琨, 等.环境胁迫下食窦魏斯氏菌的耐受性评价[J].食品工业科技, 2018, 39(24):128-133;138.QIAN Y, CHEN X Y, YI R K, et al.Tolerability of Weissella cibaria under different environmental stresses[J].Science and Technology of Food Industry, 2018, 39(24):128-133;138.
[25] 童钰. 副溶血性弧菌耐高压菌株耐压机理的研究[D].杭州:浙江工商大学, 2012.TONG Y.Anti-pressure mechanism of pressure-resistant strains of Vibrio parahaemolyticus[D].Hangzhou:Zhejiang Gongshang University, 2012.
[26] CHENG X, HUANG L, LI K T.Antioxidant activity changes of exopolysaccharides with different carbon sources from Lactobacillus plantarum LPC-1 and its metabolomic analysis[J].World Journal of Microbiology &Biotechnology, 2019, 35(5):68.
[27] 王学良, 韩雪, 王海娟, 等.乳酸菌在各种胁迫下的应激反应研究进展[J].食品工业科技, 2015, 36(6):365-369.WANG X L, HAN X, WANG H J, et al.Studying progress of Lactobacillus’s responses in a variety of stress[J].Science and Technology of Food Industry, 2015, 36(6):365-369.
[28] PRECHTL R M, WEFERS D, JAKOB F, et al.Cold and salt stress modulate amount, molecular and macromolecular structure of a Lactobacillus sakei dextran[J].Food Hydrocolloids, 2018, 82:73-81.
[29] NG I S, XUE C F.Enhanced exopolysaccharide production and biological activity of Lactobacillus rhamnosus ZY with calcium and hydrogen peroxide[J].Process Biochemistry, 2017, 52:295-304.
[30] 胡敏. 胆盐对植物乳杆菌NCU116应激基因和关键生理指标的影响[D].南昌:南昌大学, 2019.HU M.Influences of bile salts on stress genes and key physiological indexes of Lactobacillus plantarum NCU116[D].Nanchang:Nanchang University, 2019.
[31] 吴重德, 黄钧, 周荣清.调控乳酸菌酸胁迫抗性研究进展[J].微生物学报, 2014, 54(7):721-727.WU C D, HUANG J, ZHOU R Q.Regulating acid stress resistance of lactic acid bacteria-A review[J].Acta Microbiologica Sinica, 2014, 54(7):721-727.
[32] 姜陈波, 雍靖怡, 李楠.双歧杆菌胞外多糖的特性及与宿主关系的研究进展[J].食品工业科技, 2019, 40(7):351-357.JIANG C B, YONG J Y, LI N.Research progress on characteristics of bifidobacterial exopolysaccharides and their relationship with host[J].Science and Technology of Food Industry, 2019, 40(7):351-357.
[33] NGUYEN P T, NGUYEN T T, VO T NT, et al.Response of Lactobacillus plantarum VAL6 to challenges of pH and sodium chloride stresses[J].Scientific Reports, 2021, 11(1):1301.
[34] WANG J, CHEN J L, YE S H, et al.Characterization of structure and antioxidant activity of exopolysaccharides from endophytic Lysinibacillus sphaericus Ya6 under acid-base stress[J].Journal of Molecular Structure, 2023, 1294:136402.
[35] ZHAO D, LI C J.Multi-omics profiling reveals potential mechanisms of culture temperature modulating biosynthesis of carotenoids, lipids, and exopolysaccharides in oleaginous red yeast Rhodotorula glutinis ZHK[J].LWT, 2022, 171:114103.
[36] ZHANG M, HONG M T, WANG Z H, et al.Temperature stress improved exopolysaccharide yield from Tetragenococcus halophilus:Structural differences and underlying mechanisms revealed by transcriptomic analysis[J].Bioresource Technology, 2023, 390:129863.