苹果渣低聚木糖的体外模拟胃肠消化-酵解特性
蔡露阳1,戴沙1,李艾莲1,赵燕妮1,陈雪峰1,2*
1(陕西科技大学 食品科学与工程学院,陕西 西安,710021)2(陕西农产品加工技术研究院,陕西 西安,710021)
摘 要 天然低聚糖具有多种活性功能,探究苹果渣低聚木糖(xylooligosaccharides,XOS)的体外胃肠消化以及酵解特性,旨在明确其益生潜能,可为开发苹果渣的综合利用提供新的应用方向。通过体外模拟胃肠消化-酵解试验,测定过程中糖类物质、pH及OD值、短链脂肪酸(short chain fatty acids,SCFAs)含量的变化;由微生物菌群多样性分析以及16S RNA高通量测序测定肠道微生物菌群的组成变化。结果表明,胃肠消化阶段,总糖、还原糖及XOS的含量均未发生显著变化,体外酵解后含量显著下降(P<0.05),说明苹果渣XOS的消化主要发生在体外酵解阶段;酵解阶段XOS组发酵液的pH值显著下降(P<0.05),SCFAs、乙酸、丙酸、正丁酸含量极显著高于空白组(control check,CK)和阳性对照组(inulin positive control,PC)(P<0.001),OD600值极显著高于CK组(P<0.001),说明苹果渣XOS能够促进SCFAs的生成,降低肠道系统pH值,有益于肠道微生物的生长。微生物菌群多样性分析表明,苹果渣XOS可以改善肠道菌落的多样性和均匀度,与其他2组菌落组成存在显著差异;门水平上,XOS组的厚壁菌门相对丰度增加,属水平上,与CK组相比,XOS组的副拟杆菌属丰度增加,与PC组相比,XOS组的考拉杆菌属丰度增加;XOS组与CK组微生物菌落组成差异较大,表明苹果渣XOS对肠道微生物菌落构成产生了影响。研究结果为苹果渣低聚木糖在食品及医药领域的应用提供理论支撑。
关键词 苹果渣;低聚木糖;体外消化;酵解;肠道菌群
DOI:10.13995/j.cnki.11-1802/ts.040666
引用格式:蔡露阳,戴沙,李艾莲,等.苹果渣低聚木糖的体外模拟胃肠消化-酵解特性[J].食品与发酵工业,2025,51(14):202-209.
CAI Luyang,DAI Sha,LI Ailian, et al.Characteristics of in vitro digestion and fermentation of xylooligosaccharide from apple pomace[J].Food and Fermentation Industries,2025,51(14):202-209.
第一作者:硕士,实验师(陈雪峰教授为通信作者,E-mail:chenxf@sust.edu.cn)
基金项目:陕西省科技厅重点研发一般项目(2022NY-014);陕西省农业厅科技创新驱动项目(NYKJ-2022-XA-09)
收稿日期:2023-08-05,改回日期:2023-10-23
低聚木糖(xylooligosaccharides,XOS)以木糖为基础单元,一般含有2~7个木糖分子,相互间的链接键为β-1,4-糖苷键[1]。XOS具有良好的物理和化学特性,其甜度约为蔗糖的40%~50%[2],具有良好的热稳定性和酸稳定性[3];相较其他低聚糖,XOS具有较低的黏度,这可以降低水分活度,提高其在水溶液中的持水能力[4]。XOS是一类具有功能活性的低聚糖,可以有效地优化肠道菌群[5]、调节免疫活性[6]、降低血糖血脂[7]、预防癌症[8]和肠道疾病[9]。苹果渣营养丰富,含有丰富的纤维素和半纤维素[10],可以作为低聚木糖生产的理想原料,同时可以解决苹果加工过程中产生的苹果渣废弃物造成的环境污染问题,实现苹果渣废弃物的高值化利用。
消化是在消化系统中将营养物质分解为可吸收的小分子物质的一个多阶段过程[11]。体外通过模拟胃肠消化,对物质的消化特性进行研究,具有简单、快速、重复性好等优点[12]。体外酵解可以判定微生物菌落的生长情况,可以测定微生物菌落的组成分析,及其代谢产物含量的变化[13]。体外酵解具有试验周期短,检测快速及重复性好等特点,因此被广泛用于功能性食品的评估[14-16]。
目前,苹果渣生物活性物质的研究多集中在果胶、多糖、多酚等营养成分[17-19],未见苹果渣XOS的相关报道,本文通过体外模拟胃肠消化-酵解实验,明确XOS在胃肠消化过程的消化吸收方式、发酵后代谢产物短链脂肪酸(short chain fatty acids,SCFAs)及菌群变化,为苹果渣XOS在食品及医药领域的应用提供理论支撑。
1 材料与方法
1.1 材料与试剂
苹果渣XOS为前期实验室自制[20],纯化后木二糖、木三糖、木四糖总含量为(62.5±0.0.7) g/100 g。
二水合氯化钙、磷酸二氢钾、磷酸氢二钾,分析纯,天津天力公司;胃蛋白酶、猪胆盐、胰蛋白酶,生物试剂,北京索莱宝公司;胃脂肪酶(生物试剂)、胰酶(生物试剂)、氯化血红素(生物试剂)、菊粉(>95.0%),上海源叶公司;蛋白胨、酵母浸粉,生物试剂,北京奥博星公司;维生素K3(生物试剂)、乙酸标准品(>99.0%)、丙酸标准品(>99.0%)、丁酸标准品(>99.0%),上海阿拉丁公司。
1.2 仪器与设备
TS-100C台式恒温摇床,上海合恒公司;PHSJ-5T精密pH计,上海仪电公司;V3200紫外风光光度计,上海佑科公司;LC-10A台式高速离心机,日本Shimadzu公司;WH-3涡旋混合仪,上海沪西公司;6890-5973气相质谱联用仪,美国Agilent公司;LGJ-12A真空冷冻干燥机,北京四环起航公司。
1.3 实验方法
1.3.1 体外模拟胃肠液的配制
体外模拟胃液:准确称量氯化钠3.1 g、氯化钾1.1 g、碳酸氢钠0.6 g和二水和氯化钙0.15 g,完全溶解后加水定容至1 L,用1 mol/L盐酸调节溶液pH值至3.0;取上述溶液150 mL,加入35.4 mg胃蛋白酶、37.5 mg胃脂酶,用1 mol/L盐酸调节pH值至3.0,即得体外模拟胃液。
体外模拟肠液:准确称量氯化钠5.4 g、氯化钾0.65 g、二水合氯化钙0.33 g,溶解后定容至1 L,用1 mol/L碳酸氢钠将溶液中和至pH 7.0;取200 mL上述溶液,加入200 mL 70 g/L胰酶溶液、400 mL 40 g/L胆盐溶液、26 mg胰蛋白酶,并用1 mol/L碳酸氢钠调节溶液pH值至7.0,即得体外模拟肠液。
1.3.2 体外酵解实验设置
体外模拟酵解液的配制参考王科堂[21]的方法。
健康人类粪便细菌液制备:粪便由19~24岁男青年自愿提供,并签署知情同意书,要求6个月内无肠道疾病,2周内未服用过益生菌。粪便与PBS缓冲液的料液比为1∶9(g∶mL),得到100 g/L的粪便浆液,3层纱布过滤,即为健康人类粪便细菌液,厌氧贮存。
共设置3个组进行酵解实验:空白组、菊粉阳性对照组、苹果渣低聚木糖实验组,发酵至6、12、24、48 h 时取上清液测定理化指标,菌群冻存于-80 ℃冰箱进行微生物分析,具体设置如下:
空白对照组(control check,CK):酵解液22.5 mL+粪便细菌液 2.5 mL;
菊粉阳性对照组(inulin positive control,PC):酵解液22.5 mL+粪便细菌液 2.5 mL+菊粉0.125 g;
苹果渣低聚木糖实验组(xylooligosaccharide,XOS):酵解液22.5 mL+粪便细菌液 2.5 mL+XOS 0.125 g。
1.3.3 体外模拟胃肠消化-酵解过程中总糖、还原糖、XOS含量的测定
参照袁旭霜[22]的方法进行测定,总糖测定采用苯酚硫酸法,还原糖测定采用DNS法,XOS含量采用高效离子交换色谱进行检测分析。
1.3.4 体外酵解过程中理化指标的测定
体外酵解液pH测定:采用pH计。
体外酵解细菌菌落总数的测定:取摇匀的酵解液,采用分光光度计,在600 nm处测定菌落总数。
体外酵解后SCFAs含量测定:取1 mL酵解上清液,加入9.2 mol/L硫酸20 μL和无水乙醚800 μL,混合均匀使SCFAs溶解,离心取上清液,采用气相色谱仪进行测试。
1.3.5 体外酵解过程中微生物菌落组成变化测定
采用16S rRNA测序。取冻存于-80 ℃冰箱中的菌群,用基因组DNA试剂盒从粪便中提取DNA。用引物从细菌的整个基因组中扩增、纯化、测序。根据所扩增的区域特点构建小片段文库,并基于illumina NovaSeq测序平台对文库进行双末端测序。经过Reads拼接过滤,OTUs(operational taxonomic units)聚类或ASVs(amplicon sequence variants)降噪,随后对得到的有效数据进行物种注释以及丰度分析,从而揭示样本物种构成。
1.4 数据处理
使用Origin 2022、GraphPad Prism 8软件对数据进行统计学分析。
2 结果与分析
2.1 体外模拟胃消化阶段总糖、还原糖、XOS的含量变化
随着时间的延长,体外模拟胃液中,总糖、还原糖和XOS含量的变化如表1所示。胃消化0.5 h后,总糖含量略有增加,继续进行胃消化,总糖含量未再产生显著性变化;随着胃消化时间的延长,还原糖和XOS含量无显著性差异;在胃消化阶段,总糖、还原糖及XOS含量均未发生显著变化,说明苹果渣XOS在胃消化阶段不易被分解。
表1 胃消化中总糖-还原糖-XOS含量变化 单位:mg/mL
Table 1 Changes of total sugar-reducing sugar-XOS content in gastric digestion
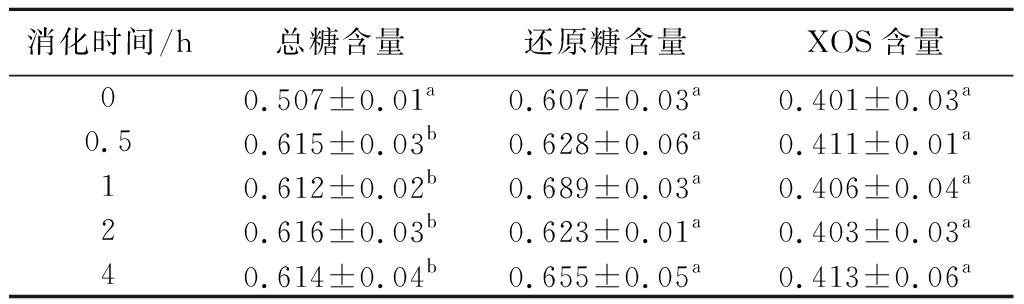
消化时间/h总糖含量还原糖含量XOS含量00.507±0.01a0.607±0.03a0.401±0.03a0.50.615±0.03b0.628±0.06a0.411±0.01a10.612±0.02b0.689±0.03a0.406±0.04a20.616±0.03b0.623±0.01a0.403±0.03a40.614±0.04b0.655±0.05a0.413±0.06a
注:数值以“平均值±标准差”表示,小写字母表示差异显著(P<0.05)(下同)。
2.2 体外模拟肠消化阶段总糖、还原糖、XOS的含量变化
总糖、还原糖和XOS含量在体外模拟肠消化阶段的变化如表2所示。还原糖在模拟肠消化至0.5 h时,含量略减少,这可能是由于在肠消化阶段未产生明显的还原端,也意味着部分还原糖在肠消化阶段被分解[23],与开始时相比,有显著差异(P<0.05),但随着消化时间的延长,无显著差异;随着肠消化的进行,总糖含量和XOS含量均无显著性差异;因此,在体外模拟肠消化阶段,总糖、还原糖和XOS含量均未发生显著变化,说明苹果渣XOS在肠消化阶段未被分解。
表2 肠消化中总糖-还原糖-XOS含量变化 单位:mg/mL
Table 2 Changes of total sugar-reducing sugar-XOS content in intestinal digestion
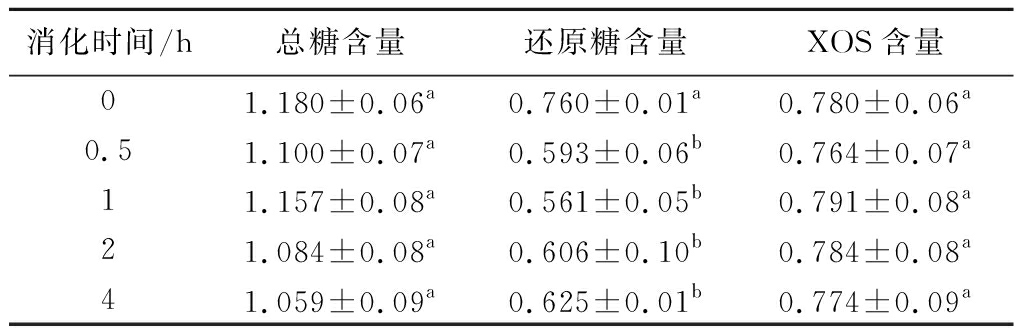
消化时间/h总糖含量还原糖含量XOS含量01.180±0.06a0.760±0.01a0.780±0.06a0.51.100±0.07a0.593±0.06b0.764±0.07a11.157±0.08a0.561±0.05b0.791±0.08a21.084±0.08a0.606±0.10b0.784±0.08a41.059±0.09a0.625±0.01b0.774±0.09a
2.3 体外酵解阶段总糖、还原糖及XOS的含量变化
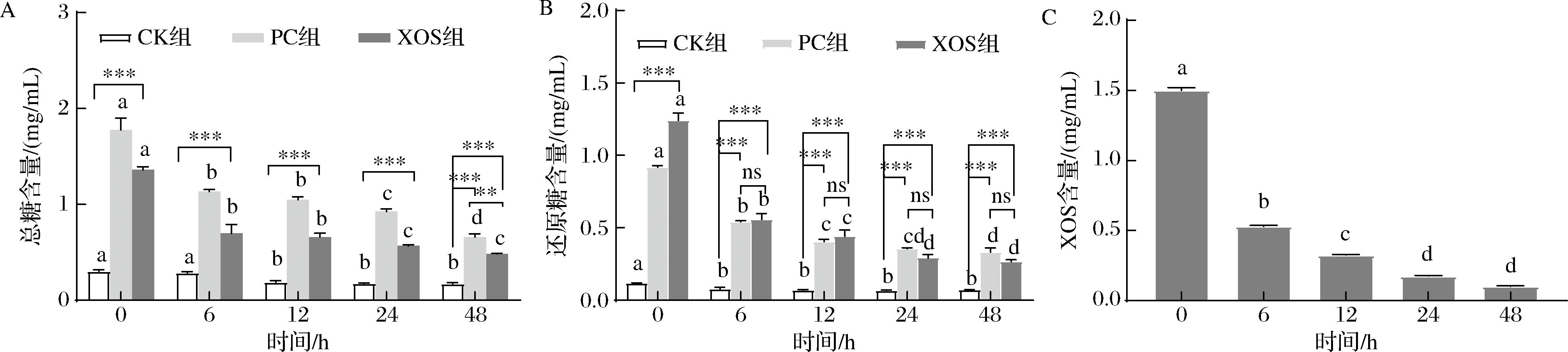
体外酵解阶段总糖、还原糖及XOS含量变化如图1所示。图1-A为总糖含量的变化,XOS组总糖初始含量为(1.36±0.02) mg/mL,发酵6 h后,显著降至(0.7±0.08) mg/mL(P<0.05),PC组总糖初始含量为(1.77±0.10) mg/mL,显著降至(1.13±0.02) mg/mL(P<0.05),而CK组的总糖含量呈缓慢下降趋势;随着体外酵解的进行,3组中总糖含量的下降速度均逐渐缓慢。图1-B为还原糖含量的变化,从图中可知,XOS组还原糖初始含量为(1.24±0.04) mg/mL,发酵6 h后,显著降至(0.56±0.03) mg/mL,PC组还原糖初始含量为(0.92±0.01) mg/mL,显著降至(0.54±0.01) mg/mL,而CK组还原糖含量呈缓慢下降趋势;随着体外酵解的进行,3组还原糖含量的下降速度均逐渐缓慢。图1-C为酵解过程中XOS含量的变化,在酵解进行的前6 h,XOS含量由(1.50±0.02) mg/mL,显著下降至(0.53±0.01) mg/mL(P<0.05),随着酵解时间的延长,XOS含量下降速度逐渐缓慢,其变化趋势与总糖和还原糖相一致。综上所述,酵解液中总糖、还原糖和XOS含量在酵解的前6 h快速下降,可能是因为在此阶段菌落快速生长,大量糖类作为能源和碳源被微生物所消耗,发酵后期,菌落生长速度减慢,需要消耗的糖类减少,导致酵解液中总糖、还原糖和XOS含量下降速度减缓,说明苹果渣XOS可以被肠道微生物利用,促进自身的生长繁殖。
2.4 体外酵解阶段pH的变化
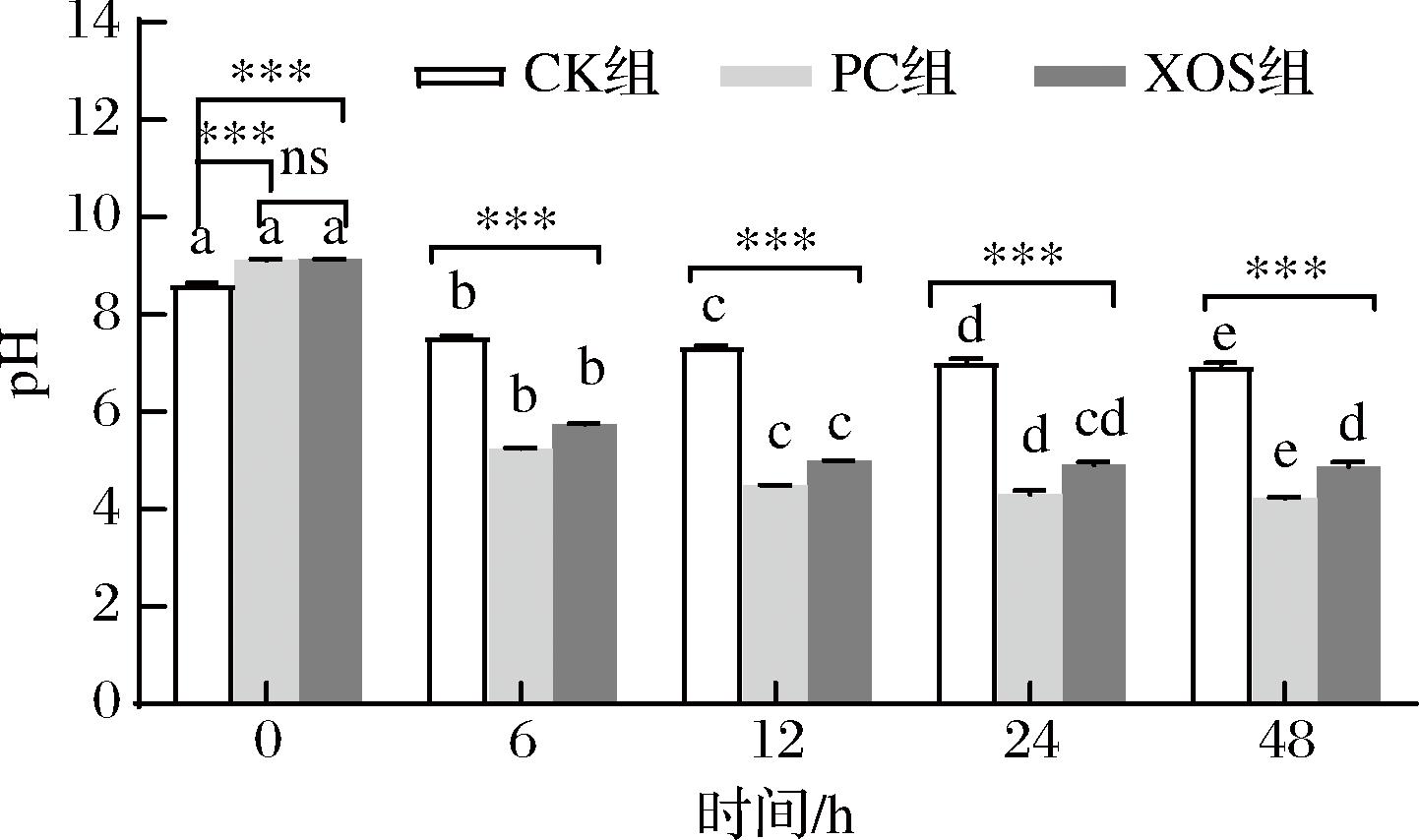
低聚糖可以被肠道微生物消化利用,过程中会产生乳酸及短链脂肪酸,从而改变酵解液的pH,因此pH常被用来评价发酵水平[24]。体外酵解过程中pH的变化情况如图2所示,在实验设定的酵解过程中,3个实验组的酵解液pH均发生显著降低,且呈现先快速下降后变缓慢的趋势;发酵至6 h时,PC和XOS组的pH值由初始时的9.12±0.02、9.13±0.01分别显著下降至5.24±0.01、5.75±0.01(P<0.05),CK组由8.63±0.02下降至7.54±0.03;在整个酵解过程中,与CK组相比,PC、XOS组的pH值下降速度更快,且pH值显著低于CK组,说明在酵解过程中,苹果渣XOS对肠道微生物的生长有促进作用,对肠道环境产生了一定影响。
2.5 体外酵解阶段SCFAs的变化
肠道微生物可以利用未被消化的碳水化合物,生长代谢过程中将产生SCFAs,其主要组成成分为乙酸、丙酸和正丁酸,占总SCFAs的90%以上[25],因此,本文主要研究了酵解过程中这3种酸及总SCFAs含量的变化,结果见图3。随着酵解过程的进行,总SCFAs含量显著增加(P<0.05),与CK组相比,XOS和PC组总SCFAs含量极显著高于CK组(P<0.001),酵解至48 h时,XOS组SCFAs含量为(11.17±0.18) mmol/L。随着酵解过程的进行,发酵液中3种酸含量显著增加(P<0.05),且XOS和PC组3种酸含量极显著高于CK组(P<0.001)。厚壁菌门(Firmicutes)、副拟杆菌属(Parabacteroides)、考拉杆菌属(Phascolarctobacterium),能够促进SCFAs的产生,厚壁菌门可以促进丁酸的产生,其中乳酸菌与乙酸的产生呈正相关,副拟杆菌属和考拉杆菌属与乙酸盐、丙酸盐等SCFAs的分泌有关。综上所述,苹果渣XOS能够促进产生SCFAs,降低肠道内pH,这有益于益生菌的增长,改善肠道健康。
2.6 体外酵解阶段菌落总数的变化
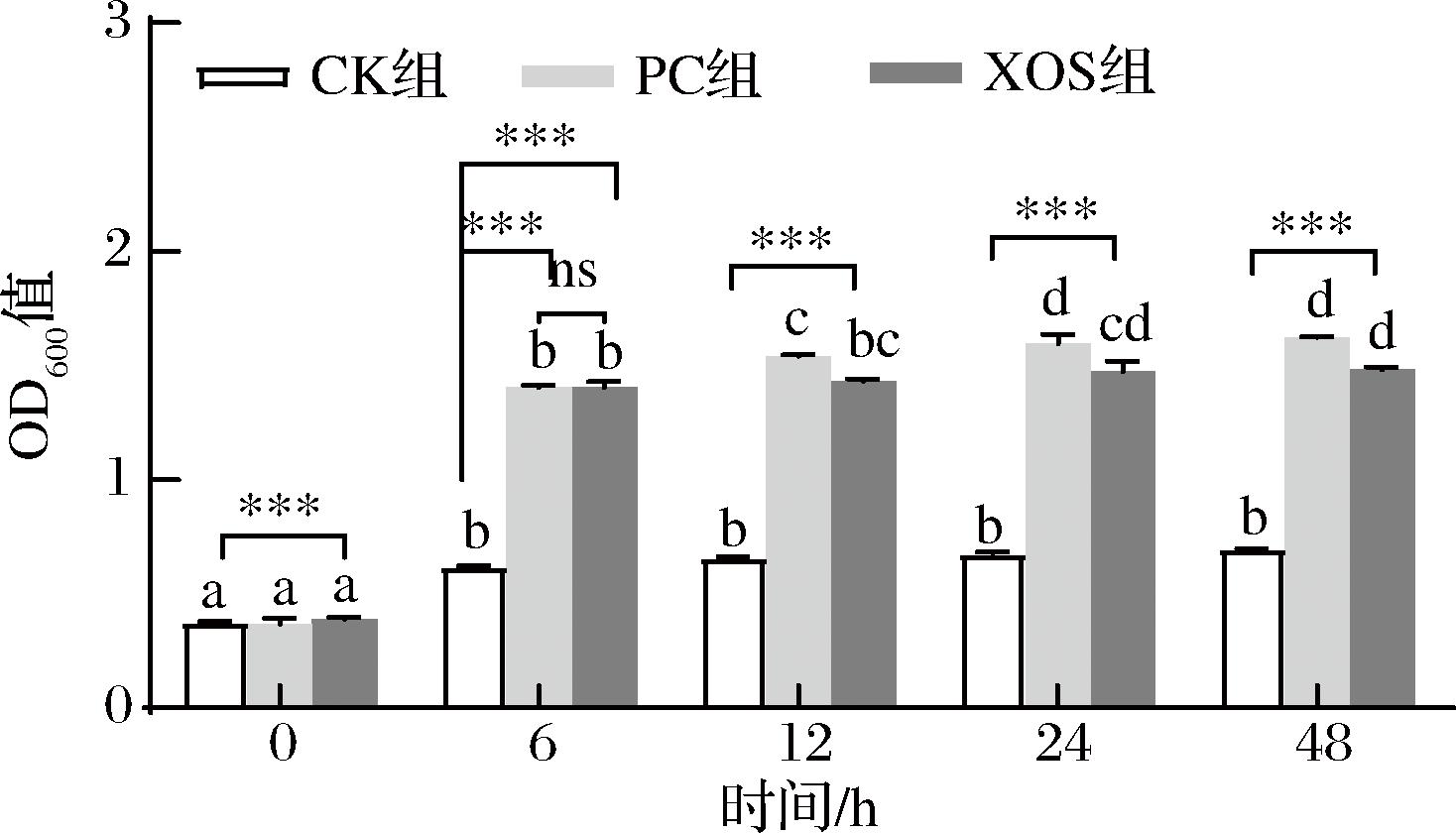
用OD600值表示酵解液中菌落总数的变化,结果如图4所示。随着酵解的进行,XOS、PC及CK组的OD600值均呈现先快速后缓慢上升的趋势,发酵至6 h时,OD600值上升速度最快。在实验设定的体外模拟酵解阶段,XOS和PC组的OD600值均极显著高于CK组(P<0.001),说明苹果渣XOS的添加可以促进肠道微生物的生长繁殖,OD值的变化规律同上文中糖类消耗情况相符,互为印证。
2.7 体外酵解阶段肠道微生物的多样性分析
通过对酵解阶段糖类物质、pH、SCFAs等指标变化情况进行分析,发现苹果渣XOS对肠道微生物生长具有一定的促进作用,进一步通过分析肠道微生物的组成变化来阐明关键物种的作用。
肠道微生物菌群的α多样性分析结果如表3所示,Chao1和Observed features指数常用来揭示物种丰富度,而Simpson和Shannon指数常用来揭示物种均匀度,经过体外酵解后,XOS组的Chao1和Observed features指数显著高于CK组(P<0.05),说明苹果渣XOS能够丰富肠道微生物的物种数目,同时Simpson和Shannon指数也是3组中最高的,说明苹果渣XOS可以改善菌群的均匀度。综上所述,苹果渣XOS可以改善肠道菌落的多样性和均匀度。
表3 酵解液中菌群的α多样性
Table 3 α diversity of flora in the fermentation solution
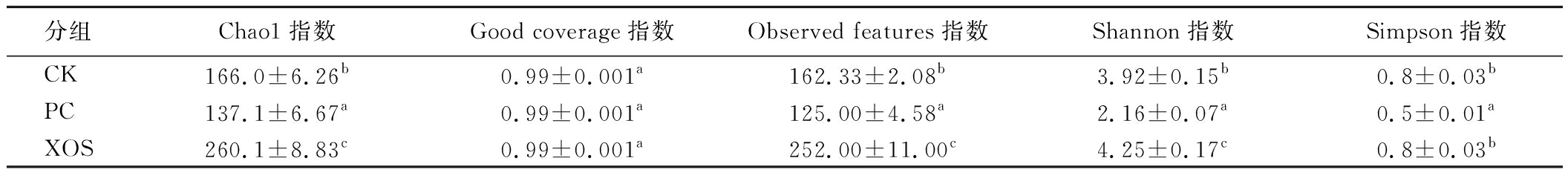
分组Chao1指数Good coverage指数Observed features指数Shannon指数Simpson指数CK166.0±6.26b0.99±0.001a162.33±2.08b3.92±0.15b0.8±0.03bPC137.1±6.67a0.99±0.001a125.00±4.58a2.16±0.07a0.5±0.01aXOS260.1±8.83c0.99±0.001a252.00±11.00c4.25±0.17c0.8±0.03b
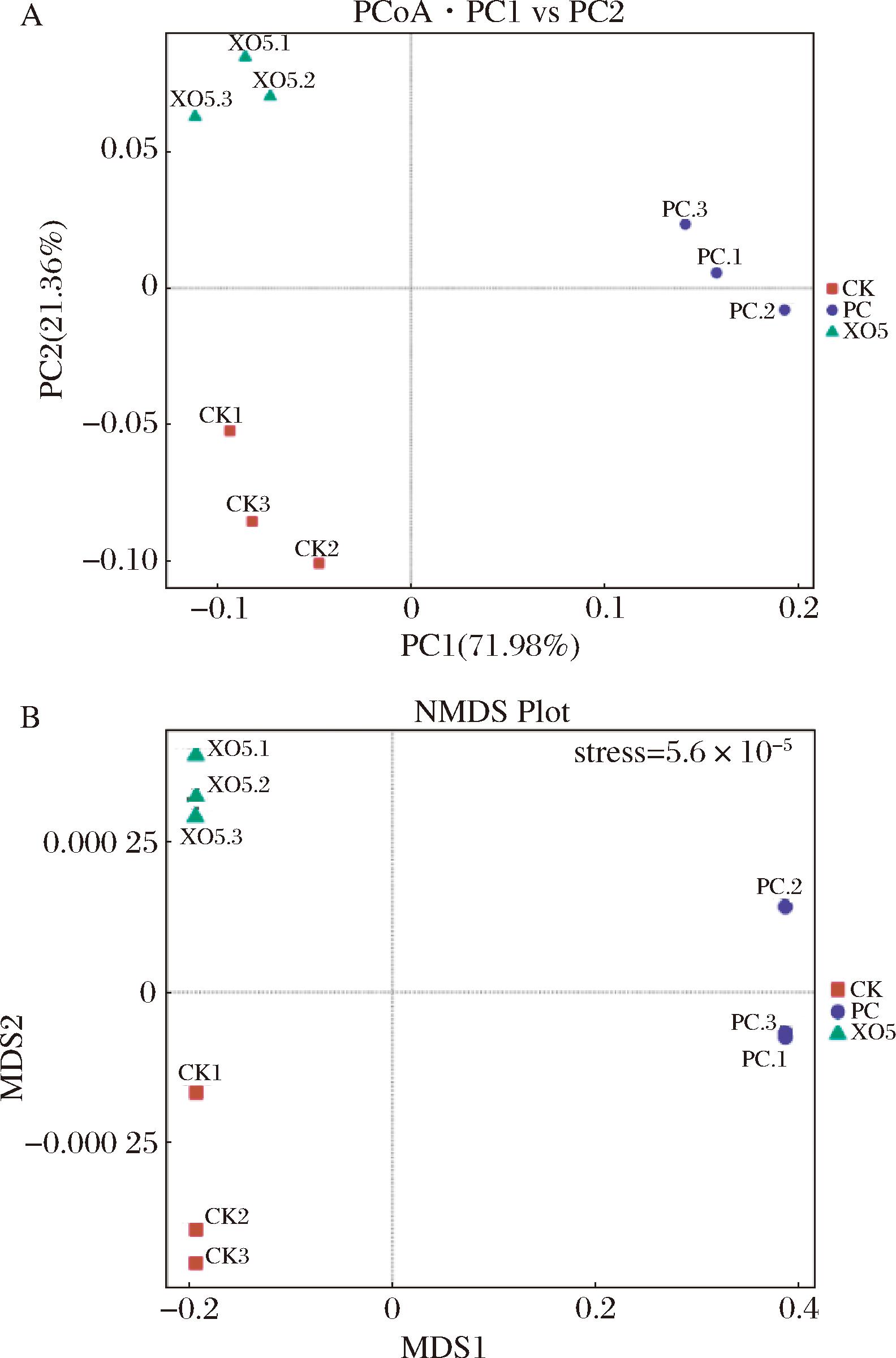
酵解液中微生物菌群的β多样性分析结果如图5 所示。主坐标分析(principal coordinates analysis,PCoA)可以评价不同类群微生物菌落的相关性,由图5-a可知,PCo1和PCo2的累积贡献率为93.34%,说明筛选后的数据对原始数据的解释率可达93.34%,图中3组微生物菌落间是明显分离的,表明XOS组的微生物菌落与其他2组相比,具有显著性差异;图5-b的NMDS图的stress为5.6×10-5,小于0.05,说明数据具有很好的代表性,3组间的数据分布较远,说明3组间微生物菌落具有显著性差异,这与PCoA的分析结果一致。综上所述,苹果渣XOS显著改变了肠道微生物菌群组成,对肠道菌群有很强的干预作用。
2.8 体外酵解液中肠道微生物的组成分析
门水平上,体外酵解液中肠道微生物的分布情况如图6-a、图6-b所示。CK组酵解液中变形菌门、厚壁菌门、拟杆菌门、脱硫杆菌门的相对丰度较高,分别占总菌落的58.9%、13.6%、19.7%、7.3%;变形菌门、厚壁菌门和拟杆菌门在XOS组酵解液中相对丰度较高,分别占总菌落的59.2%、28.7%、10.6%。对比CK组,XOS组酵解液中厚壁菌门相对丰度增加,拟杆菌门相对丰度降低。厚壁菌门中有许多微生物可以利用未被消化的碳水化合物,例如益生菌乳酸菌,其丰度的增加有利于SCFAs的生成,从而使肠道环境pH值发生改变,有利于肠道微生物的生长,厚壁菌门还能促进宿主对微生物、矿物质的吸收和合成[26];有研究将中成药乌梅丸用于结直肠癌的研究中,发现结直肠癌模型小鼠的肠道微生物菌落发生改变,拟杆菌门相对丰度降低、厚壁菌门相对丰度增加来恢复肠道微生物菌群平衡[27]。以上说明苹果渣XOS可以影响肠道微生物菌群在门水平上的组成。
为了更加明晰体外发酵阶段肠道微生物的组成,对肠道微生物属水平上的组成变化进行了分析,结果见图6-c、图6-d。大肠杆菌属(Escherichia-Shigella)、拟杆菌属(Bacteroides)、嗜胆菌属(Bilophila)、摩根氏菌(Morganella)、考拉杆菌属为CK组中相对丰度较高的菌属,共占菌落总数的82.9 %;PC组中相对丰度较高的菌属为大肠杆菌属、肠球菌(Enterococcus)、柯林斯氏菌(Collinsella)、双歧杆菌属(Bifidobacterium),共占菌落总数的94.6%;XOS组中相对丰度较高的菌属为大肠杆菌属、拟杆菌属、克雷伯氏菌属(Klebsiella)、考拉杆菌属、副拟杆菌属,共占菌落总数的69.5%。对比CK组,XOS组的副拟杆菌属丰度升高,副拟杆菌属能够分解碳水化合物并产生SCFAs,同时可以调节免疫系统;与PC组相比,XOS组的考拉杆菌属丰度增加,考拉杆菌属可以改善肠道健康,增强胰岛素敏感性和减少全身炎症。因此,苹果渣XOS可以影响肠道微生物菌群在属水平上的组成。
肠道微生物的线性判别分析效应大小[linear discriminant analysis (LDA) Effect Size, LEfSe]分析图和LDA柱形图如图7所示,选择LDA>4的菌群进行比较。XOS和CK组相比,酵解液中梭菌属(Clostridia)、厚壁菌门、亨盖特菌属(Hungatella)、克雷伯菌属、月形单孢菌目(Selenomonadales)、韦荣氏菌科(Veillonellaceae)组间相对丰度明显增加;PC和XOS组相比,酵解液中柯林斯菌属(Collinsella)、红蝽菌纲(Coriobacteriia)、红椿菌科(Coriobacteriaceae)、红蝽菌目(Coriobacteriales)的组间相对丰度明显增加,而梭菌属、厚壁菌门、亨盖特菌属、克雷伯菌属、月形单孢菌目、韦荣氏菌科组间相对丰度明显降低。XOS组与CK组微生物菌落组成差异较大。由此可知,苹果渣XOS能够影响肠道微生物菌落组成。
3 结论
本文通过体外模拟胃肠消化-酵解实验,探究过程中苹果渣XOS的变化,明确XOS的消化吸收方式以及对肠道微生物菌群的影响。结果表明,苹果渣XOS可以作为糖源被肠道微生物利用,其消化吸收主要发生在体外酵解阶段;酵解阶段XOS组发酵液的pH值显著下降,OD600值极显著增加,苹果渣XOS能够促进SCFAs的产生,总SCFAs、乙酸、丙酸、正丁酸含量极显著高于CK组(P<0.001);在菌群多样性方面,添加XOS可以改善肠道菌落的多样性和均匀度;β多样性分析可知,XOS组的微生物菌落与其他2组存在显著性差异。在菌群组成方面,门水平上,XOS组中变形菌门、厚壁菌门、拟杆菌门相对丰度较高;属水平上,与CK组相比,XOS组的副拟杆菌属和考拉杆菌属丰度增加;XOS组物种丰度低于CK组,与CK组微生物菌落组成差异较大。综上所述,苹果渣XOS能够影响肠道微生物菌落组成和代谢功能,为苹果渣低聚木糖的高值化利用提供理论依据。
参考文献
[1] KUMAR V, SATYANARAYANA T.Applicability of thermo-alkali-stable and cellulase-free xylanase from a novel thermo-halo-alkaliphilic Bacillus halodurans in producing xylooligosaccharides[J].Biotechnology Letters, 2011, 33(11):2279-2285.
[2] SAMANTA A K, SENANI S, KOLTE A P, et al.Production and in vitro evaluation of xylooligosaccharides generated from corncobs[J].Food and Bioproducts Processing, 2012, 90(3):466-474.
[3] YANG S Q, WU C X, YAN Q J, et al.Nondigestible functional oligosaccharides:Enzymatic production and food applications for intestinal health[J].Annual Review of Food Science and Technology, 2023, 14: 297-322.
[4] PENG P, PENG F, BIAN J, et al.Studies on the starch and hemicelluloses fractionated by graded ethanol precipitation from bamboo Phyllostachys bambusoides f.Shouzhu Yi[J].Journal of Agricultural and Food Chemistry, 2011, 59(6):2680-2688.
[5] PAN J, YIN J, ZHANG K, et al.Dietary xylo-oligosaccharide supplementation alters gut microbial composition and activity in pigs according to age and dose[J].AMB Express, 2019, 9(1):134.
[6] LIU X L, CAO R, XU Y.Acidic hydrolyzed xylo-oligosaccharides bioactivity on the antioxidant and immune activities of macrophage[J].Food Research International, 2023, 163:112152.
[7] WANG J, CAO Y P, WANG C T, et al.Wheat bran xylooligosaccharides improve blood lipid metabolism and antioxidant status in rats fed a high-fat diet[J].Carbohydrate Polymers, 2011, 86(3):1192-1197.
[8] QIAN S Q, ZHOU J, CHEN X Y, et al.Evaluation of an efficient fed-batch enzymatic hydrolysis strategy to improve production of functional xylooligosaccharides from maize straws[J].Industrial Crops and Products, 2020, 157:112920.
[9] TONG Y J, WANG Q Y, ZHANG J Y, et al.Orally administered xylo-oligosaccharides (XOS) ameliorates diarrhea symptoms in mice via intestinal barrier improvement and gut microbiota modulation[J].Molecular Nutrition &Food Research, 2022, 66(20):e2200171.
[10] BHUSHAN S, KALIA K, SHARMA M, et al.Processing of apple pomace for bioactive molecules[J].Critical Reviews in Biotechnology, 2008, 28(4):285-296.
[11] MEI X Y, YANG W J, HUANG G L, et al.The antioxidant activities of balsam pear polysaccharide[J].International Journal of Biological Macromolecules, 2020, 142:232-236.
[12] FENG X J, BIE N N, LI J Y, et al.Effect of in vitro simulated gastrointestinal digestion on the antioxidant activity, molecular weight, and microstructure of polysaccharides from Chinese yam[J].International Journal of Biological Macromolecules, 2022, 207:873-882.
[13] LEY R E, PETERSON D A, GORDON J I.Ecological and evolutionary forces shaping microbial diversity in the human intestine[J].Cell, 2006, 124(4):837-848.
[14] SCHROPP N, STANISLAS V, MICHELS K B, et al.How do prebiotics affect human intestinal bacteria:Assessment of bacterial growth with inulin and XOS in vitro[J].International Journal of Molecular Sciences, 2023, 24(16):12796.
[15] LE BASTARD Q, CHAPELET G, JAVAUDIN F, et al.The effects of inulin on gut microbial composition:A systematic review of evidence from human studies[J].European Journal of Clinical Microbiology &Infectious Diseases, 2020, 39(3):403-413.
[16] LUO Q Y, LI X J, LI H Y, et al.Effect of in vitro simulated digestion and fecal fermentation on Boletus auripes polysaccharide characteristics and intestinal flora[J].International Journal of Biological Macromolecules, 2023, 249:126461.
[17] MA Y C, LUO J, XU Y.Co-preparation of pectin and cellulose from apple pomace by a sequential process[J].Journal of Food Science and Technology, 2019, 56(9):4091-4100.
[18] FERNANDES P A R, SILVA A M S, EVTUGUIN D V, et al.The hydrophobic polysaccharides of apple pomace[J].Carbohydrate Polymers, 2019, 223:115132.
[19] 张馨月, 王济瀚, 孙雯雯, 等.超声波-微波协同提取苹果渣多酚工艺优化及其性能评价[J].食品科技, 2022, 47(11):185-191.ZHANG X Y, WANG J H, SUN W W, et al.Optimization of ultrasonic-microwave synergistic extraction of polyphenols from apple residue and its property evaluation[J].Food Science and Technology, 2022, 47(11):185-191.
[20] 戴沙, 陈雪峰, 蔡露阳, 等.酶解苹果渣制备低聚木糖的工艺优化[J].食品科技, 2024, 49(1):183-190.DAI S, CHEN X F, CAI L Y, et al.Optimization of preparation of Xylo-oligosaccharides from apple residue by enzymatic hydrolysis[J].Food Science and Technology, 2024, 49(1):183-190.
[21] 王科堂. 猕猴桃果粉的研制及其降脂活性研究[D].西安:陕西科技大学, 2023.WANG K T.Kiwifruit powder formulation and hypolipidemic activity study[J].Xi’an:Shaanxi University of Science and Technology, 2023.
[22] 袁旭霜. 应用冠突散囊菌液态、固态发酵不同种类茶叶的作用机理[D].西安:陕西科技大学, 2023.YUAN X S.The mechanism of liquid and solid fermentation of different kinds of tea by Aspergillus cristatus[J].Xi’an:Shaanxi University of Science and Technology, 2023.
[23] YUAN Q, HE Y, XIANG P Y, et al.Effects of simulated saliva-gastrointestinal digestion on the physicochemical properties and bioactivities of okra polysaccharides[J].Carbohydrate Polymers, 2020, 238:116183.
[24] HUANG F, LIU Y, ZHANG R F, et al.Structural characterization and in vitro gastrointestinal digestion and fermentation of Litchi polysaccharide[J].International Journal of Biological Macromolecules, 2019, 140:965-972.
[25] MARTIN-GALLAUSIAUX C, MARINELLI L, BLOTTI RE H M, et al.SCFA:Mechanisms and functional importance in the gut[J].Proceedings of the Nutrition Society, 2021, 80(1):37-49.
RE H M, et al.SCFA:Mechanisms and functional importance in the gut[J].Proceedings of the Nutrition Society, 2021, 80(1):37-49.
[26] BARCZYNSKA R, SLIZEWSKA K, LITWIN M, et al.Effects of dietary fiber preparations made from maize starch on the growth and activity of selected bacteria from the Firmicutes, Bacteroidetes, and Actinobacteria Phyla in fecal samples from obese children[J].Acta Biochimica Polonica, 2016, 63(2):261-266.
[27] 殷琳, 夏文睿, 黄国鑫, 等.中药-肠道菌群互作与宿主自身代谢免疫稳态相关性的研究进展[J].中草药, 2022, 53(8):2526-2538.YIN L, XIA W R, HUANG G X, et al.Research progress on correlation between traditional Chinese medicine-gut microbiota and host’s own metabolic immune homeostasis[J].Chinese Traditional and Herbal Drugs, 2022, 53(8):2526-2538.
Characteristics of in vitro digestion and fermentation of xylooligosaccharide from apple pomace
CAI Luyang1, DAI Sha1, LI Ailian1, ZHAO Yanni1, CHEN Xuefeng1,2*
1(School of Food Science and Engineering, Shaanxi University of Science and Technology, Xi’an 710021, China)2(Shaanxi Agricultural Product Processing Technology Research Institute, Xi’an 710021, China)
ABSTRACT Natural oligosaccharides own a variety of active functions.Digestive and glycolysis properties of xylooligosaccharide (XOS) from apple pomace in vitro were explored to clarify its probiotic potential and to provide a new application direction for the comprehensive utilization of apple pomace.The changes in carbohydrate, pH, and OD values and short-chain fatty acid (SCFAs) contents were measured in the simulated gastrointestinal digestion and fermentation test.Microbial diversity analysis and 16 s RNA high-throughput sequencing were included to determine alterations of intestinal microbiota.Results showed that the contents of total sugar, reducing sugar and XOS did not significantly change in the gastrointestinal digestion stage, but significantly decreased after in vitro fermentation (P<0.05), which indicated that the digestion of XOS mainly occurred in the fermentation stage.The pH value of fermentation broth in the XOS group decreased significantly (P<0.05).The contents of SCFAs, acetic acid, propionic acid, and n-butyric acid were extremely significantly higher than those in the other groups (P<0.001).OD600 value was significantly higher than that in the CK group (P<0.05).Results indicated that apple pomace XOS could promote the production of SCFAs and reduce the pH value, which could be beneficial to the growth of intestinal microorganisms.Microbial diversity analysis showed that XOS could improve the diversity and evenness of intestinal microbiota.The composition of intestinal microbiota in the XOS group was significantly different from the other two groups.At the phylum classification level, the relative abundance of firmicutes increased in the XOS group.At the genus classification level, the abundance of paracoides in the XOS group and the abundance of koala bacillus in the XOS group increased, separately compared with the CK group and with the PC group.The species abundance in the XOS group was lower than that in the CK group, which indicated that apple residue XOS could affect the composition of intestinal microbiota.Results of this study provide theoretical support for the application of XOS from apple pomace in food and medicine.
Key words apple pomace; xylo-oligosaccharide; in vitro digestion; glycolysis; intestinal flora






 RE H M, et al.SCFA:Mechanisms and functional importance in the gut[J].Proceedings of the Nutrition Society, 2021, 80(1):37-49.
RE H M, et al.SCFA:Mechanisms and functional importance in the gut[J].Proceedings of the Nutrition Society, 2021, 80(1):37-49.