基于网络药理学及分子对接探讨白桦茸防治阿尔兹海默病的潜在作用机制
符丹丹1,2,3*,邵鑫源1,张琦1,张迪1,彭心暖1,刘燕山1,孙建瑞1,2,3,宫强1,2,3
1(河南科技大学 食品与生物工程学院,河南 洛阳,471023)2(河南省食品微生物工程技术研究中心, 河南 洛阳,471023)3(微生物资源开发与利用河南科技大学重点实验室, 河南 洛阳, 471023)
摘 要 该研究利用网络药理学和分子对接技术,进行了白桦茸的活性成分、关键靶点和信号通路分析,以明确白桦茸防治阿尔茨海默病(Alzheimer’s disease,AD)的潜在作用机制。从TCMSP等数据库和文献获得白桦茸的活性成分以及作用靶点,通过GeneCards等数据库获得疾病的靶点,得到白桦茸和阿尔茨海默病的共同作用靶点,通过String数据库构建共同靶点的蛋白质互作(protein-protein interaction,PPI)网络图,运用Cytoscape软件构建“活性成分-靶点”网络图,并通过DAVID和Metascape数据库进行GO富集和KEGG通路富集分析,再通过Autodock软件进行分子对接模拟。最终筛选得9种活性成分,阿尔茨海默病筛选到3 397个靶点,由PPI筛选得到MMP3、IL6、AKT1、IL10、TNF、MAPK1和HSP90AB1等关键靶点20个,由KEGG通路分析可知桦褐孔菌通过脂质和动脉粥样硬化通路、乙肝、人巨细胞病毒感染、白介素-17及阿尔茨海默病等信号通路发挥抗AD作用。由GO富集分析发现其与RNA聚合酶Ⅱ转录因子复合物、质膜的组成部分、RNA聚合酶Ⅱ启动子的pri-miRNA正调节转录通路等相关。将20个关键靶点与白桦茸活性成分分子对接,验证均能稳定结合,预测槲皮素等化学成分在缓解阿尔茨海默病中发挥重要作用。白桦茸通过多成分、多靶点、多通路干预脂质和动脉粥样硬化及阿尔茨海默病等多个信号通路,从而发挥白桦茸抗阿尔茨海默病的功能,为药食同源保健食品的开发提供理论依据。
关键词 桦褐孔菌;药食同源;老年痴呆;蛋白质-蛋白互作;信号通路
DOI:10.13995/j.cnki.11-1802/ts.042100
引用格式:符丹丹,邵鑫源,张琦,等.基于网络药理学及分子对接探讨白桦茸防治阿尔兹海默病的潜在作用机制[J].食品与发酵工业,2025,51(14):228-235.
FU Dandan,SHAO Xinyuan,ZHANG Qi, et al.Potential mechanism of chaga mushroom in treatment of Alzheimer’s disease based on network pharmacology and molecular docking[J].Food and Fermentation Industries,2025,51(14):228-235.
第一作者:博士,讲师 (通信作者, E-mail:fudandanly@126.com)
基金项目:河南省自然科学基金项目(242300420145);河南省科技攻关项目(232102110134)
收稿日期:2025-01-10,改回日期:2025-03-17
阿尔茨海默病(Alzheminer’s disease,AD)是老年人中常见的一种疾病类型,表现为健忘甚至失忆,阅读和表达能力下降。阿尔茨海默病引起的不可逆的神经元损伤对个人和家庭都是一种严重的负担,已成为全球最大的公共卫生挑战之一[1]。随着老龄化社会的到来,这一问题也将越发严重,《World Alzheimer Report 2023》指出全世界已经有超过0.5亿人患有老年痴呆,到2050年甚至可能会达到1.3亿[2],可见阿尔茨海默病的治疗已成为全世界需面对的难题之一。AD的发病机制较为复杂,原理虽还未完全阐明,但发现应与β-淀粉样蛋白(amyloid β-protein,Aβ)沉积及微管结合蛋白(microtubule-associated protein,Tau)蛋白过度磷酸化、神经炎症、线粒体功能障碍、肠道菌群紊乱、微生物感染和自身免疫障碍等机制[3]有关,目前对于该病并无有效的治疗药物,临床上主要推荐他克林(tacrine)、多奈哌齐(donepezil)等药物,近些年还有乙酰胆碱酯等酶类抑制剂和阿杜卡奴等单抗(aducanumab)类产品应用到此病的临床,这些药物无法根治只起到改善、延缓症状作用,有的还具有严重不良反应等缺点[4]。目前采用中医药进行AD治疗的研究也越来越受到关注,以生物信息学为媒介的分子对接模拟和网络药理学方法在药物研发中大大减少了筛选范围,大大提高了药物研发的速度,具有明显的优势。因此针对病因不清、多因素相关的复杂性疾病,中医药多靶点、多途径治疗的特点可能比单靶点治疗更具有优势[3]。如黄连解毒汤可通过刺激脑脊液中TNF-α(tumor necrosis factor,肿瘤坏死因子α)/IL-10、IL-8/IL-10回调,改善脑内炎症微环境和肠道菌群丰度,使大脑皮层和海马中淀粉样蛋白Aβ减少来缓解AD的发展[5]。四君子汤可调节葡萄糖代谢、呼吸链相关酶活性,在启动线粒体自噬、调节线粒体分裂蛋白/融合蛋白平衡等途径方面发挥了巨大的潜力[6]。中药单体中如五味子可通过激活NF-κB(nuclear factor-kappa B核因子)/MAPK(mitogen activated protein kinase,丝裂原活化蛋白激酶)通路,减少胞外调节蛋白激酶磷酸化,使TNF-α、IL-6、IL-1β下调表达,从而改善小鼠的认知和记忆能力[7]。黄芩中所含的黄芩苷成分可抑制神经细胞铁死亡、改善脑出血,有利于对AD的治疗[8];黄芪中的环黄芪醇可增加紧密链接支架蛋白的表达,增强血脑屏障,增加 Aβ外排来清除蛋白的沉积[9];刺五加能通过调节神经递质来改善 AD记忆障碍等来减轻AD症状[10]。人参皂苷能增加BACE1等蛋白表达水平,降低淀粉样蛋白Aβ的表达,改善细胞凋亡[11]等。真菌中也有如灵芝三萜可以调节肠道菌群组成来减轻炎症细胞浸润、缓解细胞黏膜脱落损伤来治疗AD[12]。
白桦茸,也叫桦褐孔菌(Inonotus obliquus),是担子菌亚门((Basidiomycotina)层菌纲(Hymenomycetes)锈革孔菌目(Hymenochaetales)锈革孔菌科(Hymenochaetaceae)纤孔菌属(Inonotus)真菌,常寄生于白桦树等落叶乔木的树干上,野生的白桦茸因为在低温环境下生长缓慢,通常需要10~15年才能具有药用价值,会形成5~40 cm直径的楔形菌核锥,突穿树皮形成胆状结构。主要产地有俄罗斯、中国、日本和北欧等地区。桦褐孔菌有效成分主要有多糖、三萜类、甾类、酚酸类、黄酮类和芳香物质等多种成分[13]。现研究发现桦褐孔菌具有良好的抗癌、抗病毒、抗炎、抗衰老、增强免疫力、降血糖、降血压、调节血脂等药理特性[14]。如刘畅等[15]发现桦褐孔菌多糖对肾病小鼠的体重能有效抑制,对修复肾损伤、缓解肾衰竭和糖尿病小鼠肾指数改善非常明显;程欢欢等[16]从桦褐孔菌中找到了桦褐孔菌醇、白桦脂酸等24种三萜类成分,可通过CASP3、CASP7等蛋白的调控,诱导癌细胞凋亡;武建平等[17]从桦褐孔菌中筛选出桦褐孔菌酸、栓菌酸等19种成分,具有明显降血糖作用。白桦茸中丰富的多糖和三萜类成分越来越受到国人的重视[18],它能发挥抗神经系统疾病作用[19],具有较大的保健开发潜力。本研究以网络药理学与分子对接技术为基础,探索白桦茸活性成分治疗阿尔茨海默病的潜在靶点和通路,发掘其分子机制,为研制和开发更多种的白桦茸保健产品提供科学依据。
1 材料与方法
1.1 白桦茸活性成分的获取及筛选
根据文献及TCMSP(Traditional Chinese Medicine Systems Pharmacology Database,https://tcmsp-e.com/tcmsp.php)、TCMID(Traditional Chinese Medicines Integrated Database,https://www.bidd.group/TCMID/)、ETCM(The Encyclopedia of Traditional Chinese Medicine,http://www.tcmip.cn/ETCM/)、BATMAN-TCM(Bioinformatics Analysis Tool for Molecular Mechanism of Traditional Chinese Medicine,http://bionet.ncpsb.org.cn/batman-tcm)等数据库收集白桦茸的化学成分,将收集的所有成分以口服生物利用度(oral bioavailability,OB)≥30%和药物相似性(drug-likeness,DL)≥0.15作为筛选的条件。
1.2 阿尔茨海默病的靶点
以“Alzheimer’s disease”作为关键词,通过GeneCards(https://www.genecards.org/)、DiSGeNET(Disease Gene Network,https://www.disgent,org/search)数据库对疾病靶点进行收集,将获得阿尔茨海默病的靶点和白桦茸活性成分的靶点通过Venny获得交集,交集靶点上传到STITCH(Search Tool for Interacting Chemicals,http://stitch.embl.de)网站进行蛋白质互作分析,选择“Multiple names”和“Homo sapiens”,设置交互分数>0.4,构建PPI网络图,进行关键靶点的筛选。
1.3 “中药化合物-靶点-通路”调控网络的构建
将筛选得到的数据,按照“成分-相关蛋白”、“成分-交集蛋白靶点”、“相关蛋白-交集蛋白靶点”、“GO通路-交集蛋白靶点”、“疾病-交集蛋白靶点”整理到一个网络文件。导入Cytoscape软件进行网络分析,点击Analyze Network计算degree值,选择“CentiScaPe”插件进行关键靶点的筛选,筛选关键词为“degree”、“closeness”、“betweenness”,选择“highest confidence(0.900)”根据以上阈值进行筛选关键靶点。通过 Cytoscape软件构建“活性化合物-靶点-通路”网络,以degree值为参数调节节点的大小,展示其重要程度。
1.4 GO富集和KEGG通路数据收集
利用DAVID(Database for Annotation, Visualization and Integrated Discovery,https://david.ncifcrf.gov)数据库和Metascape(http://metascape.org)网站进行GO分析和KEGG通路分析。将关键基因上传到数据库进行分析,选择具有代表性的前20条结果的描述性信息、P值、lg P和Count值作为绘图数据。然后通过在DAVID网站同样进行富集分析,GO富集分析的结果将BP(biological process)、CC(cellular component)、MF(molecular function)的数据各取前10条信息收集在表格中,利用“微生信”(https://www.bioinformatics.com.cn)进行气泡图的绘制,分析结果相互验证筛选GO和KEGG数据。
1.5 分子对接验证
为验证白桦茸缓解阿尔茨海默症潜在关键靶点的准确性,将核心活性成分与1.2节中度值较高靶点进行分子对接。从PDB数据库(https://www.rcsb.org/)下载靶点蛋白结构,活性成分与靶点蛋白结构均导入Pymol软件进行脱水和去残基配体操作,再通过Autodock软件进行预处理,将目标小分子进行修饰并设为配体,“edit”及“hydrogens”中选择“add”进行加H,点击“gird”-“gird Box”,调整立方体盒子包裹住靶点蛋白,运行AutoGird软件,选择打开靶点蛋白及小分子进行分子对接,设置对接参数,结果运用Pymol、DiscoveryStudio软件进行输出优化。
2 结果与分析
2.1 成分的收集与活性成分的筛选
将从文献中查找到的桦褐孔菌成分,利用化源网(https://www.chemsrc.com)找到的CAS号,在TCMSP数据库中进行OB≥30%且DL≥0.18的活性成分筛选,得到9种有效活性成分和177个相关蛋白,详见表1。
表1 桦褐孔菌活性成分
Table 1 The active components of Inonotus obliquus
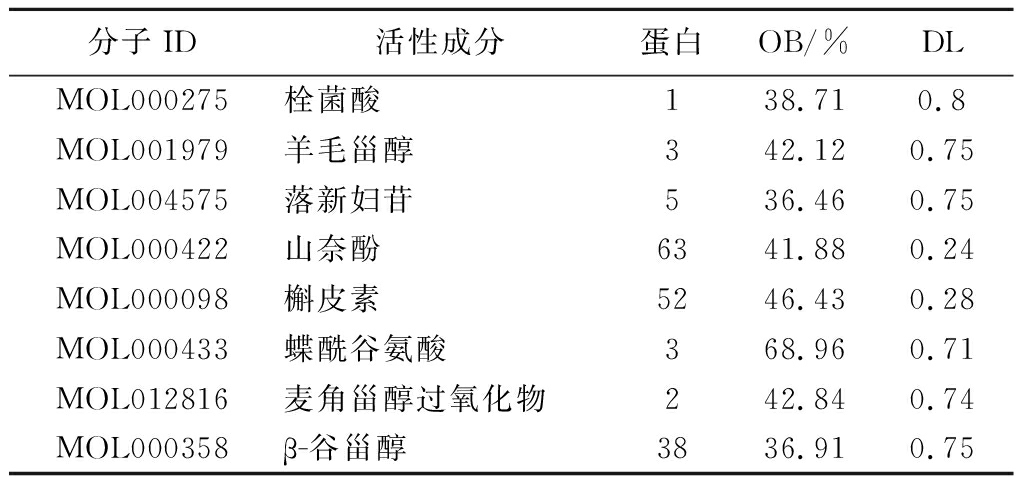
分子ID活性成分蛋白OB/%DLMOL000275栓菌酸138.710.8MOL001979羊毛甾醇342.120.75MOL004575落新妇苷536.460.75MOL000422山奈酚6341.880.24MOL000098槲皮素5246.430.28MOL000433蝶酰谷氨酸368.960.71MOL012816麦角甾醇过氧化物242.840.74MOL000358β-谷甾醇3836.910.75
2.2 疾病靶点的筛选
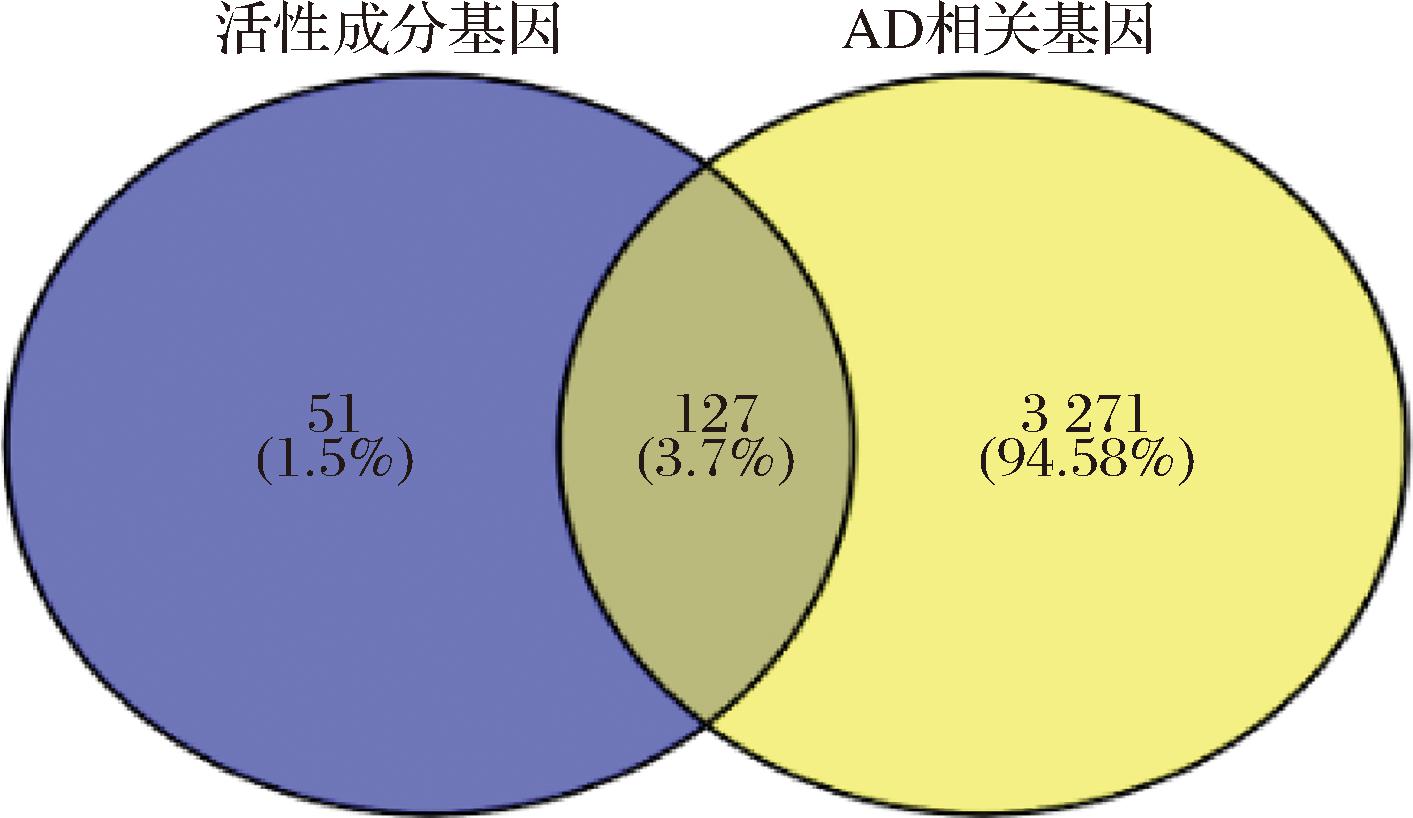
通过GeneCards、DiSGeNET数据库检索,获得阿尔茨海默病靶点数3 397个。然后将疾病靶点和白桦茸活性成分对应的靶点通过Venny软件获得交集(图1),共有基因有127个,占比3.7%,此交集靶点可作为白桦茸治疗阿尔茨海默的潜在作用靶点。
2.3 蛋白相互作用PPI网络图
通过String数据库进行蛋白互作分析, 导入127个共有靶点,构建PPI网络图(附图1,https://doi.org/10.13995/j.cnki.11-1802/ts.042100),通过“highest confidence(0.900)筛选出的重要蛋白靶点有RELA、AKT1、TNF、IL6、MAPK1、TP53等。其中如RELA蛋白在免疫系统和炎症反应中起着重要的作用,参与调节免疫细胞和细胞凋亡,赵丽洁等[20]研究证明RELA蛋白水平与子宫内膜癌有密切的关系。TNF是肿瘤坏死因子,程欢欢等[16]阐述了胞膜上受体蛋白可与胞外游离的配体TNF-α结合,发生级联反应激活凋亡蛋白Caspase-3,引发一系列炎症反应,最终细胞凋亡。MAPK1属于丝裂原活化蛋白激酶MAPK家族,是控制许多细胞过程如增殖、氧化应激、存活和凋亡的重要途径,陈宣世等[21]阐述了在AD的发病机制中,MAPK 通路通过诱导神经元凋亡、β和γ分泌酶的转录与活化以及淀粉样蛋白Aβ前体蛋白Tau磷酸化来促进AD 疾病的进一步发展的机理。
2.4 关键靶点的筛选及药物成分-关键靶点网络图的构建
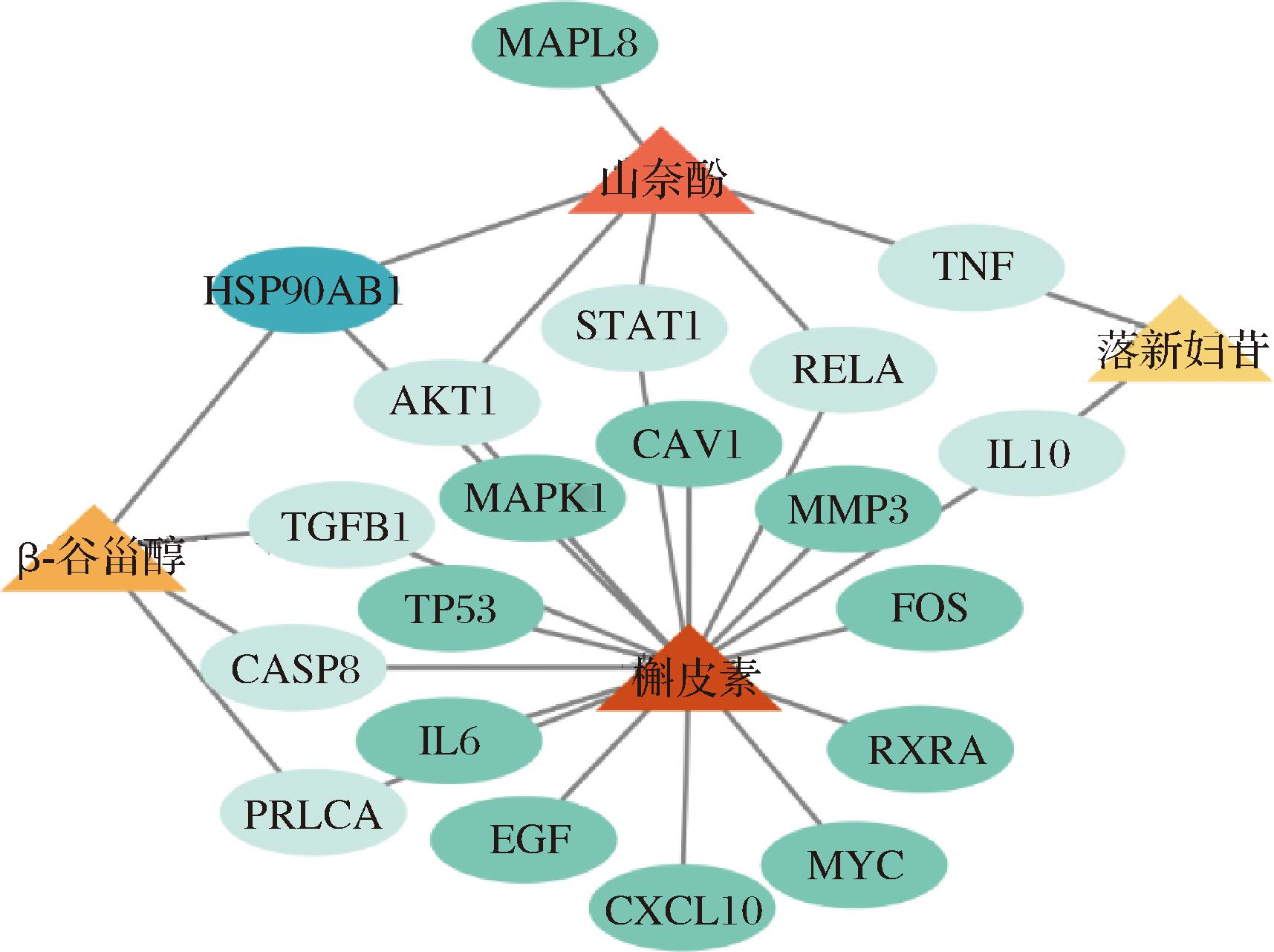
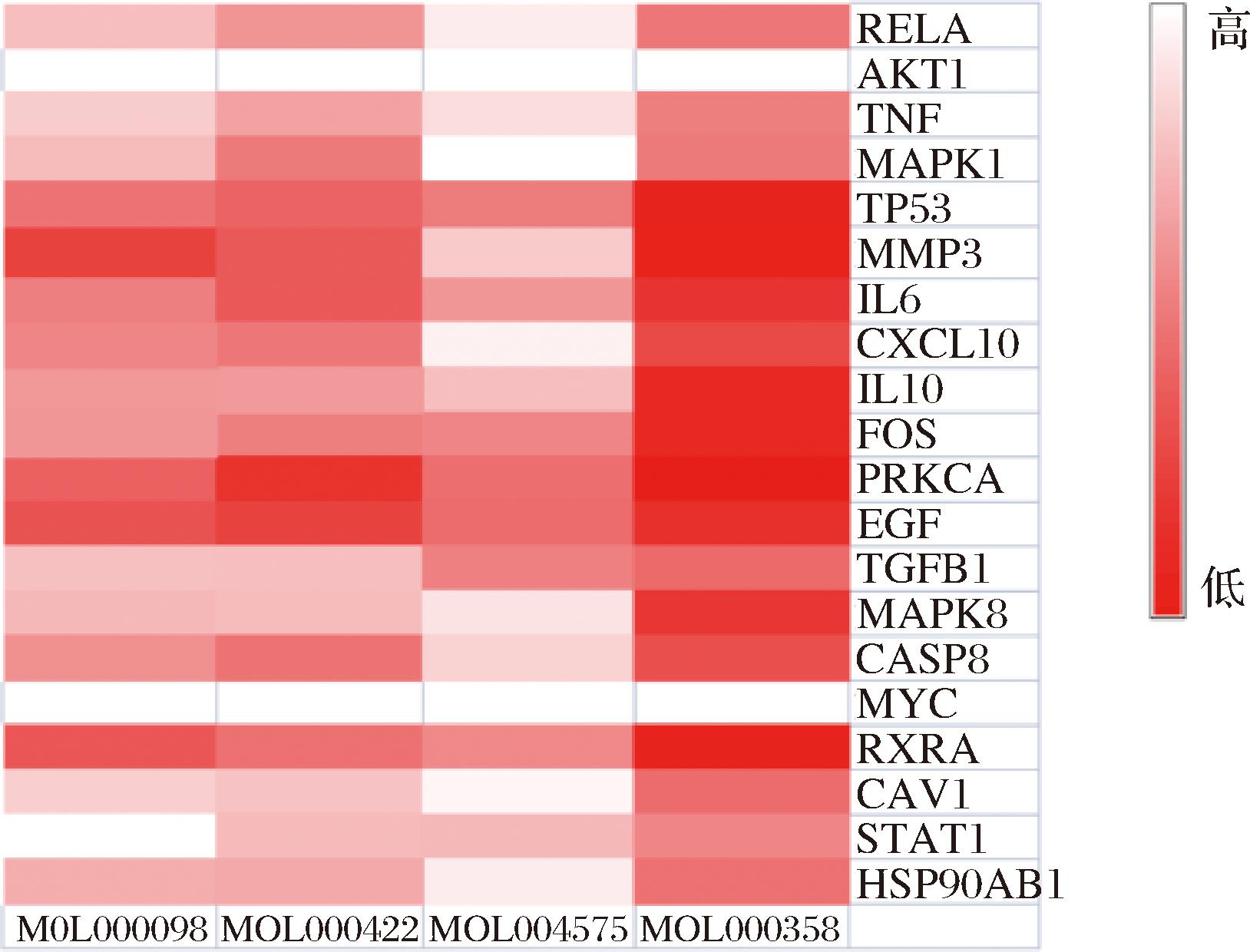
将筛选条件设为“Closeness”阈值为0.070,“Betweenness”阈值为174.804,“degree”的阈值为6.187。将所获得蛋白互作数据导入Cytoscape软件中构建网络图,结果见图2。颜色越深代表靶点越重要,得到关键靶点20个,分别为MMP3、IL6、CXCL10、IL10、FOS、PRKCA、EGF、TGFB1、TNF、MAPK1、MAPK8、CASP8、MYC、RXRA、CAV1、TP53、AKT1、STAT1、RELA、HSP90AB1。
MIZUNO等[22]认为MMP3(Matrix Metallopro-teinase-3,基质金属蛋白酶-3)是小胶质细胞的内源性神经元激活剂。蔡可珍等[6]提出HSP90(Heat shock protein 90,热休克蛋白90)是细胞内一种普遍存在的、有高度活性的蛋白质,HSP90通过抑制神经炎症性疾病中的凋亡活性,在避免蛋白质错误折叠和聚集方面具有重要作用,可以增强小胶质细胞对Aβ的吞噬和降解,调节AD中p-Tau蛋白的稳定性和功能。殷春燕等[23]阐述了AKT1(Alpha serine/threonine-protein kinase,丝氨酸/苏氨酸激酶1)蛋白作为 PI3K/Akt 信号通路的核心因子,在细胞增殖和凋亡等多种细胞过程中发挥关键作用。如脂肪代谢过程中,AKT通过调控一系列与脂肪酸合成相关的基因表达,可增加细胞中脂肪酸和磷酸甘油酯的浓度。
将白桦茸活性成分与这20个关键靶点构建PPI网络图(图3),槲皮素和山奈酚都是桦褐孔菌缓解AD的主要成分,其中槲皮素关联17个靶点,山奈酚有6个靶点与疾病相关。而其中HSP90AB1、RELA、MAPK1、TNF、IL-10、AKT1等可能都是白桦茸活性成分缓解阿尔茨海默病的关键靶点。
2.5 KEGG通路分析结果
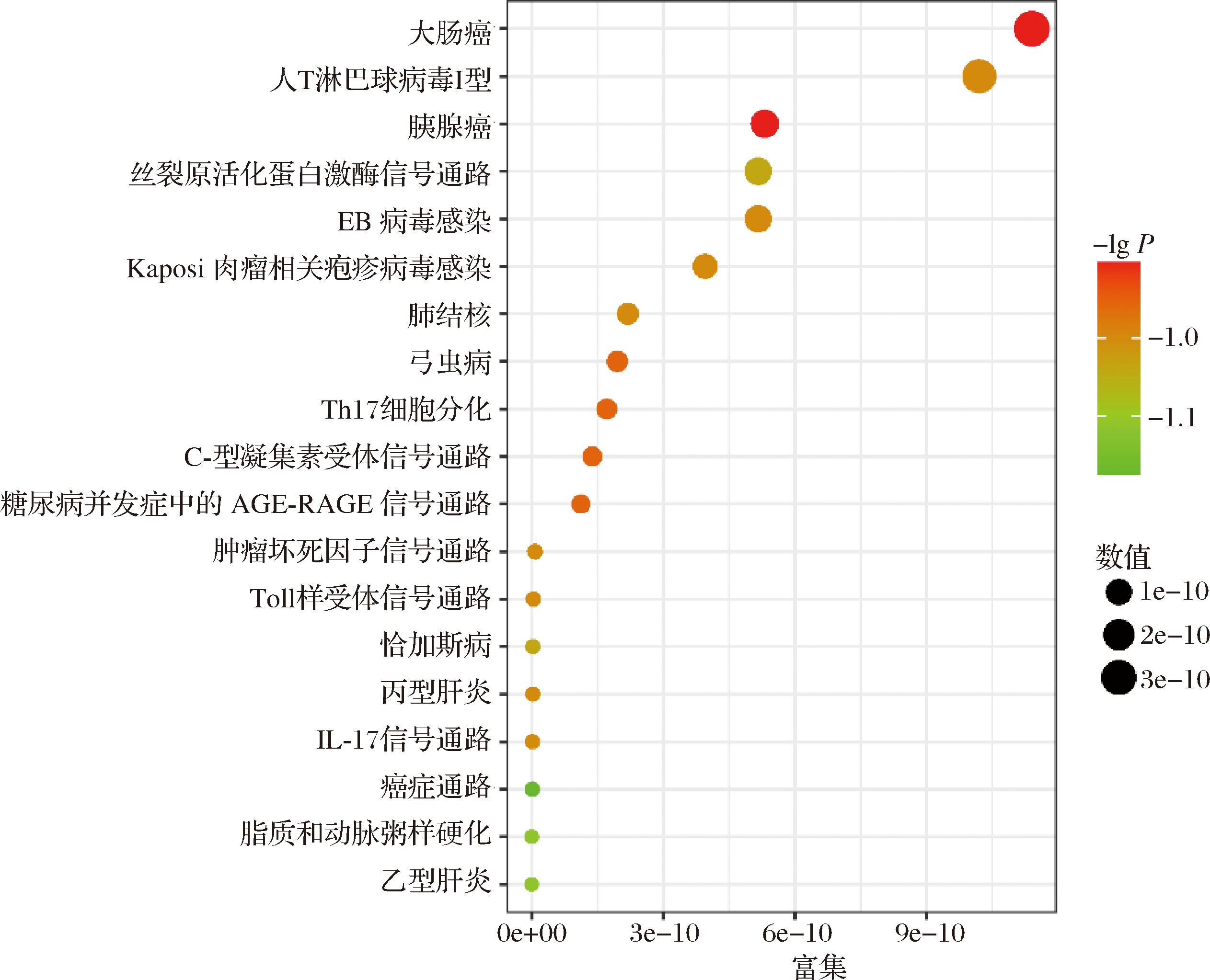
将20个关键靶点导入Metascape数据库进行KEGG通路分析,由图4可以看出,桦褐孔菌作用核心靶标与脂质和动脉粥样硬化、乙肝、TNF信号通路、人T细胞白血病病毒感染、IL-17信号通路、阿尔茨海默病相关联,其余重要通路还有人巨细胞病毒感染、卡波西肉瘤相关疱疹病毒感染、神经退行性变的途径-多种疾病、肝细胞癌、甲型流感等。再利用DAVID数据库验证KEGG通路分析数据,按照P值进行排序,选择前20条具有代表性的条目。与Metascape数据库分析结果相比较,发现比较重要的信号通路有:TNF信号通路、Toll样受体信号通路、IL-17信号通路、子宫内膜癌等,分析结果与Metascape数据库分析结果有部分重合。
2.6 GO富集分析
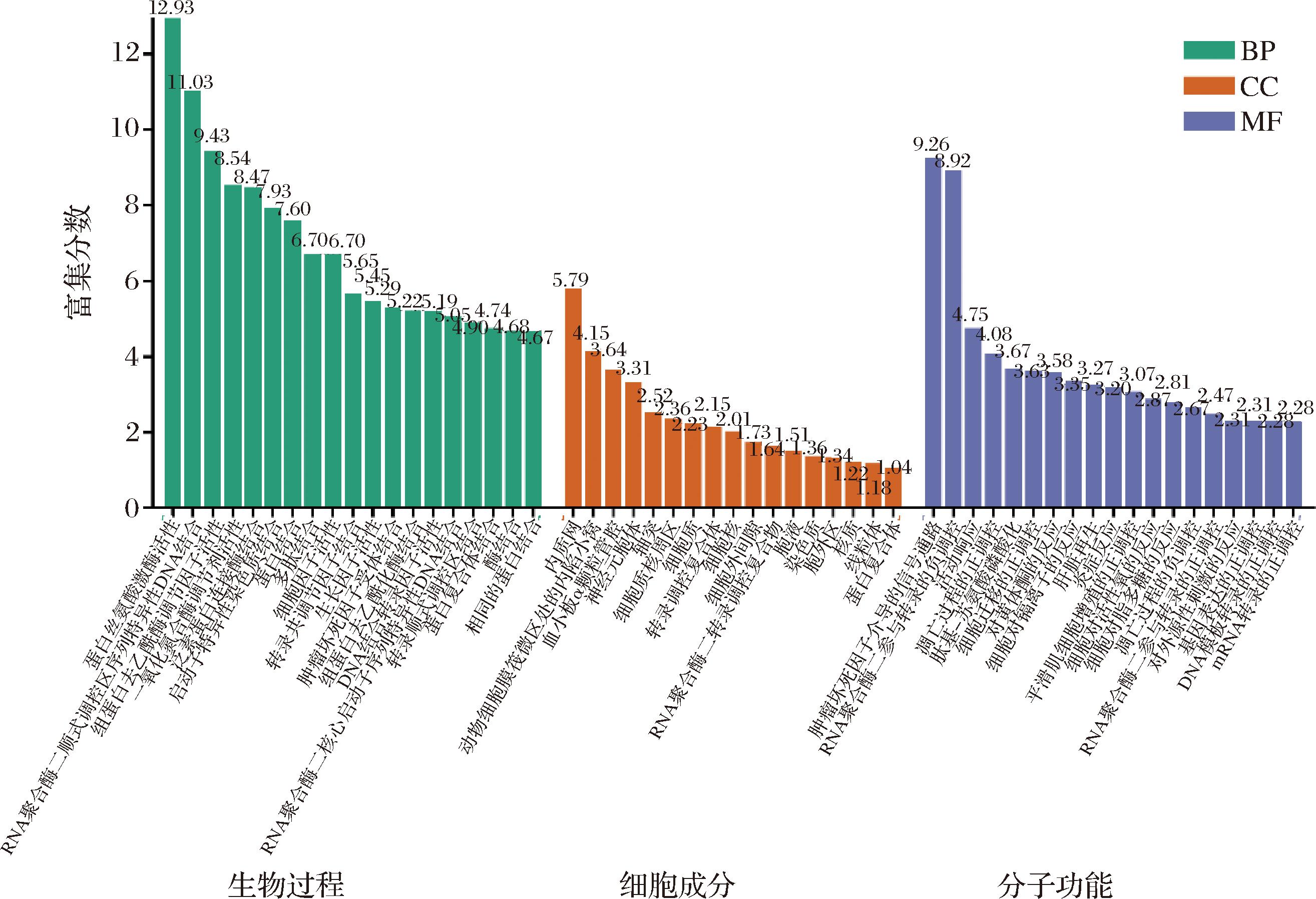
将20个关键靶点导入到DAVID数据库进行GO富集分析,按照“BP”、“CC”、“MF”等不同类型进行整理,从图5 GO-BP分析可知,与RNA聚合酶Ⅱ启动子pri-miRNA转录的正向调节、平滑肌细胞增殖的正向调节、细胞对有机环状化合物的反应、肝再生等生物学过程密切相关。由GO-CC分析结果可以看出其在细胞中的定位分布较多位置的有:线粒体、细胞核、核原生质、细胞外间隙、转录因子复合物等部位。而GO-MF分析可以看出其密切相关的分子功能包括:相同的蛋白质结合、RNA聚合酶Ⅱ核心启动子序列特异性DNA结合、肿瘤坏死因子受体结合、转录辅因子结合、组蛋白去乙酰化酶结合等。
2.7 分子对接
将20种关键蛋白与4种活性小分子进行分子对接,根据模拟的最佳构象结合能,做出分子对接热图(图6),其中结合能小于-7 kcal/mol的有13个分别是:槲皮素-MMP3、山奈酚-PRKCA、山奈酚-EGF、β-谷甾醇-TP53、β-谷甾醇-MMP3、β-谷甾醇-IL6、β-谷甾醇-CXCL10、β-谷甾醇-IL10、β-谷甾醇-FOS、β-谷甾醇-PRKCA、β-谷甾醇-EGF、β-谷甾醇-MAPK8、β-谷甾醇-RXRA。结合能越低表明结合越稳定,在图7中颜色越深。
结合能低并不意味着一定就是最合理的,也会有假阳性的可能,所以还需要结合对接时氢键情况来判断,氢键的个数至少要有2个。如表2所示,氢键最多的前10项为:山奈酚-EGF、山奈酚-PRKCA、落新妇苷-PRKCA、槲皮素-MMP3、槲皮素-FOS、槲皮素-EGF、槲皮素-RXRA、槲皮素-CAV1、山奈酚-RXRA、落新妇苷-FOS。
表2 氢键个数
Table 2 Number of hydrogen bonds
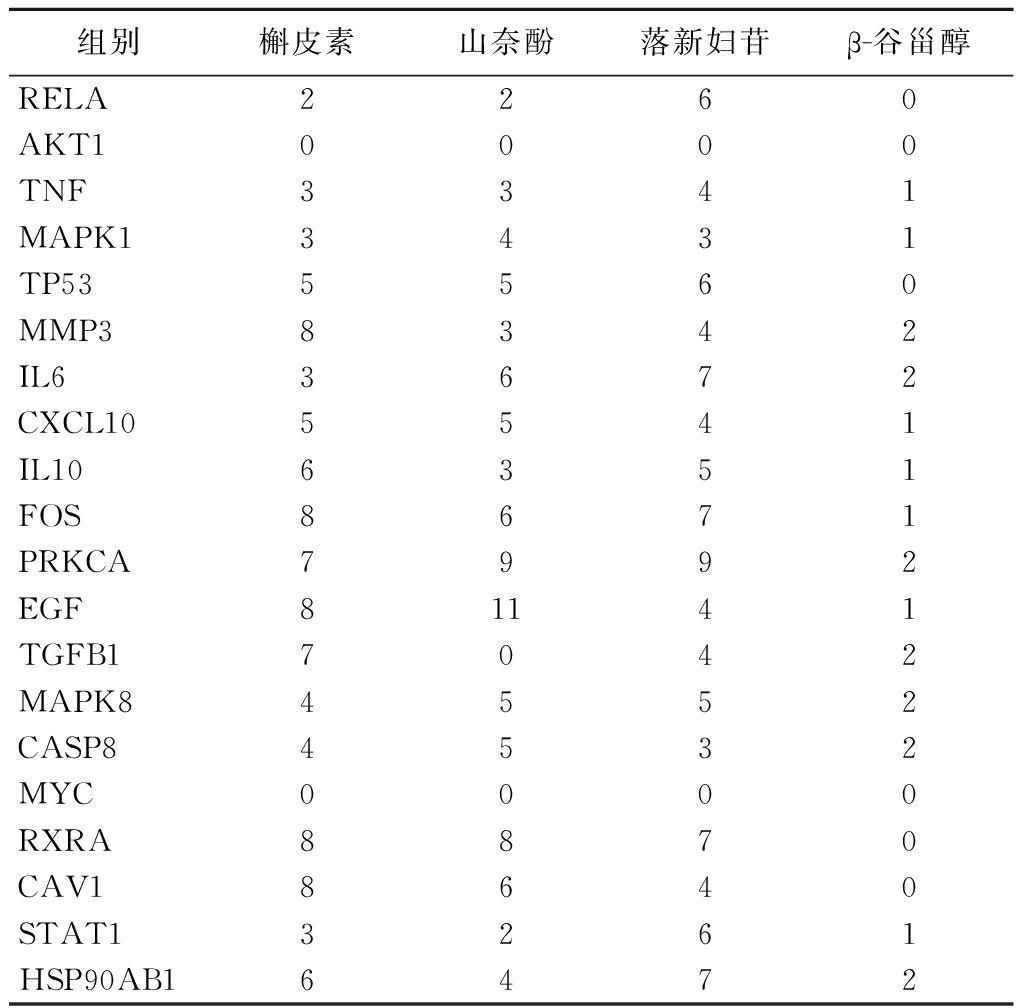
组别槲皮素山奈酚落新妇苷β-谷甾醇RELA2260AKT10000TNF3341MAPK13431TP535560MMP38342IL63672CXCL105541IL106351FOS8671PRKCA7992EGF81141TGFB17042MAPK84552CASP84532MYC0000RXRA8870CAV18640STAT13261HSP90AB16472
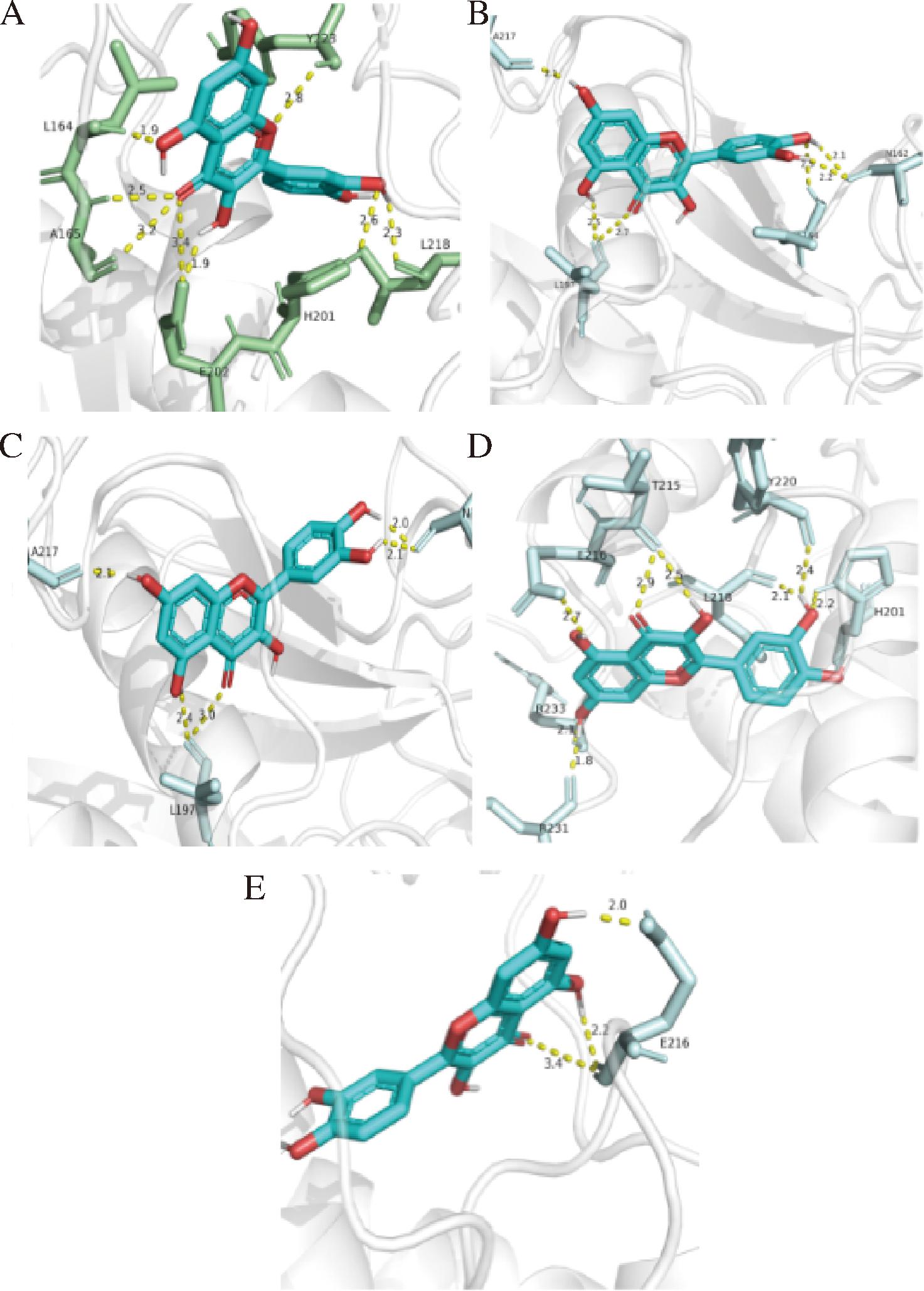
分子对接展示靶点蛋白MMP3与小分子槲皮素进行的前5次对接。分子对接结果显示槲皮素与MMP3蛋白的第1次对接(图7-A)有8个氢键:总结合能为-7.33 kcal/mol。此构象为最佳构象。第2次对接(图7-B)有6个氢键,总结合能为-7.1 kcal/mol。第3次对接位点(图7-C)有5个氢键,总结合能-6.99 kcal/mol。第4次对接位点(图7-D)有8个氢键,总结合能为-6.9 kcal/mol。第5次对接位点(图7-E)有3个氢键,总结合能为-6.04 kcal/mol。
3 讨论
阿尔茨海默病是一种较为复杂的神经退行性疾病,随着发病机制研究的不断完善,中医药防治老年痴呆显示出一定的优越性,结合网络药理学的研究和分子对接验证而开发的抗阿尔兹海默症中药单体小分子药物正在逐年增加。该研究共获取白桦茸的9个活性成分和177个成分靶点,筛选出来20个关键靶点和化合物蛋白靶点相比较,发现槲皮素、山奈酚、β-谷甾醇和落新妇苷等4个重要的活性成分。槲皮素具有抗炎、抗氧化、抗癌等药理作用,通过缓解氧化应激、细胞凋亡和炎症反应等抑制动脉粥样硬化,使硬化斑块变小[24]。山奈酚是天然黄酮类物质,具有抗癌、抗炎症和抑菌等多种药理作用,成云芳[25]指出山奈酚对神经元的具有一定保护的作用,能促进脑源性神经营养因子在海马体中的表达及其受体磷酸化,从而减少Aβ积聚和海马体神经元损伤而导致的认知障碍,提高AD大鼠的学习和记忆能力。β-谷甾醇是植物中常见的具有抗氧化和抗炎活性的甾醇,可通过IL-17通路抑制细胞炎症,减轻细胞凋亡,改善AD模型小鼠的认知功能[26]。落新妇苷是落妇新属植物中常见的黄酮类物质,具有调节脂肪代谢、抗炎、抗氧化、抗肿瘤和保护神经等作用[27]。由此可推测,白桦茸通过多成分共同对AD进行干预。
PPI网络分析可得20个重要靶点是白桦茸发挥作用的核心靶点,包括RELA、AKT1、TNF、IL-6、MAPK1、TP53、MAPK8、TNF、IL-10、FOS、HSP90AB1等。MAPK1、MAPK8同属MAPK蛋白家族,MAPK通路可调节细胞对外部应激信号的反应,调节炎症和凋亡介质的合成。IL-6 通过降低低密度脂蛋白和氧化脂蛋白受体的信使RNA表达,抑制动脉粥样硬化斑块的形成。HSP90在动脉粥样硬化患者中有较高的表达,与动脉粥样硬化斑块的形成密切相关。由此可知,这些靶点均是与AD病症发展密切相关的重要靶点,白桦茸可通过多靶点共同对AD进行治疗。
另外白桦茸与脂质和动脉粥样硬化、乙肝、TNF、人T细胞白血病病毒感染、IL-17、阿尔茨海默病等信号通路密切关联,这些可从KEGG通路分析得知。近年来的研究表明,阿尔茨海默等神经退行性疾病的主要病理特征是受线粒体细胞凋亡影响,从细胞凋亡、吞噬的过程抑制炎症因子,释放自身免疫成分的抗原,保护神经元存活和轴突再生微环境的形成,从而对AD进行缓解[28]。脂质与动脉粥样硬化是最主要的富集通路之一,与AD紧密相关。当内皮细胞暴露受干扰的血流中时,激活 MAPK信号通路,进而上调内皮细胞中血管细胞黏附分子, 促进TNF-α、IL-6 的表达,从而导致内皮细胞损伤和动脉粥样硬化产生,这些与TNF和 IL-17通路密切相关,证明KEGG分析结果是与AD病症密切相关的信号通路。
GO富集分析发现白桦茸与细胞信号交流、基因转录、机体免疫等密切相关。白桦茸的活性成分主要通过RNA聚合酶II启动子pri-miRNA正向调节转录、平滑肌细胞正向调节增殖、细胞对有机环状化合物的反应等生物过程发挥其缓解阿尔茨海默病的作用。
由分子对接的结果可知,白桦茸的关键活性成分均能与这些靶点自发的结合,尤其是槲皮素与 MMP3的结合效果最好。这表明白桦茸活性成分确实可以通过与一些靶点产生相互作用的效果,对AD、肿瘤等疾病起到潜在的缓解作用。
综上所述,本研究通过网络药理学及分子对接技术对白桦茸缓解阿尔茨海默病的活性成分及蛋白靶点进行筛选,共有127个蛋白基因交集靶点和4种关键活性成分,即槲皮素、山奈酚、落新妇苷和β-谷甾醇。利用PPI蛋白质相互作用分析共筛选出20个关键靶点,即MMP3、IL-6、CXCL10、IL10、FOS、PRKCA、EGF、TGFB1、TNF、MAPK1、MAPK8、CASP8、MYC、RXRA、CAV1、TP53、AKT1、STAT1、RELA和HSP90AB1等。主要信号通路有脂质和动脉粥样硬化通路、人T细胞白血病病毒感染通路、乙肝信号通路、TNF信号通路、IL-17信号通路、阿尔茨海默病通路和神经退行性病变等途径,通过分子对接推测,槲皮素与MMP3的结合最好,在缓解阿尔茨海默病中发挥重要作用。由此可知,白桦茸可通过多成分、多靶点、多通路干预脂质代谢、炎症、细胞增殖和凋亡等多个生理过程而发挥抗AD作用,从而为下一步实验验证白桦茸缓解阿尔茨海默的作用机制提供思路,该研究为开发应用药食同源白桦茸的功能性产品提供了理论依据,后续将进一步开展体内实验验证等研究。
参考文献
[1] 张赫, 郑焱.β淀粉样蛋白级联假说相关的阿尔茨海默病发病机制及防治策略研究进展[J].中国医学科学院学报, 2019, 41(5):702-708.ZHANG H, ZHENG Y.β amyloid hypothesis in Alzheimer’s disease:Pathogenesis, prevention and management[J].Acta Academiae Medicinae Sinicae, 2019, 41(5):702-708.
[2] LONG S, BENOIST C, WEIDNER W.World Alzheimer report 2023.Reducing dementia risk:never too early, never too late[R].London:Alzheimer’s Disease International, 2023.
[3] 张晨曦, 董承瑜, 胡鑫,等.中药治疗阿尔茨海默病分子作用机制的研究进展[J].中草药, 2022, 53(13):4132-4145.ZHANG C X, DONG C Y, HU X, et al.Research progress on molecular mechanism of traditional Chinese medicine in treatment of Alzheimer’s disease[J].Chinese Traditional and Herbal Drugs, 2022, 53(13):4132-4145.
[4] 储超扬, 肖彪, 单江晖, 等.酶抑制剂及其构效优化在阿尔茨海默病中的应用[J].生物化学与生物物理进展, 2024, 51(7):1510-1529.CHU C Y, XIAO B, SHAN J H, et al.Application study of enzyme inhibitors and their conformational optimization in the treatment of Alzheimer’s disease[J].Progress in Biochemistry and Biophysics, 2024, 51(7):1510-1529.
[5] GU X R, ZHOU J Y, ZHOU Y Y, et al.Huanglian Jiedu Decoction remodels the periphery microenvironment to inhibit Alzheimer’s disease progression based on the “brain-gut” axis through multiple integrated omics[J].Alzheimer’s Research &Therapy, 2021, 13(1):44.
[6] 蔡可珍, 郑琴, 朱徐东, 等.基于UPLC-Q-TOF-MS结合网络药理学与实验验证探讨四君子汤治疗阿尔茨海默病的作用机制[J].中国中药杂志, 2023, 48(6):1620-1631.CAI K Z, ZHENG Q, ZHU X D et al.Mechanism of Sijunzi Decoction in treatment of Alzheimer’s disease based on UPLC-Q-TOF-MS, network pharmacology, and experimental verification[J].China Journal of Chinese Materia Medica, 2023, 48(6):1620-1631.
[7] FAN Y T, WANG A M, LIU Z Q, et al.Integrated spatial metabolomics and network pharmacology to explore the pharmacodynamic substances and mechanism of Radix ginseng-Schisandra chinensis Herb Couple on Alzheimer’s disease[J].Analytical and Bioanalytical Chemistry, 2024, 416 (19):4275-4288.
[8] PENG Y T, ZHOU C J.Network pharmacology and molecular docking identify the potential mechanism and therapeutic role of Scutellaria baicalensis in Alzheimer’s disease[J].Drug Design, Development and Therapy, 2024, 18:1199-1219.
[9] LV F, SUN M, QIN C M, et al.Study of the multitarget mechanism of Astragalus(HUANGQI) in the treatment of Alzheimer′s disease based on network pharmacology and molecular docking technology[J].Pharmaceutical Biology, 2024, 62(1):634-647.
[10] KUANG F, XIANG T.Molecular mechanism of Acanthopanax senticosus in the treatment of Alzheimer′s disease based on network pharmacology and molecular docking[J].Molecular Diversity, 2023, 27(6):2849-2865.
[11] 吴超, 袁鑫, 郑红.基于APP/BACE1/Aβ信号通路的人参皂苷Rg1对AD树鼩模型的神经保护作用[J].中国医院药学杂志, 2024, 44(1):18-22;34.WU C, YUAN X, ZHENG H.Neuroprotective effect of ginsenoside Rg1 based on the APP/BACE1/Aβ signaling pathway on Alzheimer’s tree shrew model[J].Chinese Journal of Hospital Pharmacy, 2024, 44(1):18-22;34.
[12] SHEN W P, WU J M, SHI L Y, et al.Explore the mechanisms of triterpenoids from Ganoderma lucidum in the protection against Alzheimer’s disease via microbiota-gut-brain axis with the aid of network pharmacology[J].Fitoterapia, 2024,178:106150.
[13] 张旭, 赵芬琴, 韩光, 等.桦褐孔菌的化学成分及抗炎活性[J].天然产物研究与开发, 2010, 22(3):433-436.ZHANG X, ZHAO F Q, HAN G, et al.Chemical constituents and anti-inflammatory activities of Inonotus obliquus[J].Natural Product Research and Development, 2010, 22(3):433-436.
[14] HU Y, SHENG Y, YU M, et al.Antioxidant activity of Inonotus obliquus polysaccharide and its amelioration for chronic pancreatitis in mice[J].International Journal of Biological Macromolecules, 2016, 87:348-356.
[15] 刘畅, 崔敬爱, 王思霁, 等.桦褐孔菌多糖对糖尿病肾病小鼠肾脏的保护作用[J].食品工业科技, 2021, 42(2):321-325.LIU C, CUI J A, WANG S J, et al.Protective effect of Inonotus obliquus polysaccharides on kidneys of diabetic kidney disease mice[J].Science and Technology of Food Industry, 2021, 42(2):321-325.
[16] 程欢欢, 宋辉, 刘博男, 等.基于网络药理学及分子对接探讨桦褐孔菌三萜类成分抗胃癌作用机制[J].天然产物研究与开发, 2021, 33(8):1391-1400.CHENG H H, SONG H, LIU B N, et al.Study on the mechanism of triterpenoids from Inonotus obliquus against gastric cancer based on network pharmacology and molecular docking[J].Natural Product Research and Development, 2021, 33(8):1391-1400.
[17] 武建平, 李文兰, 曲中原, 等.基于网络药理学探讨桦褐孔菌降血糖功效成分及作用机制[J].食品工业科技, 2021, 42(22):18-29.WU J P, LI W L, QYU Z Y, et al.Action mechanism of Inonotus obliquus in the treatment of diabetes and the material basis of pharmacodynamics based on network pharmacology[J].Science and Technology of Food Industry, 2021, 42(22):18-29.
[18] LU Y P, JIA Y N, XUE Z H, et al.Recent developments in Inonotus obliquus (chaga mushroom) polysaccharides:Isolation, structural characteristics, biological activities and application[J].Polymers, 2021, 13(9):1441-1441.
[19] 陶丽清, 张衡.三萜类化合物在阿尔茨海默病防治中的研究进展[J].生命科学, 2024, 36(4):487-498.TAO L Q, ZHANG H.Research progress of triterpenoids in the prevention and treatment of Alzheimer’s disease[J].Chinese Bulletin of Life Sciences, 2024, 36(4):487-498.
[20] 赵丽洁, 赵慧, 郭丹, 等.孕酮和骨化三醇通过miR-590-5p靶向RelA调控子宫内膜癌细胞Ishikawa的细胞因子分泌[J].中国免疫学杂志, 2022, 38(11):1343-1348.ZHAO L J, ZHAO H, GUO D, et al.Progesterone and calcitriol use miR-590-5p to target RelA to regulate cytokine secretion in endometrial cancer cells Ishikawa[J].Chinese Journal of Immunology, 2022, 38(11):1343-1348.
[21] 陈宣世, 刘梦文, 沈静, 等.基于 HPLC 指纹图谱及网络药理学探讨黑桑葚防治阿尔兹海默病潜在机制[J].食品与发酵工业, 2024, 50(13):270-278.CHEN X S, LIU M W, SHEN J, et al.The mechanism of black mulberry reatment for AD was studied based on HPLC fingerprint and network pharmacology[J].Food and Fermentation Industries, 2024, 50(13):270-278.
[22] MIZUNO N, IWATA T, OHSAWA R, et al.Optineurin regulates osteoblastogenesis through STAT1[J].Biochemical and Biophysical Research Communications, 2020, 525(4):889-894.
[23] 殷春燕, 董占军, 陈江魁.基于网络药理学和分子对接技术研究花生红衣多酚抗动脉粥样硬化的作用机制[J].食品与发酵工业, 2023, 49(20):242-249.YIN C Y, DONG Z J, CHEN J K.Study on anti-atherosclerosis mechanism of action of peanut skin polyphenols based on network pharmacology and molecular docking[J].Food and Fermentation Industries, 2023, 49(20):242-249.
[24] WANG D M, LI S Q, WU W L, et al.Effects of long-term treatment with quercetin on cognition and mitochondrial function in a mouse model of Alzheimer’s disease[J].Neurochemical Research, 2014, 39(8):1533-1543.
[25] 成云芳, 孙邈, 戴轶伟, 等.山奈酚对阿尔茨海默病大鼠学习记忆功能及海马组织中极性蛋白Par3、Par6和aPKC表达的影响[J].中国老年学杂志, 2024, 44(18):4480-4484.CHENG Y F, SUN M, DAI Y W, et al.Effects of kaempferol on learning and memory function and the expressions of polar protein Par3, Par6 and aPKC in hippocampus of Alzheimer’s disease rats[J].Chinese Journal of Gerontology, 2024, 44(18):4480-4484.
[26] AYAZ M,JUNAID M,ULLAH F, et al.Anti-alzheimer’s studies on β-sitosterol isolated from Polygonum hydropiper L[J].Frontiers in Pharmacology, 2017, 8:697.
[27] CHEN F,SUN Z Q,ZHU X G,et al.Astilbin inhibits high glucose-induced autophagy and apoptosis through the PI3K/Akt pathway in human proximal tubular epithelial cells[J].Biomedicine &Pharmacotherapy, 2018, 106:1175-1181.
[28] JAYARAMAN A, REYNOLDS R.Diverse pathways to neuronal necroptosis in Alzheimer’s disease[J].The European Journal of Neuroscience, 2022, 56(9):5428-5441.
Potential mechanism of chaga mushroom in treatment of Alzheimer’s disease based on network pharmacology and molecular docking
FU Dandan1,2,3*, SHAO Xinyuan1, ZHANG Qi1, ZHANG Di1, PENG Xinnuan1, LIU Yanshan1, SUN Jianrui1,2,3, GONG Qiang1,2,3
1(School of Food and Biological Engineering, Henan University of Science and Technology, Luoyang 471023, China)2(Henan Food Microbiology Engineering and Technology Research Center, Luoyang 471023, China)3(University Key Laboratory of Microbiology Resources Development and Utilization of Henan University of Science and Technology, Luoyang 471023, China)
ABSTRACT To investigate the potential mechanisms of Chaga mushroom in the treatment of Alzheimer’s disease (AD), network pharmacology and molecular docking techniques were used to predict the active components, key targets, and signalling pathways.The active components and target genes of Inonotus obliquus were obtained from databases such as TCMSP and literature.The disease targets of AD were acquired through databases such as GeneCards to identify the common targets of Inonotus obliquus and Alzheimer’s disease.The protein-protein interaction (PPI) network diagram of common targets was constructed using the String database, and the interaction network of “active components-key targets” was constructed by Cytoscape software.GO and KEGG enrichment analyses were performed by DAVID and Metascape databases.Molecular docking simulations were conducted using Autodock software.Finally, 9 active components and 3 397 targets of Alzheimer’s disease were screened out.Twenty key targets were obtained by PPI, such as MMP3, IL6, AKT1, IL10, TNF, MAPK1, HSP90AB1, and so on.KEGG pathway analysis showed that Inonotus obliquus played an anti-AD role through the signalling pathways of lipid and atherosclerosis, hepatitis B, human cytomegalovirus infection, interleukin-17, Alzheimer’s disease, and so on.GO enrichment analysis showed that it was related to RNA polymeraseⅡtranscription factor complex, an integral component of the plasma membrane, positive regulation of pri-miRNA transcription from RNA polymeraseⅡpromoter, and so on.20 key targets were docked with their corresponding active components to verify that they could bind stably, which predicted that quercetin played an important role in alleviating Alzheimer’s disease.Chaga mushroom could interfere with multiple signalling pathways, such as lipid and atherosclerosis, as well as through multiple components and targets, providing theoretical support for the development of medicine and food homologous health foods.
Key words Inonotus obliquus; homology of medicine and food; senile dementia; protein-protein interaction; signalling pathway