WU Jinpeng,WU Ying,CAO Shuangshuang, et al.Preparation of Massa Medicata Fermentata fermented by probiotics and its improvement effect on functional dyspepsia mice[J].Food and Fermentation Industries,2025,51(14):236-244.
功能性消化不良是一种多因素引起的复杂症状,据统计,10%~20%的人存在有功能性消化不良,且持续周期长,已经严重影响到了人体健康和生活质量[1-2]。随着对功能性消化不良的深入研究,已发现其表现主要是肠胃动力障碍,并伴有脑肠轴功能紊乱、微炎症等,不少研究表明,胃肠微生物的失衡也与功能性消化不良有着密切的关系[3]。
六神曲(Massa Medicata Fermentata,MMF)由面粉、麦麸、赤小豆、苦杏仁等食物或者药食同源物经过发酵炮制而成,具有消食化积、健脾和胃的功效,沿用至今已近千年[4]。六神曲中含有黄酮、生物碱、酚酸等成分。其中,黄酮类化合物不仅能够保护肠上皮细胞抵御摄入的食物毒素,还能够通过调节消化酶、胃肠道相关激素的分泌、胃肠道免疫系统、肠道微生物菌群等途径影响肠胃功能[5]。此前,已有越鞠丸、小儿复方鸡内金、越鞠二陈汤等陆续用于治疗功能性消化不良的研究,这些复方中主成分都有六神曲[6-8]。然而,传统六神曲采用自然发酵,且发酵过程未进行严格的无菌控制,造成不同产地或相同产地不同批次的产品差异较大、质量稳定性较差等问题。益生菌发酵中药材,一方面可通过水解酶作用破坏植物细胞壁,从而提高药材有效成分的浸出率;还可帮助中药中的非活性或活性成分被分解、转化,进而在一定条件下形成新化合物,产生有效用或效用更强的活性成分;另一方面发酵过程中产生的醇、酯、酸等风味物质在保障中药药效有效发挥的同时,可极大改善中药产品的口感和风味。
为此,本研究采用益生菌强化发酵六神曲,利用HPLC法分析优化前后六神曲中阿魏酸、槲皮素、槲皮苷等主要功效成分含量变化,并从肠胃动力、消化酶活性、炎症因子、肠道激素、肠道菌群结构等角度初步探究益生菌六神曲治疗功能性消化不良的作用机制,旨在为益生菌在中药材活性成分转化和传统药典创新研究提供参考。
1.1.1 菌株
植物乳植杆菌CGMCC 29919(Lactiplantibacillus plantarum CGMCC 29919),保藏于中国普通微生物菌种保藏管理中心,鼠李糖乳酪杆菌LH-1(Lacticaseibacillus rhamnosus LH-1)、嗜酸乳杆菌LA-1(Lactobacius acidophilus LA-1)为本实验室保藏菌株。
1.1.2 试剂
阿魏酸(纯度≥98%),上海源叶生物科技有限公司;芦丁(纯度≥98%)、槲皮素(纯度≥98%)、槲皮苷(纯度≥98%)、木犀草素(纯度≥98%),合肥博美生物科技有限责任公司;碘乙酰胺(纯度≥98%)、多潘立酮(纯度≥98%),上海阿拉丁生化科技股份有限公司;胃蛋白酶试剂盒、IL-4试剂盒和IL-1β试剂盒,伊势久生物科技有限责任公司。
1260 Infinity高效液相色谱仪,安捷伦科技有限公司;YXO-LS-50SⅡ高压蒸汽灭菌锅,上海博迅实业有限公司医疗设备厂;CLARIOstar Plus酶标仪,江苏肯尔菲实验仪器贸易有限公司。
1.3.1 益生菌六神曲的制备
根据《中华人民共和国卫生部药品标准》组方,在实验前期优化的六神曲工艺基础上,将L.rhamnosus LH-1、L.plantarum CGMCC 29919、L.acidophilus LA-1按1∶1∶1的复配添加,接种量为3%(质量分数),青蒿、辣蓼和苍耳草煎煮液与固体配料之间的液料比为1.1∶1(g∶mL),采用固态发酵的方式,制成大小为2 cm×2 cm×2 cm的曲块,于32 ℃下发酵4 d。将发酵好的曲块粉碎,于40 ℃条件下干燥12 h,即得到制备的益生菌六神曲(益生菌六神曲中含有活菌,在动物喂饲时,由于六神曲采用水煎服的服用方式,所以灌胃的煎煮液中不存在活菌)。
1.3.2 功效成分的测定
多酚黄酮类物质的测定参考周晨一[9]的方法,用HPLC法测定阿魏酸、芦丁、槲皮苷、槲皮素、木犀草素的含量。采用电位滴定法测定总有机酸含量[10]。
1.3.3 抗氧化能力的测定
DPPH自由基清除能力和ABTS阳离子自由基清除能力的测定方法参考姚青[11]的方法。
1.3.4 功能性消化不良小鼠模型的建立
将70只SPF级KM小鼠适应性喂养7 d后,随机分为空白组(CON)、模型组(MOD)和益生菌六神曲低(MMP-L)、中(MMP-M)、高剂量处理组(MMP-H)以及未强化六神曲处理组(CMMP)、多潘立酮治疗组(DOM),每组10只。造模方法参考邓晰文等[12]的方法,模型组、处理组及治疗对照组小鼠灌胃0.2 mL 1 g/L碘乙酰胺蔗糖溶液并隔日禁食,正常对照组给予蔗糖溶液灌胃,正常饮食。造模成功后,CON组和MOD组小鼠灌胃0.2 mL蒸馏水,MMF-L、MMF-M、MMF-H剂量组分别灌胃1、2.5、4 g/(kg·d)益生菌强化发酵六神曲,CMMP组灌胃2.5 g/(kg·d)六神曲,DOM组灌胃3.78 g/(kg·d)多潘立酮,持续灌胃2周。该研究内容和过程遵循伦理学标准(SCXK(豫)2020-0005)。
1.3.5 胃肠动力的测定
小鼠末次给药后,禁食不禁水12 h,次日上午各组小鼠灌胃5%(质量分数)炭末半固体糊。20 min后颈椎脱臼处死小鼠,迅速打开腹腔结扎胃贲门和幽门,进行全胃切除,准确称量全胃质量。沿胃大弯剪开胃体,用0.9%生理盐水洗去胃内容物,滤纸擦干称量空胃质量。胃排空率(gastric emptying rate,GER)的计算如公式(1)所示:
(1)
式中:D为胃排空率,%;M为全胃质量,g;m为空胃质量,g。
取上自幽门、下至回盲部的整段小肠,自然拉直平铺于白色滤纸上,用直尺测量炭末推进距离和小肠总长度。小肠推进率(small bowel propulsion rate, SBPR)的计算如公式(2)所示:
(2)
式中:P为小肠推进率,%;S为炭末推进距离(即幽门前端至炭末前端),cm;L为小肠总长度(即幽门前端至回盲部),cm。
1.3.6 胃蛋白酶活力测定
采用胃蛋白酶试剂盒对小鼠胃黏膜组织胃蛋白酶活力(Pepsin)进行测定。
1.3.7 炎症因子测定
采用ELISA试剂盒测定小鼠血清IL-4和IL-1β含量。
1.3.8 血清激素水平测定
按照胆囊收缩素(cholecystokinin, CCK)和胃动素(motilin,MTL)试剂盒说明书测定小鼠血清中CCK和MTL含量。
1.3.9 肠道菌群测序
取小鼠盲肠内容物冻存于-80 ℃保存,由上海百趣生物医学科技有限公司进行16 s测定。
使用SPSS软件对实验数据统计分析,Origin 2021软件对结果进行作图。
2.1.1 多酚黄酮类物质含量测定
六神曲有效成分阿魏酸、芦丁、槲皮苷、槲皮素、木犀草素等物质能有效的发挥抗炎、抑菌、抗病毒作用,在消化类疾病中发挥功效[13-15]。本研究对益生菌强化发酵六神曲中成分进行分析,结果见表1和图1。益生菌六神曲中阿魏酸、芦丁、槲皮苷、槲皮素、木犀草素含量分别为:131.05、38.928、6.997、4.979、2.505 μg/g。与未强化六神曲比,分别提高了35.98%、191.91%、241.93%、65.25%和50.08%(P<0.05),显著高于未强化六神曲和未发酵六神曲(槲皮素、木犀草素未检出)。研究表明,乳酸菌代谢产物乳酸能水解纤维素,提高植物组织中活性物质的溶出率,提高功效成分的利用率[16]。结果表明,益生菌强化发酵六神曲能显著提升阿魏酸、芦丁、槲皮苷等有效物质含量,所添加的益生菌及其代谢产物能对六神曲原料进行代谢转化,使中药的有效成分得以提高,从而增强六神曲的药效和生物利用度。
表1 标准曲线汇总表
Table 1 Summary of standard curves
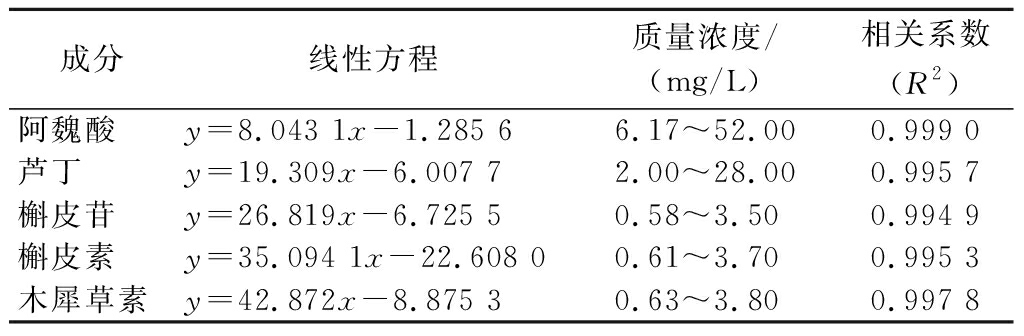
成分线性方程质量浓度/(mg/L)相关系数(R2)阿魏酸y=8.043 1x-1.285 66.17~52.000.999 0芦丁y=19.309x-6.007 72.00~28.000.995 7槲皮苷y=26.819x-6.725 50.58~3.500.994 9槲皮素y=35.094 1x-22.608 00.61~3.700.995 3木犀草素y=42.872x-8.875 30.63~3.800.997 8
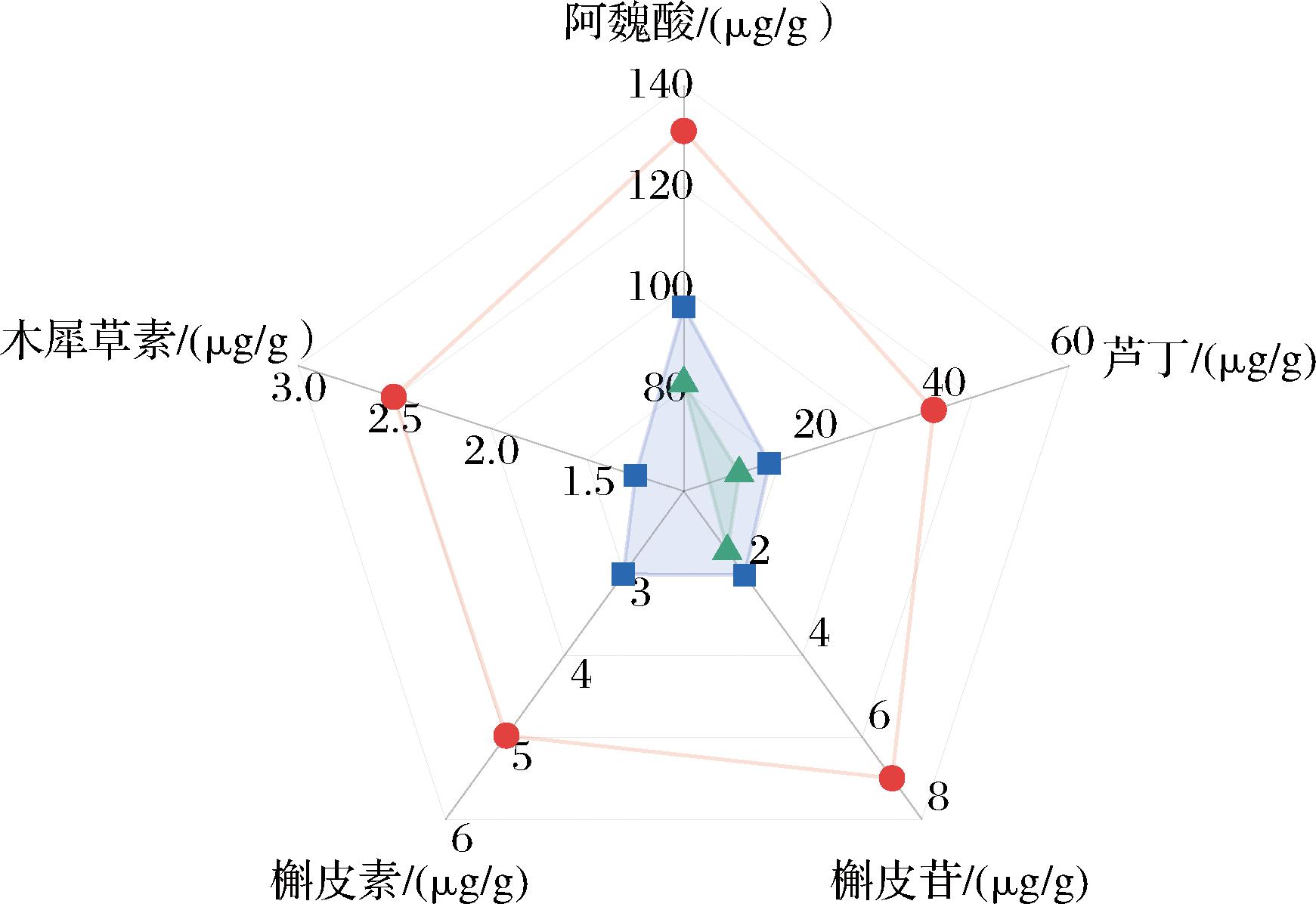
图1 各黄酮类物质含量
Fig.1 The contents of various flavonoids
2.1.2 总酸含量测定
有机酸具有促消化、抗氧化、止泻、抗炎的功效[17]。如图2所示,未发酵六神曲、未强化六神曲总有机酸平均含量分别是1.27%、2.96%。经过益生菌强化发酵炮制后,有机酸含量提升到4.36%。与未强化六神曲比,益生菌六神曲的有机酸总量提高了47.29%,这可能是乳酸菌在代谢过程中产生了乳酸等有机酸,有利于六神曲发挥促消化、抗氧化等功效。
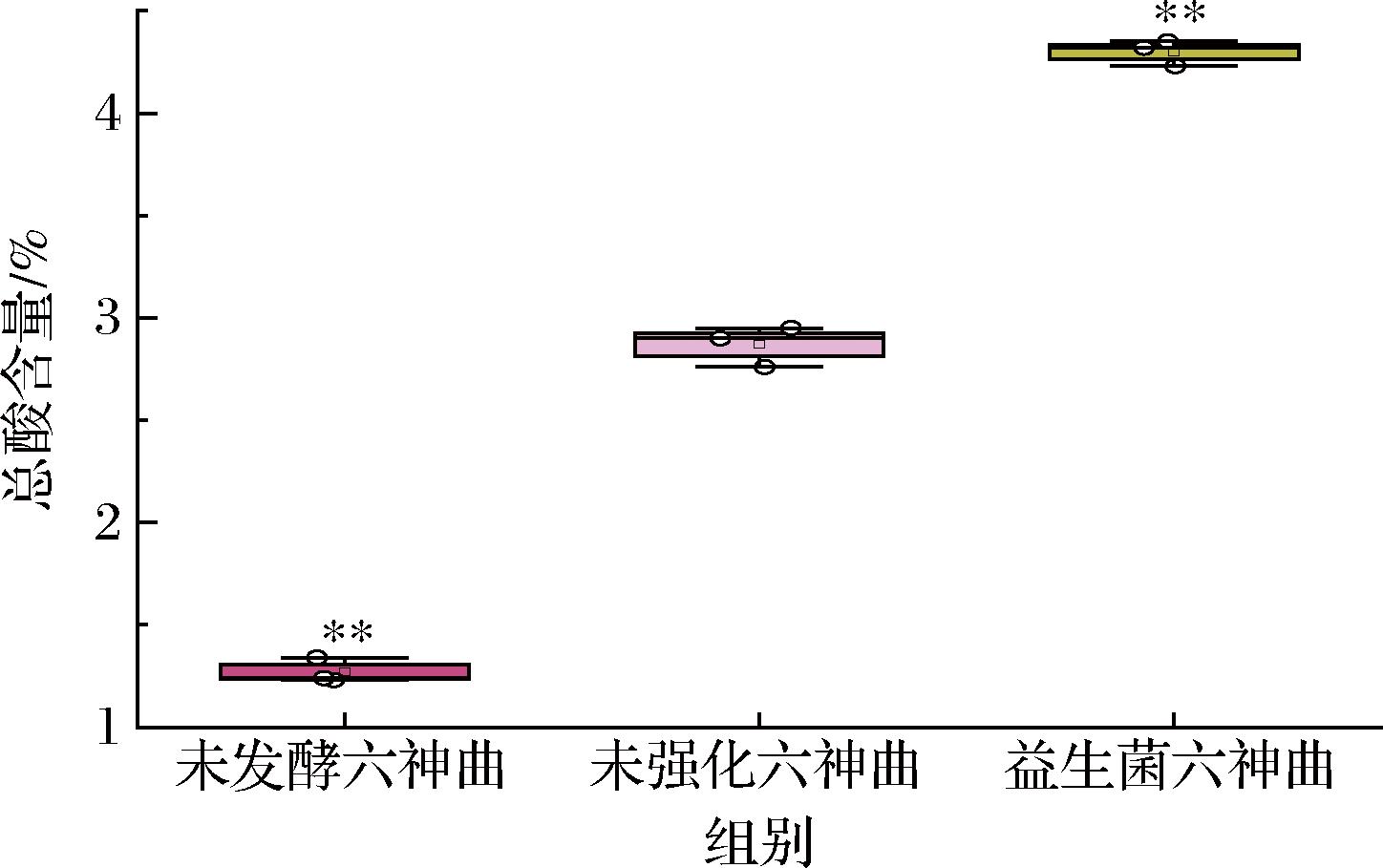
图2 总酸含量测定
Fig.2 Determination of total acid content
注:与未强化六神曲比,**表示P<0.01。
抗氧化能力在维持机体代谢平衡方面发挥着至关重要的作用[10]。如图3所示,实验测得未发酵六神曲、未强化六神曲和益生菌六神曲的DPPH自由基清除能力分别是43.44%、81.33%和88.89%,ABTS阳离子自由基清除能力分别是65.27%、80.18%和84.98%。与未强化六神曲比,益生菌六神曲DPPH自由基清除能力和ABTS阳离子自由基清除能力分别提高了9.30%和5.99%,说明益生菌强化发酵六神曲后抗氧化能力得到了提升,可能是发酵过程中乳酸菌产生乳酸有利于纤维素的酸水解和纤维素酶对纤维素的酶解作用,破坏了药材原料细胞壁的纤维素结构,提高了多酚黄酮类物质的析出,从而提高了六神曲的抗氧化能力[16]。
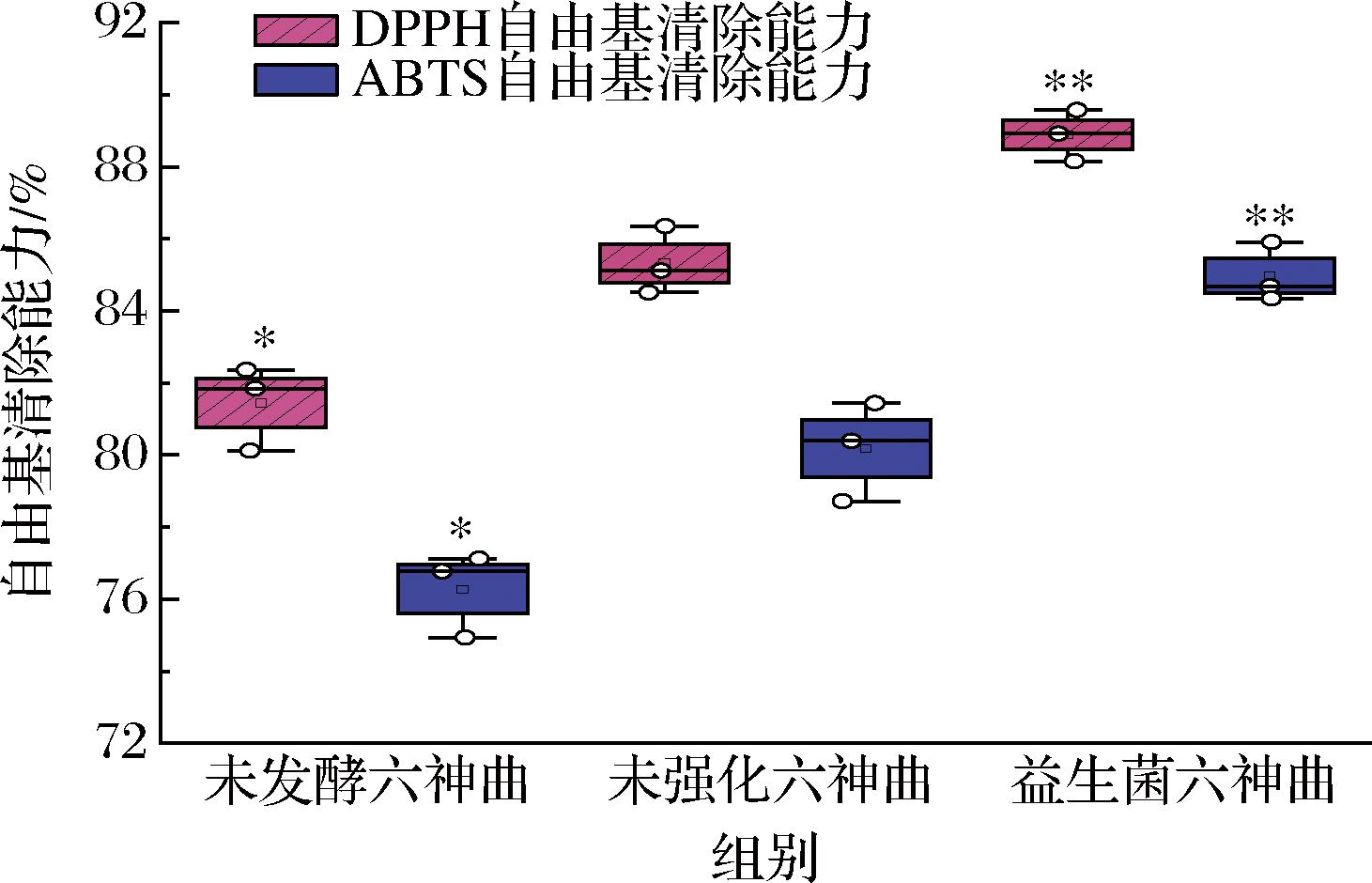
图3 抗氧化能力测定
Fig.3 Determination of antioxidant capacity
注:与未强化六神曲比,*表示P<0.05,**表示P<0.01。
2.3.1 益生菌六神曲对功能性消化不良小鼠摄食量和体重的影响
如图4所示,小鼠在适应性喂养期间,体重略有增长,在造模期体重开始下降,尤其是在造模第2周,体重下降幅度较大。治疗后,小鼠体重开始恢复,MMP-M组和DOM组的治疗效果较好,MMP-L和MMP-H组效果次之。小鼠摄食量变化与小鼠体重变化趋势相吻合。
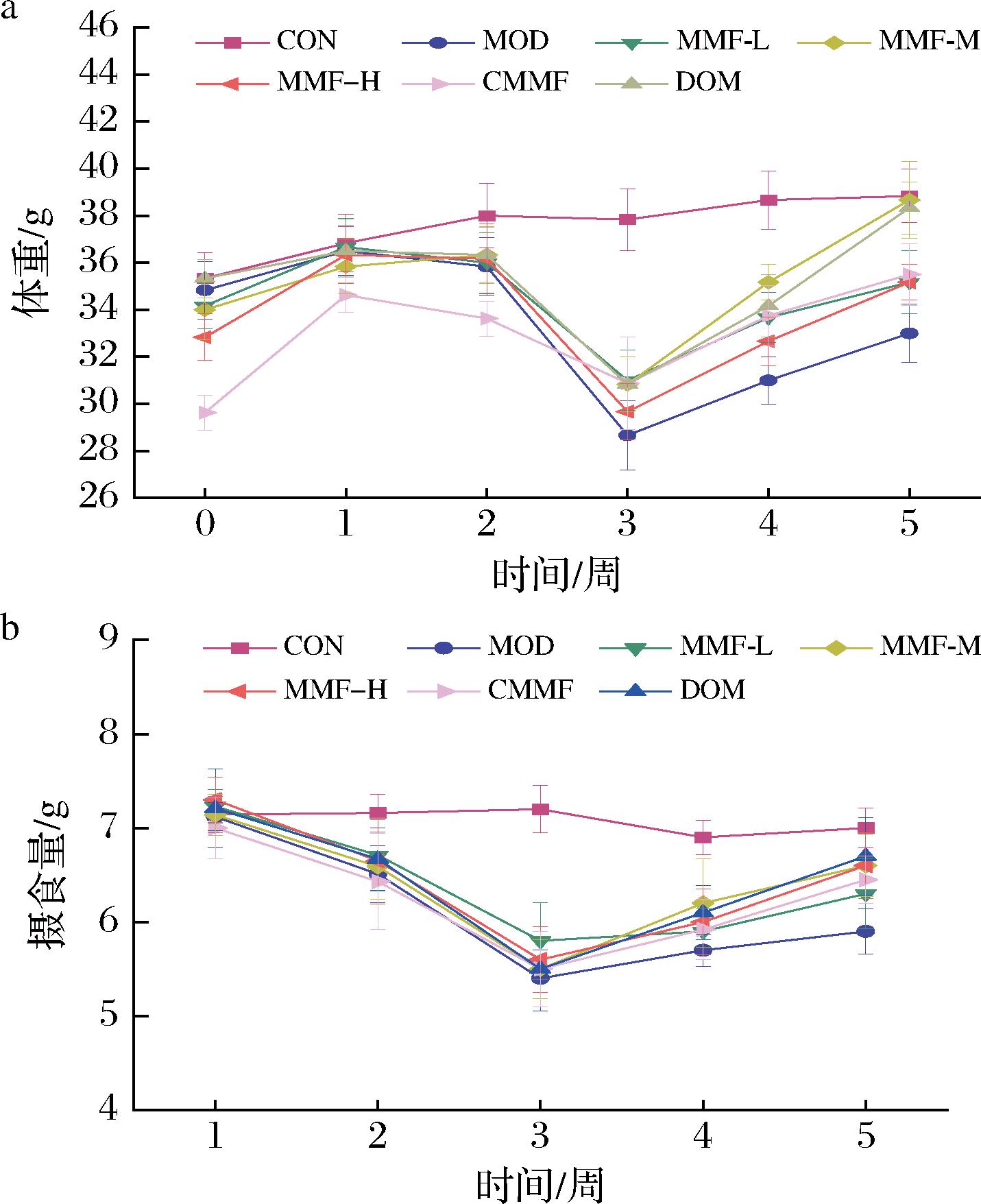
a-小鼠体重变化;b-小鼠摄食量变化
图4 实验分组及生理指标测定
Fig.4 Experimental groups and measurement of physiological indexes
2.3.2 益生菌六神曲对功能性消化不良小鼠肠胃动力的改善作用
胃肠动力是评价消化功能的重要指标,医学上也常用促胃肠动力药物来缓解功能性消化不良[3]。如图5所示,与CON组比,MOD组小鼠的胃排空率和小肠推进率分别下降34.71%、48.58%,表明建模成功。同MOD组比,各组小鼠的肠胃动力组均有所恢复,其中MMP-M和MMP-H组小鼠的肠胃动力基本恢复到CON组,与DOM组效果相当。MMP-M组小鼠的胃排空率和小肠推进率,分别提高了46.26%、93.50%,表明益生菌六神曲中、高剂量干预均能够有效改善功能性消化不良引起肠胃动力问题。
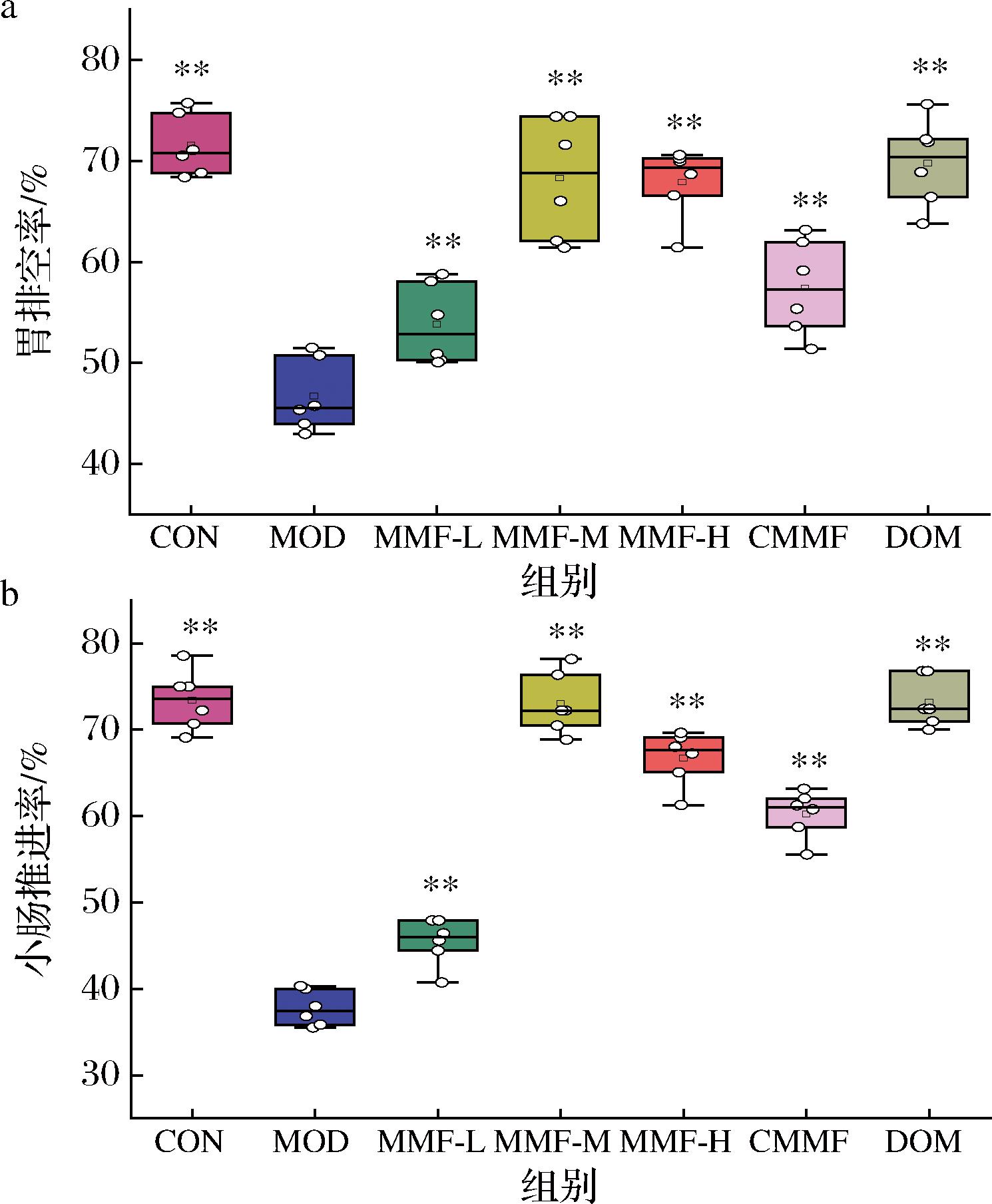
a-胃排空率;b-小肠推进率
图5 肠胃动力测定
Fig.5 Gastrointestinal motility was measured
注:*表示与MOD组比,P<0.05,**表示P<0.01(下同)。
2.3.3 益生菌六神曲对功能性消化不良小鼠胃蛋白酶活力的影响
小鼠胃组织匀浆的胃蛋白酶活力如图6所示。MOD组小鼠的胃蛋白酶活力明显低于CON组(P<0.01),说明功能性消化不良也伴随有胃蛋白酶活力降低。与MOD组比,各干预组小鼠的胃蛋白酶活力均有一定程度的恢复。MMP-M和MMP-H组小鼠的胃蛋白酶活力与CON组无明显差异,说明益生菌六神曲中、高剂量干预后能缓解功能性消化不良引起的胃蛋白酶活力问题。
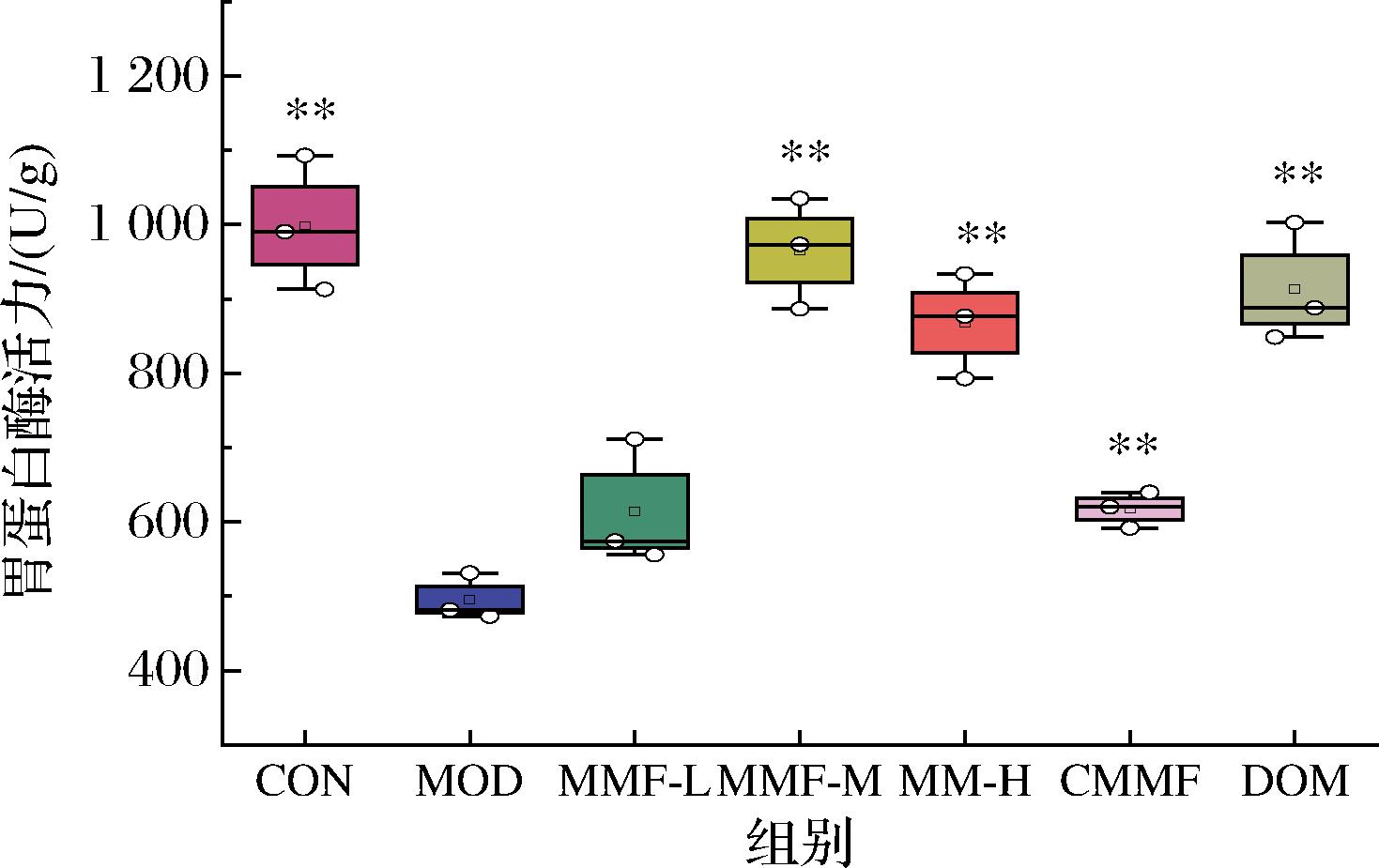
图6 小鼠胃蛋白酶活力测定结果
Fig.6 Determination results of pepsin activity in mice
2.3.4 益生菌六神曲对功能性消化不良小鼠血清炎症因子含量的影响
如图7所示,与CON组比,MOD组小鼠血清中IL-4和IL-1β含量上升(P<0.01),说明功能性消化不良会伴随有炎症反应产生。与MOD组比,各实验组的IL-4和IL-1β含量下降(P<0.01),且MMP-M和MMP-H组下降含量要比MMP-L组更明显,推测可能是由于中、高剂量的六神曲当中发挥抗炎作用的黄酮多酚类物质更加丰富,所以在调节炎症方面也更具效果。
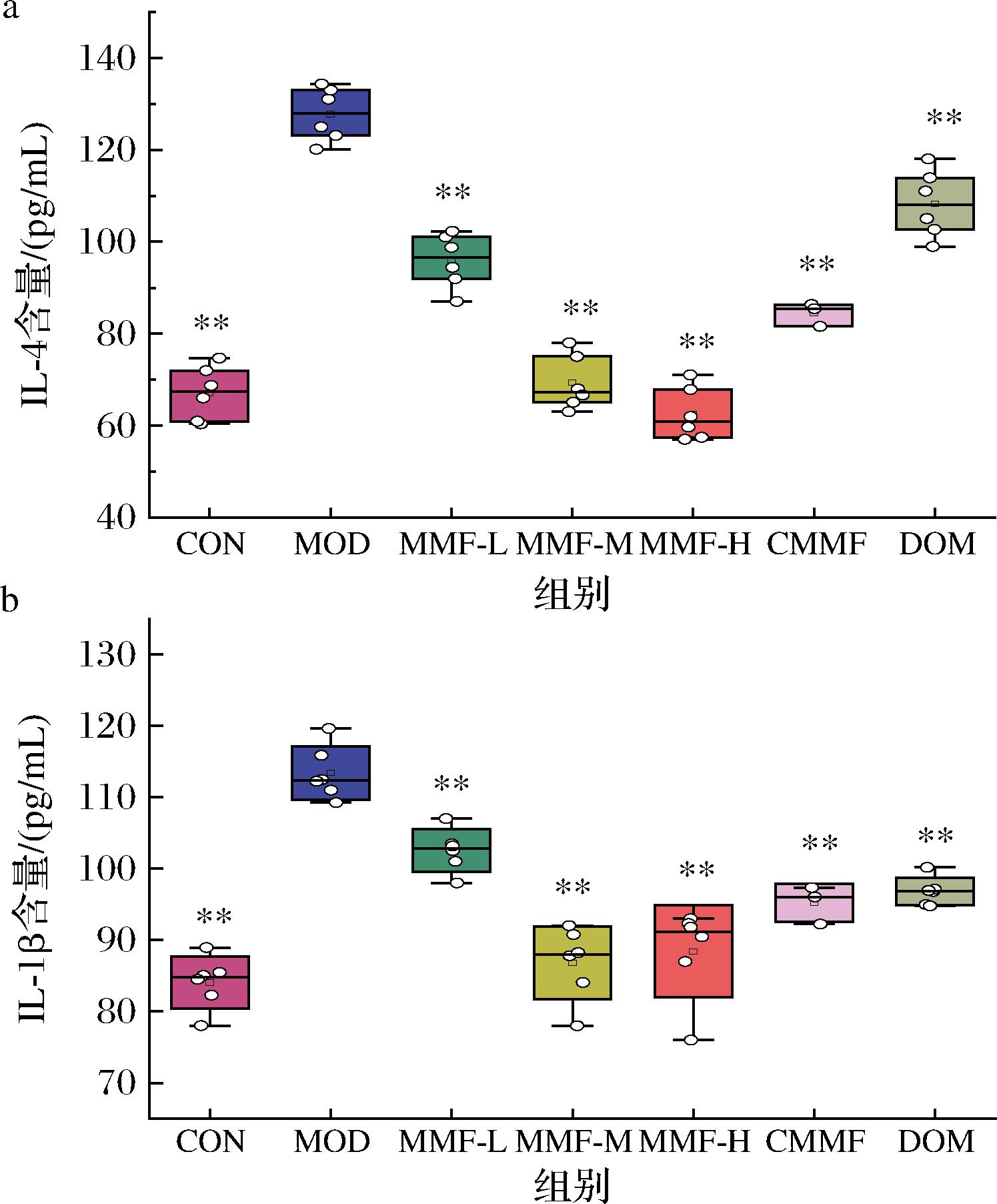
a-IL-4;b-IL-1β
图7 IL-4和IL-1β在各组小鼠血清中的含量
Fig.7 Serum contents of IL-4 and IL-1β in each group of mice
2.3.5 益生菌六神曲对功能性消化不良小鼠胃肠激素水平的影响
CCK会抑制胃排空率,促进分泌胃酸,同时还会刺激神经系统,产生饱腹感,抑制摄食。MTL能促进肠胃蠕动,促进消化。如图8-a所示,与CON组比,MOD组小鼠血清中CCK含量显著上升(P<0.01)。
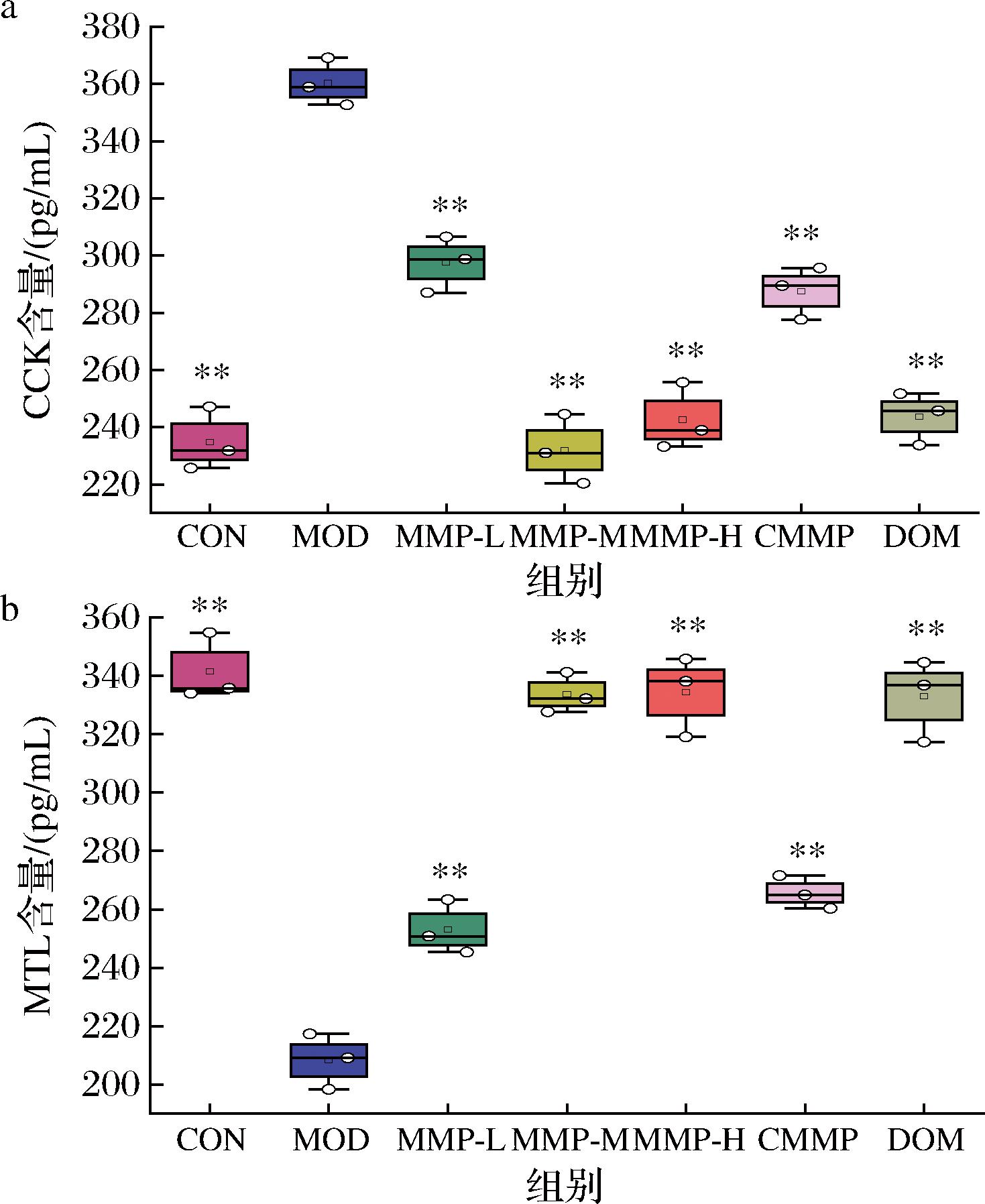
a-CCK;b-MTL
图8 CCK和MTL在各组小鼠血清中的含量
Fig.8 Serum contents of CCK and MTL in each group of mice
与MOD组比,各干预组小鼠血清中CCK含量显著下降(P<0.01)。如图8-b所示,与CON组相比,MOD组小鼠血清中MTL含量显著下降(P<0.01)。说明功能性消化不良会伴随有MTL含量的变化。与MOD组相比,各干预组小鼠血清中MTL含量显著上升(P<0.01)。以上结果表明,益生菌六神曲能够通过抑制CCK的分泌和促进MTL的生成,缓解功能性消化不良的症状。
2.4.1 Alpha多样性指数分析
Alpha多样性指数分析结果如表2所示。
表2 Alpha多样性指数
Table 2 Alpha diversity indices
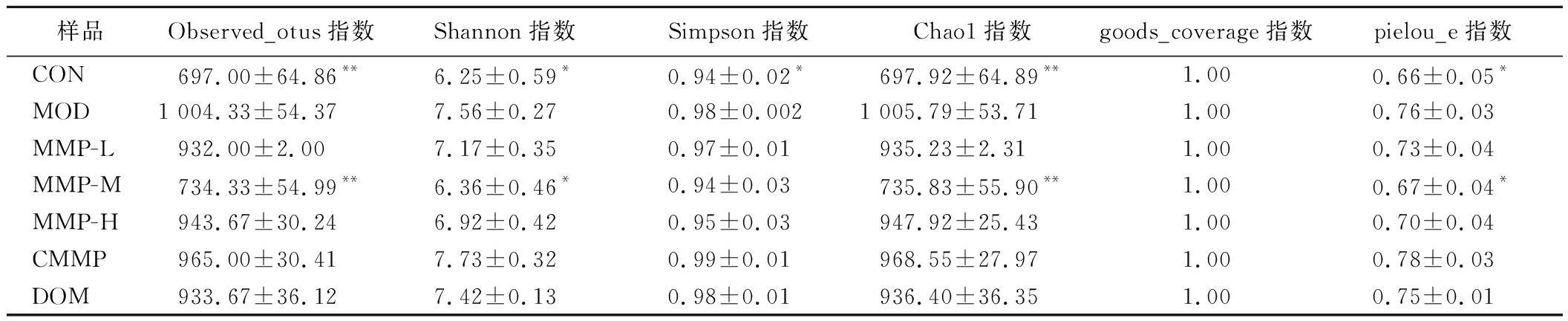
样品Observed_otus指数Shannon指数Simpson指数Chao1指数goods_coverage指数pielou_e指数CON697.00±64.86**6.25±0.59*0.94±0.02*697.92±64.89**1.000.66±0.05*MOD1 004.33±54.377.56±0.270.98±0.0021 005.79±53.711.000.76±0.03MMP-L932.00±2.007.17±0.350.97±0.01935.23±2.311.000.73±0.04MMP-M734.33±54.99**6.36±0.46*0.94±0.03735.83±55.90**1.000.67±0.04*MMP-H943.67±30.246.92±0.420.95±0.03947.92±25.431.000.70±0.04CMMP965.00±30.417.73±0.320.99±0.01968.55±27.971.000.78±0.03DOM933.67±36.127.42±0.130.98±0.01936.40±36.351.000.75±0.01
注:*表示与MOD组比,P<0.05,**表示P<0.01。
2.4.2 Beta多样性分析
在图9的PCoA图中,MOD组和CON组之间样本区间相距较远,说明功能性消化不良会让正常小鼠肠道菌群发生变化,2组小鼠肠道菌群结构存在显著差异。不同实验组与MOD组有部分重合,说明不同实验组对于失衡的菌群具有不同的调节效果。
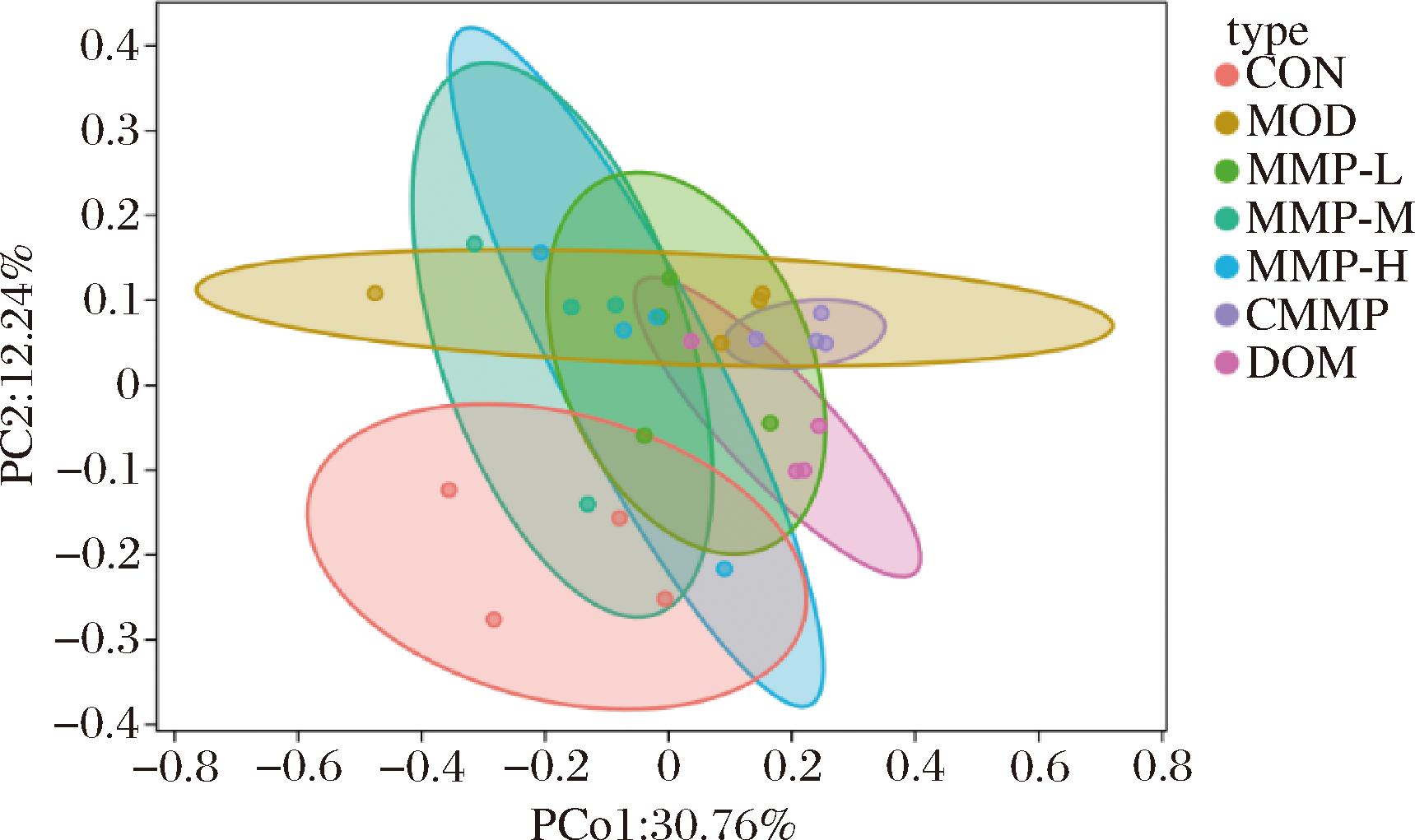
图9 Beta多样性分析
Fig.9 Beta diversity analysis
2.4.3 肠道菌群组成分析
如图10-a所示,门水平分析表明,与CON组相比,MOD组厚壁菌门丰度下降,拟杆菌门、变形菌门、放线菌丰度上升,厚壁菌门与拟杆菌门的比值(F/B)降低。与MOD组相比,各实验组厚壁菌门丰度上升,拟杆菌门、变形菌门、放线菌门丰度下降,MMP-M组和MMP-H组F/B上升。

a-门水平;b-属水平
图10 基于门水平和属水平上的菌群分布图
Fig.10 Maps of flora distribution based on phylum level and genus level
在属水平上分析发现,同CON组比,MOD组小鼠的盲肠内容物菌群中毛螺菌属(Lachnospiraceae)、阿克曼氏菌属(Akkermansia)、梭目菌属(Clostridiales)、乳酸菌属(Lactobacillus)相对丰度下降,Muribaculaceae、瘤胃球菌属(Ruminococcus)和螺杆菌属(Helicobacter)相对丰度上升。与MOD组比,各实验组均不同程度的提升毛螺菌属、阿克曼氏菌属、梭目菌属等的相对丰度,降低Muribaculaceae、瘤胃球菌属等的相对丰度。其中,MMP-M组还降低了螺杆菌属和志贺杆菌属(Shigella)的相对丰度(图10-b)。
2.4.4 肠道菌群LEfSe差异物种分析
通过[线性判别(linear discriminant analysis,LDA)效应大小(effect size),LEfSe]分析益生菌六神曲缓解功能性消化不良症状相关的差异物种。如附图1(https://doi.org/10.13995/j.cnki.11-1802/ts.039781)所示,在属水平上,CON组中富集了真杆菌属(Eubacterium siraeum group)、嗜木聚糖真杆菌属(Eubacterium xylanophilum group)、罗宾氏菌属(Robinsoniella);MOD组中富集了欧陆森氏菌属(Olsenella)、杜博斯氏菌属(Dubosiella)、单球菌属(Monoglobus)、寡养单胞菌属(Stenotrophomonas);MMP-L组中富集了乳杆菌属(Ligilactobacillus)以及其下的未命名的乳杆菌属(Ligilactobacillus_unclassified)、艾森伯格菌属(Eisenbergiella);MMP-H组富集了副拟杆菌属(Parabacteroides)、八叠球菌属(Sporosarcina)、产碱杆菌(Alcaligenes)以及其下的未命名的产碱杆菌(Alcaligenes_unclassified)、产粪甾醇真杆菌属(Eubacterium coprostanoligenes group);CMMP组中富集了副拟杆菌属、泰泽雷拉菌属(Tyzzerella);DOM组富集了芽孢杆菌属(Bacillales)。其中MMP-M组富集了乳酸菌、MMP-H组反而未富集,推测可能与剂量有关。这与吴桐[18]报道一致,说明适当剂量的六神曲能够有效缓解肠道菌群的紊乱,而超过剂量效果就会下降。
2.4.5 相关性分析
为了进一步探究肠道菌群对功能性消化不良的影响,分别对肠道菌群与胃肠动力、胃蛋白酶活力、胃肠激素、炎症因子进行相关性分析,结果见图12。在属水平上,未命名梭菌属(Clostridium unclassified)、艾森伯格菌属与胃排空率呈显著正相关,杜博斯氏菌属与胃排空率呈显著性负相关。未命名梭菌属、艾森伯格菌属与肠推进率呈显著正相关,德沃斯氏菌属(Devosia)与肠推进率呈显著性负相关。毛螺菌属NK4A136(Lachnospiraceae NK4A136 group)与胃蛋白酶活力呈显著性正相关。HT002系列菌属(HT002)、杜博斯氏菌属以及其他未分类的菌属与胃蛋白酶活力呈显著性负相关。CCK与HT002系列菌属、瘤胃球菌属呈显著性正相关,与毛螺菌属NK4A136、未命名梭菌属、艾森伯格菌属、罗氏菌属(Roseburia)呈显著性负相关。MTL与毛螺菌属NK4A136、艾森伯格菌属呈显著性正相关性,与HT002系列菌属、德沃斯氏菌属、杜博斯氏菌属以及未分类的其他菌属呈显著性负相关。IL-4与HT002系列菌属、瘤胃球菌属、德沃斯氏菌属、杜博斯氏菌属以及未分类的其他菌属呈显著性正相关,与毛螺菌属NK4A136、未命名梭菌属、拟普雷沃菌属(Alloprevotella)、艾森伯格菌属、罗氏菌属呈显著性负相关。IL-1β与HT002系列菌属、德沃斯氏菌属、杜博斯氏菌属以及未分类的其他菌属呈显著性正相关,与未命名梭菌属、艾森伯格菌属呈显著性负相关。上述相关性分析结果表明,关键菌属与胃肠动力、胃蛋白酶活力、胃肠激素、炎症因子之间存在较强关联,推测肠道微生物可能通过其关键代谢物调节胃肠激素和胃肠动力、提高胃蛋白酶活力、缓解炎症反应,从而改善功能性消化不良。
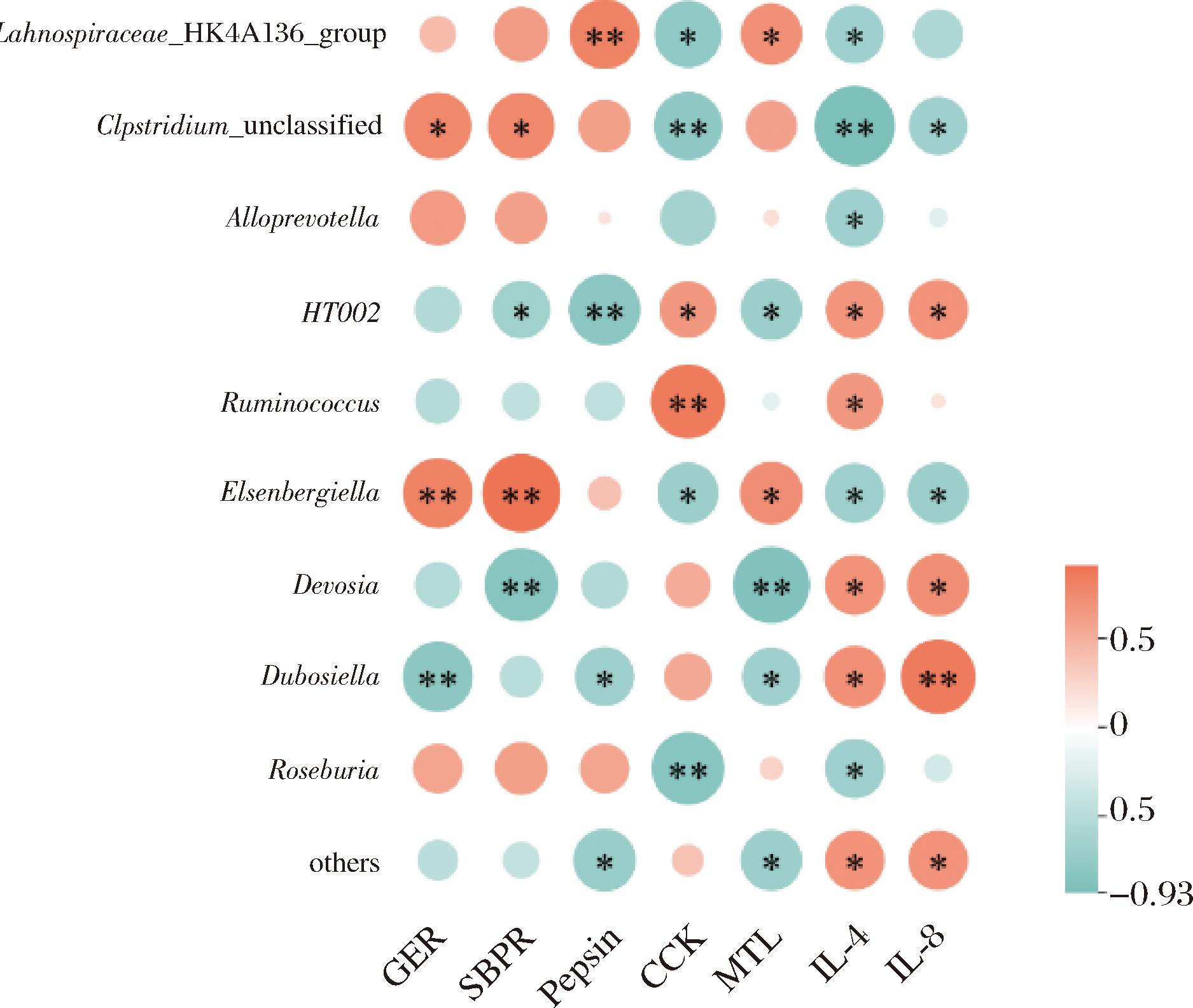
图11 肠道菌群与各检测指标的相关性
Fig.11 Correlation between intestinal flora and various detection indicators
注:*表示P<0.05,**表示P<0.01。
本研究制备的益生菌六神曲中阿魏酸、芦丁、槲皮苷、槲皮素、木犀草素含量较未强化六神曲分别提高了35.98%、191.91%、241.93%、65.25%和50.08%(P<0.05),证实益生菌产生的纤维素酶、纤维二糖酶、蛋白酶、半乳糖酶等能裂解植物细胞壁,降低多糖等对有效成分的包裹作用,析出更多的生物碱、黄酮、糖苷、有机酸和萜类等有效成分,提高药效。益生菌发酵六神曲对碘乙酰胺蔗糖溶液所致的功能性消化不良小鼠胃肠动力障碍的胃排空率、小肠推进率和胃蛋白酶活力具有明显的促进作用,能有效调节小鼠胃肠激素的分泌(CCK水平下降,MTL水平上调),缓解炎症反应,进而改善消化功能,结果与王艳等[6]报道相一致。
肠道健康由肠道屏障、免疫系统和肠道菌群共同调节。胃肠道微生物菌群的紊乱与胃肠道疾病如肠炎、腹泻等密切相关,肠道菌群失调是影响消化不良的重要因素。厚壁菌门与拟杆菌门的比例与炎症有关,可作为肠道菌群紊乱的标志[19]。变形菌门可导致肠道内毒素增加影响肠道免疫功能[20]。本研究结果显示,益生菌六神曲能有效缓解MOD组小鼠厚壁菌门的相对丰度下降(P<0.05),厚壁菌门与拟杆菌门的比值降低(P<0.05),变形菌门和放线菌门相对丰度升高(P<0.05)的现象,说明益生菌六神曲能够抑制小鼠肠道菌群发生紊乱,维持肠道稳态。
肠道菌群能够通过肠脑轴调节炎症反应。本研究中MOD模型组小鼠肠道有害菌如瘤胃球菌属和螺杆菌属(Helicobacter species)丰度显著上升,且瘤胃球菌属丰度与IL-4呈显著性正相关。已有研究证明,瘤胃球菌属已被确定为导致克罗恩病症状的原因之一,瘤胃球菌属产生的瘤胃球菌多糖可激活免疫细胞[21]。螺杆菌属会引起盲肠结肠炎。因此,这些菌群丰度上升,可能会导致机体产生免疫应答。在灌胃益生菌六神曲后,显著降低了这些有害菌的丰度,且还提升了肠道菌群中毛螺菌属NK4A136、阿克曼氏菌属和乳酸杆菌属等有益菌的相对丰度,其中毛螺菌属NK4A136与IL-4呈显著性负相关。研究表明,肠道微生物影响维持宿主健康所必需的各种代谢途径,将碳水化合物转化成短链脂肪酸,为肠上皮细胞提供能量,尤其是丁酸和丙酸,调节免疫系统[22]。毛螺菌属NK4A136能通过丁酰辅酶A途径产生丁酸,通过丙酰辅酶A生成丙酸[22]。阿克曼氏菌能通过增加脂质氧化、激活LKB1-AMPK轴调节L-天冬氨酸代谢和胆汁酸代谢等途径促进机体消化[23]。乳酸杆菌属可通过参与合成多种消化酶、氨基酸和维生素,帮助宿主对食物进行消化吸收和营养利用,调节免疫和增强肠道黏膜屏障功能,抑制有害细菌生长,抵抗致病菌感染[24]。
肠道菌群及其代谢物可通过肠神经元、神经胶质和肠肌层巨噬细胞等影响胃肠道蠕动。微生物代谢产物包括短链脂肪酸、胆汁酸和吲哚等会刺激肠源性激素,如CCK的分泌,再激活迷走神经和脊髓肠源性信号,实现对肠道生理功能的调控。拟杆菌和阿克曼氏菌与肠道转运时间呈正相关,梭菌、乳酸菌、甲基杆菌与肠道转运时间呈负相关。本研究发现,毛螺菌属NK4A136、未命名梭菌属、艾森贝氏菌属、罗氏菌属、瘤胃球菌属等菌属与胃肠道激素之间存在着显著的关联性。特别是毛螺菌属NK4A136与肠道肽类激素的关系尤为密切,其能通过调节5-HT和p-CREB-AANAT等肠道肽类激素的水平来影响肠道微生物群落的组成和功能。未命名梭菌属则与肠道神经递质有着紧密的联系,能够调节褪黑素等肠道神经递质水平[25]。另外,异普雷沃氏菌属、艾森贝氏菌属、罗氏菌属、瘤胃球菌属等菌属也与肠道激素有一定的关联性。
综上所述,本研究筛选获得的益生菌能有效提升六神曲的活性成分。功能性消化不良小鼠造模小鼠出现了体重下降、精神萎靡、毛发变黄、溏便等典型症状;给予益生菌强化发酵六神曲干预治疗后,可一定程度改善功能性消化不良小鼠的症状,提高胃肠动力和消化酶活力,增强恢复免疫功能,调节肠道微生物多样性稳态。研究结果可为阐明益生菌强化发酵六神曲治疗功能性消化不良的提供理论依据。
[1] HE Y X, YANG C, WANG P, et al.Child compound Endothelium corneum attenuates gastrointestinal dysmotility through regulating the homeostasis of brain-gut-microbiota axis in functional dyspepsia rats[J].Journal of Ethnopharmacology, 2019, 240:111953.
[2] FORD A C, MAHADEVA S, CARBONE M F, et al.Functional dyspepsia[J].The Lancet, 2020, 396(10263):1689-1702.
[3] 汪芸吉, 徐海燕.功能性消化不良的临床研究进展[J].现代医药卫生, 2023, 39(19):3375-3379.WANG Y J, XU H Y.Clinical research progress on functional dyspepsia[J].Journal of Modern Medicine &Health, 2023, 39(19):3375-3379.
[4] 付婷婷, 尹兴斌, 蔡梦如, 等.曲类中药的品种整理和标准现状分析[J].中国中药杂志, 2023, 48(10):2699-2712.FU T T, YIN X B, CAI M R, et al.Varieties systematization and standards status analysis of fermented Chinese medicine[J].China Journal of Chinese Materia Medica, 2023, 48(10):2699-2712.
[5] 常化松, 袁雯雯, 玄红专, 等.黄酮类化合物吸收代谢及其对胃肠道功能影响的研究进展[J].食品工业科技, 2019, 40(18):340-347.CHANG H S, YUAN W W, XUAN H Z, et al.Research progress on absorption and metabolism of flavonoids and their effects on the gastrointestinal tract function[J].Science and Technology of Food Industry, 2019, 40(18):340-347.
[6] 王艳, 高田田, 王子颖, 等.越鞠丸干预CUMS小鼠对抑郁样行为、功能性消化不良及PACAP/PAC1-R表达的影响[J].南京中医药大学学报, 2024, 40(3):261-267.WANG Y, GAO T T, WANG Z Y, et al.Effects of Yueju pill on depressive behavior, functional dyspepsia and PACAP/PAC1-R expression in CUMS mice[J].Journal of Nanjing University of Traditional Chinese Medicine, 2024, 40(3):261-267.
[7] 李慧萍. 小儿复方鸡内金咀嚼片联合西沙必利治疗功能性消化不良患儿临床疗效[J].实用中西医结合临床, 2022, 22(23):106-109.LI H P.Clinical efficacy of pediatric compound Jineijin chewable tablets combined with cisapride in the treatment of children with functional dyspepsia[J].Practical Clinical Journal of Integrated Traditional Chinese and Western Medicine, 2022, 22(23):106-109.
[8] 杜菲. 新加越鞠二陈汤治疗功能性消化不良伴失眠的临床研究[D].杭州:浙江中医药大学, 2022.DU F.Clinical study on the treatment of functional dyspepsia with insomnia by Xinjia Yueju Erchen decoction[D].Hangzhou:Zhejiang Chinese Medical University, 2022.
[9] 周晨一. 中药六神曲的现代化发酵制备[D].邯郸:河北工程大学, 2021.ZHOU C Y.Modern fermentation preparation of Chinese traditional medicine Liu Shen Qu[D].Handan:Hebei University of Engineering, 2021.
[10] 肖瑜, 魏引平, 袁小倩.六神曲中总有机酸含量的测定[J].黑龙江科学, 2022, 13(24):49-50;53.XIAO Y, WEI Y P, YUAN X Q.Determination of total organic acids in Liushenqu[J].Heilongjiang Science, 2022, 13(24):49-50;53.
[11] 姚青. 以麦麸为基质的红曲霉的固态发酵及抗氧化活性研究[D].杭州:浙江工业大学, 2015.YAO Q.Study on Monascus solid-state fermentation and antioxidant activity of matrix in wheat bran[D].Hangzhou:Zhejiang University of Technology,2015.
[12] 邓晰文, 彭新安, 林倩如, 等.余甘子提取物及其复配物对功能性消化不良小鼠的改善作用[J].现代食品科技, 2023, 39(5):8-13.DENG X W, PENG X A, LIN Q R, et al.The functional dyspepsia-ameliorating effect of Phyllanthus emblica L.extract and its formulated productss in mice[J].Modern Food Science and Technology, 2023, 39(5):8-13.
[13] 余胜. 基于TXNIP/NLRP3通路对透脓散及其单体阿魏酸抑制溃疡性结肠炎的实验和临床研究[D].南京:南京中医药大学, 2022.YU S.Experimental and clinical studies of Tou Nong San and its monomer ferylic acid inhibit ulcerative colitis based on TXNIP/NLRP3 pathway[D].Nanjing:Nanjing University of Chinese Medicine, 2022.
[14] 褚旭芳, 宋顺喆, 王笑楠, 等.芦丁与消化系统炎症性疾病关系的研究进展[J].医学综述, 2019, 25(20):4122-4127.CHU X F, SONG S Z, WANG X N, et al.Research Progress of relationship between rutin and digestive system inflammatory diseases[J].Medical Recapitulate, 2019, 25(20):4122-4127.
[15] QIN H Y, ZANG K H, ZUO X, et al.Quercetin attenuates visceral hypersensitivity and 5-hydroxytryptamine availability in postinflammatory irritable bowel syndrome rats:Role of enterochromaffin cells in the colon[J].Journal of Medicinal Food, 2019, 22(7):663-671.
[16] 覃超, 唐富豪, 滕建文, 等.产β-葡萄糖苷酶乳酸菌发酵对百香果皮多酚含量和功能活性的影响[J].食品与发酵工业, 2023, 49(8):230-236.QIN C, TANG F H, TENG J W, et al.Effect of β-glucosidase producing lactic acid bacteria fermentation on polyphenol content and functional activity of passion fruit peel[J].Food and Fermentation Industries, 2023, 49(8):230-236.
[17] 蒋昊. 北山楂、南山楂和广山楂性状鉴别和有机酸成分研究进展[J].辽宁中医药大学学报, 2023, 25(1):132-137.JIANG H.Research progress on character identification and organic acid compositions of Shanzha (Crataegus pinnatifida), Nanshanzha (South crataegus) and Guangshanzha (Cantonese crataegus)[J].Journal of Liaoning University of Traditional Chinese Medicine, 2023, 25(1):132-137.
[18] 吴桐. 芪参地黄颗粒对MG患者及EAMG大鼠肠道菌群影响的研究[D].长春:长春中医药大学, 2023.WU T.Effects of Qishen Dihuang granules on intestinal microbiota in MG patients and EAMG model rats[D].Changchun:Changchun University of Traditional Chinese Medicine, 2023.
[19] ZHANG X, ZHAO Y F, ZHANG M H, et al.Structural changes of gut microbiota during berberine-mediated prevention of obesity and insulin resistance in high-fat diet-fed rats[J].PLoS One, 2012, 7(8):e42529.
[20] 杨超茅, 张顺宵, 李园园, 等.六味地黄汤加减联合氯沙坦钾对糖尿病肾病大鼠ACE1/Ang Ⅱ/AT1R轴及肠道菌群的影响[J].中国实验方剂学杂志, 2024, 30(6):1-9.YANG C M, ZHANG S X, LI Y Y, et al.Modified Liuwei Dihuangtang combined with losartan potassium regulates ACE1/Ang I/AT1R axis and intestinal flora in rat model of diabetic kidney disease[J].Chinese Journal of Experimental Traditional Medical Formulae, 2024, 30(6):1-9.
[21] HENKE M T, KENNY D J, CASSILLY C D, et al.Ruminococcus gnavus, a member of the human gut microbiome associated with Crohn’s disease, produces an inflammatory polysaccharide[J].Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(26):12672-12677.
[22] LIN X Q, HU T Y, WU Z N, et al.Isolation of potentially novel species expands the genomic and functional diversity of Lachnospiraceae[J].iMeta, 2024, 3(2):e174.
[23] RAO Y, KUANG Z Q, LI C, et al.Gut Akkermansia muciniphila ameliorates metabolic dysfunction-associated fatty liver disease by regulating the metabolism of L-aspartate via gut-liver axis[J].Gut Microbes, 2021, 13(1):1-19.
[24] LIU Y, LIAO W T, LIU X R, et al.Digestive promoting effect and mechanism of Jiao Sanxian in rats[J].Journal of Ethnopharmacology, 2021, 278:114334.
[25] SONG L J, HE M B, SUN Q H, et al.Roseburia hominis increases intestinal melatonin level by activating p-CREB-AANAT pathway[J].Nutrients, 2021, 14(1):117.