LIU Bowen,SUN Yang,KANG Yu, et al.Effects of texture properties on functional characteristics of nanosized selenium embedded in the konjac gel[J].Food and Fermentation Industries,2025,51(14):253-264.
魔芋葡甘聚糖(konjac glucomannan, KGM)是一种源自魔芋块茎的高分子水溶性多糖,具有突出的亲水性和凝胶化能力[1]。在碱性条件下,KGM分子链上的乙酰基团脱除后可促进其分子间氢键的形成,导致KGM分子链相互缠结以束缚大量水分,从而形成具有一定机械强度的凝胶体系[2]。KGM在胃和小肠中稳定难以分解,可在盲肠和结肠区域被肠道微生物降解,从而发挥益生元的作用并促进肠道健康[3]。该特性是KGM可用于口服药物载体的重要功能基础,是药物递送领域发展的研究方向之一[4]。目前,多糖凝胶已经在药物递送、组织工程、食品包装等多个领域得到广泛应用[5-7],其应用在递送药物领域的研究相对较多,但如何通过调控多糖凝胶物性以增加药物稳定性和生物活性周期的相关研究较为少见。
硒是人体必需的微量元素,在维持人体健康方面发挥着关键作用,包括增强免疫力、促进生殖健康、预防心血管疾病和某些癌症等[8-9]。然而,硒在自然界的分布极为不均,许多地区的土壤硒含量远低于人体所需,导致通过日常饮食难以获得足够的硒[10]。鉴于此,生活在缺硒地区的人们常常需要通过硒补充剂来满足身体对硒的需求。近年来,纳米硒(selenium nanoparticles, SeNPs)因其较低的毒性、较宽的安全剂量范围以及较短的合成周期等优势,逐渐成为研究者关注的焦点[11]。SeNPs相比于其他硒形态具有独特的物理特性,如小尺寸效应和高比表面积,这使得它们更容易被人体吸收和转化[12]。与无机硒相比,SeNPs在体内的生物可利用度更高,且具有更宽的安全剂量范围,这使得它们在健康促进和疾病预防领域的应用前景更加广阔[13]。由于SeNPs在稳定性和潜在毒性方面存在挑战,这限制了它们在实际应用中的广泛使用。例如,在制备、贮藏及消化吸收等过程中,一系列复杂的体内外环境因素势必对SeNPs的稳定性产生不利影响[14],不仅会降低其生物活性[15],甚至可能因此产生毒性[16]。这些因素限制了SeNPs应用在医疗和膳食补充剂领域[17]。因此,研究和开发更安全、更稳定的SeNPs制剂变得尤为迫切,这不仅响应了市场和消费者对高效硒补充剂的需求,也旨在提高其在临床应用中的安全性和有效性。
本研究旨在探讨KGM-SeNPs凝胶的质构特性对SeNPs功能特性的影响。通过质构分析仪、X射线衍射、傅里叶变换红外光谱以及扫描电子显微镜等实验设备,对KGM凝胶结构特征以及KGM凝胶与SeNPs相互作用进行了深入分析。再系统地探讨KGM-SeNPs凝胶内部分子相互作用力对凝胶质构特性的影响,以及这些特性如何调控SeNPs的释放行为及生物活性。研究结果展示了KGM凝胶在SeNPs递送领域的应用潜力,有助于提高KGM凝胶在生物医学领域的应用价值,并为设计具有良好缓释效果的凝胶材料提供了理论参考。
魔芋葡甘聚糖(食品级,纯度≥95%),湖北强森魔芋科技有限公司;碳酸钠(AR),国药集团化学试剂有限公司;亚硒酸钠(AR),山东西亚化学股份有限公司;抗坏血酸(AR),国药集团化学试剂有限公司;α淀粉酶(≥100 U/mg)、胃蛋白酶(≥15 000 U/mg)、胰酶(100~350 U/mg),上海阿拉丁生化科技股份有限公司;大肠杆菌 ATCC 25922、金黄色葡萄球菌CMCC(B)26003,北京生物保藏中心;2,2-diphenyl-1-picrylhydrazyl(DPPH),2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS),Sigma-Aldrich公司。
TA.TOUCH质构分析仪,上海保圣实业发展有限公司;X射线衍射仪,岛津企业管理(中国)有限公司;iS5傅里叶红外光谱仪,美国Thermo公司;Zetasizer Nano ZS动态光散射仪,英国马尔文公司;Gemini SEM 300,德国Carl Zeiss公司;HF-180二氧化碳培养箱,赛默飞世尔科技(中国)有限公司;BOXUN立式灭菌锅,上海博讯实业有限公司医疗设备厂;DNP-9162BS-Ⅲ电热恒温培养箱,上海新苗医疗器械制造有限公司。
1.3.1 SeNPs的制备
参考徐颖等[18]的方法略作修改。分别向25 ℃和60 ℃的Na2SeO3溶液中逐滴加入一定量的抗坏血酸溶液,确保Na2SeO3和抗坏血酸的摩尔比为1∶2,同时以500 r/min的速度搅拌30 min,得红色SeNPs溶胶。随后,采用3 500 Da的透析袋在纯水中对溶胶进行透析除杂,充分透析6 h后存于4 ℃冰箱备用。将上述在25 ℃和60 ℃条件下制备的2种SeNPs溶胶依次命名为SeNPs-a和SeNPs-b。
1.3.2 KGM-SeNPs凝胶的制备
将适量的Na2CO3溶液和SeNPs溶胶加入到蒸馏水中并进行搅拌,待到Na2CO3和SeNPs充分混匀后加入不同质量的KGM粉末使其质量分数分别为2%、4%、5%,继续搅拌10 s后装入模具,封口并静置1 h。随后,将模具置于90 ℃的恒温水浴锅中加热1 h,待凝胶冷却至室温后备用。其中Na2CO3与KGM的质量比为1∶10,SeNPs的含量为3 mg。
1.4.1 SeNPs粒径分析
参考吴玲莹[19]的方法并适当修改。利用动态光散射仪对SeNPs的粒径分布和分散性进行测定。将SeNPs-a、SeNPs-b溶胶超声处理3 min后,取出3 mL于比色皿中,测定粒径。设定预热时间10 min,测量温度25 ℃,测量次数3 次。
1.4.2 质构测定
参考TRESPALACIOS等[20]的方法并适当修改。以质构仪测定KGM-SeNPs凝胶(2.7 cm×2.7 cm×2.7 cm)的质构性质。室温下使用全质构分析模式和铝质圆柱形探头(SMP P /36R)测试样品;测试条件:触发力为5 g、应变压缩率40 %、测前速率1 mm/s,测试速率1 mm/s,测后速率5 mm/s,数据釆集速率200 pps,每组样品做3次平行实验。
1.4.3 扫描电镜分析
参考吴玲莹[19]的方法并适当修改。首先,将4%(质量分数)KGM-SeNPs凝胶样品在-70 ℃条件下预冻12 h;随后,对预冻后的样品进行冷冻干燥,去除水分,得到冻干样品。接着,将冻干后的样品切开,取出一部分并固定在导电胶上,并对样品表面进行金颗粒溅射处理,形成一层均匀的金膜。最后,使用扫描电子显微镜观察4%冻干样品的微观形貌,测试电压为20 kV。
1.4.4 X-射线衍射分析
参考李晶[21]的方法并适当修改。将冷冻干燥后的4% KGM-SeNPs凝胶样品磨成粉末,以X-射线衍射仪对样品进行扫描后获取XRD图谱。测定条件为40 KV,40 mA,25 ℃,采用Cu-Kα1辐射,扫描速度为4°/min,步距为 2θ=0.02°,扫描范围为5°~45°。
1.4.5 傅里叶红外光谱分析
参考李晶[21]的方法并适当修改。将4% KGM-SeNPs凝胶的冻干样品粉末置于傅里叶红外光谱仪全反射附件上(iD7 Transmission),进行红外光谱扫描。测试前,以空气为背景,设定波数范围为4 000~400 cm-1,分辨率为4 cm-1,扫描32次。
1.5.1 模拟消化液的配制
参照DAO等[22]的方法并适当修改,制备模拟消化液。
模拟唾液(simulated saliva fluid,SSF):NaHCO3(5.208 g)、K2HPO4(1.369 g)、NaCl(0.877 g)、KCl(0.477 g)、CaCl2(0.441 g),加入去离子水至1 L。用2 mol/L HCl将模拟唾液pH值调节至7.0。
模拟胃液(simulated gastric fluid,SGF):NaCl(3.097 g)、CaCl2(0.111 g)、KC1(1.103 g)、8.33 mL 1 mol/L盐酸,加入去离子水至1 L,室温保存,备用。
模拟小肠液(simulated intestinal fluid,SIF):将KH2PO4(2.72 g)和KOH(0.32 g)溶解在少量去离子水,转移到1 L容量瓶中,将去离子水添加到该体积,并在室温下贮存,备用。
1.5.2 SeNPs释放率的测定
参照KHIN等[23]的方法并适当修改,其中消化酶的添加量根据酶活性进行调整,以满足模拟消化实验中所需的酶活性。
模拟口腔消化:使用机械研磨机将KGM-SeNPs凝胶粉碎3 s后取出40 g,加入40 mL SSF以及α淀粉酶,确保最终酶活性达到75 U/mL,混合后置于控温磁力搅拌器中,在37 ℃条件下以150 r/min搅拌2 min。
模拟胃消化:模拟口腔消化结束后,向反应器中加入40 mL SGF和胃蛋白酶,确保最终酶活性达到2 000 U/mL。随后使用1 mol/L HCl调节混合物的pH值至2±0.1,并在37 ℃条件下以200 r/min搅拌2 h。在消化过程的0、30、60、90、120 min时间点取1 mL上清液检测其中硒含量以评估SeNPs的释放量。在消化过程中每隔30 min对混合物的pH进行校准。
模拟小肠消化:模拟胃消化结束后,向反应器中加入40 mL SIF和胰酶,确保最终酶活性达到200 U/mL。随后使用1 mol/L NaOH溶液将混合物的pH值调整至6.8±0.2,并在37 ℃条件下以75 r/min搅拌2 h。在消化过程的0、30、60、90、120 min的时间点取1 mL上清液检测其中硒含量以评估SeNPs的释放量。在消化过程中每隔30 min对混合物的pH进行校准。整个模拟消化过程中,SeNPs释放率计算如公式(1)所示:
释放率![]()
(1)
式中:Ct为 t时间内消化液中SeNPs的含量,mg;C为模拟消化前凝胶中SeNPs的含量,mg。
1.5.3 体外释放动力学分析
为了深入理解和准确预测SeNPs在KGM-SeNPs凝胶中的释放行为,本实验选取了3种广泛使用的释放动力学模型进行拟合分析,通过Origin软件,将实验数据与这3种不同的模型进行拟合,并根据拟合结果分析SeNPs的体外释放特性。
a)零级释放动力学模型表示如公式(2)所示:
(2)
式中:Qt表示时间t的SeNPs释放速率;Mt和M∞分别表示时间t和时间∞的累积SeNPs释放量;k即零级释放系数。
b)Korsmeyer-Peppas模型的表达式如公式(3)所示:
(3)
式中:Qt表示时间t的SeNPs释放速率;Mt和M∞分别表示时间t和时间∞的累计SeNPs释放量;k是释放系数。
c)Higuchi模型的表达式如公式(4)所示:
(4)
式中:Qt表示时间t的SeNPs释放速率;Mt和M∞分别表示时间t和时间∞的累积SeNPs释放量;k为Higuchi释放系数。
1.6.1 DPPH自由基清除能力测定
取出40 g经过3 s粉碎后的KGM-SeNPs凝胶颗粒,将其加入到40 mL无菌蒸馏水中并浸泡12 h,每4 h更换无菌蒸馏水,取出浸泡凝胶颗粒4 h和12 h的蒸馏水作为液体样品用于后续实验。参照文献[24]方法检测对DPPH自由基的清除能力。将1 mL液体样品与4 mL 500 μmol/L的DPPH乙醇溶液混合,室温避光反应30 min,在517 nm下测定吸光度(A样品)。用无水乙醇代替DPPH乙醇溶液加入并测定吸光度(A空白),用蒸馏水代替液体样品并测定吸光度(A对照)。DPPH自由基清除率的计算按公式(5)计算:
DPPH自由基清除率![]()
(5)
1.6.2 ABTS阳离子自由基清除能力测定
参照文献[24]方法检测对ABTS阳离子自由基清除能力。将10 mL 7.4 mmol/L ABTS溶液与10 mL 2.6 mmol/L过硫酸钾溶液混合,室温避光反应12 h,采用无水乙醇稀释直至其在734 nm处吸光度值达到0.70±0.01,以此为ABTS工作液。将1 mL液体样品与4 mL ABTS工作液混合,室温避光反应6 min,在734 nm下测定吸光度(A样品),用无水乙醇代替ABTS工作液加入并测定吸光度(A空白),用蒸馏水代替液体样品加入并测定吸光度(A对照)。ABTS阳离子自由基清除率的计算按公式(6)计算:
ABTS阳离子自由基清除率![]()
(6)
参照刘丽莉等[25]的方法并适当修改。分别向含有100 μL金黄色葡萄球菌和大肠杆菌菌悬液(1×106 CFU/mL)的试管中加入5 mL肉汤培养基以及2 g的KGM-SeNPs凝胶,并在37 ℃恒温摇床中培养4 h,最后分别在450 nm和600 nm下测定吸光度(A样品)。取出上述样品凝胶,再次灭菌并重复1次上述步骤。用灭菌后的蒸馏水代替菌悬液加入并测定吸光度(A空白),用KGM凝胶代替KGM-SeNPs凝胶加入并测定吸光度(A对照)计算公式如公式(7)所示:
抑菌率![]()
(7)
1.8.1 Hep G2肿瘤细胞存活率的测定
参考DENG等[26]方法并稍作修改。将Hep G2细胞置于含5%(体积分数)CO2的37 ℃培养箱中预培养至良好生长状态。随后,将Hep G2细胞以每孔8 000个细胞的密度接种于96孔板中培养24 h。弃去上清液,向每个孔中加入100 μL液体样品以及100 μL DMEM培养基,继续培养24 h或48 h,以评估液体样品的抗肿瘤活性。在进行测试前,每孔重新注入100 μL的DMEM培养基,以及10 μL的CCK-8溶液,于37 ℃孵育2 h后,在450 nm下测定吸光度(A实验),用无菌蒸馏水代替液体样品加入并测定吸光度(A对照),测定不加细胞的空白组吸光度(A空白),每组5个复孔。计算肿瘤细胞存活率的公式如公式(8)所示:
存活率![]()
(8)
1.8.2 肿瘤细胞划痕愈合率的测定
参考GRADA等[27]方法并稍作修改。将2 mL HepG2细胞悬液以2×105个/孔的细胞密度接种至6孔板中,并于5% CO2、37 ℃培养箱中培养至细胞覆盖率超过80%。随后,弃去培养上清液,以200 μL移液器枪头垂直于6孔板底部进行划痕处理。用磷酸盐缓冲液冲洗3次后,加入2 mL含5%(体积分数)胎牛血清的DMEM培养基以及2 mL液体样品,继续培养48 h。通过倒置显微镜观察并拍摄经0 h、24 h、48 h培养后的划痕,使用 Image J 软件对图像进行分析。肿瘤细胞划痕愈合率的计算公式如公式(9)所示:
愈合率![]()
(9)
式中:A0为培养0 h后的划痕平均面积;A1为0 h、24 h或48 h后划痕的面积。
采用 Origin 2024 软件对结果进行统计分析,数据结果以“平均值±标准差”表示。数据采用单因素方差分析(ANOVA),使用Duncan多范围检验确定均值之间的显著差异(P<0.05)。
本研究对2种不同温度下制备的SeNPs溶胶进行了粒径分析。如图1所示,SeNPs-b的粒径相对较大,且分布范围较宽,其平均粒径为(398.8±8.26) nm,多分散指数为0.35±0.03;相比之下,SeNPs-a的粒径较小,分布集中,平均粒径为(82.08±2.34) nm,多分散指数为0.25±0.05。研究结果表明,制备温度是影响SeNPs粒径和分布的重要因素。较低的温度有助于控制SeNPs的粒径生长,从而获得更小且更均匀的SeNPs颗粒。这些数据证明了SeNPs-a溶胶具有良好的分散性。
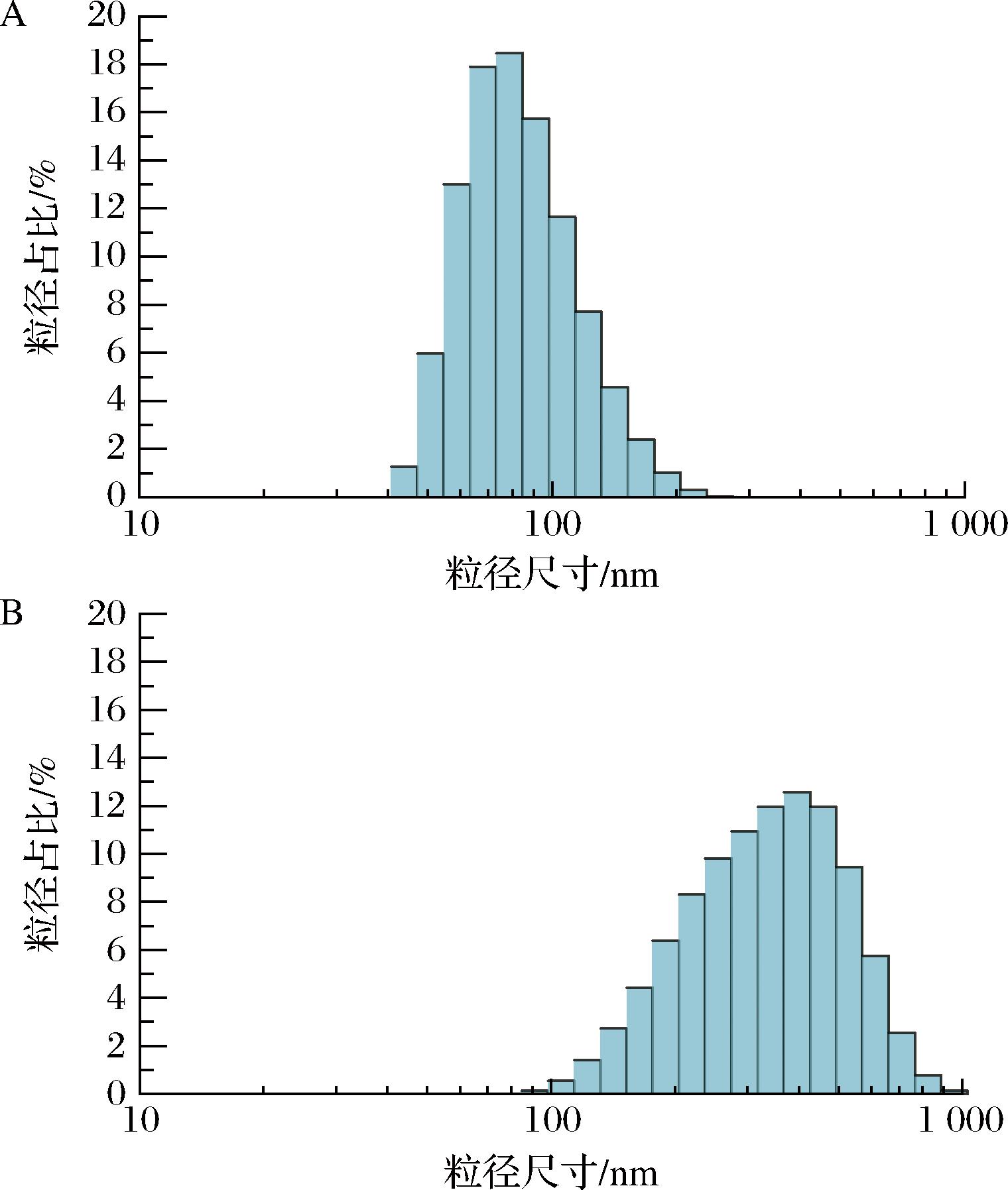
A-25 ℃;B-60 ℃
图1 不同温度对SeNPs粒径的影响
Fig.1 Effect of different temperatures on the particle size of SeNPs
如图2所示,随着KGM浓度的增加,凝胶的硬度、内聚性、弹性及咀嚼性均显著提高。这一现象可归因于KGM分子间相互作用的增强,从而形成了更加致密的三维空间网络结构,增强了凝胶的质构特性。此外,研究发现,在KGM凝胶中添加不同粒径的SeNPs并未对KGM-SeNPs凝胶的质构特性造成显著影响,凝胶的硬度、弹性、内聚性和咀嚼性等指标均未观察到明显变化。这可能是因为SeNPs的添加量不足,或者所用SeNPs的尺寸不足以破坏KGM凝胶的网络结构,SeNPs可能均匀分散在凝胶网络中,未形成大的聚集体,从而减少了对KGM分子间相互作用的影响。因此,KGM凝胶仍具有稳定的三维网络结构[28]。
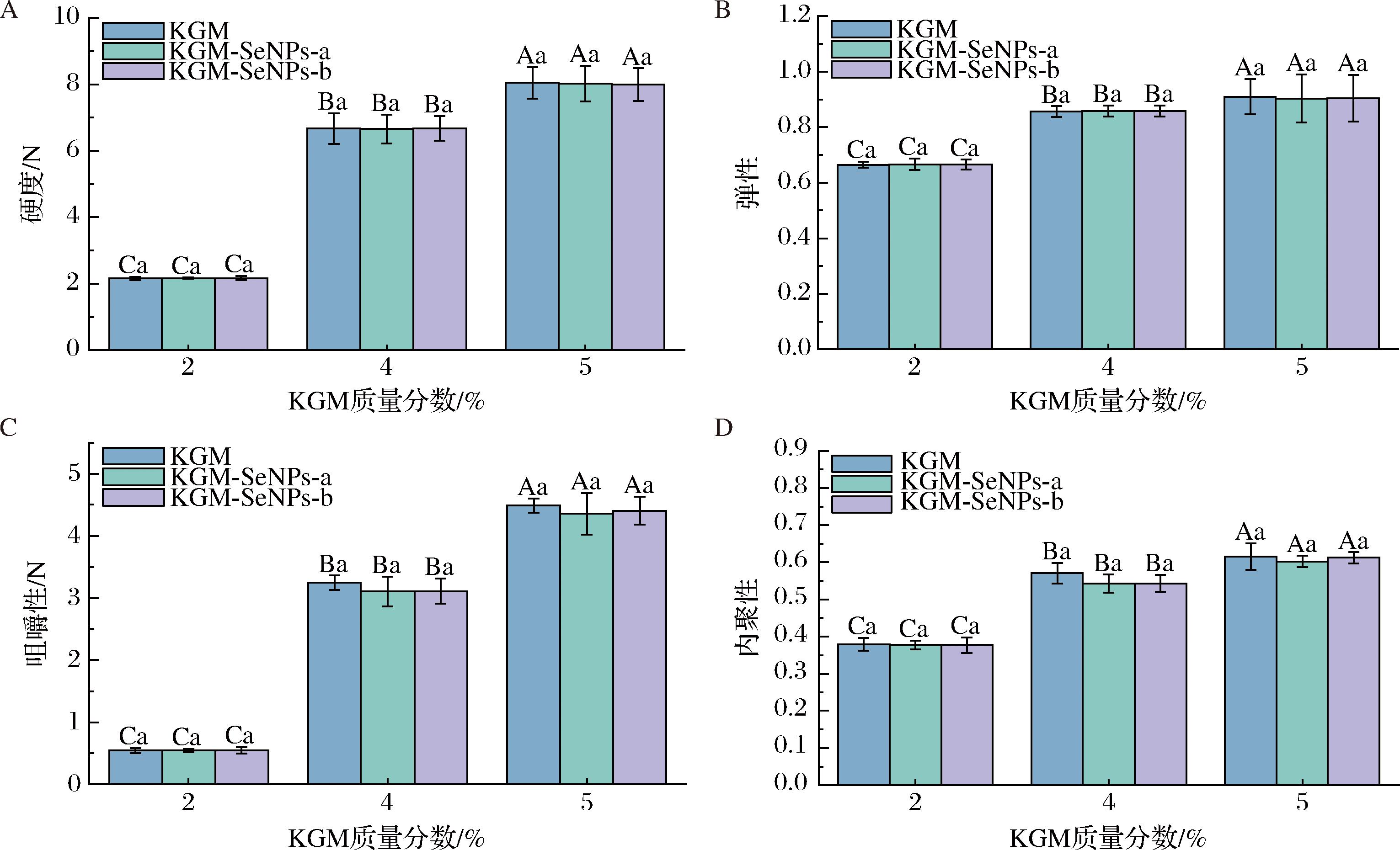
A-硬度;B-弹性;C-咀嚼性;D-内聚性
图2 KGM-SeNPs凝胶的质构特性
Fig.2 Texture characteristics of KGM-SeNPs gels
注:图中不同的大写字母表示组内存在显著性差异(P<0.05),不同的小写字母表示组间存在显著性差异(P<0.05)(下同)。
图3比较了4% KGM凝胶和4% KGM-SeNPs凝胶的微观形貌。结果显示,KGM凝胶表面较为平滑,而KGM-SeNPs凝胶表面则有球形粒子附着。对比图3-A、图3-B和图3-C可知,KGM-SeNPs-a凝胶中,SeNPs粒径较小且分布均匀,而KGM-SeNPs-b凝胶中的SeNPs的粒径较大,分布也相对集中。此外,通过电子显微镜结合能量色散谱EDS分析,确认了KGM-SeNPs凝胶中存在Se元素,证实了SeNPs成功附着在凝胶表面[29]。
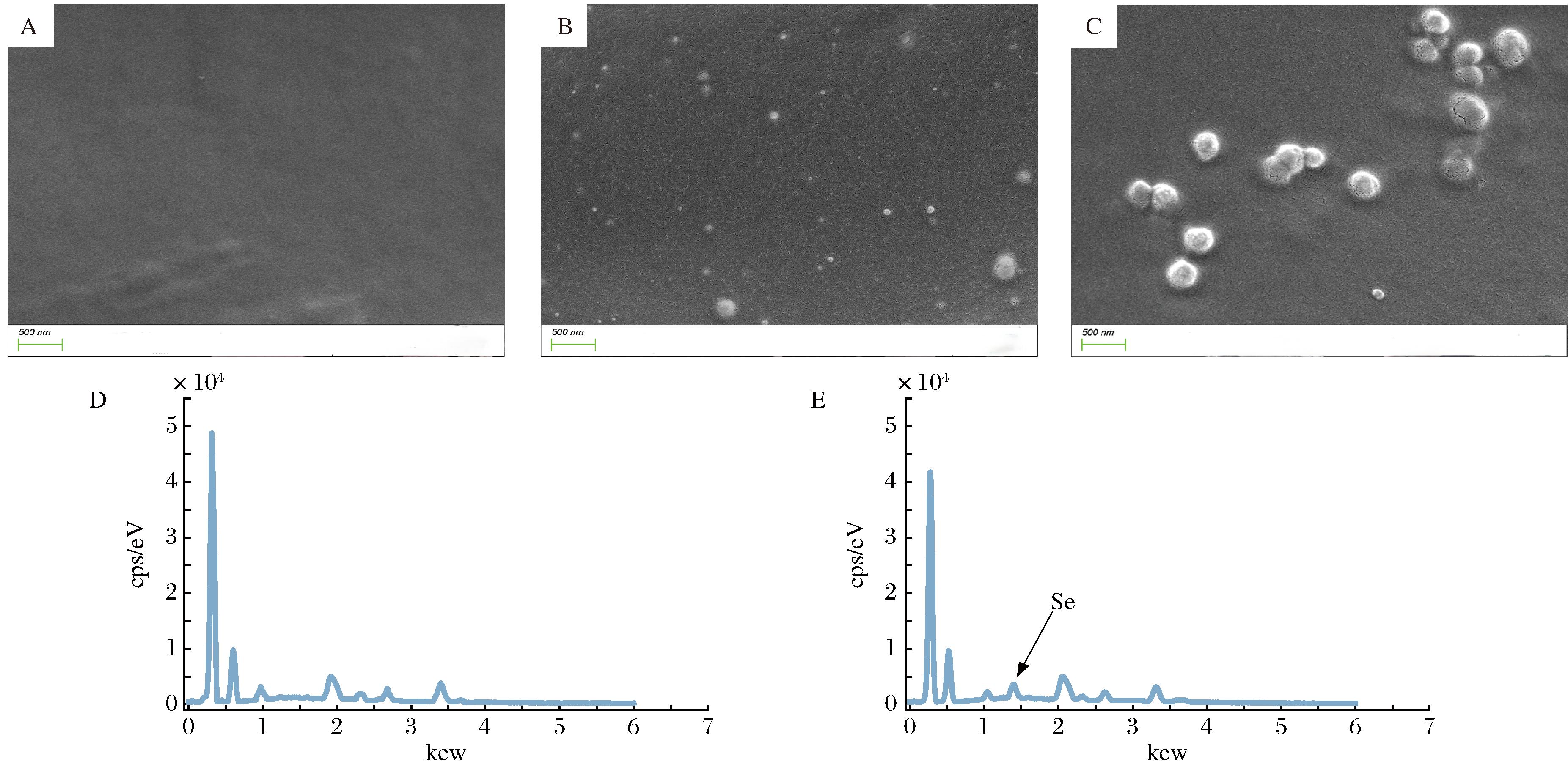
A-4% KGM凝胶的扫描电镜图;B-4% KGM-SeNPs-a凝胶的扫描电镜图;C-4% KGM-SeNPs-b凝胶(× 20 000倍)的扫描电镜图;D-KGM凝胶的元素分析结果图;E-KGM-SeNPs凝胶的元素分析结果图
图3 凝胶的扫描电镜图和元素分析结果图
Fig.3 Scanning electron microscopy images and elemental analysis results of gels
图4-A展示了4% KGM凝胶和4% KGM-SeNPs凝胶的X射线衍射图谱。研究结果显示,在2θ角为20°附近,所有样品均呈现了典型的弥散峰,这一现象表明KGM凝胶主要呈现无定型非结晶态[30]。尽管在KGM凝胶中引入了不同粒径的SeNPs,但X射线衍射图谱显示KGM凝胶的结晶状态并未发生显著变化。这可能归因于实验中SeNPs的添加量相对较低或者所用SeNPs的尺寸可能不足以显著改变KGM凝胶分子的排列和相互作用,因此对凝胶的结晶状态影响有限[21]。图4-B显示了4% KGM凝胶和4% KGM-SeNPs凝胶的红外光谱图。KGM-SeNPs-a凝胶和KGM-SeNPs-b凝胶的O—H拉伸振动峰从3 320 cm-1 移至3 330 cm-1。糖残基C—O—H键的伸缩振动峰从1 010 cm-1处移至1 020 cm-1。KGM-SeNPs凝胶中羟基的振动吸收峰的蓝移现象可归因于SeNPs的加入增强了KGM分子中羟基的氢键作用。更强的氢键会导致O—H键的振动频率增加,因为氢键的形成改变了电子密度分布,使得O—H键更难以振动,从而需要更高的能量[31]。此外,与KGM凝胶相比较,KGM-SeNPs凝胶的红外光谱中未出现新的吸收峰,这一结果表明在KGM与SeNPs的结合中未产生新的化学键。证实SeNPs并未引起KGM分子结构的显著变化,可能主要通过物理吸附或氢键作用与KGM凝胶网络相结合。
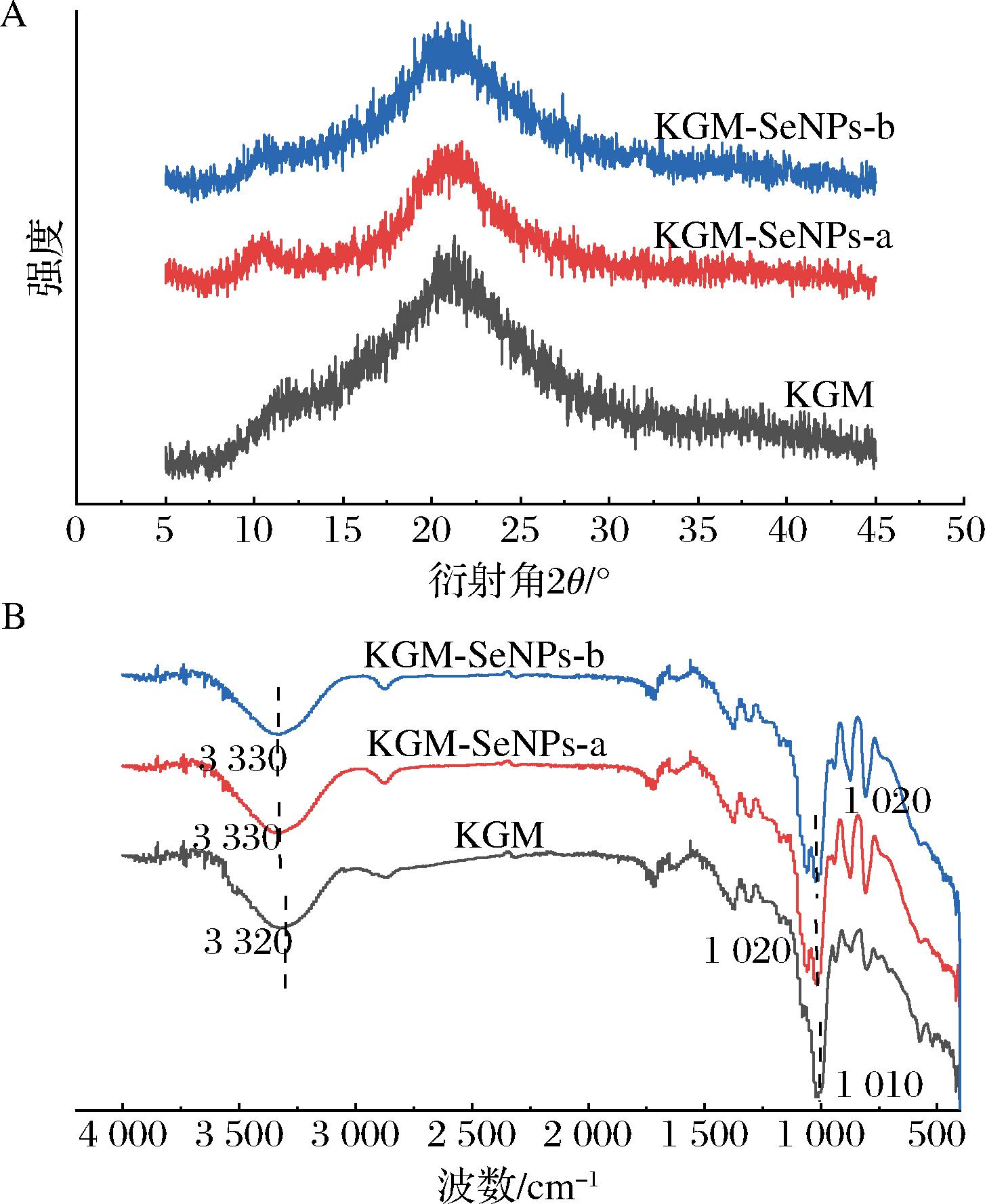
A-X射线衍射图谱;B-红外光谱
图4 4% KGM凝胶和4% KGM-SeNPs凝胶的X射线衍射图谱以及红外光谱
Fig.4 X-ray diffraction patterns and Fourier-transform infrared spectra of 4% KGM gel and 4% KGM-SeNPs gel
图5展示了KGM-SeNPs凝胶的缓释结果。随着胃肠消化的进行,SeNPs的释放量逐渐增加,这一现象证明了KGM-SeNPs凝胶在消化过程中对SeNPs具有缓释效果。进一步研究发现,高硬度KGM-SeNPs凝胶具有较低的SeNPs释放速率。推测其原因是KGM浓度的增加,导致凝胶网络结构更加紧密,加强了KGM与SeNPs的相互作用,从而限制了SeNPs的扩散,降低了其释放速率。此外,相较于具有相似硬度的KGM-SeNPs-b凝胶,KGM-SeNPs-a凝胶中SeNPs释放速率较低。这一差异可能归因于KGM-SeNPs-a凝胶中SeNPs粒径较小,具有较大的比表面积,与KGM的分子间的相互作用更为显著,从而有效减缓了SeNPs的释放速率。而在KGM-SeNPs-b凝胶中,较大的SeNPs粒径及聚集现象减少了与KGM凝胶的相互作用,从而更容易在消化过程中被释放[32]。
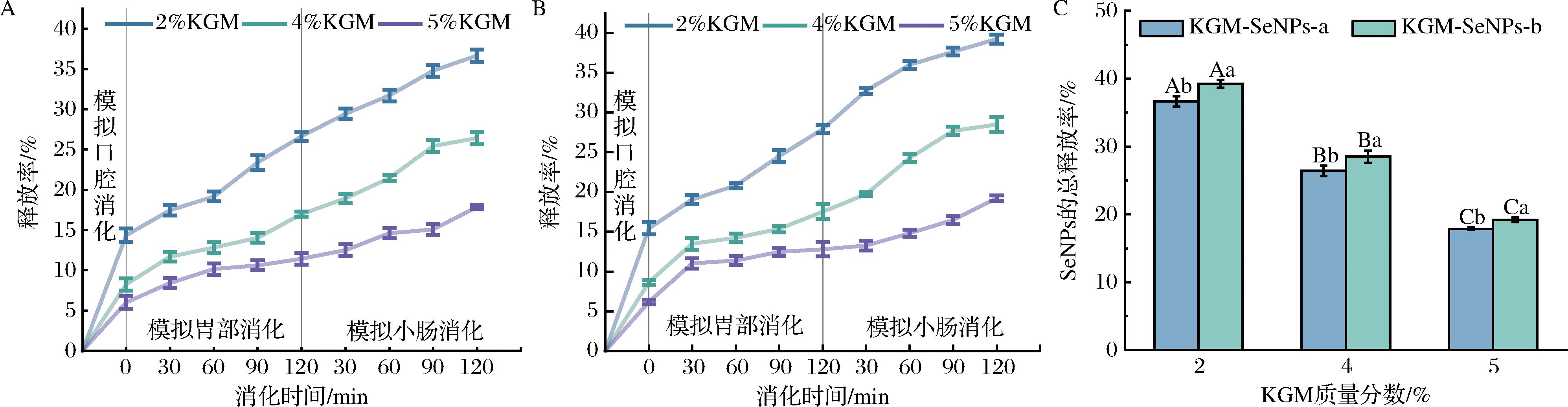
A-KGM-SeNPs-a凝胶;B-KGM-SeNPs-b凝胶;C-2种凝胶中SeNPs的总释放率
图5 SeNPs的释放率和2种凝胶中SeNPs的总释放率
Fig.5 Release rate of SeNPs and total release rate of SeNPs from two types of gels
基于零阶释放动力学模型、Korsmeyer-Peppas模型和Higuchi模型,运用Origin软件对KGM-SeNPs-a凝胶和KGM-SeNPs-b凝胶的实验数据进行分析和拟合。拟合结果如表1所示。从拟合结果可以发现,采用零阶释放动力学模型来拟合KGM-SeNPs凝胶消化阶段的实验数据,相较于其他模型展现了更优的拟合效果,可以得到较好的拟合优度R2值。这一结果表明,在消化环境中SeNPs的释放速率相对稳定,并未因pH的变化而显著改变。这种稳定性可能与KGM凝胶的结构特性有关,KGM凝胶的三维网络结构为SeNPs提供了一个稳定的释放环境,使得SeNPs能够在不同的消化阶段以相似的速率释放[33]。
表1 KGM-SeNPs凝胶在不同模型下的拟合结果
Table 1 Fitting results of KGM-SeNPs gels under different models
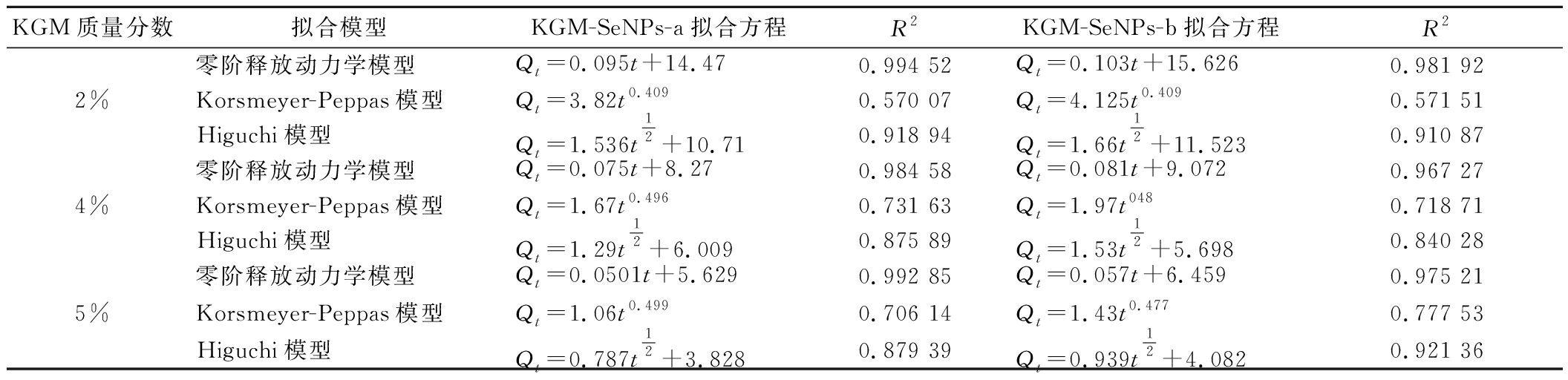
KGM质量分数拟合模型KGM-SeNPs-a拟合方程R2KGM-SeNPs-b拟合方程R22%零阶释放动力学模型Qt=0.095t+14.470.994 52Qt=0.103t+15.6260.981 92Korsmeyer-Peppas模型Qt=3.82t0.4090.570 07Qt=4.125t0.4090.571 51Higuchi模型Qt=1.536t12+10.710.918 94Qt=1.66t12+11.5230.910 874%零阶释放动力学模型Qt=0.075t+8.270.984 58Qt=0.081t+9.0720.967 27Korsmeyer-Peppas模型Qt=1.67t0.4960.731 63Qt=1.97t0480.718 71Higuchi模型Qt=1.29t12+6.0090.875 89Qt=1.53t12+5.6980.840 285%零阶释放动力学模型Qt=0.0501t+5.6290.992 85Qt=0.057t+6.4590.975 21Korsmeyer-Peppas模型Qt=1.06t0.4990.706 14Qt=1.43t0.4770.777 53Higuchi模型Qt=0.787t12+3.8280.879 39Qt=0.939t12+4.0820.921 36
2.7.1 DPPH自由基清除能力
DPPH自由基的清除机制主要是通过SeNPs粒子表面的吸附作用,使得DPPH分子中的未配对电子与SeNPs水合层上的氢原子结合,形成稳定的DPPH-H分子[34]。图6表明,低硬度的KGM-SeNPs凝胶在4 h后展现出较强的DPPH自由基清除能力,其中KGM-SeNPs-a凝胶和KGM-SeNPs-b凝胶的DPPH自由基清除率可达到58.16%和56.99%。说明小粒径SeNPs的DPPH自由基的清除效果更强。进一步的实验观察到,高硬度的KGM-SeNPs凝胶在12 h后展现出强于低硬度的KGM-SeNPs凝胶的DPPH自由基清除能力。这一现象表明高硬度的KGM-SeNPs凝胶对SeNPs的缓释作用能有效延长SeNPs生物活性的持续时间,从而可能提高其在体内的利用效率。
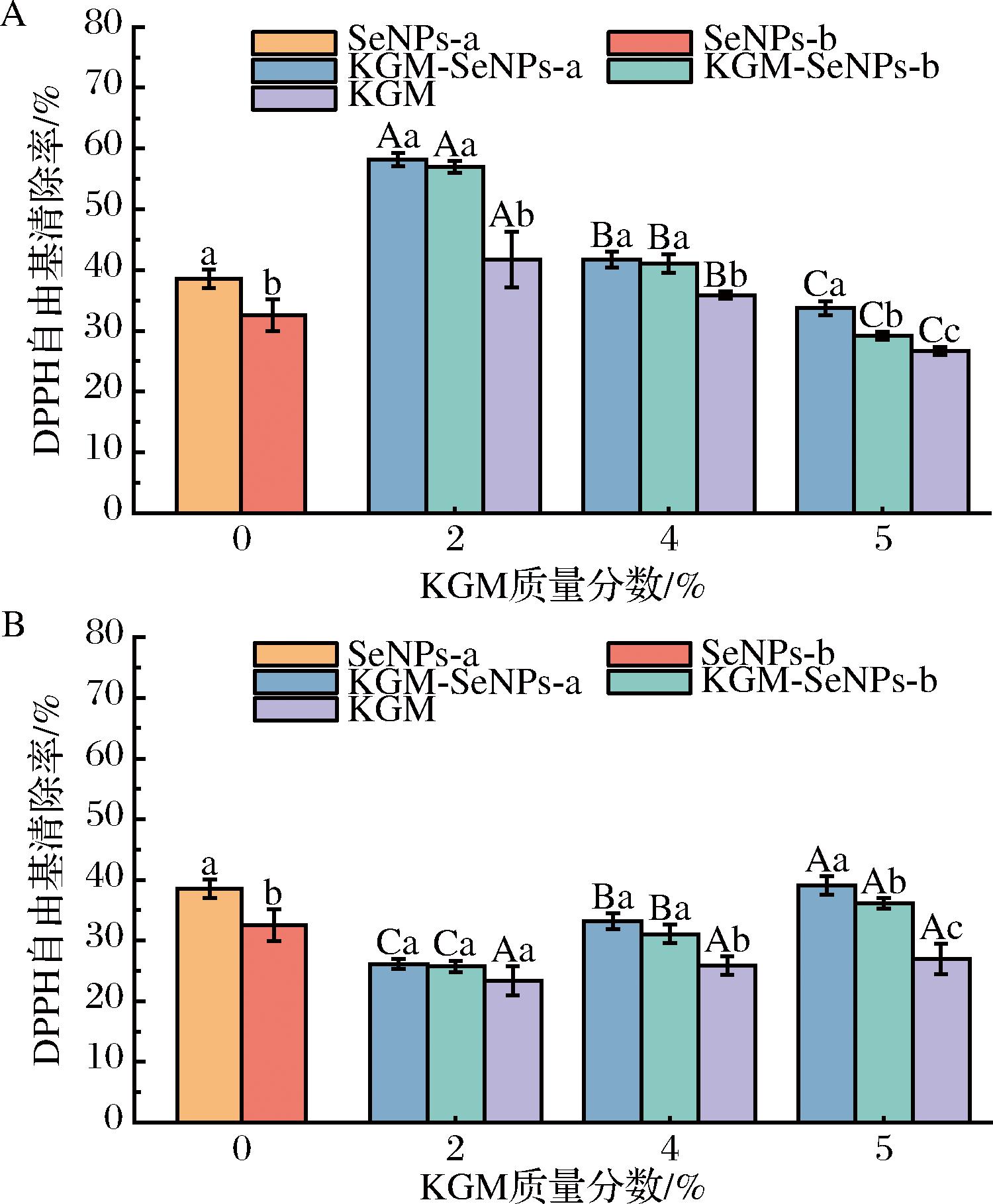
A-4 h;B-12 h
图6 不同时间的KGM-SeNPs凝胶对DPPH自由基的清除效率
Fig.6 Scavenging efficiency of DPPH free radicals by KGM-SeNPs gels at different time
2.7.2 ABTS阳离子自由基清除能力
ABTS阳离子自由基比DPPH自由基更活泼,可快速触发自由基链式反应,导致生物体内DNA、蛋白质和脂质的氧化损伤[35]。ABTS阳离子自由基清除原理是通过SeNPs向ABTS阳离子自由基提供电子,促使其还原为非自由基状态的ABTS[34]。图7表明,低硬度的KGM-SeNPs凝胶在4 h后展现出较强的ABTS阳离子自由基清除能力,其中KGM-SeNPs-a和KGM-SeNPs-b对ABTS阳离子自由基清除率可达到94.49%和93.69%。表明小粒径SeNPs在清除ABTS阳离子自由基方面更为有效。进一步研究发现,高硬度的KGM-SeNPs凝胶在12 h后的ABTS阳离子自由基清除能力强于低硬度的KGM-SeNPs凝胶。这一结果表明高硬度的KGM-SeNPs凝胶通过其缓释特性,显著提升了SeNPs的生物活性周期,优化了其在体内的利用效率。

A-4 h;B-12 h
图7 不同时间的KGM-SeNPs凝胶对ABTS阳离子自由基清除率
Fig.7 Scavenging rates of ABTS cationic radicals by KGM-SeNPs gels at different time
如图8所示,KGM-SeNPs凝胶对大肠杆菌和金黄色葡萄球菌均有一定的抗菌效果。特别值得注意的是,KGM-SeNPs凝胶对大肠杆菌有较强的抑制效果,而对于金黄色葡萄球菌的抗菌作用则相对较弱。这种差异与细菌的结构有关:大肠杆菌属于革兰氏阴性菌,而金黄色葡萄球菌则属于革兰氏阳性菌。阳性菌的肽聚糖层较厚,这会阻碍SeNPs进入细菌细胞内部,从而影响其抑菌活性[36]。此外,研究不同质构特性KGM-SeNPs凝胶的抗菌活性时,发现低硬度的KGM-SeNPs凝胶展现出更显著的抗菌效果。这是因为低硬度的KGM-SeNPs凝胶具有更快的SeNPs释放速率,会使得更多的SeNPs与细菌接触,发挥其抗菌作用。将KGM-SeNPs凝胶再次加入到新的培养基中培养4 h后,可以发现12 h后的高硬度的KGM-SeNPs凝胶仍具有较强的抗菌活性。这一现象归因于高硬度KGM-SeNPs凝胶对SeNPs的显著的缓释作用,这一作用有利于SeNPs能够在较长时间内持续稳定地释放,从而更好地维持了其抗菌活性。同时,研究还发现KGM-SeNPs-a凝胶显示出了更显著的抑菌效果。推测这一现象是由于较小粒径SeNPs更容易穿透细菌的细胞壁,从而能更有效地发挥其抗菌作用[37]。
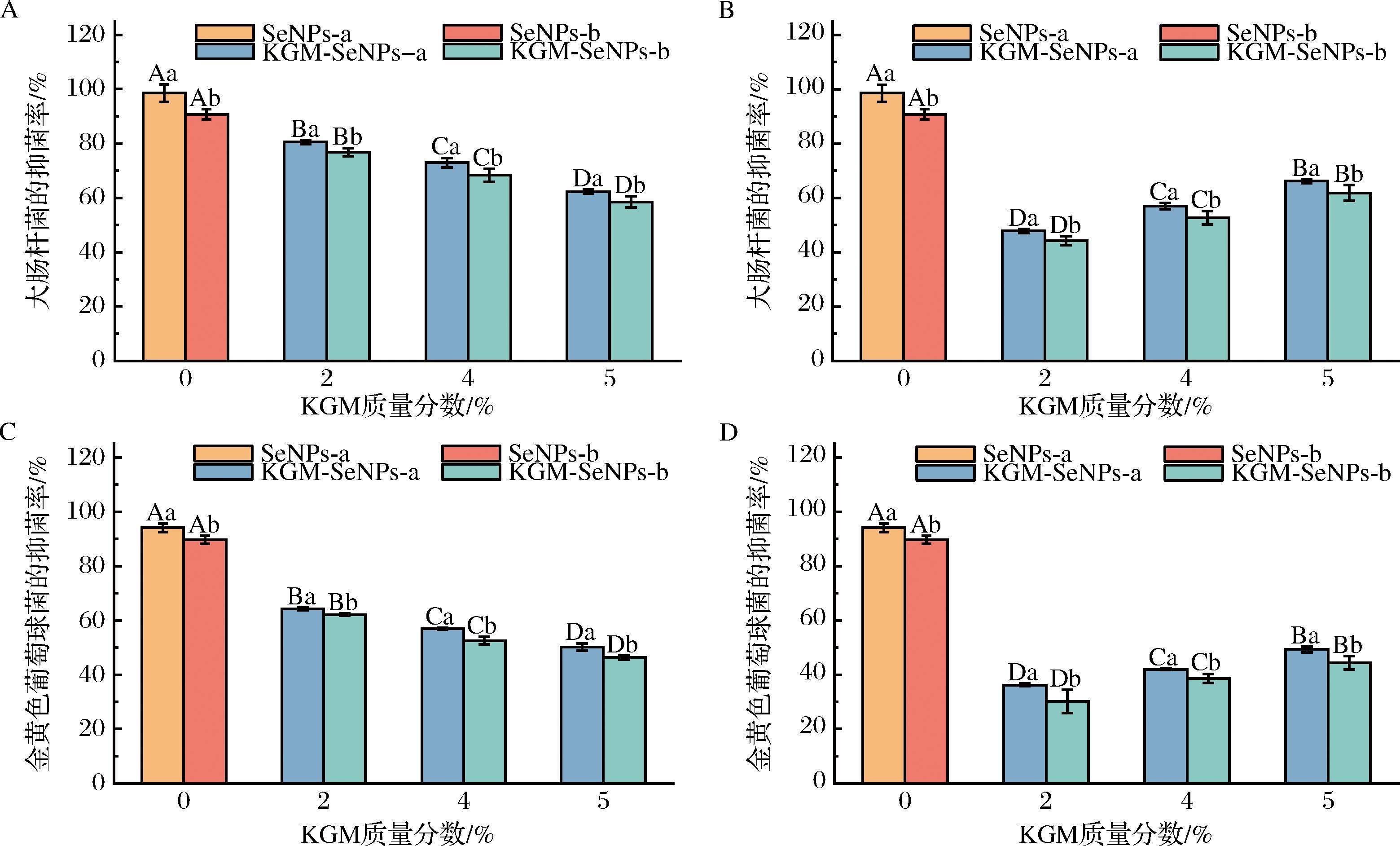
A-第1次使用凝胶对大肠杆菌的抑菌率;B-第2次使用凝胶对大肠杆菌的抑菌率;C-第1次使用凝胶对金黄色葡萄球菌的抑菌率;D-第2次使用凝胶对金黄色葡萄球菌的抑菌率
图8 不同使用次数的KGM-SeNPs凝胶的抑菌效果
Fig.8 Antibacterial effect of KGM-SeNPs gels with different times of use
2.9.1 细胞增殖抑制分析
SeNPs能够诱导癌细胞周期停滞在特定的阶段,如G1或G2/M期,从而抑制癌细胞的增殖。此外,SeNPs还能激活凋亡途径,导致癌细胞程序性死亡[38]。如图9所示,4 h后的低硬度KGM-SeNPs凝胶在抑制肿瘤细胞增殖方面表现出显著效果,肿瘤细胞24 h后的存活率仅为56.26%。12 h后的高硬度KGM-SeNPs凝胶则表现出高于低硬度的KGM-SeNPs凝胶的抑制肿瘤增殖的能力。这一现象表明,高硬度的KGM-SeNPs凝胶通过其缓释特性显著延长了SeNPs的生物活性周期,进而在抑制肿瘤细胞增殖方面实现了更为卓越的效果。在对KGM-SeNPs-a凝胶与KGM-SeNPs-b凝胶的肿瘤抑制效果进行深入对比分析后,发现KGM-SeNPs-a凝胶在抑制肿瘤细胞活性方面展现出更显著的效果。这一现象可能是由于KGM-SeNPs-a凝胶中小粒径SeNPs具有更大的比表面积,能够提供更多的活性位点与肿瘤细胞相互作用。这种尺寸效应使得小粒径SeNPs在抗肿瘤活性上更为卓越,能在抑制肿瘤细胞生长和增殖方面发挥更为关键的作用[39]。此外,实验观察到KGM-SeNPs凝胶对肿瘤细胞增殖的抑制效果在48 h后更为显著,说明随着时间的延长,KGM-SeNPs凝胶释放的SeNPs在细胞培养环境中的累积效果逐步提升,从而在更久的时间内对肿瘤细胞的生长和分裂发挥有效的抑制作用。

A-4 h;B-12 h
图9 不同时间的KGM-SeNPs凝胶对HepG2细胞存活率的影响
Fig.9 Effect of KGM-SeNPs gels at different time on the viability of HepG2 cells
2.9.2 细胞迁移能力分析
细胞划痕实验用于评估细胞迁移能力,模拟细胞在组织损伤后的修复过程[40]。图10展示了不同质构特性的KGM-SeNPs凝胶对肿瘤细胞迁移能力的影响。由图11可知,将4 h后的低硬度KGM-SeNPs凝胶样品加入到肿瘤细胞培养体系时,肿瘤细胞的迁移能力显著降低,24 h后的愈合率仅为14.9%。这一结果表明,低硬度KGM-SeNPs凝胶对肿瘤细胞迁移具有较强的抑制作用。由图11-B可知,12 h后的高硬度KGM-SeNPs凝胶样品仍具有较强的肿瘤迁移能力的抑制能力,归因于高硬度KGM-SeNPs凝胶对SeNPs具有较强的缓释作用,使其在一段时间后仍具有抑制肿瘤细胞迁移的能力。此外,研究还发现KGM-SeNPs-a凝胶展现出了更好的抑制肿瘤细胞迁移的效果,其原因可能是小粒径SeNPs具有较大的比表面积,会有更多SeNPs表面能够与肿瘤细胞接触,从而发挥出更优异的抑制效果[39]。

A-4 h;B-12 h
图10 不同时间的KGM-SeNPs凝胶对HepG2细胞迁移能力的影响
Fig.10 Effect of KGM-SeNPs gels on the migration ability of HepG2 cells at different time
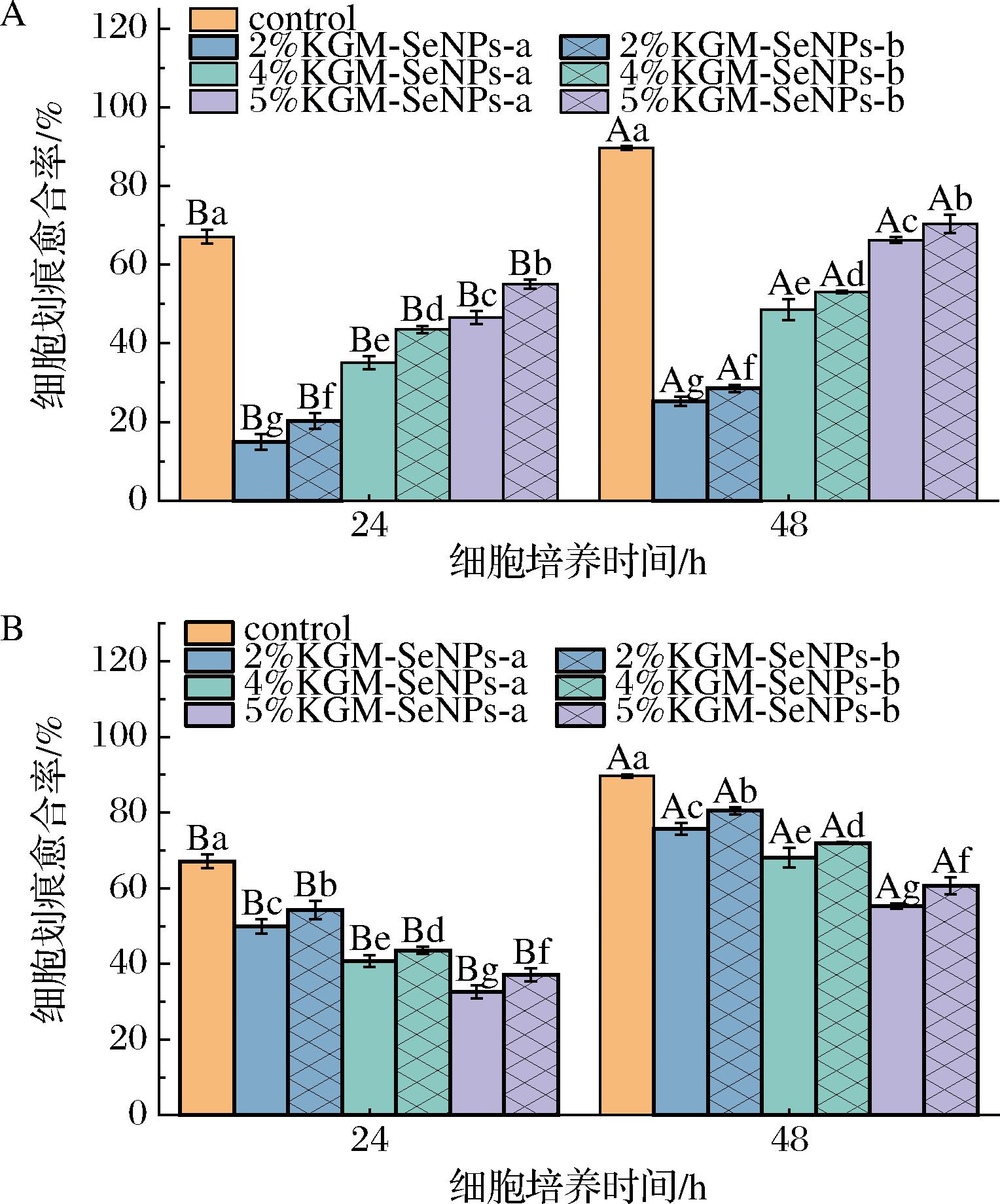
A-4 h;B-12 h
图11 不同时间的KGM-SeNPs凝胶对HepG2细胞划痕愈合率的影响
Fig.11 Effect of KGM-SeNPs gels at different time on the scratch healing rate of HepG2 cells
本研究分析了KGM凝胶与SeNPs之间的相互作用,发现KGM凝胶的质构特性在调控SeNPs的功能特性方面起到了关键作用。研究结果表明,高硬度的KGM-SeNPs凝胶能有效降低SeNPs的体外释放速率,实现较好的缓释效果,这对于提高SeNPs的生物利用率和延长其作用时间具有重要意义。在生物活性方面,12 h后的高硬度KGM-SeNPs凝胶展现出强于低硬度KGM-SeNPs凝胶的抗氧化能力和持久的抗菌性能,尤其在抑制大肠杆菌方面效果显著,抑制率达到66.2%。此外,12 h后的高硬度KGM-SeNPs凝胶在抗肿瘤活性方面也表现突出,仍能够有效抑制肿瘤细胞的增殖和迁移能力。特别地,含有小粒径SeNPs的KGM-SeNPs-a凝胶在抗肿瘤活性方面表现更为优异。这些发现为开发安全性更高、生物利用率更优的新型硒营养补充剂提供了理论支持,同时为功能性食品包装材料、生物医药敷料以及生物活性材料的开发提供了新的方向,有助于实现这些材料的安全高效应用。
[1] 石文娟, 苗丽坤, 孙炜炜, 等. 魔芋葡甘聚糖基热可逆凝胶研究进展[J]. 中国食品学报, 2022, 22(5):422-433.SHI W J, MIAO L K, SUN W W, et al. Research progress on the konjac glucomannan-based thermoreversible gels[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(5):422-433.
[2] LIU Z J, REN X, CHENG Y Q, et al. Gelation mechanism of alkali induced heat-set konjac glucomannan gel[J]. Trends in Food Science &Technology, 2021, 116:244-254.
[3] XU C F, CHENG K X, KANG Y, et al. Deacetylated konjac glucomannan with a slower hydration rate delays rice digestion and weakens appetite response[J]. Molecules, 2024, 29(7):1681.
[4] ZHANG Y T, TONG C L, CHEN Y Y, et al. Advances in the construction and application of konjac glucomannan-based delivery systems[J]. International Journal of Biological Macromolecules, 2024, 262(Pt 1):129940.
[5] YANG X, LI A Q, LI D, et al. Applications of mixed polysaccharide-protein systems in fabricating multi-structures of binary food gels: A review[J]. Trends in Food Science &Technology, 2021, 109:197-210.
[6] 李佳芮, 李江华, 蔡超, 等. 基于海洋多糖水凝胶的组织工程材料研究应用进展[J]. 中国海洋药物, 2021, 40(1):79-89.LI J R, LI J H, CAI C, et al. Advances in the research and application of tissue engineering scaffolds based on marine polysaccharide hydrogels[J]. Chinese Journal of Marine Drugs, 2021, 40(1):79-89.
[7] MANZOOR A, DAR A H, PANDEY V K, et al. Recent insights into polysaccharide-based hydrogels and their potential applications in food sector: A review[J]. International Journal of Biological Macromolecules, 2022, 213:987-1006.
[8] KALTSAS A. Oxidative stress and male infertility: The protective role of antioxidants[J]. Medicina, 2023, 59(10):1769.
[9] UMAPATHY S, PAN I, ISSAC P K, et al. Selenium nanoparticles as neuroprotective agents: Insights into molecular mechanisms for Parkinson’s disease treatment[J]. Molecular Neurobiology, 2025, 62(6):6655-6682.
[10] PETERS K M, GALINN S E, TSUJI P A. Selenium: Dietary Sources, Human Nutritional Requirements and Intake Across Populations[M]. Selenium. Cham: Springer International Publishing, 2016:295-305.
[11] ZHANG T, QI M, WU Q, et al. Recent research progress on the synthesis and biological effects of selenium nanoparticles[J]. Frontiers in Nutrition, 2023, 10:1183487.
[12] ![]() I, et al. Selenium nanoparticles as potential drug-delivery systems for the treatment of Parkinson’s disease[J]. ACS Applied Nano Materials, 2023, 6(19):17581-17592.
I, et al. Selenium nanoparticles as potential drug-delivery systems for the treatment of Parkinson’s disease[J]. ACS Applied Nano Materials, 2023, 6(19):17581-17592.
[13] PURI A, MOHITE P, ANSARI Y, et al. Plant-derived selenium nanoparticles: Investigating unique morphologies, enhancing therapeutic uses, and leading the way in tailored medical treatments[J]. Materials Advances, 2024, 5(9):3602-3628.
[14] CHEN W W, CHENG H, XIA W S. Progress in the surface functionalization of selenium nanoparticles and their potential application in cancer therapy[J]. Antioxidants, 2022, 11(10):1965.
[15] XU X D, PAN Y X, LIU X Y, et al. Constructing selenium nanoparticles with enhanced storage stability and antioxidant activities via conformational transition of curdlan[J]. Foods, 2023, 12(3):563.
[16] SELMANI A, ![]() N M, FALSONE S F, et al. Simulated gastrointestinal fluids impact the stability of polymer-functionalized selenium nanoparticles: Physicochemical aspects[J]. International Journal of Nanomedicine, 2024, 19:13485-13505.
N M, FALSONE S F, et al. Simulated gastrointestinal fluids impact the stability of polymer-functionalized selenium nanoparticles: Physicochemical aspects[J]. International Journal of Nanomedicine, 2024, 19:13485-13505.
[17] GAD H A, ALSHUBAILY F A, ALSIENI M A, et al. Biosynthesis of nano-curcumin/nano-selenium composite and their potentialities as bactericides against fish-borne pathogens[J]. Green Processing and Synthesis, 2022, 11(1):1098-1107.
[18] 徐颖, 康佳敏, 魏宁果. 多糖-纳米硒复合物的合成方法、稳定性及生物活性研究进展[J]. 食品安全质量检测学报, 2023, 14(8):119-127.XU Y, KANG J M, WEI N G. Research progress on the synthesis method, stability and biological activity of polysaccharide-nano-selenium complex[J]. Journal of Food Safety &Quality, 2023, 14(8):119-127.
[19] 吴玲莹. 负载纳米硒的温敏壳聚糖水凝胶黏膜下注射液的制备及表征[D]. 杭州:浙江理工大学, 2022.WU L Y. Preparation and Characterization of Submucosal Injection of Temperature-Sensitive Chitosan Hydrogel Loaded with Nano-Selenium[D]. Hangzhou: Zhejiang Sci-Tech University, 2022.
[20] TRESPALACIOS P, PLA R. Synergistic action of transglutaminase and high pressure on chicken meat and egg gels in absence of phosphates[J]. Food Chemistry, 2007, 104(4):1718-1727.
[21] 李晶. 冷冻影响脱乙酰魔芋葡甘聚糖凝胶的机制与应用[D]. 武汉:华中农业大学, 2014.LI J. Mechanism and application of freezing effect on deacetylkonjac glucomannan gel[D]. Wuhan:Huazhong Agricultural University, 2014.
[22] DAO L P, CHEN S Y, SUN X Y, et al. Construction and sustained release of konjac glucomannan/naringin composite gel spheres[J]. Frontiers in Nutrition, 2023, 9:1123494.
[23] KHIN M N, GOFF H D, NSOR-ATINDANA J, et al. Effect of texture and structure of polysaccharide hydrogels containing maltose on release and hydrolysis of maltose during digestion: in vitro study[J]. Food Hydrocolloids, 2021, 112:106326.
[24] 李爽, 刘小芳, 冷凯良, 等. 大西洋鳕鱼骨胶原蛋白肽的抗氧化活性及稳定性研究[J]. 食品与发酵工业, 2024, 50(16):50-56.LI S, LIU X F, LENG K L, et al. Antioxidant activity and stability of collagen peptides from Atlantic cod (Gadus morhua) bone[J]. Food and Fermentation Industries, 2024, 50(16):50-56.
[25] 刘丽莉, 陈卉, 郭净芳, 等. 儿茶素-糖基化猪血红蛋白对肉糜品质的影响及抑菌作用[J]. 食品与发酵工业, 2024, 50(21):224-231.LIU L L, CHEN H, GUO J F, et al. The effect of catechin glycosylated porcine hemoglobin on the quality of meat flour and its antibacterial effect[J]. Food and Fermentation Industries, 2024, 50(21):224-231.
[26] DENG L, XIA T T, CHENG W Q, et al. Injectable redox albumin-based hydrogel with in situ loaded dihydromyricetin[J]. Colloids and Surfaces B: Biointerfaces, 2022, 220:112871.
[27] GRADA A, OTERO-VINAS M, PRIETO-CASTRILLO F, et al. Research techniques made simple: Analysis of collective cell migration using the wound healing assay[J]. Journal of Investigative Dermatology, 2017, 137(2): e11-e16.
[28] 安玥琦. 鱼糜凝胶的交联结构对风味释放的影响与机制[D]. 武汉:华中农业大学, 2023.AN Y Q. Effect and mechanism of cross-linking structure of surimi gel on flavor release[D]. Wuhan:Huazhong Agricultural University, 2023.
[29] GRENIER J, DUVAL H, BAROU F, et al. Mechanisms of pore formation in hydrogel scaffolds textured by freeze-drying[J]. Acta Biomaterialia, 2019, 94:195-203.
[30] YE S X, ZHU J S, SHAH B R, et al. Preparation and characterization of konjac glucomannan (KGM) and deacetylated KGM (Da-KGM) obtained by sonication[J]. Journal of the Science of Food and Agriculture, 2022, 102(10):4333-4344.
[31] SONG J Y, ZHOU J J, LI X, et al. Nano-selenium stablilized by Konjac Glucommannan and its biological activity in vitro[J]. LWT, 2022, 161:113289.
[32] 郭英凯, 赵燕禹, 王韬, 等. 纳米硒粉的制备及表征[J]. 天津工业大学学报, 2013, 32(6):45-48.GUO Y K, ZHAO Y Y, WANG T, et al. Preparation and characterization of selenium nanoparticles[J]. Journal of Tianjin Polytechnic University, 2013, 32(6):45-48.
[33] 肖小年, 王凡, 周洁, 等. 甜菊糖苷改善根皮素溶解性及体外释放的研究[J]. 中国食品学报, 2021, 21(3):11-21.XIAO X N, WANG F, ZHOU J, et al. Improving of solubilization and in vitro release enhancement of phloretin by steviol glycosides[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(3):11-21.
[34] RAZZAQ H, SAIRA F, YAQUB A, et al. Interaction of gold nanoparticles with free radicals and their role in enhancing the scavenging activity of ascorbic acid[J]. Journal of Photochemistry and Photobiology B: Biology, 2016, 161:266-272.
[35] PU S, LI J, SUN L J, et al. An in vitro comparison of the antioxidant activities of chitosan and green synthesized gold nanoparticles[J]. Carbohydrate Polymers, 2019, 211:161-172.
[36] 王丽红, 杨辉, 苏文, 等. 植物乳杆菌LP21绿色合成纳米硒及对溶藻弧菌的抑菌活性[J]. 食品科学, 2022, 43(2):217-223.WANG L H, YANG H, SU W, et al. Biosynthesis of nano-selenium by Lactobacillus plantarum LP21 and its antibacterial activity against Vibrio alginolyticus[J]. Food Science, 2022, 43(2):217-223.
[37] ADIBIAN F, GHADERI R S, SABOURI Z, et al. Green synthesis of selenium nanoparticles using Rosmarinus officinalis and investigated their antimicrobial activity[J]. BioMetals, 2022, 35(1):147-158.
[38] 王珍珍, 任奕梦, 罗之林, 等. 纳米硒的靶向递送及抗癌机制研究进展[J]. 沈阳药科大学学报, 2022, 39(1):105-113.WANG Z Z, REN Y M, LUO Z L, et al. Research progress on targeted delivery of selenium nanoparticles and anti-cancer mechanism[J]. Journal of Shenyang Pharmaceutical University, 2022, 39(1):105-113.
[39] ADAM-DIMA E I, BALAS M, ANASTASESCU M, et al. Synthesis of homogeneous spherical selenium nanoparticles through a chemical method for cancer therapy applications[J]. Toxicology in Vitro, 2024, 95:105765.
[40] 韩晖琼, 王磊, 秦艳茹. Ovol2对食管鳞癌细胞增殖、迁移能力的影响和机制研究[J]. 海南医学, 2024, 35(15):2129-2134.HAN H Q, WANG L, QIN Y R. Effect of Ovol2 on the proliferation and migration of esophageal squamous cell carcinoma cells and its related mechanism[J]. Hainan Medical Journal, 2024, 35(15):2129-2134.