LIU Yijia,YANG Tao,FU Zhixuan, et al.Stability of epigallocatechin gallate-bovine serum albumin-high-esterified pectin Pickering emulsion[J].Food and Fermentation Industries,2025,51(14):265-272.
Pickering乳液是由固体颗粒依靠自身的表面湿润性,不可逆地吸附在油水界面形成的乳液,具有稳定性高、毒性低和粒径可控性等优势,在食品,制药和化妆等领域广泛应用[1]。目前关于制备Pickering乳液,主要材料有无机颗粒(如二氧化硅,氧化钛,氧化锌)以及生物来源的有机颗粒。相较于无机颗粒[2],生物材料颗粒更加安全且具有可持续性,因而在食品和药物输送体系上应用前景广阔[3]。食品级生物聚合物及其复合物(如蛋白质-多糖、蛋白质-多酚)被用于稳定Pickering乳液,具有界面柔性和优异的功能特性。蛋白质、多酚、多糖自组装的非共价三元复合物是新型软物质,具备独特结构与功能[4]。
在天然蛋白质基生物聚合物颗粒中,牛血清白蛋白(bovine serum albumin, BSA)作为纳米颗粒载体已逐渐受到重视。与其他蛋白质(如大豆蛋白、卵清蛋白、β-酪蛋白和β-乳球蛋白)相比,BSA具有更高的表面活性,使其在食品工业中得到了广泛应用[5]。如CHEN等[6]报道的茶多糖偶联物和BSA均具有乳化特性,但单独使用时存在一定的不足。高酯果胶(high-methoxyl pectin, HEP)是一种部分甲酯化的多聚糖,果胶分子中同时含有亲水基团和疏水基团,能减少油水界面的表面张力,可作为应用于靶向递送的乳液的乳化剂。此外,HEP可以增强空间位阻提高蛋白质分散体系的稳定性,吸附到两相界面上提高乳液的物理稳定性,并且在减缓奥氏熟化方面发挥重要作用[7]。因此,由蛋白质颗粒与果胶协同稳定Pickering乳液具有开发前景。
表没食子儿茶素没食子酸酯[(-)-epigallocatechin-3-gallate, EGCG]是绿茶中含量最高的儿茶素类,具有强抗氧化、抗炎及抗癌等活性[8]。在食品基质中,多酚能与蛋白质发生相互作用,改变蛋白质的结构和功能特性,如乳化、发泡等性能[9]。近年来,关于蛋白质、多酚和多糖复合物对Pickering乳液构建的研究逐渐增多。例如,可利用豌豆蛋白-果胶-EGCG复合物稳定Pickering乳液进行风味物质包埋[10];EGCG可显著提高木胸肌原纤维蛋白(wooden breast myofibrillar protein, WBMP)乳液的稳定性,但较低和较高的EGCG浓度在改善乳液质量和氧化稳定性方面表现出缺点(如抗氧化能力弱或蛋白质过度聚集)[11]。通过乳铁蛋白、EGCG、HMP和β-环状糊精形成四元复合物的高内相Pickering乳液,在凝固型酸奶方面有较好的开发价值和应用前景[12]。尽管已有多项研究,但涉及EGCG、白蛋白和果胶形成三元复合物稳定Pickering乳液的研究较为有限,且EGCG不同水平对其三元复合物乳液的影响还不清楚。
因此,本研究首先利用BSA、EGCG和HEP形成三元复合物来构建Pickering乳液,然后探究不同EGCG浓度对制备乳液的粒径、Zeta电位、流变性质的影响,最后通过探究乳液离心稳定性、热稳定性和离子稳定性来分析不同EGCG水平对乳液稳定性的影响。本研究旨在寻找构建多元Pickering乳液的最适EGCG浓度,从而为封装功能活性成分和保护脂质氧化提供新途径。
牛血清白蛋白(纯度96%),上海麦克林生化科技股份有限公司;EGCG(纯度98%),湖南艾嘉生物科技有限公司;高酯果胶(纯度98%,酯化度65%),上海仟味实业有限公司;低芥酸菜籽油(食品级),上海日清油脂有限公司;PBS磷酸盐缓冲液(pH 6.8,0.01 mol/L),北京雷根生物技术有限公司;氯化钠(纯度99.5%),国药基团化学试剂有限公司。
YP102B 电子天平,上海浦春计量仪器有限公司;ESJ120-4B电子分析天平,沈阳龙腾电子有限公司;JB-13磁力搅拌器,上海欧史拓尔实业有限公司;T10 basic ULTRA-TURRAX®匀浆机,广州艾卡仪器设备有限公司;HH-11-1电热恒温水浴锅,上海蚁霖科学仪器有限公司;TGL16M台式高速冷冻离心机,长沙英泰仪器有限公司;CX31光学显微镜,奥林巴斯(中国)有限公司;MASTERSIZER 3000激光粒度仪、ZETASIZER NANO ZS纳米粒度仪、Kinexus pro+旋转流变仪,英国马尔文帕纳科有限公司。
1.3.1 BSA-HEP-EGCG三元复合物的制备
参照CHEN等[13]的方法并稍作修改,BSA水溶液是通过在室温下将BSA(20 mg/mL)溶解在磷酸盐缓冲液(PBS,0.01 mol/L,pH=7.0)中制备。为了确保充分的水合作用,将蛋白质溶液搅拌2 h,然后在4 ℃下放置过夜。将EGCG粉末(5、10、15、20、25 mg/mL)和HEP(40 mg/mL)溶解于磷酸盐缓冲液中,形成EGCG、HEP母液。将BSA、EGCG和HEP按照1∶1∶1的质量比充分混合,形成三元复合物储备液。
1.3.2 不同EGCG浓度三元复合物Pickering乳液的制备
参照1.3.1节配制三元复合物Pickering乳液制备步骤,将不同EGCG浓度梯度的BSA-EGCG-HEP复合物溶液作为水相,与菜籽油以2∶8的质量比在匀浆机下以10 000 r/min高速剪切的条件下均质2 min制得高内相乳液。
1.3.3 Pickering乳液性质表征
1.3.3.1 粒径D4,3的测定
在25 ℃下,使用激光粒度仪测定Pickering乳液粒径。
1.3.3.2 Zeta电位的测定
使用纳米粒度仪测定Pickering乳液,在25 ℃下测定样品的Zeta电位,稀释样品以尽量减少多重散射效应。
1.3.3.3 Pickering乳液微观结构观察
利用光学显微镜,在40倍物镜观察乳液微观形态,并且对乳液图像拍照观察。
1.3.3.4 流变性质的表征
参照谢丽清[12]的方法并稍作修改,使用旋转流变仪并选取直径40 mm的平板,在25 ℃下对Pickering的流变特性进行表征。首先,以频率为1 Hz在0.01%~100%进行应变扫描。其次,在频率0.1~10 Hz以0.5%的应变进行频率扫描,记录并分析储能模量(G′)和损耗模量(G″)随频率变化的曲线。最后,以0.5%的应变在剪切速率0.1~100 s-1测定样品的表观黏度变化。
1.3.4 Pickering乳液稳定性
1.3.4.1 离心稳定性
用持水能力(water holding capacity, WHC)评价乳液的离心稳定性。乳液在4 ℃下以4 000×g的速度离心15 min,分别称重上部油相、中部乳状液和下部水相的质量。WHC的计算如公式(1)所示:
(1)
式中:WT,每个样品的总水质量;WF,离心后释放的水质量。
1.3.4.2 贮藏稳定性
取新制备的乳液各10 mL于离心管中,在25 ℃和4 ℃下静置15 d和30 d,定期观察乳液外观,并测量粒径和Zeta电位。
1.3.4.3 热稳定性
取新制备的乳液在80 ℃的恒温水浴锅中加热0.5 h后取出,观察乳液外观,测量粒径。
1.3.4.4 离子稳定性
使用2 mol/L NaCl原液,配制不同NaCl浓度(100、200、300 mmol/L)的蛋白溶液(2%,质量分数),形成乳液,并测定其粒径和Zeta电位。
所有数据均用“平均值±标准差”表示。用Excel 2019统计数据和Origin 2021绘制图形,所有实验重复3次。采用SPSS 22.0进行单因素方差分析和Duncan检验分析样本之间的差异。当P<0.05时表示样品之间在统计学意义上具有显著性差异。
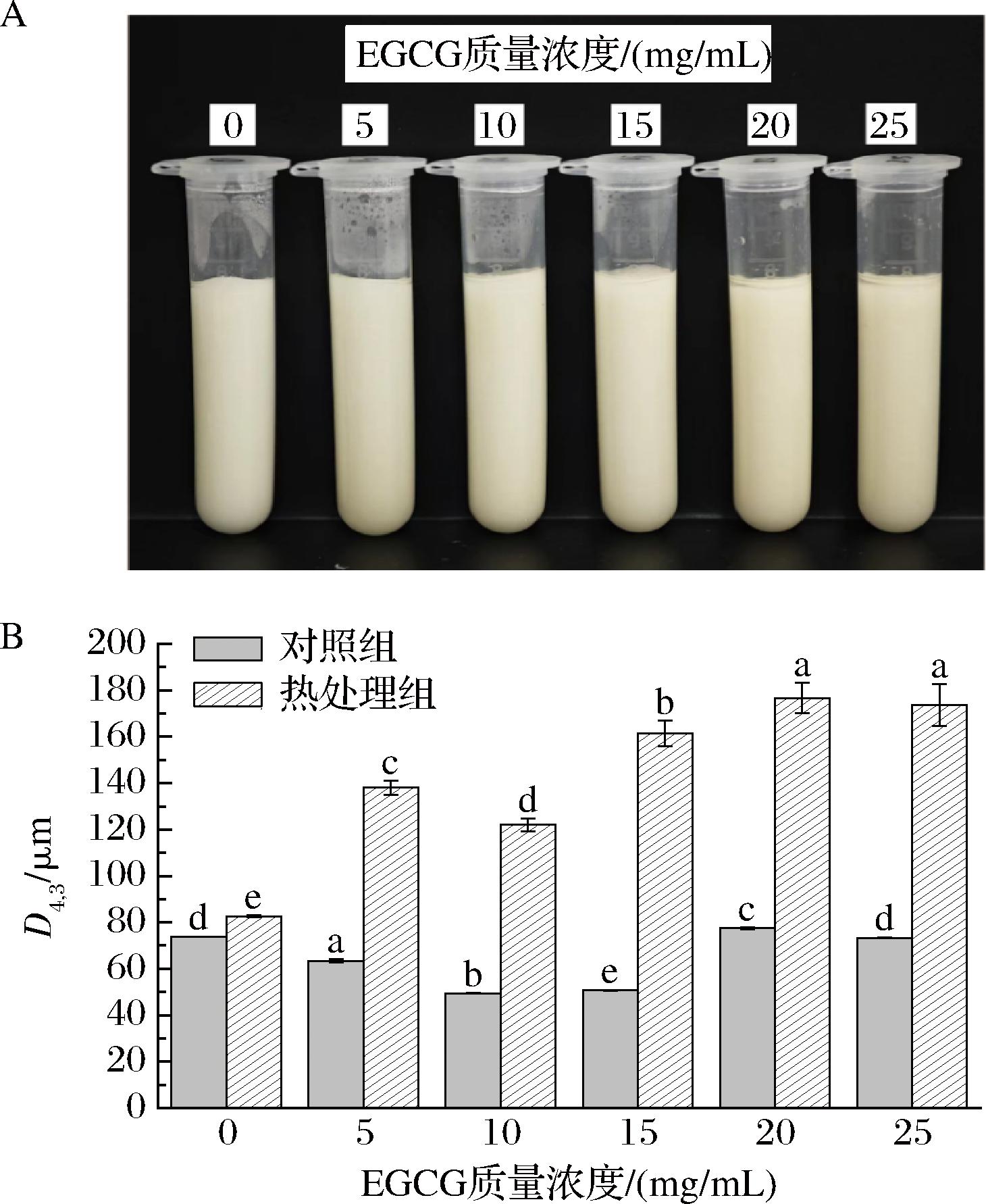
不同浓度EGCG的Pickering乳液外观和微观结构,如图1-A所示。BSA-EGCG-HEP三元复合物构建的Pickering乳液较为黏稠,且没有油层和水相析出,体系稳定。光学显微镜结果表明,所有乳滴呈现球型结构,且发现在10 mg/mL时乳滴最小。不同浓度EGCG对复合乳液粒径D4,3的影响见图1-B。BSA-EGCG-HEP复合物形成的乳液具有更致密的网络结构,粒径较小,乳液稳定性更高,这是由于BSA和EGCG的结合会减少乳液粒径[4]。随着EGCG质量浓度从5 mg/mL增至10 mg/mL,乳液粒径显著减小至49.4 μm。这是因为适量的EGCG能够改善复合物的部分湿润性,使三元复合物颗粒更加紧密地吸附在油滴表面,有助于稳定乳液体系[10]。当EGCG质量浓度超过10 mg/mL时,粒径呈增大趋势,这是由于过量的EGCG会通过非共价作用过多地结合到BSA和HEP表面,导致BSA-EGCG复合物或HEP-EGCG复合物结构松散并产生聚集现象,结果表现为粒径增加。

A-乳液微观形态;B-粒径;C-Zeta电位
图1 不同EGCG质量浓度构建的Pickering乳液微观形态、粒径和Zeta电位
Fig.1 Micromorphology, particle size and Zeta potential of Pickering emulsions constructed with different EGCG mass concentrations
注:图中不同小写字母代表差异显著(P<0.05)(下同)。
对不同EGCG浓度的复合乳液进行电位分析,如图1-C所示,仅EGCG质量浓度为5 mg/mL的电位绝对值42.73 mV和质量浓度为10 mg/mL电位绝对值36.23 mV存在显著性变化(P<0.05),其余浓度乳液无显著变化。Zeta电位的增大意味着更强的分子间斥力,液滴絮凝的可能性降低,从而提高乳液的稳定性。
流变特性分析显示了不同EGCG浓度对三元复合物Pickering乳液的应变扫描、频率扫描和黏度-剪切速率的影响,结果如图2所示。Pickering乳液的G′均大于G″,表明所有样品均以弹性为主。随着EGCG的质量浓度从0 mg/mL增加到10 mg/mL时,G′和G″均增加,可能EGCG的氢键位点较多,能够和BSA稳定结合,使得结构更加紧密[14]。当质量浓度从15 mg/mL增至25 mg/mL时,G′和G″趋于减小,这可能是高浓度的EGCG引入BSA溶液中,复合物从软凝胶相到刚凝胶相的相变,结构不再稳定,最终发生相分离,可能类似于EGCG与大豆蛋白淀粉原纤维的结合[15]。同时随着应力增大,未加EGCG的样品最先出现凝胶-溶胶的转变点,此时G″>G′,以溶胶状行为为主,加入EGCG组的平衡点往右移动,这表明EGCG浓度对Pickering乳液的稳定性发挥重要作用。
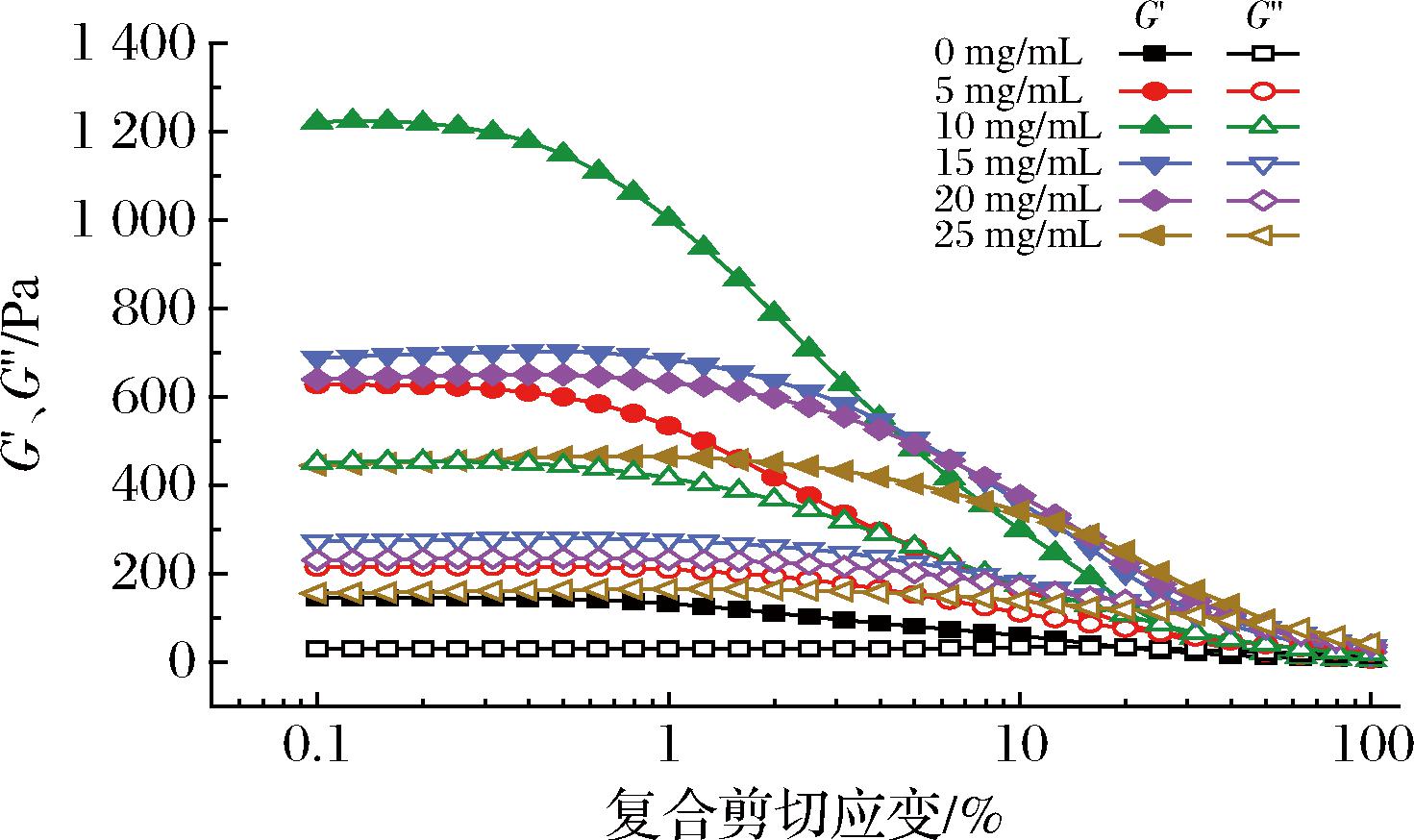
图2 不同EGCG质量浓度构建的Pickering乳液应变扫描曲线
Fig.2 Strain sweep curves of Pickering emulsion constructed with different EGCG mass concentrations
不同EGCG浓度构建的Pickering乳液频率扫描结果见图3。在整个频率范围内,所有浓度的乳液均是G′大于G″,且呈现明显的频率依赖性,表明颗粒在界面处有效吸附形成弹性凝胶状网络结构,较高的弹性表示乳液液滴是由密集的网络结构的狭小空间所包埋,不容易发生形变,稳定性较佳[16]。随着EGCG浓度升高,G′和G″呈现先上升后下降趋势,当质量浓度达到10 mg/mL时达到峰值,此时乳液的弹性和黏性最强,形成的凝胶网络结构更紧密,稳定性最佳。
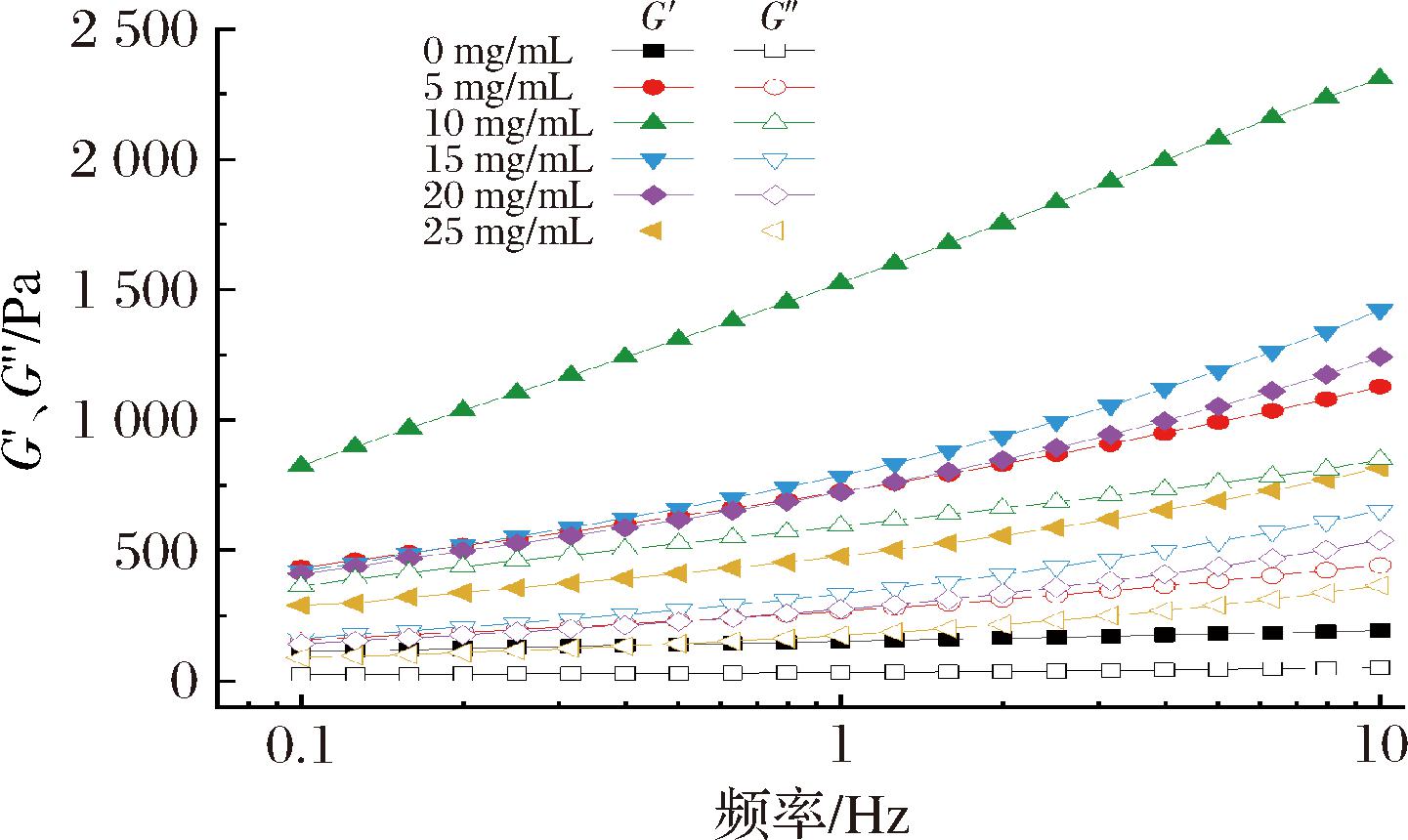
图3 不同EGCG质量浓度构建的Pickering乳液频率扫描曲线
Fig.3 Frequency sweep curves of Pickering emulsion constructed with different EGCG mass concentrations
对不同浓度EGCG构建的Pickering乳液的剪切黏度结果如图4所示,乳液的表观黏度随着剪切速率的增加而降低,这表明所有乳液都表现出假塑性行为和剪切稀化特性[17]。乳液剪切稀化行为可以归因于乳液液滴间较弱吸引力,导致乳液的网络结构不稳定[18]。随着EGCG浓度的升高,液滴间形成了堆积紧密牢固的网络结构[17],乳液表观黏度有所上升,因此适量提高EGCG的浓度利于BSA-EGCG-HEP复合物稳定HIPPEs凝胶强度并增强乳液表观黏度,减少水滴的沉降和聚集,形成稳定的Pickering乳液。
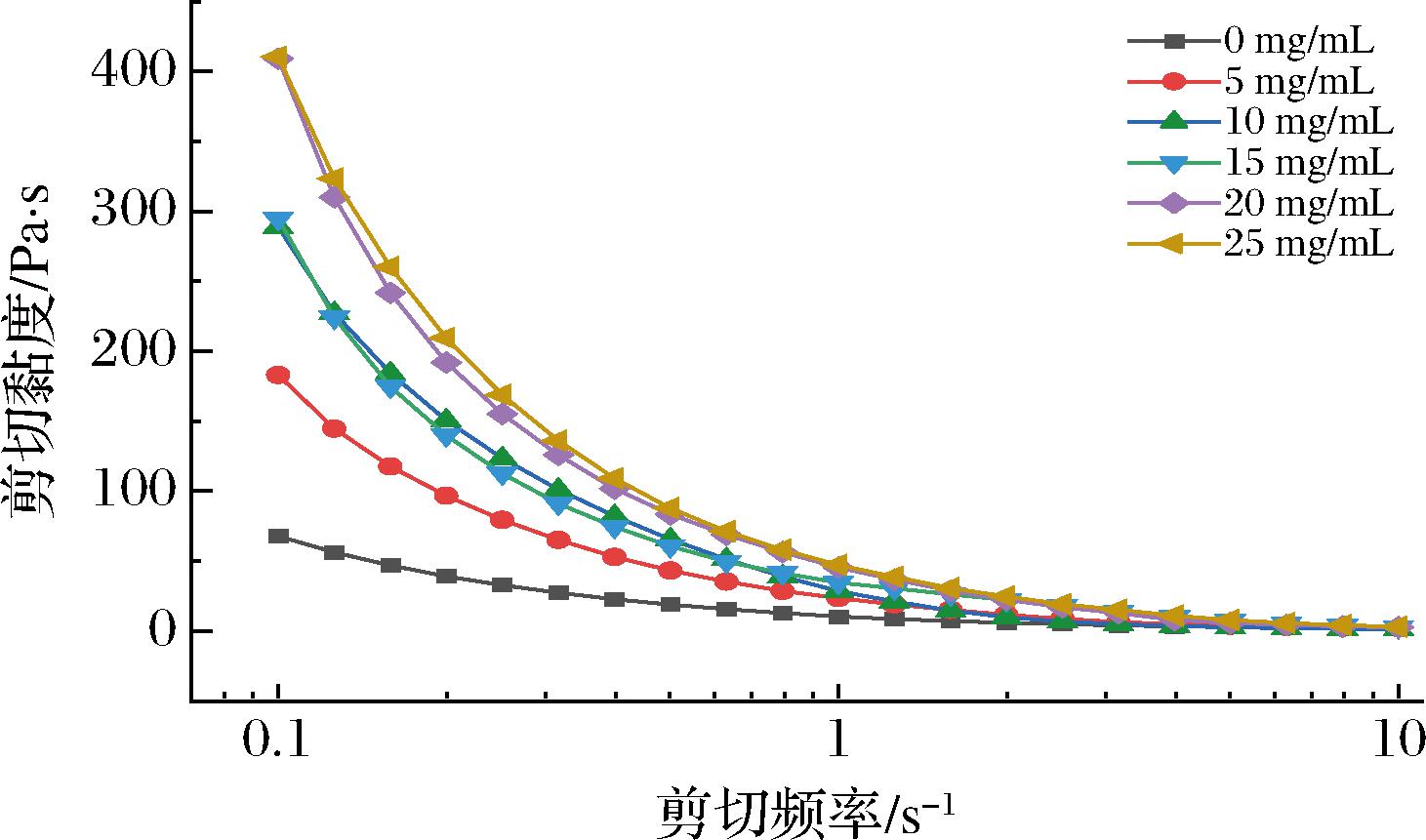
图4 不同EGCG质量浓度构建的Pickering乳液的表观黏度随剪切速率的变化曲线
Fig.4 Apparent viscosity versus shear rate curves of Pickering emulsion constructed with different EGCG mass concentrations
研究表明离心稳定性可用于加速评估乳液的长期稳定性[19]。如图6-A所示,随着EGCG浓度的增加,乳析现象逐渐减弱,稳定性增加。如图6-B所示,EGCG质量浓度为5 mg/mL的WHC(34.29%)和质量浓度为10 mg/mL的WHC(57.86%)显著高于对照组(28.57%)(P<0.05),由于Pickering乳液的WHC与复合物颗粒形成的凝胶网络结构和强度密切相关,所以适当浓度的EGCG能够改善乳液离心稳定性,使其能够抵抗离心引力。
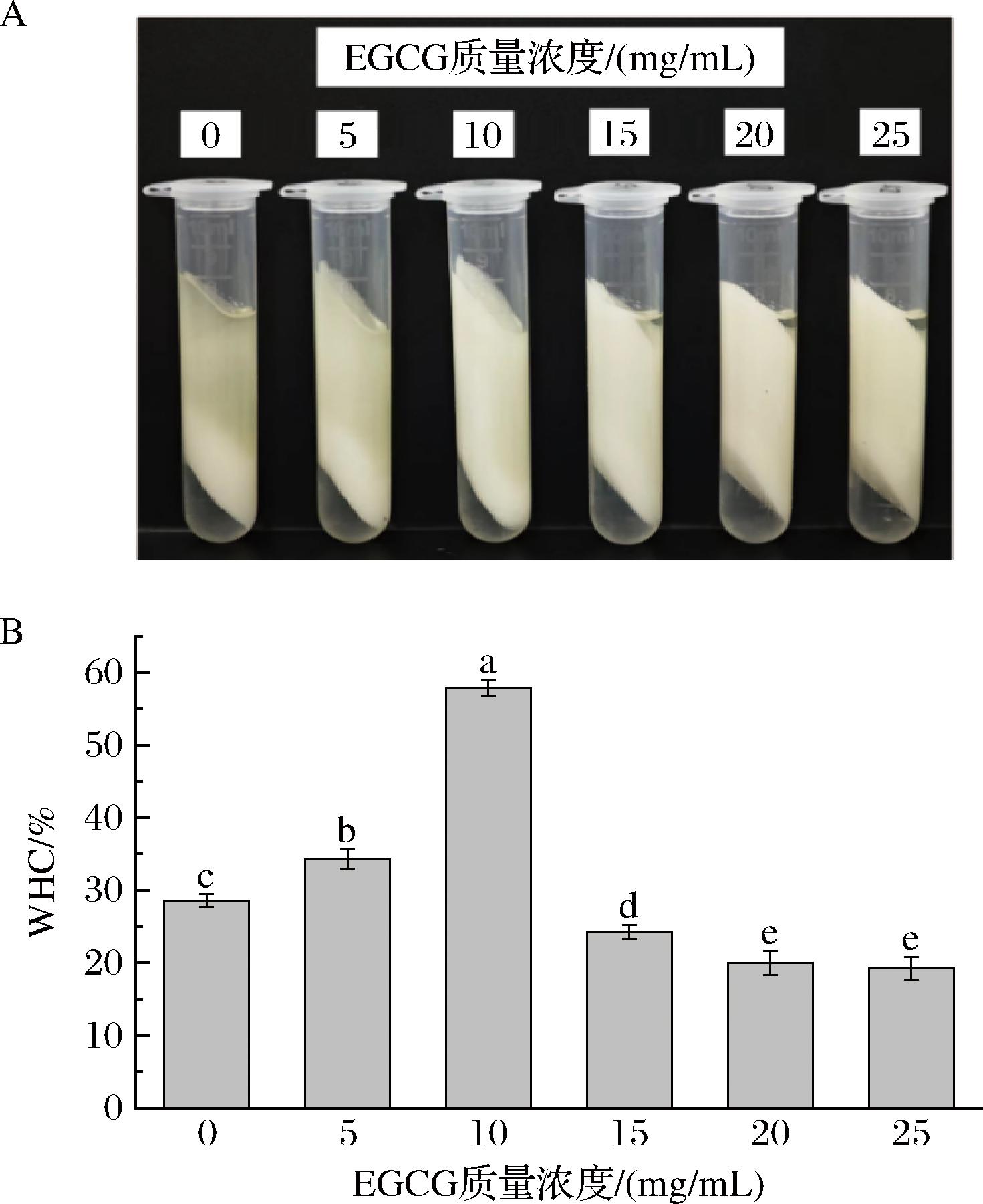
A-Pickering乳液离心后状态;B-持水能力
图5 不同EGCG质量浓度的Pickering乳液离心后的状态和持水能力
Fig.5 Pickering emulsion after centrifugation and water-holding capacity at different EGCG mass concentrations

A-外观;B-粒径;C-Zeta电位
图6 不同EGCG质量浓度的Pickering乳液25 ℃不同贮藏时间的外观、粒径和Zeta电位
Fig.6 Appearance, particle size and Zeta potential of Pickering emulsions stored at 25 ℃ for different days at different EGCG mass concentrations
贮藏稳定性是衡量乳液在食品工业中应用的重要指标。不同EGCG浓度构建的Pickering乳液在25 ℃下贮藏0、15、30 d乳液外观如图6-A所示,相较于BSA-HEP稳定的乳液,在贮藏15和30 d条件下,由BSA-EGCG-HEP稳定的乳液样品色泽有所加深,但未观察到明显析油,说明此三元复合物构建的Pickering乳液结构较稳定。常温贮藏0、15、30 d的乳液平均粒径和Zeta电位如图6-B和图6-C所示,和新鲜制备的乳液相比,贮藏15和30 d后的乳液粒径增大,Zeta电位的绝对值显著减小(P<0.05),这可能由于液滴聚结所致。添加了EGCG的乳液经过15和30 d后,粒径显著高于未添加组。特别是EGCG质量浓度为10 mg/mL的乳液,在15和30 d的贮藏中,粒径变化较小,稳定性最佳。
不同EGCG浓度构建的Pickering乳液在冷藏0、15、30 d,如图7-A所示,乳液外观的颜色无显著变化,无乳析现象,表现出良好的冷藏温定性。乳液的粒径(图7-B)分析中,发现乳液在冷藏15和30 d后粒径变化较小,这可能是是因为在低温条件下,乳液液滴间的热运动减少,液滴间的碰撞机率和摩擦挤压可能性变小[20]。同时发现当EGCG质量浓度为5 mg/mL 时,乳液在冷藏15和30 d的的粒径有所增大,但在更高EGCG浓度下,粒径保持较小,这说明由BSA-EGCG-HEP稳定的乳液具有良好的冷藏稳定性。Zeta电位(图7-C)和粒径变化趋势基本一致。与常温贮藏的乳液相比,冷藏条件下乳液粒径更小,稳定性更好,所以该乳液较适应于4 ℃下贮存。

A-外观;B-粒径;C-Zeta电位
图7 不同EGCG质量浓度的Pickering乳液4 ℃不同冷藏时间的外观、粒径和Zeta电位
Fig.7 Appearance, particle size and Zeta potential of Pickering emulsions with different EGCG mass concentrations stored at 4 ℃ for different refrigeration times
在80 ℃热处理30 min条件下的乳液稳定性的结果如图8-A所示。外观观察结果表明,由BSA-EGCG-HEP复合物构建的乳液加热后仍很黏稠,未发生破乳现象,稳定性好,仅在EGCG质量浓度为20和25 mg/mL的乳液出现了轻微的析油现象,这可能是由于过高浓度的EGCG和BSA非共价结合一定程度上削弱了其热稳定性,这是由于EGCG与BSA非共价结合使BSA的α-螺旋结构的减少[13],破坏了蛋白质分子自身疏水和静电相互作用,使得蛋白在热变性过程中更容易形成不可逆聚集[21]。如图8-B所示,经过热处理后,各个样品乳液粒径显著增大,这可能是随着温度升高,蛋白质的疏水基团暴露,分子间的吸引力增加及分子热运动速率加快,引发液滴间碰撞增加导致[22]。相比之下,EGCG质量浓度为10 mg/mL的乳液加热后粒径变化小,表现出更好的热稳定性。
A-外观;B-粒径
图8 不同EGCG质量浓度的Pickering乳液80 ℃热处理后的乳液外观和粒径
Fig.8 Appearance and particle size of Pickering emulsion with different EGCG mass concentrations after heat treatment at 80 ℃
不同EGCG浓度构建的乳液粒径和Zeta电位分别如图9-A和图9-B所示,发现在EGCG质量浓度为5~15 mg/mL时,乳液粒径相较于未添加EGCG组更小。随着盐离子浓度的增大,乳液粒径变大,这可能是在乳液体系中产生了静电屏蔽效应,导致乳液表面电荷减少,Zeta电位绝对值降低[23]。在盐离子条件下,EGCG质量浓度为10 mg/mL的乳液粒径显著低于未添加EGCG组(P<0.05),这可能是因为盐离子诱导蛋白结构更加紧凑[24],而适量EGCG通过多种相互作用增强了三元复合物的空间位阻,使乳液更稳定。在100、200、300 mmol/L的NaCl条件下,EGCG质量浓度为10 mg/mL的Pickering乳液粒径最小,稳定性最好,说明由BSA-EGCG-HEP复合物稳定的Pickering乳液具有良好的盐离子稳定性。

A-粒径;B-Zeta电位
图9 不同EGCG质量浓度构建乳液不同离子强度下的粒径和Zeta电位
Fig.9 Emulsions constructed from different EGCG mass concentrations with different ionic strengths for particle size and Zeta potential
本研究以BSA、EGCG和HEP为原料构建Pickering乳液,探索不同EGCG水平对乳液表观特性及稳定性的影响。当EGCG质量浓度为10 mg/mL时,BSA-EGCG-HEP构建的Pickering乳液粒径最小,具有最高的黏弹性,乳液凝胶网络结构最强,赋予了乳液优异的稳定性。本研究为蛋白质-多酚-多糖复合物在高内相Pickering乳液在食品领域应用提供了理论基础。
[1] CHASSAING B, KOREN O, GOODRICH J K, et al.Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome[J].Nature, 2015, 519(7541):92-96.
[2] LAM S, VELIKOV K P, VELEV O D.Pickering stabilization of foams and emulsions with particles of biological origin[J].Current Opinion in Colloid &Interface Science, 2014, 19(5):490-500.
[3] ROZGA J, PI![]() TEK T, MA
TEK T, MA KOWSKI P.Human albumin:Old, new, and emerging applications[J].Annals Transplantation, 2013, 18:205-217.
KOWSKI P.Human albumin:Old, new, and emerging applications[J].Annals Transplantation, 2013, 18:205-217.
[4] 徐班萌, 梁新红, 李波, 等.乳铁蛋白、EGCG和低甲酯果胶三元凝聚体稳定的高内相Pickering乳液构建[J].食品科学, 2023, 44(10):82-89.XU B M, LIANG X H, LI B, et al.Fabrication of high internal phase Pickering emulsions stabilized with ternary aggregates of lactoferrin, epigallocatechin-3-gallate and low methoxylated pectin[J].Food Science, 2023, 44(10):82-89.
[5] HU X N, MA T, LU S Y, et al.Studies into interactions and interfacial characteristics between cellulose nanocrystals and bovine serum albumin[J].Food Chemistry:X, 2022, 13:100194.
[6] CHEN X Q, LI M Y, CAO W D, et al.A combination of green tea polysaccharide conjugate and bovine serum albumin and its emulsion-stabilizing characteristics[J].Industrial Crops and Products, 2023, 203:117212.
[7] GUERRA-ROSAS M I, MORALES-CASTRO J, OCHOA-MART NEZ L A, et al.Long-term stability of food-grade nanoemulsions from high methoxyl pectin containing essential oils[J].Food Hydrocolloids, 2016, 52:438-446.
NEZ L A, et al.Long-term stability of food-grade nanoemulsions from high methoxyl pectin containing essential oils[J].Food Hydrocolloids, 2016, 52:438-446.
[8] FREI B, HIGDON J V.Antioxidant activity of tea polyphenols in vivo:Evidence from animal studies[J].The Journal of Nutrition, 2003, 133(10):3275S-3284S.
[9] HAN S, CUI F Z, MCCLEMENTS D J, et al.Structural characterization and evaluation of interfacial properties of pea protein isolate-EGCG molecular complexes[J].Foods, 2022, 11(18):2895.
[10] 冯婷婷. 豌豆蛋白-果胶-EGCG复合物稳定皮克林乳液的机制与风味包埋特性[D].无锡:江南大学, 2022.FENG T T.Mechanism of stabilizing Pickering emulsionsand flavor encapsulation properties bypea protein-pectin-EGCG complexes[D].Wuxi:Jiangnan University, 2022.
[11] WANG K, LI Y, ZHANG Y M, et al.Physicochemical properties and oxidative stability of an emulsion prepared from (-)-epigallocatechin-3-gallate modified chicken wooden breast myofibrillar protein[J].Antioxidants, 2022, 12(1):64.
[12] 谢丽清. 乳铁蛋白、EGCG、高甲酯果胶、β-环糊精四元复合物构建及在Pickering乳液中的应用[D].新乡:河南科技学院, 2023.XIE L Q.Fabrication of tetrameric complex and applicated inPickering emulsion by lactoferrin, EGCG, high methylester pectin and β-cyclodextrin[D].Xinxiang:Henan Institute of Science and Technology, 2023.
[13] CHEN Y, YAO M Y, PENG S, et al.Development of protein-polyphenol particles to stabilize high internal phase Pickering emulsions by polyphenols’ structure[J].Food Chemistry, 2023, 428:136773.
[14] 刘丽莉, 于影, 苏克楠, 等.植物多酚-牛血清白蛋白相互作用及对蛋白质结构的影响[J].农业工程学报, 2023, 39(13):290-298.LIU L L, YU Y, SU K N, et al.Polyphenol-bovine serum albumininteraction and its influence on protein structure[J].Transactions of the Chinese Society of Agricultural Engineering, 2023, 39(13):290-298.
[15] XU Z J, SHAN G C, HAO N R, et al.Structure remodeling of soy protein-derived amyloid fibrils mediated by epigallocatechin-3-gallate[J].Biomaterials, 2022, 283:121455.
[16] SUN C C, LIANG B, SHENG H J, et al.Influence of initial protein structures and xanthan gum on the oxidative stability of O/W emulsions stabilized by whey protein[J].International Journal of Biological Macromolecules, 2018, 120:34-44.
[17] DAI L, YANG S F, WEI Y, et al.Development of stable high internal phase emulsions by Pickering stabilization:Utilization of zein-propylene glycol alginate-rhamnolipid complex particles as colloidal emulsifiers[J].Food Chemistry, 2019, 275:246-254.
[18] XU W, XIONG Y Z, LI Z F, et al.Stability, microstructural and rheological properties of complex prebiotic emulsion stabilized by sodium caseinate with inulin and konjac glucomannan[J].Food Hydrocolloids, 2020, 105:105772.
[19] AZFARALARIFF A, FAZIAL F F, SONTANOSAMY R S, et al.Food-grade particle stabilized Pickering emulsion using modified sago (Metroxylon sagu) starch nanocrystal[J].Journal of Food Engineering, 2020, 280:109974.
[20] 徐班萌. 超稳定混合型Pickering乳液的构建及功能评价[D].新乡:河南科技学院, 2023.XU B M.Super stable construction mechanism and functionalfactor delivery of dual system Pickering lotion[D].Xinxiang:Henan institute of science and technology, 2023.
[21] CAO Y Y, XIONG Y L.Interaction of whey proteins with phenolic derivatives under neutral and acidic pH conditions[J].Journal of Food Science, 2017, 82(2):409-419.
[22] 陈俊芃, 王雯曦, 张琴秋, 等.油菜籽分离蛋白-卡拉胶轭合物-花椒精油Pickering乳液的构建及其理化性质分析[J].中国油脂, 2024, 49(6):34-41.CHEN J P, WANG W X, ZHANG Q Q, et al.Fabrication of rapeseedprotein isolate-carrageenan conjugate-pepperessential oil Pickering emulsion and analysis of its physicochemical properties[J].China Oils and Fats, 2024, 49(6):34-41.
[23] WANG Z G, ZHANG N, CHEN C, et al.Rapeseed protein nanogels as novel Pickering stabilizers for oil-in-water emulsions[J].Journal of Agricultural and Food Chemistry, 2020, 68(11):3607-3614.
[24] ZHANG L L, LIN W F, ZHANG Y, et al.New insights into the NaCl impact on emulsifying properties of globular proteins[J].Food Hydrocolloids, 2022, 124:107342.