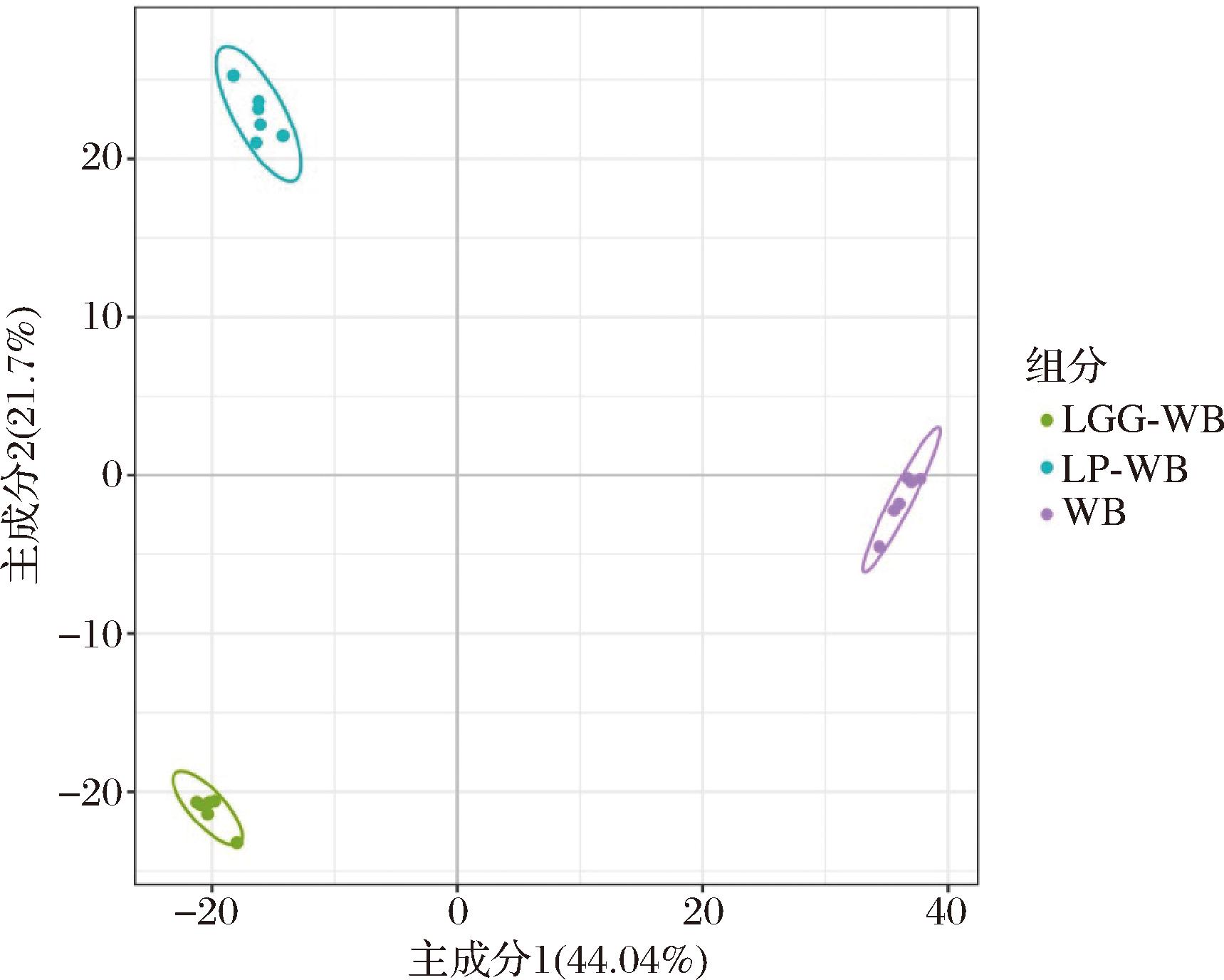
图1 主成分分析
Fig.1 Principal component analysis
SAN Yue,WU Guodong,YAN Ru, et al.Difference analysis of lipid metabolism in wheat bran fermented by different types of lactic acid bacteria[J].Food and Fermentation Industries,2025,51(14):327-335.
小麦是一种广泛种植的粮食农作物,也是世界上生产和消费最广泛的谷物之一。麦麸是小麦加工工业的一种主要副产物,在面粉生产过程中大量积累,估计年产量为1.5亿t[1]。小麦麸皮中除了富含膳食纤维外,还含有脂质和维生素等营养物质[2]。尽管麦麸中富含许多人体所需的营养素,但在食品工业中的应用率较低,大部分麦麸仍被用于制作低价值的动物饲料和生物燃料。另外,麦麸中含有的不溶性戊聚糖和不溶性膳食纤维严重影响面制品的品质和口感。为了更高效地利用麦麸资源,通过多种方法对其进行改性处理而提高其附加值。因此,通过现代的高新技术对麦麸进行改性处理,从而提高麦麸的可食用性和营养价值,改善麦麸的加工品质,促进麦麸在食品中更广泛的应用。目前,常用的麦麸改性方法有:化学方法(酸、碱处理法)、物理方法(瞬时高压技术、超微粉碎技术、冷冻粉碎技术、挤压膨化技术、热处理技术)和生物技术改性(酶法、微生物发酵法)[3]。
微生物发酵改性是利用微生物的发酵特性对麦麸进行改性处理的方法。常用于发酵的微生物菌种有:乳酸菌、酵母菌和一些霉菌类。GHAMRY等[4]的研究表明,L.apis发酵麦麸显著提高了酚类物质和其他代谢物的含量并提高抗氧化能力,促进植酸的降解,对挥发性组分、游离氨基酸、有机酸和水溶性维生素等有积极的影响。WANG等[5]研究报道用植物乳植杆菌423发酵可以改变麦麸(wheat bran, WB)原有的风味,尤其是硫化物和芳烃物质。
乳酸菌(lactic acid bacteria, LAB)是革兰氏阳性细菌的一个系统发育相关的类群,具有共同的代谢特性,可利用碳水化合物产生大量乳酸,广泛存在于食物、环境和动物肠道内[6]。乳酸菌通常被认为是安全的,不会带来任何与健康相关的风险[7]。它们可以通过抑制肠道有害菌的过度生长,维持肠道菌群结构平衡,促进营养物质的消化吸收和提高免疫力等多重形式发挥有益作用[8]。鼠李糖乳酪杆菌是乳酸菌的一种,是研究最广泛的益生菌之一,它具有抗过敏、抗焦虑和抗抑郁作用。鼠李糖乳酪杆菌通过与宿主肠道竞争脂肪酸,抑制肝脏脂肪变性,促进脂肪酸代谢,从而防止脂肪肝的发生[9]。植物乳植杆菌以独特的发酵特性广泛存在于牛奶、肉类和许多蔬菜发酵产品中,它们能通过胃液到肠道中定植,并对宿主发挥有益作用。植物乳植杆菌可以改善肠道菌群失衡,促进短链脂肪酸(short-chain fatty acids, SCFAs)等代谢产物生成,从而缓解肠道炎症,维护机体健康[10]。
在人类发展史中,乳酸菌的应用可以追溯到远古时代,那时的远古人类就已经应用乳酸菌酿造酒类和发酵面食。如今,乳酸菌在食品、医疗保健、工业、农业、科研等领域都发挥着举足轻重的作用,人体的免疫调节以及肠道对营养物质的消化吸收都离不开具有生理功能的菌群。另外,乳酸菌在食品工业中的应用也越来越广泛,用于制作益生菌饮料、保健食品、乳制品、果蔬制品、酒类、调味品等多种食品[11]。
虽然,以往的研究报道了不同类微生物(霉菌、酵母菌、乳酸菌、芽孢杆菌)发酵麦麸的营养结构和功能特性的变化,但不同类型乳酸菌发酵麦麸之间脂质代谢相关的研究还未报道。随着新型乳酸菌的发现及其应用范围的扩展,人们对乳酸菌发酵食品的研究越来越广泛。因此,本研究选择了鼠李糖乳酪杆菌(同型发酵菌)和植物乳植杆菌(兼性异型发酵菌)2种不同型乳酸菌进行固态发酵麦麸,分析其对麦麸中脂质代谢物和相关代谢通路上的差异变化,为今后开发乳酸菌发酵功能性食品奠定理论基础。
小麦(Triticum aestivum L.)麸皮,内蒙古呼和浩特市中粮面粉有限公司;鼠李糖乳酪杆菌,中国工业微生物菌种保藏管理中心(CICC),注册号为CICC 22175;植物乳植杆菌,中国农业微生物菌种保藏管理中心(ACCC),注册号为ACCC 11118;甲醇、甲酸、醋酸铵(色谱级)等,美国Thermo Fisher公司。
QExactiveTMHF-X质谱仪、Vanquish UHPLC色谱仪,德国Thermo Fisher公司;Hypesil Gold column色谱柱(100 mm×2.1 mm,1.9 μm),美国Thermo Fisher Scientific公司;D3024R低温离心机,美国Scilogex公司;HVE-50高压灭菌锅,日本Hirayama公司;ZHJH-C1112B超净工作台,上海智城分析仪器制造有限公司。
1.3.1 乳酸菌发酵麦麸的制备
将干燥的麸皮粉碎成细粉进行灭菌处理,在121 ℃条件下高温湿热处理20 min,待冷却后备用。发酵前,乳酸菌在无菌MRS肉汤培养基中活化培养3次作为发酵种子液。在超净台中吸取0.2 mL种子液加入到灭菌的MRS培养基(10 mL)中,然后放于转速为180 r/min的恒温培养箱(37 ℃)中培养20 h,离心(4 000×g,10 min,4 ℃)收集菌体,然后用生理盐水(0.85%)调至菌液浓度为109 CFU/mL,作为麦麸发酵的接种物。把10 mL接种菌液用无菌水稀释至120 mL后加入到80 g麦麸中充分搅拌后密封,水分控制在60%左右,在37 ℃恒温下进行固态发酵7 d。未加入菌液的麦麸作为对照实验。然后进行冷冻干燥并保存于-20 ℃冰箱中备用。
1.3.2 样品的提取
发酵麦麸样本(100 mg)是在液态氮和匀浆悬浮在预先冷却的80%(体积分数)甲醇和甲酸0.1%(体积分数)漩涡,然后在冰上孵化5 min后离心(15 000×g,20 min,4 ℃)。取一定量的上清液并加入质谱级水稀释至甲醇含量为53%,将混合上清液转移至新的离心管中并立即离心(15 000×g,20 min,4 ℃)。取上清液加至液质联用(high performance liquid chromatography-mass spectrometry, HPLC-MS)系统上机检测。
1.3.3 色谱条件
高效液相色谱使用的色谱柱为:Hypersil Gold Column(C18,100 mm×2.1 mm,1.9 μm),柱温控制在40 ℃,流速设置为0.2 mL/min。流动相A:0.1%甲酸或5 mmol/L醋酸铵(pH=9.0),流动相B:甲醇溶液。色谱梯度洗脱程序为:0~1.5 min,98% A、2% B;1.5~3.0 min,15% A、85% B;3~10 min,0% A、100% B;10~11 min,98% A、2% B;11~12 min,98% A、2% B。
1.3.4 质谱条件
质谱仪Q ExactiveTM HF-X在Xcalibur软件控制下进行质谱数据采集。扫描范围选择100~1 500 m/z;ESI源的设置如下:喷雾电压:3.5 kV;鞘气流速:35 psi;辅助气流速:10 L/min;离子传输管温度:320 ℃;离子导入射频电平:60;辅助气加热器温度:350 ℃;MS/MS二级扫描为数据依赖性扫描。
使用KEGG数据库(https://www.genome.jp/kegg/pathway.html)和LIPID Maps数据库(http://www.lipidmaps.org/)对鉴定的代谢物进行注释。多元统计分析部分,使用代谢组学数据处理软件metaX[12]对数据进行转换后进行主成分分析(principal component analysis, PCA)和偏最小二乘法判别分析(partial least squares discriminant analysis, PLS-DA),进而得每个代谢物的变量投影重要性(variable importance in projection, VIP)值。单变量分析部分,基于t检验来计算各代谢物在2组间统计学显著性(P值),并计算代谢物在两组间的差异倍数(fold change)即FC值。用Graph Pad Prism(8.0.2)软件进行数据计算和作图,数据以“平均数±标准差”表示(代谢组分析n=6)。
不同型乳酸菌发酵对麦麸中脂质代谢物产生了不同程度的变化。主成分分析(PCA)显示,鼠李糖乳酪杆菌发酵麦麸组(LGG-WB)和植物乳植杆菌发酵麦麸组(LP-WB)中的代谢物明显与未发酵麦麸组(WB)分开且分布在轴线统一侧,组内聚集在一起。另外,2个发酵麦麸组之间PC1距离相差不明显,而PC2距离相差较远(图1)。说明,不同乳酸菌发酵明显改变了麦麸中原有的脂质组成,并表现出一定的相似性和差异性。

图1 主成分分析
Fig.1 Principal component analysis
通过Lipid maps数据库对不同乳酸菌发酵麦麸中脂质代谢物进行了注释和分类,所有样品中共鉴定出222种脂质代谢物。其中,脂肪酰基、甘油脂类、甘油磷脂类、聚酮化合物、烯醇酮脂类、固醇脂类和鞘脂类等代谢物数量分别为57、2、52、63、19、27和2(图2)。所有的脂质代谢物中聚酮化合物、甘油磷脂类和脂肪酰基的数量占据前3个。在聚酮化合物中,黄酮类物质有56种,占据此类物质的88.9%(表1)。说明乳酸菌发酵对麦麸中黄酮类化合物的影响较大。
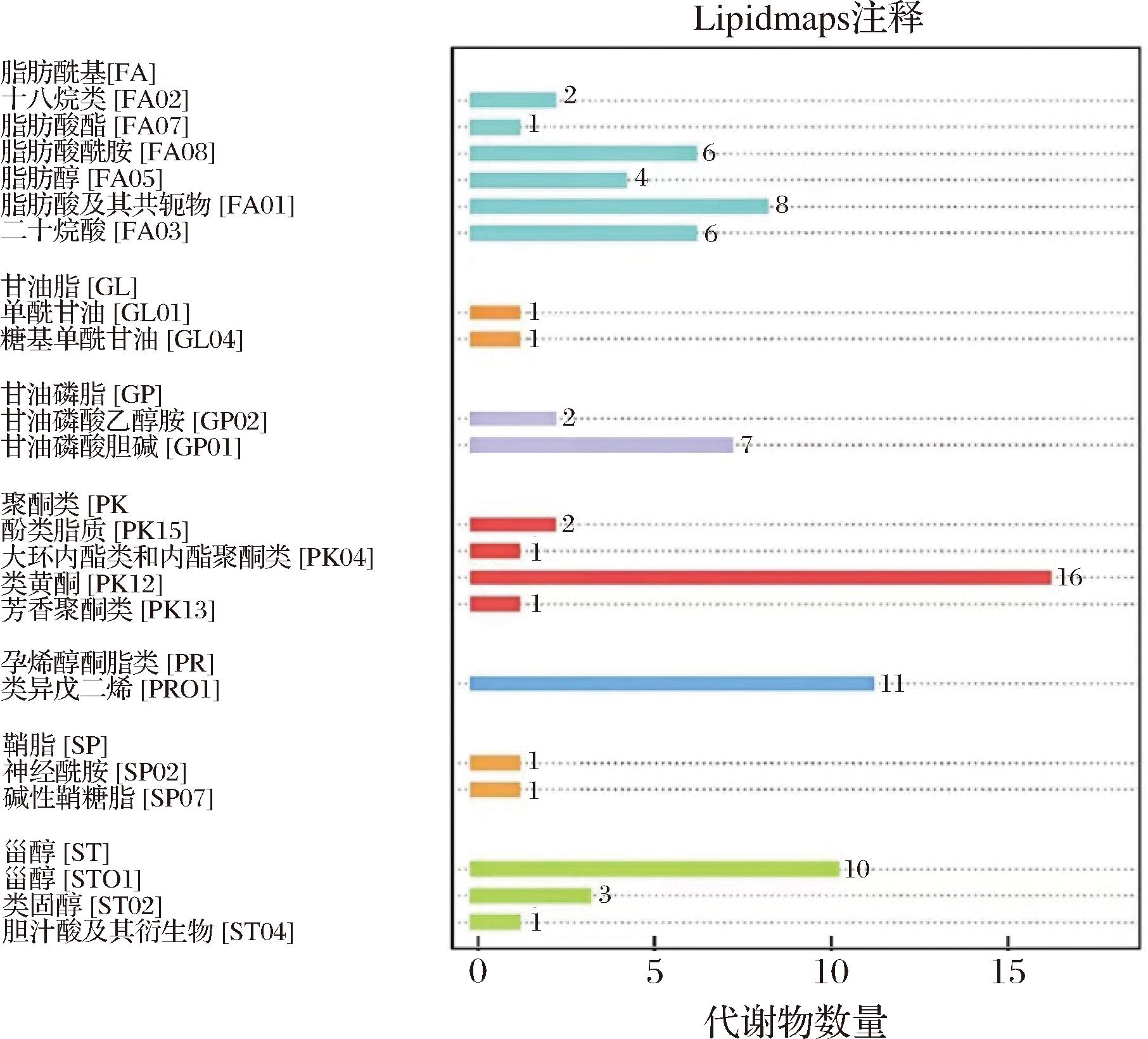
图2 脂质代谢物的注释与分类
Fig.2 Annotation and classification of lipid metabolites
表1 所有样品中黄酮类化合物的注释
Table 1 Annotation of flavonoid compounds in all samples
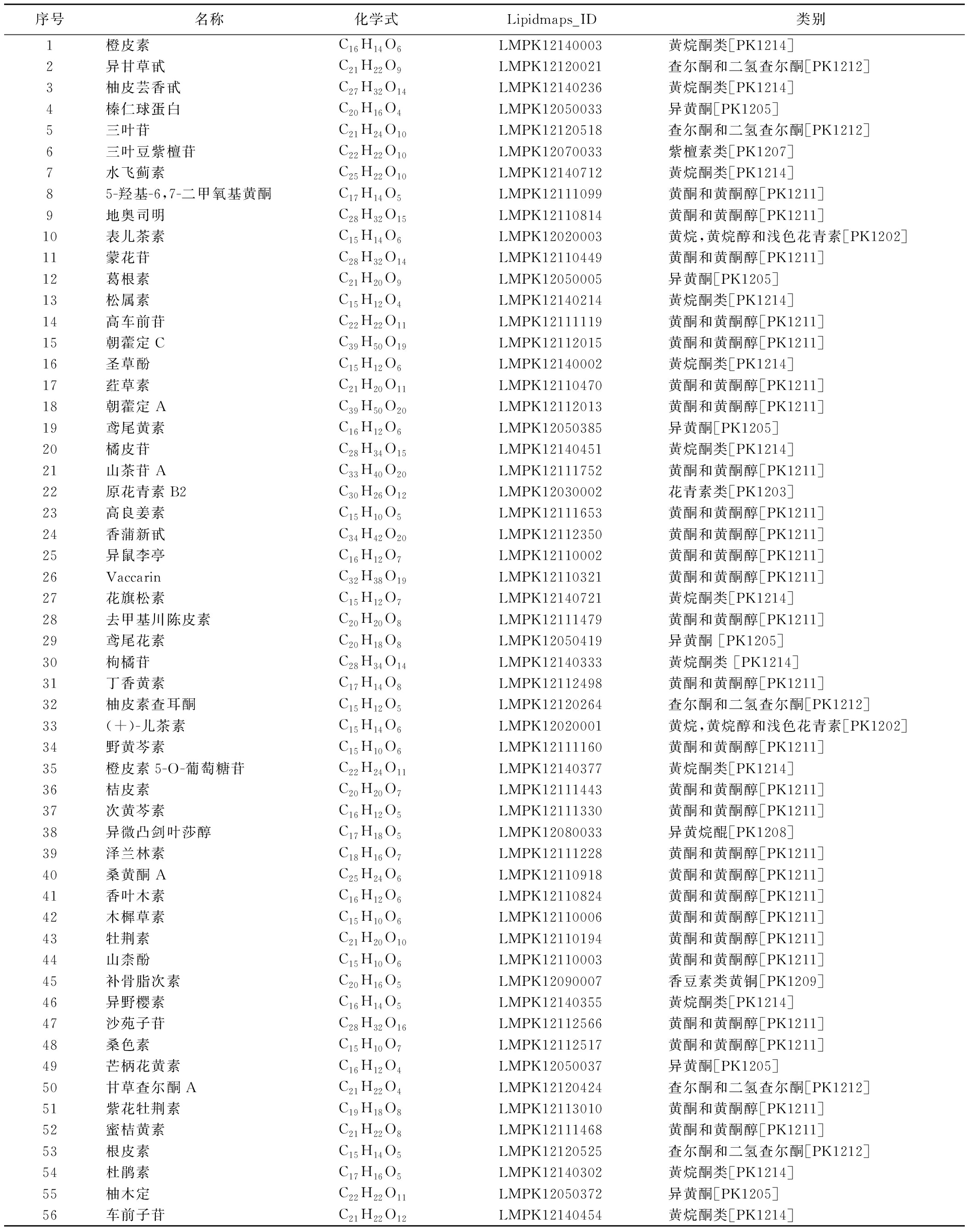
序号名称化学式 Lipidmaps_ID 类别1橙皮素C16H14O6LMPK12140003黃烷酮类[PK1214]2异甘草甙C21H22O9LMPK12120021查尔酮和二氢查尔酮[PK1212]3柚皮芸香甙C27H32O14LMPK12140236黃烷酮类[PK1214]4榛仁球蛋白C20H16O4LMPK12050033异黄酮[PK1205]5三叶苷C21H24O10LMPK12120518查尔酮和二氢查尔酮[PK1212]6三叶豆紫檀苷C22H22O10LMPK12070033紫檀素类[PK1207]7水飞蓟素C25H22O10LMPK12140712黃烷酮类[PK1214]85-羟基-6,7-二甲氧基黄酮C17H14O5LMPK12111099黄酮和黄酮醇[PK1211]9地奥司明C28H32O15LMPK12110814黄酮和黄酮醇[PK1211]10表儿茶素C15H14O6LMPK12020003黄烷,黄烷醇和浅色花青素[PK1202]11蒙花苷C28H32O14LMPK12110449黄酮和黄酮醇[PK1211]12葛根素C21H20O9LMPK12050005异黄酮[PK1205]13松属素C15H12O4LMPK12140214黃烷酮类[PK1214]14高车前苷C22H22O11LMPK12111119黄酮和黄酮醇[PK1211]15朝藿定CC39H50O19LMPK12112015黄酮和黄酮醇[PK1211]16圣草酚C15H12O6LMPK12140002黃烷酮类[PK1214]17荭草素C21H20O11LMPK12110470黄酮和黄酮醇[PK1211]18朝藿定AC39H50O20LMPK12112013黄酮和黄酮醇[PK1211]19鸢尾黄素C16H12O6LMPK12050385异黄酮[PK1205]20橘皮苷C28H34O15LMPK12140451黃烷酮类[PK1214]21山茶苷AC33H40O20LMPK12111752黄酮和黄酮醇[PK1211]22原花青素B2C30H26O12LMPK12030002花青素类[PK1203]23高良姜素C15H10O5LMPK12111653黄酮和黄酮醇[PK1211]24香蒲新甙C34H42O20LMPK12112350黄酮和黄酮醇[PK1211]25异鼠李亭C16H12O7LMPK12110002黄酮和黄酮醇[PK1211]26VaccarinC32H38O19LMPK12110321黄酮和黄酮醇[PK1211]27花旗松素C15H12O7LMPK12140721黃烷酮类[PK1214]28去甲基川陈皮素C20H20O8LMPK12111479黄酮和黄酮醇[PK1211]29鸢尾花素C20H18O8LMPK12050419异黄酮 [PK1205]30枸橘苷C28H34O14LMPK12140333黃烷酮类 [PK1214]31丁香黄素C17H14O8LMPK12112498黄酮和黄酮醇[PK1211]32柚皮素查耳酮C15H12O5LMPK12120264查尔酮和二氢查尔酮[PK1212]33(+)-儿茶素C15H14O6LMPK12020001黄烷,黄烷醇和浅色花青素[PK1202]34野黄芩素C15H10O6LMPK12111160黄酮和黄酮醇[PK1211]35橙皮素5-O-葡萄糖苷C22H24O11LMPK12140377黃烷酮类[PK1214]36桔皮素C20H20O7LMPK12111443黄酮和黄酮醇[PK1211]37次黄芩素C16H12O5LMPK12111330黄酮和黄酮醇[PK1211]38异微凸剑叶莎醇C17H18O5LMPK12080033异黄烷醌[PK1208]39泽兰林素C18H16O7LMPK12111228黄酮和黄酮醇[PK1211]40桑黄酮AC25H24O6LMPK12110918黄酮和黄酮醇[PK1211]41香叶木素C16H12O6LMPK12110824黄酮和黄酮醇[PK1211]42木樨草素C15H10O6LMPK12110006黄酮和黄酮醇[PK1211]43牡荆素C21H20O10LMPK12110194黄酮和黄酮醇[PK1211]44山柰酚C15H10O6LMPK12110003黄酮和黄酮醇[PK1211]45补骨脂次素C20H16O5LMPK12090007香豆素类黄铜[PK1209]46异野樱素C16H14O5LMPK12140355黃烷酮类[PK1214]47沙苑子苷C28H32O16LMPK12112566黄酮和黄酮醇[PK1211]48桑色素C15H10O7LMPK12112517黄酮和黄酮醇[PK1211]49芒柄花黄素C16H12O4LMPK12050037异黄酮[PK1205]50甘草查尔酮AC21H22O4LMPK12120424查尔酮和二氢查尔酮[PK1212]51紫花牡荆素C19H18O8LMPK12113010黄酮和黄酮醇[PK1211]52蜜桔黄素C21H22O8LMPK12111468黄酮和黄酮醇[PK1211]53根皮素C15H14O5LMPK12120525查尔酮和二氢查尔酮[PK1212]54杜鹃素C17H16O5LMPK12140302黃烷酮类[PK1214]55柚木定C22H22O11LMPK12050372异黄酮[PK1205]56车前子苷C21H22O12LMPK12140454黃烷酮类[PK1214]
以|FC|>1.0和P<0.05为筛选标准,发现LGG-WB和LP-WB与未发酵麦麸相比分别有84(上调:29,下调:55)和66(上调:25,下调:41)个差异代谢物。在2个发酵组中均在变化的脂质代谢物有48种,其中,15种上调,33种下调(图3-a和图3-b)。在2组发酵麦麸中,石胆酸、已二烯二酸、丙二酸、油酸和十二烷二酸等有机酸的水平显著(P<0.05)上升,而溶血磷脂酰甘油(lysophosphatidyl glycerol, LPG)、溶血磷脂酰胆碱(lysophosphatidyl choline, LPC)、溶血磷脂酸(lysophosphatidic acid, LPA)、溶血磷脂酰丝氨酸(lysophosphatidyl serine, LPS)、溶血磷脂酰肌醇(lysophosphatidyl inositol, LPI)、溶血磷脂酰乙醇胺(lysophosphatidyl ethanolamine, LPE)的水平显著(P<0.05)下降(图3-c至图3-f)。结果表明,乳酸菌发酵对麦麸中脂质代谢物的影响较大,尤其对部分有机酸和溶血磷脂酰类脂质代谢物的影响更为明显。
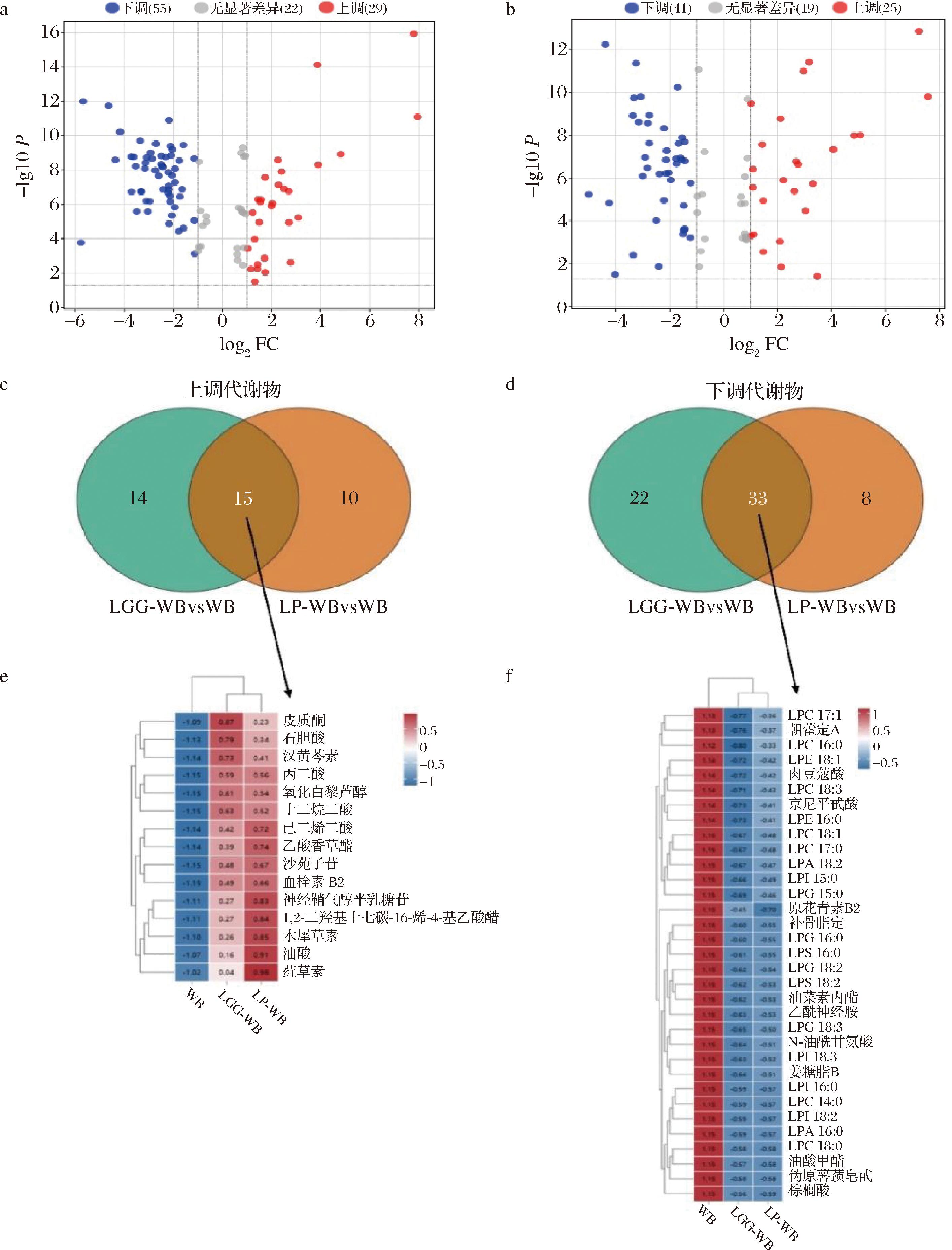
a、b-分别是LGG-WB和LP-WB与WB之间差异代谢物的变化;c、d-分别是各比较组中上、下调代谢物的韦恩图分析;e、f-分别是各比较组中共同上、下调代谢物的热图分析
图3 各组间差异代谢物的比较分析
Fig.3 Comparative analysis of different metabolites between each group
注:a、b中红色代表上调的代谢物,蓝色代表下调的代谢物;标注名称的是变化前10的代谢物。
乳酸菌发酵类型的不同,两种乳酸菌发酵麦麸中脂质代谢物的变化也存在一定的差异性。在两组发酵麦麸中除了显著(P<0.05)变化的共有代谢物外,还有一些独有的代谢物在变化。与WB组相比,在LGG-WB和LP-WB组中分别有36种(上调:14,下调:22)和18种(上调:14,下调:22)脂质代谢物显著(P<0.05)变化(图3-c和图3-d)。在LGG-WB组中,甲羟戊酸、山梨酸、硬脂酸和戊烯二酸的水平显著(P<0.05)增加,而LPC(LPC 17:2、LPC 16:1、LPC 15:1、LPC 18:2、LPC 15:0、LPC 12:0)、LPA(LPA 14:0、LPA 16:1)、LPE(LPE 18:3、LPE 22:4、LPE 18:2、LPE 16:1、LPE 17:2、LPE 14:0、LPE 15:0)和LPI(LPI 16:1)等溶血磷脂酰类脂质代谢物的水平显著(P<0.05)下降(图4-a和图4-c)。在LP-WB组中,琥珀酸、乙基丙二酸、油桐酸和脱氧胆酸的水平显著(P<0.05)增加,而硬脂酰胺、香叶香叶醇、芸香柚皮苷、十六碳酰胺、油酸酰胺和葫芦素E等的水平显著(P<0.05)下降(图4-b和图4-d)。结果表明,LGG菌发酵对麦麸中溶血磷脂酰类脂质的降低作用比LP菌更有优势,而LP菌对酰胺类化合物的影响更为明显。另外,2种乳酸菌对有机酸的提高表现出了相同的作用,但有机酸的种类各不相同。

a-LGGWB组中上调的脂质代谢物;b-LPWB组中上调的脂质代谢物;c-LGGWB组中下调的脂质代谢物;d-LPWB组中下调的脂质代谢物
图4 各组中独有脂质代谢物的变化
Fig.4 Changes of unique lipid metabolites in each group
为揭示不同乳酸菌发酵对麦麸中脂质相关代谢通路的影响,本文比较了乳酸菌发酵麦麸之间的差异代谢通路及富集的脂质代谢物。与WB相比,在LGG-WB组中脂肪酸生物合成、角质,琥珀和蜡的生物合成、花生四烯酸代谢、脂肪酸延长率、类固醇生物合成、甘油磷脂代谢、不饱和脂肪酸的生物合成、鞘脂类代谢、脂肪酸代谢等脂质代谢通路上的具有代谢物富集(图5-a)。其中,脂肪酸生物合成代谢通路显著(P<0.05)变化,并油酸、棕榈酸、硬脂酸、肉豆蔻酸和棕榈油酸等代谢物显著(P<0.05)富集(表2)。不同的是,在LP-WB组中脂肪酸降解通路上具有富集现象(图5-b),并在该通路上富集的代谢物有戊二酸和棕榈酸(表3)。

a-LGG-WB与WB之间脂质代谢通路变化;b-LP-WB与WB之间脂质代谢通路变化
图5 各组中脂质代谢通路的变化分析
Fig.5 Analysis of changes of lipid metabolism pathway in each group
表2 脂质代谢通路上富集的代谢物(LGG-WB vs WB)
Table 2 Enriched metabolites on the lipid metabolic pathways (LGG-WB vs WB)

Map ID代谢途径P 值富集状态代谢物 map00061脂肪酸生物合成0.005 7富集油酸; 棕榈酸; 硬脂酸; 肉豆蔻酸; 棕榈油酸map00073角质、琥珀和蜡的生物合成0.129 4富集油酸;棕榈酸 map00590花生四烯酸代谢0.192 9富集血栓素B2; 前列腺素J2; 前列腺素 H2; 16(R)-HETEmap00062脂肪酸伸长率0.360 9富集棕榈酸map00100类固醇生物合成0.360 9富集胆钙化醇map00564甘油磷脂代谢0.621 3富集胆碱; 胆碱磷酸map01040不饱和脂肪酸生物合成0.705 5富集油酸; 棕榈酸; 硬脂酸map00600鞘脂代谢1.000 0富集鞘氨醇半乳糖苷map01212脂肪酸代谢1.000 0富集棕榈酸
表3 脂质代谢通路上富集的代谢物(LP-WB vs WB)
Table 3 Enriched metabolites on the lipid metabolic pathway (LP-WB vs WB)
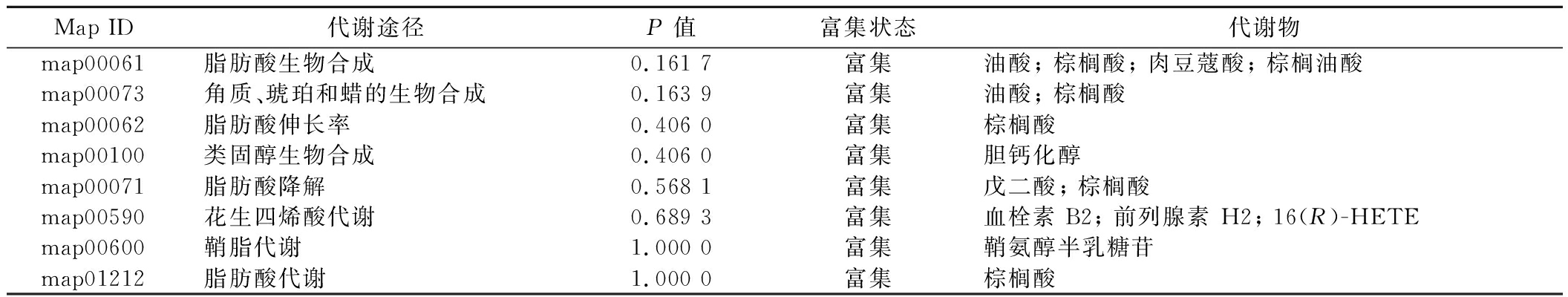
Map ID代谢途径P 值富集状态代谢物 map00061脂肪酸生物合成0.161 7富集油酸; 棕榈酸; 肉豆蔻酸; 棕榈油酸map00073角质、琥珀和蜡的生物合成0.163 9富集油酸; 棕榈酸map00062脂肪酸伸长率0.406 0富集棕榈酸map00100类固醇生物合成0.406 0富集胆钙化醇map00071脂肪酸降解0.568 1富集戊二酸; 棕榈酸map00590花生四烯酸代谢0.689 3富集血栓素 B2; 前列腺素 H2; 16(R)-HETEmap00600鞘脂代谢1.000 0富集鞘氨醇半乳糖苷map01212脂肪酸代谢1.000 0富集棕榈酸
随着人们健康饮食的需求不断提高,对功能性食品的要求也越来越高。在谷物副产品发酵过程中,LAB作为一种辅助培养物或发酵剂被广泛应用于健康食品的开发和推广[13]。麦麸是膳食纤维、维生素、矿物质和酚酸等营养物质的重要来源,但口感差、质地硬,不宜直接用于食品中,微生物发酵是改善麦麸口感和功能特性的有效方法[14]。因此,越来越多的研究者选择LAB发酵来改善食品的风味和营养结构,从而提高麦麸原料的附加值。本研究比较分析了不同型乳酸菌发酵对麦麸中脂质代谢物和代谢通路上的差异变化。LGG和LP发酵明显改变了麦麸中脂质代谢物,并表现出了一定的相似性和差异性。在两组发酵麦麸中,石胆酸、已二烯二酸、丙二酸、油酸和十二烷二酸等有机酸的水平上升,而溶血磷脂酰类(LPG、LPC、LPA、LPS、LPI、LPE)化合物的水平降低。石胆酸是胆固醇代谢产物之一,在肠道中有助于脂溶性营养物质的消化吸收[15]。已二烯二酸是一种具有生物活性的脂质代谢物,既可以转化为己二酸和对苯二甲酸,也可以转化为生物制品中应用的次级代谢物[16]。在本研究中,2种乳酸菌发酵麦麸中石胆酸和已二烯二酸的水平均有所提高,这些物质赋予麦麸更丰富的营养价值和功能特性。相反,溶血磷脂类化合物的水平有所降低。特别是,LGG发酵对麦麸中溶血磷脂类化合物的降低能力比LP更胜一筹。LGG发酵显著降低了麦麸中溶血磷脂酰类化合物的水平,这类物质的主要表现形式是LPA、LPC、LPE、LPG和LPI。溶血磷脂类是小麦胚乳中含量最多的极性脂类,与直链淀粉联合形成天然络合物而影响淀粉的理化性质[17]。最近的研究表明,溶血磷脂类不仅是合成各种磷脂类(生物膜的主要成分)的中间体,而且本身也是重要的信号介质,具有广泛的生物学效应。LPC和LPA是溶血磷脂类化合物的主要表现形式,也被认为是最主要的炎症性脂质,参与一些免疫介导的疾病,如动脉粥样硬化和自身免疫疾病等[18]。因此,在功能性食品的开发和发展角度考虑,LGG-WB中溶血磷脂类化合物的降低对健康饮食带来了有益作用。另外,LGG菌发酵显著提高了甲羟戊酸、油酸、硬脂酸和棕榈酸的水平。甲羟戊酸是一种具有旋光性的有机酸,是合成异戊二烯的重要前体化合物,在食品、医药、化工等行业有重要应用价值。生物体内乙酰辅酶A是合成甲羟戊酸的前体物,对甲羟戊酸的合成起重要作用[19](图6)。LGG作为同型发酵菌而依靠EMP途径产生大量的乙酰辅酶A,这对甲羟戊酸的增加提供了有效的物质前体(图6)。山梨酸是一种抗菌防腐剂,具有抗菌特性,用于药品、食品和化妆品等行业。LGG菌发酵有效改变了麦麸中代谢通路,其中,脂肪酸生物合成代谢通路上发生了显著性变化。这些改变强化了麦麸中硬脂酸和油酸等脂肪酸的生物合成。
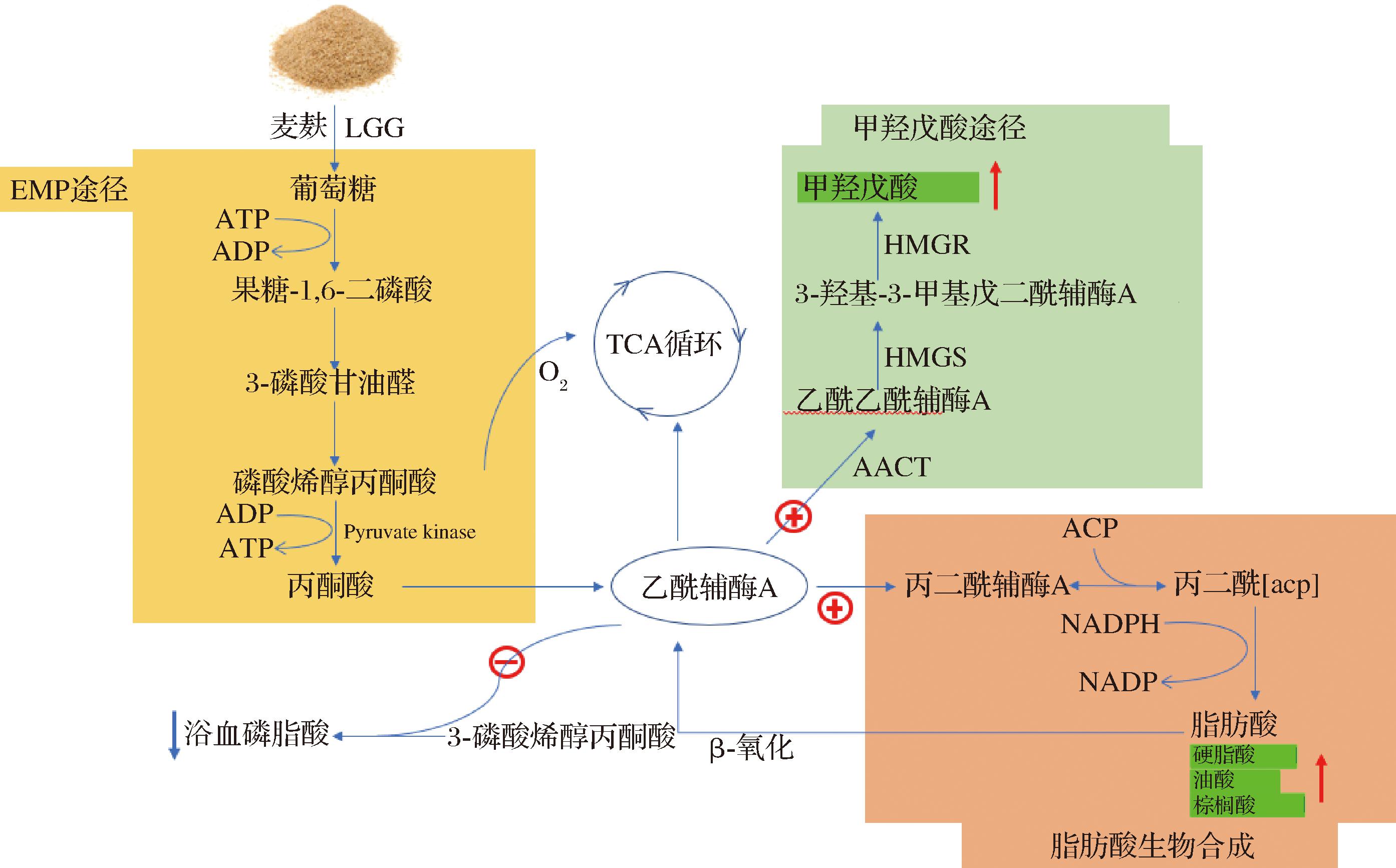
图6 鼠李糖乳酪杆菌发酵麦麸脂质代谢机制
Fig.6 Lipid metabolism mechanism of Lactobacillus rhamnosus fermented WB
在LP-WB组中,琥珀酸、乙基丙二酸、油桐酸和脱氧胆酸的水平显著增加,而硬脂酰胺、十六碳酰胺和油酸酰胺等的水平显著下降。琥珀酸是三羧酸(tricarboxylic acid, TCA)循环的中间体,微生物在低pH值条件下生产琥珀酸。许多细菌有还原性TCA循环并合成琥珀酸作为厌氧发酵的最终产物[20]。琥珀酸在食品、化学和制药工业中被广泛应用,被用作生产可生物降解塑料聚琥珀酸丁二烯的原料和食品添加剂,主要是通过化学方法合成获得。因此,通过采用微生物发酵法生产琥珀酸是可取的方法[21]。脱氧胆酸是一种次级胆汁酸,在发酵过程中在细菌分泌的胆汁水解酶的作用下产生。在制药工业中用作开发美学产品,它是美国食品和药物管理局批准的第一种用于该领域的脂溶性物质[22]。植物乳植杆菌是兼性异型发酵菌,可以通过EMP途径或磷酸戊糖途径产生乳酸、乙酸、乙醇和其它的生物活性物质。这些物质的提高赋予麦麸更高的营养价值,使其在食品工业中的应用更广泛[23]。因此,LAB发酵是一种高效转化低成本资源,同时创造高附加值产品的可行性方法,发酵可以产生许多生物活性成分[24]。先前的研究表明,LAB对麦麸进行发酵是一种有效的预处理方法,可以改善含麸皮产品的工艺、感官和营养特性以及降解抗营养因子[25]。然而,目前的研究主要集中在乳酸菌发酵对感官特性、工艺特性和抗氧化能力的影响[26]。迄今为止,尚未对麦麸中脂类代谢物变化进行分析。然而,这是非常重要的指标,脂类代谢物的变化也能给予食品带来更强的营养价值和功能特性。
随着人们对发酵食品的需求和消费日益增长,越来越多的人被乳酸菌发酵植物性食品吸引。本文选用不同型乳酸菌对麦麸进行发酵,并通过不同代谢途径修饰了麦麸中脂质代谢物。以|FC|>1.0和P<0.05为筛选标准,LGG-WB和LP-WB中分别有84和66差异脂质代谢物。LGG发酵可提高甲羟戊酸、山梨酸、硬脂酸和戊烯二酸的水平,而降低溶血磷脂酰类化合物的水平;LP发酵可提高琥珀酸、乙基丙二酸、油桐酸和脱氧胆酸的水平,而降低了硬脂酰胺、十六碳酰胺和油酸酰胺的水平。在脂质代谢通路上,LGG菌发酵显著改变了脂肪酸生物合成代谢通路,而LP菌发酵对脂质代谢通路无显著影响。因此,不同型乳酸菌发酵可以不同程度的改变麦麸中脂质组分结构,这些变化依赖于乳酸菌的代谢表型,它们可以通过不同代谢途径修饰麦麸的脂质代谢物。
[1] PIETI INEN S, MOLDIN A, STRÖM A, et al. Effect of physicochemical properties, pre-processing, and extraction on the functionality of wheat bran Arabinoxylans in breadmaking-A review[J]. Food Chemistry, 2022, 383:132584.
INEN S, MOLDIN A, STRÖM A, et al. Effect of physicochemical properties, pre-processing, and extraction on the functionality of wheat bran Arabinoxylans in breadmaking-A review[J]. Food Chemistry, 2022, 383:132584.
[2] 李诚. 麦麸阿魏酰阿拉伯木聚糖的亚临界水制备及其氧化凝胶化性能的研究[D]. 无锡: 江南大学, 2021.LI C. Preparation of feruloyl Arabinoxylan from wheat bran in subcritical water and its oxidative gelation properties[D]. Wuxi: Jiangnan University, 2021.
[3] 崔晨晓. 麸皮的发酵改性及其在馒头中的应用[D]. 无锡: 江南大学, 2015.CUI C X. Fermentation modification of bran and its application in steamed bread[D]. Wuxi: Jiangnan University, 2015.
[4] GHAMRY M, ZHAO W, LI L. Impact of Lactobacillus apis on the antioxidant activity, phytic acid degradation, nutraceutical value and flavor properties of fermented wheat bran, compared to Saccharomyces cerevisiae and Lactobacillus plantarum[J]. Food Research International, 2023, 163:112142.
[5] WANG M, LEI M, SAMINA N, et al. Impact of Lactobacillus plantarum 423 fermentation on the antioxidant activity and flavor properties of rice bran and wheat bran[J]. Food Chemistry, 2020, 330:127156.
[6] FERNANDO W M A D B, FLINT S H, RANAWEERA K K D S, et al. The potential synergistic behaviour of inter- and intra-genus probiotic combinations in the pattern and rate of short chain fatty acids formation during fibre fermentation[J]. International Journal of Food Sciences and Nutrition, 2018, 69(2):144-154.
[7] RIAZ RAJOKA M S, JIN M L, ZHAO H B, et al. Functional characterization and biotechnological potential of exopolysaccharide produced by Lactobacillus rhamnosus strains isolated from human breast milk[J]. LWT, 2018, 89:638-647.
[8] LIU J, TAN F, LIU X H, et al. Exploring the antioxidant effects and periodic regulation of cancer cells by polyphenols produced by the fermentation of grape skin by Lactobacillus plantarum KFY02[J]. Biomolecules, 2019, 9(10):575.
[9] JANG H R, PARK H J, KANG D, et al. A protective mechanism of probiotic Lactobacillus against hepatic steatosis via reducing host intestinal fatty acid absorption[J]. Experimental &Molecular Medicine, 2019, 51(8):1-14.
[10] LI X P, HUANG Y M, SONG L Q, et al. Lactobacillus plantarum prevents obesity via modulation of gut microbiota and metabolites in high-fat feeding mice[J]. Journal of Functional Foods, 2020, 73:104103.
[11] 陈杰, 徐冲, 孙翠焕, 等. 乳酸菌在食品工业中的应用现状及发展前景[J]. 微生物学杂志, 2012, 32(3):91-94.CHEN J, XU C, SUN C H, et al. Current situation and development outlook of the application of lactobacteria in food field[J]. Journal of Microbiology, 2012, 32(3):91-94.
[12] WEN B, MEI Z L, ZENG C W, et al. metaX: A flexible and comprehensive software for processing metabolomics data[J]. BMC Bioinformatics, 2017, 18(1):183.
[13] BAO W J, HUANG X N, LIU J J, et al. Influence of Lactobacillus brevis on metabolite changes in bacteria-fermented sufu[J]. Journal of Food Science, 2020, 85(1):165-172.
[14] TU J, ZHAO J, LIU G H, et al. Solid state fermentation by Fomitopsis pinicola improves physicochemical and functional properties of wheat bran and the bran-containing products[J]. Food Chemistry, 2020, 328:127046.
[15] LI W J, WANG Z Y, LIN R R, et al. Lithocholic acid inhibits gallbladder cancer proliferation through interfering glutaminase-mediated glutamine metabolism[J]. Biochemical Pharmacology, 2022, 205:115253.
[16] LING C, PEABODY G L, SALVACH A D, et al. Muconic acid production from glucose and xylose in Pseudomonas putida via evolution and metabolic engineering[J]. Nature Communications, 2022, 13(1):4925.
A D, et al. Muconic acid production from glucose and xylose in Pseudomonas putida via evolution and metabolic engineering[J]. Nature Communications, 2022, 13(1):4925.
[17] LIU L, GUO Q, HE Z H, et al. Genotypic variation in wheat flour lysophospholipids[J]. Molecules, 2017, 22(6):909.
[18] ZENG C W, WEN B, HOU G X, et al. Lipidomics profiling reveals the role of glycerophospholipid metabolism in psoriasis[J]. GigaScience, 2017, 6(10):1-11.
[19] XIONG M Y, SCHNEIDERMAN D K, BATES F S, et al. Scalable production of mechanically tunable block polymers from sugar[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(23):8357-8362.
[20] CUI Z Y, ZHONG Y T, SUN Z J, et al. Reconfiguration of the reductive TCA cycle enables high-level succinic acid production by Yarrowia lipolytica[J].Nature Communications, 2023, 14(1):8480.
[21] JIANG M, MA J F, WU M K, et al. Progress of succinic acid production from renewable resources: Metabolic and fermentative strategies[J]. Bioresource Technology, 2017, 245:1710-1717.
[22] MSC G A F, PHD K C, DE FIGUEIREDO PHD M A Z, et al. Deoxycholic acid in the submental fat reduction: A review of properties, adverse effects, and complications[J]. Journal of Cosmetic Dermatology, 2020, 19(10):2497-2504.
[23] KAWANO K, SHOBAKO M, FURUKAWA T, et al. Fatty acid amides present in Camembert cheese improved cognitive decline after oral administration in mice[J]. Neuroscience Research, 2024, 205:34-39.
[24] SPYROPOULOS B G, MISIAKOS E P, FOTIADIS C, et al. Antioxidant properties of probiotics and their protective effects in the pathogenesis of radiation-induced enteritis and colitis[J]. Digestive Diseases and Sciences, 2011, 56(2):285-294.
[25] ZHAO H M, GUO X N, ZHU K X. Impact of solid state fermentation on nutritional, physical and flavor properties of wheat bran[J]. Food Chemistry, 2017, 217:28-36.
[26] SIKORA M, Z OTEK U, KORDOWSKA-WIATER M, et al. Effect of basil leaves and wheat bran water extracts on antioxidant capacity, sensory properties and microbiological quality of shredded iceberg lettuce during storage[J]. Antioxidants, 2020, 9(4):355.
OTEK U, KORDOWSKA-WIATER M, et al. Effect of basil leaves and wheat bran water extracts on antioxidant capacity, sensory properties and microbiological quality of shredded iceberg lettuce during storage[J]. Antioxidants, 2020, 9(4):355.