TANG Ying,ZHOU Xiaofang,MA Tingting.Study on electrochemiluminescence detection method of aflatoxin B1 using CdTe quantum dot monoclonal antibody[J].Food and Fermentation Industries,2025,51(14):336-342.
黄曲霉毒素B1(aflatoxin B1,AFB1)是一种毒性极强的次生代谢产物,主要由黄曲霉(Aspergillus flavus)、褐曲霉(Aspergillus nomius)、寄生曲霉(Aspergillus parasiticus)和塔玛曲霉(Aspergillus tamarii)等丝状霉菌产生[1]。在已发现的18种黄曲霉真菌毒素中,AFB1毒性最强,分布最广,被国际癌症研究机构(International Agency for Research on Cancer,IARC)列为人类第一类致癌物[2]。因AFB1是对人类和动物的致癌、致畸、肝毒性和免疫抑制特性,造成对食品和粮食的巨大危害。
多次分析技术可实现对AFB1的检测,包括酶联免疫技术[3]、荧光光谱技术[4]、高效液相色谱[5]、液相色谱串联质谱[6]、电化学发光技术[7]等。然而目前这些分析技术存在不稳定、检测仪器昂贵、受检测条件制约、对检验人员要求高等缺点[8]。因此,开发快速、可视化、灵敏度高、简便的AFB1检测方法对保障食品和粮食作物安全意义重大。量子点(quantum dot, QDs)是一类半导体纳米晶体,引起了科学界的广泛兴趣[9]。这种纳米粒子具有优异的光学性能,包括尺寸依赖的光致发光特性、对称的发射光谱和优异的光稳定性,作为检测荧光探针,具有良好的光学稳定性[10-12]。同时量子点发光的频率随量子点的尺寸的改变而变化[13]。因而应用量子点做标记探针,根据结合目标化合物数量调节量子点尺寸就可以控制其发光的频率,从而实现目标化合物的可视化快速定量筛查检测。制备量子点传感器的材料种类很多,SUN等[14]设计了一种基于水溶性锌镉硫(ZnCdS/ZnS)量子点的无标记免疫ECL传感器。WANG等[15]应用碲化镉(CdTe)材料制备量子点检测赭曲霉毒素(ochratoxin A, OTA)。其中CdTe材料具有制造成本低、比表面积大、电子转移速度快、长期稳定性和良好的生物相容性等优点,有望成为量子点理想的生物传感器材料[16]。
目前,量子点荧光微球标记的抗体的大多是羧基化的[17]。然而,在某些生物系统或环境中,量子点标记的羧基化抗体直接与目标化合物结合的稳定性不足,易受到极端 pH 条件、高离子强度溶液以及暴露于强光照时长的影响,导致其荧光性能随时间延长衰减。单克隆抗体(monoclonal antibody, mAb)单克隆抗体因其高度一致的结构和特异性,能够与羧基化抗原紧密且专一地结合[18]。 基于此特性,通过壳聚糖介导的量子点偶联技术,可将抗体-抗原复合物与量子点稳定结合,从而特异性捕获目标化合物,并触发稳定的电化学发光信号。目前,该技术已在部分农药残留检测中得到成功应用[19],但在黄曲霉毒素B1(AFB1)的快速检测领域仍鲜见报道。未来,通过将量子点标记技术与生物电化学发光传感器联用,有望开发出高效、灵敏的AFB1免疫检测新方法。
本研究基于化学修饰构建AFB1抗原,通过免疫应答,产生结构一致,能够与目标化合物紧密结合的单克隆抗体。利用壳聚糖将单克隆抗体与CdTe材料的量子点粘连,组成电化学发光传感器。建立量子点单克隆抗体QDs-mAb可视化快速定量筛查检测AFB1的新方法,实现食品与粮食中AFB1的现场即时检测(point-of-care testing, POCT),以期提升基层监管机构的日常筛查检测的整体水平。
1.1.1 试剂
标准品AFB1、AFB2、AFG1、AFM1、OTA、T-2毒素、脱氧雪腐镰刀菌烯醇、伏马毒素B1、香兰素,美国开曼化学公司;三乙胺、碲粉、硼氢化钠(NaBH4)、硫醇丙酸(mercaptopropionic acid,MPA)、氯化镉、乙酸钠、辛酸、甲醇和丙酮,Sigma Aldrich(北京)公司。
乙二醇二甲基丙烯酸酯(ethylene dimethacrylate,EDMA)、偶氮二异丁晴(azodiisobutyrine,AIBN)、聚乙二醇(polyethylene glycol,PEG)、弗氏完全佐剂、弗氏不完全佐剂,美国Thermo Fisher Scientific公司;小鼠单克隆抗体亚型鉴定试剂盒,南京天为生物科技有限公司;RPMI-1640培养基、胎牛血清、HRP标记的羊抗鼠IgG,美国Gibco公司。
1.1.2 实验动物
用于实验的小鼠使用SPF级4~6周龄雌性BALB/c 小鼠,中国农业科学院兰州畜牧与兽药研究所,许可证号:SYXK(甘)20190002;小鼠骨髓瘤细胞株SP2/0,上海中科院细胞库。
U3000型高效液相色谱仪、FACSCantoTM Ⅱ型流式细胞仪,美国BD公司;XYZ3000 点膜仪,美国Bio-Dot 公司;TSQ Quantis plus液相色谱仪-三重四极杆质谱联用仪、BB150-2TCS型CO2培养箱,美国Thermo Fisher Scientific公司;高速冷冻离心机,湖南湘仪实验室仪器有限公司;MDI-E电化学发光分析仪,江西维邦生物科技有限公司;Sigma 500扫描电子显微镜(scanning electron microscope,SEM),德国蔡司公司。
1.3.1 AFB1抗原合成
称取400 mg香兰素于100 mL圆底烧瓶中,加入25 mL甲醇溶解,完全溶解后再添加1 mL三乙胺,0.5 mL 乙酰丙酸乙酯,600 mg三乙酰氧基硼氢化钠,常温振荡反应18 h,再加入10 mL 0.5 mol/L NaOH溶液,继续反应5 h,45 ℃旋转蒸发反应液得到白色残渣。加15 mL纯水溶解残渣,滴加5 mL HCl(1 mol/L),冰浴静置5 h,析出白色沉淀,过滤收集白色沉淀,得到AFB1抗原。
1.3.2 免疫原和包被原的合成与鉴定
采用碳二亚胺/N-羟基琥珀酰亚胺活性酯包被AFB1抗原,再与血蓝蛋白偶联,参考王云芹[20]的方法。将偶联抗原用纯水稀释至0.5~1 mg/mL,抗原与AFB1浓度偶联比例为30∶1、50∶1和70∶1。载体蛋白偶联上小分子后,分子质量会发生相应变化,用SDS-PAGE来鉴定偶联后的抗原。
1.3.3 小鼠免疫
AFB1免疫原用无菌生理盐水稀释至2 mg/mL,与弗氏佐剂以1∶1(体积比)混合乳化。选用7~9周龄、25~28 g的BALB/c小鼠,首次免疫采用背部皮下多点注射免疫原和弗氏完全佐剂混合乳化剂,二免至五免为背部皮下注射弗氏不完全佐剂,免疫剂量为100 μg/只,每次免疫时间间隔2周[21]。从三免开始,培养7 d后进行尾尖采血,间接ELLSA检测小鼠血清效价。选择效价最高的小鼠进行细胞融合。
1.3.4 单克隆抗体制备和纯化
采用体内诱生腹水法进行单克隆抗体制备,选择7~9周龄健康的BALB/c小鼠,每只量腹腔注射0.5 mL无菌石蜡油。注射10 d后,再注射杂交瘤细胞。调节杂交瘤细胞浓度为2×107 cells/mL,每只小鼠注射量为0.5 mL。8 d后,采集腹水。腹水采集后8 000 r/min离心10 min,去除杂质,-18 ℃保存备用。采用辛酸盐析-硫酸铵法进行纯化[22]。
1.3.5 单克隆抗体亲和力和表位鉴定
根据LI等[23]采用的非竞争测定方法,将AFB1抗原从1 μg/mL开始,成倍稀释为0.5、0.25、0.125 μg/mL进行包板,37 ℃孵育3 h。单克隆抗体从5 μg/mL开始成倍稀释为2.50、1.25、0.625、0.312、0.156、0.078、0.039 μg/mL,采用间接ELIAS方法鉴定单克隆抗体亲和力。单抗亲和常数(Ka)计算如公式(1)所示:
(1)
将上述浓度两两组合,式中:n,表示每组中2个AFB1抗原浓度的倍数比值;[c]i和[D]i分别表示对应每组50%的ODmax对应的抗体浓度,mol/L。
采用单克隆抗体亚型鉴定试剂盒进行单克隆抗体的表位鉴定,按照说明书进行检测。
1.3.6 CdTe量子点的制备
水溶性CdTe量子点通过优化BHAND等[24]的方法合成。首先,将碲粉(125 mg, 0.98 mmol)、NaBH4 (200 mg, 5.29 mmol)和超纯水10 mL混合在样品瓶中。氮气鼓泡30 min后密封,在冰水浴中冷却搅拌8 h,得到NaHTe溶液。其次,在175 mL水中加入CdCl2·2.5H2O (554.3 mg, 1.21 mmol/L)和300 μL MPA,形成镉前驱体;将制备好的NaHTe溶液注入镉前驱体中,在充氮气条件下75 ℃加热回流1 h,得到CdTe量子点(5.30 mmol)。
1.3.7 传感器制备与电化学发光信号捕捉
传感器制作过程如图1所示。在修改之前,用0.3、0.05 mm氧化铝浆液仔细抛光玻碳电极(glassy carbon electrode,GCE),并在每个抛光步骤之间用双重蒸馏水彻底冲洗。然后,在超声波浴中分别用双蒸馏水和乙醇洗涤。清洁后的电极在室温下干燥。在GCE表面滴加5 μL 1%(质量分数)的壳聚糖制备固态电化学发光传感器。
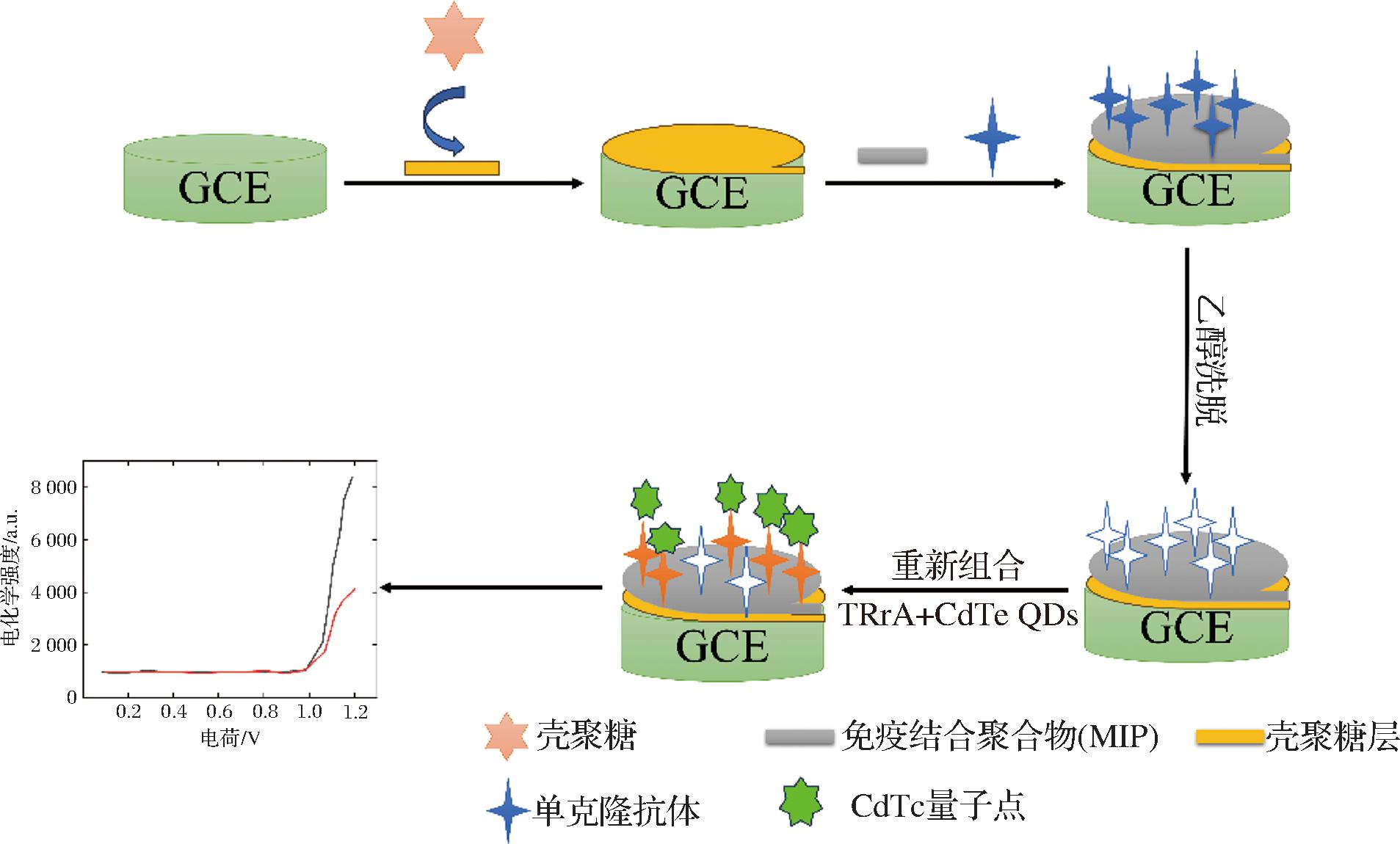
图1 AFB1检测传感器原理图
Fig.1 Schematic diagram of AFB1 detection sensor
其次,将AFB1模板分子、AFB1单克隆抗体、交联剂EDMA和引发剂AIBN混合,得到免疫结合聚合物(imprinted polymer,MIP)的原始溶液。除AFB1模版分子外,非免疫结合聚合物(non imprinted polymer,NIP)的原始溶液与MIP相同。将原溶液2 μL滴在GCE表面,用波长为245 nm的紫外光诱导得到MIP或NIP传感器。聚合后,将MIP或NIP传感器用2 mL 乙醇洗涤5 min,去除免疫结合分子或免疫结合膜内或表面的吸附物,得到免疫结合膜上具有立体空腔的MIP传感器。但是NIP传感器没有空腔,因为它们没有模板分子。
1.3.8 发射极耦合检测
将免疫结合膜中有立体空腔的MIP传感器浸入3 mL AFB1质量浓度为 0.001~12.00 μg/L(0.001、0.01、0.1、0.5、1、10、12 μg/L)的溶液中5 min,使溶液中AFB1与MIP中空腔进行重新结合。随后捕捉电化学信号,电压为0~1.2 V,扫描速率为100 mV/s,光电倍增管(photomultiplier tubes,PMT)的电压设置为600 V。以上操作在含有2 mmol TPrA 和2.65 mmol量子点的3 mL 0.1 mol/L PBS(pH 7.0)中进行。通过测试一系列含有不同AFB1浓度的标准溶液,来确定浓度和传感器发光强度响应之间的关系。
1.3.9 实际样品特异性、重复性检测
取AFB1质量浓度为2 μg/L的玉米样品, 分别加入10倍质量浓度的AFB2、AFG1、AFM1、赭曲霉毒素A、T-2毒素、脱氧雪腐镰刀菌烯醇、伏马毒素B1为干扰项,以仅含2 μg/L AFB1的玉米样品为阳性对照,评价QDs-mAb方法的特异性。
采用QDs-mAb方法在常温下对含有AFB1质量浓度为2 μg/L的玉米样品进行10次试验,通过ECL发光强度评估该方法的重复性。
1.3.10 QDs-mAb与高效液相色谱-柱后衍生法(HPLC-post column derivation method,HPLC-PCDM)比较分析
选取不同样本基质的AFB1阳性样本, 同时用QDs-mAb方法和HPLC-PCDM法检测, 两者检测结果进行相关性分析, 以评价QDs-mAb方法的准确度。HPLC-PCDM法的样本前处理及上机检测参数全部参照GB 5009.22—2016 《食品安全国家标准 食品中黄曲霉毒素B族和G族的测定》进行。
所有实验均进行了3次独立的平行重复测定,实验数据通过Origin 2024软件进行统计分析和处理。
检测AFB1抗原合成产物,液相色谱图(图2-a)表明在8.32 min处有一明显峰,没有其他杂峰,说明产物成分单一。质谱图为提取该处峰顶的离子质谱图(图2-b),主要碎片离子为372.084 5,由于抗原合成为单基团反应,推断该组分为AFB1抗原。AFB1抗原的合成,通过还原胺化反应,再经过水解,引入活性羧基,AFB1抗原合成原理如图3所示。
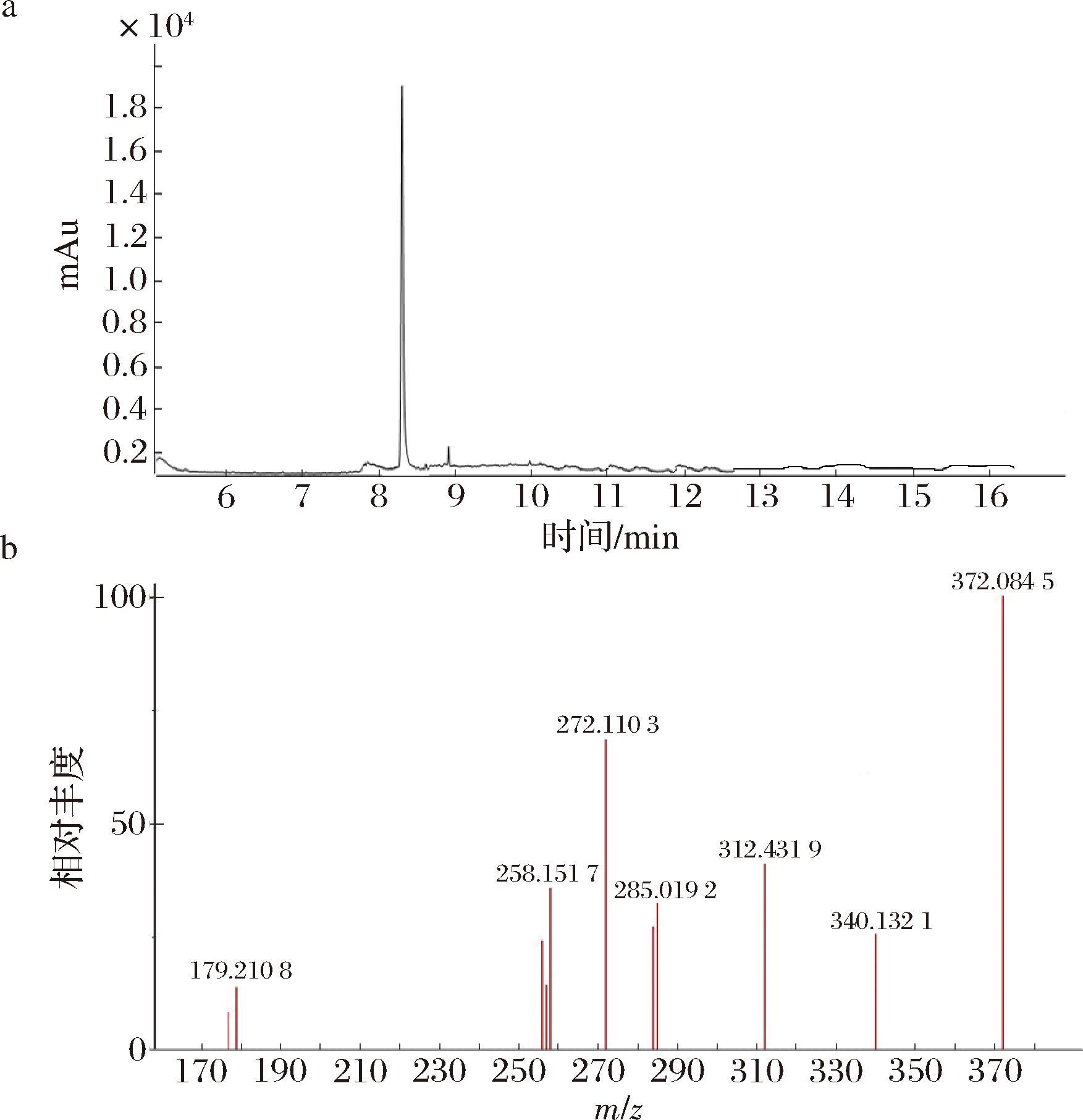
a-色谱图;b-质谱图
图2 AFB1抗原谱图
Fig.2 AFB1Antigen Profile
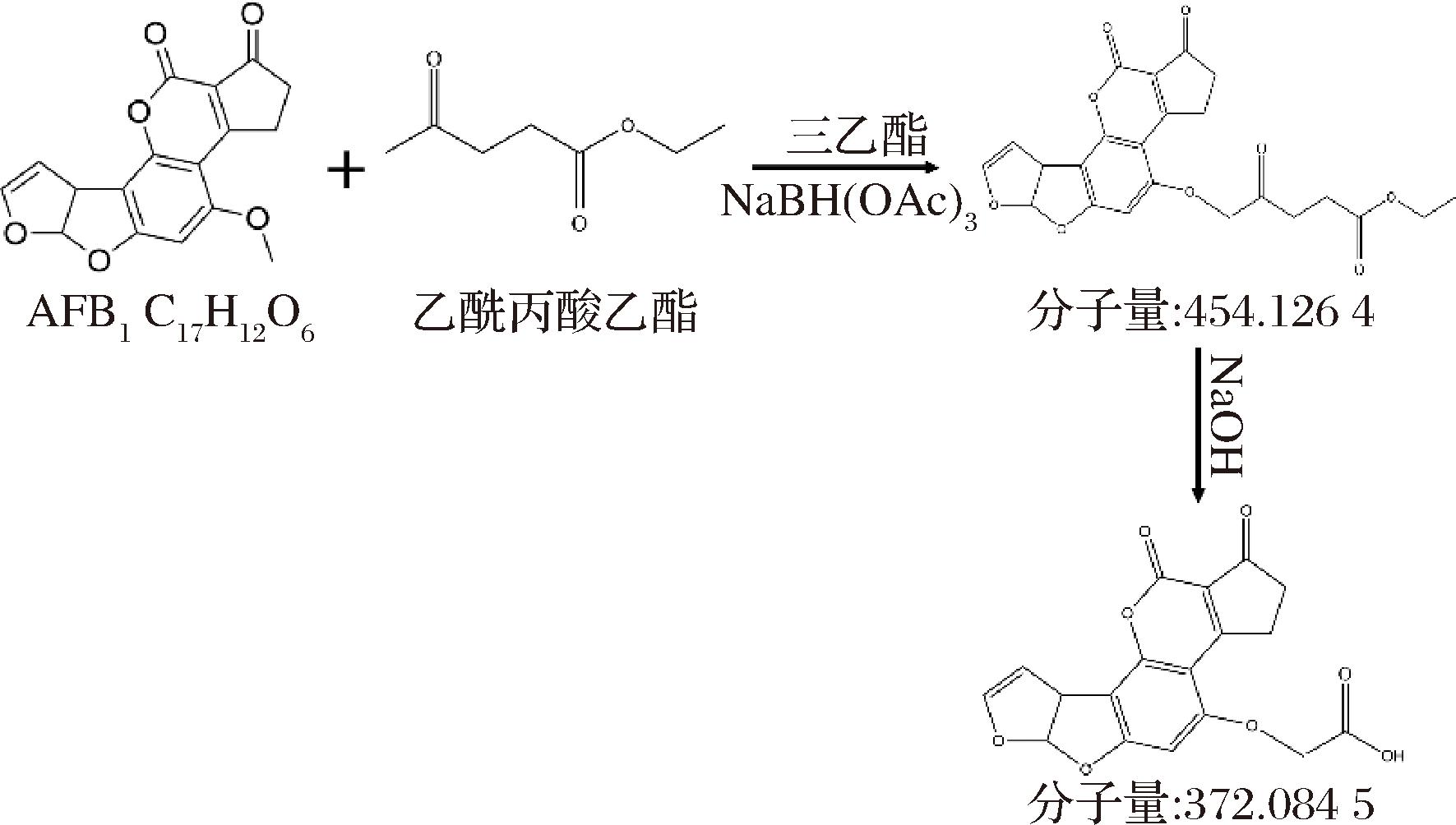
图3 AFB1抗原合成原理
Fig.3 AFB1 antigen synthesis principle
AFB1抗原与AFB1偶联后,分子质量会比未偶联的AFB1抗原大,偶联成功的AFB1抗原-AFB1分子的蛋白电泳条带会滞后于未偶联的AFB1抗原条带,采用SDS-PAGE电泳鉴定。如图4所示,条带1为AFB1抗原,条带2、3和4分别为30∶1、50∶1和70∶1比例反应的AFB1抗原-AFB1。结果表明,AFB1抗原与AFB1三种反应比例的偶联物条带都比单纯的AFB1抗原条带明显滞后,表明偶联成功。偶联比例为50∶1和70∶1的偶联物条带位置差异不大,表示50∶1的偶联比例已经趋于饱和,因此后续实验的偶联比例为50∶1。
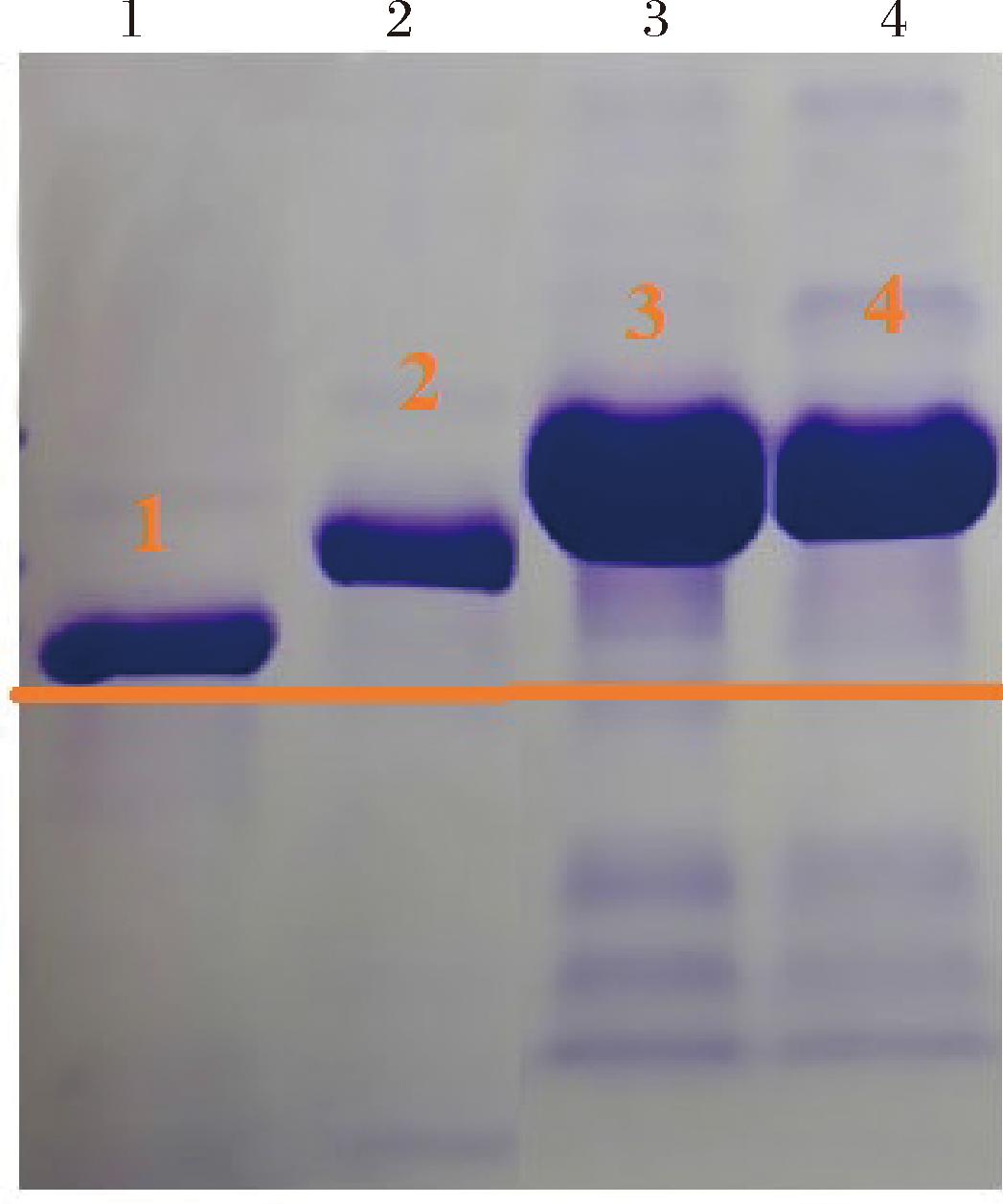
图4 不同偶联比例的AFB1抗原-AFB1电泳鉴定图
Fig.4 AFB1 antigen-AFB1 electrophoresis identification diagram with different coupling ratios
抗体的亲和常数Ka为107~1012 L/mol时为高亲和力抗体,表明该抗体能建立性能良好的免疫检测方法。本试验制备的单克隆抗体亲和常数的测定如图5所示,4条亲和曲线的50% ODmax对应的抗体浓度分别为0.024、0.025 3、0.029 4、0.053 6 μg/mL,AFB1单克隆抗体亲和常数为9.72×109 L/mol,属于高亲和力抗体。
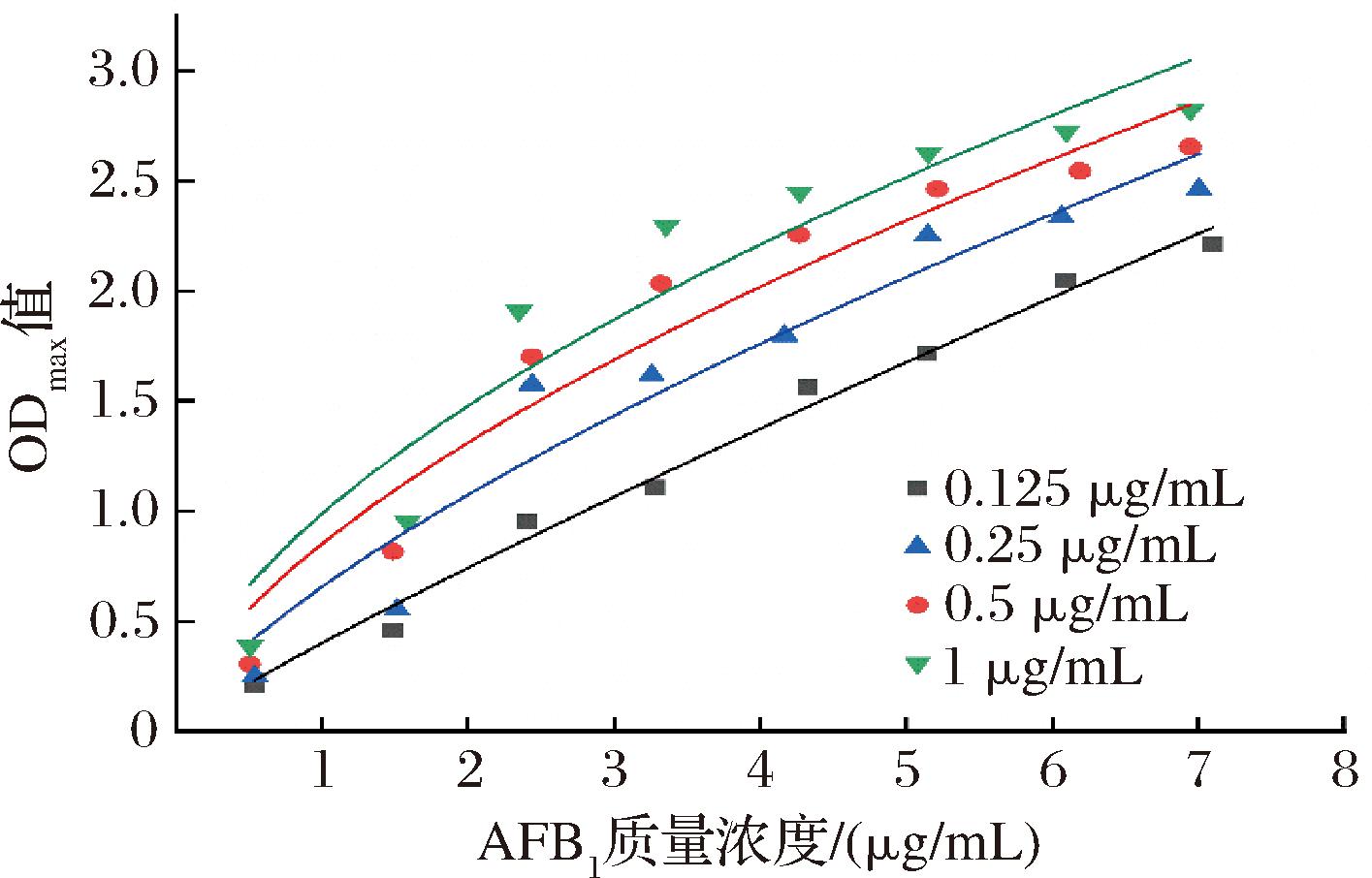
图5 AFB1单克隆抗体亲和常数
Fig.5 Affinity constant of AFB1monoclonal antibody
试验建立的单克隆抗体亚型种类决定后期的纯化方法,采用单克隆抗体亚型鉴定试剂盒进行鉴定,鉴定结果如表1所示,加入IgG1酶标抗体的反应孔会显色,ODmax值达到2.316,判断AFB1单克隆抗体为IgG1型。
表1 AFB1 单克隆抗体亚型鉴定结果
Table 1 Result of AFB1 monoclonal antibody subtype identification

亚型OD值IgA0.073IgM0.081IgG12.316IgG30.094IgG2a0.115IgG2b0.086
通过SEM对不同修饰电极的表面形貌进行了表征。图6-a为GCE的SEM图像;图6-b为MIP的SEM图像,可以看出球形纳米颗粒几乎均匀地分布在电极表面;图6-c为结合AFB1的QDs-mAb传感器,可以看出QDs-mAb结合AFB1后,表面形状发生了改变,QDs-mAb传感器表明几乎都结合了AFB1化合物,证明试验制备的QDs-mAb是有效的。
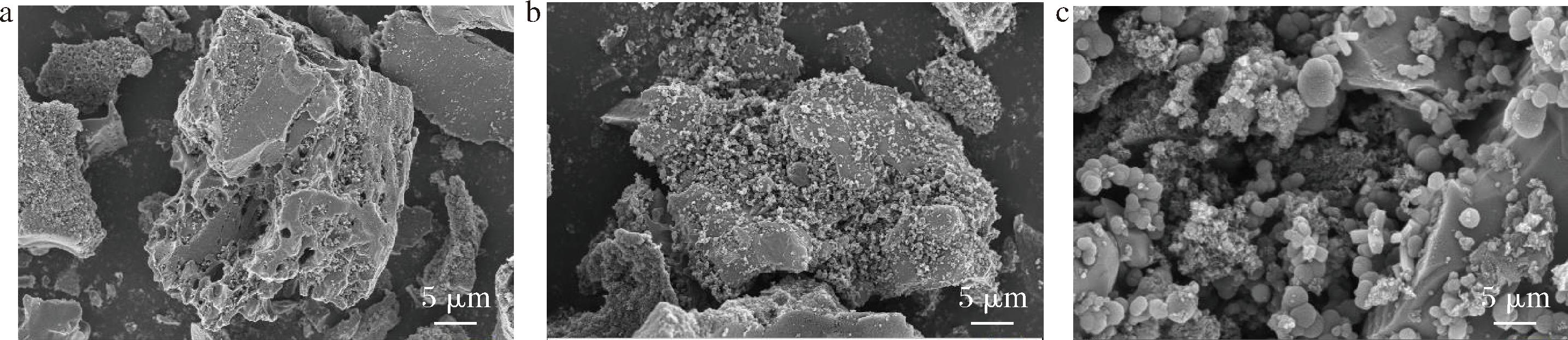
a-GCE图;b-MIP;c-QDs-mAb-AFB1
图6 QDs-mAb-AFB1扫描电镜图
Fig.6 SEM of AFB1monoclonal antibody quantum dot-AFB1
通过测试一系列含有不同AFB1浓度的标准溶液,质量浓度为0.001~12.00 μg/L(0.001、0.01、0.1、0.5、1、10、12 μg/L),来研究浓度与AFB1 QDs-mAb之间的响应关系。如图7所示,ΔIECL(0.001~12.00 μg/L)与AFB1浓度(c)的对数呈线性关系,最低检出限(limit of detection,LOD)为0.03 μg/L(S/N=3)。线性回归方程是:ΔIECL=716.29lgc+4 724.52,线性相关系数为0.998。各浓度(由低至高)相对标准偏差(relative standard deviation,RSD)分别为10.7%、7.9%、3.4%、2.9%,2.0%、1.9%和1.9%。为了进一步肯定所制备传感器的优越性能,将其检测范围和检出限与文献中报道的其他方法进行了比较,具体结果如表2所示。可以看出,试验制备的AFB1 QDs-mAb具有较宽的线性范围和较低的检测限。
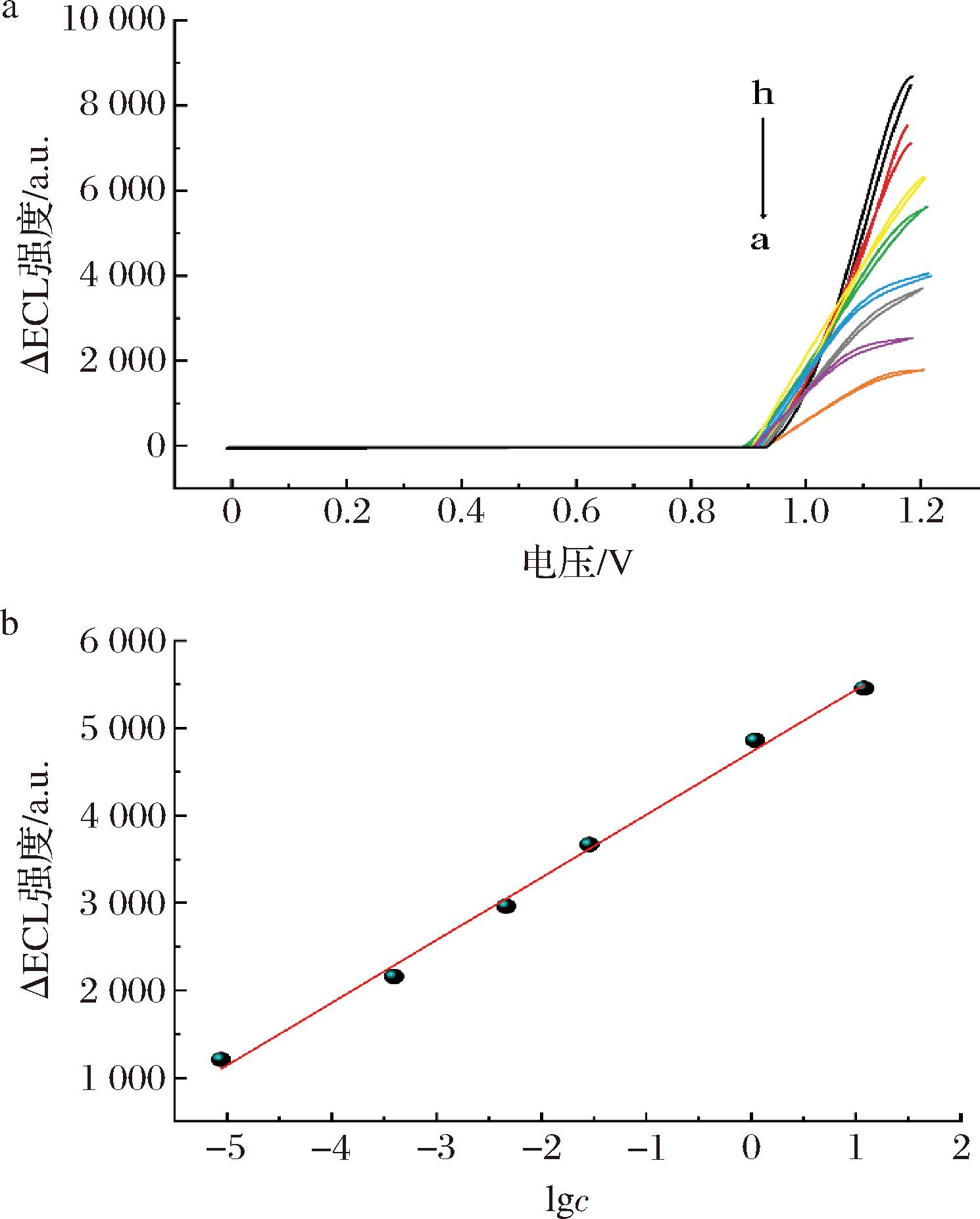
a-不同AFB1浓度对ECL的响应;b-AFB1定量标准曲线
图7 QDs-mAb传感器ECL响应
Fig.7 ECL response of QDs-mAb sensor
注:a~h分别表示MIP传感器孵育AFB1质量浓度为0、0.001、0.01、0.1、0.5、1、10、12 μg/L。
表2 制备AFB1单克隆抗体量子点检测方法与已报道AFB1检测方法比较
Table 2 Comparison of the prepared AFB1 QDs-mAb detection method with reported AFB1 detection methods
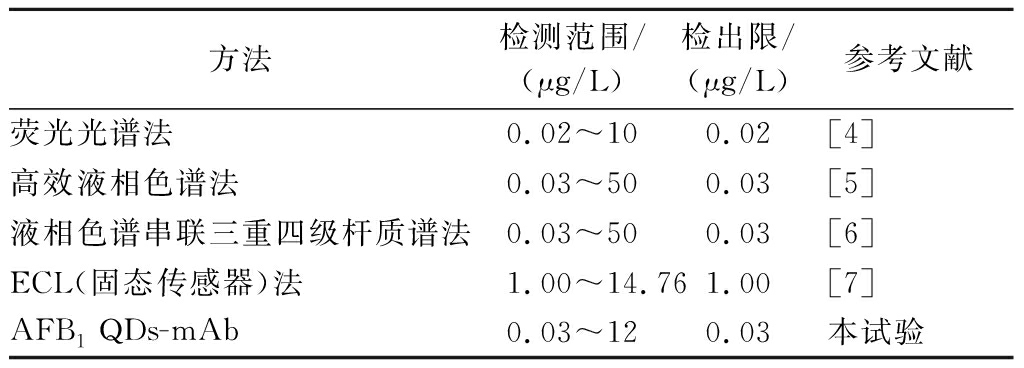
方法检测范围/(μg/L)检出限/(μg/L)参考文献荧光光谱法0.02~100.02[4]高效液相色谱法0.03~500.03[5]液相色谱串联三重四级杆质谱法0.03~500.03[6]ECL(固态传感器)法1.00~14.761.00[7]AFB1 QDs-mAb0.03~120.03本试验
QDs-mAb方法的特异性在检验中至关重要,以AFB2、AFG1、AFM1、OTA、T-2毒素、脱氧雪腐镰刀菌烯醇、伏马毒素B1为干扰物,评估QDs-mAb方法的特异性。如图8-a所示,在AFB1质量浓度为2 μg/L的玉米样品中添加10倍的干扰物,与不添加干扰物的阳性对照,没有明显差异,说明QDs-mAb方法的选择性和特异性良好。

a-QDs-mAb方法抗干扰图;b-QDs-mAb方法重复性
图8 QDs-mAb方法特异性及重复性
Fig.8 Specificity and repeatability of the qbs-mab method
采用QDs-mAb方法连续10次检测AFB1含量为2 μg/L的玉米样品,结果如图8-b所示,响应信号的变化约为3.24%,表明QDs-mAb方法有良好的重复性。
选取16 批次经HPLC-PCDM 方法确证AFB1 为阳性的样本, 样本来源包括花生、玉米等容易被AFB1污染的样品, 采用QDs-mAb方法进行检测, 两者检测结果相关性分析结果如表3所示,QDS-mAb检测花生、玉米样品中AFB1回收率为84.62%~114.47%,与现行GB 5009.22—2016《食品安全国家标准 食品中黄曲霉毒素B族和G族的测定》标准采用的HPLC-PCDM方法具有良好的一致性,验证试验建立的QDs-mAb方法可用于实际样本中AFB1快速定量筛查检测。
表3 QDs-mAb检测方法与HPLC-PCDM的一致性分析
Table 3 Consistency analysis between QDs-mAb detection method and HPLC-PCDM
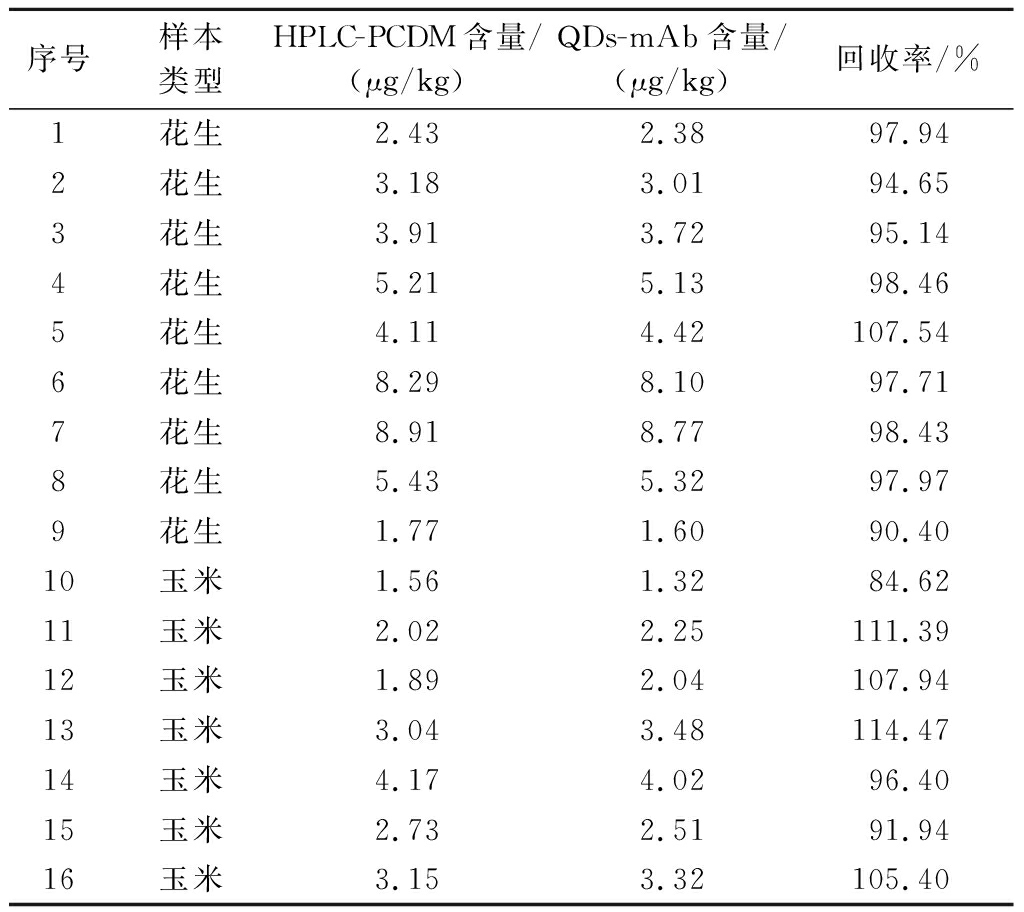
序号样本类型HPLC-PCDM含量/(μg/kg)QDs-mAb含量/(μg/kg)回收率/%1花生2.432.3897.942花生3.183.0194.653花生3.913.7295.144花生5.215.1398.465花生4.114.42107.546花生8.298.1097.717花生8.918.7798.438花生5.435.3297.979花生1.771.6090.4010玉米1.561.3284.6211玉米2.022.25111.3912玉米1.892.04107.9413玉米3.043.48114.4714玉米4.174.0296.4015玉米2.732.5191.9416玉米3.153.32105.40
本研究通过还原胺化反应,再经过水解,引入活性羧基设计合成AFB1抗原,制备单克隆抗体-CdTe量子点传感器免疫结合AFB1,引发电化学发光反应,建立用于实际样本中AFB1可视化快速定量检测方法。AFB1抗原与AFB1偶联比例为50∶1时,QDS-mAb对AFB1检测范围为0.03~12 μg/L,LOD为0.03 μg/L,该方法灵敏度高,具有较宽的线性范围,同时表现出良好的抗干扰能力、重复性。在实际样品检测时,回收率为84.62%~114.47%,与现行国家标准GB 5009.22—2016《食品安全国家标准 食品中黄曲霉毒素B族和G族的测定》中采用的HPLC-PCDM检测方法有高度的一致性。试验建立的QDs-mAb检测AFB1方法在粮食作物现场快速检测中显示出巨大的潜力。
[1] SIPOS P, PELES F, BRASS D L, et al.Physical and chemical methods for reduction in aflatoxin content of feed and food[J].Toxins, 2021, 13(3):204.
D L, et al.Physical and chemical methods for reduction in aflatoxin content of feed and food[J].Toxins, 2021, 13(3):204.
[2] 赵萌, 高婧, 褚华硕, 等.黄曲霉毒素B1的分子致毒机理及其微生物脱毒研究进展[J].食品科学, 2019, 40(11):235-245.ZHAO M, GAO J, CHU H S, et al.Recent progress in research on toxicity mechanism and microbial detoxification of aflatoxin B1[J].Food Science, 2019, 40(11):235-245.
[3] 高志存, 石露莎, 余舒宁, 等.酶联免疫吸附法与高效液相色谱法检测玉米中黄曲霉毒素B1的比较[J].云南畜牧兽医, 2023(6):10-12.GAO Z C, SHI L S, YU S N, et al.Comparison of enzyme-linked immunosorbent assay and high-performance liquid chromatography for the detection of aflatoxin B1in maize[J].Yunnan Journal of Animal Science and Veterinary Medicine, 2023(6):10-12.
[4] 杨卓燃, 李龙, 吴琼, 等.三溴化吡啶衍生-发光二极管激发的荧光光谱法快速测定玉米粉中黄曲霉毒素B1的含量[J].理化检验-化学分册, 2023, 59(4):448-452.YANG Z R, LI L, WU Q, et al.Rapid determination of aflatoxin B1 in corn meal by light-emitting diode excited fluorescence spectrometry after pyridine tribromide derivatization[J].Physical Testing and Chemical Analysis Part B:Chemical Analysis, 2023, 59(4):448-452.
[5] 焦梓毅, 李丽, 刘金阳, 等.样品前处理对超高效液相色谱法分析粮食中黄曲霉毒素的影响[J].粮油食品科技, 2023, 31(6):98-106.JIAO Z Y, LI L, LIU J Y, et al.Effect of sample pretreatment on the detection of aflatoxin in grain by ultra performance liquid chromatography[J].Science and Technology of Cereals, Oils and Foods, 2023, 31(6):98-106.
[6] PATYAL A, GILL J P S, BEDI J S, et al.Assessment of aflatoxin contamination in dairy animal concentrate feed from Punjab, India[J].Environmental Science and Pollution Research, 2021, 28(28):37705-37715.
[7] TIAN L, SHI Y Y, SONG Y N, et al.Dual signal-enhanced electrochemiluminescence strategy based on functionalized biochar for detecting aflatoxin B1[J].Biosensors, 2023, 13(9):846.
[8] OKECHUKWU V O, ADELUSI O A, KAPPO A P, et al.Aflatoxins:Occurrence, biosynthesis, mechanism of action and effects, conventional/emerging detection techniques[J].Food Chemistry, 2024, 436:137775.
[9] LIU Y H, HUANG H, CAO W J, et al.Advances in carbon dots:From the perspective of traditional quantum dots[J].Materials Chemistry Frontiers, 2020, 4(6):1586-1613.
[10] LI R S, LIU F Q, LU Q Y.Quantum light source based on semiconductor quantum dots:A review[J].Photonics, 2023, 10(6):639.
[11] KLEEORIN Y, MEIR Y.Quantum phase transition in a realistic double-quantum-dot system[J].Scientific Reports, 2018, 8:10539.
[12] HAN C Y, KIM H S, YANG H.Quantum dots and applications[J].Materials, 2020, 13(4):897.
[13] BAHMANI JALALI H, SADEGHI S, SAHIN M, et al.Colloidal aluminum antimonide quantum dots[J].Chemistry of Materials, 2019, 31(13):4743-4747.
[14] SUN C N, LIAO X F, JIA B Y, et al.Development of a ZnCdS@ZnS quantum dots-based label-free electrochemiluminescence immunosensor for sensitive determination of aflatoxin B1 in lotus seed[J].Microchimica Acta, 2020, 187(4):236.
[15] WANG Q L, CHEN M M, ZHANG H Q, et al.Enhanced electrochemiluminescence of RuSi nanoparticles for ultrasensitive detection of ochratoxin A by energy transfer with CdTe quantum dots[J].Biosensors and Bioelectronics, 2016, 79:561-567.
[16] SUWATTHANARAK T, TANAKA M, MINAMIDE T, et al.Screening and characterisation of CdTe/CdS quantum dot-binding peptides for material surface functionalisation[J].RSC Advances, 2020, 10(14):8218-8223.
[17] 刘琦, 许海燕, 苏雨轩, 等.石墨烯量子点与体外巨噬细胞生物相容性的研究[J].生物化学与生物物理进展, 2024, 51(11):2971-2982.LIU Q, XU H Y, SU Y X, et al.Study on biocompatibility of graphene quantum dots with macrophages in vitro[J].Progress in Biochemistry and Biophysics, 2024, 51(11):2971-2982.
[18] 贺贞云, 石云娇, 刘星.纳米抗体在生物毒素及农药残留检测中的应用研究进展[J].食品安全质量检测学报, 2024, 15(9):122-131.HE Z Y, SHI Y J, LIU X, et al.Application research progress of nanobodies in the detection of biotoxins and pesticide residues[J].Journal of Food Safety &Quality, 2024, 15(9):122-131.
[19] 王瑞琛, 张婷, 伏广想, 等.荧光碳量子点传感器检测食品中农药残留的研究进展[J].中国食品添加剂, 2024, 35(4):295-299.WANG R C, ZHANG T, FU G X, et al.Research progress in detection of pesticide residues in food by fluorescent carbon quantum dot sensors[J].China Food Additives, 2024, 35(4):295-299.
[20] 王云芹. 基于全合成纳米抗体技术的黄曲霉毒素B1抗体制备及优化[D].重庆:重庆三峡学院, 2024.WANG Y Q.Preparation and optimization of aflatoxin B1 antibody based on fully synthetic nanobody technology[D].Chongqing:Chongqing Three Gorges University, 2024.
[21] 韦琳. 农产品中真菌毒素单克隆抗体高效筛选及免疫分析技术研究[D].淄博:山东理工大学, 2023.WEI L.Highly efficient screening and immunoassay technology for monoclonal antibodies against mycotoxins in agricultural products[D].Zibo:Shandong University of Technology, 2023.
[22] 段长飞, 梁琦, 马少芹, 等.莱克多巴胺单克隆抗体非亲和层析法纯化研究[J].质量安全与检验检测, 2023, 33(2):53-60.DUAN C F, LIANG Q, MA S Q, et al.Ractopamine monoclonal antibody purification based on non-affinity purification techniques[J].Quality Safety Inspection and Testing, 2023, 33(2):53-60.
[23] LI J F, HU F H, CHEN S Y, et al.Characterization of novel Omp31 antigenic epitopes of Brucella melitensis by monoclonal antibodies[J].BMC Microbiology, 2017, 17(1):115.
[24] BHAND G R, CHAURE N B.Synthesis of CdTe, CdSe and CdTe/CdSe core/shell QDs from wet chemical colloidal method[J].Materials Science in Semiconductor Processing, 2017, 68:279-287.